Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 3: карликовые свиньи
Войтенко Н.Г., Макарова М.Н. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 3: карликовые свиньи. Лабораторные животные для научных исследований. 2020; 3. https://doi.org/10.29296/2618723X-2020-03-02
Резюме
На сегодняшний день в распоряжении ученых для проведения токсикологических, фармакокинетических и других исследований, помимо грызунов, находится более десятка других лабораторных животных. Свиней уже давно используют для изучения трансплантации органов и тканей, хирургической подготовки студентов-медиков, однако их применение может быть значительно шире. Анатомическое сходство с человеком и крупные размеры этих животных позволяют успешно проводить исследования сердечно-сосудистой, пищеварительной и мочевыделительной систем, а также использовать в доклинических и токсикологических исследованиях. В связи с этим установление референсных интервалов биохимических показателей крови лабораторных свиней является актуальной задачей.
В статье представлены референсные интервалы биохимических показателей крови карликовых свиней, полученные с применением классического подхода. Были использованы результаты биохимического анализа крови 15 самцов и 15 самок клинически здоровых карликовых свиней в возрасте 9–11 мес массой тела 14–26 кг, выращенных в нашем питомнике. Помимо основных биохимических показателей (креатинин, мочевина, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, холестерин, триглицериды, общий белок, альбумин, глюкоза и общий билирубин), представлены дополнительные параметры – расширенный липидный профиль, концентрация кальция и фосфора, активность ряда ферментов (лактатдегидрогеназа, креатинкиназа, амилаза, гамма-глутамилтрансфераза и холинэстераза), являющихся биохимическими маркерами повреждения различных систем и органов.
Наиболее выраженные отличия обнаружены при исследовании липидного профиля самцов и самок карликовых свиней: концентрация общего холестерина и триглицеридов в крови самок была выше в среднем в 1,5 и 2 раза соответственно. Кроме того, в сыворотке крови самок концентрация Х-ЛПНП была в среднем в 1,8 раз выше, чем в сыворотке крови самцов. Менее выраженные, но статистически значимые различия были обнаружены в отношении концентрации общего белка и глобулинов.
Проведенный анализ представленных референсных интервалов с данными литературы показал сопоставимость полученных значений. Несмотря на значительное сходство биохимических профилей человека и лабораторных свиней, необходимо учитывать наличие видовых различий при рассмотрении результатов доклинических исследований.
Введение
Сегодня в распоряжении ученых для проведения токсикологических, фармакокинетических и других исследований, помимо грызунов, имеется более десятка других лабораторных животных. Благодаря своему анатомическому и физиологическому сходству с человеком свиньи признаны одним из лучших вариантов для моделирования и изучения целого ряда патологий, кроме того, известно, что геном свиньи в 3 раза ближе к геному человека, чем геном мыши [1]. Свиней уже давно используют для изучения трансплантации органов и тканей, хирургической подготовки студентов-медиков и разработки новых методов и медицинских устройств [2, 3], однако их применение может быть значительно шире. Анатомическое сходство с человеком и крупные размеры этих животных позволяют успешно проводить исследования сердечно-сосудистой, пищеварительной и мочевыделительной систем, а также использовать их в доклинических и токсикологических исследованиях [4–6].
Все более широкое распространение в биомедицинских исследованиях получают модели с использованием генетически модифицированных животных. И тут свиньи тоже имеют ряд преимуществ благодаря генетической близости к человеку. Геном мыши хорошо изучен, современная наука может предложить трансгенных мышей для изучения спинальной мышечной атрофии и болезни Паркинсона, но, к сожалению, далеко не все они в полной мере воспроизводят патогенез изучаемых патологий [7, 8]. Одним из ярких примеров является муковисцидоз. В этом случае, когда мутация, вызывающая муковисцидоз у человека, моделируется на мышах, у них не наблюдается ни одного из симптомов болезни человека. В настоящее время разработана более успешная модель этого заболевания на свиньях, которая полностью имитирует патогенез и симптомы у человека [9]. Несмотря на такие преимущества, свиньи являются далеко не самыми распространенными лабораторными животными. В отчете Understanding Animal Research в Англии за 2019 г. свиньи не упоминаются отдельной строкой, так как их количество в доклинических исследованиях не превышает суммарно использованных приматов, собак и кошек, на долю которых приходится всего 0,2% от общего числа лабораторных животных [10]. В связи с отсутствием достаточной информации в доступных источниках литературы и различными условиями содержания и кормления карликовых свиней, а также с возможными породными особенностями установление референсных интервалов (РИ) биохимических показателей крови этих животных в каждом испытательном центре является актуальной задачей.
С целью реализации принципов 3Rs наиболее рационально проводить ретроспективный анализ, который позволяет включать большое количество животных, для редко используемых или новых видов применим классический подход к формированию РИ [1]. В статье, помимо РИ, для основных биохимических показателей, уже рассмотренных в наших предыдущих сообщениях, представлены дополнительные параметры – расширенный липидный профиль, активность ряда ферментов, являющихся биохимическими маркерами повреждения разных систем и органов. Различный дизайн экспериментов с проведением каких-либо дополнительных исследований (изучение гормонального статуса, иммунологических тестов или фармакокинетических исследований) может предусматривать получение как сыворотки, так и плазмы крови. Для оптимизации сбора биологического материала проведен сравнительный анализ биохимических показателей в плазме и сыворотке крови.
Материал и методы
Для формирования РИ использованы данные, определенные в первом полугодии 2020 г. в ходе мониторинга здоровья животных, выращенных в нашем центре. В сформированном массиве находились результаты, полученные от 15 самцов и 15 самок карликовых свиней в возрасте 9–11 мес массой тела 14–26 кг. Были использованы небеременные и нерожавшие самки. В период адаптации и последующих экспериментов животных содержали в одинаковых стандартных условиях вивария: температура воздуха 22–26оС, относительная влажность 40–75%, 12-часовой световой день. Карликовых свиней содержали в вольерах с древесным подстилом со свободным доступом к воде. Кормление животных проводили в соответствии с Директивой 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986) в соответствии с правилами надлежащей лабораторной практики.
Определение биохимических показателей для всех животных проводили в равных условиях с использованием принятых в нашем испытательном центре аналитических методов. В плазме и сыворотке крови этих животных на автоматическом биохимическом анализаторе Rendom Access A-25 (Biosystems S.A., Испания) измерены следующие показатели: креатинин, мочевина, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ), холестерин, триглицериды, общий белок, альбумин, глюкоза и общий билирубин. Также рассчитаны уровень глобулинов в сыворотке крови и соотношение альбумин/глобулины (A/G). В 15 образцах сыворотки самцов и в 14 образцах сыворотки самок дополнительно измерены активность лактатдегидрогеназы (ЛДГ), креатинкиназы, амилазы, гамма-глутамилтрансферазы (ГГТ) и холинэстеразы, а также концентрация кальция, фосфора, холестерина (ХС) липопротеинов высокой плотности (ЛПВП) и холестерина липопротеинов низкой плотности (Х-ЛПНП). Для определения концентрации общего билирубина и активности ГГТ использовали наборы реактивов Вектор-Бест (Россия), для остальных аналитов – наборы BioSystems S.A. (Испания). Статистическую обработку результатов осуществляли в программе Statistica.10: статистические выбросы по методу Тьюки, вид распределения по критерию Шапиро–Уилка, сравнение между животными разного пола по U-критерию Манна–Уитни и t-критерию Стьюдента. Для сравнения результатов в плазме и сыворотке крови использовали критерий Уилкоксона и t-критерий Стьюдента для парных измерений.
Результаты и обсуждение
Учитывая малое число животных, для формирования РИ применен классический подход – сформированы группы клинически здоровых самцов и самок, близких по возрасту и морфометрическим показателям.
Несмотря на ограниченное число наблюдений, массивы были проверены на наличие статистических выбросов, которые определяли отдельно для каждого показателя и пола животных по методу Тьюки. Из дальнейшей работы было необходимо исключить данные, лежащие за пределами интервала 1-го и 3-го квартилей Q1 и Q3 соответственно. Межквартильный интервал IQR определяли как Q3 – Q1. Верхний и нижний пределы рассчитывали следующим образом: Q1–1,5.IQR и Q3 +1,5.IQR, значения, выходящие за пределы интервала Q1–3.IQR и Q3 +3.IQR, определяли как «жесткие» выбросы [11].
При анализе статистических выбросов не отмечено ни одного «жесткого» выброса. При обнаружении выбросов по одному и тому же показателю в плазме и сыворотке результаты были рассмотрены дополнительно – в 4 случаях (1 — при измерении активности АСТ и 3 – концентрации триглицеридов) обнаружены однонаправленные выбросы в парных образцах. Это позволило предположить, что выявленные отклонения не являются случайными, не связаны с дефектами образцов или некорректными измерениями, а, возможно, являются редкими наблюдениями и поэтому должны быть включены в общий массив данных [2]. Таким образом, статистических выбросов в полученном массиве было меньше, чем было выявлено по методу Тьюки. В плазме крови самцов в одном образце обнаружены выбросы сразу по нескольким показателям – креатинину, мочевине, ХС, триглицеридам, АЛТ, при этом в сыворотке того же животного все эти и другие показатели находятся внутри интервала Q1–1,5.IQR - Q3 +1,5.IQR. Это позволяет предположить, что выбросы, полученные в плазме этого самца, связаны с дефектом конкретного образца сыворотки, поэтому результаты были исключены из расчетов. В табл. 1 указаны статистические выбросы, которые исключили из дальнейшей работы.
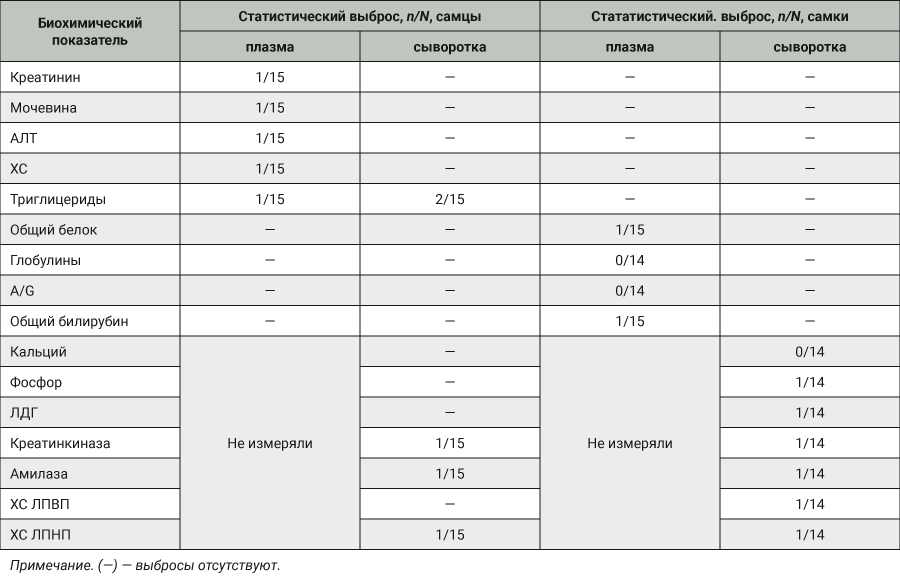
Максимальное количество статистических выбросов обнаружено при определении концентрации триглицеридов в плазме и сыворотке самцов. При этом по ряду показателей – активность АСТ, ГГТ, ЩФ, холинэстеразы, концентрация глюкозы и альбумина –статистических выбросов не обнаружено (данные в табл. 1 не представлены).
Для дальнейшей обработки данных определяли тип распределения для каждого показателя в плазме или сыворотке самцов или самок. В большинстве случаев результаты подчинялись нормальному распределению, за исключением активности АСТ в плазме и сыворотке крови самцов и в плазме крови самок, концентрации альбумина в плазме крови животных обоего пола, активности амилазы в сыворотке крови самцов и расчетного показателя A/G.
На следующем этапе проведено сравнение исследуемых показателей в плазме и сыворотке крови. Из массива для анализа исключены пары образцов, где хотя бы один из результатов измерения был признан статистическим выбросам, а также расчетные значения, зависящие от этих результатов (концентрация глобулинов и соотношение A/G). Согласно правилам [3], для измерения активности АСТ предпочтительно использовать плазму крови, так как в сыворотке при проведении пробоподготовки может быть повышена активность этого фермента. При исследовании мы не обнаружили статистически значимых различий активности АСТ в зависимости от вида образца. Снижение концентрации общего белка в сыворотке крови за счет выхода фибриногена в сгусток нашло свое отражение в настоящем исследовании: в среднем концентрация общего белка в сыворотке была ниже на 5 г/л и сопровождалась статистически значимым увеличением доли глобулинов в образцах. Кроме того, отмечено статистически значимое повышение концентрации триглицеридов в среднем на 0,05 ммоль/л в сыворотке крови по сравнению с плазмой. Эти изменения отмечены как у самцов, так и у самок, но, учитывая, что эта разница сопоставима с пределом обнаружения этого аналита [4], считаем, что можно пренебречь этими отличиями. По той же причине обнаруженное статистически значимое увеличение концентрации билирубина в сыворотке крови самок по сравнению с плазмой этих же животных также можно считать незначимым [5].
В табл. 2 представлены РИ биохимических показателей крови карликовых свиней в зависимости от пола животных и вида образца (плазма или сыворотка). Для данных, подчинявшихся нормальному распределению, РИ рассчитывали как среднее ±1,96 * стандартное отклонение (Хср±1,96SD), в табл. 2 указаны интервал и в скобках среднее значение. Для других видов распределения (промежуток 2,5–97,5 процентиля – pr) в табл. 2 представлены интервал и в скобках – медиана. Данные, не подчиняющиеся нормальному распределению, выделены серым цветом.
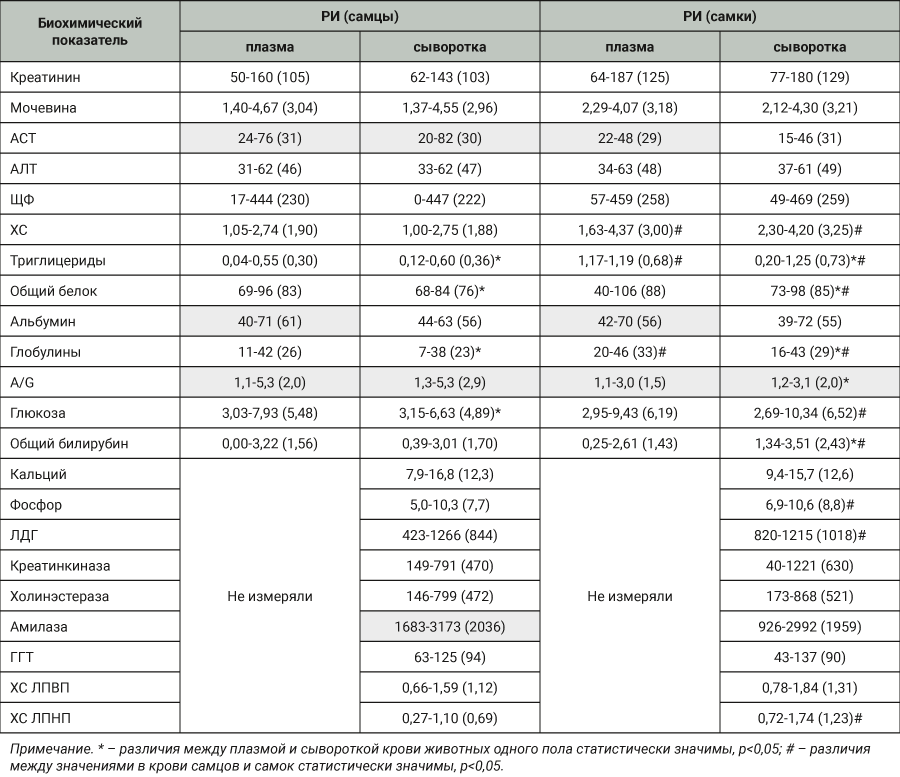
Дополнительно проводили сравнение биохимических показателей крови между животными разного пола методами параметрической статистики для нормально распределенных данных (t-критерий Стьюдента) и непараметрической статистики для ненормального распределения (U-критерий Манна–Уитни).
Наиболее выраженные отличия обнаружены при исследовании липидного профиля самцов и самок карликовых свиней: концентрация общего холестерина и триглицеридов в крови самок была выше в среднем в 1,5 и 2 раза соответственно. Эта тенденция сохранялась как в плазме, так и сыворотке крови. Кроме того, в сыворотке крови самок концентрация ХС ЛПНП была в среднем в 1,8 раза выше, чем в сыворотке крови самцов. Менее выраженные, но статистически значимые различия обнаружены в отношении концентрации общего белка и глобулинов у самок, которые в среднем были выше на 12 и 26% соответственно. Также в сыворотке крови самок отмечали более высокий уровень глюкозы, фосфора и активности ЛДГ. Ни для одного из перечисленных выше показателей в человеческой популяции не описаны значимые отличия в зависимости от пола [12]. Несмотря на отмеченную ранее схожесть физиологических и биохимических процессов в организме свиней и человека, ряд показателей крови существенно отличается: концентрация кальция, фосфора, активность ЛДГ, ЩФ, креатинкиназы и особенно амилазы в крови карликовых свиней имеет значительно более высокий диапазон значений. Так, содержание фосфора в крови карликовых свиней выше примерно в 2 раза, а кальция – в 5 раз и более. Активность амилазы больше на 2 порядка, чтобы попасть в линейный диапазон методики (до 1300 Ед/л) для всех проб при измерении этого параметра, потребовалось разведение в 2 раза. Обратная картина наблюдается в отношении общей холинэстеразы – активность этого фермента, измеренная по бутирилхолину [6], у наших животных составила в среднем 500 Ед/л, в то время как диапазон нормальных значений в клинической практике лежит в пределах 4000–11 000 Ед/л. Значения концентрации общего холестерина, ХС ЛПНП, триглицеридов и особенно общего билирубин лежат в более низком диапазоне. Другие изученные в этом исследовании биохимические показатели укладываются в диапазон от 50 до 150%, т.е. имеют сходные значения с таковыми у человека. Для иллюстрации полученных данных результаты измерения биохимических показателей у карликовых свиней были выражены в процентах по отношению к усредненным значениям для человека (см. рисунок). В случае если оптимальными для человека считаются значения ниже определенной величины (например, общий холестерин менее 5,2 ммоль/л), это пограничное значение и брали для расчета. Для получения усредненных показателей крови карликовых свиней объединили данные, которые были определены в плазме и сыворотке крови самцов и самок.
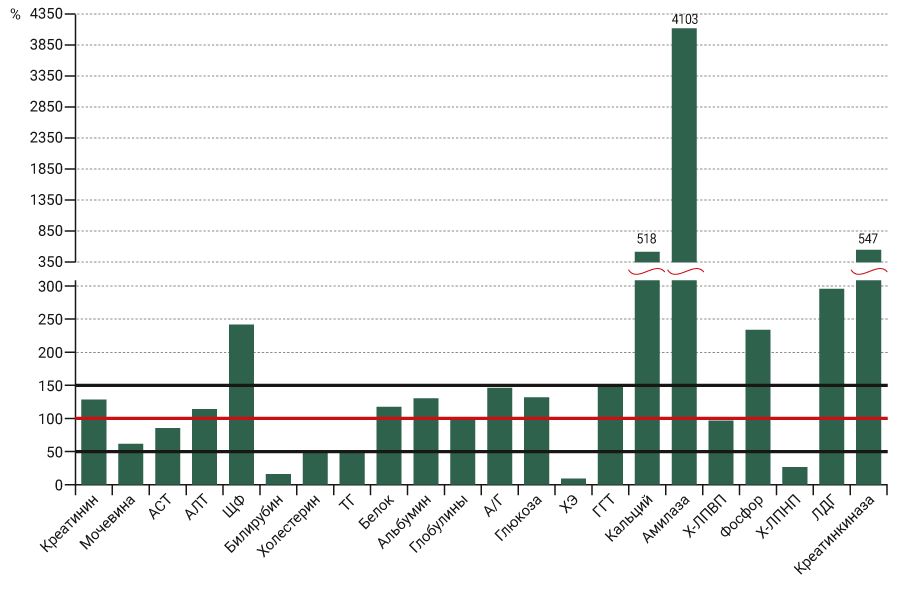
Оценить в данном исследовании межиндивидуальную и внутрииндивидуальную вариабельность биохимических показателей крови карликовых свиней и сравнить их с аналогичными данными для человеческой популяции не представляется возможным из-за малого объема выборки экспериментальных животных.
При сравнении полученных результатов с опубликованными референсными интервалами биохимических показателей крови свиней не выявлено существенных противоречий. По данным литературы, концентрация общего холестерина и билирубина колеблется в более широком диапазоне, чем у нас, что, вероятно, связано с ограниченной выборкой животных в настоящем исследовании и возможными различиями в условиях содержания и кормления. В табл. 3 указаны диапазоны значений основных биохимических показателей, а также средние значения и стандартное отклонение (М±SD), полученные от разных пород свиней. Представленные значения были переведены в единицы измерения, в которых проведено измерение в нашем испытательном центре.
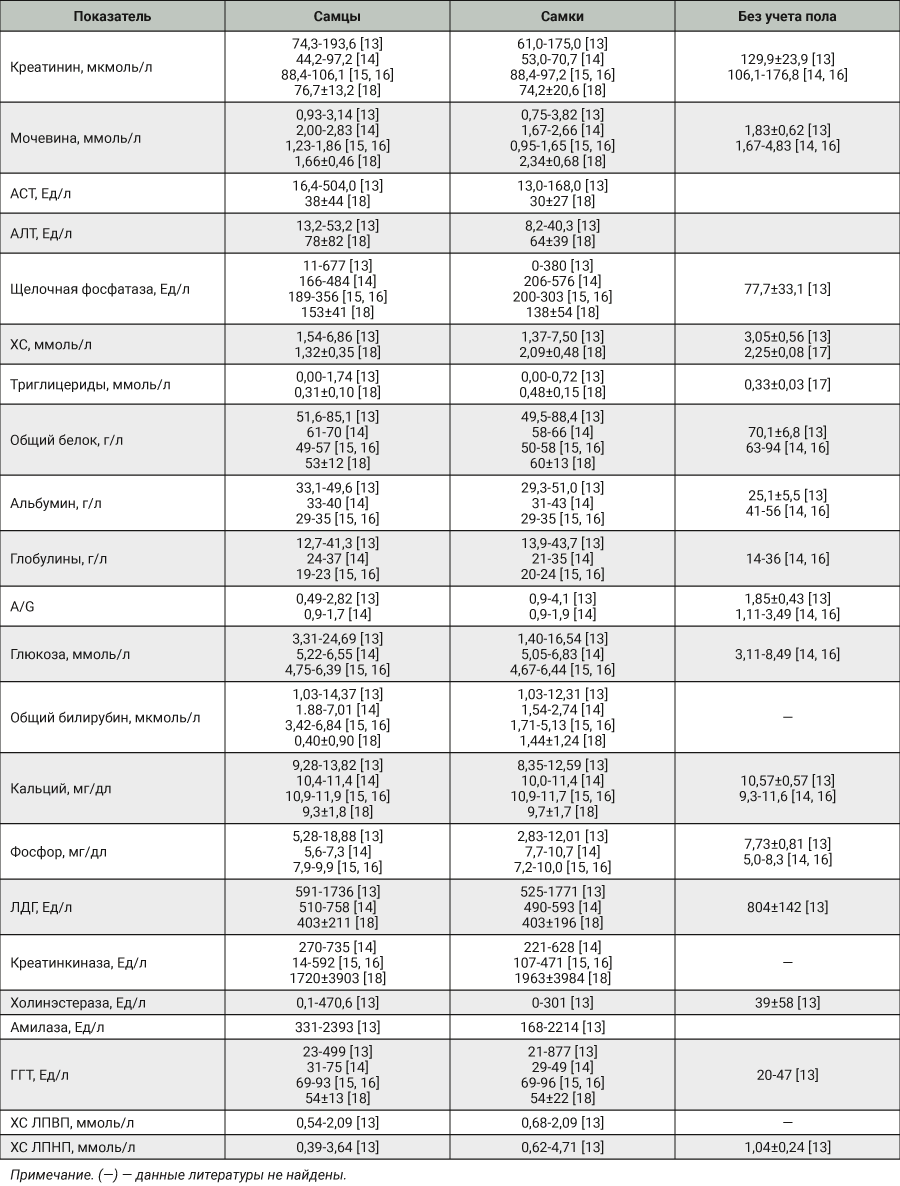
Указанные результаты еще раз подтверждают необходимость создания в каждом испытательном центре внутрилабораторных баз данных РИ для каждого вида животных, поскольку на полученные значения может влиять целый ряд факторов – порода, условия содержания и кормления. Со временем накопление данных позволит провести ретроспективный анализ больших выборок с полным соблюдением принципов 3Rs. Для расчета РИ следует использовать значения тех или иных показателей, которые были получены от интактных (клинически здоровых животных), содержащихся в равных условиях с использованием одинаковых аналитических методов.
Заключение
Представленные результаты подтверждают необходимость и актуальность накопления данных для создания и периодического пересмотра референсных интервалов для каждого вида лабораторных животных, используемых для проведения доклинических исследований в испытательном центре. При анализе референсных интервалов с использованием классического подхода в сравнении с указанными в литературе выявлена сопоставимость их значений, что можно считать дополнительным подтверждением удовлетворительности полученных нами данных.
Сравнительный анализ результатов измерений биохимических показателей в плазме и сыворотке крови не выявил клинически значимых отличий, что позволяет в дальнейшем накапливать для ретроспективного анализа данные, определенные в любом из этих биологических образцов. Несмотря на значительное сходство биохимических профилей человека и лабораторных свиней, необходимо учитывать наличие видовых различий при рассмотрении результатов доклинических исследований.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов
Войтенко Н.Г. – идея, планирование, разработка дизайна, сбор и систематизация материала, анализ и интерпретация результатов, написание, редактирование текста.
Макарова М.Н. – идея, разработка дизайна.
[1] ГОСТ Р53022-3 – 2008. Технологии лабораторные и клинические. Требования к качеству лабораторных исследований. Правила оценки клинической эффективности лабораторных тестов. – М., 2008.
[2] ГОСТ Р ИСО 16269-4-2017 Статистические методы. Статистическое представление данных. Часть 4. Выявление и обработка выбросов.
[3] ГОСТ Р 53079.4-2008 Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа.
[4] Инструкция к набору для определения триглицеридов (глицеролфосфатоксидаза/пероксидаза), BioSystems S.A. – 01/2012.
[5] Инструкция по применению «Набор реагентов для определения общего билирубина в сыворотке крови». Вектор-БЕСТ, утверждена 17.11.2009 приказом Росздравнадзора №9239-Пр/09.
[6] Инструкция к набору для определения активности холинэстеразы (бутирилхолин), BioSystems S.A. – 01/2012.
Список источников
- Wernersson R., Schierup M.H., Jorgensen F.G., Gorodkin J., Panitz F., Staerfeldt H.H., et al. Pigs in sequence space: a 0.66X coverage pig genome survey based on shotgun sequencing. BMC Genomics. 2005;6:70.
- Kim H.I., Lee S.Y., Jin S.M., Kim K.S., Yu J.E., Yeom S.C., Yoon T.W., Kim J.H., Ha J., Park C.G., Kim S.J. Parameters for successful pig islet isolation as determined using 68 specific-pathogen-free miniature pigs Xenotransplantation. 2009 16(1):11-8.
- Wang S., Liu Y., Fang D., Shi S. The miniature pig: a useful large animal model for dental and orofacial research. Oral Dis. 2007 13(6):530-7.
- Walters E.M., Prather R.S. Advancing Swine Models for Human Health and Diseases Mo Med. 2013; 110(3): 212–15.
- Smith A.C., Swindle M.M. Preparation of swine for the laboratory. ILAR J. 2006;47(4):358–363.
- Lorson M.A., Spate L.D., Samuel M.S., Murphy C.N., Lorson C.L., Prather R.S., et al. Disruption of the Survival Motor Neuron (SMN) gene in pigs using ssDNA. Transgenic Res. 2011;20:1293-1304.
- Swanson K.S., Mazur M.J., Vashisht K., Rund L.A., Beever J.E., Counter C.M., et al. Genomics and Clinical Medicine: Rationale for Creating and Effectively Evaluating Animal Models. Experimental Biology and Medicine. 2004;229:866–75
- Welsh M.J., Rogers C.S., Stoltz D.A., Meyerholz D.K., Prather R.S. Development of a porcine model of cystic fibrosis. Trans Am Clin Climatol Assoc. 2009;120:149–162.
- Rogan M.P., Reznikov L.R., Pezzulo A.A., Gansemer N.D., Samuel M., Prather R.S., et al. Pigs and humans with cystic fibrosis have reduced insulin-like growth factor 1 (IGF1) levels at birth. Proc Natl Acad Sci U S A. 2010;107:20571–20575.
- Animal Research Numbers in 2019. – URL.: https://www.understandinganimalresearch.org.uk/news/communications-media/animal-research-numbers-in-2019, (дата обращения 07.08.2020 г).
- TUKEY, J.W. Exploratory data analysis. Reading, Massachusetts: Addison-Wesley, 1977
- Маршалл В.Дж. Клиническая биохимия/ Пер. с англ. – М. – Спб.: «Издательство БИНОМ» - «Невский Диалект», 1999. – 368 с. [Marshall V.Dzh. Klinicheskaya biokhimiya/ Per. s angl. – M. – Spb.: «Izdatel'stvo BINOM» - «Nevskij DialekT», 1999. – 368 s.]
- Yeom S.C., Cho S.Y., Park C.G., Lee W.J. Analysis of reference interval and age-related changes in serum biochemistry and hematology in the specific pathogen free miniature pig Lab Anim Res. 2012 28(4):245-53
- Fox J.G. Laboratory Animal Medicine. Academic Press; Amsterdam, The Netherlands; New York: 2002.
- Helke K.L., Ezell P.C., Duran-Struuck R., Swindle M.M. Biology and Diseases of Swine. Laboratory Animal Medicine, Third Edition Elsevier Inc 2015
- Swindle M.M. Swine in the Laboratory: Surgery, Anesthesia, Imaging, and Experimental Techniques. CRC Press; Boca Raton, FL: 2007
- Badin J.K., Kole A., Stivers B., Progar V., Pareddy A., Alloosh M., and Sturek M. Alloxan-induced diabetes exacerbates coronary atherosclerosis and calcification in Ossabaw miniature swine with metabolic syndrome J Transl Med. 2018; 16: 58.
- Minipigs, E.G., 2010. The Gottingen Minipig [Online]. – URL: http://minipigs.dk/thegottingenminipig/ (дата обращения 10.08.2020).




