Разработка модели бактериальной инфекции личинок Galleria mellonella (большая восковая моль)
Работа выполнена без спонсорской поддержки.
Салмова Ю.В., Никифорова Л.Р., Боровкова К.Е. Разработка модели бактериальной инфекции личинок Galleria mellonella (большая восковая моль). Лабораторные животные для научных исследований. 2022; 3. https://doi.org/10.57034/2618723X-2022-03-05
Резюме
В последние годы в качестве альтернативной модели для изучения бактериальных инфекций, а также для оценки эффективности антибактериальных препаратов широко используют Galleria mellonella — личинки большой восковой моли. Преимущества данной модельной системы — отсутствие биоэтических ограничений, возможности использования большого количества животных в эксперименте, короткий жизненный цикл. Личинки могут расти при широком температурном диапазоне (18–37 °C), что позволяет исследовать на данной модели патогены человека, которым в большинстве случаев необходима инкубация при 37 °C. Несмотря на отсутствие у насекомых приобретенного иммунитета, врожденный иммунитет восковой моли имеет значительное сходство с иммунным ответом позвоночных животных, в том числе и человека.
Цель работы — разработка модели бактериальной инфекции личинок большой восковой моли, включающая сравнительную оценку как эффективности заражения личинок эталонными штаммами микроорганизмов и их клиническими изолятами, так и применения препаратов Рифампицин (ПАО «Красфарма», Россия) и Ципрофлоксацин (Эльфа Лабораториз, Индия) на инфицированных личинках.
Данное исследование предусматривало три последовательных этапа, на I этапе проводили сравнительную оценку вирулентности эталонных штаммов Staphylococcus aureus, Streptococcus pneumoniae, Escherichia coli и их клинических изолятов, а также определяли инфекционную дозу бактериальной суспензии для инъекции личинкам. Таким образом, было установлено, что исследуемые клинические изоляты St. aureus, Str. pneumoniae и E. coli оказались более вирулентными относительно эталонных штаммов микроорганизмов.
На II этапе исследования определяли минимально подавляющую концентрацию in vitro для каждого штамма микроорганизма, что позволяло определить чувствительность штаммов к исследуемым антибиотикам, а именно ципрофлоксацину и рифампицину.
На III этапе после заражения личинок инфекционной дозой была проведена антибактериальная терапия, при этом полученные результаты подтвердили данные II этапа in vitro. Наблюдали гибель личинок, зараженных резистентными штаммами St. aureus и E. coli к ципрофлоксацину и рифампицину соответственно.
Данная модель характеризовалась изменением общего состояния личинок (меланизация, подвижность, образование кокона) и гибелью животных в зависимости от концентрации микроорганизмов в инокулюме. Продемонстрировано, на сколько данная модель применима для оценки чувствительности бактерий к антибиотикам на примере ципрофлоксацина и рифампицина.
Введение
Доклинические исследования эффективности и безопасности лекарственных средств проводят с использованием лабораторных животных, обеспечивающих возможность переносить полученные результаты на человека. В качестве таких тест-систем наиболее часто используют грызунов — мышей, крыс. Однако при проведении исследований на животных необходимо учитывать этические принципы и большую стоимость данных разработок.
Помимо стандартных моделей исследований с применением лабораторных грызунов существуют альтернативные модели, использующие в качестве тест-системы беспозвоночных животных. Данные модели не могут полностью заменить исследования на млекопитающих, но они применяются в качестве дополнительных для расширения знаний о бактериальном патогенезе, изучения вирулентности микроорганизмов, а также открытия новых антибактериальных соединений.
Для изучения бактериальных инфекций, а также для оценки эффективности антибактериальных препаратов широко используются личинки большой восковой моли [1]. Большая восковая моль Galleria mellonella — один из традиционных объектов лабораторных исследований [2]. Отсутствие биоэтических ограничений и возможность применения большого количества личинок в эксперименте позволяют большой восковой моли быть модельным объектом в следующих тестах:
1) определение микробной вирулентности и патогенности микроорганизмов;
2) определение ЛД50 (среднелетальная доза) вещества;
3) фармакокинетика;
4) тестирование эффективности противомикробных средств на зараженных личинках.
Несмотря на отсутствие у насекомых приобретенного иммунитета, врожденный иммунитет восковой моли имеет значительное сходство с иммунным ответом позвоночных животных, в том числе и человека [3]. Эти характеристики делают G. mellonella удобным объектом для оценки вирулентности бактерий, а также исследований на чувствительность к антибиотикам, в частности, штаммов Staphylococcus aureus, Streptococcus pneumoniae и Escherichia coli [4, 5].
Цель данного исследования — разработка модели бактериальной инфекции личинок большой восковой моли, включающая сравнительную оценку эффективности не только заражения личинок эталонными штаммами микроорганизмов и их клиническими изолятами, но и применения препаратов Рифампицин (ПАО «Красфарма», Россия) и Ципрофлоксацин (Эльфа Лабораториз, Индия) на инфицированных личинках.
Материал и методы
Личинки большой восковой моли
В качестве биологической тест-системы использовали личинки большой восковой моли G. mellonella. В исследование отбирали личинки в возрасте 5 нед, массой 200–300 мг. Личинки большой восковой моли до начала эксперимента содержали на искусственном субстрате (22% кукурузной муки, 22% зародышей пшеницы, 11% сухих дрожжей, 17,5% пчелиного воска, 11% меда и 11% глицерина) при температуре 2–8 °C в затемненных контейнерах для замедления созревания и перехода в стадию куколки [6]. После заражения личинки помещали в чашках Петри без субстрата, затем — в термостат при температуре 37 °C на 5 сут [7]. Распределение животных на группы по 10 личинок в каждой проводили методом слепой рандомизации [8]. Исследование выполняли в соответствии с принципами 3Rs, то есть осуществили замену лабораторных животных на альтернативную модель более низкой филогенетической группы. Проведение исследования было одобрено экспертной комиссией (ЭК) АО НПО «ДОМ ФАРМАЦИИ» (протокол ЭК № 8/21).
Микроорганизмы
В качестве инфекционных агентов были выбраны эталонные штаммы микроорганизмов из Американской коллекции типовых культур (American Type Culture Collection, ATCC): E. coli ATCC 25922 (ВКПМ В-8076), St. aureus ATCC 29213, Str. pneumoniaе ATCC 6303, а также их клинические изоляты: E. coli ENV 194, St. aureus SA 0077 (MRSA), Str. pneumoniaе 1068 19 А. Музейные тест-штаммы и клинические изоляты, используемые в исследовании перед началом эксперимента, были активированы высевом в гидролизат говяжьего мяса ферментативного (ГМФ-бульон) с последующим пересевом на соответствующий питательный агар: ГМФ-агар, колумбийский агар.
Определение инфекционной дозы
Заражение штаммами E. coli, Str. pneumoniaе, St. aureus проводили в 1‑й день эксперимента путем введения бактериального инокулюма в гемоцель через последнюю левую ложноножку с помощью микрошприца Hamilton (Hamilton, СШA) 10 мкл [9]. Для удобства введения инокулюма личинки были обездвижены путем помещения на 15 мин в холодильную камеру при температуре 2–8 °С. Для создания оптимальных условий развития патогена после заражения личинки содержали в термостате при температуре 37 °C [6, 9]. Инфекционная доза определялась как доза, вызывающая иммунный ответ, распознаваемый по потемнению кутикулы, а также 60–80% летальность [9].
Регистрация показателей здоровья личинок
Для оценки заражения штаммами микроорганизмов проводили учет показателей здоровья личинок (в соответствии с табл. 1 и рис. 1). Было оценено состояние здоровья личинок путем присвоения баллов по 4 основным показателям: подвижность личинок, образование коконов, меланизация и выживаемость [7]. При оценке подвижности личинки использовали в качестве стимула стерильные одноразовые петли.


Личинки признавали мертвыми, если они не проявляли реакции (движений) на прикосновение. Оценку выживаемости проводили методом построения кривой Каплана–Мейера. Летальность и учет показателей здоровья личинок оценивали каждые 24 ч [6, 7, 10, 11].
Определение антимикробной активности in vitro
На данном этапе исследования определяли чувствительность используемых штаммов микроорганизмов к рифампицину и ципрофлоксацину in vitro для дальнейшего исследования эффективности лечения данными препаратами инфицированных личинок. Определение антимикробной активности исследуемых объектов проводили методом микроразведений в планшетах с определением минимальной подавляющей концентрации (МПК). Для метода микроразведений грамположительных и грамотрицательных микроорганизмов использовали бульон Мюллера–Хинтона [12], для микроорганизма Str. pneumoniae — бульон Мюллера–Хинтона с добавлением 5% лизированной бараньей крови [13, 14].
На данном этапе изучали тестируемые объекты ципрофлоксацин и рифампицин. Рифампицин активен в отношении грамположительных микроорганизмов Streptococcus spp. и Staphylococcus spp., а также является стандартным средством лечения метициллинрезистентного стафилококка (S. aureus MRSA). Однако по отношению к грамотрицательным микроорганизмам E. coli рифампицин менее активен. К ципрофлоксацину чувствительны грамотрицательные аэробные микроорганизмы E. coli, также он активен в отношении грамположительных микроорганизмов Streptococcus spp. и Staphylococcus spp. Однако большинство стафилококков, устойчивых к метициллину (S. aureus MRSA), резистентны к ципрофлоксацину [15, 16].
Приготовление рабочих растворов исследуемых объектов осуществляли с использованием бульона Мюллера–Хинтона. Были изучены концентрации от 0,007 до 512 мкг/мл. Планшеты инкубировали при температуре 34–37 °С в течение 18±2 ч [12]. После инкубации визуально оценивали наличие или отсутствие роста микроорганизмов в лунках планшетов. МПК исследуемых объектов соответствовала лунка с наименьшей концентрацией исследуемых объектов без признаков видимого роста тест-микроорганизмов.
Антибактериальная терапия инфицированных личинок
Личинок большой восковой моли заражали инфекционной дозой, установленной на I этапе эксперимента в последнюю левую ложноножку, затем инкубировали в термостате при температуре 37 °C. Через 2 ч вводили тестируемые препараты в последнюю правую ложноножку и продолжали инкубацию.
Согласно инструкции по медицинскому применению (ИМП) препарата Рифампицин в виде лиофилизата для приготовления раствора для инфузий (150 мг) [15], максимальная суточная доза 600 мг, что при пересчете на 1 кг массы тела взрослого человека составляет:
Терапевтическая доза = 600 мг/60 кг (средняя масса тела человека) = 10 мг/кг.
Терапевтическая доза (ТД) ципрофлоксацина, согласно инструкции по медицинскому применению, также равна 10 мг/кг [16].
Расчет концентрации (С) инъекции антибиотика проводили по формуле:
Cинъекции = (Cin vivo×Vличинки)/Vинъекции,
где Cинъекции — концентрация тестируемого объекта в инъекции; Cin vivo — концентрация тестируемого объекта в личинке; Vличинки — объем личинки, Vличинки=0,3 мл; Vинъекции — объем инъекции, Vинъекции=10 мкл.
При перерасчете концентрации ципрофлоксацина на личинку с учетом отношения массы гемолимфы личинки к ее объему, приблизительно равному единице [17], соответствует:
10 мг/кг = 10 мкг/г = 10 мкг/мл = Cin vivo.
Концентрация вводимого препарата для личинки:
Cинъекции = (10 мкг/мл×0,3 мл)/0,01 мл = 300 мкг/мл.
Таким образом, было исследовано 3 дозы: 1/2 ТД; ТД; ТД×2.
В каждой исследуемой группе было по 10 личинок, причем в каждый первый день использовали 3 контрольные группы: интактную, травмированного контроля (нарушение целостности кутикулы, прокалывание иглой) и контрольную с введенным буфером (PBS). Также были добавлены контрольные группы для тестируемых препаратов, чтобы исключить токсическое влияние самих антибиотиков. На протяжении всего III этапа осуществляли регистрацию гибели ежедневно с балльной системой учета показателей здоровья (см. табл. 1).
Эвтаназия
Эвтаназию всех использованных в эксперименте личинок большой восковой моли проводили путем погружения в 70% раствор этилового спирта в последний, 5‑й день эксперимента [18].
Анализ данных
Для данных, полученных на I этапе исследования, был применен анализ выживаемости методом Каплана–Мейера с последующей оценкой межгрупповых различий логранговым тестом Мантела–Кокса с построением кривой выживаемости.
Различия считали достоверными при уровне значимости р<0,05. Статистический анализ выполняли с помощью программного обеспечения Prism 9 (GraphPad Software, СШA).
Расчет летальных доз (ЛД50 и ЛД70) проводили с помощью пробит-анализа по Прозоровскому [19].
Результаты и обсуждение
I этап — моделирование патологии
На протяжении всего эксперимента (до заражения, в 1‑й день и далее каждые 24 ч до эвтаназии) проводили учет показателей здоровья личинок (см. табл. 1).
До заражения у личинок всех экспериментальных групп наблюдали активное движение и способность к коконообразованию, меланизация отсутствовала.
При учете показателей здоровья через 24 часа после контрольного укола и введения индукторов патологии в интактной группе не установлено признаков угнетения личинок. Все личинки проявляли умеренную активность с возможностью коконообразования. Меланизация и гибель отсутствовали (рис. 2).
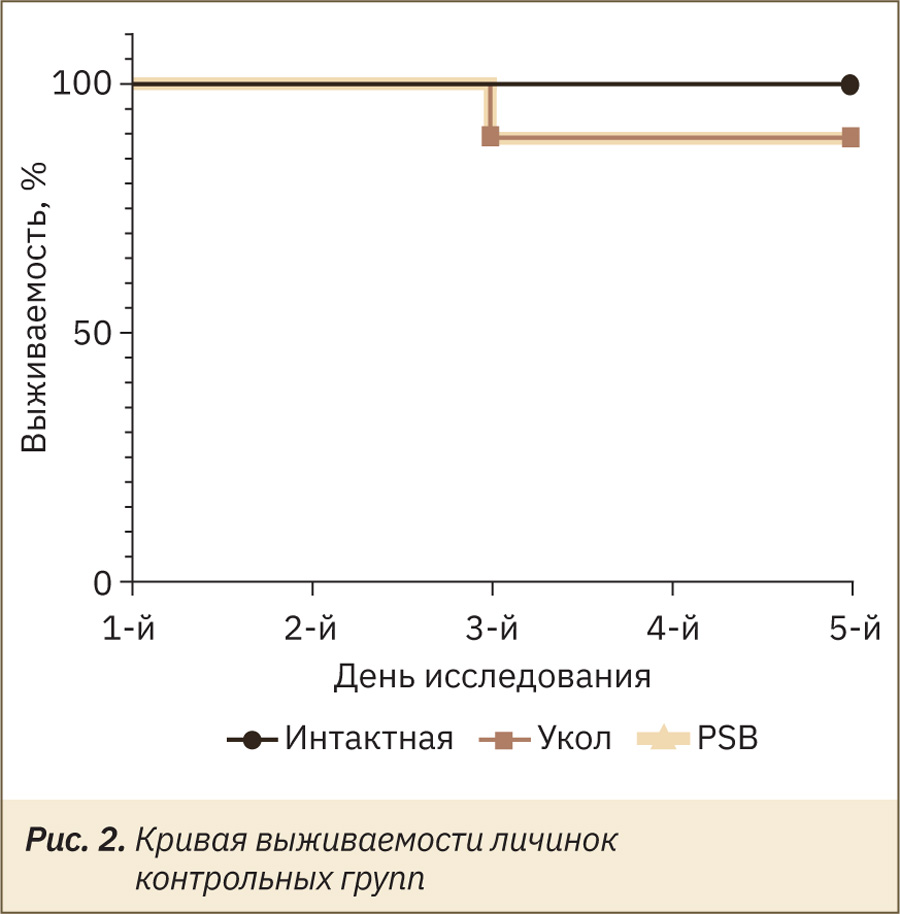
Во всех группах с нарушением целостности покровов регистрировали единичные случаи гибели личинок. В группах с контрольным проколом и с введенным фосфатно-солевым буфером регистрировали гибель одной личинки в каждой группе. Оставшиеся в живых личинки не отличались по своим жизненным показателям от интактных (рис. 3).

В группах, зараженных инокулюмом в более низких концентрациях, наблюдали гибель нескольких личинок (рис. 4). Выжившие личинки были в основном активны, меланизация либо отсутствовала, либо была слабо выражена, способность к коконообразованию сохранилась. С увеличением концентрации инокулюма, смертность в группах значительно возрастала (рис. 5, 6). У оставшихся в живых личинок регистрировали снижение активности, потемнение кутикулы и угнетение способности коконообразования (см. рис. 4). У погибших личинок отмечали полное почернение покровов тела (рис. 7).
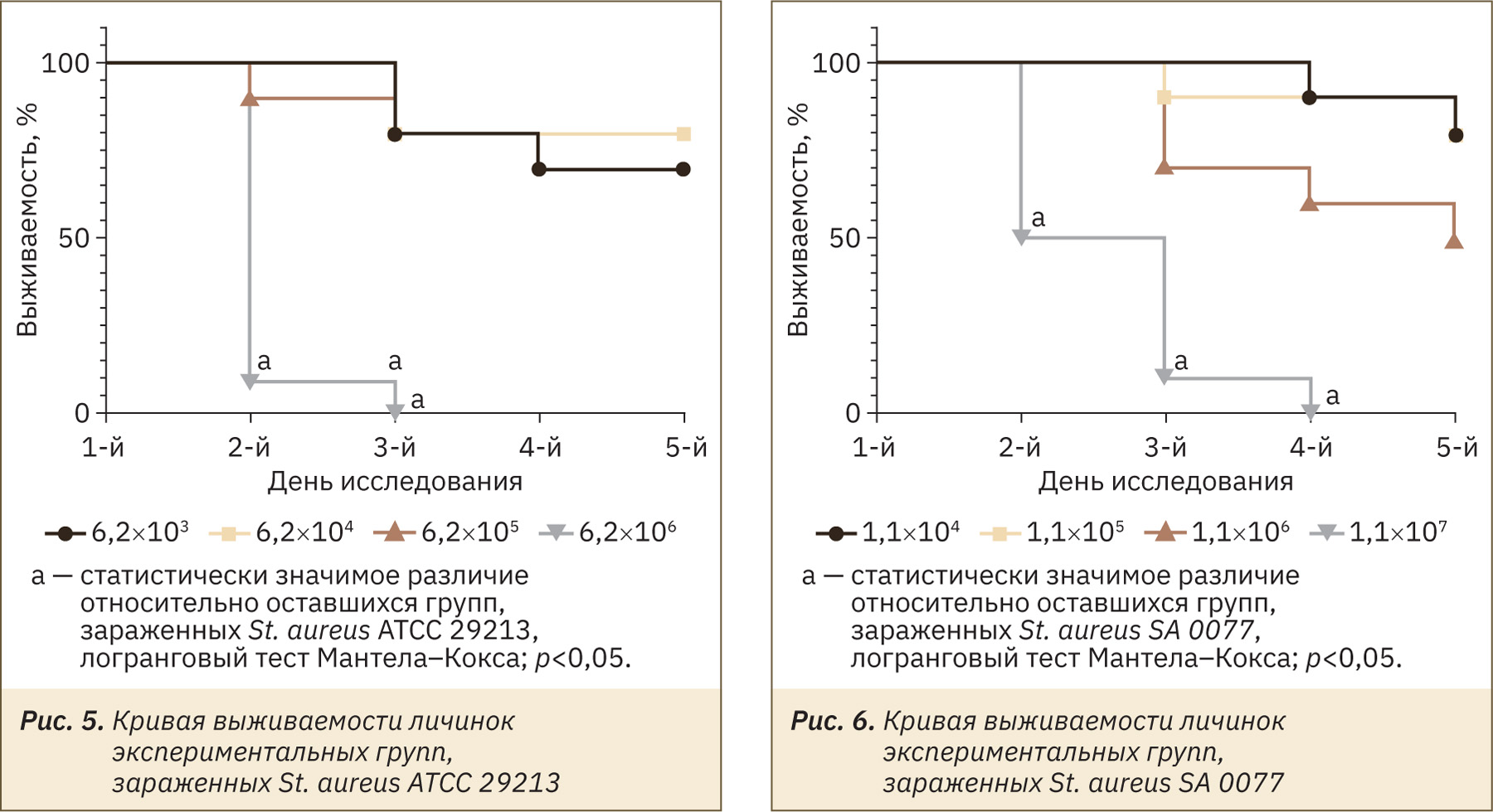

Для оценки вирулентности штаммов было принято решение рассчитать летальные дозы с использованием пробит-анализа по Прозоровскому (табл. 2).
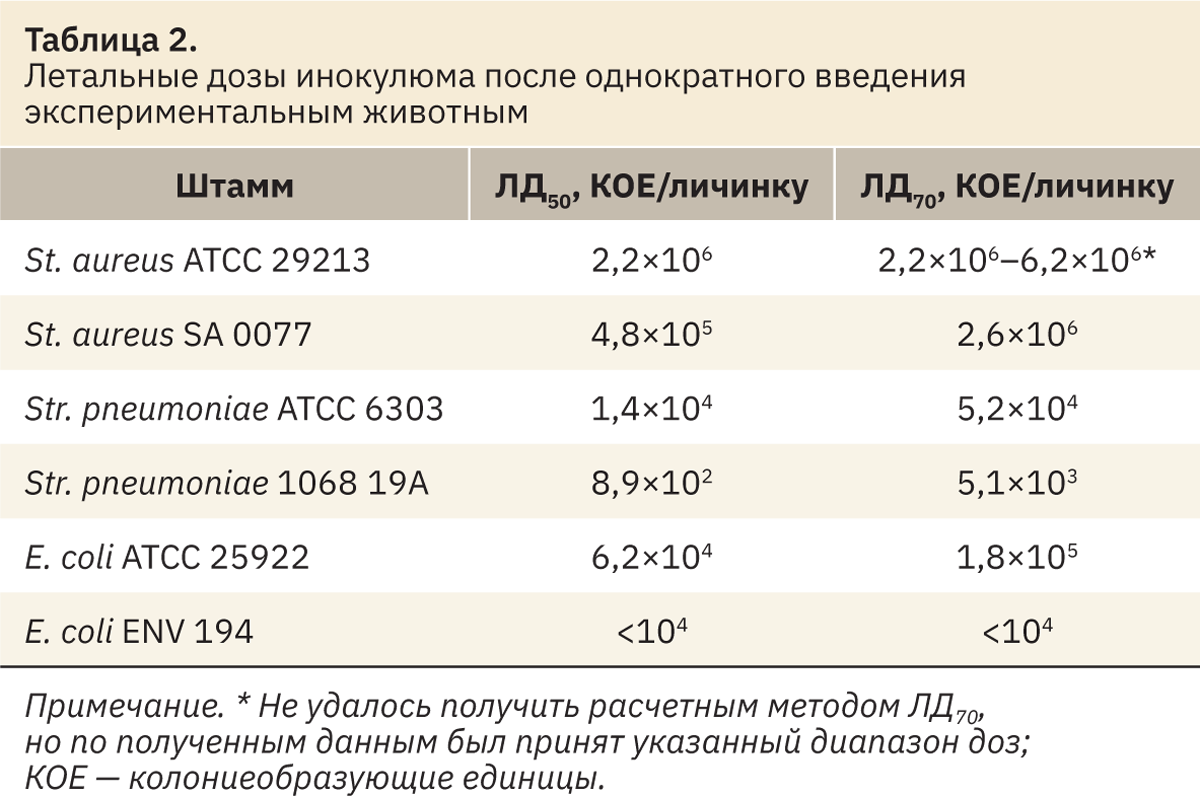
Исходя из полученных значений ЛД50, можно сделать заключение, что клинические изоляты являются более вирулентными относительно соответствующих эталонных штаммов.
Для заражения и дальнейшего лечения личинок большой восковой моли была установлена инфекционная доза. За инфекционную дозу бактерий приняли дозу, вызывающую 60–80% летальность. Исходя из расчетов летальной дозы (ЛД70), были выбраны дозы для инфицирования и дальнейшей антибактериальной терапии личинок на III этапе исследования.
II этап — определение МПК
Через 18 ч после инкубации планшетов оценивали антимикробную активность рифампицина и ципрофлоксацина в отношении используемых штаммов микроорганизмов. Для подтверждения вносимого количества клеток микроорганизмов в лунки планшетов в день постановки теста проводили высев содержимого лунки на чашки Петри. Контроль посевной дозы подтвердил необходимое количество клеток, вносимых в лунки планшетов, для бактерий в диапазоне 2×105–8×105 КОЕ/мл [13].
Также вместе с контролями посевных доз проводили учет результатов с 96‑луночных планшетов. Результаты учитывали визуально в проходящем свете. Данные оценки антимикробной активности сравнивали со значениями ECOFF (Epidemiological cut-off value, эпидемиологическое пороговое значение), представленными EUCAST (European Committee on Antimicrobial Susceptibility Testing, Европейский комитет по тестированию чувствительности к антимикробным препаратам), полученные сведения отображены в табл. 3.
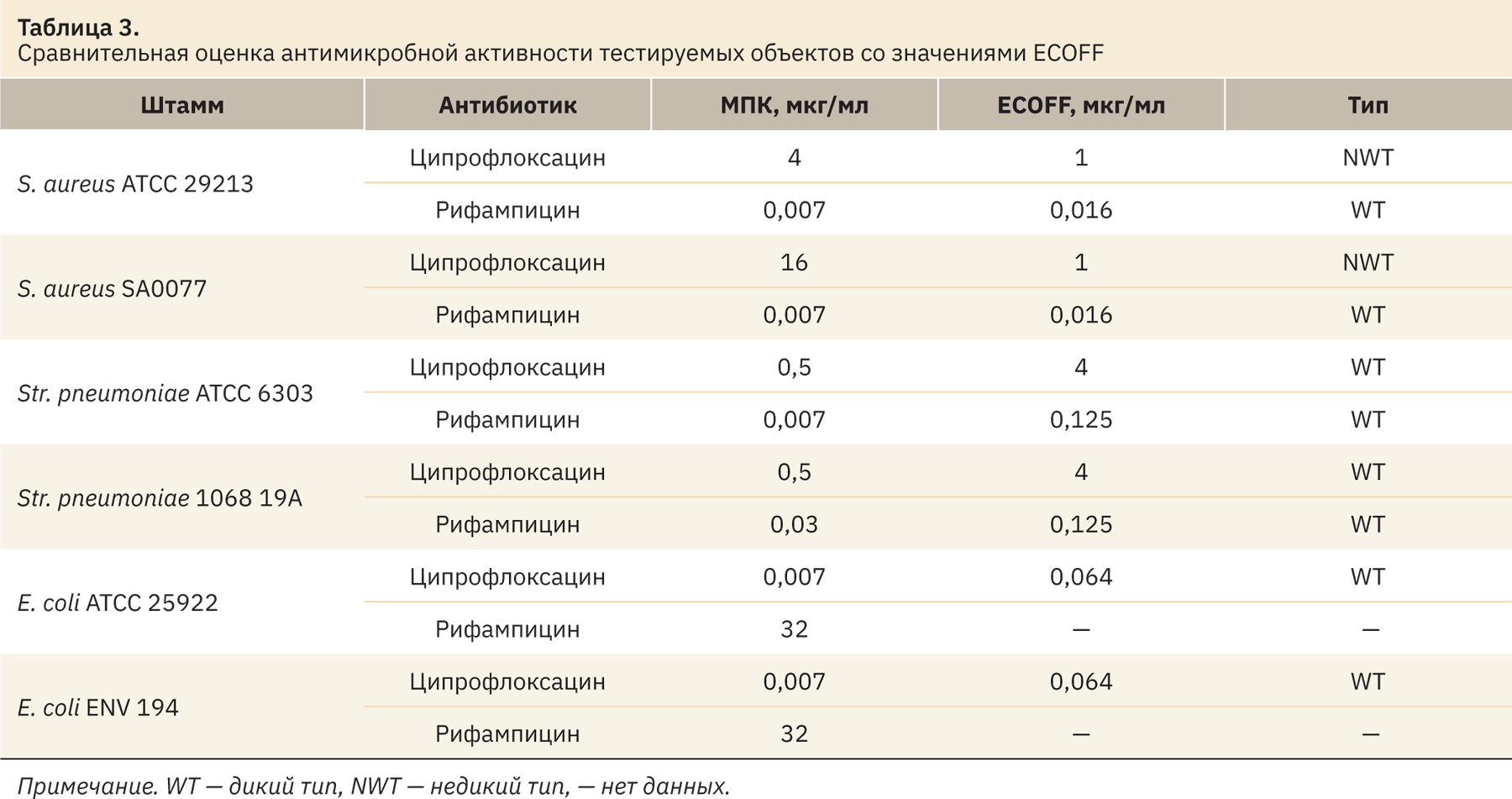
При сравнении полученных значений МПК и ECOFF можно сделать выводы о чувствительности микроорганизмов к антибиотикам.
Клинический изолят S. aureus SA0077 по паспорту является метициллинрезистентным золотистым стафилококком (MRSA) соответственно, штамм оказался устойчивым к ципрофлоксацину и чувствительным к рифампицину. Эталонный штамм S. aureus ATCC 29213 также чувствителен к рифампицину и начал вырабатывать устойчивость к ципрофлоксацину. Str. pneumoniae, эталонный штамм и клинический изолят оказались оба чувствительными к исследуемым антибиотикам. E. coli, как и ожидалось, был чувствителен к ципрофлоксацину и устойчив к рифампицину.
III этап — антибактериальная терапия
На III этапе исследования проверяли работу антибиотиков in vivo, заражали личинок большой восковой моли инфекционной дозой, а затем осуществляли антибактериальную терапию. При этом, как и на I этапе, проводили учет показателей здоровья личинок до заражения, в 1‑й день и далее каждые 24 ч. До заражения все личинки были активны и способны к коконообразованию, меланизация отсутствовала.
В 1‑й день эксперимента заражали личинок большой восковой моли соответствующими инфекционными дозами для каждого исследуемого штамма. Расчетные и фактически полученные концентрации инокулюмов представлены в табл. 4.

Концентрация инокулюма у штаммов Str. pneumoniae ATCC 6303, Str. pneumoniae 1068 19A, E. coli ENV 194 превысила расчетные концентрации на порядок, однако антибактериальная терапия все же оказалась эффективной относительно негативного контроля — инфицированных личинок без лечения.
При учете показателей здоровья через 24 ч после контрольного укола и введения индукторов патологии в контрольных группах не установлено признаков угнетения личинок. Все личинки проявляли умеренную активность с возможностью коконообразования. Меланизация и гибель отсутствовали, за исключением гибели одной личинки в группе контрольного прокола. Сумма баллов при оценке показателей здоровья в течение 5 дней наблюдения не была ниже 87,5. Также в группах контроля токсичности антибиотика гибель не зарегистрирована, личинки чувствовали себя хорошо — сумма баллов здоровья не ниже 91 из 100. В негативном контроле (зараженные личинки без лечения) регистрировали значительную гибель, потемнение кутикулы и снижение активности.
Как и ожидалось по результатам исследования in vitro, ципрофлоксацин оказался неэффективным, а рифампицин был действенным во всех концентрациях относительно микроорганизма St. aureus. Рифампицин in vivo чуть лучше воздействовал на инфекцию, вызванную эталонным штаммом St. aureus ATCC 29213, чем клиническим изолятом SA 0077. Оценка (в баллах) здоровья личинок, получавших антибактериальную терапию рифампицином, была значительно выше, чем в негативном контроле, что подтверждает действие антибиотика по отношению к штамму St. aureus SA 0077 (рис. 8).
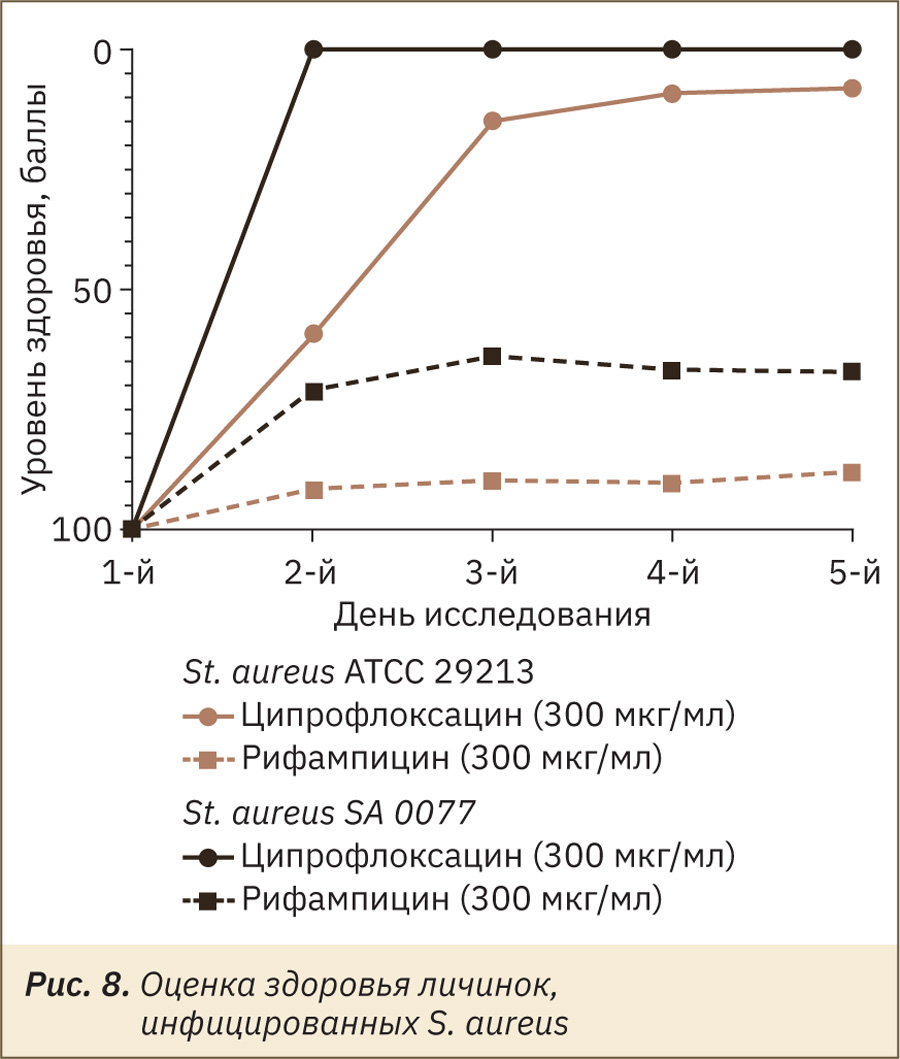
Штаммы Str. pneumoniae оказались чувствительны по отношению к исследуемым антибиотикам во всех концентрациях. Установлено, что на уровень здоровья личинок эталонный штамм Str. pneumoniae ATCC 6303 и клинический изолят Str. pneumoniae 1068 19A влияли одинаково (рис. 9).

Из II этапа следует, что штамм E. coli устойчив по отношению к рифампмцину, что можно увидеть на графике при оценке уровня здоровья (рис. 10), однако к ципрофлоксацину E. coli был чувствителен во всех концентрациях.
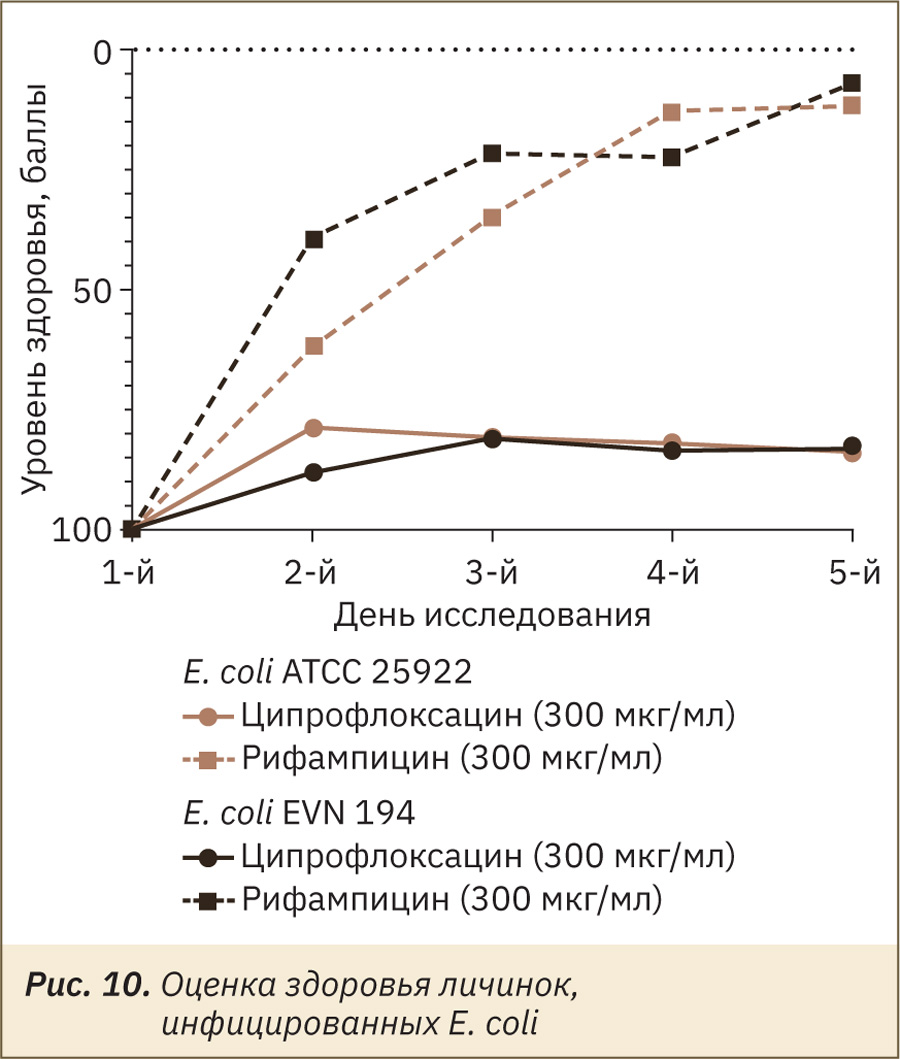
Таким образом, антибактериальная терапия во всех трех исследуемых дозах, рассчитанных исходя из терапевтических, оказалась эффективной. Как и ожидалось, in vivo наблюдали резистентность S. aureus по отношению к ципрофлоксацину, E. coli — к рифампицину.
Заключение
В рамках проведенного эксперимента была разработана модель бактериальной инфекции личинок Galleria mellonella на примере эталонных штаммов Escherichia coli, Staphylococcus aureus, Streptococcus pneumoniae и их клинических изолятов. Модель характеризовалась изменением общего состояния личинок (меланизация, подвижность, образование кокона) и гибелью животных в зависимости от дозы микроорганизмов.
Было установлено, что исследуемые клинические изоляты Staphylococcus aureus, Streptococcus pneumoniae и Escherichia coli оказались более вирулентными относительно эталонных штаммов микроорганизмов при инфицировании личинок Galleria mellonella. Штаммы микроорганизмов, оказавшиеся резистентными к антибиотикам в исследовании in vitro, приводили к гибели личинок на фоне антибактериальной терапии теми же антибиотиками.
Таким образом, совокупность полученных результатов продемонстрировала применимость в качестве модельного объекта личинок Galleria mellonella для оценки эффективности антибактериальных препаратов.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Ю.В. Салмова — дизайн исследования, выполнение экспериментальной части, сбор и систематизация материала, анализ и статистическая обработка данных, написание текста статьи.
Л.Р. Никифорова — выполнение экспериментальной части, сбор и систематизация материала.
К.Е. Боровкова — концепция исследования, редактирование текста статьи.
Список источников
- Cutuli M.A., Petronio G., Vergalito F. et al. Galleria mellonella as a consolidated in vivo model hosts: New developments in antibacterial strategies and novel drug testing // Virulence. 2019. Vol. 10. N. 1. P. 527–541. doi: 10.1080/21505594.2019.1621649.
-
Ramarao N., Nielsen-Leroux C., Lereclus D. The insect Galleria mellonella as a powerful infection model to investigate bacterial pathogenesis // Journal of Visualized Experiments. 2012. Vol. 70. P. 1–7. doi: 10.3791/4392.
- Tsai C.J. Y., Loh J.M., Proft T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing // Virulence. 2016. Vol. 7. N. 3. P. 214–229. doi: 10.1080/21505594.2015.1135289.
-
Evans B.A, Rozen D.E.A Streptococcus pneumoniae infection model in larvae of the wax moth Galleria mellonella // European Journal of Clinical Microbiology & Infectious Diseases. 2012. Vol. 31. N. 10. P. 2653–2660. doi: 10.1007/s10096‑012‑1609‑7.
-
Ignasiak K, Maxwell A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials // BMC Res. Notes. 2017. Vol. 10. N. 1. P. 428. doi: 10.1186/s13104‑017‑2757‑8.
-
Peleg A.Y., Jara S., Monga D. et al. Galleria mellonella as a model system to study Acinetobacter baumannii pathogenesis and therapeutics // Antimicrobial agents and chemotherapy. 2009. Vol. 53. N. 6. P. 2605–2609. doi: 10.1128/AAC.01533-08.
-
Гайдай Д.С., Гайдай Е.А., Макарова М.Н. Личинки большой восковой моли (Galleria mellonella) как модельный объект для исследования новых лекарственных средств // Международный вестник ветеринарии. 2017. № 2. С. 82–90 [Gaidai D.S., Gaidai E.A., Makarova M.N. Lichinki bol’shoi voskovoi moli (Galleria mellonella) kak model’nyi ob’ekt dlya issledovaniya novykh lekarstvennykh sredstv // Mezhdunarodnyi vestnik veterinarii. 2017. N. 2. P. 82–90 (In Russ)].
-
Селезнева А.И., Макарова М.Н., Рыбакова А.В. Методы рандомизации животных в эксперименте // Международный вестник ветеринарии. 2014. № 2. С. 84–89 [Selezneva A.I., Makarova M.N., Rybakova A.V. Metody randomizatsii zhivotnykh v eksperimente // Mezhdunarodnyi vestnik veterinarii. 2014. N. 2. P. 84–89. (In Russ)].
- Harding C.R., Schroeder G.N., Collins J.W. et all. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection // Journal of visualized experiments. 2013. N. 81. P. 1–10. doi: 10.3791/50964.
-
Desbois A.P., Coote P.J. Wax moth larva (Galleria mellonella): an in vivo model for assessing the efficacy of antistaphylococcal agents // Journal of Antimicrobial Chemotherapy. 2011. Vol. 66. N. 8. P. 1785–1790. doi: 10.1093/jac/dkr198.
-
Mukherjee K., Altincicek B., Hain T. et al. Galleria mellonella as a model system for studying Listeria pathogenesis // Applied And Environmental Microbiology. 2010. Vol. 76. N. 1. P. 310–317. doi: 10.1128/AEM.01301-09.
-
Национальный стандарт РФ ГОСТ Р ИСО 20776-1–2010 «Клинические лабораторные исследования и диагностические тест-системы in vitro. Исследование чувствительности инфекционных агентов и оценка функциональных характеристик изделий для исследования чувствительности к антимикробным средствам. Часть 1. Референтный метод лабораторного исследования активности антимикробных агентов против быстрорастущих аэробных бактерий, вызывающих инфекционные болезни». URL: http://docs.cntd.ru/document/1200083430 (дата обращения: 10.2021) [Natsional’nyi standart RF GOST R ISO 20776-1–2010 «Klinicheskie laboratornye issledovaniya i diagnosticheskie test-sistemy in vitro. Issledovanie chuvstvitel’nosti infektsionnykh agentov i otsenka funktsional’nykh kharakteristik izdelii dlya issledovaniya chuvstvitel’nosti k antimikrobnym sredstvam. Chast’ 1. Referentnyi metod laboratornogo issledovaniya aktivnosti antimikrobnykh agentov protiv bystrorastushchikh aerobnykh bakterii, vyzyvayushchikh infektsionnye bolezni». URL: http://docs.cntd.ru/document/1200083430 (data obrashcheniya: 10.2021). (In Russ)].
-
МУК 4.2.1890–04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» [MUK 4.2.1890–04 «Opredelenie chuvstvitel’nosti mikroorganizmov k antibakterial’nym preparatam». (In Russ)].
-
Media preparation for EUCAST disk diffusion testing and for determination of MIC values by the broth microdilution method / Version 5.0. January 2017. P. 4–5.
-
Инструкция по медицинскому применению лекарственного препарата Рифампицин (Rifampicinum). URL: https://www.rlsnet.ru/mnn_index_id_216.htm [Instrukciya po medicinskomu primeneniyu lekarstvennogo preparata Rifampicin (Rifampicinum). URL: https://www.rlsnet.ru/mnn_index_id_216.htm (In Russ)].
-
Инструкция по медицинскому применению лекарственного препарата Ципрофлоксацин (Ciprofloxacin). URL: https://www.rlsnet.ru/tn_index_id_3610.htm. [Instrukciya po medicinskomu primeneniyu lekarstvennogo preparata Ciprofloksacin (Ciprofloxacin). URL: https://www.rlsnet.ru/tn_index_id_3610.htm (In Russ)].
- Andrea A., Krogfelt K.A., Jenssen H. Methods and Challenges of Using the Greater Wax Moth (Galleria mellonella) as a Model Organism in Antimicrobial Compound Discovery // Microorganisms. 2019. Vol. 7. N. 3. P. 85. doi: 10.3390/microorganisms7030085.
-
Голуб В.Б. и др. Энтомологические и фитопатологические коллекции, их составление и хранение. Воронеж: изд-во ВГУ. 1980. 228 c. [Golub V.B. et al. Entomologicheskie i fitopatologicheskie kollektsii, ikh sostavlenie i khranenie. Voronezh: izd-vo VGU. 1980. 228 p. (In Russ)].
- Прозоровский В.Б. Использование методов наименьших квадратов для пробит-анализа кривых летальности // Фармакология и токсикология. 1962. № 1. C. 115–119 [Prozorovskii V.B. Ispol’zovanie metodov naimen’shikh kvadratov dlya probit-analiza krivykh letal’nosti // Farmakologiya i toksikologiya. 1962. N. 1. P. 115–119. (In Russ)].




