Клинико-биохимические и патоморфологические особенности прямого острого повреждения легких у крыс, вызванного интратрахеальным введением липополисахарида Salmonella enterica
Работа выполнена без спонсорской поддержки.
Волошин Н.И. , Пугач В.А., Тюнин М.А., Строкина Е.И., Хижа В.В., Николаев А.В., Салухов В.В. Клинико-биохимические и патоморфологические особенности прямого острого повреждения легких у крыс, вызванного интратрахеальным введением липополисахарида Salmonella enterica. Лабораторные животные для научных исследований. 2022; 3. https://doi.org/10.57034/2618723X-2022-03-02
Резюме
Цель исследования — оценка клинико-биохимических и патоморфологических особенностей прямого острого повреждения легких (ОПЛ) у крыс, вызванного интратрахеальным (и/т) введением липополисахарида (ЛПС) Salmonella enterica в дозе 20 мг/кг (ЛД50).
Были использованы 67 белых беспородных крыс-самцов в возрасте 8–12 нед массой тела 310–350 г (питомник «Рапполово», Ленинградская область), которые по методу аналогов были разделены на 2 группы: экспериментальную и контрольную. Экспериментальную работу проводили в два этапа. На первом этапе в течение 4 сут после моделирования ОПЛ исследовали общее состояние животных, измеряли показатели массы и температуры тела, регистрировали динамику гибели животных. В отдельной серии экспериментов изучали характер патоморфологических изменений в ткани легких у крыс. На втором этапе через 3 сут после и/т-введения ЛПС у крыс забирали кровь для проведения лабораторных исследований. Определяли показатели клинического и биохимического анализа крови, изучали гемостазиограмму, а также показатели газового и электролитного состава крови. Кроме этого, исследовали гравиметрические показатели легких (массовый коэффициент легких и степень их влагонасыщения).
Использованная модель ОПЛ характеризовалась снижением массы тела экспериментальных животных в среднем на 15%, стойкой гипотермической реакцией и развитием воспалительных гистоморфологических изменений в ткани легких на 2–3‑и сутки после и/т-введения ЛПС. Гибель животных на фоне ОПЛ регистрировали в течение 12 ч — 3 сут. Значение среднего эффективного времени гибели составило 29,10±3,05 ч.
По данным лабораторных исследований на 3‑и сутки после моделирования ОПЛ у экспериментальных животных отмечали лейкоцитоз, увеличение концентрации растворимых фибрин-мономерных комплексов и фибриногена, гиперкалиемию, гипогликемию, гипоксемию и ацидоз. Указанные изменения лабораторных показателей выявляли на фоне выраженного увеличения массового коэффициента легких и показателя их влагонасыщения, что свидетельствовало о развитии отека легких.
Простота исполнения, высокая воспроизводимость, наличие типовых признаков острого воспалительного повреждения легких, а также доступный набор лабораторных критериев для определения степени выраженности патологического процесса позволяют рекомендовать данную модель ОПЛ для проведения доклинических исследований, направленных на поиск и оценку эффективности кандидатных препаратов для профилактики и лечения острого респираторного дистресс-синдрома.
Введение
Острый респираторный дистресс-синдром (ОРДС) — остро возникающее диффузное воспалительное поражение паренхимы легких, развивающееся как неспецифическая реакция на различные повреждающие факторы и приводящее к формированию острой дыхательной недостаточности (как компонент полиорганной недостаточности) вследствие нарушения структуры и уменьшения массы аэрированной легочной ткани. ОРДС — полиэтиологический синдром, причинами возникновения которого являются как прямые повреждающие факторы (легочная инфекция, аспирационный синдром, утопление, вдыхание токсических веществ, тупая травма груди и др.), так и непрямые (шок, сепсис, политравма, кровопотеря, острый панкреатит, гемотрансфузии, отравления, искусственное кровообращение и т. д.) [1]. В США ежегодно диагностируется порядка 190 000 случаев и 74 000 смертей от ОРДС. Летальность у таких пациентов составляет в среднем около 35–45% в зависимости от причины ОРДС, тяжести его течения и наличия полиорганной недостаточности [2, 3].
В последние годы актуальность ОРДС особенно возросла в связи с периодически возникающими вспышками инфекционных заболеваний, при которых развивается тяжелое острое прямое повреждение легочной ткани [в том числе вызванное вирусами гриппа (А/H1N1 2009 pdm), а также коронавирусами MERS-CoV, SARS-CoV, SARS-CoV-2]. Так, например, большинство случаев тяжело протекающей новой коронавирусной инфекции, связанной с вирусом SARS-CoV-2, сопровождается развитием ОРДС, летальность при котором достигает 60%, что требует интенсивной респираторной и лекарственной терапии [4].
Существует большое количество методик, с помощью которых можно индуцировать прямое острое повреждение легких (ОПЛ) в эксперименте на лабораторных животных. Наиболее часто для воспроизведения ОПЛ используют интратрахеальное (и/т) введение липополисахаридов (ЛПС), соляной кислоты, блеомицина, а также ингаляционное воздействие газовой смесью под избыточным давлением и др. [5]. Идеальные экспериментальные модели ОПЛ должны иметь схожие механизмы развития и исходы с ОРДС, который встречается в клинической практике.
В настоящее время перспективными направлениями являются поиск и разработка экспериментальных моделей ОПЛ, обладающих высокой воспроизводимостью и возможностью применения простых количественных показателей, отражающих степень выраженности патологического процесса. Использование таких биомоделей имеет первостепенную важность при проведении доклинических исследований, направленных на поиск и оценку эффективности кандидатных препаратов для профилактики и лечения ОРДС различной этиологии.
Цель исследования — оценить клинико-биохимические и патоморфологические особенности прямого острого повреждения легких у крыс, вызванного и/т-введением липополисахарида Salmonella enterica.
Материал и методы
Все исследования выполнены с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986), в соответствии с правилами надлежащей лабораторной практики и Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование одобрено локальным этическим комитетом Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург (протокол № 258 от 21.12.21).
В работе использованы 67 белых беспородных крыс-самцов в возрасте 8–12 нед массой тела 310–350 г (питомник «Рапполово», Ленинградская область), которые по методу аналогов были разделены на 2 группы: экспериментальную и контрольную. Животных содержали в условиях вивария с соблюдением основных зоогигиенических требований: температурный режим 20–24 °С, 12‑часовой световой день, свободный доступ к корму и воде.
У крыс экспериментальной группы ОПЛ моделировали посредством и/т-ведения ЛПС S. enterica («Sigma-Aldrich») в дозе 20 мг/кг (ЛД50). Объем введения составил 1,5 мл/кг. В качестве растворителя использовали фосфатно-солевой буфер (рН 7,4). Перед выполнением и/т-введения животных наркотизировали с помощью внутрибрюшинного введения препарата «Золетил 100» в дозе 5 мг/кг. Процедуру и/т-введения осуществляли через 5 мин после наркотизации и проверки глубины наркоза с помощью зонда для крыс («MicroSprayer®» Aerosolizer, модель IA-1B, США). Контрольную группу составили животные после и/т-введения фосфатно-солевого буфера в аналогичном объеме.
Для выведения из эксперимента животных подвергали комбинированной эвтаназии с помощью передозировки растворов общих анестетиков [растворы препарата «Ксила» (20 мг/мл) и «Золетил 100» (50 мг/мл) в соотношении 1:1 в объеме 1 мл на 1 кг массы тела внутримышечно] и последующего обескровливания.
Эксперимент проводили в два этапа. На первом этапе (n=10) исследовали общее состояние животных, измеряли показатели массы и температуры тела, регистрировали динамику гибели животных. Измерение массы тела крыс осуществляли ежедневно в течение 4 сут в утреннее время с помощью коммерческих весов «AND NP-2000s» (Япония). Температуру тела животных регистрировали, используя ректальный термометр (зонд) «Microtherma ThermoWork» (Великобритания), через 3, 6, 12 ч после и/т-введения ЛПС, далее — ежедневно в течение 4 сут. В отдельной серии экспериментов изучали динамику патоморфологических изменений в ткани легких у крыс в течение 4 сут после моделирования ОПЛ (n=27). Через 3, 6, 12, 24, 48, 72 и 96 ч после и/т-введения ЛПС проводили эвтаназию животных и отбирали образцы ткани легких для гистологического исследования. Аутопсийный материал фиксировали в 10% растворе забуференного формалина и заливали в парафин. Гистологические срезы окрашивали гематоксилином и эозином.
На втором этапе исследовали лабораторные показатели у крыс через 3 сут после введения ЛПС. Для этого у контрольных (n=10) и выживших экспериментальных животных (n=9) из каудальной полой вены отбирали пробы крови. Клинический анализ крови выполняли на автоматическом ветеринарном гематологическом анализаторе («Mythic 18 Vet», Швейцария), а биохимический анализ — на автоматическом анализаторе («ChemWell 2910», США). Активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (ПВ), уровень фибриногена и активность антитромбина III (в %) определяли на полуавтоматическом анализаторе-коагулометре («Tcoag KC 4 Delta», Ирландия) с использованием реагентов «Tcoag» и НПО «Ренам». Уровень растворимых фибрин-мономерных комплексов (РФМК) исследовали в паракоагуляционном фенантролиновом тесте (НПО «Ренам»). Исследование газового и электролитного состава крови проводили при помощи автоматического анализатора «Abbot I-STAT» (Abbot, США). Определяли следующие показатели газового и электролитного состава крови: Na, K, Ca, pH, pCO2, pO2, TCO2, HCO3, BE, sO2.
После обескровливания животного извлекали легочный комплекс для изучения гравиметрических показателей, которые включали определение массового коэффициента легких и степени их влагонасыщения [6].
Статистическую обработку полученных результатов проводили при помощи пакета прикладных программ Graph Pad Prism 8.0. Результаты исследования приведены в виде медианы, верхнего и нижнего квартилей — Me [Q1; Q3]. При сравнении показателей применяли критерий Вилкоксона и U-критерий Манна–Уитни. Различия считали статистически значимыми при р<0,05. Для оценки динамики показателей массы и температуры тела в качестве фоновых значений использовали данные измерений, полученные за день до моделирования ОПЛ. Вероятностную оценку среднеэффективного времени гибели выполняли по методике, предложенной Т.В. Пастушенко [7].
Результаты и обсуждение
На первом этапе исследования оценивали показатели температуры и массы тела, а также патоморфологические изменения в ткани легких в течение 4 сут после моделирования ОПЛ.
В контрольной группе у животных регистрировали стабильный прирост массы тела в течение всего периода наблюдения, который в итоге составил 7,4% (p<0,05). Измерение температуры тела позволило выявить незначительные колебания показателя, которые не имели статистической значимости. У животных экспериментальной группы в течение 4 сут после и/т-введения ЛПС отмечали снижение массы тела относительно фоновых величин в среднем на 13,4% (p<0,05). Весь период наблюдения регистрировали стойкую гипотермическую реакцию. Уже через 3 ч после моделирования ОПЛ определяли резкое снижение температуры тела на 3,9 °C (p<0,05) относительно фоновых значений. Далее динамика температуры тела характеризовалась постепенным повышением показателя, в результате чего температура тела приближалась к уровню фоновых значений к исходу 4‑х суток наблюдения.
Гибель животных после и/т-введения ЛПС регистрировали в течение 12 ч — 3 сут. Значение среднего эффективного времени гибели составило 29,10±3,05 ч.
При оценке патоморфологических изменений через 3 и 6 ч после и/т-введения ЛПС в паренхиме легких экспериментальных животных отмечали развитие выраженного интерстициального и внутриальвеолярного отека, мелкоочаговых кровоизлияний и массивной лейкоцитарной инфильтрации всех структурных компонентов паренхимы органа. Через 12–24 ч более 50% объема легочной паренхимы было представлено безвоздушной тканью с тотальным внутриальвеолярным отеком и крупноочаговыми кровоизлияниями. В отечном паравазальном интерстиции большинства сосудов значительно увеличивались количество и плотность инфильтрата, содержащего нейтрофильные лейкоциты и активные формы макрофагов. На 2–3‑и сутки выявленные ранее патоморфологические изменения прогрессировали. Практически вся паренхима была представлена плотной гомогенной легочной тканью в состоянии альвеолярного отека с экссудатом, насыщенным белками, наличием кровоизлияний различного характера и со скоплением значительного количества сегментоядерных лейкоцитов на фоне дистелектаза. На 4‑е сутки исчезали проявления паравазального отека, а в участках альвеолярных перегородок увеличивалось количество клеточного инфильтрата в виде активных форм макрофагов и лимфоцитов с примесью эозинофильных лейкоцитов. Определяли активацию процессов клеточной репарации эпителия респираторных и воздухоносных путей.
Выявленная патоморфологическая картина изменений ткани легких у крыс после и/т-введения ЛПС S. enterica определяется как ОПЛ и является характерной для экспериментальных моделей ОРДС [8].
С учетом выявленной стадийности воспалительных изменений при гистологическом исследовании и максимальной выраженности патоморфологических изменений ткани легких все лабораторные исследования проводили на 3‑и сутки после индукции ОПЛ.
При исследовании показателей клинического анализа крови у животных экспериментальной группы установили увеличение количества лейкоцитов (p<0,05) и абсолютного количества моноцитов (p<0,05) в сравнении с показателями контрольных животных (табл. 1).
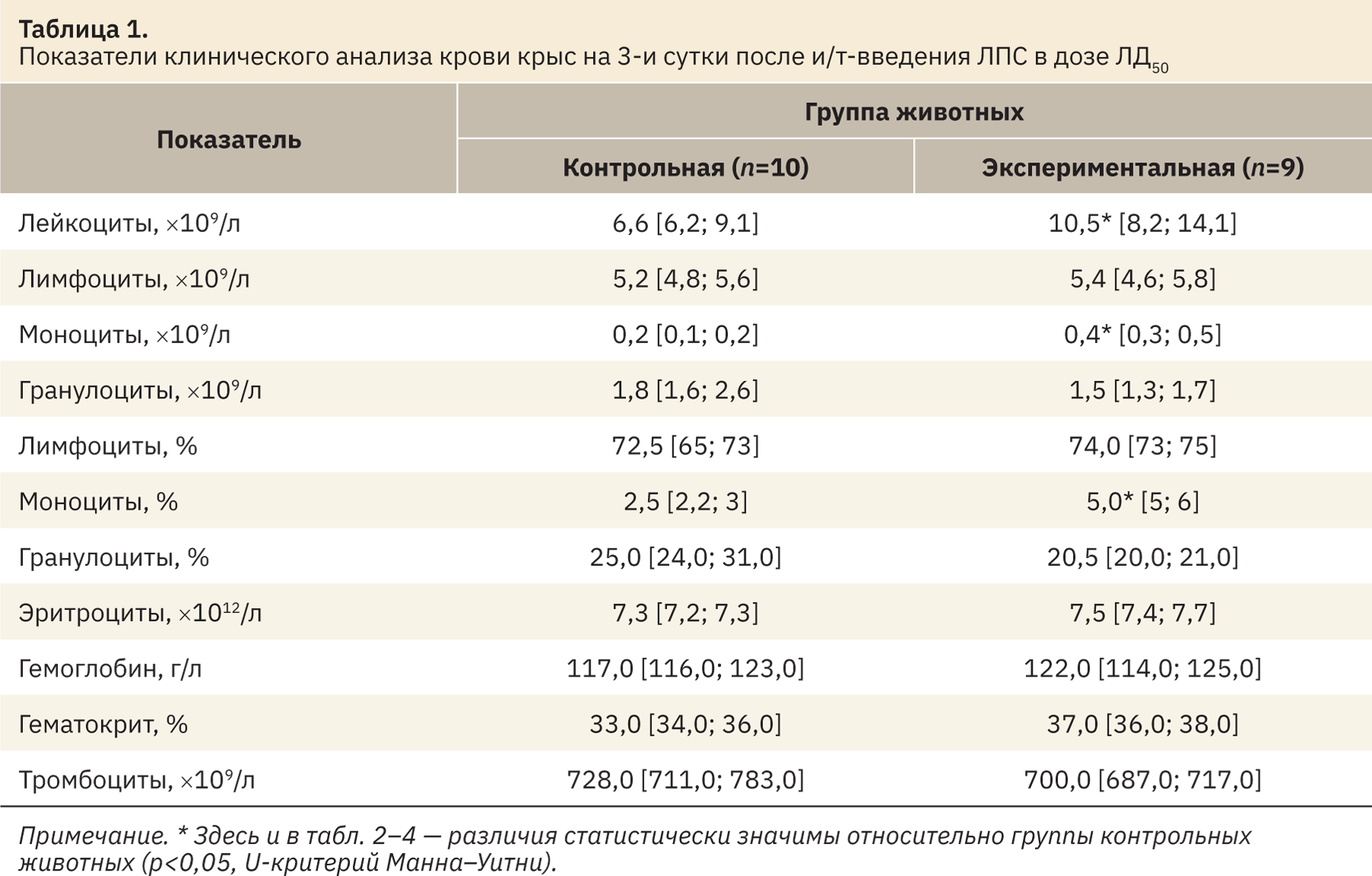
Анализ гемостазиологических показателей позволил выявить увеличение концентрации РФМК (p<0,05) и фибриногена (p<0,05), что свидетельствовало об активации свертывающей системы и высоком риске развития внутрисосудистого свертывания и тромботических осложнений (табл. 2). Увеличение количества лейкоцитов и фибриногена указывало на формирование системного воспалительного ответа.
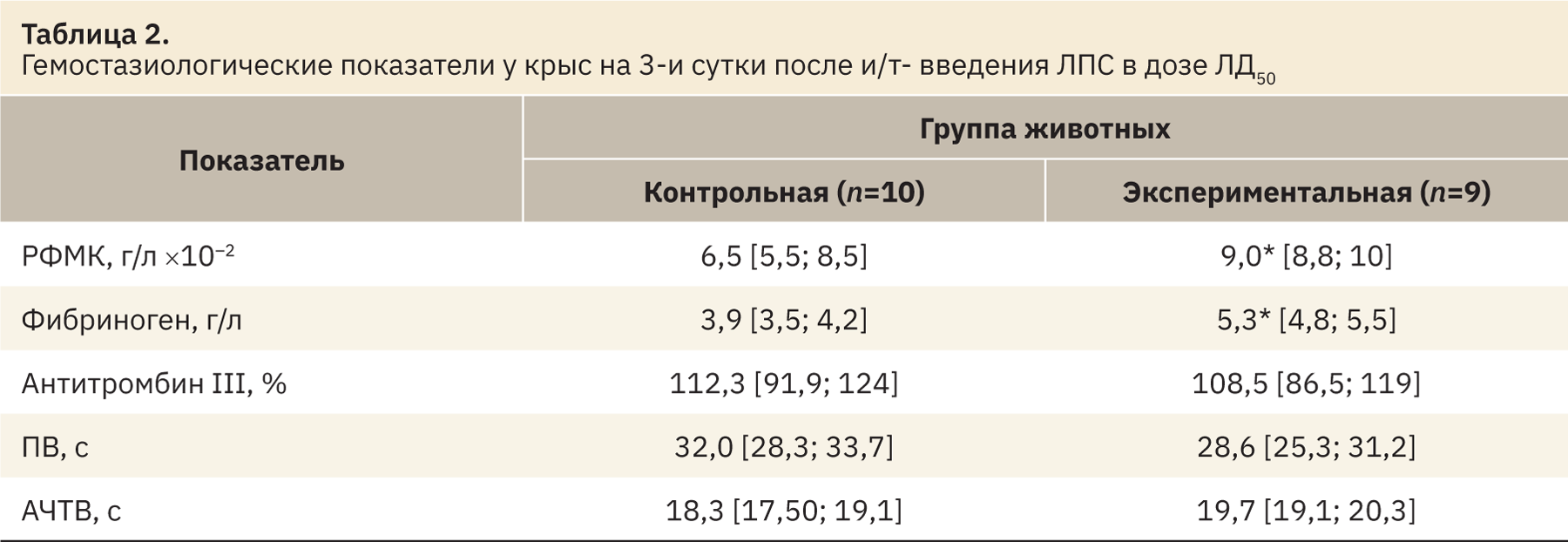
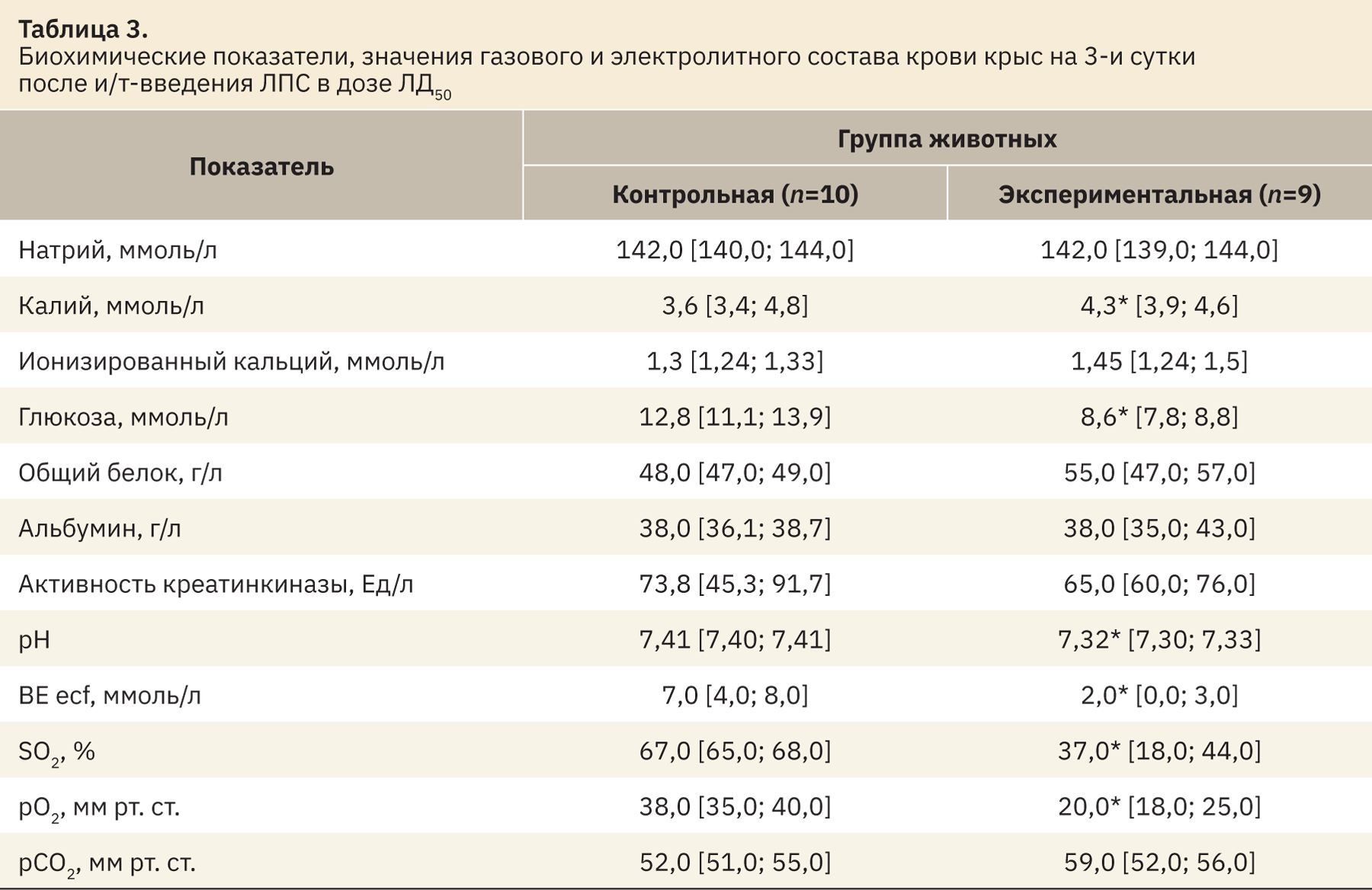
При исследовании биохимических показателей у животных экспериментальной группы было выявлено увеличение концентрации калия (p<0,05) и снижение концентрации глюкозы (p<0,05) в крови в сравнении с животными контрольной группы. Более высокие значения уровня калия в экспериментальной группе, вероятнее всего, были связаны с гипоперфузией почек на фоне системной воспалительной реакции, развивающейся после введения ЛПС.
Анализ газового состава венозной крови экспериментальных животных позволил выявить развитие гипоксемии, которая проявлялась в уменьшении парциального напряжения кислорода (pO2; p<0,05) и снижении сатурации (sO2; p<0,05). Кроме этого, наблюдали понижение pH (p<0,05), что свидетельствовало о формировании ацидоза на фоне уменьшения уровня буферных оснований (BE; p<0,05) (табл. 3).
При анализе гравиметрических показателей легких выявлено увеличение массового коэффициента легких в 2,1 раза и повышение их влагонасыщения на 21,7% в сравнении со значениями контрольных животных. Указанные изменения свидетельствовали о развитии экссудативной фазы воспаления после и/т-введения ЛПС, сопровождающейся отеком легочной ткани (табл. 4).

Заключение
В настоящем исследовании использована модель ОПЛ у крыс, вызванная и/т-введением ЛПС S. enterica. На фоне введения ЛПС у экспериментальных животных определены снижение массы тела в среднем на 15% в сравнении с контрольными животными и стойкая гипотермическая реакция, наблюдаемые в течение 4 сут после воздействия. Экспериментальная модель характеризовалась типовой воспалительной реакцией в ткани легких, пик патоморфологических изменений регистрировали на 2–3‑и сутки после моделирования ОПЛ.
По данным лабораторных исследований на 3‑и сутки после моделирования ОПЛ у экспериментальных животных определяли лейкоцитоз, увеличение концентрации РФМК и фибриногена, гиперкалиемию, гипогликемию, гипоксемию и ацидоз. Указанные изменения лабораторных показателей происходили на фоне выраженного увеличения массового коэффициента и влагонасыщения легких, что свидетельствовало о развитии отека.
Простота исполнения указанной модели, высокая воспроизводимость и наличие простых клинико-биохимических и патоморфологических показателей позволяют рекомендовать данную модель ОПЛ для проведения доклинических исследований, направленных на поиск и оценку эффективности кандидатных препаратов для профилактики и лечения ОРДС.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Н.И. Волошин — проведение экспериментов, сбор данных, анализ данных, написание рукописи.
В.А. Пугач — проведение экспериментов, сбор данных, анализ данных, написание рукописи.
М.А. Тюнин — критический пересмотр рукописи и утверждение окончательного варианта статьи для публикации.
Е.И. Строкина — экспериментальное моделирование, отбор биоматериала.
В.В. Хижа — проведение лабораторных методов исследования.
А.В. Николаев — разработка концепции исследования и критический пересмотр его содержания.
В.В. Салухов — разработка концепции исследования и критический пересмотр его содержания.
Список источников
-
Ярошецкий А.И., Грицан А.И., Авдеев С.Н. и др. Диагностика и интенсивная терапия острого респираторного дистресс-синдрома // Анестезиология и реаниматология. 2020. Т. 2. С. 5–39 [Yaroshetsky A.I., Gritsan A.I., Avdeev S.N. et al. Diagnostics and intensive therapy of Acute Respiratory Distress Syndrome // Russian Journal of Anaesthesiology and Reanimatology. 2020. Vol. 2. P. 5–39 (In Russ.)] https://doi.org/10.17116/anaesthesiology20200215.
-
Fan E., Del Sorbo L., Goligher E.C. et al. An Official American Thoracic Society/European Society of Intensive Care Medicine/Society of Critical Care Medicine Clinical Practice Guideline: Mechanical Ventilation in Adult Patients with Acute Respiratory Distress Syndrome // Am. J. Respir. Crit. Care Med. 2017. Vol. 195 (9). P. 1253–1263. https://doi.org/10.1164/rccm.201703-0548ST.
-
Griffiths M.J.D., McAuley D.F., Perkins G.D. et al. Guidelines on the management of acute respiratory distress syndrome // BMJ Open Respiratory Research. 2019. 6: e000420. https://doi.org/10.1136/bmjresp-2019-000420.
-
Gibson P.G., Qin L., Puah S.H. COVID-19 acute respiratory distress syndrome (ARDS): clinical features and differences from typical pre-COVID-19 ARDS // Med. J. Aust. 2020. Vol. 213 (2). P. 54–56. e1. https://doi.org/10.5694/mja2.50674.
-
Pierrakos C., Karanikolas M., Scolletta S. et al. Acute respiratory distress syndrome: pathophysiology and therapeutic options // J. Clin. Med. Res. 2012. Vol. 4 (1). P. 7–16. https://doi.org/10.4021/jocmr761w.
-
Торкунов П.А., Шабанов П.Д. Токсический отек легких: патогенез, моделирование, методология изучения // Обзоры по клинической фармакологии и лекарственной терапии. 2008. Т. 6. № 2. C. 3–54 [Torkunov P.A., Shabanov P.D. Toksicheskij otek legkih: patogenez, modelirovanie, metodologiya izucheniya // Obzory po klinicheskoj farmakologii i lekarstvennoj terapii. 2008. Vol. 6. N. 2. P. 3–54 (In Russ.)].
-
Шефтель В.О., Дышиневич Н.Е., Сова Р.В. Токсикология полимерных материалов / Киев: Здоровье, 1988. С. 77–78 [Sheftel’ V.O., Dyshinevich N.E., Sova R.V. Toksikologiya polimernyh materialov / Kiev: Zdorov’e, 1988. P. 77–78 (In Russ.)].
- Matute-Bello G., Downey G., Moore B.B. et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals // Am. J. Respir. Cell Mol. Biol. 2011. Vol. 44 (5). P. 725–738. https://doi.org/10.1165/rcmb.2009-0210ST.




