Определение сроков декальцинации образцов грудины, коленного сустава и препарата носовых ходов крыс
Устенко Ж.Ю., Викулина Д.А., Гущин Я.А. Определение сроков декальцинации образцов грудины, коленного сустава и препарата носовых ходов крыс . Лабораторные животные для научных исследований. 2021; 3. https://doi.org/10.29296/2618723X-2021-03-03
Резюме
Костная ткань и образцы с очагами минерализации требуют предварительной декальцинации перед гистологической обработкой. Декальцинация – это метод удаления солей кальция из образцов предварительно фиксированной ткани. В зависимости от типа исследования, сроков, отведенных на изготовление препарата, и типа образца для декальцинации используют различные растворы. В процессе декальцинации важно определить ее «конечную точку» – момент, когда минеральный компонент костной ткани удален, а органическая часть осталась нетронутой. Для определения конечной точки существует ряд методов, например, физический (прокол и сгибание), гравиметрический и рентгенологический. В клинической практике обычно контроль конечной точки осуществляется для каждой партии образцов. В доклинических исследованиях образцы, содержащие костную ткань, являются рутинной практикой, объем их довольно высок, а процедура отбора, как правило, стандартизирована в рамках конкретной лаборатории. Эти особенности позволяют стандартизировать методику декальцинации, установив при помощи одного из вышеперечисленных методов контрольные точки для типовых образцов.
В данном исследовании представлена сравнительная характеристика методик оценки конечной точки декальцинации, а также установлены сроки декальцинации для образцов грудины, препаратов коленного сустава и носовых ходов крыс. Гравиметрический метод наиболее хорошо подходит для контроля конечной точки в рутинных исследованиях. Он обладает точностью, простотой, быстротой и доступен для большинства лабораторий. Для всех типов перечисленных образцов установлен оптимальный срок декальцинации при использовании раствора на основе соляной и муравьиной кислот и в соответствии с описанной процедурой отбора, который составляет 6 сут. Более короткий срок пребывания образцов в декальцинирующем растворе приводит к получению толстых срезов с большим количеством артефактов, более длительный – к потере нормальной морфологии клеток и способности их воспринимать окраску. В рамках каждой лаборатории необходимо проводить валидацию методики декальцинации с учетом выбранных реактивов, типа и методики отбора образцов
Введение
Костная ткань, а также любые ткани с очагами минерализации из-за присутствия солей кальция не могут быть подготовлены для гистологического исследования в нативном виде. Декальцинация – это процесс удаления солей кальция из предварительно фиксированных образцов костной ткани, подобная процедура делает возможным дальнейшую вырезку и гистологическую обработку образцов для микроскопической оценки.
В доклинических исследованиях, в частности, проводимых на крысах, часто возникает необходимость в обработке образцов, содержащих костную ткань. В нашей лаборатории наиболее часто исследованию подвергаются носовые ходы (здесь требуется обработка всего лицевого черепа), грудина, эпифизы бедренной кости, коленный сустав (в этом случае происходит отбор вместе с бедренной и берцовыми костями).
Декальцинации можно подвергать выпиленный кусочек ткани или анатомическое образование целиком. В случае образцов доклинических исследований, особенно при исследовании носовых ходов и суставов, важно сохранить пространственную ориентацию образца и анатомо-топографические связи тканей. Малый размер образцов и плотность недекальцинированной костной ткани могут привести к сложностям во время выпилки. Вырезка после предварительной декальцинации костей с суставом или лицевого черепа целиком позволяет провести процедуру более аккуратно и точно [1].
Цель исследования – сравнить методики оценки контрольной точки декальцинации, а также установить оптимальный срок декальцинации типичных образцов, который обеспечит достаточное качество нарезки и хорошую окраску образца.
Декальцинации подвергаются предварительно фиксированные образцы. Для фиксации наиболее часто используют 10% нейтральный забуференный формалин [2]. В клинической практике отбирают для последующего исследования предварительно выпиленные образцы. В условиях доклинических исследований, учитывая объем образцов костной ткани и необходимость сохранения ориентации тканей и органов, наиболее часто декальцинации подвергается орган/анатомическое образование целиком. Фиксация проводится по общим правилам с соблюдением соотношения объема образца и фиксатора (1:10 – 1:20).
Существует большое количество вариантов декальцинирующих растворов и протоколов декальцинации. Выбор в каждом конкретном случае следует делать исходя из индивидуальных особенностей, целей и практического опыта лаборатории [1].
Наиболее часто в рутинных исследованиях для декальцинации используются растворы различных кислот. В клинической практике целесообразно использовать растворы на основе этилендиаминтетраацетата (ЭДТА) при исследовании опухолевых образцов, так как использование любых растворов кислот делает невозможным дальнейшую иммуногистохимическую (ИГХ) окраску. В доклинических исследованиях, если необходимо ИГХ-окрашивание, также следует использовать раствор на основе ЭДТА.
Используемые в качестве декальцинирующих растворов кислоты делят на сильные (соляная, азотная) и слабые (муравьиная, уксусная, пикриновая). Растворы сильных кислот быстрее извлекают соли кальция из образцов и поэтому используются для декальцинации компактных костей. Губчатые кости рекомендуют декальцинировать растворами слабых кислот, что требует большего времени. При выборе декальцинирующего раствора важно понимать, какие цели преследует конкретное исследование, какая кость будет подвергнута обработке и каковы сроки проведения исследования. На данный момент на рынке много коммерчески доступных декальцинирующих растворов и каждая лаборатория может выбрать подходящий под ее цели.
Объем выбранного раствора должен превышать таковой образца в 10–50 раз. Для растворов сильных кислот допускается меньший по сравнению с образцом объем, для растворов слабых кислот рекомендуется использовать объем, минимум в 20 раз превышающий образец. Чтобы обеспечить свободный выход солей кальция в раствор, его меняют на свежий ежедневно/еженедельно в зависимости от выбранного декальцинирующего раствора [1, 2].
Для достижения оптимальных результатов соотношения качества нарезки и окрашивания образцов костной ткани важно определить конечную точку декальцинации. Конечной точкой считается момент, когда все неорганические компоненты удалены, но органический остов кости при этом остался максимально нетронутым. Чрезмерное пребывание образца в декальцинирующей жидкости будет приводить к повреждению белковых структур и ухудшению качества окраски и морфологии ткани. При определении конечной точки в клинической практике рекомендуют проводить выборочную оценку одного/нескольких образцов [2], так как делать это для каждого образца достаточно трудно. В практике доклинических исследований, учитывая стандартизированную методику отбора образцов, применимо определение конечной точки для конкретного типа образца. В последующем установленный срок экспозиции в декальцинирующем растворе можно использовать для всех образцов данного типа. Определение контрольной точки должно быть выполнено в каждой лаборатории индивидуально. Сроки декальцинации могут различаться в первую очередь в зависимости от выбранного декальцинирующего раствора и методики отбора образца, а также от температурных и влажностных условий.
Для определения конечной точки существует ряд методов.
- физическая проба (прокол тонкой иглой/сгибание). Декальцинацию считают законченной, если игла проходит без хруста или материал легко сгибается. Однако данный метод может привести к появлению большого количества артефактов. При пробе с иглой в образце остаются повреждения, которые могут попасть в диагностически ценные участки. При сгибании образец может сломаться даже при отсутствии в нем минерального компонента. Кроме того, физическая проба довольно субъективна и не позволяет достоверно оценить весь образец, а только конкретные его участки.
- рентгенографический метод. Декальцинацию считают законченной, когда кость перестает быть рентгеноконтрастной. Метод достаточно точный и быстрый, позволяет обрабатывать большое количество образцов. Однако он требует наличия специального оборудования, навыков работы с ним, а также связан с вредным воздействием рентгеновского излучения на персонал.
- гравиметрический метод заключается в ежедневном взвешивании образцов с точностью до миллиграмма. Мелкие и легкие однотипные образцы допускается взвешивать вместе. В процессе декальцинации масса образца будет уменьшаться, а по достижении конечной точки вода начнет замещать кальций и масса может немного увеличиться. Декальцинацию в этот момент можно считать законченной. Гравиметрический метод прост, достаточно точен и доступен большинству лабораторий.
Не менее точным, но гораздо реже используемым методом является оксалатный тест. Суть его состоит в обнаружении нерастворимых гидроокиси и оксалата кальция в декальцинирующем растворе посредством их преципитации. Для этого к декальцинирующей жидкости добавляют 25% водный раствор аммиака и доводят его до нейтральности, а затем – насыщенный при комнатной температуре раствор оксалата аммония. Образование преципитата указывает на присутствие солей кальция в растворе, а прозрачность раствора на протяжении 30 мин говорит об отсутствии их и, следовательно, окончании декальцинации. Также используются углекислый тест (оценивается прекращение появления пузырьков углекислоты на поверхности декальцинирующего раствора) и оценка всплывания образца на поверхность (образец всплывает на поверхность при достаточной степени декальцинации). Два последних метода субъективны и часто могут приводить к ложным результатам.
По достижении конечной точки декальцинации образцы промывают и подвергают стандартной гистологической обработке [3].
Материал и методы
Исследование проведено на базе АО «НПО «Дом Фармации». Проанализированы данные, полученные от лабораторных самцов и самок крыс (питомник АО «НПО «Дом Фармации», Россия) контрольных групп доклинических исследований, проведенных в период январь–март 2021 г. Критериями включения животных в исследование были возраст (8–12 нед), линия (Wistar), пол (самцы и самки). Общее количество животных в исследовании 30. Животных содержали в условиях 24-часового фоторежима (12 ч день : 12 ч ночь, включение света в 8:00), контролируемой температуры (22±2ºC) и влажности (65±10%) воздуха при свободном доступе к очищенной воде и стандартному корму (гранулированный комбикорм). Эвтаназия животных: начальный этап – СО2, конечный этап – обескровливание полостей сердца или перерезание основных кровеносных сосудов. Все манипуляции проведены в соответствии директивой 2010/63/EU Европейского парламента и совета Европейского союза от 22.09.10 по охране животных, используемых в научных целях [4, 5].
Отбор образцов и процедура декальцинации
От каждого животного отбирали грудную кость, препарат коленного сустава, верхней челюсти с сохраненными носовыми ходами. Грудную кость забирали целиком, отсекая ребра и мечевидный хрящ, а также мягкие ткани. Для получения образца коленного сустава конечность перерезали проксимально на уровне середины бедренной кости, дистально на уровне середины большой и малой берцовых костей. Образец очищали от окружающих мягких тканей и кожи. Для получения препарата верхней челюсти с носовыми ходами предварительно отделяли нижнюю челюсть. После этого очищали верхнюю челюсть от кожи и мягких тканей, удаляли глазные яблоки и делали поперечный разрез на уровне глазниц.
Полученные образцы помещали в 10% нейтральный забуференный формалин (ООО «Лабико», Россия) в соотношении 1:20 и оставляли для фиксации на 72 ч.
Далее образцы помещали в емкость объемом 200 мл с электролитным декальцинирующим раствором (ООО «Лабико», Россия), представляющим собой смесь соляной и муравьиных кислот. Раствор заменяли через день.
Разделение на группы и оценка конечной точки
Полученные наборы образцов делили на 3 группы и оценивали тремя методами (физическим, гравиметрическим, рентгенографическим). Оценку проводили сразу после отбора, по окончании срока фиксации и в течение 10 дней после начала декальцинации ежедневно.
1-я группа (n=10)
Конечную точку декальцинации оценивали физическим методом (прокол и сгибание). Прокол осуществляли препаровальной гистологической иглой. Для улучшения точности оценки были определены критерии оценки физических параметров. Для метода прокола: прокол невозможен (-), прокол с большим трудом/хрустом или не прокалывается на всю толщу (+), прокалывается полностью с усилием (++), легко прокалывается на всю толщу образца (+++). Для метода сгибания: не гнется/не сгибается (-), легкая упругость образца, но не сгибается (+), сгибается/гнется с усилием (++), легко сгибается/сжимается (+++).
2-я группа (n=10)
Оценку конечной точки декальцинации проводили гравиметрическим методом. Образцы взвешивали по отдельности на аналитических весах 2-го класса точности Adventurer RV 214 (AR 2140) (OHAUS, Китай) и записывали в заранее подготовленную таблицу значения с точностью до 1 мг.
Для демонстрации данные массы образцов в каждый из дней эксперимента переводили в процентные значения. За 100% была взята масса образца в нулевой день эксперимента. Для полученных данных, выраженных в процентах, считали среднее и стандартную ошибку среднего в каждый из дней эксперимента. Полученные значения наносили на график.
3-я группа (n=10)
В этой группе оценку конечной точки декальцинации проводили рентгенографическим методом при помощи портативного рентгенологического аппарата Rextar X (Pasdion, Ю. Корея). В зависимости от типа образца использовали различное время экспозиции: 0,18 с для образцов коленного сустава, 0,16 с для образца грудины 0,20–0,22 с для препаратов носовых ходов (в зависимости от размера образца). Характеристики напряжения и тока в данном аппарате фиксированные и составляют 70 кВ и 2 мА соответственно. Оценивали наличие очагов минерализации, плотность костных структур, четкость их визуализации.
Прекращение декальцинации и дальнейшая обработка образцов
Для сравнения качества окраски и трудностей гистологической обработки материала часть образцов вне зависимости от результатов оценки конечной точки выводили из эксперимента на 4-й (n=6; по 2 из каждой группы), 6-й (n=6; по 2 из каждой группы) и 10-й (n=18; по 6 из каждой группы) дни декальцинации и подвергали дальнейшей гистологической обработке.

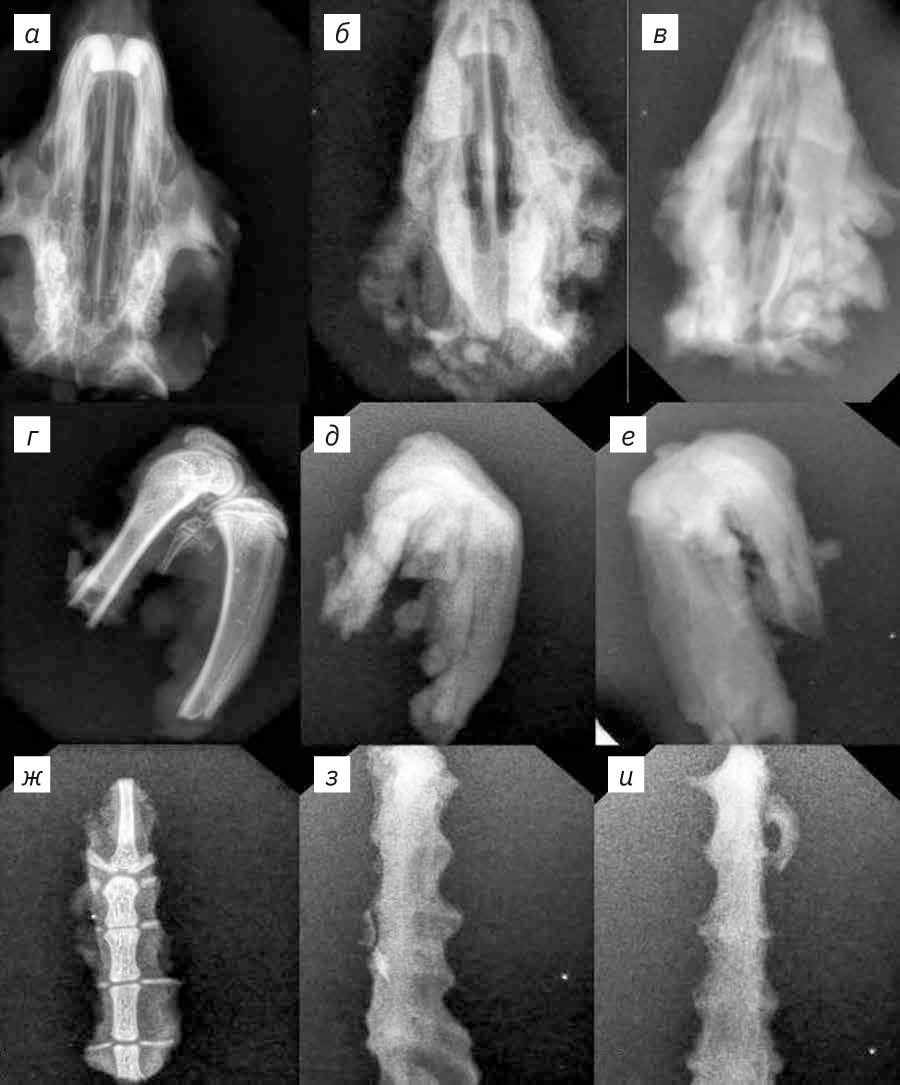
Вырезку материала осуществляли микротомными лезвиями MX35 Premier+ (Thermo Scientific, США) следующим образом: препарат сустава разрезали на две половины в медианной плоскости и помещали в кассету; препарат носовых ходов последовательно разрезали в поперечной плоскости с ходом 4 мм и помещали в кассеты 2 образца (срез за резцами и срез на уровне первых моляров). Грудину помещали в кассету целиком (рис. 1).
В дальнейшем кассеты с образцами подвергали стандартной гистологической проводке: промывка, обезвоживание в батарее восходящих спиртов, пропитывание и заливка в парафин. Полученные парафиновые блоки охлаждали и резали на ротационном микротоме Accu-Cut® SRM™ 200 (Sakura, Нидерланды) на части толщиной 2–4 мкм. Срезы наносили на предметное стекло, сушили и красили гематоксилином и эозином.
Статистический анализ полученных данных выполняли с помощью пакета программы GraphPad Prism 9. Данные представлены в виде среднего и стандартной ошибки среднего.
Результаты и обсуждение
Оценка контрольной точки
Все образцы из 1-й группы не прокалывались и не сгибались непосредственно после отбора и фиксации. После 1 дня нахождения в декальцинирующем растворе наблюдали прокалывание и сжатие, что отмечено как +. Начиная со 2-х суток нахождения в декальцинирующем растворе и все последующие дни степень сжатия и прокола оценивали как ++. В ходе нашего исследования степень сжатия/прокола образцов никак значимо не менялась после 2-х суток.
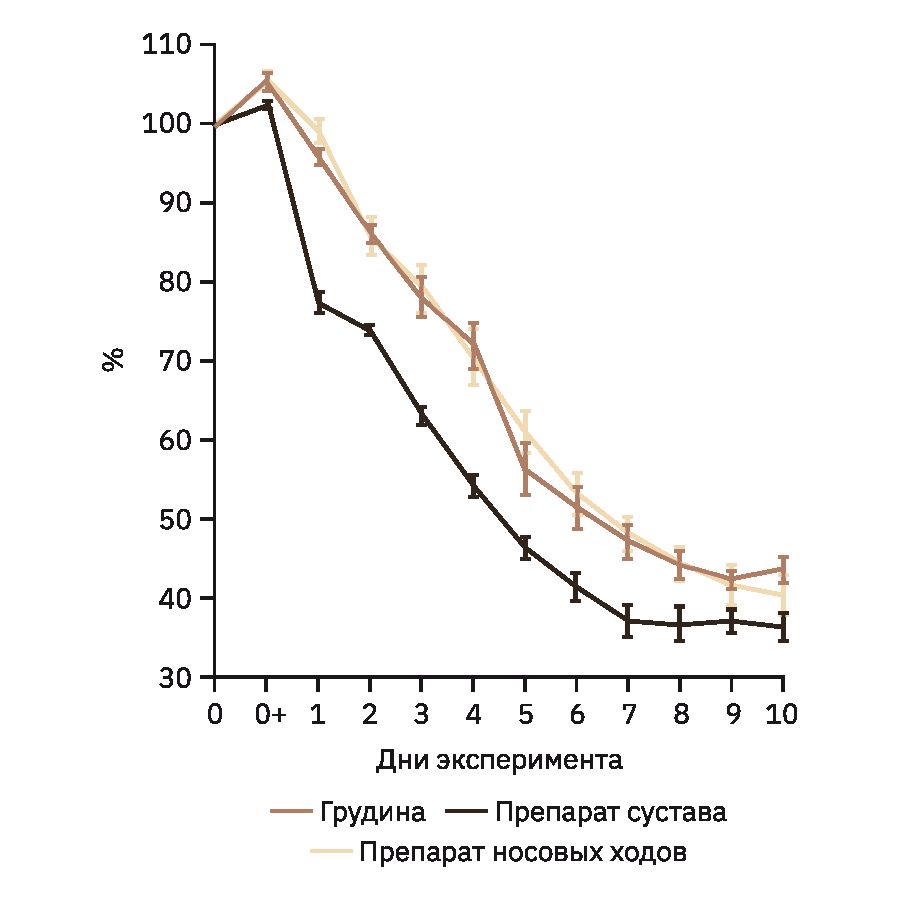
При оценке контрольной точки гравиметрическим методом во всех случаях отмечали увеличение массы образцов после фиксации. Далее масса образцов уменьшалась. Все образцы грудины и препаратов сустава демонстрировали плавное уменьшение массы вплоть до 7–8-го дня декальцинации. После чего масса стабилизировалась или незначительно увеличивалась. В двух образцах наблюдали продолжающееся снижение массы до 10-го дня. Большинство препаратов носовых ходов демонстрировали продолжение снижения массы вплоть до 10-го дня. В двух образцах масса стабилизировалась на 9-й день декальцинации. Образцы грудины на 6-й день декальцинации уменьшались в массе в среднем на 48,4±2,7%. На 10-й день снижение массы составило 56,2±1,8%. Образцы препаратов суставов на 6-й и 10-й дни стали легче на 58,5±1,8 и 63,4±1,8% соответственно, а образцы препаратов носовых ходов – на 46,7±2,8 и 59,4±2,6%.
На рис. 2 продемонстрирована динамика снижения массы каждого типа образцов. Данные представлены в виде средних значений массы и стандартных ошибок среднего.
На рис. 3 представлены рентгенограммы образцов из 3-й группы, сделанные сразу после отбора образцов, на 6-й и 10-й дни декальцинации. Во всех образцах отмечали постепенную потерю детализации очертаний костей, снижение их рентгенографической плотности. Области костей выглядели матовыми. На рентгенограммах, сделанных на 10-й день декальцинации, все еще выявляются мелкие очаги минерализации. Наиболее заметны они в костях верхней челюсти и эпифизах большеберцовой и бедренной костей.
Результаты гистологического исследования костей с разным сроком декальцинации
Образцы после 4 дней декальцинации с трудом резались на вырезке и микротоме. При резке на микротоме отмечали большое количество полос и разрывов. Меньше всего артефактов и трудностей при нарезке отмечали в образцах грудины. На 6-й и 10-й дни декальцинации разница между усилием при вырезке и нарезке не была существенной, все образцы резались хорошо.
На рис. 4–6 представлены результаты гистологического исследования образцов. Во всех образцах, выведенных из эксперимента на 4-й день декальцинации, отмечали артефакты нарезки. Срезы были толстыми, многие содержали разрывы, значимо влияющие на диагностическую ценность образца. Отмечали окраску «полосами» как следствие неравномерной толщины образца. Однако образцы, которые находились в декальцинирующем растворе дольше 4 дней, хуже удерживались на стекле. Срезы грудины, декальцинированной в течение 4 дней, получались наиболее качественными по сравнению с препаратами суставов и носовых ходов.
Трабекулы костной ткани в срезах грудины на 4-й день декальцинации содержали умеренное количество очагов минерализации. Клетки костного мозга имели хорошо детализированную морфологию. Срез грудины в этом случае был достаточно тонкий для обзорной оценки морфологии клеток костного мозга. После 6 дней декальцинации срез становился более тонким, равномерно окрашенным, без разрывов и полос. В этом случае все еще отмечались небольшие очаги минерализации в костной ткани. Качество окраски кроветворных клеток, сохранность их морфологии и толщина среза позволяли провести обзорную оценку патологий костного мозга. В образце грудины после 10 дней декальцинации не выявлялись очаги минерализации кости, срез был тонкий, равномерно окрашенный. Однако было заметно слабое прокрашивание ядер всех типов клеток. Также отмечалось ухудшение морфологии клеток костного мозга: детализация ядер в большинстве клеток снижена, гранулы цитоплазмы плохо визуализируются, границы клеток нечеткие. Оценить патологию костного мозга в таком образце невозможно.
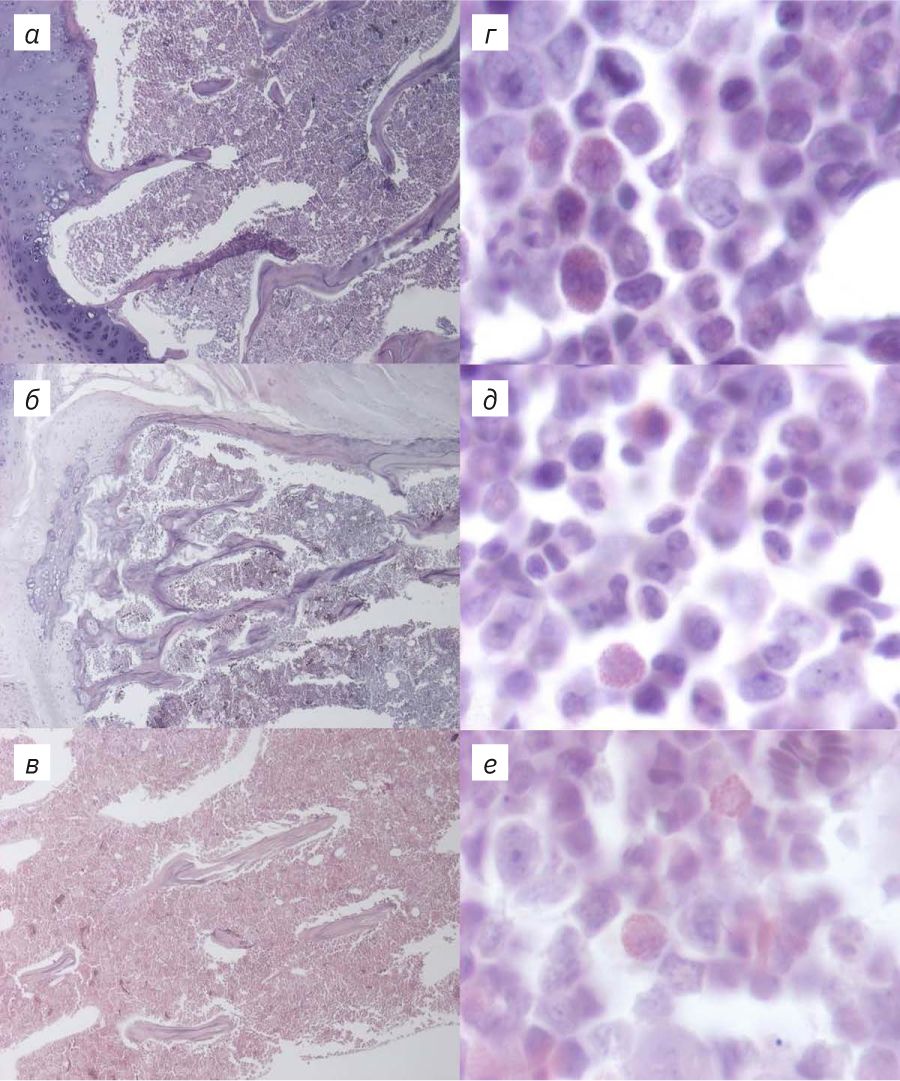
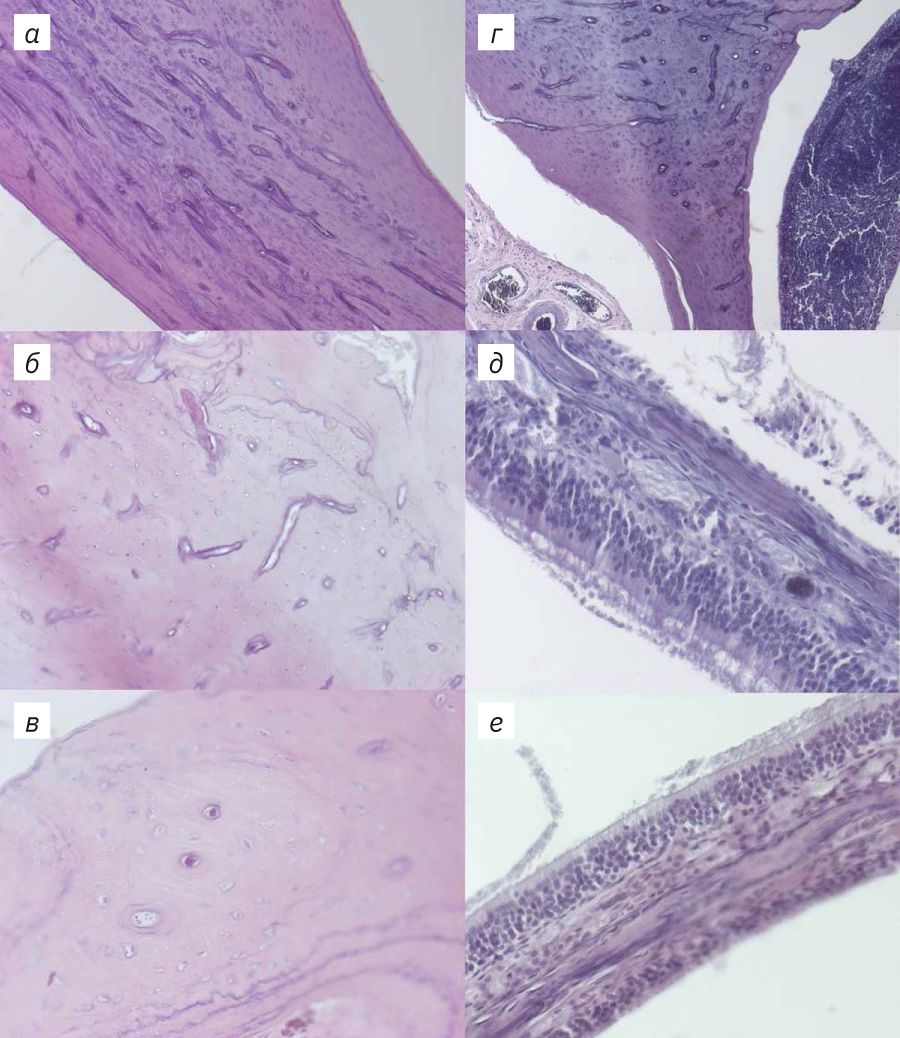
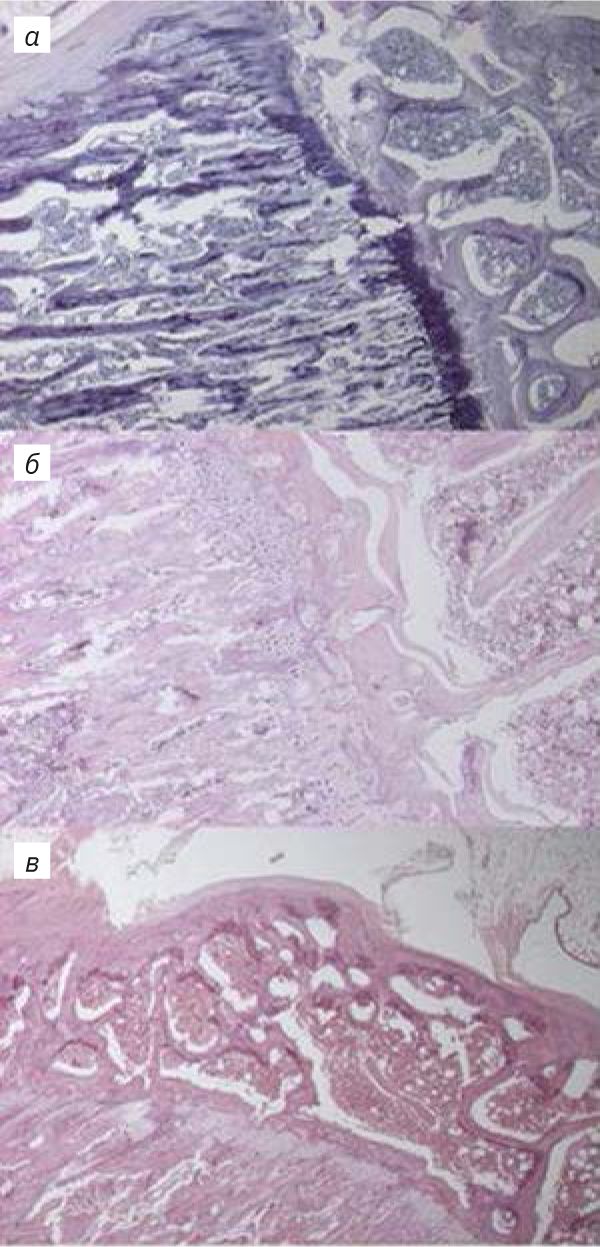
В препаратах носовых ходов количество очагов минерализации также снижалось к 10-му дню декальцинации. На 4-й день отмечали большое количество разрывов, на 4-й и 6-й дни – присутствие окраски «полосами». Морфология клеток эпителия носовых ходов была сохранена в образцах после 4 и 6 дней в декальцинирующем растворе. Однако в образце, декальцинированном 4 дня, значительная часть эпителия была разорвана в процессе нарезки. Образцы, подвергавшиеся воздействию декальцинирующего раствора 10 дней, демонстрировали неравномерную окраску эпителия. Как в костной, так и в эпителиальной ткани отмечали ухудшение окраски ядер, потерю границ клеток, снижение детализации ресничек эпителия.
В препаратах сустава после 4 дней декальцинации отмечали большое количество очагов минерализации в эпифизах костей. Срез получался толстым, содержал большое количество разрывов. Вследствие большой толщины среза хрящевая ткань была интенсивно окрашена, что затрудняло оценку ее морфологии. Срезы образцов после 6 и 10 дней декальцинации были тонкими. Окраска их была равномерной, но в образцах после 10 дней декальцинации ядра были прокрашены хуже, а границы клеток нечетко детализированы. В срезах из образцов после 6-дневной декальцинации присутствовали очаги минерализации в небольшом количестве.
Заключение
Оценка конечной точки декальцинации физическим методом является довольно субъективной и не подходит для стандартизации процессов декальцинации. При оценке образцов, отобранных для рутинного токсикологического исследования, невозможно точно выявить тонкие изменения в степени кальцинации ткани. Артефактов прокола не замечено, так как размеры образцов позволяли провести прокол и вырезку в разных местах. Однако в случае более маленького образца артефакт прокола может значимо повлиять на его диагностическую ценность. Гравиметрический и рентгенографический методы гораздо более объективные и точные. Гравиметрический метод прост, не требует больших финансовых и временных затрат и может быть рекомендован для оценки конечной точки декальцинации в рутинных токсикологических исследованиях. Рентгенографический метод также подходит для этих целей и может использоваться лабораториями, имеющими необходимые оборудование и навыки, а также в специализированных исследованиях.
Каждой лаборатории необходимо проводить процедуру валидации методики декальцинации типовых образцов самостоятельно, так как выбранный декальцинирующий раствор, методика отбора образцов и условия в лаборатории могут повлиять на сроки в каждом конкретном случае.
На основании полученных результатов, можно сделать вывод, что при использовании декальцинирующего раствора из смеси соляной и муравьиной кислот образцы грудины и препараты суставов достигают достаточной для рутинного токсикологического исследования степени декальцинации на 6-й день. Для препаратов носовых ходов оптимальным будет 8-дневная декальцинация при указанных условиях. На этом сроке можно получить тонкий срез, окраска происходит равномерно, детализация клеток и их структур четкая. Более длительное пребывание в декальцинирующем растворе приводит к разрушению органических структур и ухудшению морфологии тканей, что затрудняет их оценку, кроме того, снижает способность тканей и клеток (особенно ядер) воспринимать краситель. Более раннее прерывание декальцинации приводит к наличию большого количества артефактов нарезки, которые могут сделать невозможной оценку диагностически ценных участков. Отмечено снижение адгезии среза к стеклу после 6 дней декальцинации, что следует учесть при планировании работы.
Стоит отметить, что в нашем исследовании очаги минерализации отмечались при использовании рентгенографического метода даже после 10 дней пребывания в декальцинирующем растворе. Таким образом, 6- или 8-дневный срок декальцинации описанных в работе образцов нельзя назвать «конечной точкой», однако, на наш взгляд, этого срока достаточно для получения качественных, диагностически ценных срезов. В случае специализированных исследований при необходимости извлечь весь кальций из кости следует рассмотреть возможность вырезки интересующих участков на 2–3-й день декальцинации и продолжить ее, поместив вырезанные объекты в гистологические кассеты. Меньшие количество мягких тканей и толщина образца и большая площадь соприкосновения с декальцинирующим раствором ускорят процесс и позволят раствору проникнуть в более глубокие слои образца. Также можно рассмотреть более частую смену декальцинирующего раствора.
На основании проведенного исследования мы можем рекомендовать следующий протокол декальцинации образцов костной ткани крыс:
- 1–3-й день: отбор материала и фиксация;
- 4-й день (1-й день декальцинации): замена фиксатора на декальцинирующий раствор;
- 5-й день (2-й день декальцинации): вырезка интересующего участка (если необходимо);
- 6-й день (3-й день декальцинации): замена декальцинирующего раствора на свежий;
- 7-й день (4-й день декальцинации): отсутствие манипуляций с образцом;
- 8-й день (5-й день декальцинации): замена декальцинирующего раствора на свежий;
- 9-й день (6-й день декальцинации): результаты оценки степени декальцинации:
- а) промывка образца и начало дальнейшей гистологической проводки или помещение в 10% забуференный формалин для хранения;
- б) повторить пункты 6, 7 до достижения достаточной степени декальцинации образца.
Рекомендуется проводить корректировку сроков декальцинации гравиметрическим методом при смене типа декальцинирующего раствора, поставщика растворов, а также при обработке нового типа образцов.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Вклад авторов
Ж.Ю. Устенко – идея, концепция и дизайн исследования, сбор и систематизация материала, написание и редактирование текста статьи, подготовка фотоматериалов для статьи.
Д.А. Викулина – сбор и систематизация материала, написание и редактирование текста статьи.
Я.А. Гущин – идея, концепция и дизайн исследования, редактирование текста статьи.
Список источников
- Skinner R.A. Decalcification of Bone Tissue: in Handbook of Histology Methods for Bone and Cartilage/ edited by Yuehuei H., Kylie L. Martin. // Humana Press: Totowa, New Jersey. – 2003. – 588 p.
- Пешков М.В. Декальцинация в гистологической лабораторной технике // Архив патологии. – 2012. –№6. – С. 43-45 [Peshkov M.V. Dekal'tsinatsiya v gistologicheskoi laboratornoi tekhnike // Arkhiv patologii. – 2012. – № 6. – P. 43-45 (In Russ)]
- Мужикян А.А., Макарова М.Н., Гущин Я.А. Особенности гистологической обработки органов и тканей лабораторных животных. // Международный вестник ветеринарии. – 2014. – № 2. – С. 103-109 [Muzhikyan A.A., Makarova M.N., Gushchin Ya.A. Osobennosti gistologicheskoi obrabotki organov i tkanei laboratornykh zhivotnykh. // Mezhdunarodnyi vestnik veterinarii. – 2014. – № 2. – P. 103-109 (In Russ)].
- Рыбакова А.В., Макарова М.Н. Методы эвтаназии лабораторных животных в соответствии с европейской директивой 2010/63 // Международный вестник ветеринарии. – 2015. – № 2. – С. 96-107 [Rybakova A.V., Makarova M.N. Metody ehvtanazii laboratornykh zhivotnykh v sootvetstvii s evropeiskoi direktivoi 2010/63 // Mezhdunarodnyi vestnik veterinarii. – 2015. – N2. – S. 96-107 (In Russ)].
- Директива 2010/63/EU Европейского парламента и совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях. Гл. I, ст. 6 [Direktiva 2010/63/EU Evropeiskogo parlamenta i soveta Evropeiskogo soyuza ot 22.09.2010 po okhrane zhivotnykh, ispol'zuemykh v nauchnykh tselyakh. Gl. I, st. 6 (In Russ)].
- Коптяева К.Е., Мужикян А.А., Гущин Я.А., Беляева Е.В., Макарова М.Н., Макаров В.Г. Методика вскрытия и извлечения органов лабораторных животных (крысы) // Лабораторные животные для научных исследований. – 2018. – № 2. – C. 1-22 https://doi.org/10.29296/2618723X-2018-02-08 [Koptyaeva K.E., Muzhikyan A.A., Gushchin Ya.A., Belyaeva E.V., Makarova M.N., Makarov V.G. Metodika vskrytiya i izvlecheniya organov laboratornykh zhivotnykh (krysy) // Laboratornye zhivotnye dlya nauchnykh issledovanii. – 2018. – № 2. – P. 1-22 (In Russ)].




