Модель диет-индуцированного экспериментального сахарного диабета у лабораторных песчанок и дегу
Работа выполнена без спонсорской поддержки.
Ходько С.В., Крышень К.Л., Гайдай Е.А. Модель диет-индуцированного экспериментального сахарного диабета у лабораторных песчанок и дегу. Лабораторные животные для научных исследований. 2023; 3. https://doi.org/10.57034/2618723X-2023-03-07
Резюме
По последним данным Международной федерации диабета (International Diabetes Federation, IDF), количество пациентов с сахарным диабетом в мире достигло 463 млн, что опередило ранее прогнозируемые темпы прироста на 10–12 лет, а к 2045 г. ожидается увеличение на 51%, то есть до 700 млн человек. Таким образом, разработка и оценка эффективности и безопасности гипогликемических средств являются актуальной задачей по причине высокой социальной значимости проблемы. Для проведения доклинических исследований существует множество моделей формирования экспериментального сахарного диабета у животных как с использованием химических индукторов, вызывающих поражение островкового аппарата поджелудочной железы, так и с использованием диет. Согласно данным литературы, песчанки и дегу склонны к проявлению гипергликемии и инсулинорезистентности при кормлении стандартными лабораторными кормами, которые обладают относительно высокой калорийностью по сравнению с пищей, добываемой этими животными в условиях естественной среды обитания. Благодаря данной особенности экспериментальная индукция сахарного диабета у указанных видов животных может быть смоделирована только за счет применения высококалорийной диеты. Цель настоящего исследования — проверка данной гипотезы. В качестве экспериментальных животных использовали самцов и самок песчанок двух возрастных категорий (14–20 и 40–41 нед), а также самцов и самок дегу, возраст которых составлял 65–70 нед. В ходе эксперимента оценивали следующие показатели: концентрацию глюкозы, холестерина, триглицеридов, креатинина, мочевины в плазме крови, активность дипептидилпептидазы 4-го типа (ДПП-4) и параметры глюкозотолерантного теста. По совокупности всех экспериментальных данных для самцов и самок дегу, получавших высокоуглеводную диету, установлено состояние близкое к предиабетическому. На это указывает повышение активности фермента ДПП-4 и формирование глюкозотолерантности к 12-й неделе эксперимента. Для большинства экспериментальных животных (песчанок и дегу), вне зависимости от возраста, сформировать экспериментальный сахарный диабет или скрытый сахарный диабет с помощью высококалорийных диет не удалось. Полученные результаты заставляют задуматься о целесообразности использования данных экспериментальных моделей для формирования экспериментального диабета.
Введение
Сахарный диабет признан глобальной социально значимой неинфекционной эпидемией, находящейся под контролем Организации Объединенных Наций (ООН) и национальных систем здравоохранения во всем мире. Сахарный диабет относится к категории заболеваний с неуклонными темпами роста распространенности и представляет собой угрозу за счет ранней инвалидизации и высокой смертности от сосудистых заболеваний. В Российской Федерации (РФ), так же как и в других странах мира, продолжается рост распространенности сахарного диабета — с 2000 г. численность пациентов с сахарным диабетом увеличилась более чем в 2 раза. По последним данным Росстата, количество пациентов сахарным диабетом в РФ на период окончания 2021 г. составило 5 млн 168,8 тыс. человек [1].
Для изучения препаратов, предназначенных для лечения сахарного диабета существует множество моделей формирования экспериментального сахарного диабета у животных. В качестве индукторов патологии используют введение веществ, вызывающих нарушение функций поджелудочной железы (например, стрептозотоцин) и различные варианты диет.
Использование химических индукторов, вызывающих поражение островкового аппарата поджелудочной железы, как правило, приводит к развитию диабета смешанного типа [2, 3].
Использование диет для индукции сахарного диабета у животных является относительно нетрудоемким и дешевым методом. Известно, что песчанки и дегу склонны к проявлению гипергликемии и инсулинорезистентности при кормлении стандартными лабораторными кормами. Это обусловлено относительно высокой калорийностью кормов по сравнению с пищей, добываемой этими животными в условиях естественной среды обитания [4, 5].
Учитывая эту особенность, использование песчанок и дегу считается рациональным для моделирования экспериментального сахарного диабета на фоне высококалорийной диеты. Для песчанок существуют опубликованные данные, описывающие возрастные изменения в метаболизме глюкозы [6, 7]. Сообщается, что помимо развития гипергликемии, у песчанок и дегу на фоне высококалорийной диеты предполагается появление таких явлений, как ожирение, гипертензия и дислипидемия [8–11]. Кроме того, для дегу характерны инсулинорезистентность, связанная с низкой продукцией инсулина (от 1 до 10% в сравнении с другими млекопитающими) и пониженное содержание инсулиновых рецепторов. Как и у человека, у дегу развиваются амилоидоз и гиперплазия островков Лангерганса, что характерно для сахарного диабета 2-го типа и инсулиномы [11, 12].
Цель представленного исследования — воспроизведение модели экспериментального сахарного диабета, вызванного диетой с повышенным содержанием углеводов и жиров, у лабораторных песчанок и дегу.
Задачи исследования.
- Проведение пищевой адаптации экспериментальных животных к высококалорийному рациону.
- Индукция экспериментального сахарного диабета у песчанок и дегу путем введения в их рацион высококалорийной диеты.
- Контроль ключевых клинико-лабораторных показателей животных, характеризующих формирование экспериментального диабета, в период использования двух типов высококалорийной диеты.
- Сравнительная оценка эффективности формирования экспериментального диабета у экспериментальных животных при использовании двух типов высококалорийных диет.
Материал и методы
Для индукции экспериментального сахарного диабета в ходе эксперимента использовали два вида высококалорийных диет: диета с повышенным содержанием углеводов (№ 1) и «диета кафетерия» (№ 2).
Перед началом 12-недельного кормления животные проходили 2-недельный период пищевой адаптации, который включал суточную порцию стандартной диеты с добавлением пищевых продуктов из диет № 1 и 2 в количестве 1/3 от массы продукта в основном эксперименте для соответствующих экспериментальных групп. Для моделирования экспериментального сахарного диабета в эксперименте использовали перечень продуктов, указанный в табл. 1.
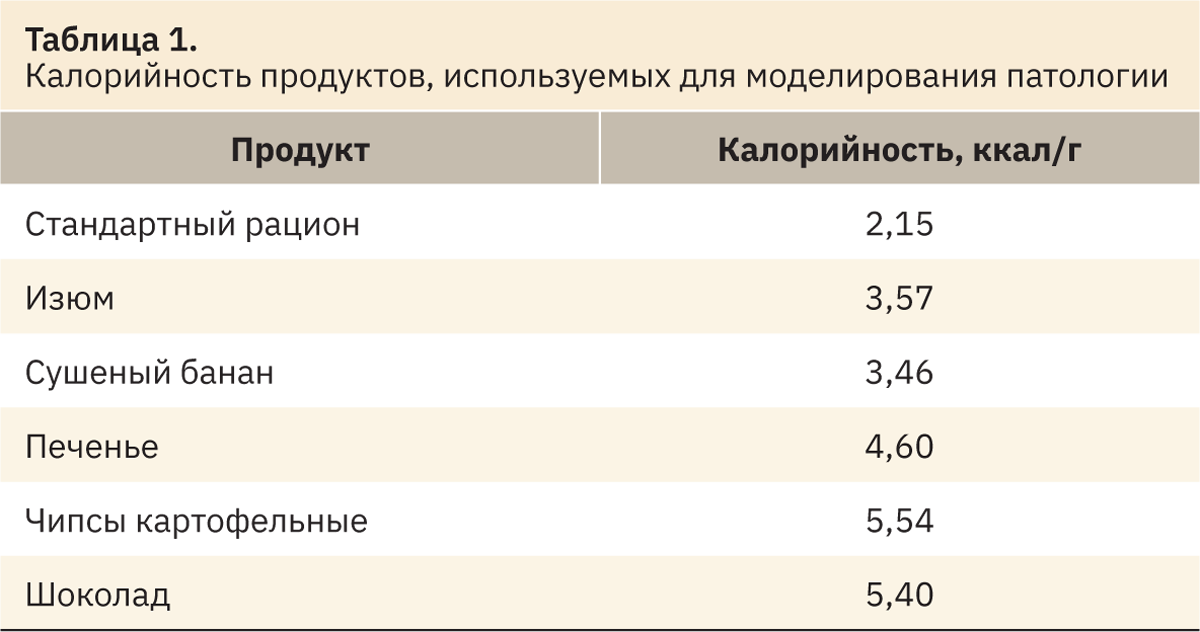
Согласно опубликованным данным [4, 13–15], для формирования сахарного диабета у песчанок и дегу необходимо соблюдать диету с содержанием общих углеводов не менее 50–60%.
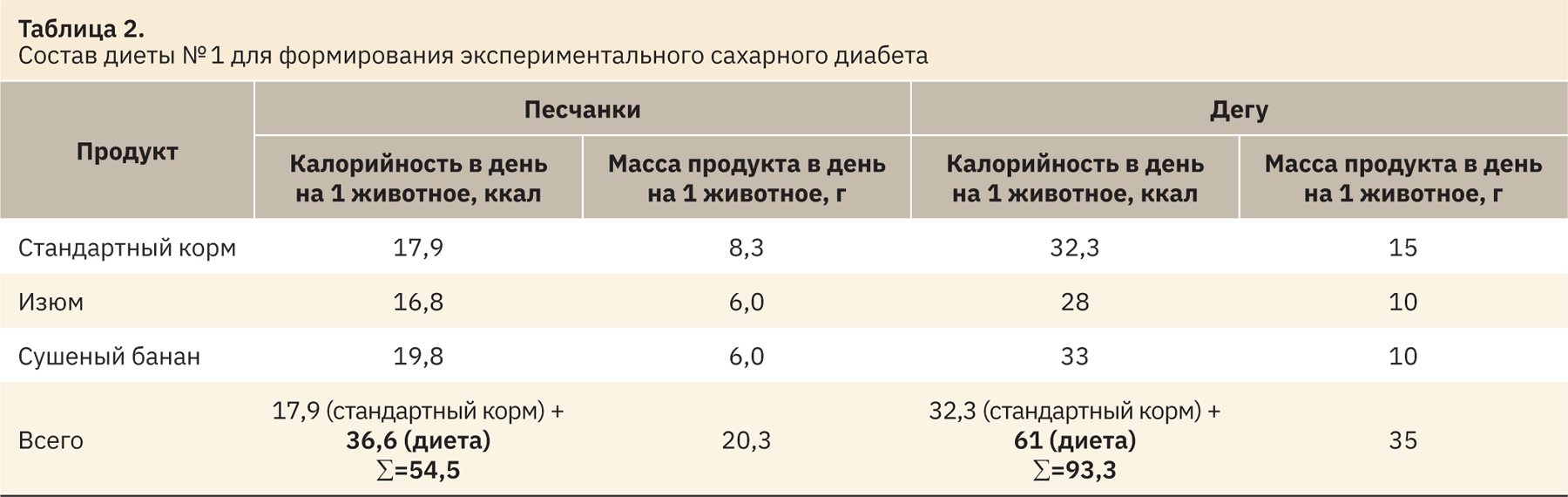
В качестве основных источников углеводов в данном рационе используют изюм [16] и сушеные бананы [17]. Данные продукты составляли 60% дневного рациона. Остальные 40% включали стандартный рацион вивария. Доступ к воде не был ограничен (табл. 2).
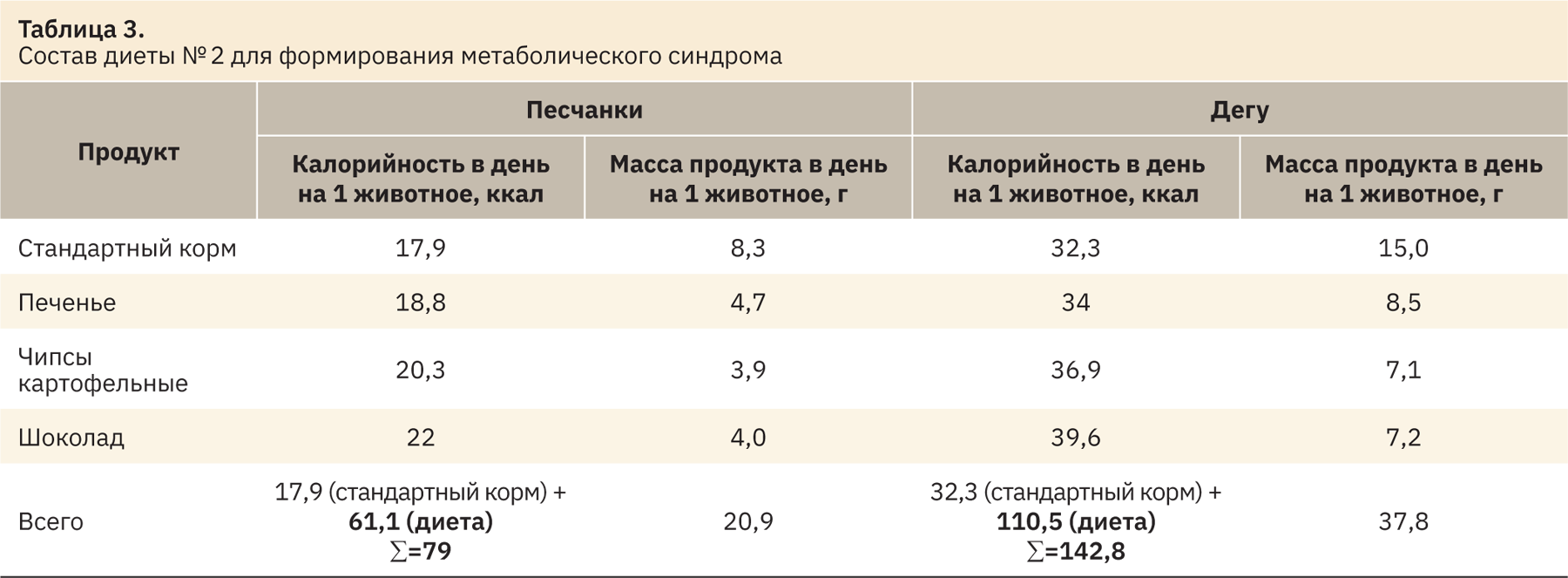
«Диета кафетерия» применяется для формирования у лабораторных животных метаболического синдрома, который включает в том числе формирование гипергликемии и инсулинорезистентности [17]. Вариант состава рациона с повышенным содержанием углеводов и жиров для проявления признаков сахарного диабета представлен в табл. 3.
Дизайн эксперимента
Исследование было одобрено биоэтической комиссией АО «НПО «ДОМ ФАРМАЦИИ».
Всего в исследовании было использовано 102 животных, из них 21 самец и 21 самка дегу, 30 самцов и 30 самок песчанок. Источник получения — питомник АО «НПО «ДОМ ФАРМАЦИИ». Животные содержались в стандартных контролируемых условиях окружающей среды.
Характеристика экспериментальных групп и применяемые манипуляции со сроками выполнения представлены в табл. 4–6.


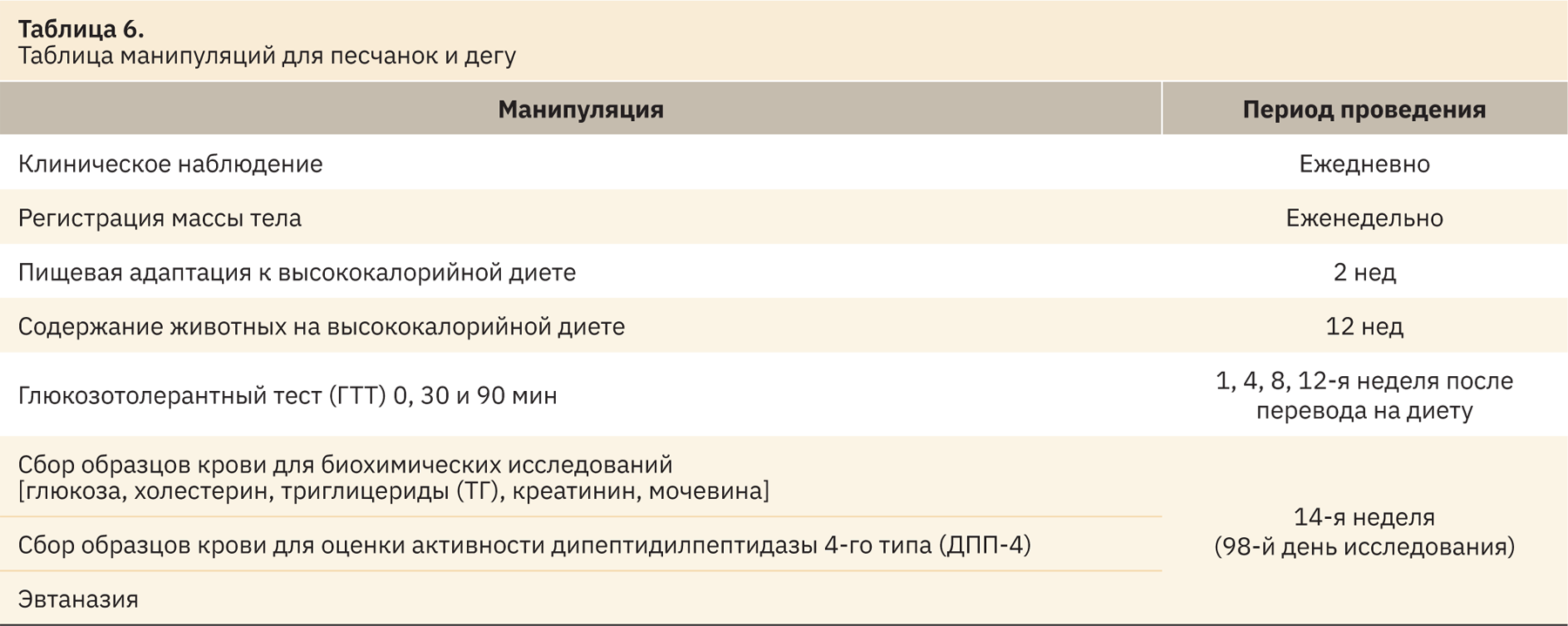
Количество животных в каждой группе и подгруппе было достаточным для того, чтобы оценить характер и частоту проявления регистрируемых эффектов, и позволило подвергнуть полученные результаты статистическому анализу. Вместе с тем число животных было минимальным с точки зрения этических принципов.
В соответствии с Директивой 2010/63/EU1 животных подвергали эвтаназии с помощью СО2 (начальный этап) с последующим обескровливанием полостей сердца (конечный этап). Данный вид эвтаназии животных сопровождается минимумом боли, страдания и дистресса и проводится компетентными сотрудниками.
Биохимическое исследование крови
Отбор крови для биохимического анализа у дегу и песчанок проводили во время эвтаназии на 14-й неделе (98-й день исследования).
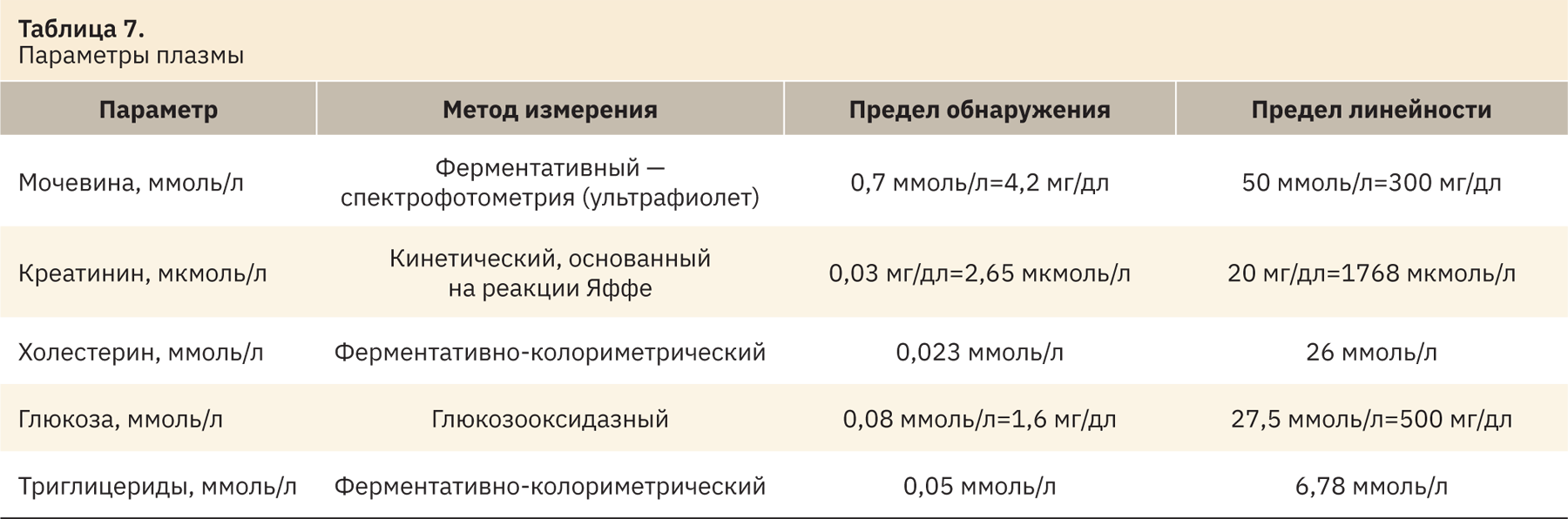
Все исследования биохимических показателей крови осуществляли на биохимическом анализаторе «Random Access А-25» (BioSystems, Испания) с использованием реагентов фирмы BioSystems (Испания) в плазме крови. Для исследования использовали кровь, которую отбирали из полостей сердца в процессе эвтаназии в вакуумные пластиковые пробирки с гепарином натрия. Для получения плазмы кровь центрифугировали [центрифуга Z 216 МК (Hermle Labortechnik GmbH, Германия)] 15 мин при 3000 об/мин. Полученную плазму переносили во вторичные пробирки, которые затем загружали в анализатор. В плазме определяли следующие параметры (табл. 7).
Оценка активности ДПП-4
На 14-й неделе (98-й день исследования) во время эвтаназии у животных отбирали кровь из сердца в пробирки с ЭДТА по 0,2 мл. Анализ проводили в образцах цельной крови.
Оценку активности фермента ДПП-4 проводили с использованием в качестве хромогенного субстрата Gly-L-Pro p-nitroanilide, из которого под действием ДПП-4 образуются дипептид Gly-Pro и p-нитроанилин (р-NA). Концентрацию продукта ферментативной реакции р-NA в реакционной смеси оценивали фотометрическим методом в 96-луночных планшетах с помощью микропланшетного анализатора ClarioStar (BMG Labtech, Германия) при длине волны 405 нм.
Результаты и обсуждение
Применение в течение 12 нед высококалорийных рационов у песчанок в возрасте 14–20 и 40–41 нед и дегу 65–70 нед в качестве индуктора экспериментального сахарного диабета не привело к развитию патологии.
Следует отметить, что адаптация к новому рациону не принесла ожидаемых результатов. Животные не потребляли диабетоиндуцирующий корм в требуемом объеме. В связи с этим было принято решение об удалении из рациона животных стандартного корма. Однако спустя неделю стандартный корм вернули в рацион, поскольку животные полностью отказывались от предлагаемой пищи. Также значительная часть диабетоиндуцирующего корма оставалась в подстиле.
Таким образом, животных не удалось в полной мере перевести на диабетоиндуцирующий рацион.
Эвтаназия всех животных была проведена на 14-й неделе. Изначально планировалось осуществить эвтаназию 3 животных каждого пола из группы на 13-й неделе при отсутствии выраженных проявлений сахарного диабета у животных 2-й и 3-й групп. Оставшиеся животные должны были получать диеты в течение 18 нед. Однако по результатам глюкозотолерантного теста на 1, 4, 8 и 12-й неделе увеличения уровня глюкозы, значимого для регистрации развития экспериментального сахарного диабета, не было обнаружено.
На фоне применения в течение 12 нед высококалорийных рационов у экспериментальных животных не установлено влияние на внешний вид, массу тела и поведение.
Полученные данные параметров биохимического анализа крови (глюкоза, холестерин, ТГ, креатинин, мочевина и ДПП-4) экспериментальных животных свидетельствуют, что высококалорийные рационы, потребляемые животными в течение 12 нед, не привели к развитию экспериментального сахарного диабета.
В данной работе приведены результаты ГТТ, полученные только после 12 нед соблюдения диет как наиболее показательные.
После углеводной нагрузки у экспериментальных животных было показано статистически значимое повышение концентрации глюкозы в крови с последующим снижением через 90 мин до значений концентрации глюкозы контрольной группы (статистически значимых различий в этой точке уже не наблюдали). Данная реакция организма является ожидаемой при проведении ГТТ и говорит об адекватном ответе организма и отсутствии нарушений толерантности к глюкозе. Однако следует отметить, что у самцов песчанок подгрупп 2а, 2b, 3а и у самок подгрупп 2а и 3а через 90 мин после углеводной нагрузки, начиная с 4-й и до 12-й недели, уровень глюкозы был выше верхней границы нормы (7,5 ммоль/л), приведенной в литературе [18], что указывает на снижение толерантности к глюкозе, даже с учетом отсутствия статистически значимых различий.
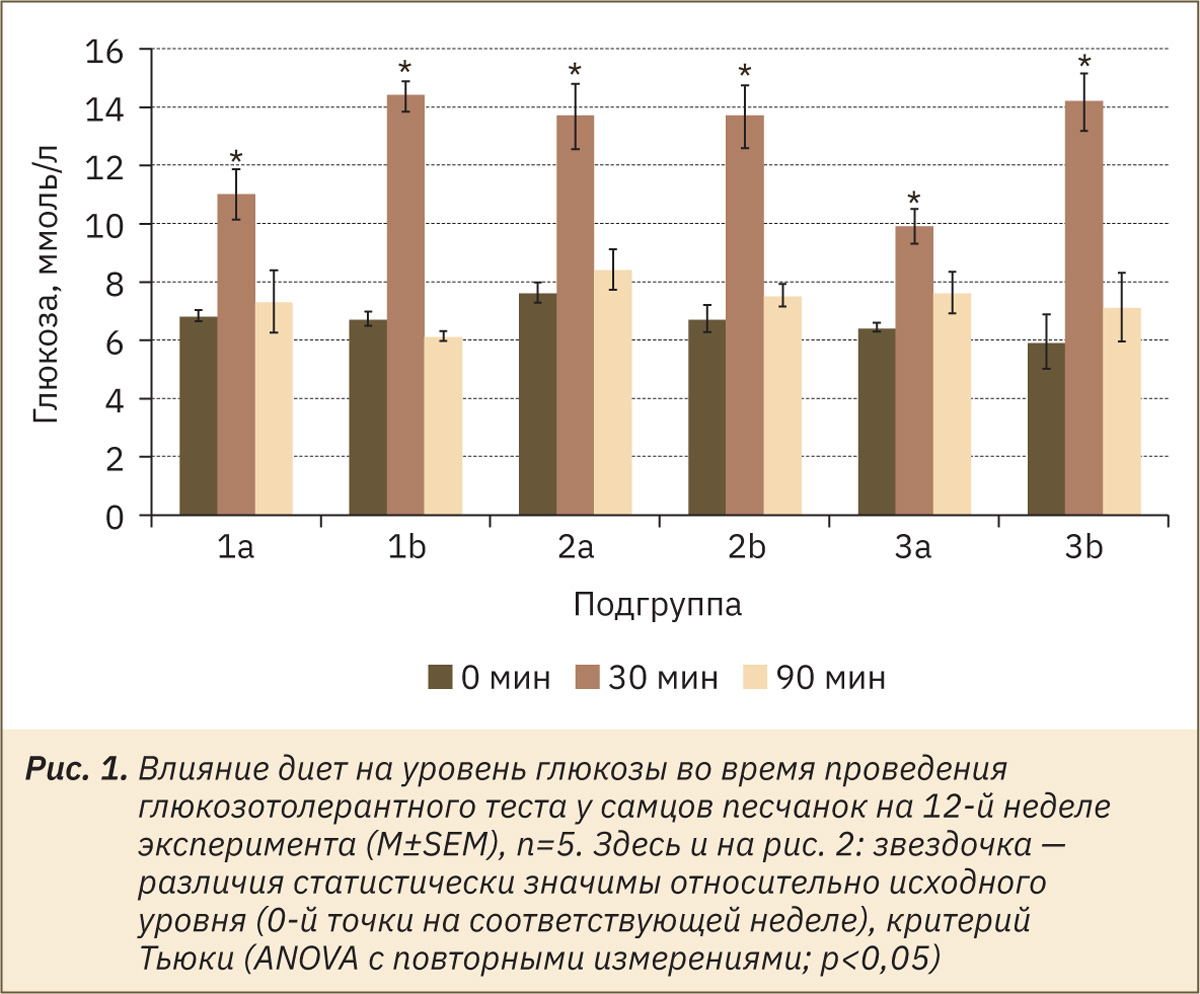
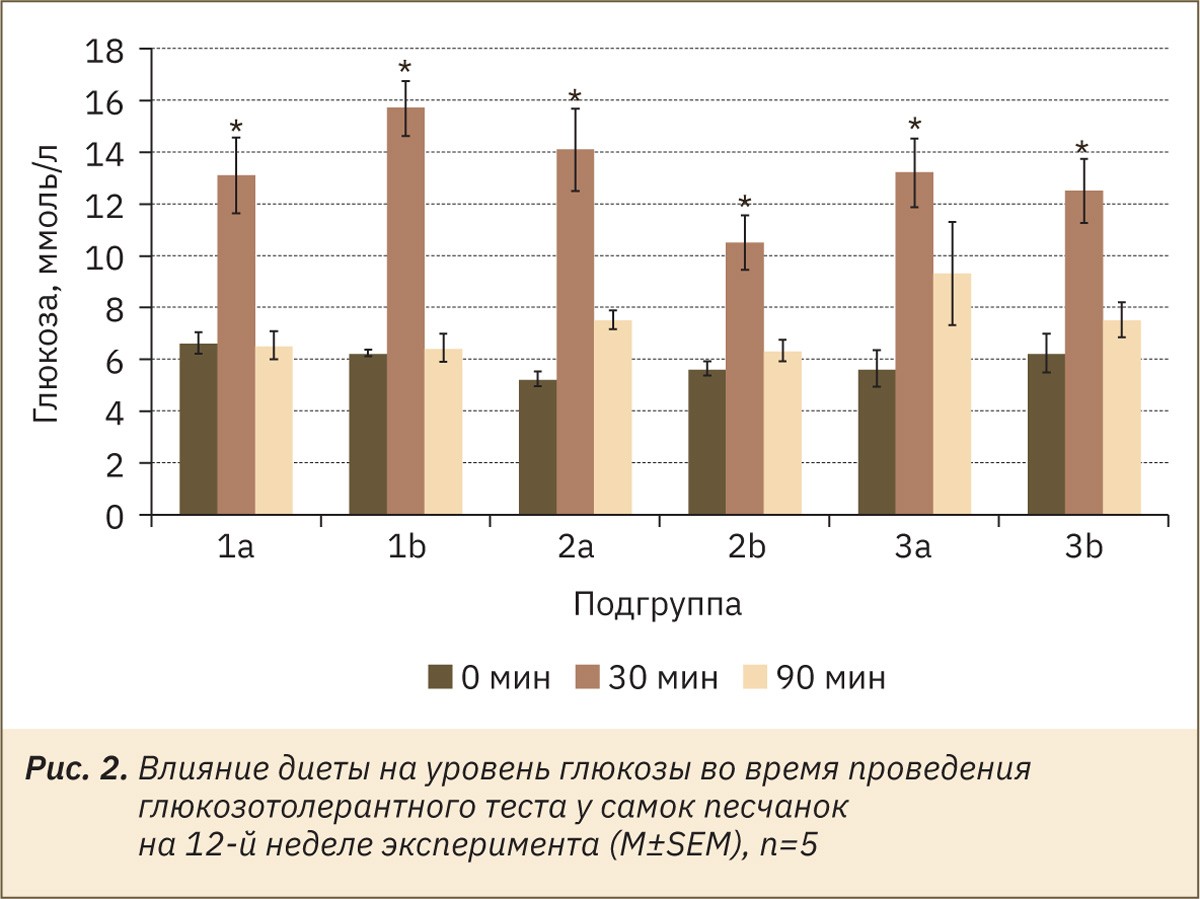
Для песчанок вне зависимости от возраста и пола сформировать экспериментальный сахарный диабет или предиабетическое состояние с помощью высококалорийных диет не удалось (рис. 1, 2).
ДПП-4 представляет собой повсеместно распространенный в организме фермент, который регулирует инкретины и, следовательно, связан с патофизиологией сахарного диабета 2-го типа у человека. В основном ДПП-4 секретируется эндотелиальными клетками и действует как регуляторная протеаза для цитокинов, хемокинов и нейропептидов, участвующих в воспалении, иммунитете и сосудистой функции [19].
В относительно недавних исследованиях были показаны значительно более высокие уровни и активность ДПП-4 у пациентов с диабетом, чем в контроле (здоровые добровольцы), после исключения пациентов, получавших метформин и/или глитазоны [19].
Экспериментальное исследование, приведенное в данной работе, установило снижение активности ДПП-4 у самцов и самок песчанок (табл. 8), и только у самцов дегу, получавших диету № 1, было показано статистически значимое по сравнению с животными, получавшими стандартный рацион, повышение уровня ДПП-4 (табл. 9).


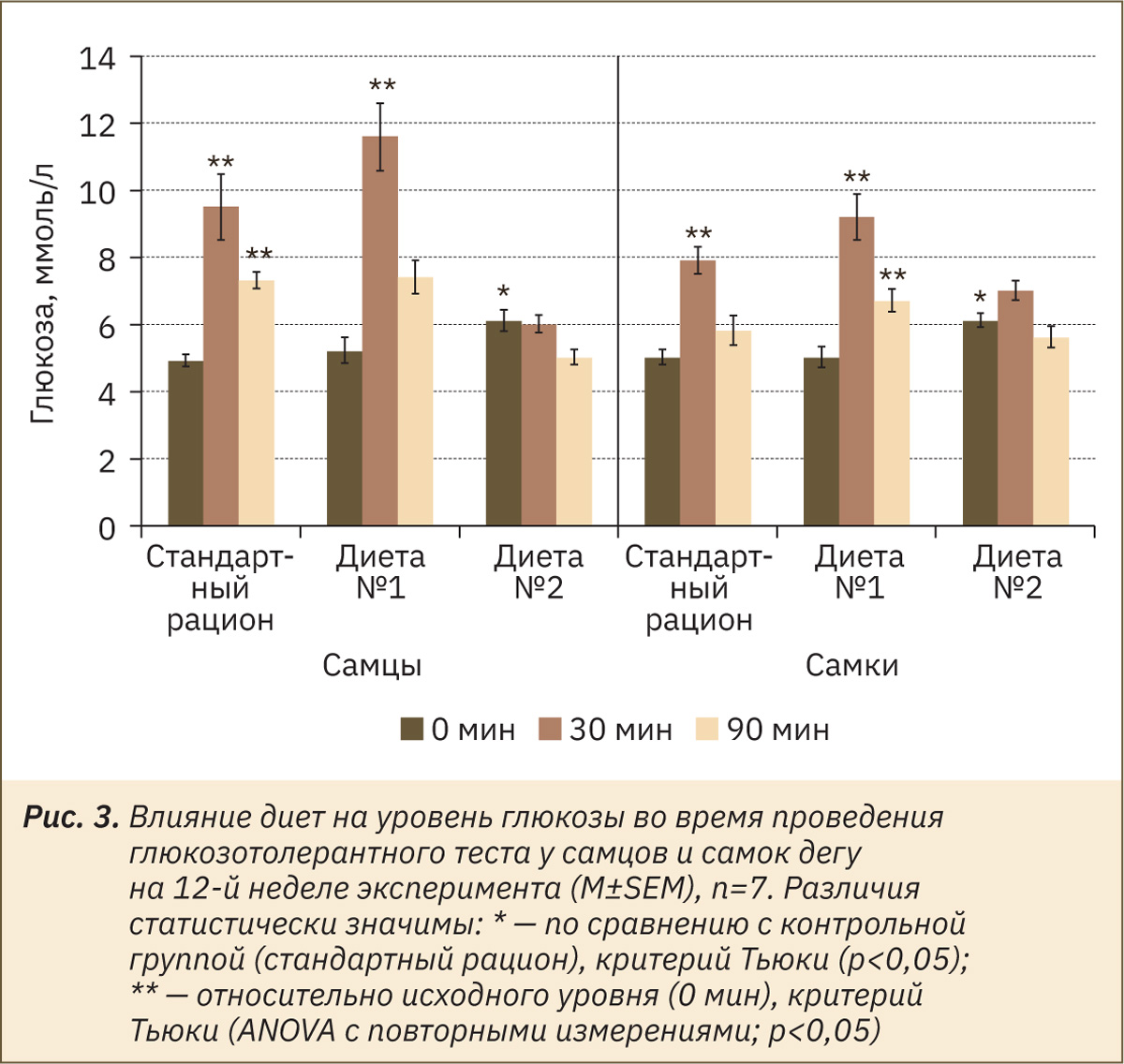
Таким образом, по совокупности всех экспериментальных данных для самцов и самок дегу, получавших высокоуглеводную диету, установлено наиболее близкое состояние к предиабетическому.
На это состояние указывает:
- повышенная активность фермента ДПП-4 у самцов, получавших диету № 1 (см. табл. 9);
- повышение базового уровня глюкозы у самцов и самок дегу, получавших диету № 2 (рис. 3);
- повышение уровня глюкозы на 90-й минуте у самок дегу, получавших диету № 1 (см. рис. 3), при проведении глюкозотолерантного теста.
Проведенное исследование по воспроизведению модели экспериментального сахарного диабета, вызванного диетой с повышенным содержанием углеводов и жиров, у лабораторных песчанок и дегу позволило сделать следующие выводы.
-
По результатам проведения пищевой адаптации экспериментальных животных не удалось в полной мере перевести на диабетоиндуцирующий рацион. Вероятными причинами отсутствия результата могли служить неудачно подобранные продукты. Их органолептические качества не удовлетворяли животных, что привело к отказу от потребления. Схема приучения к новому рациону не подошла данным видам животных. Возможно, имела место совокупность всех перечисленных факторов.
-
По результатам клинического наблюдения, анализа данных массы тела установлено, что высококалорийные рационы не оказали влияния на внешний вид и поведение животных. Ожидаемого прироста массы тела у животных, получавших высококалорийные рационы, не отмечено.
-
По результатам глюкозотолерантного теста можно сделать заключение о формировании состояния близкого к предиабетическому у самок песчанок в возрасте 14–20 нед, получавших «диету кафетерия», и у самцов и самок дегу, получавших оба вида высококалорийных диет.
-
При оценке биохимических параметров крови для песчанок не было выявлено отклонений, соответствующих формированию предиабетического состояния или экспериментального сахарного диабета. Для дегу отмечено увеличение активности фермента ДПП-4, что может косвенно указывать на развитие предиабетического состояния у животных.
Заключение
На сегодняшний день публикация отрицательных результатов исследований является крайне непопулярной. Стоит отметить, что подобные работы могли бы значительно сократить временные затраты ученых на поиски научной литературы, позволили бы меньше использовать лабораторных животных для пилотных исследований и т. д.
Существует множество источников литературы, в которых описаны экспериментальные модели сахарного диабета с использованием различных диет у песчанок и дегу, однако при попытке воспроизвести указанные модели по данным литературы, желаемый результат не был достигнут. В результате исследования не удалось сформировать экспериментальный сахарный диабет у животных по описанным ранее моделям.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
С.В. Ходько — интерпретация результатов исследования; анализ данных научной литературы, редактирование текста рукописи; поиск, обобщение данных литературы; подготовка табличного материала и рисунков.
К.Л. Крышень — идея, концепция и дизайн исследования, планирование исследования, решение вопросов, связанных с достоверностью данных и целостностью всех частей статьи; критический пересмотр текста и одобрение окончательного варианта рукописи для публикации.
Е.А. Гайдай — проведение эксперимента, расчет параметров и анализ полученных данных; проведение статистической обработки и анализ полученных данных.
- Директива 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях.
Список источников
-
Дедов И.И., Шестакова М.В., Викулова О.К. и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. // Сахарный диабет. 2023. Т. 26. № 2. С. 104–123. [Dedov I.I., Shestakova M.V., Vikulova O.K. et al. Sakharnyi diabet v Rossiiskoi Federatsii: dinamika epidemiologicheskikh pokazatelei po dannym Federal’nogo registra sakharnogo diabeta za period 2010–2022 gg. Sakharnyi diabet. 2023. Vol. 26. N. 3. P. 104–123. (In Russ.)]. DOI: 10.14341/DM13035.
-
Okamoto H. Okamoto model for B-cell damage: Recent advances. Lessons from animal diabetes. 1996: 97–111.
-
Etuk E.U. Animal models for studying diabetes mellitus // Agric. Biol. J. N. Am. 2010. Vol. 1. N. 2. P. 130–134.
-
Kaiser N., Cerasi E., Leibowitz G. Diet-induced diabetes in the sand rat (Psammomys obesus) // Animal Models in Diabetes Research. Humana Press, Totowa, NJ. 2012. P. 89–102.
-
Гвазава И.Г., Каримова М.В., Васильев А.В. и др. Сахарный диабет 2 типа: особенности патогенеза и экспериментальные модели на грызунах // Acta Naturae. 2022. Т. 14. № 3. С. 57–68. [Gvazava I.G., Karimova M.V., Vasil’ev A.V. et al. Sakharnyi diabet 2 tipa: osobennosti patogeneza i eksperimental’nye modeli na gryzunakh // Acta Naturae. 2022. Vol. 14. N. 3. Р. 57–68. (In Russ.)]. DOI: 10.32607/actanaturae.11751.
-
Shafrir E., Ziv E., Kalman R. Nutritionally induced diabetes in desert rodents as models of type 2 diabetes: Acomys cahirinus (spiny mice) and Psammomys obesus (desert gerbil) // ILAR journal. 2006. Vol. 47. N. 3. Р. 212–224.
-
Colby L.A. et al. Degu // The laboratory rabbit, guinea pig, hamster, and other rodents. Academic Press, 2012. Р. 1031–1053.
-
Walder K., Oakes N., Fahey R.P. et al. Profile of dyslipidemia in Psammomys obesus, an animal model of the metabolic syndrome // Endocr. Regul. 2002. Vol. 36. Р. 1–8.
-
Wong S.K. et al. Animal models of metabolic syndrome: a review // Nutrition & metabolism. 2016. Vol. 13. N. 1. Р. 65.
-
Saïdi T., Mbarek S., Omri S. et al. The sand rat, Psammomys obesus, develops type 2 diabetic retinopathy similar to humans // Investigative ophthalmology & visual science. 2011. Vol. 52. N. 12. Р. 8993–9004.
-
Rivera D.S., Lindsay C.B., Codocedo J.F. et al. Long-term, fructose-induced metabolic syndrome-like condition is associated with higher metabolism, reduced synaptic plasticity and cognitive impairment in Octodon degus // Molecular neurobiology. 2018. Vol. 55. N. 12. Р. 9169–9187. DOI: 10.1007/s12035-018-0969-0.
-
Ardiles A. Octodon degus (Molina 1782): A model in comparative biology and biomedicine // Cold Spring Harb. Protoc. 2013. Vol. 4. Р. 312–318. DOI: 10.1101/pdb.emo071357.
-
Inducing diets. Diabetes diet. URL: https://altromin.com/products/specialdiets/inducingdiets/C1064 (дата обращения: 04.2023).
-
Gouaref I., Detaille D., Wiernsperger N. et al. The desert gerbil Psammomys obesus as a model for metformin-sensitive nutritional type 2 diabetes to protect hepatocellular metabolic damage: Impact of mitochondrial redox state // PloS one. 2017. Vol. 12. N. 2. Р. 1–17. DOI: 10.1371/journal.pone.0172053.
-
Morris J.L., Bridson T.L., Alim M.A. et al. Development of a diet-induced murine model of diabetes featuring cardinal metabolic and pathophysiological abnormalities of type 2 diabetes // Biology open. 2016. Vol. 5. N. 8. Р. 1149–1162. DOI: 10.1242/bio.016790.
-
FoodData Central. RAISINS. URL: https://fdc.nal.usda.gov/fdc-app.html#/food-details/441340/nutrients (дата обращения: 04.2023).
-
FoodData Central. Bananas, dehydrated, or banana powder. URL: https://fdc.nal.usda.gov/fdc-app.html#/food-details/173945/nutrients (дата обращения 04.2023).
-
Декоративные грызуны и зайцеобразные: учебное пособие / Н.Б. Никулина; Министерство сельского хозяйства Российской Федерации, федеральное государственное бюджетное образовательное учреждение высшего образования «Пермский государственный аграрно-технологический университет имени академика Д.Н. Прянишникова». Пермь: ИПЦ «Прокростъ», 2019. 118 с. [Dekorativnye gryzuny i zaitseobraznye: uchebnoe posobie / N.B. Nikulina; Ministerstvo sel’skogo khozyaistva Rossiiskoi Federatsii, federal’noe gosudarstvennoe byudzhetnoe obrazovatel’noe uchrezhdenie vysshego obrazovaniya “Permskii gosudarstvennyi agrarno-tekhnologicheskii universitet imeni akademika D.N. Pryanishnikova”. Perm’: IPTs “Prokrost”, 2019. 118 p. (In Russ.)].
- Silva Júnior W.S., Godoy-Matos A.F., Kraemer-Aguiar L.G. Dipeptidyl Peptidase 4: A New Link between Diabetes Mellitus and Atherosclerosis? // Biomed. Res. Int. 2015. Р. 816164. DOI: 10.1155/2015/816164.




