Использование кроликов в доклинических исследованиях
Работа выполнена без спонсорской поддержки.
Макарова М.Н., Макаров В.Г. Использование кроликов в доклинических исследованиях. Лабораторные животные для научных исследований. 2023; 3. https://doi.org/10.57034/2618723X-2023-03-02
Резюме
Кролики являются одним из наиболее часто используемых видов лабораторных животных в медико-биологических исследованиях. На кроликах разработано большое количество моделей различных заболеваний человека. Эти животные широко используются для оценки безопасности субстанций и лекарственных препаратов. Появление генетически модифицированных кроликов расширило возможности их использования для моделирования различных патологических состояний. Преимущества использования кроликов в биомедицинских исследованиях заключаются в их относительно небольших размерах и простоте содержания. На кроликах можно проводить практически любые экспериментальные манипуляции (любые доступные способы введения тестируемых соединений, проведение различных аппаратных исследований, возможен многократный сбор образцов крови и др.). В исследованиях репродуктивной токсичности важными преимуществами кролика относительно более крупных животных являются короткий период беременности, хорошая репродуктивная способность. Кролики чувствительны к тератогенам человека и являются предпочтительным видом негрызунов для исследований, в которых оценивается потенциальное неблагоприятное влияние на эмбриофетальное развитие. Они используются в иммунологии для продуцирования диагностических антител. Важным моментом является и то, что в научной литературе имеется достаточное количество собранных исторических и справочных материалов по анатомии, физиологии, патофизиологии этих животных. Среди недостатков кроликов как лабораторных животных можно выделить часто развивающиеся нарушения функции желудочно-кишечного тракта. Функциональная активность пищеварительной системы кролика сильно зависит от характера питания. Любые изменения в рационе следует вводить постепенно. Для кроликов должны быть созданы условия, позволяющие им ежедневно активно двигаться. При неправильной технике проведения манипуляций животному легко причинить вред. Поскольку у лабораторных кроликов могут спонтанно развиваться некоторые патологические проявления, это может потребовать либо применения медикаментозной терапии, либо исключения животного из эксперимента. Поэтому в случае планирования длительных исследований на кроликах целесообразно включение не менее 8 самцов и 8 самок в каждую группу. Если предусмотрены группы отсроченного наблюдения, то количество животных также должно быть достаточным для оценки возможных отсроченных эффектов. При планировании и проведении экспериментов необходимо предпринимать все усилия для реализации принципов 3Rs. Сокращения количества кроликов в токсикологических исследованиях можно также добиться, используя комбинированные дизайны, в которых в рамках исследования токсических свойств оцениваются параметры фармакологической безопасности, иммунотоксичности, репродуктивной токсичности, фармако- и токсикокинетики. Необходимо планировать исследования с учетом имеющихся научных данных о тестируемом соединении или о соединениях-аналогах, на основании которых может быть принято обоснованное решение о сокращении количества животных в эксперименте без ущерба для прогнозирования безопасности для человека.
Введение
Кролик домашний, Oryctolagus cuniculus, относится к отряду зайцеобразных и семейству зайцевых (которое также включает зайцев), происходит от диких кроликов Западной Европы и Северо-Западной Африки. Кролик — одно из самых хорошо адаптированных млекопитающих в мире: он одновременно плодовит и легко приспосабливается к различным условиям окружающей среды, благодаря чему обитает на всех континентах. Одомашнивание кролика в европейских странах, вероятно, началось в монастырях в XVI веке. К середине XVII века кролиководство уже активно развивалось в Англии и континентальной Европе [1]. Первые упоминания о разведении кроликов в Древней Руси относятся к началу ХI века. В то время в женских монастырях разводили в основном длинноволосых кроликов — «песцовых» или «щипанцев» с целью получения ценного пуха [2].
В процессе одомашнивания и селекции в строении тела и биологических особенностях кроликов произошли заметные изменения. В отличие от дикой, самка домашнего кролика может давать 8 и даже 10 окролов в год, то есть в процессе одомашнивания удалось удлинить сезон размножения этих животных, создавая им улучшенные условия. Существенно различаются дикие и домашние кролики по живой массе (в 3–5 раз и более) и телосложению [2].
В настоящее время в мире насчитывается около 70 пород и породных групп кроликов. Породы кроликов классифицируются по массе на мелкие (массой до 2–2,5 кг), средние (от 3 до 5,5 кг) и крупные (масса взрослых животных более 6 кг); по характеру получаемой продукции на шкурковые, мясошкурковые, мясные и пуховые; по длине волосяного покрова на коротковолосые (порода Рекс), нормальноволосые, длинноволосые (пуховые) [2].
Самые ранние свидетельства о проведении научных исследований на кроликах относятся к 1683 г. (работы А. Левенгука). С тех пор кролики широко используются в научных исследованиях. Кролики-альбиносы породы новозеландский белый наиболее часто применяются для биомедицинских исследований за рубежом [1]. Порода выведена в США в 1910 г. путем отбора альбиносов среди кроликов породы новозеландская красная. На заключительной стадии консолидации породы для укрепления конституции и увеличения живой массы прибегали к вводному скрещиванию с кроликами породы Фландр, завезена на территорию бывшего СССР в 1971 г. Средняя масса взрослого кролика породы новозеландский белый составляет 5 кг. Крольчата при рождении весят 45–50 г, но, имея высокую скорость развития, уже к 8–10‑й неделе достигают массы 2–2,5 кг, а к 12‑й — 2,5–3 кг. Крольчихи крайне плодовиты, за один окрол приносят до 9 крольчат. Новозеландские белые кролики с самого начала выводились как сугубо практичная порода. Они имеют отличные биологические показатели, такие как скороспелость, низкая затратность кормов на единицу массы тела, высокая плодовитость, неприхотливость, а также, что играет немаловажную роль, — это спокойный нрав животного [2].
В кролиководческих хозяйствах распространена еще одна порода крупных кроликов-альбиносов — белый великан. Порода создана в Бельгии и Северной Германии в XIX веке путем длительного отбора и однородного подбора особей белой окраски (альбиносов), появляющихся среди животных породы Фландр. На территорию бывшего СССР животные этой породы завезены в 1927–1929 гг. из Германии. Однако большинство завезенных животных вследствие низкой приспособленности к новым условиям погибли. В процессе дальнейшего разведения кроликов этой породы скрещивали с породами шиншилла и серый великан с последующим отбором альбиносов крепкой конституции, лишенных экстерьерных недостатков. Кролики породы белый великан отличаются большой массой, в среднем 5,1 кг, с колебаниями от 4,3 до 8,3 кг. Крольчата при рождении весят около 90 г, быстро растут: в 2‑х месячном возрасте масса составляет 1,5–1,7 кг, в 3‑х месячном — 2–2,2 кг. Плодовитость высокая, в помете в среднем 8 крольчат [2].
В Российской Федерации (РФ) одной из традиционно используемых пород в биомедицинских исследованиях является советская шиншилла. Порода создана путем воспроизводительного скрещивания мелких кроликов породы шиншилла с белым великаном и целенаправленного отбора с целью увеличения массы, повышения скороспелости, сохранения отличного качества шиншилловой шкурки и хорошей приспособленности к различным климатическим и кормовым условиям. Эта порода создана в Советском Союзе, утверждена в 1963 г. Средняя масса взрослых животных 5 кг. Плодовитость самок до 9 крольчат. Кролики породы советская шиншилла неприхотливы, выносливы, хорошо приспособлены к разведению в различных климатических условиях, широко применяются как лабораторные животные в биологии, медицине и ветеринарии [2].
Также в РФ в биомедицинских исследованиях используют кроликов породы калифорнийская — порода средних по величине нормальноволосых кроликов чисто-белой окраски, за исключением черных или темно-коричневых ушей, кончика носа, лап и хвоста. Порода выведена в США путем сложного воспроизводительного скрещивания пород шиншилла, новозеландская белая и русский горностаевый. Кролики породы калифорнийская на территорию бывшего СССР завезены в 1971 г. из Англии и Венгрии. Взрослые кролики весят в среднем 4,5 кг, при рождении масса крольчат составляет 45 г, быстро растут и в возрасте 2 мес достигают массы 1,8 кг [2].
Широкое использование кроликов в биомедицинских исследованиях обусловлено относительной простотой и низкой стоимостью их содержания по сравнению с такими лабораторными животными, как кошки, собаки и обезьяны. Кроликов можно использовать для широкого спектра экспериментальных процедур. Трудно найти область биомедицинских исследований, в которой бы не проводились эксперименты на кроликах. В иммунологии кроликов широко используют для продуцирования антител, в том числе и потому, что кровь относительно легко брать из их больших и доступных ушных вен. Благодаря размерам и некоторому сходству в строении глаза кролика и человека на кроликах можно моделировать различные патологические состояния и изучать эффективность офтальмологических препаратов. Кролики используются в токсикологии, в том числе для оценки эмбриотоксичности и тератогенного потенциала лекарств. Традиционно кролики являются моделью для изучения токсичности накожных лекарственных форм. На кроликах проводят исследования имплантатов и других медицинских изделий.
Доклинические исследования in vivo
Доклинические исследования имеют целью установление эффективности и безопасности лекарственных препаратов.
Программа доклинической оценки должна включать следующие аспекты1, 2.
-
Изучение фармакологических свойств лекарственного препарата:
а) основные фармакодинамические эффекты (первичная фармакодинамика);
б) фармакологические эффекты, не связанные с заявленным показанием к применению (вторичная фармакодинамика);
в) фармакологическая безопасность;
г) фармакодинамическое взаимодействие. -
Изучение фармакокинетических свойств.
-
Изучение токсических свойств:
а) токсичность при однократном введении;
б) токсичность при многократном введении и токсикокинетика;
в) генотоксичность;
г) канцерогенность;
д) репродуктивная и онтогенетическая токсичность;
е) местная переносимость;
ж) при необходимости другие токсикологические исследования (антигенность, иммунотоксичность, лекарственная зависимость).
Ряд исследований, согласно регламентирующим документам, должен быть проведен с использованием лабораторных животных. Более того, для некоторых исследований необходимым условием является использование двух видов животных, одним из которых должен быть вид, не относящийся к грызунам. В доклинических программах разработки многих лекарственных препаратов в качестве второго вида животных для оценки безопасности могут быть использованы кролики. Кроме того, кролики используются для изучения фармакокинетики лекарственных средств, а также некоторых параметров фармакологической безопасности.
Фармакодинамика
На кроликах разработано множество экспериментальных моделей. Ряд преимуществ по сравнению с грызунами, в первую очередь это более крупные размеры, привели к широкому применению этих животных в области изучения физиологии сердечно-сосудистой, опорно-двигательной и пищеварительной систем. Кролики остаются одной из наиболее часто применяемых моделей в офтальмологии.
Кролики используются для проведения некоторых обязательных тестов по безопасности и специфической активности, в частности, для оценки раздражающего действия веществ. Глаза человека и кожа часто случайно или преднамеренно подвергаются воздействию химических веществ. Следовательно, химические вещества должны пройти оценку раздражающего действия на глаза и кожу перед выпуском на рынок. В 1944 г. на кроликах был разработан тест Драйза, который и по сей день применяется для оценки раздражающего действия субстанций. Методики тестирования описаны в протоколах OECD 4043 и OECD 4054. Следует отметить, что в последние годы эти методики тестирования вызывают озабоченность в отношении благополучия животных. Чтобы заменить эти методы, были разработаны различные альтернативы тестирования in vitro [3].
Согласно Государственной фармакопее, инъекционные растворы и субстанции должны пройти испытание на пирогенность. Для этого также используют кроликов. Тестирование основано на измерении температуры тела кроликов до и после инъекции5.
Для оценки биологической активности инсулинов необходимо проведение тестирования на кроликах. Биологические испытания основаны на способности человеческого инсулина и его аналогов снижать уровень глюкозы в крови животных и включают определение биологической активности инсулина и его аналогов, биоидентичности, а также пролонгированного действия. Для оценки первых двух показателей используют кроликов и мышей, а для определения пролонгированности действия — только кроликов6.
Большой вклад в понимание механизмов развития патологических состояний и разработку средств терапии заболеваний сердечно-сосудистой системы внесли исследования на моделях гиперлипидемии у кроликов. Для индукции патологического состояния может быть использована специальная диета с холестерином. Кроме того, была выведена линия кроликов с гиперлипидемией. Эти исследования способствовали разработке гиполипидемических лекарственных препаратов статинов. Фактически история открытий, связанных с разработкой статинов Акирой Эндо, начинается с сообщения российского ученого Николая Николаевича Аничкова в 1913 г. о том, что у кроликов, получавших повышенные количества холестерина с пищей, развились гиперхолестеринемия и тяжелый атеросклероз аорты. Это была первая экспериментальная модель атеросклероза. Однако в то время работы ученого не получили должного внимания. Серьезные исследования роли холестерина в развитии атеросклероза у человека не проводились до 1940‑х годов из‑за преобладающего мнения, что болезнь является простым следствием старения и не может быть предотвращена [4, 5]. Нобелевская премия по физиологии и медицине 1985 г. была присуждена Майклу С. Брауну и Джозефу Л. Гольдштейну за их открытия, касающиеся регуляции метаболизма холестерина [4]. В 1973 г. японский ученый Акира Эндо обнаружил ингибитор холестерогенеза у культуры Penicillium citrinium. Ловастатин, первый из семейства статинов, был одобрен FDA в 1986 г. Статины в настоящее время являются одними из наиболее часто назначаемых терапевтических средств для лечения дислипидемии [4].
Кролики и сегодня широко применяются для изучения патофизиологии атеросклероза. Недавно были выведены кролики с нокаутом белка-переносчика эфиров холестерина (cholesteryl ester transfer protein, CETP) для изучения роли этого белка в предрасположенности к атеросклерозу. По сравнению с диким типом у кроликов-нокаутов, получавших диету с высоким содержанием холестерина в течение 18 недель, наблюдались пониженный уровень холестерина в плазме и снижение выраженности атеросклероза артерий [6]. В клинических исследованиях ингибитора CETP (анацетрапибама) получены обнадеживающие результаты, указывающие на перспективность данного терапевтического подхода [7].
Кролики используются в исследованиях по изучению патофизиологии и терапии легочных заболеваний и по оценке терапевтической эффективности лекарственных средств. Ни одна модель на животных не может воспроизвести все черты как острых, так и хронических заболеваний легких человека. Однако кролик является одной из наиболее подходящих моделей, поскольку есть определенное сходство между кроликами и людьми с точки зрения анатомии дыхательных путей и реакции на медиаторы воспаления. Воспалительные реакции, которые воспроизводятся на кроликах, особенно при астме, сравнимы с таковыми у людей. Кроме того, у кролика легкие являются органом-мишенью для анафилактической реакции, что также сходно с клинической ситуацией [8].
Кролики имеют больше общих анатомических и биохимических офтальмологических характеристик с людьми, чем грызуны. Размер глаза кролика также делает этих животных удобной моделью для исследований в офтальмологии [9]. Кролики используются для изучения различных заболеваний человека, включая синдром «сухого глаза», глаукому, возрастную дегенерацию желтого пятна, индуцированную светом ретинопатию, катаракту и увеит [10].
На кроликах разработан метод индукции пролиферации эндотелиальных клеток роговицы, который может быть использован для лечения эндотелиальной дистрофии роговицы Фукса. В этом состоянии у пациентов развивается потеря зрения, которую в настоящее время лечат хирургическим путем, заменяя эндотелий роговицы донорским эндотелием. По результатам экспериментальных работ [11, 12], в клиническом исследовании успешно использовали культивированные эндотелиальные клетки роговицы в сочетании с ингибитором протеинкиназы.
Европейский кролик также является хорошей моделью для понимания совместной эволюции позвоночных и вирусных патогенов. За последние 60 лет популяции диких и домашних кроликов резко сократились из‑за появления двух вирусных заболеваний, а именно миксоматоза в 1950‑х годах и геморрагической болезни кроликов в 1980‑х годах. Изменение не только генетической устойчивости естественной популяции кроликов к миксоматозу, но и степени вирулентности возбудителя является одним из лучших примеров коэволюции вируса и хозяина. Геморрагическая болезнь кроликов, также вызываемая вирусом, стала причиной резкого сокращения естественной популяции кроликов в конце 1980‑х годов. Хотя популяции впоследствии восстановились, появление в 2010 г. нового варианта этой болезни, генетически и антигенно сильно отличающегося от ранее описанных штаммов, привело к увеличению смертности. Новый вариант заболевания обладает очень высокой летальностью и имеет повышенный уровень рекомбинации, что дает возможность понять, как животное-хозяин и вирус будут взаимно эволюционировать [13].
Кролик является одной из лучших моделей для изучения инфекционных заболеваний. К ним относятся бактериальные (сифилис и туберкулез) и вирусные инфекции (ВИЧ, папилломавирус, вирус простого герпеса, вирусы оспы, норовирусы) [14].
Разработаны модели на кроликах для изучения ряда вирусных инфекций. Вирус папилломы человека — инфекция, которая может привести к раку эпителия слизистой оболочки. Папилломавирусы специфичны для человека, так что не могут быть непосредственно изучены в доклинических моделях на лабораторных животных. Разработаны две модели папилломавируса кролика, которые широко используются для изучения различных аспектов биологии папилломавируса, а также для тестирования вакцин и противовирусного лечения. Вирусы кролика включают вирус CRPV (Cottontail rabbit papillomavirus) [15], поражающий кожу, места поражения спонтанно трансформируются в рак; и вирус ROPV (rabbit oral papillomavirus), поражающий слизистые и вызывающий инфекции полости рта [13].
Модели на мелких лабораторных животных вируса иммунодефицита человека также не могут быть разработаны по причине того, что вирус воздействует только на клетки человека. В течение двух 10‑летий изучались молекулярные механизмы, препятствующие проникновению вируса в клетки животных. Выявление некоторых их них привело к созданию генетически модифицированных животных, грызунов и кроликов, которые в сочетании с небольшими модификациями вируса могут быть использованы для изучения патогенеза и потенциальной терапии. При этом именно кролики рассматриваются как привлекательный вид-кандидат для создания модели инфекции вируса иммунодефицита человека, обладающей высокой трансляционной ценностью [13].
Кролики используются как модельные животные для изучения бактериальных инфекций. Так, с момента идентификации возбудителя сифилиса, Treponema pallidum, моделью для изучения этой инфекции был выбран кролик. Кролики легко инфицируются T. pallidum, что, возможно, связано с их восприимчивостью в природе к очень близкой родственной бактерии Treponema paraluiscuniculi, которая передается половым путем. Клиническое, гистологическое и иммунологическое сходство между сифилисом у кроликов и людей поразительно. Внутрикожная инокуляция кроликам T. pallidum приводит к развитию поражений, которые сильно напоминают первичные шанкры у человека как клинически, так и гистологически. Как и у людей, первичные шанкры у кроликов рассасываются спонтанно с последующим возникновением диссеминированной вторичной сыпи и ранней инвазией в центральную нервную систему. У кроликов формируется иммунный ответ, аналогичный тому, который развивается у людей во время естественной инфекции [13]. Как и у людей, после длительной инфекции у кроликов вырабатывается иммунитет к повторному заражению. Поскольку T. pallidum нельзя культивировать, кролики также имеют решающее значение для выделения новых штаммов T. pallidum из клинических образцов. Хотя некоторые другие виды животных могут быть инфицированы T. pallidum (нечеловекообразные приматы, хомяки, морские свинки и мыши), только у кроликов и приматов развивается клиническая картина заболевания, сходная с таковой у людей [13, 16].
С конца XIX века (со времен идентификации Робертом Кохом возбудителя туберкулеза человека — бактерии Mycobacterium tuberculosis) кролики используются в экспериментах по изучению туберкулеза. Новозеландские белые кролики стали наиболее часто используемой породой для исследований туберкулеза. Основным преимуществом моделей туберкулеза на кроликах по сравнению с моделями на мышах является то, что у кроликов из воспалительных, содержащих лейкоциты очагов формируются организованные гранулемы. Эти поражения могут некротизироваться, что является патологическим признаком туберкулеза, а также может развиваться фиброз. Модель на кроликах имеет большое гистопатологическое сходство с болезнью человека. На кроликах оценивается эффективность не только иммуномодулирующей терапии, но и вакцин [13].
Огромным прогрессом в разработке экспериментальных моделей заболеваний человека стало появление технологий, которые сделали возможным создание генетически модифицированных кроликов. Трансгенные кролики со сверхэкспрессией различных генов были получены в начале 90‑х годов прошлого века и стали альтернативным инструментом для исследования функций генов при различных заболеваниях. Более того, недавно разработанная технология редактирования генома предоставила огромные возможности для создания нокаутных кроликов (KO, knock-out) и кроликов с включением/изменением гена (KI, knock-in) [17].
Долгое время не удавалось получить нокаутных кроликов по причине того, что геном кролика был плохо изучен в основном из‑за нехватки средств и небольшого числа лабораторий, занимающихся этим вопросом. Только к 2016 г. был секвенирован геном кроликов: японских белых, новозеландских белых и кроликов линии WHHL [17–19].
Первые КО-кролики были получены в 2011 г., это были кролики с нокаутом гена иммуноглобулина, выведенные с целью дальнейшего продуцирования гуманизированных антител [20]. Почти в то же время китайские ученые создали кроликов, нокаутных по гену аполипопротеина CIII (АpoCIII) с помощью технологии редактирования генома. Высокие уровни АpoCIII в плазме увеличивают риск ишемической болезни сердца. Благодаря получению кроликов, нокаутных по гену АpoCIII, было показано, что генетическая делеция гена АpoCIII значительно ускоряет катаболизм богатых триглицеридами липопротеинов в печени, а дефицит АpoCIII приводит к устойчивости кроликов с нокаутом к гиперлипидемии, индуцированной холестериновой диетой, и ингибирует атеросклероз. Эти результаты показывают, что терапевтическое ингибирование экспрессии АпоСIII может стать новой стратегией лечения гиперлипидемии и атеросклероза [21].
Кролики с генетическими модификациями также используются для исследования заболеваний сердца человека, включая синдром удлиненного интервала QT, гипертрофическую кардиомиопатию и кардиомиопатию, индуцированную тахикардией [22].
Для изучения потенциально вызывающего слепоту рецидивирующего герпесного стромального кератита разработана модель HLA-трансгенных кроликов. Данный вирус у латентно инфицированных людей может спонтанно реактивироваться из инфицированных сенсорных нейронов и выделений вируса в слезной пленке. Однако в отличие от латентно инфицированных людей, у инфицированных мышей спонтанная реактивация и выделение вируса через слезы происходят на очень низком уровне или вообще отсутствуют. Несмотря на этот факт, в большинстве доклинических исследований использовалась модель первичной острой инфекции на мышах. Разработанная альтернативная модель HLA-трансгенных кроликов позволяет избежать этих недостатков, так как у них реактивация и выделение вируса в слезной пленке происходят спонтанно. Иммунологически на кроликах воспроизводится картина заболевания человека, что позволяет проводить доклинические исследования иммунотерапевтических лекарственных средств [13, 23].
С появлением технологии редактирования генома CRISPR-Cas9 и ее применением для получения нокаутированных кроликов в 2014 г. получены десятки KO- и KI-типов кроликов для воспроизведения генетических патологий человека. Можно прогнозировать, что в ближайшие несколько лет с использованием этой технологии появится еще больше KO- или KI-кроликов [18, 24, 25].
Отдельного внимания заслуживает вопрос об использовании кроликов в иммунологии. Они участвуют в исследовании и разработке иммунологических методов более 100 лет. Репертуар кроличьих антител, сначала в форме поликлональных, а в последнее время в виде моноклональных, остается основным источником диагностических и терапевтических антител с широким применением [14, 26].
Поликлональные антитела можно описать как набор различных антител, которые продуцируются в ответ на конкретный патоген или антиген и обычно связываются с разными эпитопами. Моноклональные антитела (мАт) содержат определенный антигенсвязывающий сайт (паратоп), который обычно связывается с высокой аффинностью и специфичностью только с одним эпитопом. С фармацевтической точки зрения мАт представляет собой молекулярно определенный и воспроизводимый продукт, тогда как поликлональные антитела традиционно представляют собой смесь различных антител. Как и в случае с мАт мыши и человека, у кроликов IgG является наиболее распространенным изотипом мАт [27].
Преимуществом антител кролика является то, что они способны распознавать эпитопы на антигенах человека, которые не являются иммуногенными для грызунов и поэтому могут связываться с большим количеством эпитопов. Кроме того, в то время как мышиные мАт к человеческим антигенам могут не реагировать перекрестно с другими видами, кроличьи мАт, специфичные к одному и тому же антигену, часто дают перекрестную реакцию с мышиными антигенами. Показано, что у кроликов развивается сильный иммунный ответ на введение малых молекул и гаптенов, что не характерно для грызунов. Важным аспектом является также то, что инбредных линий кроликов мало, в то время как большинство линий мышей являются инбредными. Считается, что у инбредных линий в целом меньше разнообразных иммунных реакций, а это затрудняет получение нужных антител. Соответственно во многих иммуногистохимических исследованиях, в которых кроличьи и мышиные мАт сравнивали с одними и теми же человеческими антигенами, кроличьи мАт неизменно демонстрировали более высокую чувствительность. Большинство методов получения мАт основано на извлечении В-клеток из селезенки, костного мозга или крови, то есть биологического материала, который присутствует в бо́льших количествах у кроликов, чем у мышей, из‑за их общего большего размера тела. Например, у кроликов можно получить в 50 раз больше В-клеток селезенки, чем у мышей. Кроме того, больший объем крови кроликов по сравнению с мышами облегчает масс-спектрометрический анализ общего количества IgG в сыворотке [14, 27].
Поликлональные антитела кролика широко используются для аналитики в биомедицинских исследованиях, особенно в таких иммунологических методах, как иммуногистохимия, вестерн-блоттинг и проточная цитометрия, а также и в клинической практике. Ярким примером является антитимоцитарный глобулин — препарат, который представляет собой смесь очищенных поликлональных IgG кролика, лошади или козы к Т-клеткам человека и используется в качестве иммунодепрессанта. При трансплантации органов и аллогенной трансплантации костного мозга применение этого препарата вызывает быстрое истощение Т-клеток, что приводит к снижению риска отторжения и острой реакции «трансплантат против хозяина». Антитимоцитарный глобулин кролика — один из наиболее часто используемых из‑за его более высокой лимфоцитотоксичности по сравнению с аналогичным белком лошади. Кроличий антитимоцитарный глобулин был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в 1998 г. [27].
Кроличьи поликлональные антитела широко используются в диагностических целях. Так, в FDA одобрен препарат кроличьих поликлональных антител для использования в качестве диагностического инструмента in vitro для иммуногистохимического обнаружения экспрессии CD117 (c-kit) в гастроинтестинальных стромальных опухолях, что необходимо для выбора дальнейшей тактики лечения. Кроличьи мАт применяются также для обнаружения экспрессии ассоциированных с опухолью антигенов, включая HER2, рецепторы эстрогена, рецепторы прогестерона и PD-L1. Кроме того, в настоящее время в клинических исследованиях изучается несколько терапевтических препаратов, полученных из мАт кролика [27].
Таким образом, на сегодняшний день существует большое количество моделей различных патологических состояний, разработанных на кроликах. Спектр этих моделей, а также возможности использования кроликов в различных областях биомедицинских исследований значительно увеличились и продолжают расширяться благодаря появлению и совершенствованию технологий создания генетически модифицированных особей.
Фармакологическая безопасность
Основной набор исследований фармакологической безопасности включает оценку воздействия на сердечно-сосудистую, центральную нервную и дыхательную системы7, 8. Изучение фармакологической безопасности лекарственного кандидата должно проводиться до начала клинической разработки, поскольку полученная на данном этапе информация о влиянии потенциального лекарства на функциональную активность основных органов и систем крайне важна для принятия решения о целесообразности его разработки.
Центральная нервная система
Оценка влияния субстанций на нервную систему развивалась в нескольких параллельных направлениях. Для определения побочных эффектов лекарств на ЦНС обычно использовали ряд наблюдений и манипуляций, которые известны как тест Ирвина [28]. Этот тест широко применялся в фармацевтической промышленности. Еще один подход (используемый в исследованиях хронической токсичности, проводимых в 50–70‑х годах прошлого века) — наблюдение за поведением животного в клетке — стал методом выявления ранних признаков токсического действия, при этом использование этого подхода для изучения самого поведения не получило широкого распространения. Несколько позже (80‑е годы прошлого века) по инициативе Агентства по охране окружающей среды США (U.S. Environmental Protection Agency, U.S. EPA) было разработано и опубликовано руководство по использованию серии тестов, частично основанных на тесте Ирвина, которые получили название «функциональная батарея тестов» (functional observational battery, FOB). Проведение поведенческих тестов для оценки влияния на ЦНС потенциальных лекарственных средств требуется согласно руководству Международной конференции по гармонизации (ICH) S7A [29].
Рекомендовано проводить двухуровневое тестирование влияния на функцию ЦНС. Тесты уровня 1 включают скрининг с использованием теста Ирвина или функциональной батареи тестов для оценки широкого спектра показателей. Если выявлено или предполагается влияние тестируемого соединения на функциональную активность ЦНС, то на уровне 2 оцениваются двигательные, сенсорные и когнитивные функции. Тестирование уровня 1 обычно состоит из простых или быстрых тестов, которые можно использовать для определения того, действует ли вещество на нервную систему и в каких дозах, тогда как тестирование уровня 2 включает тесты сложнее, которые обеспечивают более полное описание эффектов и зависимости показателя доза—реакция [29].
Важно отметить, что не существует единого протокола проведения тестирования, а в руководствах описываются более общие аспекты и экспериментальные тесты, которые следует включить. Каждая испытательная лаборатория обычно использует свою версию такого протокола. В целом наблюдения проводятся в домашней клетке и на открытой арене, во время которых оцениваются движения животного, его внешний вид и реакции на различные раздражители. Преимущество этого типа скрининга заключается в том, что одно животное можно многократно оценивать для определения начала, прогрессирования, продолжительности и обратимости нейротоксического повреждения. Чаще всего в таких исследованиях используют грызунов, так как именно на них разработаны методы оценки [28, 29].
Необходимость оценки эффектов в отношении ЦНС на кроликах может возникнуть в случае, если кролик является более чувствительным видом к фармакологическим эффектам соединения, а также в том случае, если данный тип исследования проводится как дополнительный в рамках изучения токсических свойств. За основу может быть взят тест Ирвина, который включает комплексную оценку функциональной активности нервной системы. Альтернативно для оценки ЦНС может быть использована функциональная батарея тестов, предложенная V.C. Moser [29, 30]. Изначально разработанные для проведения тестирования на грызунах данные подходы с определенными модификациями применимы и для проведения тестирования на любых других видах лабораторных животных, в том числе и на кроликах, с учетом их видовых особенностей.
Для кроликов можно использовать адаптированный тест Ирвина. Для выявления возможных поведенческих и физиологических изменений оценивают следующие параметры [31]:
- возбуждение (увеличенная двигательная активность, прыжки, повышенные: пугливость и реакция на прикосновение, агрессия, тремор и др.);
- стереотипии (стереотипные движения головой, жевание, принюхивание, почесывание, потягивание и др.);
- моторные нарушения [нарушение координации движений, каталепсия, акинезия, абнормальная походка («на цыпочках») и др.];
- седация (сниженная двигательная активность, пониженная реакция на прикосновение и др.);
- признаки боли/анальгезии (корчи, анальгезия — отсутствие реакции в ответ на болевой раздражитель);
- вегетативная нервная система (птоз верхнего века, мидриаз/миоз, экзофтальм, пилоэрекция, дефекация, саливация, слезотечение, тахипноэ и др.).
Регистрируется наличие/отсутствие признака, при необходимости более точной оценки может быть использована система баллов. Целесообразно проводить исследование до введения тестируемого соединения, чтобы была возможность сравнения поведенческих и физиологических характеристик у одного и того же животного до и после воздействия.
Сердечно-сосудистая система
При изучении влияния лекарственного кандидата на сердечно-сосудистую систему in vivo рекомендовано оценить влияние на артериальное давление, частоту сердечных сокращений и показатели электрокардиограммы (ЭКГ), в том числе на интервал QT9. Интервал QT (время от начала комплекса QRS до окончания зубца Т) на ЭКГ является мерой продолжительности деполяризации и реполяризации желудочков. На сегодняшний день считается, что при задержке реполяризации желудочков и удлинении интервала QT существует повышенный риск развития желудочковой тахиаритмии, включая летальную желудочковую тахикардию типа «пируэт» (torsades de pointes).
В исследованиях по оценке влияния на сердечно-сосудистую систему in vivo рекомендовано использовать морских свинок, кроликов, хорьков, собак, приматов.
По сравнению с человеческим сердце кролика обладает сходным распределением ионных токов, ответственных за реполяризацию сердца, что приводит к формированию потенциала действия прямоугольной конфигурации у обоих видов. Кроме того, сходные биофизические свойства ионных каналов сердца кролика и человека приводят к сопоставимому фармакологическому ответу. Следует отметить, что паттерны аритмии у обоих видов похожи из‑за сходного эффективного размера сердца. Кальциевые токи у человека (опосредованные кальциевыми каналами L-типа) сходны с токами кальция у кролика. Канал Nav1.5 является преобладающим натриевым каналом у крупных млекопитающих, что свидетельствует об аналогичном влиянии блокаторов натриевых каналов на сердце человека и кролика. Поэтому кролики используются для изучения безопасности ингибиторов натриевых каналов. В совокупности эти преимущества подтверждают то, что кролик является адекватной моделью для оценки влияния фармакологических веществ на функцию сердца [32].
В скрининговых исследованиях фармакологическую безопасность оценивают путем регистрации ЭКГ и артериального давления. Оценку ЭКГ можно проводить на животных под наркозом. При этом следует учитывать потенциальное влияние средств для наркоза на показатели. В связи с этим целесообразно фиксировать параметры до введения тестируемого соединения и после и/или включать в эксперимент группу контроля, которая получает плацебо. Для снятия ЭКГ используют четыре электрода типа «крокодил», которые располагают в сгибах обоих коленей и локтей. На каждый электрод наносят небольшое количество токопроводящего геля для лучшей электропроводности. Возможно подключение дополнительных электродов [31].
После электрокардиографии на наркотизированных кроликах целесообразно оценить артериальное давление. Это можно осуществить инвазивным методом. Для этого кроликам выполняют трахеотомию, чтобы позволить животным дышать спонтанно. Затем изолируют левую сонную артерию, вставляют в нее канюлю, соединяют с датчиком давления, подключенным к системе регистрации диастолического, систолического и среднего артериального давления. С применением инвазивной методики регистрация осуществляется в течение 20 мин [31].
При неинвазивном методе оценки артериального давления используют надувные манжеты, регистрацию проводят с использованием ветеринарного прибора для измерения артериального давления, которую осуществляют 3 раза, с перерывами не менее 1 мин между измерениями.
С развитием технологий стало возможно использование телеметрического оборудования, позволяющего оценивать в режиме реального времени большое количество параметров, характеризующих функциональное состояние сердечно-сосудистой системы. Существенным преимуществом данных систем является то, что регистрация проводится на бодрствующих животных, поэтому влияние наркотизации и/или стресса обездвиживания на регистрируемые параметры исключается.
Дыхательная система
В руководстве ICH S7A10 подчеркивается, что частоту дыхания и другие показатели дыхательной функции (например, дыхательный объем или насыщение гемоглобина кислородом) следует оценивать с использованием соответствующих методологий, дополняющих клинические наблюдения. Эти исследования включают оценку как всей дыхательной системы, так и механических свойств легких. Рекомендуется проводить оценку параметров на животных в сознании [33].
Дыхательную систему функционально можно разделить на систему забора воздуха и газообменную систему. Оценку дыхательной функции осуществляют с помощью плетизмографа, который предназначен для непосредственного мониторинга изменений объема легких или воздушных потоков, создаваемых движениями грудной клетки. Хотя в большинстве своем коммерческое оборудование используется для оценки параметров у грызунов, могут быть модификации, позволяющие определять требуемые характеристики у более крупных животных.
Различные подходы к измерению параметров функции дыхания in vivo описаны в обзоре D.J. Murphy [34].
Для оценки газов крови и других параметров, характеризующих сохранность дыхательной функции, у кроликов образцы артериальной крови можно забирать из центральной артерии уха.
За последние годы разработаны и начали применяться методы непрерывного мониторинга параметров дыхания у находящихся в сознании, не подвергнутых стрессу ограничения движений мелких и крупных лабораторных животных. Применение этих методов позволяет уменьшить количество животных в исследованиях благодаря возможности одновременного измерения параметров сердечно-сосудистой и дыхательной систем [33].
Дыхательная система кроликов имеет больше сходства с точки зрения анатомии и физиологии с такой человека, чем у грызунов. В этом плане кролики могут быть более подходящей моделью для оценки влияния препаратов на функцию дыхательной системы, если таковая предполагается. При определении влияния на функцию респираторной системы следует принимать во внимание видовые особенности кроликов. Анатомические и физиологические особенности дыхательной системы кролика в сравнении с человеком освещены в обзоре N.A. Kamaruzaman [8].
Фармакокинетика
Кролики являются удобной моделью для фармакокинетических исследований абсорбции и выведения благодаря возможности введения необходимых объемов/доз лекарственного препарата, а также возможности многократного забора биологического материала (кровь, моча, кал) в достаточных количествах.
При изучении фармакокинетики лекарственных средств на кроликах следует учитывать их некоторые видовые особенности.
Основная особенность пищеварения кроликов состоит в поедании ими собственного кала. Это так называемая капрофагия или цекотрофия. Кролики выделяют кал двух видов: мягкий, или ночной (цекотрофы), и твердый, или обычный. Твердый кал кролики поедают редко, причем последнее свойственно больше молодым животным, которые выделяют еще мало мягкого кала. Взрослые животные поедают твердый кал в том случае, когда им не хватает корма. Поедая мягкий кал, кролики получают дополнительно большое количество микроорганизмов. Кроме того, микроорганизмы синтезируют витамины комплекса В и витамин К, которые с мягким калом попадают в организм кроликов и усваиваются в тонком кишечнике. Под действием ферментов микроорганизмов осуществляется более полное переваривание питательных веществ корма, особенно клетчатки, поскольку при капрофагии часть питательных веществ проходит через пищеварительный тракт животных минимум дважды [2]. Такая видовая особенность может оказывать влияние на фармакокинетические параметры, особенно в том случае если существенная доля тестируемого соединения и/или его активных метаболитов выводится с калом.
Кролики — травоядные животные с относительно сложным пищеварительным трактом. Желудок обычно содержит примерно 15% пищи, присутствующей в пищеварительном тракте. Тонкая кишка относительно короткая для млекопитающего, составляет примерно 12% желудочно-кишечного тракта. Исходя из массы тела, у кролика самая большая слепая кишка среди всех ныне живущих млекопитающих. В слепой кишке обычно удерживается около 40% содержимого желудочно-кишечного тракта [1].
Функциональная активность пищеварительной системы кролика сильно зависит от характера питания. Сбалансированная диета с достаточным количеством растительной клетчатки необходима для обеспечения нормальной перистальтики кишечника и предотвращения ряда заболеваний пищеварительной системы. В норме желудок эффективно стерилизует потребляемую пищу при рН от 1,0 до 2,0. Питательные вещества всасываются в тонком кишечнике. В толстом кишечнике неперевариваемая клетчатка перерабатывается в твердые фекальные гранулы, а более мелкие частицы ферментируются в слепой кишке, прежде чем перерабатываются в мягкий кал. Время прохождения пищи по пищеварительному тракту кролика обычно короткое. Однако следует учитывать, что в зависимости от рациона время прохождения пищи может меняться, что, вероятно, может отразиться на фармакокинетических параметрах перорально вводимых препаратов. Так, рацион с высоким содержанием неперевариваемой клетчатки, особенно лигноцеллюлозы, стимулирует быстрое продвижение пищи через желудочно-кишечный тракт. Диеты с низким содержанием клетчатки приводят к снижению перистальтики кишечника и застою в желудке, что увеличивает частоту запоров. Диеты с высоким содержанием сахара и крахмала превышают способность тонкого кишечника к их абсорбции и прохождению в слепую кишку [1].
При этом распределение кишечной микрофлоры в кишечнике (и, следовательно, ее потенциальная метаболическая активность) у кроликов больше похоже на таковое у людей, чем у морских свинок, крыс или мышей, при пероральном введении соединение с меньшей вероятностью будет подвергаться метаболизму и соответственно уменьшается вероятность образования токсического или активного метаболита у кролика, чем у других видов лабораторных животных. Однако, поскольку время опорожнения желудка у кроликов может варьировать от 20 мин до 20 ч в отличие от скорости опорожнения желудка у человека от 1,0 до 1,5 ч, это ограничивает применение кроликов для оценки абсорбции перорально вводимых веществ [1].
Хотя кролики часто используются для изучения токсичности веществ при накожном нанесении, кожа кроликов имеет ряд особенностей, которые необходимо учитывать при проведении исследований. Кожа человека имеет более толстый роговой слой и более устойчива к абсорбции веществ, наносимых на кожу, чем кожа большинства широко используемых лабораторных животных, включая кролика и крысу. In vitro проницаемость кожи для водорастворимых веществ и веществ, растворенных в органических растворителях, увеличивается в следующем порядке: человек, свинья, морская свинка, крыса и кролик. При сравнении проницаемости кожи in vivo для нескольких соединений обнаружено, что абсолютная скорость кожной абсорбции у кролика была выше, чем у крысы, свиньи или человека (в порядке убывания). По-видимому, поскольку проницаемость кожи карликовых свиней близка к таковой человека, для исследований, в которых данные токсичности при накожном нанесении должны использоваться при прогнозировании токсичности для людей, в некоторых отношениях карликовые свиньи представляются более подходящим видом, чем кролик. Однако, несмотря на значительные различия между кожей кролика и человека, кролики обычно используются при оценке безопасности накожно наносимых веществ. При интерпретации данных, полученных с использованием кроликов, необходимо учитывать следующее. При однократном нанесении общее воздействие на поверхность кожи нанесенного соединения у кролика будет короче, чем у человека. Однако из‑за более высокой скорости проникновения в кожу кролика временно могут возникать более высокие концентрации соединения в коже кролика по сравнению с кожей человека. Кроме того, временные параметры системной абсорбции соединения также будут заметно различаться у кролика и человека [1].
Низкая частота моргания у кролика по сравнению с человеком предполагает, что время пребывания растворов для местного применения в прекорнеальной области у кроликов намного дольше. В эксперименте, направленном на оценку этого предположения, небольшую каплю, содержащую либо флуоресцеин, либо FITC Dextran, наносили на глаз кролика без использования анестетика. За изменением флуоресценции прекорнеальной слезной пленки следили с помощью неинвазивного флюорометра. Животное не моргало в течение 20–30 мин после закапывания. Флуоресценция слезной пленки оставалась постоянной после первых нескольких минут и резко падала при первом моргании. Сравнение с фармакокинетикой в человеческом глазу показало, что абсорбция лекарственного средства в глазу кролика может быть выше (до 3 раз) из‑за низкой частоты моргания. Однако большинство лекарственных препаратов легко проникает через эпителий, и практически все вещество, присутствующее в слезной пленке, через несколько минут уже может оказаться в роговице. В таких случаях время контакта, измененное при частом моргании, не будет иметь существенного значения [9, 35].
Ферменты, метаболизирующие ксенобиотики, у кролика изучены очень хорошо. Активность микросомальных ферментов печени CYP-450 (цитохром Р-450) и уровни активности субстратов оценивались у кроликов в сравнении с другими видами лабораторных животных (мыши, крысы, хомяки и морские свинки). Содержание цитохрома Р-450 (1,05–1,09 нмоль/мг) и активность НАДФ/цитохром‑с-редуктазы (130–150 нмоль/мин/мг) у кролика были аналогичны таковым у других исследованных видов. При этом активность CYP-450 редуктазы у кролика оказалась намного ниже (3,0–3,4 нмоль/мин/мг), чем у мыши и крысы. Содержание CYP-450 у кролика было несколько выше, чем у человека (0,31±0,09 нмоль/мг) [1, 36].
Известно, что распределение оксидаз между гладкой и шероховатой микросомальной мембраной различается между видами животных. У кролика концентрации всех компонентов оксидазной системы в 4–5 раз выше в гладком эндоплазматическом ретикулуме, чем в шероховатом эндоплазматическом ретикулуме микросомальных фракций печени, тогда как у некоторых животных (например, у крыс и мышей) распределение между гладкой и шероховатой мембраной довольно равномерное [1, 37].
Как и у других видов лабораторных животных, ферменты, метаболизирующие ксенобиотики, у новорожденных кроликов не полностью развиты. Например, фенобарбитал оказывал более выраженное токсическое действие на новорожденных кроликов по сравнению со взрослыми кроликами [1].
Метаболизм ксенобиотиков может быть различным у разных пород кроликов. Причем если отличия в метаболизме некоторых соединений (гексобарбитал, гормоны коры надпочечников, 2‑нафтиламин) у линий крыс и мышей были довольно умеренные, различия между породами кроликов были более выраженными. У кроликов, вероятно, такая разница могла быть вызвана дефицитом некоторых ферментов. Например, скорость микросомального метаболизма гексобарбитала и амфетамина в печени американского кролика (in vitro) составляла 19 и 8 нмоль/мг белка в 1 ч соответственно, тогда как скорость метаболизма гексобарбитала в печени новозеландского кролика — 254 нмоль/мг/ч, а скорость метаболизма амфетамина у голландского кролика — 154 нмоль/мг/ч [1].
Разная межвидовая токсичность соединения может зависеть от разницы в его метаболизме. Влияние может оказывать степень связывания с белками, интенсивность выведения с желчью, почечная экскреция. При изучении связывания с белками некоторых лекарств (клофибриновой кислоты, этодолака, толрестата, перринона, беноксапрофена) на кроликах и других лабораторных животных (крыса, мышь, собака, макака-резус), а также на людях, связывание у кролика было средним по выраженности. В целом связывание было самым высоким в сыворотке человека и самым слабым в сыворотке мыши. Однако при изучении связывания преднизолона с белками в сыворотке крови кроликов, собак, крыс и людей характеристики связывания препарата в кроличьей сыворотке оказались наиболее сходными с таковыми в сыворотке человека [38].
Токсикология
В исследованиях токсичности необходимо использовать два вида лабораторных животных, один из которых не должен относиться к грызунам11. Поскольку кролик представляет отряд зайцеобразных, формально его использование как второго вида в токсикологических исследованиях удовлетворяет нормативным требованиям.
При этом следует помнить, что выбор видов животных для токсикологических исследований должен быть определен в каждом конкретном случае на основе анализа имеющихся научных данных с учетом фармакологической активности лекарственного препарата, его фармакокинетического профиля, возможности обеспечения достаточной экспозиции, релевантности видов лабораторных животных, а также планируемой длительности клинического применения.
Продолжительность исследований токсичности регламентирована. Если препарат планируется применять в клинике от 1 до 3 мес, продолжительность доклинических исследований на негрызунах должна составлять 6 мес, при длительности использования более 3 мес продолжительность доклинических исследований на негрызунах — 9 мес12.
Исходя из этого, для препаратов, предназначенных для длительного применения необходимы продолжительные доклинические исследования токсичности. Длительные исследования на крупных лабораторных животных достаточно дороги. В ряде случаев по причинам экономической целесообразности и если есть все основания полагать, что использование кроликов как второго вида лабораторных животных позволит получить достаточно информации для прогнозирования рисков для человека, исследования токсичности при многократном введении могут быть выполнены на кроликах.
Преимущества и недостатки кроликов как вида лабораторных животных
Как и любой другой вид лабораторных животных в плане использования в исследованиях кролики имеют свои преимущества и недостатки. Преимущества использования кролика в биомедицинских исследованиях заключаются в его относительно небольших размерах и относительной простоте содержания. На кроликах можно проводить практически любые экспериментальные манипуляции (доступны любые способы введения тестируемых соединений, проведение различных аппаратных исследований, катетеризация, возможен многократный сбор образцов крови и др.). Для кроликов требуется умеренное количество тестируемых веществ, что немаловажно, особенно в случае если эти вещества имеют высокую стоимость. При этом кроликам можно вводить достаточно большие объемы растворов, суспензий тестируемых субстанций. Кроликам можно вводить препараты в лекарственной форме капсул или таблеток без разрушения их целостности, что особенно важно для тестирования лекарственных форм с модифицированным высвобождением. В исследованиях репродуктивной токсичности важным преимуществом кролика относительно более крупных животных являются короткий период беременности, хорошая репродуктивная способность, в то же время размер кролика достаточен для того, чтобы оценивать плод. Кролики чувствительны к тератогенам человека и, как правило, являются предпочтительным видом негрызунов для исследований, в которых оценивается потенциальное неблагоприятное влияние на эмбриофетальное развитие. Эти животные также широко используются в иммунологии для продуцирования диагностических антител, в том числе и потому, что образцы крови относительно легко собирать. Важным моментом является и то, что в научной литературе имеется достаточное количество исторических и справочных материалов по анатомии, физиологии, патофизиологии этих животных.
Однако у кроликов часто развиваются нарушения функции желудочно-кишечного тракта. Функциональная активность пищеварительной системы кролика сильно зависит от характера питания. Изменение рациона может оказать влияние на рН желудка. Диета с высоким содержанием сахара и крахмала превышает способность тонкого кишечника к их абсорбции и прохождению в слепую кишку, где размножение микроорганизмов может привести к энтеротоксемии. Анорексия и другие заболевания могут вызвать повышение рН желудка, снижая его эффективность по стерилизации содержимого. Кроме того, компактный шарик концентрированной сухой пищи в желудке может препятствовать эффективной стерилизации, позволяя микроорганизмам проникать дальше и вызывать неблагоприятные последствия. Диета с высоким содержанием клетчатки, низким уровнем белка и углеводов является более естественной для кролика. Пищеварительная система кролика функционирует лучше всего при наличии достаточного количества растительной клетчатки, например, хорошо зарекомендовали себя рационы, содержащие сено хорошего качества с уменьшенным количеством гранулированных кормов. Любые изменения в рационе следует вводить постепенно. Количество крахмала и жиров должно быть минимальным [1].
Для кроликов должны быть созданы условия, позволяющие им ежедневно активно двигаться.
Кроликов необходимо брать и держать правильно, чтобы предотвратить травмы как животных, так и людей. С ними следует обращаться достаточно твердо, но осторожно. Поскольку кролики очень пугливые животные, они часто сопротивляются при попытке взять их в руки и пытаются убежать. Кролик, которого взяли неправильно или удержали ненадежно, будет сильно отталкиваться задними лапами, в результате чего может быть травмирован, частая ситуация — перелом спины. Кроме того, при попытке убежать кролики могут поцарапать человека своими мощными задними лапами. Следует помнить, что уши кролика очень хрупкие, поэтому кролика нельзя поднимать или удерживать за уши.
Если запланированы особенно длительные исследования токсичности in vivo с использованием кроликов, необходимо уделять внимание реализации принципов 3Rs, (сократить/оптимизировать/заменить — «reduce/refine/replace»), что предусматривает в том числе улучшение и оптимизацию проведения экспериментальных процедур с лабораторными животными.
Объемы и способы введения
В токсикологических исследованиях часто существует необходимость введения больших объемов лекарственного препарата для достижения требуемых доз. Введение больших объемов может быть затруднено на практике и вызвать неблагоприятные физиологические эффекты, ставящие под угрозу благополучие животных.
На сегодняшний день, с точки зрения гуманных принципов обращения с животными, используются такие понятия, как рекомендованный и максимальный объемы для введения им препаратов. Использование сведений о рекомендованных и максимальных объемах для введения лекарственных средств позволит более рационально подходить к вопросу разработки плана исследования, сводя к минимуму страдания животного [39].
В табл. 1 представлены рекомендуемые и максимальные объемы введения для кроликов при наиболее часто используемых в исследованиях способах [39–43].
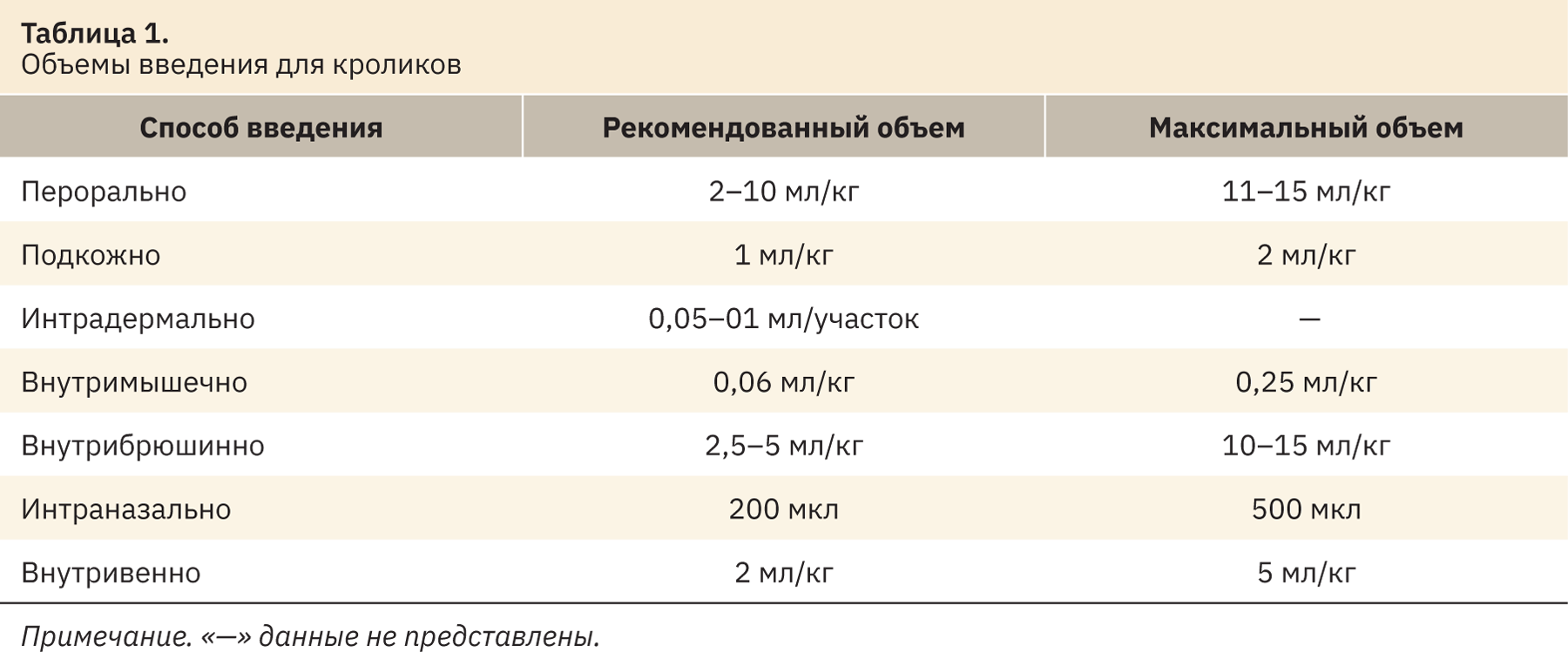
Для энтерального введения кроликам используется желудочный зонд, применяются капсулы/таблетки, суспензии, иногда препараты вводятся с кормом/водой.
При введении вещества с кормом или водой следует учитывать, что кролики, как и многие другие виды лабораторных животных, не будут потреблять корм или воду с веществом, если они имеют неприятный запах или вкус, а также если у корма форма, неудобная для поедания. Кроме того, кролики, как правило, разбрасывают корм и «играют» со своими поилками, поэтому из‑за рассыпания и потерь, учитывая потенциальные проблемы со вкусовыми качествами, эти методы для кроликов не являются предпочтительными, особенно, если важно вводить точное количество вещества [1].
Небольшие объемы растворов веществ можно вводить, помещая кончик шприца в угол рта кролика и медленно вводя препарат. Наиболее точным методом перорального введения соединений является введение раствора/суспензии вещества с помощью специальной иглы с шариковым наконечником из нержавеющей стали. Иглу присоединяют к шприцу, голову и шею животного фиксируют вручную, чтобы избежать травм, если животное будет сопротивляться, и вводят иглу в заднюю часть рта и в пищевод.
Внутрижелудочное введение можно осуществлять с использованием латексного катетера в качестве желудочного зонда. Животное также фиксируют. Рот держат открытым и катетер вводят в заднюю часть глотки, стараясь не задеть зубы, а затем осторожно направляют в пищевод и желудок. Чтобы убедиться в правильном расположении катетера в желудке, а не бронхах, в трубке не должно быть движений воздуха, соответствующих дыхательным движениям. Если животное сопротивляется, катетер следует удалить и снова ввести. После введения катетера в открытый конец вставляют иглу с шариковым наконечником, прикрепленную к шприцу, и осторожно нажимают на поршень шприца для введения дозы. Затем катетер, прикрепленный к пустому шприцу, удаляют, снова стараясь не задеть зубы [1].
Введение капсул или таблеток без разрушения часто бывает необходимо при проведении токсикологических исследований или определении фармакокинетики. Для введения можно использовать таблеткодаватель или шприц подходящего размера, у которого предварительно аккуратно срезан наконечник для фиксации иглы. Количество вводимых таблеток/капсул зависит от их размера. Диаметр пищевода кролика (8,5–11 мм) и размер фарингеального сужения (8,9 мм) позволяют вводить кроликам таблетки/капсулы довольно большого размера [40]. Для облегчения процедуры введения и проглатывания таблетки/капсулы предварительно можно смазать небольшим количеством растительного масла. При введении нескольких капсул/таблеток большого размера необходимо выдерживать интервал между введениями.
Накожное нанесение. Вещества наносят на дорсальную область туловища. Предварительно удаляют шерсть, для чего используют машинку для стрижки, по мере необходимости после введения шерсть удаляют снова. Следует соблюдать осторожность, чтобы не повредить кожу, и использовать только животных со здоровой, неповрежденной кожей. Если тестируемое вещество жидкое, его можно применять в разбавленном или неразбавленном виде, если твердое, то перед нанесением его следует слегка увлажнить физиологическим раствором, деионизированной водой или другим подходящим растворителем, чтобы обеспечить хороший контакт с кожей. Затем вещество равномерно наносится на кожу. Зону воздействия можно оставить открытой или закрыть марлевой повязкой, закрепленной лейкопластырем. Для того чтобы у животных повязка была хорошо зафиксирована, и/или чтобы избежать попадания вещества в желудочно-кишечный тракт при груминге, животным одевают гибкие пластиковые воротники (могут подойти воротники, предназначенные для кошек). По окончании периода воздействия вещества повязки и воротник снимают, а кожу промывают водой или протирают полотенцем, смоченным водой или слабым мыльным раствором, как можно тщательнее, при этом не раздражая кожу.
Закапывание в глаза. Животных следует обследовать перед введением препарата, не следует использовать животных, у которых обнаружено раздражение или повреждение роговицы. Если необходимо ввести твердый или гранулированный материал, его следует тонко измельчить в пыль или порошок. Тестируемое вещество закладывают/закапывают в конъюнктивальный мешок, а затем верхнее и нижнее веко осторожно удерживают вместе в течение секунды перед тем, как отпустить, чтобы предотвратить потерю вещества [1].
Внутривенное введение. Введение вещества обычно осуществляют в краевую вену уха (по заднему краю снаружи уха). Животное фиксируют, осторожно выщипывают шерсть из области вены и наносят дезинфицирующее средство. Если вена плохо видна, ее можно протереть спиртом или закрыть, осторожно нажав на основание уха или поместив скрепку у основания уха. Для внутривенных инъекций игла должна быть острой (предпочтительнее предварительно упакованные, стерильные, одноразовые иглы) и как можно меньшего размера (диаметр 25G или меньше). Иглу сначала вводят в кожу рядом и параллельно кровеносному сосуду, а затем продвигают в вену скошенным краем вверх. Следует следить, чтобы в шприце находился только дозирующий раствор и не было воздуха. Если в месте инъекции есть признаки нагрубания или припухлости, указывающие на то, что игла находится вне вены, необходимо ее переместить [1].
Подкожное введение. Подкожные инъекции делаются в область шеи или спины с помощью иглы диаметром от 23G до 27G. Кожу захватывают одной рукой, и вещество вводят в натянутую кожу. Если необходимо ввести большие объемы, иглу можно немного вытянуть назад и перенаправить, чтобы распределить жидкость в пространстве под кожей [1].
Внутримышечное введение. Внутримышечные инъекции делаются в латеральные области крупных мышц задней части тела (например, в мышцы бедра). Необходимо соблюдать осторожность, чтобы не задеть крупные кровеносные сосуды, нервы и кости. Сначала область места инъекции иммобилизуют, обрабатывают дезинфицирующим средством, а затем вводят иглу. После того, как игла введена, поршень шприца следует слегка оттянуть, чтобы убедиться, что кровь не аспирируется, то есть игла случайно не попала в кровеносный сосуд. Если в шприце появляется кровь, иглу следует осторожно переместить или извлечь и снова ввести. Введение проводят медленно [1].
Внутрикожное введение. Внутрикожные инъекции делают в область поясницы и бока, куда кролику трудно дотянуться задними лапами. Сначала следует удалить шерсть с помощью машинки для стрижки и крема для депиляции. Затем нанести антисептик. Кожу растягивают и иглу вводят только в дерму, образуя небольшой пузырь, инъекцию делают с помощью иглы диаметра 25G, прикрепленной к шприцу с тестируемым веществом. После извлечения иглы следует осмотреть место инъекции на предмет вытекания вещества. Если такое происходит, то игла должна быть глубже вставлена в кожу во время инъекции [1].
Внутрибрюшинное введение. Кролика фиксируют вручную, приподнимая заднюю часть туловища. Иглу (23G–25G) вводят скошенной частью вверх в область немного латеральнее средней линии и ниже области середины живота [1].
Интравагинальное введение. Самку фиксируют и осторожно захватывают ее хвост между большим и указательным пальцами, в то время как остальная часть руки плотно прижимается к области бедра животного. Когда животное расслабляется, хвост подтягивается вверх, открывая вход во влагалище. Катетер осторожно вводят во влагалище примерно на 2–3 см, вводят дозу и извлекают катетер. После завершения процедуры, чтобы предотвратить вытекание, животное держат в зафиксированном положении в течение 1–2 мин, поднимая заднюю часть туловища. Для введения как жидких лекарственных форм, так и кремов можно использовать также шприцы объемом 1 мл. Суппозитории и таблетки можно вводить вагинально с помощью пластикового тампонообразного аппликатора [1]. Объем введения 0,5–1 мл геля, крема, раствора [44].
Ректальное введение. Наиболее часто используемой лекарственной формой являются суппозитории. Суппозитории обычно имеют массу от 0,5 до 1 г, должны быть короткими и затупленными по форме, вводятся примерно на 3 см от наружного ректального сфинктера [1]. Объем введения 1 мл геля, крема [44].
Токсичность при однократном введении
Целью исследования острой токсичности (токсичность при однократном введении) является установление среднелетальных доз и/или максимально переносимых доз тестируемых субстанций. Исследования острой токсичности традиционно проводились для новых субстанций с целью установления класса опасности. Для лекарственных препаратов в большинстве случаев такие исследования не являются необходимыми, так как информация о классе токсичности активной фармацевтической субстанции уже имеется. Конечной точкой в таких исследованиях является гибель животных. Согласно современным представлениям о гуманном обращении с животными, при принятии решения о проведении исследований должен быть тщательно рассмотрен вопрос о целесообразности проведения такого рода исследований. Чаще всего острая токсичность изучается с использованием крыс и мышей. На кроликах такие исследования проводятся редко. При необходимости изучения острой токсичности на кроликах должны быть предприняты все меры по снижению количества животных в эксперименте и ограничению их страданий.
Для изучения острой токсичности (токсичность при однократном введении) субстанции может быть использовано несколько подходов. В соответствии с «Руководством по проведению доклинических исследований лекарственных средств» (2012)13 для установления ЛД50 соединения используют несколько групп животных (в каждой не менее 5 голов каждого пола), по частоте летальных исходов с помощью математических методов (например, пробит-анализ) рассчитывают ЛД50 и устанавливают класс токсичности (в соответствии с ГОСТом 12.1.007–76). Преимуществом данного подхода является точное установление ЛД50, недостатком — использование большого количества животных.
Современные подходы, закрепленные в соответствующих руководствах OECD (TG OECD 42014, TG OECD 42315) и ГОСТах (ГОСТ 32296–201316, ГОСТ 32644–201417), позволяют использование меньшего числа лабораторных животных. Точное значение ЛД50, применяя данные подходы, не рассчитывается. Класс токсичности субстанции устанавливается в соответствии с классификацией GHS18. Протокол TG OECD 42519 (ГОСТ 34557–201920) описывает метод, позволяющий получить значение ЛД50 с использованием меньшего, чем рекомендовано отечественным руководством21, количества животных. С учетом современных требований к проведению исследований по изучению токсичности соединения при однократном применении целесообразно использовать подходы, изложенные в упомянутых протоколах OECD и ГОСТа.
Токсичность при многократном введении
В зарубежных (американских и европейских) токсикологических программах кролики редко используются как второй вид животных для проведения длительных исследований токсичности новых лекарственных кандидатов. Предпочтение отдается собакам, карликовым свиньям, нечеловекообразным приматам. Если кролики используются, то это исследование токсичности, как правило, ограничивается длительностью периода введения не более 90 дней [1].
Методология исследований токсичности при многократном введении на негрызунах освещена в протоколе OECD TG 40922. В основные группы включено минимальное количество животных, которое должно быть в каждой, — 4 самца и 4 самки. Количество доз — три, также в исследование должна быть включена контрольная группа. Для оценки обратимости токсических эффектов могут быть включены группы отсроченного наблюдения. Однако данный протокол предполагает использование собак, свиней или карликовых свиней. При использовании кроликов методология может быть та же, однако количество животных в группе должно быть увеличено.
Поскольку у лабораторных кроликов могут спонтанно развиваться некоторые патологические проявления (например, патологии пищеварительного тракта), это может потребовать либо применения медикаментозной терапии, либо исключения животного из эксперимента. Поэтому в случае планирования длительных исследований на кроликах целесообразно включение не менее 8 самцов и 8 самок в каждую группу. Если предусмотрены группы отсроченного наблюдения, то число кроликов в эксперименте увеличивается. Количество животных должно быть достаточным для оценки возможных отсроченных эффектов.
Если программа исследований предусматривает проведение длительного исследования токсичности на кроликах, перед началом эксперимента целесообразно провести исследование по подбору доз с целью установления диапазона для основного исследования.
В ряде случаев (например, изучение препарата, о котором уже имеются предварительные данные) количество кроликов в эксперименте может быть сокращено за счет снижения числа животных в группах отсроченного наблюдения. Сокращения количества кроликов в исследованиях токсических свойств можно также добиться, используя комбинированный дизайн, в котором оцениваются параметры фармакологической безопасности, иммунотоксичности, репродуктивной токсичности, фармако- и токсикокинетики. Еще одним возможным подходом является проведение одного длительного эксперимента, продолжительность которого достаточна для регистрационных целей без проведения более коротких исследований.
В ходе токсикологического исследования на кроликах проводятся все рутинные манипуляции, которые требуются для оценки токсических эффектов. В общем случае это следующие параметры:
- клинический осмотр и наблюдение;
- регистрация массы тела;
- регистрация потребления корма и воды;
- клинический анализ крови;
- оценка параметров гемостаза;
- биохимический анализ крови;
- общий анализ мочи;
- регистрация ЭКГ и артериального давления;
- офтальмоскопия;
- патолого-анатомическое исследование с оценкой массы органов;
- гистологическое исследование.
Клинические наблюдения и осмотры являются неотъемлемой частью токсикологических исследований. Клинические наблюдения и осмотры обычно проводятся как до введения препаратов, так и после и состоят в наблюдении за поведением животного для регистрации любых признаков, свидетельствующих о плохом состоянии здоровья или аномальном поведении (например, снижение двигательной активности, тремор и др.). Прежде чем проводить такие наблюдения, важно ознакомиться со спектром клинических признаков, которые можно наблюдать в нормальной популяции кроликов. Целесообразно провести детальный клинический осмотр каждого животного перед началом введения тестируемого соединения.
Регистрация массы тела проводится еженедельно. Однако в случае отсутствия влияния тестируемого соединения в первые недели эксперимента можно снизить частоту этой манипуляции до 1 раза в 2 нед.
Потребление корма и воды у кроликов достаточно трудно регистрировать, так как животные часто разбрасывают корм и «играют» с поилками, что приводит к потере корма и воды. При оценке потребления воды необходимо предусмотреть надежное закрепление поилок. Одним из возможных подходов к оценке потребления корма является ежедневное визуальное наблюдение за его использованием.
Сбор биологических образцов
Сбор крови. Кровь у кроликов обычно собирают из крупных легкодоступных краевых ушных вен. Для облегчения процедуры животное помещают в специальный бокс для фиксации, так что с внешней стороны бокса оказывается только голова кролика. Место введения иглы дезинфицируют. Для расширения сосудов можно использовать лампу в качестве источника тепла. Легкое раздражение пальцами кончика уха также увеличивает кровоток и облегчает сбор крови. Проксимальнее места укола может быть наложена скрепка, выполняющая роль жгута, либо сосуд можно зажать пальцем. При необходимости многократного забора крови в течение одного дня (например, для отбора проб при оценке фармакокинетических параметров) в ушные вены могут быть вставлены катетеры, которые фиксируют пластырем [1].
Сбор мочи. Наиболее распространенный метод сбора мочи — помещение животных в метаболические клетки из нержавеющей стали, где моча и фекалии разделяются, максимально предотвращая загрязнение образца мочи. Использование метаболических клеток позволяет измерять суточный диурез. В течение суток животное имеет доступ к корму и воде, так как конструкция метаболических клеток позволяет минимизировать попадание частиц корма в образцы мочи [1]. Однако метаболические клетки для кроликов довольно громоздки по сравнению с аналогичными устройствами для грызунов, и для размещения клеток для кроликов требуется много места. К тому же в большинстве случаев для анализа требуется небольшое количество мочи, а получить от кролика при посадке в метаболическую клетку на непродолжительное время (до 4 ч) образец мочи не всегда удается даже с использованием водной нагрузки. Поэтому еще одним неинвазивным способом сбора мочи является процедура, при которой образец мочи получают путем мягкого надавливания на область мочевого пузыря животного. Данная процедура более успешна, если животное предварительно к ней приучено и соответственно не испытывает стресса при фиксации.
Если загрязнение образца фекалиями и другими материалами неприемлемо, образцы мочи можно получить путем катетеризации уретры (осуществимо только у самцов) или прямой пункции мочевого пузыря (цистоцентез) [1].
Для процедуры катетеризации используют стерильные катетеры. Животное наркотизируют, фиксируют в положении лежа на спине и выдавливают пенис. Катетер (подойдет уретральный катетер для кошек) вводят в отверстие уретры и осторожно продвигают в уретру, а затем в мочевой пузырь. Когда начинается выделение мочи, к катетеру можно присоединить шприц и использовать его для аспирации мочи, оставшейся в мочевом пузыре [1].
Для сбора мочи непосредственно из мочевого пузыря (цистоцентез) через брюшную стенку животное следует успокоить и выбрить кожу по средней линии в паховой области. Мочевой пузырь, обнаруженный при пальпации в заднем отделе брюшной полости, прочно удерживается через брюшную стенку, при этом иглу вводят через брюшную стенку по средней линии под углом примерно 45°. Мочу собирают в шприц. Затем переносят в пробирку [1].
В исследованиях токсичности, в которых эвтаназия является конечной точкой, забор мочи из мочевого пузыря может быть осуществлен при вскрытии.
Ниже приведен пример комбинированного дизайна 90‑дневного исследования токсичности лекарственного препарата на кроликах.
Основные группы (в каждой 8 самцов+8 самок):
- 1‑я контрольная (плацебо);
- 2‑я «лекарственный препарат» (доза 1);
- 3‑я «лекарственный препарат» (доза 2);
- 4‑я «лекарственный препарат» (доза 3).
Группы отсроченного наблюдения (в каждой 5 самцов + 5 самок)*:
- 1А контрольная;
- 2А «лекарственный препарат» (доза 1);
- 3А «лекарственный препарат» (доза 2);
- 4А «лекарственный препарат» (доза 3).
Примечание. * При наличии научного обоснования (данные о потенциальной токсичности лекарственного препарата или близких по структуре соединений) и достаточного количества исторических данных лаборатории можно снизить количество животных в группах отсроченного наблюдения (например, контроль и максимальная доза).
Ежедневное пероральное введение препарата или плацебо всем животным в течение 90 дней, эвтаназия всех животных основных групп на 91‑й день, животных групп отсроченного наблюдения на 120‑й день.
Объем исследований:
- клиническое наблюдение ежедневно;
- клинический осмотр до введения и далее еженедельно;
- определение динамики массы тела животных (регистрация до введения, далее еженедельно);
- оценка потребления корма и воды (регистрация до введения, далее еженедельно);
- клинический анализ крови (до введения, 30 дней введения, 90 дней введения, по окончании периода отсроченного наблюдения);
- определение показателей гемостаза (до введения, 30 дней введения, 90 дней введения, по окончании периода отсроченного наблюдения);
- биохимический анализ крови (до введения, 30 дней введения, 90 дней введения, по окончании периода отсроченного наблюдения);
- анализ цитологического состава костного мозга (в случае выявления существенных отклонений в клиническом анализе крови) при эвтаназии;
- общий анализ мочи (до введения, 29 дней введения, 89 дней введения, по окончании периода отсроченного наблюдения);
- взвешивание органов при некропсии;
- гистологическое исследование внутренних органов23;
- оценка местно-раздражающего действия по данным патоморфологического исследования.
В рамках исследования могут быть проведены:
- во‑первых, оценка иммунотоксических свойств. Включает анализ клинических и биохимических показателей крови, патолого-анатомическое исследование органов иммунной системы (тимус, селезенка, лимфатические узлы), гистологическое исследование органов (тимус, селезенка, лимфатические узлы, костный мозг), оценка массовых коэффициентов органов (тимус, селезенка)24;
- во‑вторых, оценка репродуктивной (генеративной) токсичности. У животных, подлежащих эвтаназии на 91‑й день эксперимента и на 120‑й день, проводятся патолого-анатомическое исследование органов репродуктивной системы; оценка массовых коэффициентов семенников и яичников; гистологическое исследование органов репродуктивной системы; оценка морфофункционального состояния сперматозоидов. При необходимости спермограмма у самцов может быть проанализирована несколько раз, на более ранних этапах исследования;
- в‑третьих, изучение возможных канцерогенных свойств. Предварительная оценка возможных канцерогенных свойств включает выявление любых новообразований в ходе клинических осмотров, патолого-анатомическое исследование, вырезку и фиксацию новообразований для последующего гистологического и/или иммуногистохимического исследования;
- в‑четвертых, оценка фармакологической безопасности. Проводится оценка фармакологический безопасности в отношении дыхательной, сердечно-сосудистой и центральной нервной систем (см. раздел «Фармакологическая безопасность»);
- в‑пятых, оценка фармакокинетических и токсикокинетических параметров. После первого введения препарата и после последнего на 10 временных точках забираются образцы крови для оценки концентрации активного вещества в крови и расчета фармакокинетических параметров.
Генотоксичность и канцерогенность
Генотоксичность. Для новых молекул необходимо проведение исследований генотоксичности, которые регламентируются ГОСТом Р 57130–201625 и руководством ICH S226.
Исследования генотоксичности in vivo проводятся для двух разных тканей, обычно тесты включают микроядерную пробу с использованием гемопоэтических клеток грызунов, в качестве второго анализа может использоваться анализ поломки нитей ДНК в печени.
Для определения кластогенов применимы либо анализ хромосомных аберраций, либо измерение микроядерных полихроматических эритроцитов в костном мозге in vivo. Для проведения микроядерной пробы в костном мозге в качестве модели подходят и крысы, и мыши. Микроядра также можно исследовать в незрелых (например, полихроматических) эритроцитах в периферической крови мышей либо в новообразованных ретикулоцитах в крови крыс. Аналогичным образом также могут использоваться незрелые эритроциты животных любого другого вида, характеризующиеся аналогичной чувствительностью к определению индукторов кластогенов/анеуплоидии в костном мозге или периферической крови. Во втором анализе in vivo в качестве суррогатной конечной точки проводят оценку повреждения ДНК. Исследования с наиболее полно опубликованным опытом и рекомендациями в рамках протоколов включают анализы поломки нитей ДНК, в том числе единичной клетки методом гель-электрофореза («комет-тест») и разрывов ДНК, анализы трансгенных мутаций на мышах in vivo и ковалентного связывания ДНК (любой из них может применяться во многих тканях), а также анализ репаративного синтеза ДНК в печени (анализ UDS).
В случае необходимости оценки генотоксичности in vivo на кроликах тесты для определения генотоксичности целесообразно проводить в рамках исследования токсических свойств. Здесь возможен забор материала при эвтаназии. В качестве тестов для оценки возможных генотоксических свойств может быть использован анализ частоты образования микроядер в костном мозге или периферической крови, а также «комет-тест», для проведения которого забирают образцы тканей от нескольких органов.
Канцерогенность. Исследования канцерогенных свойств новых лекарственных средств проводятся с целью выявления потенциального канцерогенного действия исследуемого вещества у лабораторных животных и возможного риска для человека. Любые факты, свидетельствующие о вероятности такого эффекта, полученные в ходе лабораторных, токсикологических исследований и клинического применения, могут обусловливать необходимость проведения исследований канцерогенных свойств. В общем случае исследования канцерогенных свойств проводят на мышах и/или крысах при многократном введении лекарственного средства на протяжении средней продолжительности жизни животного с регистрацией и последующим сравнением частоты развития новообразований в контрольной и экспериментальных группах27, 28. Доклинические исследования канцерогенности на кроликах не проводят. Однако если на кроликах запланировано длительное исследование токсичности, в данном случае в качестве дополнительных параметров может быть включен мониторинг всех возникших в период введения и отсроченного наблюдения новообразований с их последующей морфологической оценкой. Данная информация может быть полезна при оценке риска канцерогенности тестируемого соединения. Одним из способов оценки возможного канцерогенного потенциала и/или токсических эффектов может быть прижизненное взятие материала посредством биопсии.
Репродуктивная и онтогенетическая токсичность
Изучение репродуктивной токсичности включает оценку влияния тестируемого соединения на фертильность, раннее эмбриональное развитие, эмбриофетальное, пренатальное и постнатальное развитие, влияние на развитие неполовозрелого потомства.
Для большинства фармацевтических препаратов обычно подходит трехэтапный дизайн исследований репродуктивной токсичности, хотя можно комбинировать эти дизайны с целью сокращения количества используемых животных. Дизайны исследований по влиянию на фертильность и раннее эмбриональное развитие (FEED), эмбриофетальное развитие (EFD) и пре- и постнатальное развитие (PPND), а также их варианты и комбинации описаны в руководстве ICH S5(R3)29 (в приложении 1). При выборе дизайна(ов) исследования следует учитывать все имеющиеся фармакологические, токсикокинетические и токсикологические данные о препарате.
В исследованиях токсичности при многократном введении может быть проведена оценка репродуктивной системы у самцов и самок по результатам стандартного гистопатологического исследования органов репродуктивной системы. Такая оценка считается сопоставимой по чувствительности к выявлению токсического действия на репродуктивные органы животных со специальными исследованиями фертильности30.
Хотя самым распространенным биологическим видом при проведении исследований являются крысы в силу практичности, сравнимости с другими результатами, полученными для данного вида животных, а также при большой базе накопленных знаний по данному биологическому виду, полученные на другом виде животных результаты могут дать дополнительную информацию для прогнозирования рисков репродуктивной токсичности при клиническом применении.
Для оценки влияния соединений на эмбриофетальное развитие (EFD) обычно используют второй вид млекопитающих, не являющийся грызунами, хотя есть и исключения, например, вакцины и биофармацевтические препараты. При тестировании вакцин выбранный вид животных должен демонстрировать иммунный ответ на вакцину. Тип проводимого исследования и выбор вида животных должны быть обоснованы с учетом наблюдаемого иммунного ответа и возможности введения соответствующей дозы. Как правило, в исследованиях репродуктивной токсичности вакцин используются кролики, крысы или мыши31.
Кролики занимают важное место в истории исследований репродуктивной токсичности благодаря своей чувствительности к веществу, оказывающему тератогенное действие у человека, талидомиду. Кролики были единственным видом животных, не являющихся приматами, у которых были обнаружены дефекты, очень похожие на те, что наблюдались у людей [45–47].
Именно после талидамидовой трагедии появились нормативные требования к оценке онтогенетической токсичности, согласно которым исследуемое вещество необходимо тестировать на одном виде грызунов и на одном виде, не относящимся к грызунам, при этом кролик часто является предпочтительным. Для кроликов существует большая база исторических контрольных данных, помогающая отличать аномалии плода, вызванные ведением исследуемого вещества, от спонтанно возникающих фоновых аномалий [48].
К настоящему моменту времени проведено большое количество исследований с использованием крыс и кроликов, что позволяет сравнить результаты онтогенетической токсичности одних и тех же субстанций, проведенных на этих двух видах животных, и ответить на ряд вопросов. Например, какой вид является наиболее чувствительным для обнаружения потенциальной токсичности соединения? Существуют ли ситуации, в которых достаточно тестирования на одном виде? Сравнение стало возможным благодаря использованию на крысах и кроликах стандартных протоколов исследований. Данные при исследовании крыс и кроликов сравнивали на основе фармакокинетических параметров. Таким образом, было проанализировано 379 соединений. В подавляющем большинстве случаев (83%) наименьшие дозы, вызывающие нежелательные эффекты на эмбриофетальное развитие у крыс и кроликов, были в пределах одного порядка (различались менее чем в 10 раз) при сравнении на основе фармакокинетических параметров. К 13,5% соединений были более чувствительны кролики, а к 3,5% — крысы (при сравнении на основе системной экспозиции). При оценке на основе преобразования эквивалентной дозы для человека с использованием стандартных коэффициентов крыса и кролик были одинаково чувствительны. Относительная степень эмбриофетальной токсичности при наличии материнской токсичности не различалась между видами. Сделан вывод, что для отдельных соединений исследования влияния на эмбриофетальное развитие на двух видах имеют дополнительную ценность при прогнозировании возможных рисков для человека, чем исследования на одном виде животных [49].
В дополнение к преимуществам крыс в плане их использования в исследованиях репродуктивной и онтогенетической токсичности (а именно хорошая репродуктивная способность, короткий срок беременности, большие размеры групп и помета, возможность использования для всех типов исследований репродуктивной токсичности, доступность в лабораториях, исторические справочные данные) достоинством кроликов является возможность многократных отборов образцов спермы32. В исследованиях генеративной функции важно, что сперму кролика можно относительно легко собрать и оценить фертильность в контролируемых условиях с помощью искусственного осеменения, тем самым обеспечив прямое сравнение с анализом спермы человека, что является основным компонентом в оценке репродуктивной функции у мужчин [48].
На кроликах можно оценить большинство, если не все, репродуктивные и токсикологические параметры, которые можно исследовать на более крупных животных, включая оценку спермограммы у самцов, фертильности, а также уровня половых гормонов в крови. Важным преимуществом кроликов по сравнению с грызунами является возможность многократной оценки морфологии репродуктивных органов самцов у одного и того же животного путем взятия биопсии, а также то, что кроликам можно проводить искусственное осеменение. Самка кролика имеет предсказуемый репродуктивный цикл и может быть искусственно осеменена во время тестирования на фертильность [48, 50]. Искусственное осеменение также может иметь практическую ценность при планировании масштабных исследований, поскольку овуляцию у самок можно вызвать в любой желаемый день с помощью гормональных препаратов [51].
В сравнении с грызунами висцеральный желточный мешок кролика — преплацентарный орган и экстраэмбриональные оболочки имеют большее сходство с таковыми у человека [48]. Кроме того, у кроликов по сравнению с грызунами плацентарный перенос антител более близок к таковому у приматов, что важно при тестировании вакцин33.
Наиболее часто в исследованиях онтогенетической токсичности за рубежом используются новозеландские кролики, которые, по‑видимому, чаще всего применяются в США. Для этой породы накоплен большой объем исторических данных [52]. Другие породы, такие как голландский кролик, гималайский и японский белый, также используются во многих лабораториях. Общие характеристики воспроизводства кроликов разных пород сходны [48].
В исследованиях репродуктивной токсичности кроликам можно вводить вещества различными путями, включая внутрижелудочное, ингаляционное, накожное, различные виды парентеральных введений. В отличие от грызунов кроликам можно вводить пероральные лекарственные формы без разрушения целостности капсул/таблеток, что делает в некоторых случаях этих животных незаменимой моделью для исследований токсичности модифицированных лекарственных форм.
Благодаря размерам кролики хорошо подходят для тестирования противозачаточных средств, которые вводятся вагинально.
На кроликах можно оценивать различные токсические эффекты в отношении материнского организма. Примеры методов, которые вполне применимы для кроликов, включают мониторинг артериального давления, частоты сердечных сокращений, дыхательной функции у животных в сознании, а также различные ультразвуковые исследования (например, подтверждение беременности). В последнее время получают широкое распространение методы телеметрического мониторинга физиологических параметров, что способствует получению данных без артефактов, вызванных манипуляциями с животными и стрессом [51].
Немаловажным фактором в исследованиях репродуктивной токсичности на кроликах является возможность одновременной оценки фармакокинетических и токсикокинетических параметров, так как на кроликах, в отличие от грызунов, от одного животного можно получить достаточное количество биоматериала.
Следует отметить, что даже если фармакокинетические и токсикокинетические данные были получены в ходе исследований общей токсичности, учитывая возможность значительных изменений параметров фармакокинетики при беременности, рекомендуется определить, влияет ли беременность на экспозицию. В случае если выбор дозы основан на соотношении экспозиции, токсикокинетические данные, полученные на беременных самках, необходимы. При этом нужно обосновать день/дни отбора проб. В ряде случаев определение концентрации лекарственного препарата в эмбрионе или плоде может облегчить интерпретацию противоречивых данных. Эта информация может быть получена в отдельном исследовании для определения фактического воздействия. Также может понадобиться оценка экскреции с молоком (путем отбора проб молока или подтверждения воздействия на потомство в период до отъема от матери)34.
При планировании исследований репродуктивной токсичности на кроликах нужно учитывать ряд факторов. Кролики имеют ограниченное применение для тестирования чужеродных белков, поскольку эти белки могут давать сниженный фармакологический эффект или вообще не оказывать действие на кроликов вследствие потенциального влияния иммуногенности. По сравнению с крысами для кроликов исторические данные по фертильности и исследования онтогенетической токсичности не столь обширны. Общее физическое состояние кроликов трудно контролировать по клиническим признакам. У кроликов могут наблюдаться самопроизвольные аборты. Иногда развиваются желудочно-кишечные расстройства (например, при введении некоторых антибиотиков)35.
Кроме того, у кроликов могут развиваться желудочно-кишечные расстройства, когда тестируемое соединение вводят через желудочный зонд. Эта желудочно-кишечная дисфункция может привести к полному аборту помета и/или нарушениям развития у потомства. Часто крольчихи отказываются от корма в течение нескольких дней на поздних сроках беременности. Во многих случаях это вызывает спонтанный аборт как косвенное следствие материнской анорексии, хотя у некоторых животных беременность может протекать нормально, несмотря на несколько дней ограниченного потребления корма. Некоторые антибиотики также могут нарушить кишечную флору и привести к нарушениям внутриутробного развития [48].
Очевидно также, что исследования на кроликах требуют большего количества тестируемого соединения, чем сопоставимые исследования на мышах или крысах. Количество тестируемого соединения можно несколько уменьшить, используя кроликов мелких пород, таких как голландский кролик. Для очень дорогих тестируемых соединений использование кроликов мелких пород может привести к значительной экономии [48].
Дизайн исследования по влиянию на эмбриофетальное развитие на кроликах сходен с таковым для крыс, за исключением того, что введение тестируемого соединения проводится в период с 6–7‑го по 19‑й день беременности (у крыс с 6–7‑го по 15–17‑й день), а извлечение плодов проводится на 28–29‑й день беременности (у крыс на 20–21 или 17–18‑й)36.
Возможно использование комбинированных дизайнов, объединяющих несколько исследований репродуктивной токсичности. Например, объединение исследований по влиянию на фертильность и раннее эмбриональное (FEED), а также на эмбриофетальное развитие (EFD). Цель комбинированного исследования FEED/EFD состоит в том, чтобы оценить токсические эффекты, возникающие в результате введения препарата до спаривания (самцы/самки), во время спаривания, в период имплантации и до конца органогенеза. Этот дизайн чаще всего используется в исследованиях на грызунах, хотя его можно применять и в экспериментах на негрызунах. Такой комбинированный подход можно применять для самцов/самок, но доступен и отдельный вариант только для самок, когда фертильность самцов оценивалась в отдельном эксперименте, например, в исследовании токсичности при многократном введении. В этом случае в комбинированном исследовании FEED/EFD будут использоваться не получающие препарат самцы только для спаривания37.
Прежде чем приступать к проведению исследования EFD проводят предварительные опыты по подбору доз для основного эксперимента (dose rage-finding). Следует отметить, что такие исследования необходимы для оценки токсичности новых веществ, для которых нет никаких предварительных данных по влиянию на EFD. Для такого эксперимента формируют 5 групп по 5 беременных самок в каждой (одна группа контрольная). Введение тестируемого соединения с 7‑го по 19‑й день беременности. Клиническое наблюдение проводят дважды в день. Масса тела регистрируется на 0, 7, 10, 13, 16, 20, 24 и 29‑й день беременности. Кесарево сечение с последующей оценкой репродуктивной системы самок и морфологии плодов проводят на 29‑й день [1].
В основном исследовании используется 4 группы по 12 беременных самок в каждой (одна группа контрольная). Введение тестируемого соединения с 7‑го по 19‑й день беременности. Клиническое наблюдение проводят дважды в день. Масса тела регистрируется на 0, 7, 10, 13, 16, 20, 24 и 29‑й день беременности. Кесарево сечение с последующей оценкой репродуктивной системы самок и морфологии плодов выполняют на 29‑й день [1].
Нейротоксичность
При оценке влияния тестируемого соединения изучаются возможные негативные влияния на развитие центральной нервной системы.
Кролики становятся все более широко используемой моделью для исследования нейротоксичности в процессе онтогенеза. Для проведения испытаний предпочтительным видом животных являются крысы, однако при необходимости можно использовать другие виды животных. В экспериментах на крысах исследуемое вещество или растворитель вводят беременным самкам крыс не менее одного раза в день с момента имплантации (6‑й день беременности) и на протяжении лактации (до 21‑го дня после родов) для воздействия исследуемого вещества во время пре- и постнатального развития нервной системы детенышей. При использовании других видов животных длительность введения вещества необходимо скорректировать для обеспечения выявления нейротоксичности в ранние периоды развития мозга (то есть соответствующие пренатальному и раннему постнатальному развитию мозга человека).
Адаптация протоколов, обычно используемых для оценки нейротоксичности в процессе онтогенеза у крыс, для кроликов может быть полезна в конкретных случаях, когда на кроликах лучше воспроизводятся токсические эффекты соединения.
Основными преимуществами использования видов кроликов в исследованиях нейротоксичности в процессе онтогенеза являются: 1) большее сходство в отношении развития мозга и сроков созревания белого вещества с людьми, чем с грызунами, поскольку у кроликов миелинизация начинается постнатально; 2) более сложная структура мозга, чем у грызунов; 3) большее сходство с человеком, чем с грызунами, с точки зрения экстраэмбриональных оболочек, развития плаценты и изменений кровообращения во время внутриутробного развития. С практической точки зрения доступность атласа мозга кролика с 2013 г. [53] и наличие справочной базы данных in vivo, включая общедоступный набор данных по конечным точкам, облегчают использование этой модели для оценки нейротоксического влияния на развитие плода.
В связи с этим группой ученых с участием европейских и американских специалистов разработано и опубликовано 14 протоколов для оценки побочных эффектов веществ на развитие нервной системы у кроликов. Эти протоколы включают методы как in vitro, так и in vivo. Представлены ожидаемые контрольные значения и их вариации, рассмотрены наиболее распространенные проблемы, связанные с каждым протоколом, и пути их решения. Таким образом, разработаны надежные экспериментальные подходы, которые можно применять для оценки нейротоксичности в процессе онтогенеза с использованием кроликов [54].
Местная переносимость (местно-раздражающее действие)
Местная переносимость лекарственного препарата при его планируемом пути введения может быть изучена во время исследований общей токсичности, выполнение отдельного исследования местной переносимости лекарственного препарата не требуется38. Соответственно оценка местной переносимости должна включаться в дизайн токсикологического исследования.
Как описано выше (см. раздел «Фармакодинамика»), кролики используются для оценки раздражающего действия тестируемых соединений на глаза и кожу39, 40.
Заключение
Кролики широко используются для оценки безопасности субстанций и лекарственных препаратов. Появление генетически модифицированных кроликов расширило возможности применения этих животных для моделирования различных патологических состояний.
При планировании экспериментов с использованием кроликов необходимо принимать во внимание как их преимущества, так и недостатки.
Преимуществами являются их относительно небольшие размеры и простота содержания. На кроликах можно проводить практически любые экспериментальные манипуляции. При этом требуется умеренное количество тестируемых субстанций, что немаловажно, особенно в случае, если эти вещества имеют высокую стоимость. В исследованиях репродуктивной токсичности важными преимуществами кролика относительно более крупных животных являются короткий период беременности, хорошая репродуктивная способность. Кролики чувствительны к тератогенам человека и, как правило, являются предпочтительным видом негрызунов для исследований влияния на эмбриофетальное развитие. В научной литературе имеется достаточное количество исторических и справочных материалов по анатомии, физиологии, патофизиологии этих животных.
Среди недостатков кроликов как лабораторных животных можно выделить высокую подверженность нарушениям функции желудочно-кишечного тракта. Кролики очень чувствительны к изменениям рациона питания. Для кроликов должны быть созданы условия, позволяющие ежедневно и активно двигаться. При проведении манипуляций с кроликами очень важно делать это правильно, чтобы не причинить животному вред.
При планировании исследований по изучению токсических свойств при многократном введении, особенно при планировании длительных экспериментов (более 90 дней введения), следует учитывать вероятность того, что в ходе эксперимента у кроликов могут спонтанно развиваться некоторые патологические проявления. Это может потребовать либо применения медикаментозной терапии, либо исключения животного из эксперимента. Поэтому целесообразно включение не менее 8 самцов и 8 самок в каждую группу. Если предусмотрены группы отсроченного наблюдения, то количество животных должно быть достаточным для оценки возможных отсроченных эффектов.
При планировании и проведении экспериментов должны быть предприняты все усилия для реализации принципов 3Rs. Сокращения количества кроликов в токсикологических исследованиях можно также добиться, используя комбинированные дизайны. Всесторонний анализ научных данных при планировании и предварительной разработке программы доклинических исследований способствует созданию оптимизированных дизайнов, позволяющих не только снизить количество животных в экспериментах, но и количество проводимых манипуляций, что важно для поддержания благополучия экспериментальных животных.
Сведения о конфликте интересов
В.Г. Макаров является главным редактором журнала «Лабораторные животные для научных исследований». М.Н. Макарова является членом редакционной коллегии журнала «Лабораторные животные для научных исследований».
Вклад авторов
М.Н. Макарова — поиск, обобщение данных литературы, написание и редактирование текста рукописи.
В.Г. Макаров — критический пересмотр текста и одобрение окончательного варианта рукописи для публикации.
- Решение Совета ЕЭК от 03.11.2016 N 78 О правилах регистрации и экспертизы лекарственных средств.
- Решение Коллегии ЕЭК от 26.11.2019 № 202 Об утверждении Руководства по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов.
-
OECD Test No. 404. OECD GUIDELINE FOR THE TESTING OF CHEMICALS. Acute Dermal Irritation/Corrosion. 2002.
- OECD Test No. 405. OECD GUIDELINE FOR THE TESTING OF CHEMICALS. In Vivo Eye Irritation/Serious Eye Damage. 2021.
- ОФС.1.2.4.0005.15 Пирогенность. Государственная фармакопея. Издание 14‑е. Том I. Москва, 2020.
- ОФС.1.2.4.0001.15 Биологические испытания инсулина. Государственная фармакопея. Издание 14‑е. Том I. Москва, 2020.
- ГОСТ Р 56700–2015 Лекарственные средства для медицинского применения. Доклинические фармакологические исследования безопасности.
- ICH S7A Safety Pharmacology studies for human pharmaceuticals.
- ISH S7B The non-clinical evaluation of the potential for delayed ventricular repolarization (QT interval prolongation) by human pharmaceuticals.
- ICH S7A Safety Pharmacology studies for human pharmaceuticals.
-
Решение Коллегии ЕЭК от 26.11.19 № 202 Об утверждении Руководства по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов.
- Там же.
-
Руководство по проведению доклинических исследований лекарственных средств. Часть первая. Миронов А.Н. Москва: Гриф и К, 2012. 944 с.
-
OECD Test No. 420. OECD GUIDELINE FOR THE TESTING OF CHEMICALS. Acute Oral Toxicity — Fixed Dose Procedure. 2001.
-
OECD Test No. 423. OECD GUIDELINE FOR THE TESTING OF CHEMICALS. Acute Oral Toxicity — Acute Toxic Class Method. 2001.
-
ГОСТ 32296–2013 Методы испытаний по воздействию химической продукции на организм человека.
-
ГОСТ 32644–2014 Острая пероральная токсичность — метод определения класса острой токсичности.
-
Globally Harmonised System of classification and labelling of chemicals (GHS). Fifth revised edition // New York and Geneva: United Nations. 2013. 530 р.
-
OECD Test N. 425. OECD GUIDELINE FOR THE TESTING OF CHEMICALS. Acute Oral Toxicity: Up-and-Down Procedure. Adopted: 16 October 2008 Corrected: 30 June 2022.
-
ГОСТ 34557–2019 Испытания по оценке острой токсичности при внутрижелудочном поступлении. Метод «вверх и вниз».
-
Руководство по проведению доклинических исследований лекарственных средств. Часть первая. Миронов А.Н. Москва: Гриф и К, 2012. 944 с.
- OECD Test N. 409 OECD GUIDELINE FOR THE TESTING OF CHEMICALS. Repeated Dose 90‑day Oral Toxicity Study in Non-Rodents. 1998.
-
Рекомендация Коллегии ЕЭК № 10 от 21 мая 2020 г. о Руководстве по проведению доклинических исследований токсичности при повторном (многократном) введении действующих веществ лекарственных препаратов для медицинского применения.
- ICH S8 Immunotoxicity studies for human pharmaceuticals.
- ГОСТ Р 57130–2016 Лекарственные средства для медицинского применения. Исследование генотоксичности и интерпретация полученных данных.
-
ICH guideline S2(R1) on genotoxicity testing and data interpretation for pharmaceuticals intended for human use. 2012.
-
ГОСТ Р 57146–2016 Лекарственные средства для медицинского применения. Изучение канцерогенности лекарственных средств и вспомогательных веществ.
-
ICH S1A Guideline on the need for carcinogenicity studies of pharmaceuticals.
- ICH S5(R3) Detection of Reproductive and Developmental Toxicity for Human Pharmaceuticals. Step 4 Version. 18 February 2020.
-
Решение Коллегии ЕЭК от 26.11.19 № 202 Об утверждении Руководства по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов.
-
ICH S5(R3) Detection of Reproductive and Developmental Toxicity for Human Pharmaceuticals. Step 4 Version. 18 February 2020.
- Там же.
- Там же.
- Там же.
- Там же.
- Там же.
- Там же.
-
Решение Коллегии ЕЭК от 26.11.19 № 202 Об утверждении Руководства по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов.
-
OECD Test N. 404. OECD GUIDELINE FOR THE TESTING OF CHEMICALS. Acute Dermal Irritation/Corrosion. 2002.
- OECD Test N. 405. OECD GUIDELINE FOR THE TESTING OF CHEMICALS. In Vivo Eye Irritation/Serious Eye Damage. 2021.
Список источников
-
Animal models in toxicology. Edited by Gad S.C. 2nd ed. CRC Press, 2007. 933 p.
-
Юращик С.В. Кролиководство. Учебное пособие для высших учебных заведений. Гродно: УО «ГГАУ», 2005. 412 с. [Yurashhik S.V. Krolikovodstvo. Uchebnoe posobie dlya vy’sshix uchebny’x zavedenij. Grodno: UO “GGAU”, 2005. 412 p. (In Russ.)].
-
Lee M., Hwang J.H., Lim K.M. Alternatives to In Vivo Draize Rabbit Eye and Skin Irritation Tests with a Focus on 3D Reconstructed Human Cornea-Like Epithelium and Epidermis Models // Toxicol Res. 2017. Vol. 33. N. 3. P. 191–203. DOI: 10.5487/TR.2017.33.3.191.
-
Endo A. A historical perspective on the discovery of statins // Proc. Jpn. Acad. Ser B Phys. Biol. Sci. 2010. Vol. 86. N. 5. P. 484–493. DOI: 10.2183/pjab.86.484.
-
Anitschkow N. Über die Veränderungen der Kaninchenaorta bei experimenteller Cholesterinsteatose // Beitr. Pathol. Anat. 1913. Vol. 56. P. 379–404.
-
Zhang J., Niimi M., Yang D. et al. Deficiency of Cholesteryl Ester Transfer Protein Protects Against Atherosclerosis in Rabbits // Arterioscler. Thromb. Vasc. Biol. 2017. Vol. 37. N. 6. P. 1068–1075. DOI: 10.1161/ATVBAHA.117.309114.
-
HPS3/TIMI55‑REVEAL Collaborative Group; Writing Committee; Sammons E., Hopewell J.C., Chen F. et al. REVEAL Collaborative Group. Long-term safety and efficacy of anacetrapib in patients with atherosclerotic vascular disease // Eur. Heart J. 2022. Vol. 43. N. 14. P. 1416–1424.
DOI: 10.1093/eurheartj/ehab863.
-
Kamaruzaman N.A., Kardia E., Kamaldin N., Latahir A.Z., Yahaya B.H. The rabbit as a model for studying lung disease and stem cell therapy // Biomed. Res. Int. 2013. Vol. 691830. DOI: 10.1155/2013/691830.
-
Sebbag L., Mochel J.P. An eye on the dog as the scientist’s best friend for translational research in ophthalmology: Focus on the ocular surface // Med.Res. Rev. 2020. Vol. 40. N. 6. P. 2566–2604. DOI: 10.1002/med.21716.
-
Zernii E.Y., Baksheeva V.E., Iomdina E.N. et al. Rabbit Models of Ocular Diseases: New Relevance for Classical Approaches // CNS Neurol. Disord. Drug Targets. 2016. Vol. 15. N. 3. P. 267–291. DOI: 10.2174/1871527315666151110124957.
-
Okumura N., Matsumoto D., Fukui Y., Teramoto M. et al. Feasibility of cell-based therapy combined with descemetorhexis for treating Fuchs endothelial corneal dystrophy in rabbit model // PLoS One. 2018. Vol. 13. N. 1. P. e0191306. DOI: 10.1371/journal.pone.0191306.
-
Kinoshita S., Koizumi N., Ueno M. et al. Injection of cultured cells with a ROCK inhibitor for bullous keratopathy // N. Engl. J. Med. 2018. Vol. 378. P. 995–1003.
-
Esteves P.J., Abrantes J., Baldauf H.M., BenMohamed L. et al. The wide utility of rabbits as models of human diseases // Exp.Mol. Med. 2018. Vol. 50. N. 5. P. 1–10. DOI: 10.1038/s12276‑018‑0094‑1.
-
Mage R.G., Esteves P.J., Rader C. Rabbit models of human diseases for diagnostics and therapeutics development // Dev. Comp. Immunol. 2019. Vol. 92. P. 99–104. DOI: 10.1016/j.dci.2018.10.003.
-
Christensen N.D. Cottontail rabbit papillomavirus (CRPV) model system to test antiviral and immunotherapeutic strategies // Antivir. Chem. Chemother. 2005. Vol. 16. N. 6. P. 355–362. DOI: 10.1177/095632020501600602.
-
Fitzgerald T.J. Experimental congenital syphilis in rabbits // Can J. Microbiol. 1985. Vol. 31. N. 9. P. 757–762. DOI: 10.1139/m85-142.
-
Wang Z., Zhang J., Li H., Li J. et al. Hyperlipidemia-associated gene variations and expression patterns revealed by whole-genome and transcriptome sequencing of rabbit models // Sci. Rep. 2016. Vol. 6. P. 26942. DOI: 10.1038/srep26942.
-
Fan J., Wang Y., Chen Y.E. Genetically Modified Rabbits for Cardiovascular Research // Front. Genet. 2021. Vol. 12. P. 614379. DOI: 10.3389/fgene.2021.614379.
-
Carneiro M., Rubin C.J., Di Palma F., Albert F.W. et al. Rabbit genome analysis reveals a polygenic basis for phenotypic change during domestication // Science. 2014. Vol. 345. N. 6200. P. 1074–1079. DOI: 10.1126/science.1253714.
-
Flisikowska T., Thorey I.S., Offner S., Ros F. et al.. Efficient immunoglobulin gene disruption and targeted replacement in rabbit using zinc finger nucleases // PLoS One. 2011. Vol. 6. N. 6. P. e21045. DOI: 10.1371/journal.pone.0021045.
-
Yan H., Niimi M., Matsuhisa F., Zhou H. et al. Apolipoprotein CIII Deficiency Protects Against Atherosclerosis in Knockout Rabbits // Arterioscler Thromb. Vasc. Biol. 2020. Vol. 40. N. 9. P. 2095–2107. DOI: 10.1161/ATVBAHA.120.314368.
-
Peng X. Transgenic rabbit models for studying human cardiovascular diseases // Comp. Med. 2012. Vol. 62. N. 6. P. 472–479.
-
Chentoufi A.A., Dasgupta G., Christensen N.D., Hu J. et al. A novel HLA (HLA-A*0201) transgenic rabbit model for preclinical evaluation of human CD8+ T cell epitope-based vaccines against ocular herpes // J. Immunol. 2010 Vol. 184. N. 5. P. 2561–2571. DOI: 10.4049/jimmunol.0902322.
-
Young S., Forsberg-Nilsson K., Good J.M., Lander E.S. et al. Rabbit genome analysis reveals a polygenic basis for phenotypic change during domestication // Science. 2014. Vol. 346. N. 6200. P. 1074–1079. DOI: 10.1126/science.1253714.
-
Fan J., Challah M., Watanabe T. Transgenic rabbit models for biomedical research: current status, basic methods and future perspectives // Pathol. Int. 1999. Vol. 49. N. 7. P. 583–594. DOI: 10.1046/j.1440-1827.1999.00923.x.
-
Mage R.G., Lanning D., Knight K.L. B cell and antibody repertoire development in rabbits: the requirement of gut-associated lymphoid tissues // Dev. Comp. Immunol. 2006. Vol. 30. N. 1–2. P. 137–153. DOI: 10.1016/j.dci.2005.06.017.
-
Weber J., Peng H., Rader C. From rabbit antibody repertoires to rabbit monoclonal antibodies // Exp. Mol. Med. 2017. Vol. 49. N. 3. P. e305. DOI: 10.1038/emm.2017.23.
-
Irwin S. Comprehensive observational assessment: Ia. A systematic, quantitative procedure for assessing the behavioral and physiologic state of the mouse // Psychopharmacologia. 1968. Vol. 13. N. 3. P. 222–257. DOI: 10.1007/BF00401402.
-
Moser V.C. Functional assays for neurotoxicity testing // Toxicol Pathol. 2011. Vol. 39. N. 1. P. 36–45. DOI: 10.1177/0192623310385255.
-
Mathiasen J.R., Moser V.C. The Irwin Test and Functional Observational Battery (FOB) for Assessing the Effects of Compounds on Behavior, Physiology, and Safety Pharmacology in Rodents // Curr. Protoc. Pharmacol. 2018. Vol. 83. N. 1. P. e43. DOI: 10.1002/cpph.43.
-
Palozi R.A.C., Guarnier L.P., Romão P.V.M., Nocchi S.R. et al. Pharmacological safety of Plinia cauliflora (Mart.) Kausel in rabbits // Toxicol Rep. 2019. Vol. 28. N. 6. P. 616–624. DOI: 10.1016/j.toxrep.2019.06.017.
-
Ellermann C., Wolfes J., Eckardt L., Frommeyer G. Role of the rabbit whole-heart model for electrophysiologic safety pharmacology of non-cardiovascular drugs // Europace. 2021. Vol. 23. N. 6. P. 828–836. DOI: 10.1093/europace/euaa288.
-
Avila A.M., Bebenek I., Bonzo J.A., Bourcier T. et al. An FDA/CDER perspective on nonclinical testing strategies: Classical toxicology approaches and new approach methodologies (NAMs) // Regul. Toxicol. Pharmacol. 2020. Vol. 114. P. 104662. DOI: 10.1016/j.yrtph.2020.104.
-
Murphy D.J. Assessment of respiratory function in safety pharmacology // Fundam. Clin. Pharmacol. 2002. Vol. 16. N. 3. P. 183–196. DOI: 10.1046/j.1472-8206.2002.00060.x.
-
Maurice D. The effect of the low blink rate in rabbits on topical drug penetration // J. Ocul. Pharmacol. Ther. 1995. Vol. 11. N. 3. P. 297–304. DOI: 10.1089/jop.1995.11.297.
-
Souhaili-el Amri H., Batt A.M., Siest G. Comparison of cytochrome P-450 content and activities in liver microsomes of seven animal species, including man // Xenobiotica. 1986. Vol. 16. N. 4. P. 351–358. DOI: 10.3109/00498258609043538.
-
Gram T.E., Schroeder D.H., Davis D.C., Reagan R.L., Guarino A.M. Enzymic and biochemical composition of smooth and rough microsomal membranes from monkey, guinea pig and mouse liver // Biochem Pharmacol. 1971. Vol. 20. N. 7. P. 1371–1381. DOI: 10.1016/0006-2952(71)90264-4.
-
Rocci M.L., Johnson N.F., Jusko W.J. Serum protein binding of prednisolone in four species // J. Pharm. Sci. 1980. Vol. 69. N. 8. P. 977–978. DOI: 10.1002/jps. 2600690831.
-
Рыбакова А.В., Макарова М.Н., Кухаренко А.Е., Вичаре A.С., Рюффер Ф-Р. Существующие требования и подходы к дозированию лекарственных средств лабораторным животным // Ведомости Научного центра экспертизы средств медицинского применения. 2018. Т. 8. № 4. C. 207–217. [Rybakova A.V, Makarova M.N., Kukharenko A.E. et al. Sushestvuyushie trebovaniya i podhody k dosirovaniyu lekarstvennih sredstv laboratornym zhivotnim // Vedomosti Nauchnogo tsentra ekspertizy sredstv meditsinskogo primeneniya. 2018. Vol. 8. N. 4. P. 207–217. (In Russ.)]. DOI: 10.30895/1991‑2919‑2018‑8‑4‑207‑217.
-
Acceptable Volumes for Drug Administration UCDAVIS. Office of research. URL: https://research.ucdavis.edu/policiescompliance/animal-care-use/iacuc/acceptable-volumes-for-drug-administration/ (дата обращения: 04.2023).
-
Washington State University Institutional Animal Care and Use Committee Guideline 10: Drug and Chemical Administration URL: https://iacuc.wsu.edu/documents/2018/09/guidelines-for-drug-and-chemical-administration.pdf/ (дата обращения: 04.2023).
-
Morton D.B., Jennings M., Buckwell A. et al. Joint Working Group on Refinement. Refining procedures for the administration of substances. Report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. British Veterinary Association Animal Welfare Foundation/Fund for the Replacement of Animals in Medical Experiments/Royal Society for the Prevention of Cruelty to Animals/Universities Federation for Animal Welfare // Lab. Anim. 2001. Vol. 35. N. 1. P. 1–41. DOI: 10.1258/0023677011911345.
-
Turner P.V., Brabb T., Pekow C., Vasbinder M.A. Administration of substances to laboratory animals: routes of administration and factors to consider // J. Am. Assoc. Lab. Anim. Sci. 2011. Vol. 50. N. 5. P. 600–613.
-
Чернышова А.В., Рощина Е.А., Алексеева Л.И., Кательникова А.Е., Макарова М.Н. Рекомендованные и максимально допустимые объемы для ректального и интравагинального введения лекарственных средств разным видам животных // Лабораторные животные для научных исследований. 2023. № 1. https://doi.org/10.57034/2618723X-2023‑01‑04. [Chernyshova A.V., Roshchina E.A., Alekseeva L.I., Katelnikova A.E., Makarova M.N. Rekomendovannie i maksimalnie dopustimie obiemi dlia rektalnogo i intravaginalnogo vvedeniya lekarstvennih sredstv raznim vidam zhivotnyh // Laboratornye zhivotnie dlia nauchnih issledovaniy. 2023. N. 1. (In Russ.)]. DOI: 10.57034/2618723X-2023‑01‑04.
-
Drobeck H.P., Coulston F., Cornelius D. Effects of thalidomide on fetal development in rabbits and on establishment of pregnancy in monkeys // Toxicol. Appl. Pharmacol. 1965. Vol. 7. P. 165–178. DOI: 10.1016/0041-008x(65)90086-4.
-
Fratta I.D., Sigg E.B., Maiorana K. Teratogenic effects of thalidomide in rabbits, rats, hamsters, and mice // Toxicol. Appl. Pharmacol. 1965. Vol. 7. P. 268–286. DOI: 10.1016/0041-008x(65)90095-5.
-
Schumacher H., Blake D.A., Gurian J.M., Gillette J.R. A comparison of the teratogenic activity of thalidomide in rabbits and rats // J. Pharmacol. Exp. Ther. 1968. Vol. 160. N. 1. P. 189–200.
-
Foote R.H., Carney E.W. The rabbit as a model for reproductive and developmental toxicity studies // Reprod. Toxicol. 2000. Vol. 14. N. 6. P. 477–493. DOI: 10.1016/s0890-6238(00)00101-5.
-
Theunissen P.T., Beken S., Beyer B.K., Breslin W.J. et al. Comparison of rat and rabbit embryo — fetal developmental toxicity data for 379 pharmaceuticals: on the nature and severity of developmental effects // Critical Reviews in Toxicology. 2016. Vol. 46. N. 10. P. 900–910.
-
Morton D. The use of rabbits in male reproductive toxicology // Environ. Health Perspect. 1988. Vol. 77. P. 5–9. DOI: 10.1289/ehp.88775.
-
Danielson M.K., Danielsson B.R., Marchner H., Lundin M. et al. Histopathological and hemodynamic studies supporting hypoxia and vascular disruption as explanation to phenytoin teratogenicity // Teratology. 1992. Vol. 46. N. 5. P. 485–497. DOI: 10.1002/tera.1420460513.
-
Palmer A.K. Spontaneous malformations of the New Zealand White Rabbit: the background to safety evaluation tests // Lab. Anim. Sci. 1968. Vol. 2. P. 195–206.
-
Muñoz-Moreno E., Arbat-Plana A., Batalle D., Soria G. et al. A Magnetic Resonance Image Based Atlas of the Rabbit Brain for Automatic Parcellation // PLoS One. 2013. Vol. 8. P. e67418. DOI: 10.1371/journal.pone.0067418.
- Pla L., Kühne B.A., Guardia-Escote L., Vázquez-Aristizabal P. et al. Protocols for the Evaluation of Neurodevelopmental Alterations in Rabbit Models In Vitro and In Vivo // Front. Toxicol. 2022. Vol. 22. N. 4. P. 918520. DOI: 10.3389/ftox.2022.918520.




