Метод прижизненной диагностики цилиарной активности многорядного столбчатого реснитчатого эпителия слизистой оболочки полости носа у лабораторных крыс
Барашкова С.В., Журавский C.Г., Алексеенко С.И. Метод прижизненной диагностики цилиарной активности многорядного столбчатого реснитчатого эпителия слизистой оболочки полости носа у лабораторных крыс. Лабораторные животные для научных исследований. 2018; 1. https://doi.org/10.29296/2618723X-2018-01-07
Резюме
Представлены результаты сравнительного исследования прижизненного цитологического материала многорядного столбчатого реснитчатого эпителия слизистой оболочки полости носа интактных взрослых крыс самцов стока Wistar (220–250 г), содержащихся в вивариях конвенционального типа (n=2) и SPF-категории (n=2). Интактная картина клеток многорядного столбчатого реснитчатого эпителия отмечена в материале животных SPF-статуса. У животных конвенционального вивария наблюдали проявления подострого воспаления и персистирования бактериальной инфекции. При этом имели место морфофункциональные признаки дегенерации цилиарного аппарата: укорочение, асинхронизм и неполный цикл биения цилий. Наилучшее качество цитологического материала при браш-биопсии in vivo было получено при использовании комбинированных цервикальных щеток «Cervex-Brush Combi» из полимерного материала, модифицированных путем тримминга щетинок центрального ершика.
Введение
Экспериментальные исследования, связанные с морфофункциональным анализом состояния многорядного столбчатого реснитчатого эпителия верхних дыхательных путей нацелены на изучение влияния лекарственных препаратов и фармакологических аддитивов на цилиарную активность [1–3]. Традиционно для этого используют метод культивирования реснитчатого эпителия иссеченной перегородки носа, эпителия трахеальных колец или эпителия дистальных отделов дыхательных путей в тонких срезах легочной ткани, полученных от умерщвленных животных [1, 2, 4, 5]. Особенность метода – необходимость затратной материально-технической базы на культивирование эпителиальных клеток in vitro, зависящих от таких факторов, как температура, влажность, pH, вязкость и ионный состав инкубационной среды [3]. При этом отсутствует возможность оценивать функцию и морфологию мукоцилиарной системы в экспериментах in vivo, моделирующих клинические условия.
Разработка метода получения в хроническом эксперименте in vivo на повседневно использующихся биологических тест-системах (лабораторных грызунах) нативного материала многорядного столбчатого реснитчатого эпителия позволит проводить динамическое наблюдение при экспериментальной патологии, скрининг фармакологических субстанций по цилиоактивным свойствам. Актуальность нашего эксперимента обусловлена также появлением перспективного направления топического применения вакцин, аэрозольных препаратов для коррекции генетических заболеваний, лечения опухолей носоглотки и легких [6, 7].
Цель исследования – разработка метода для изучения цилиарной активности многорядного столбчатого реснитчатого эпителия слизистой оболочки полости носа in vivo у лабораторных крыс.
Материал и методы
В работе использованы 4 крысы – самцы стока Wistar массой 220–250 г, содержащиеся в условиях конвенционального вивария (n=2; ПЛЖ «Рапполово», Ленинградская область) и вивария SPF-категории (n=2; ПЛЖ «Пущино», Московская область). Процедура браш-биопсии проводилась неоднократно у животных, находящихся в условиях общей анестезии при интраперитонеальном введении препарата «Золетил 100» (6 мг/кг) и ингаляционном введении воздушной смеси с 2,5% содержанием изофлюрана. Для выполнения браш-биопсии применяли различного вида инструментарий, доступный на рынке медицинских средств. Цитологический материал слизистой оболочки носовой перегородки и нижней носовой раковины получали на глубине 1–1,5 см от кожной части преддверия носа, ориентируясь на проекцию резцового сосочка и первого небного гребня – в зоне наибольшего представительства на слизистой оболочке полости носа многорядного столбчатого реснитчатого эпителия [8, 9].
При проведении браш-биопсии сравнивали качество материала, полученного при использовании интрадентальных ершиков Curaprox prime 0,6–2,2 мм с держателем (Curaprox, Германия), цитологических щеток Cervex-Brush Combi (Rovers Medical Devices, Нидерланды), цитологических щеток для эндоскопов Olympus (Olympus, Япония) (рис. 1). Весь имевшийся инструментарий предварительно модифицировали следующим образом: нейлоновые щетинки интрадентальных ершиков и цитологических щеток для эндоскопов обстригали ножницами до их основания, у цитологической щетки Cervex-Brush Combi удаляли боковые щетинки, центральный ершик разделяли пополам с помощью микротомного лезвия, оставляя одну рабочую поверхность, покрытую ворсинками, укороченными с помощью ножниц до основания, апикальный край оплавляли на открытом пламени горелки в течение 1 с. Стерилизация перед процедурой проводилась в этиловом спирте 95° в течение 40 мин.

После взятия материала кончик щетки споласкивался в пробирке Эппендорф с 0,5 мл физиологического раствора (37°С). Полученную суспензию в объеме 50 мкл немедленно наносили на предметное стекло и накрывали покровным стеклом. Визуальный анализ нативного материала проводился на микроскопе Nikon Eclipse E200 с дополнительной комплектацией для фазового контраста с объективами CFI Achromat DL ×40 и CFI Achromat ×100 oil (Nikon, Япония). Для каждого образца в режиме реального времени записывался цифровой видеофайл с частотой в среднем 76,5 кадров в секунду с помощью высокоскоростной цветной камеры Basler puA2500-14uc USB3.0. Морфометрическая обработка видеороликов осуществлялась в программе MMC Multimeter (MMCSoft, Россия). Оставшийся материал наносился на предметные стекла с помощью цитоцентрифуги Cyto-Tek (Sakura, Япония) и окрашивался гематоксилином Гарриса по Папаниколау и эозином-метиленовым синим по Май-Грюнвальду Гимза.
Результаты и обсуждение
Выполнение биопсии с помощью нейлоновых ершиков и браш-щеток для эндоскопов очень травматично для слизистой оболочки полости носа. Полученный материал имел выраженные артифициальные изменения в виде большого количества эритроцитов, мешающих проведению видеорегистрации, а также клетки низкого качества в связи с их механической деструкцией и дегенерацией (рис. 2, а). Кроме того, длина рабочей поверхности использованных инструментов не позволяла без дополнительной травмирующей компрессии преддверия достигать необходимого уровня глубины полости носа.
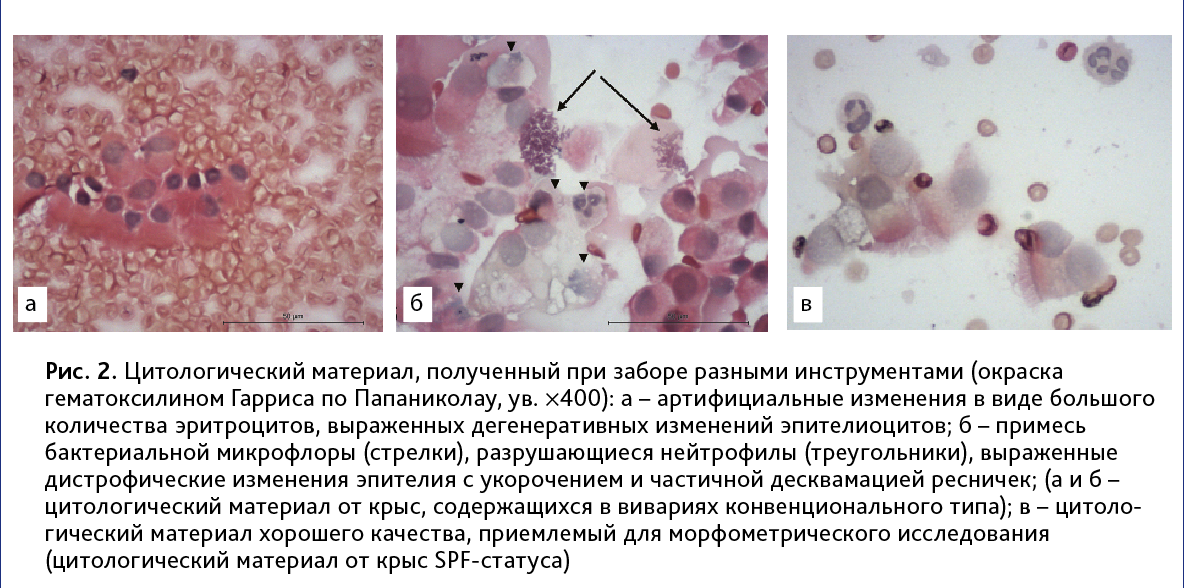
Наилучшие результаты были получены с помощью полимерных комбинированных гинекологических щеток Cervex-Brush Combi (Rovers Medical Devices, Нидерланды) после их модифицирования для наименьшего травмирования слизистой оболочки путем тримминга щетинок центрального ершика (см. рис. 1). Таким инструментом у взрослой крысы удалось изъять достаточный объем цитологического материала при минимальном загрязнении эритроцитарной массой и хорошей сохранности пластов клеток многорядного реснитчатого эпителия (рис. 2, в).
Обратим внимание, что цитологический материал крыс, содержащихся в условиях конвенционального вивария, во всех случаях показывал высокую бактериальную обсемененность, наличие нейтрофильного экссудата, выраженные реактивно-дистрофические изменения многорядного респираторного эпителия с укорочением и повышенным слущиванием цилий (рис. 2, б). Эти изменения расценивались как признаки текущего подострого воспаления. Двигательная активность цилиарного аппарата была зарегистрирована лишь на минимальном количестве клеток с явлениями асинхронизма, неполного цикла биения цилий, что не позволяло провести полноценной морфометрической оценки.
В образцах, полученных у животных SPF-статуса, отсутствовала микрофлора и элементы воспалительного экссудата. При морфометрическом анализе выявлена неравномерная частота биения ресничек в различных пластах в пределах диапазона нормальных значений (7,94–13,87 Гц). Различий в качестве полученного цитологического материала (визуальное состояние клеток эпителия, двигательная активность цилиарного аппарата) при браш-биопсиях, проводимых в условиях газовой и интраперитонеальной анестезии, выявлено не было.
Таким образом, в результате проведенного исследования удалось убедиться в возможности прижизненного получения и исследования цитологического материала многорядного столбчатого реснитчатого эпителия слизистой оболочки полости носа крыс. Несомненное преимущество – использование животных SPF-статуса, что позволяет исключить влияние экзо- и эндогенных патологических факторов, влияющих на работу цилиарного аппарата многорядного реснитчатого эпителия (воспалительные процессы верхних дыхательных путей в условиях вирусных и бактериальных персистенций, воздействия кормовых, подстилочных поллютантов и пр.).
Предлагаемый метод позволяет неоднократно получать цитологический материал слизистой оболочки полости носа и проводить динамическое исследование на одной биологической тест-системе. Значительную экономическую выгоду составляет аспект масштабных скрининговых исследований по поиску цилиотропных препаратов на лимитированной группе экспериментальных животных, ограниченных только периодом естественного обновления реснитчатого эпителия верхних дыхательных путей.
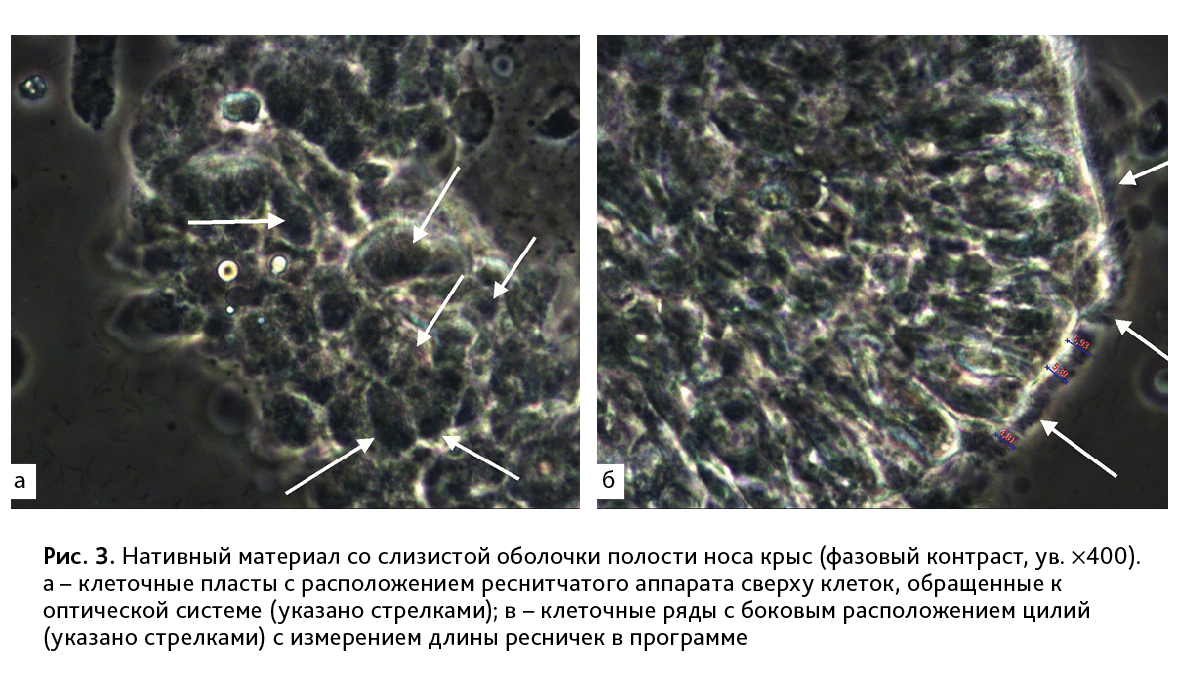
Следующим этапом методической разработки планируется решение проблемы с оптимальной пространственной ориентацией клеточных рядов для проведения морфометрии. На данный момент исследователь лишен возможности регулировать положение цилиарного аппарата в пространстве по отношению к оптической системе. В ходе браш-биопсии получаются обширные клеточные пласты или наслаивающиеся ряды клеток, что ограничивает возможности полноценного морфометрического исследования, требующего расположения цилий в сагиттальной плоскости («в профиль») (рис. 3). В перспективе предстоит разработать методическое обеспечение для атравматичной диссекции полученных эпителиальных пластов на однослойные ряды клеток в условиях in vitro и ориентации клеток в положение, оптимальное для анализа функционального состояния цилиарного аппарата, с возможностью более детального изучения состояния эпителиоцитов.
Интерес к разработке доступного метода прижизненной оценки цилиарной активности на крысах подкрепляется данными литературы, в которых морфологическая картина и морфометрические показатели многорядного столбчатого реснитчатого эпителия крыс наиболее соответствуют параметрам, полученным у человека [4, 10–12]. Кроме того, прижизненное изучение мукоцилиарной системы на таких грызунах как, лабораторные мыши, востребовано не менее, но подбор инструмента для малых размеров носовых ходов остается пока технически неразрешенной задачей.
Заключение
По результатам изложенного сделаны следующие выводы:
- Браш-биопсия слизистой оболочки носа у крыс – технически легко выполняемая, малоинвазивная и низкотравматичная процедура.
- Качество прижизненно полученного цитологического материала многорядного столбчатого реснитчатого эпителия слизистой оболочки полости носа в абсолютной степени зависит от условий разведения и содержания животных в виварии. Использование животных SPF-статуса становится ключевым условием для проведения исследований, связанных с изучением органов дыхательной системы.
- Бесспорное преимущество метода – возможность динамического исследования на одной биологической тест-системе.
Список источников
- Inoue D., Furubayashi T., Ogawara K., Kimura T., Higaki K., Katsumi H., Sakane T., Yamamoto A., Higashi Y. In vitro evaluation of nasal mucociliary clearance using excised rat nasal septum. Biol Pharm Bull 2012; 35(6): 889–894.
- Inoue D., Furubayashi T., Ogawara K., Kimura T., Higaki K., Shingaki T., Kimura S., Tanaka A., Katsumi H., Sakane T., Yamamoto A., Higashi Y. In vitro evaluation of ciliary beat frequency of the rat nasal epithelium using a high-speed digital imaging system. Biol Pharm Bull 2013; 36(6): 966–973.
- Rusznak C., Devalia J.L., Lozewicz S., Davies R.J. The assessment of nasal mucociliary clearance and the effect of drugs. Respir Med 1994; 88: 89–101.
- Delmotte P., Sanderson M.J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. Am J Respir Cell Mol Biol 2006; 35: 110–117.
- Li D., Shirakami G., Zhan X., Johns R.A. Regulation of ciliary beat frequency by the nitric oxide-cyclic guanosine monophosphate signaling pathway in rat airway epithelial cells. Am J Respir Cell Mol Biol 2000; 23: 175–181.
- Fernandes C.A., Vanbever R. Preclinical models for pulmonary drug delivery. Expert Opin Drug Deliv 2009; 6(11): 1231–1245.
- Laube B.L. The expanding role of aerosols in systemic drug delivery, gene therapy, and vaccination. Respir Care 2005; 50(9): 1161–1174.
- Harkema J.R., Carey S.A., Wagner J.G. The nose revisited: a brief review of the comparative structure, function, and toxicologic pathology of the nasal epithelium. Toxicol Pathol 2006; 34: 252–269.
- Uraih L.C., Maronpot R.R. Normal histology of the nasal cavity and application of special techniques. Environ Health Perspect 1990; 85: 187–208.
- Chilvers M.A., O’Callaghan C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax 2000; 55: 314–317.
- Kempeneers C., Seaton C., Chilvers M.A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. CHEST 2017; 151(5): 993–1001.
- Chilvers M.A., Rutman A., O’Callaghan C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax 2003; 58: 333–338.




