Моделирование глобальной церебральной ишемии у монгольских песчанок
Вавилова В.А., Гущин Я.А. Моделирование глобальной церебральной ишемии у монгольских песчанок. Лабораторные животные для научных исследований. 2019; 2. https://doi.org/10.29296/2618723X-2019-02-03
Резюме
В ходе исследования был отработан протокол моделирования глобальной церебральной ишемии (GCI, global cerebral ischemia) с последующей реперфузией на монгольских песчанках. Выбор в качестве биологической модели песчанок обусловлен анатомической особенностью кровоснабжения головного мозга, которое отличается от такового у основных лабораторных животных и человека отсутствием полноценного Виллизиева круга (нет задних соединительных артерий). Оценку эффективности воспроизведения патологии у песчанок осуществляли по критериям: смертность, неврологический статус, гистологическое исследование головного мозга. Визуализация области ишемии после индукции патологии выполнялась при помощи окрашивания срезов головного мозга 2,3,5 трифенилтетразолием хлоридом (ТТС). Оценка неврологического статуса в баллах включала наличие или отсутствие патологических изменений. Состоятельность модели подтверждена патоморфологическим и гистологическим исследованием. Выраженность повреждений преобладает на 2-й в меньшей степени на 3-й день после моделирования патологии. При гистологическом исследовании головного мозга песчанок после индукции патологии в области коры больших полушарий и коры мозжечка, определялись нейроны с признаками дистрофии (полиморфные, гиперхромные клетки с нечеткими контурами – «красные» нейроны) и уменьшенные в размере – «клетки-тени», а также были обнаружены поля со слабовыраженным глиозом. Согласно результатам проведенного исследования, при моделировании постишемических нарушений у монгольских песчанок путем билатеральной окклюзии продолжительностью 20 мин выживаемость животных составляет около 60%, при этом у большинства животных наблюдается выраженный неврологический дефицит. Окрашивание с помощью ТТС показало, что оценку зоны ишемического поражения целесообразно проводить в первые 24 ч после индукции патологии. При оценке степени патологических изменений в первые 1–4 дня после формирования патологии информативна оценка неврологического дефицита, далее на протяжении эксперимента для оценки выраженности постишемических повреждений целесообразно проводить гистологическое исследование образцов ткани головного мозга.
Введение
С конца 1970-х годов в эксперименте изучаются модели церебральной ишемии на животных с целью выявления механизмов, вызывающих повреждение тканей, и обеспечения основы для разработки на доклиническом уровне новых методов лечения инсульта. Несколько последних моделей на животных были разработаны специально для выявления конкретных факторов риска, для определения процессов восстановления нервной системы, для тестирования новых нейропротекторных стратегий. На сегодняшний день моделирование симптомокомплекса выполняется на различных видах экспериментальных животных, включая приматов, свиней, овец, собак, кошек, монгольских песчанок, кроликов, крыс и мышей [1].
Наиболее распространенные модели переднемозговой ишемии: 1-я модель – глобальная ишемия (окклюзия общих сонных артерий) 2-я – фокальная (или мультифокальная) ишемия; 3-я – глобальная и(или) фокальная ишемия в сочетании с гипотензией. При глобальной ишемии достигается уменьшение мозгового кровотока во всем мозге в его большей части, тогда при фокальной ишемии снижение кровотока происходит в определенной области мозгa [2, 3]. Вышеперечисленные подходы широко применяются на крысах. Однако ввиду анатомо-физиологических особенностей кровоснабжения мозга крыс, индивидуальная вариабельность степени патологических изменений очень существенна. Поэтому на крысах чаще проводят моделирование фокальной ишемии (например, путем окклюзии средней мозговой артерии).
Каждая из упомянутых моделей имеет свои преимущества и недостатки. Так, при глобальной ишемии максимальная выраженность повреждений наблюдается уже через 24 ч после перевязки сосудов, через 3 сут ишемические изменения затрагивают 85% клеток полушария, при этом выживаемость животных низка, что затрудняет воспроизводимость модели. 2-я и 3-я модели позволяют снижать мозговой кровоток в гиппокампе, неокортексе и стриатуме [4]. При этом могут избирательно поражаться пирамидные нейроны поля СА1 в гиппокампе, хвостатом ядре, покрышке и неокортексе.
Для моделирования глобальной ишемии довольно широко используются песчанки, которые имеют уникальное строение сосудов, что позволяет добиться значительной ишемии переднего мозга. Изменение кровотока на этой модели схоже с таковым на модели двухсосудистой окклюзии у крыс. Выраженные изменения ЭЭГ отмечаются достаточно быстро, снижение кровотока происходит в коре и гиппокампе [5].
У песчанок, в отличие от других видов лабораторных животных и человека, отсутствует Виллизиев круг (артериальный круг головного мозга, расположенный в основании головного мозга и обеспечивающий компенсацию недостаточности кровоснабжения за счет перетока из других сосудистых бассейнов) (рис. 1) [2]. Временная окклюзия общих сонных артерий у песчанок позволяет создать обратимую ишемию переднего отдела головного мозга, т.е. экспериментально воспроизвести ситуацию, близкую к клинической практике, когда отмечают нарушения кровообращения головного мозга у человека [6].
Модель была предложена в 1966 г. Levine и Payan [7]. Они обнаружили, что глобальная ишемия, индуцированная путем необратимой окклюзии обеих сонных артерий, привела к гибели песчанок в течение 4 ч после операции, у 8 из 40 животных с односторонней окклюзией наблюдался выраженный неврологический дефицит, они погибли в течение 48 ч после операции. Все эти факты навели исследователей на мысль, у животных этого вида есть особенности анатомической структуры системы кровоснабжения мозга. Это было подтверждено при проведении дальнейших морфологических исследований [8].
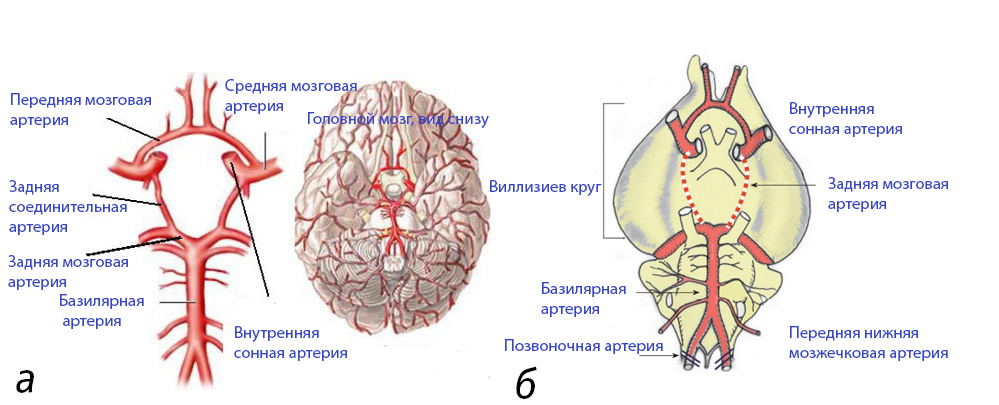
При моделировании ишемического инсульта на песчанках большое значение имеет такой фактор, как продолжительность окклюзии сосудов. Так, в результате двусторонней окклюзии в течение 5 мин в последующие 24 ч гибели животных не наблюдалось, то время как смертность достигла 11% после 15-минутной окклюзии и 42% – при трех 5-минутных эпизодах окклюзии, проведенных с интервалом в 1 ч. При этом выраженность патологических изменений была наибольшей у животных, подвергнутых однократной 15-минутной окклюзии [6].
Таким образом, подбор параметров при моделировании данной патологии – важный этап при постановке методики в конкретной лаборатории. Выбор параметров должен способствовать тому, чтобы минимизировать процент гибели животных. Вместе с тем необходимо добиться равномерной выраженности патологических проявлений в выборке животных.
Цель исследования – подбор оптимальных параметров продолжительности окклюзии сонных артерий, а также выбор наиболее информативных показателей оценки степени выраженности патологических изменений при моделировании глобальной церебральной ишемии у песчанок.
Материал и методы
Эксперименты были выполнены на монгольских песчанках (вид: Meriones unguiculatus) массой 68–85 г (самцы) и 56–73 г (самки) из питомника НПО «ДОМ ФАРМАЦИИ» (Россия). Животных содержали в условиях 24-часового фоторежима (12 ч – день: 12 ч – ночь, включение света в 8:00), контролируемой температуры (22±2ºC) и влажности (65±10%) воздуха при свободном доступе к очищенной воде и стандартному корму (гранулированный комбикорм).
Научно-исследовательская работа была рассмотрена на биоэтической комиссии НПО «ДОМ ФАРМАЦИИ», одобрена для проведения (№ БЭК 1.55/17 от 08 августа 2017 г), и выполнена в соответствии с рекомендациями Директивы 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22 сентября 2010 г. по охране животных, и политикой национальных институтов здоровья США «Принципы лабораторного ухода за животными». Исследование соответствовало принципам 3 «R» (reduction, refinement and replacement). Все усилия были направлены на минимизацию страданий животных и сокращение числа используемых животных.
Моделирование патологии. Для моделирования экспериментальной патологии была использована общая анестезия смесью препаратов Zoletil 100 («Virbac Sante Animale», Франция) (2,6 мг/кг) и Xila («Interchemie werken «De Adelaar» B.V», Нидерланды) (2,6 мг/кг) при их внутримышечном введении. После фиксации животного и обработки операционного поля был сформирован оперативный доступ путем срединного разреза кожи (1,5 см) в области шеи по линии проекции трахеи. Затем тупым способом были разобщены мягкие ткани с целью выделения правой и левой общих сонных артерий. После выделения левой и правой общих сонных артерий было произведено лигирование правой общей сонной артерии и временное наложение сосудистого зажима типа «бульдог» на левую общую сонную артерию (рис. 2) – фаза глобальной ишемии. Период ишемии составил от 15 до 30 мин, после чего с левой общей сонной артерии был снят зажим (фаза реперфузия). При значительном снижении частоты дыхательных движений зажим с левой общей сонной артерии снимали ранее, чем через 30 мин (но не ранее 15 мин), в отсутствии этих признаков – через 30 мин. Для каждого животного фиксировали продолжительность времени билатеральной окклюзии.
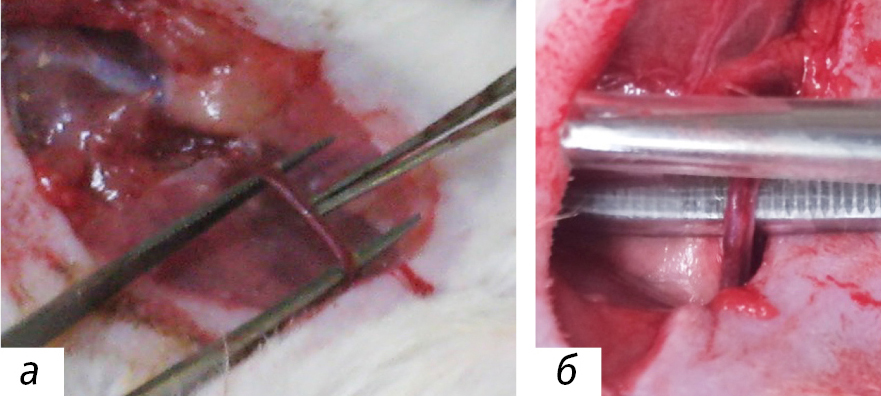
После реперфузии левой сонной артерии у животных было произведено глухое ушивание раны с обработкой шва и прилегающих к шву тканей препаратом Террамицин. В послеоперационный период для уменьшения болевого синдрома экспериментальным животным внутримышечно однократно вводили Флексопрофен в дозе 5 мг/кг.
Дизайн исследования. В эксперимент включили 20 песчанок. У 3 животных была проведена ложная операция, которая содержала ту же последовательность манипуляций, у остальных животных, за исключение наложения лигатуры и зажима на сонные артерии.
Контролируемые показатели: смертность, неврологический статус, оценка зоны ишемического поражения головного мозга и гистологическое исследование головного мозга.
Оценка неврологического статуса. Для оценки неврологических нарушений, вызванных моделированием ишемии головного мозга, применялся метод оценки неврологического дефицита по шкале (stroke-index) McGraw [10] с модификациями, предложенными K. Ohno и соавторами [11] (табл. 1). Оценку тяжести неврологической симптоматики проводили через 6, 24 и 48 ч после начала реперфузии.
Таблица 1
Шкала оценки неврологических нарушений у песчанок
|
Неврологический симптом |
Индекс повреждения, баллы |
|
Взъерошенность волосяного покрова или тремор |
1 |
|
Притупление чувствительности, вялость, замедленность движений |
1 |
|
Изменения слуха (прижатие ушей) |
1 |
|
Запрокидывание головы |
3 |
|
Птоз |
2 |
|
Парез конечностей |
3 |
|
Манежные движения |
3 |
|
Судороги или двигательная гиперактивность (гиперкинезия) |
3 |
|
Коматозное состояние |
6 |
Все показатели были определены по двоичной системе кодирования (да/нет, где «да» соответствовало баллам, указанным в табл. для каждого показателя).
Регистрировали птоз (опущение верхнего века, патологическое смыкание верхнего и нижнего века на одном или двух глазах), парез конечностей (ослабление двигательных функций конечностей), манежные движения (вынужденные произвольные движения животного по кругу), судороги (приступообразные, непроизвольные сокращение мышц), коматозное состояние.
Эвтаназия. Эвтаназию осуществляли с помощью СО2. Выживших животных эвтаназировали на 2-й (7 животных), 3-й и 4-й (по 3 животных) дни для определения динамики восстановительного процесса в тканях головного мозга.
Определение размеров ишемических повреждений головного мозга. Головной мозг 15 животных (из них 6 павших) был извлечен, помещен в фосфатный буфер. Далее на охлаждающем столике изготавливали срезы толщиной 2 мм. Размер области ишемии оценивали путем инкубации срезов в 3% растворе 2,3,5-трифенилтетразолина хлорида (2,3,5 triphenyltetrazoliumchloride, ТТС, Sigma-Aldrich, США) при температуре 37°С в течение 20 мин, после чего срезы фиксировали в 10% растворе формалина при комнатной температуре в течение 16 ч [12]. Полученные гистологические срезы наносили на стекла и фотографировали фотокамерой Canon PC1742 (Canon, Китай), затем анализировали при помощи программного комплекса «ВидеоТест-Размер 5.0» (ООО «ВИДЕОТЕСТ», Россия), в котором измеряли площадь каждого среза и площадь ишемизированного участка; результат выражали в процентах от общей площади срезов.
Гистологическое исследование. У 5 животных, подвергнутых эвтаназии на 1-й, 2-й и 3-й дни, в целях дополнительного изучения изменений микроскопической картины головного мозга при моделировании патологии был выполнен гистологический анализ. Образцы тканей головного мозга были вырезаны, обезвожены, пропитаны парафином, нарезаны на срезы, окрашены гематоксилином и эозином и исследованы микроскопией. Гистологические препараты исследованы методом световой микроскопии.
Результаты и обсуждение
Прижизненные наблюдения. За весь эксперимент частота летальных исходов составила 41% (табл. 2). У погибших животных при макроскопическом исследовании визуально отмечалось умеренное полнокровие сосудов головного мозга, отек тканей головного мозга с очагами размягчения.
Таблица 2
Длительность временной окклюзии левой сонной артерии, летальность и день плановой эвтаназии для каждого животного
|
№ животного |
Время временной окклюзии, мин |
День эксперимента |
|
|
павшие животные |
плановая некропсия, день |
||
|
1 |
Ложная операция |
– |
4-й |
|
2 |
20 |
через 20 мин после операции |
– |
|
3 |
20 |
– |
4-й |
|
4 |
15 |
– |
3-й |
|
5 |
15 |
– |
2-й |
|
6 |
18 |
– |
3-й |
|
7 |
24 |
– |
2-й |
|
8 |
20 |
– |
3-й |
|
9 |
20 |
3-й день |
- |
|
13 |
24 |
1-й день |
- |
|
14 |
26 |
1-й день |
- |
|
15 |
20 |
- |
2-й |
|
16 |
20 |
2-й день |
- |
|
17 |
20 |
- |
2-й |
|
18 |
20 |
2-й день |
- |
|
19 |
20 |
3-й день |
- |
|
20 |
30 |
- |
4-й |
|
21 |
20 |
- |
2-й |
|
22 |
Ложная операция |
- |
4-й |
|
23 |
Ложная операция |
- |
4-й |
В ходе оценки неврологического дефицита у животных со сформированной патологией наблюдали: взъерошенность шерсти, притупление чувствительности, вялость, замедленность движений. Кроме того, отмечены характерные признаки воспроизведенной модели ишемического инсульта: пальпебральное закрытие век (птоз), одного или обоих глаз, парезы, манежные движения, судороги, запрокидывание головы и коматозное состояние (табл. 3).
Таблица 3
Оценка неврологического дефицита, баллы
|
№ животного |
Время временной окклюзии, мин |
День эксперимента |
||
|
2-й |
3-й |
4-й |
||
|
1 |
Ложная операция |
1 |
0 |
0 |
|
2 |
20 |
- |
- |
- |
|
3 |
20 |
2 |
0 |
0 |
|
4 |
15 |
0 |
2 |
- |
|
5 |
15 |
1 |
- |
- |
|
6 |
18 |
0 |
0 |
- |
|
7 |
24 |
22 |
- |
- |
|
8 |
20 |
1 |
0 |
- |
|
9 |
20 |
7 |
- |
- |
|
13 |
24 |
- |
- |
- |
|
14 |
26 |
- |
- |
- |
|
15 |
20 |
16 |
- |
- |
|
16 |
20 |
- |
- |
- |
|
17 |
20 |
0 |
- |
- |
|
18 |
20 |
- |
- |
- |
|
19 |
20 |
0 |
- |
- |
|
20 |
30 |
11 |
4 |
2 |
|
21 |
20 |
11 |
- |
- |
|
22 |
Ложная операция |
0 |
0 |
0 |
|
23 |
Ложная операция |
0 |
0 |
0 |
Как видно из табл. 4, процент выживших животных снижался по мере увеличения времени полной билатеральной окклюзии, у выживших животных, если время окклюзии составило более 20 мин, неврологический дефицит был более выражен по сравнению с животными с менее продолжительным периодом окклюзии.
Таблица 4
Зависимость смертности и выраженности неврологического дефицита от времени билатеральной окклюзии
|
Продолжительность билатеральной окклюзии, мин |
Выживаемость, % |
Неврологический дефицит, баллы (Mе (Q1;Q3) |
|
15–18 |
100 |
1,0 (0,0; 2,0) |
|
20–24 |
67 |
4,5 (0,5; 13,5) |
|
26–30 |
50 |
11* |
Примечание: *Данные 1-го животного
Следует отметить, что уже на 3-й и 4-й дни после моделирования патологии у большинства животных наблюдалось улучшение общего состояния, восстановление рефлексов. Полученные результаты указывают на наличие интенсивного восстановительного процесса у песчанок.
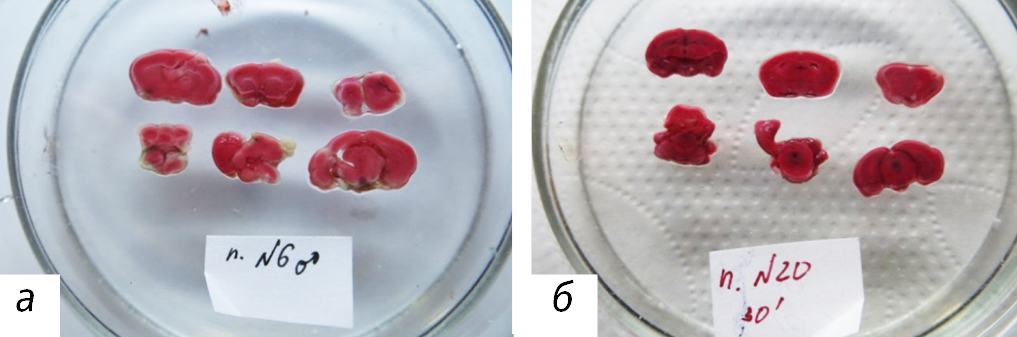
Патоморфологическое исследование. Оценивали площадь ишемического поражения. При эвтаназии для оценки площади ишемического поражения головного мозга применяли окраску 2,3,5 – трифенилтетразолием хлоридом. У ложнооперированных животных срезы равномерно окрашены (рис. 3).
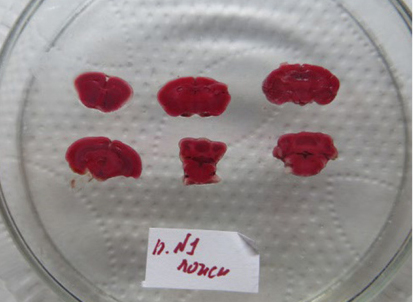
У всех погибших, а также у планово эвтаназированных на 2-й день эксперимента животных были выявлены участки ишемизированной ткани, хотя площадь этих участков в ряде случаев была незначительной, вплоть до полного ее отсутствия у некоторых животных. При этом у животных с выраженным неврологическим дефицитом область ишемии всегда четко идентифицировалась, относительная площадь составляла от 17% и выше (рис. 4, 5).
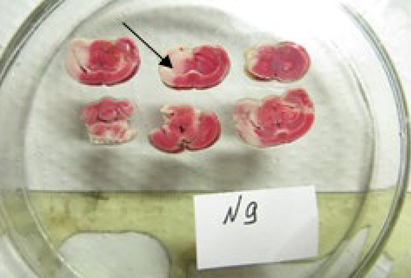

Взятые на 3-й и 4-й дни образцы ткани головного мозга равномерно окрашивались у всех животных (рис. 6). Область ишемии не идентифицировалась.
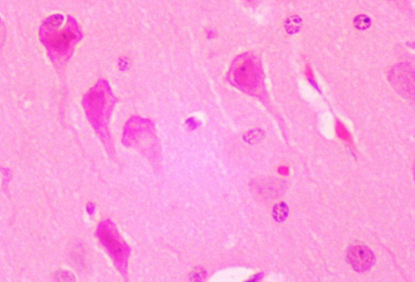
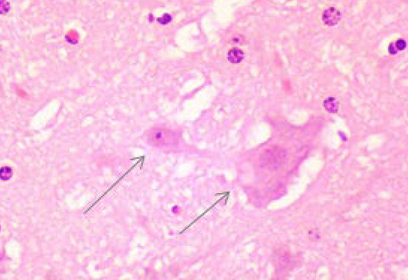
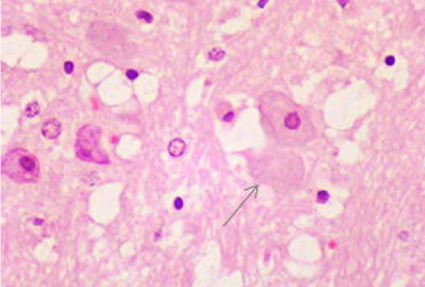
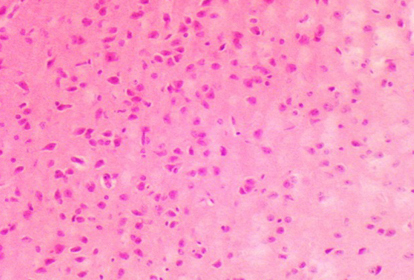
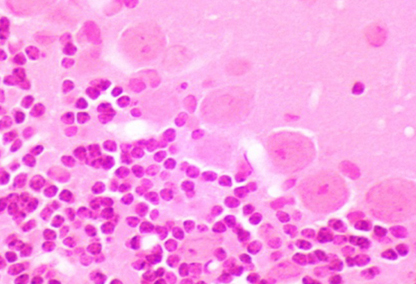
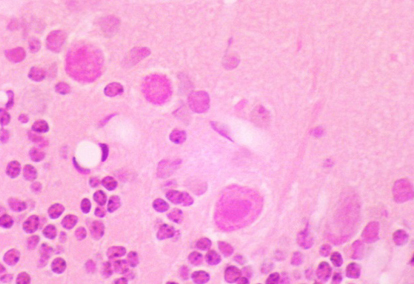
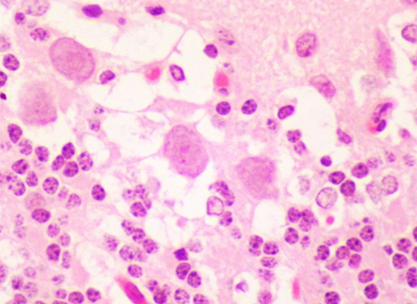
Гистологическое исследование. Цитоархитектоника коры больших полушарий головного мозга была сохранена (рис. 7). В области коры больших полушарий наблюдались нейроны с признаками дистрофии (полиморфные, гиперхромные клетки с нечеткими контурами) и уменьшенные в размере – «клетки-тени» (рис. 8, 9). Выявлялись нечеткие поля со слабо выраженным глиозом (рис. 10). Изменения коснулись коры мозжечка, где наблюдались «красные» нейроны – клетки с необратимыми изменениями, потерявшие базофильное окрашивание (рис. 11, 12). Сосуды мозговых оболочек умеренно полнокровные. Отмечалось наличие умеренного и выраженного перицеллюлярного и периваскулярного отека (рис. 13). Данные изменения не были специфичны, в сумме характеризуют явления ишемии головного мозга, сопровождающейся гибелью нейронов.
Как показали результаты гистологического исследования, у большинства животных с низким неврологическим дефицитом при отсутствии неврологических отклонений, билатеральная окклюзия привела тем не менее к развитию патологических изменений ткани головного мозга уже ко 2-му дню эксперимента (табл. 5).
Таблица 5
Наличие гистологических изменений в зависимости от длительности временной окклюзии и неврологического статуса для каждого животного
|
№ животного |
Время временной окклюзии, мин |
День плановой некропсии, день |
Неврологический статус животного в день эвтаназии |
Гистологические изменения |
|
4 |
15 |
3-й |
2 |
Есть |
|
8 |
20 |
3-й |
0 |
Нет |
|
7 |
20 |
2-й |
0 |
Есть |
|
19 |
20 |
Павшее животное на 3-й день |
0 |
Есть |
|
23 |
Ложная операция |
4-й |
0 |
Нет |
Результаты и обсуждение
В группах с моделированной патологией уровень смертности был в пределах 41%. Полученные результаты предсказуемы, так при экспериментальном моделировании инсультов, в том числе и ишемических, гибель животных может составлять до 50% [6–8]. Смертность животных увеличивалась по мере увеличения времени билатеральной окклюзии, у выживших животных у которых время окклюзии составило более 20 мин, неврологический дефицит был более выражен по сравнению с животными с менее продолжительным периодом окклюзии. Следует отметить, что уже на 3-й и 4-й дни после моделирования патологии у большинства выживших животных наблюдалось улучшение общего состояния, восстановление рефлексов.
Для визуализации области ишемии проводили окраску головного мозга 2,3,5 – трифенилтетразолием хлоридом (ТТС). На 2-й день эксперимента у животных с высоким индексом инсульта область ишемии лучше идентифицировалась, относительная площадь составляла от 17% и выше. У животных, эвтаназированных на 3–4-й дни после моделирования патологии, область ишемии при данном методе оценки уже практически не определялась.
Окраска с применением ТТС – одним из широко применяемых в эксперименте методов для выявления очагов ишемии. Это относительно дешевый метод, позволяющий быстро получить результаты. Его принцип основан на способности ТТС окисляться митохондриальной дегидрогеназой до формазана, который имеет характерный карминово-красный цвет. Поскольку в зоне ишемического поражения активного фермента нет, окисления не происходит, это позволяет по отсутствию окрашивания идентифицировать ишемизированный участок. Показано, что уже через 3 ч после нарушения кровотока, зона поражения хорошо идентифицируется с помощью данного метода [12, 13]. У крыс к 7-му дню после ишемии зона поражения уменьшается в размерах, хотя еще ее можно визуализировать. На 30-й день зона поражения с помощью ТТС не идентифицируется [14], что существенно снижает информативность данного метода, если необходимо оценить динамику восстановления ткани мозга на протяжении длительного периода терапии. В проведенном эксперименте также наблюдалось существенное уменьшение зоны поражения головного мозга песчанок при окраске ТТС уже к 3-му дню после индукции патологии. Обнаруженная тенденция к уменьшению зоны ишемии, выявленной по результатам окраски с применением ТТС, может быть связана с замещением ишемизированного участка глиальными клетками [14], который у песчанок может происходить, возможно, даже более интенсивно, чем у крыс. Показано, что глобальная ишемия головного мозга у песчанок избирательно вызывает отсроченную гибель пирамидных нейронов в области CA1 гиппокампа через 4–5 дней после ишемии, тогда как пирамидные нейроны в CA2 / 3 области не повреждаются. Гибель нейронов сопровождается глиозом, – это результат реакции астроцитов и микроглии. Астроциты – наиболее распространенные глиальные клетки в ЦНС. Они поддерживают метаболизм и функциональное состояние нейронов. При ишемии астроциты реагируют на ишемическое повреждение, восстанавливая гомеостаз. Они также участвуют в синтезе стимулирующих разрушение клеток медиаторов, что ведет к потере нейронов после ишемических инсультов [15]. Кроме того, после билатеральной окклюзии активация астроцитов в области СА1 гиппокампа значительно увеличивалась со временем и достигала пика через 30 дней после ишемии, с последующей деградацией клеток и гибелью к 40-му дню после моделирования патологии. Таким образом, ишемия индуцирует прогрессирующую дегенерацию пирамидных нейронов гиппокампа с 5 до 30 дни на фоне увеличения активации астроцитов, с последующим апоптозом [16].
При гистологическом исследовании головного мозга песчанок после индукции патологии в области коры больших полушарий наблюдались нейроны с признаками дистрофии (полиморфные, гиперхромные клетки с нечеткими контурами) и уменьшенные в размере - «клетки-тени», обнаружены поля со слабо выраженным глиозом. Изменения коснулись коры мозжечка, где можно было наблюдать «красные» нейроны – клетки с необратимыми изменениями, потерявшие базофильное окрашивание. Данные изменения не были специфичны, в сумме характеризуют явления ишемии головного мозга, сопровождающейся гибелью нейронов. Было показано, у большинства животных с низким неврологическим дефицитом у тех, у которых не было отмечено неврологических отклонений, билатеральная окклюзия привела к развитию патологических изменений ткани головного мозга уже ко 2-му дню эксперимента. Это свидетельствует о целесообразности применения данного методического подхода оценки степени постишемических повреждений головного мозга в течение длительного периода после формирования патологии, что подтверждается данными литературы. Показано, у песчанок через 30 дней после ишемии при гистологическом исследовании выявляются изменения ткани головного мозга (некротические изменения нейронов, аутолиз и др.) [17].
Таким образом, согласно результатам проведенного исследования, для моделирования постишемических нарушений у песчанок при применении подхода с билатеральной окклюзией при продолжительности билатеральной окклюзии около 20 мин выживаемость животных составляет около 60%, при этом у большинства животных наблюдается выраженный неврологический дефицит. При оценке зоны ишемического поражения с применением окраски с помощью ТТС целесообразно проводить процедуру в первые 24 ч после индукции патологии. При оценке степени патологических изменений в первые 1–4 дня после формирования патологии информативна оценка неврологического дефицита, далее на протяжении эксперимента для оценки выраженности постишемических повреждений следует выполнять гистологическое исследование образцов ткани головного мозга.
Список источников
- Bacigaluppi M., Comi G., Hermann D. M. Animal models of ischemic stroke. Part two: modeling cerebral ischemia. The open neurology journal. 2010. Vol. 4: 34–8.
- Traystman R. J. Animal models of focal and global cerebral ischemia. Ilar j. 2003. Vol. 44; 2: 85–95.
- Ginsberg M. D., Busto R. Rodent models of cerebral ischemia. Stroke. 1989. Vol. 20; 12: 1627–42.
- Smith M. L., Bendek G., Dahlgren N., Rosen I., Wieloch T., Siesjo B. K. Models for studying long-term recovery following forebrain ischemia in the rat. 2. A 2-vessel occlusion model. Acta Neurol Scand. 1984. Vol. 69; 6: 385–401.
- Kato H., Araki T., Kogure K., Murakami M., Uemura K. Sequential cerebral blood flow changes in short-term cerebral ischemia in gerbils. Stroke. 1990. Vol. 21; 9: 1346–9.
- Tomida S., Nowak T. S., Jr., Vass K., Lohr J. M., Klatzo I. Experimental model for repetitive ischemic attacks in the gerbil: the cumulative effect of repeated ischemic insults. J Cereb Blood Flow Metab. 1987. Vol. 7; 6: 773–82.
- Levine S., Payan H. Effects of ischemia and other procedures on the brain and retina of the gerbil (Meriones unguiculatus). Exp Neurol. 1966. Vol. 16; 3: 255–62.
- Berry K., Wisniewski H. M., Svarzbein L., Baez S. On the relationship of brain vasculature to production of neurological deficit and morphological changes following acute unilateral common carotid artery ligation in gerbils. J Neurol Sci. 1975. Vol. 25; 1: 75–92.
- Brain imaging with correlative two-photon and light sheet microscopy. Costantini I., 2013.
- McGraw C. P. Experimental cerebral infarctioneffects of pentobarbital in Mongolian gerbils. Arch Neurol. 1977. Vol. 34; 6: 334–-6.
- Ohno K., Ito U., Inaba Y. Regional cerebral blood flow and stroke index after left carotid artery ligation in the conscious gerbil. Brain Res. 1984. Vol. 297; 1: 151–7.
- Rupadevi M., Parasuraman S., Raveendran R. Protocol for middle cerebral artery occlusion by an intraluminal suture method. J Pharmacol Pharmacother. 2011. Vol. 2; 1: 36–9.




