Особенности воспроизводства мармозеток, или игрунок обыкновенных
Работа выполнена без спонсорской поддержки.
Акимов Д.Ю., Бармина Т.Г. Особенности воспроизводства мармозеток, или игрунок обыкновенных. Лабораторные животные для научных исследований. 2023; 1. https://doi.org/10.57034/2618723X-2023-01-08
Резюме
В связи с развитием производства биотехнологических продуктов и широким применением генной терапии увеличилось использование нечеловекообразных приматов в доклинических исследованиях, поскольку они часто являются единственными видами, позволяющими провести достоверную оценку исследуемых объектов. Так, на сегодняшний день игрунка обыкновенная (Callithrix jacchus) выступает важным объектом исследований в биологических областях, иммунологических и токсикологических оценках безопасности, диагностике заболеваний, при разработке и контроле качества продуктов и устройств в области медицины, стоматологии и ветеринарии.
Для проведения доклинических исследований нередко возникает необходимость запускать воспроизводство животных. Игрунка обыкновенная — одно из тех животных, размножение которых требует должного внимания, знаний и определенных условий. Игрунковые (лат. Callitrichidae) представляют собой семейство приматов небольшого размера, относящееся к широконосым обезьянам Нового Света.
В данном обзоре описывается воспроизводство игрунок, начиная с популяционного и заканчивая молекулярным уровнем, где учитываются социальные роли животных в группах, физиологические особенности организма и самок, и самцов, а также влияние внешних факторов при их содержании. Понимание целостной картины воспроизводства животных позволяет спрогнозировать и спланировать дальнейшие производственные процессы, обеспечить благополучие поголовья и получить здоровое потомство.
Цель обзора — обозначить репродуктивный потенциал и уровень воспроизводства у игрунок, определить поведенческие особенности и социальные роли в группах, а также рассмотреть физиологические аспекты половой системы на всех уровнях организации.
Для достижения обозначенной цели были выделены следующие задачи:
1) исследование данных литературы, касающихся особенностей репродуктивной системы самцов и самок игрунок;
2) обобщение и систематизация полученных материалов.
В результате настоящего обзора было обобщено и описано следующее:
- определены основные физиологические параметры самцов и самок;
- установлены сроки первого оплодотворения самок игрунок;
- разобраны поведенческие особенности самцов и самок в период размножения;
- описана суть и значение гипоталамо-гипофизарно-гонадной оси у самцов и самок;
- рассмотрены процессы пролиферации половых клеток, динамики уровней основных половых гормонов в зависимости от цикла и их влияние на организм.
Введение
С ростом производства фармацевтических препаратов, полученных с помощью биотехнологий, увеличилось использование нечеловекообразных приматов, в частности, игрунок обыкновенных (мартышка обыкновенная, мармозетка, уистити, Callithrix jacchus). Данный вид имеет ряд преимуществ перед другими видами, используемыми для исследований в разных областях наук [1].
Во-первых, это достаточно удобная модель для содержания в неволе в лабораторных условиях за счет ее малых размеров и массы тела (до 500 г). Затраты на содержание и кормление их значительно ниже по сравнению с потребностями других видов приматов. Сюда же можно отнести и меньшие требования к площади пола при их размещении [1, 2].
Во-вторых, мармозетки представляют собой оптимальную модель для изучения тератологического потенциала фармацевтических препаратов и аспектов репродуктивной физиологии и иммунной контрацепции из‑за их ранней половой зрелости, высокой эффективности воспроизводства и сходства плацентации с таковой у человека [1].
В-третьих, этот вид животных можно успешно воспроизводить в лабораторных условиях. Однако для реализации данной цели необходимо принимать во внимание некоторые особенности физиологии репродуктивной системы как самок, так и самцов.
Цель данного обзора — обобщение и систематизация данных, касающихся репродуктивной системы игрунок обыкновенных, для дальнейшего применения их в воспроизводстве.
Внешние факторы, влияющие на воспроизводство
При содержании большого количества групп игрунок в одном помещении желательно разделить пространство между ними (например, пластиковый занавес, модификация клетки и т. п.), чтобы установить неполный визуальный контакт между соседними группам и снизить уровень стресса и агрессии между ними [2]. Авторы указывают, что большое значение для игрунок имеет гнездовое место, которым может быть обычный пластиковый контейнер. Данное место в таком случае используется животными не только для сна, но и в качестве убежища при их уединении от других животных и персонала.
Между возрастом и годовой продуктивностью игрунок существует U-образная зависимость: у самок среднего возраста (от 3 до 5 лет) репродуктивная способность выше, чем у молодых или пожилых [3].
У обыкновенных мартышек отмечается взаимосвязь репродуктивной способности со стрессом. Так, выполнение манипуляций в ходе исследований становится стрессовым фактором, при котором значительно снижаются концентрация сперматозоидов и объем спермы у взрослых самцов, в свою очередь у самок повышается уровень кортизола (гормона стресса), что снижает их материнские инстинкты [4]. Для снижения уровня стресса и оптимизации репродуктивного потенциала необходимо подбирать клетку содержания соответствующего размера [2, 5]. Согласно Директиве Европейского союза1, площадь пола должна составлять 5000 мм2, высота — 1500 мм. Причем большое внимание уделяется высоте клетки, поскольку приматы в естественной среде обитания предпочитают наблюдать за любыми объектами внимания сверху вниз [2, 5].
Немаловажным при разведении игрунок в лабораторных условиях является своевременный мониторинг здоровья животных, что позволяет сохранить текущее поголовье и получить здоровое потомство [6].
Репродуктивная система на популяционном уровне
Для популяций игрунок характерна развитая социальная организация. Так, в одной семье размножение подавляется у всех самок, кроме одной, причем в группе сверстников этот процесс происходит опосредованно как физиологическими, так и поведенческими средствами, а в семейных группах действуют только поведенческие ограничения [7, 8].
Кожа мартышек содержит специальные ароматические железы в аногенитальной и надлобковой областях, над грудиной и, возможно, на лице по краям рта. Маслянистые выделения из этих желез, смешанные с мочой и выделениями из половых органов, оседают на всех объектах окружающей среды, в том числе на других особях в клетке. Запах играет роль в различных социосексуальных взаимодействиях животных, а также в привязанности между членами группы и младенцами, о которых они заботятся. Запах размножающейся самки способствует подавлению овуляции у других самок из группы [7].
При содержании игрунок в неволе необходимо учитывать, что в размножении участвует только один самец и одна самка. При содержании двух самцов и одной самки один самец в скором времени будет подчиняться другому. Можно сформировать группы сверстников из молодых мартышек, но такие группы необходимо тщательно контролировать, потому что уровень агрессии, как правило, высок в первые 2–3 дня и некоторых животных приходится изолировать [7, 8].
Хотя семейные группы более стабильны, чем группы неродственных животных, молодняк в конечном итоге изгоняется. Независимо от того, какой механизм преобладает, инициатором этих изгнаний являются пожилые животные того же пола из их первоначальной группы. Это способствует присоединению молодняка к другим группам или образованию новых групп [8].
В уходе за появившимся потомством участвуют все члены группы. Первое время малыши передвигаются на животе самки. По истечении 7 дней о детенышах заботятся самцы, отдавая их самкам только для кормления. Поэтому беременных самок никогда не следует размещать в одиночестве. Если участвующий в размножении самец умирает или его необходимо удалить, самку следует поместить к другому самцу. Опытный самец, помещенный с беременной самкой, поможет ей вырастить потомство [7, 8].
Детеныши при передвижении на теле родительских особей цепляются за их шею и область плеч. При этом детеныши, которые цепляются за бедра или брюшную часть, обычно слабы. На это может указывать и вяло свисающий вниз, а не закручивающийся к телу переносящей его особи хвост [7].
Через 4–6 нед после рождения детеныши пытаются передвигаться на небольшие расстояния самостоятельно. Примерно в том же возрасте они начинают питаться твердой пищей, часто выпрашивая еду у взрослых, и к 10‑й неделе могут быть полностью независимы от заботы со стороны членов группы.
Животных, предназначенных для разведения, следует оставить со своими родителями по крайней мере до тех пор, пока не будут отняты от груди следующие две группы младших братьев и сестер. Так, с детенышами 5–7‑месячные братья и сестры из группы активно играют, а с рождением следующих участвуют в уходе за ними. Животные, которые никогда не помогали выращивать младших братьев и сестер, могут убить или пренебречь собственным потомством, как только они начнут размножаться [7, 8].
При необходимости детенышей можно выращивать без участия родительских особей в течение небольшого периода времени (до 3 нед) и затем повторно вводить либо в первоначальную группу, либо в опытную, которая имела визуальный и обонятельный контакт с ними ранее [7].
Визуальная коммуникация обезьян играет важную роль в репродуктивном поведении — самки часто используют жесты в сочетании со специфическим выражением лица [9]. У многих самок приматов сексуальная привлекательность демонстрируется как поведенческими, так и неповеденческими сигналами, такими как визуальные или химические. Как во время прекопуляции, так и совокупления, поведенческие и физиологические реакции могут наблюдаться многими проявлениями. Психологические реакции включают сокращение маточных, вагинальных, анальных и тазовых мышц, учащенное сердцебиение и частоту дыхания, а также вагинальные выделения.
Размножаются игрунки один раз в полгода.
У самцов на продуктивность влияют гормоны, а половое поведение связано с овуляцией у самок [10]. Привлекательность самок основана на гормональных изменениях, например, выделения на коже отражают изменение уровней эстрогена и прогестерона. Лидеры-самцы исследуют тело самки и анализируют ее мочу, чтобы получить информацию о гормональном статусе.
Процесс спаривания у игрунок обычно непродолжительный. Перед совокуплением самцы внимательно следят за самками в пределах 30 см от нее, быстро и ритмично высовывают язык и причмокивают губами. Данные действия также сопровождаются резкими слышимыми вдохами и пилоэрекцией. При этом самки остаются неподвижными, пристально смотрят на самца, поворачивая голову вбок и назад через плечо, так же причмокивают губами и производят движения языком [7, 8].
Репродуктивная система самок на организменном уровне
Самки достигают полового созревания в возрасте 400–500 дней, тогда как половая зрелость наступает в 500–600 дней. Отмечают, что если мартышки оплодотворялись уже в возрасте 300 дней, то у них наблюдали аборт или падеж потомства [7, 8].
Продолжительность беременности у игрунок составляет 144–146 сут. За один раз самка производит 2–3 детеныша с примерной массой по 25 г.
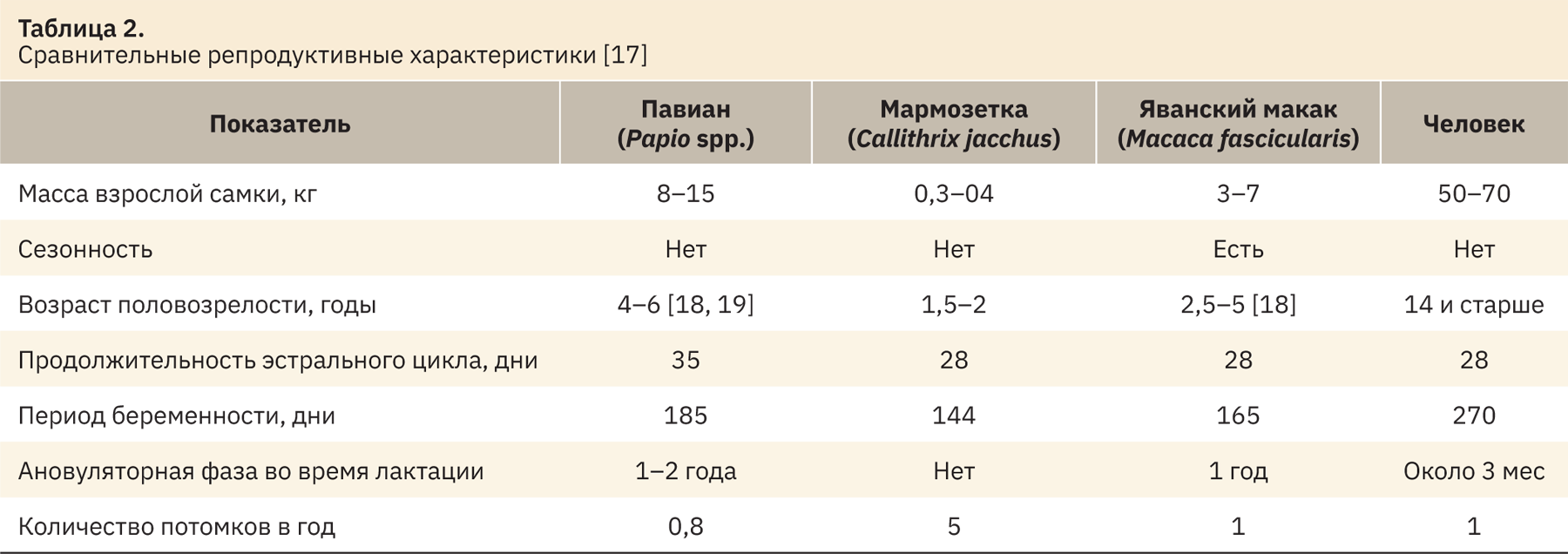
Репродуктивный период самок включает циклические изменения яичников, беременность, кормление грудью и, наконец, наступление менопаузы. Продолжительность овуляторного цикла взрослых самок обыкновенных игрунок составляет 28–30 дней. Большинство различий в длине цикла происходит в фолликулярной фазе. Вариации цикла имеют важное влияние на скорость воспроизводства самок, включая продолжительность послеродовой аменореи, количество циклов до зачатия, продолжительность беременности и сезонность. Интервал между родами у игрунок составляет 157 дней [11–13]. Данные этого показателя по сравнению с другими видами приматов представлены в табл. 1.

Игрунки и тамарины — единственные виды приматов с множественной овуляцией. Количество преовуляторных фолликулов колеблется от 1 до 4 и соотносится с числом рожденных потомков. Спонтанная овуляция связана с высокоразвитой социальной системой, в которой самцы регулярно взаимодействуют с самками, обеспечивая возможность оплодотворения. Это указывает на важность социального поведения в воспроизводстве. Внешних маркеров цикличности немного, если они вообще есть, и отек кожи наружных половых органов отсутствует. В отличие от большинства нечеловекообразных приматов у игрунок не наблюдаются серьезные задержки овуляции, связанные с лактацией. У самок мартышек овуляция происходит обычно через 9–11 дней после родов [14–16].
Сравнительные репродуктивные характеристики некоторых видов приматов и человека представлены в табл. 2.
Существует ряд факторов, которые могут повлиять на фертильность, но взаимодействие между генами и факторами окружающей среды является ключевым в наступлении фертильности. Начало половой зрелости самок варьирует от семейства к семейству и может значительно различаться у разных видов [20, 21].
У беременных самок потребность в энергии и потреблении пищи на 17–32% выше, чем у небеременных. При ограничении в рационе содержания белков или минералов у самок может наблюдаться замедление темпов роста плода. Материнское ожирение, как и доступ потомства при искусственном вскармливании к смеси с высоким содержанием жиров, способствуют появлению потомства с более высокой массой тела при рождении и набору излишней массы тела к возрасту 1 год [2, 22].
Репродуктивная система самок на системном уровне
Термин «ось гипоталамус–гипофиз–яичники–матка» хорошо характеризует иерархию событий в процессе воспроизводства. Внешние факторы, такие как партнер по спариванию, стресс или свет, могут влиять на характер секреции факторов высвобождения гонадотропина, вырабатываемого гипофизом. Гонадотропин, фолликулостимулирующий гормон (ФСГ) и лютеинизирующий гормон (ЛГ) контролируются пульсирующей секрецией рилизинг-гормона, который стимулирует стероиды и другие гормоны в яичниках и вызывает рост фолликулов, овуляцию и лютеинизацию. Цикл яичников определяется фолликулярной и лютеиновой фазами [10, 16].
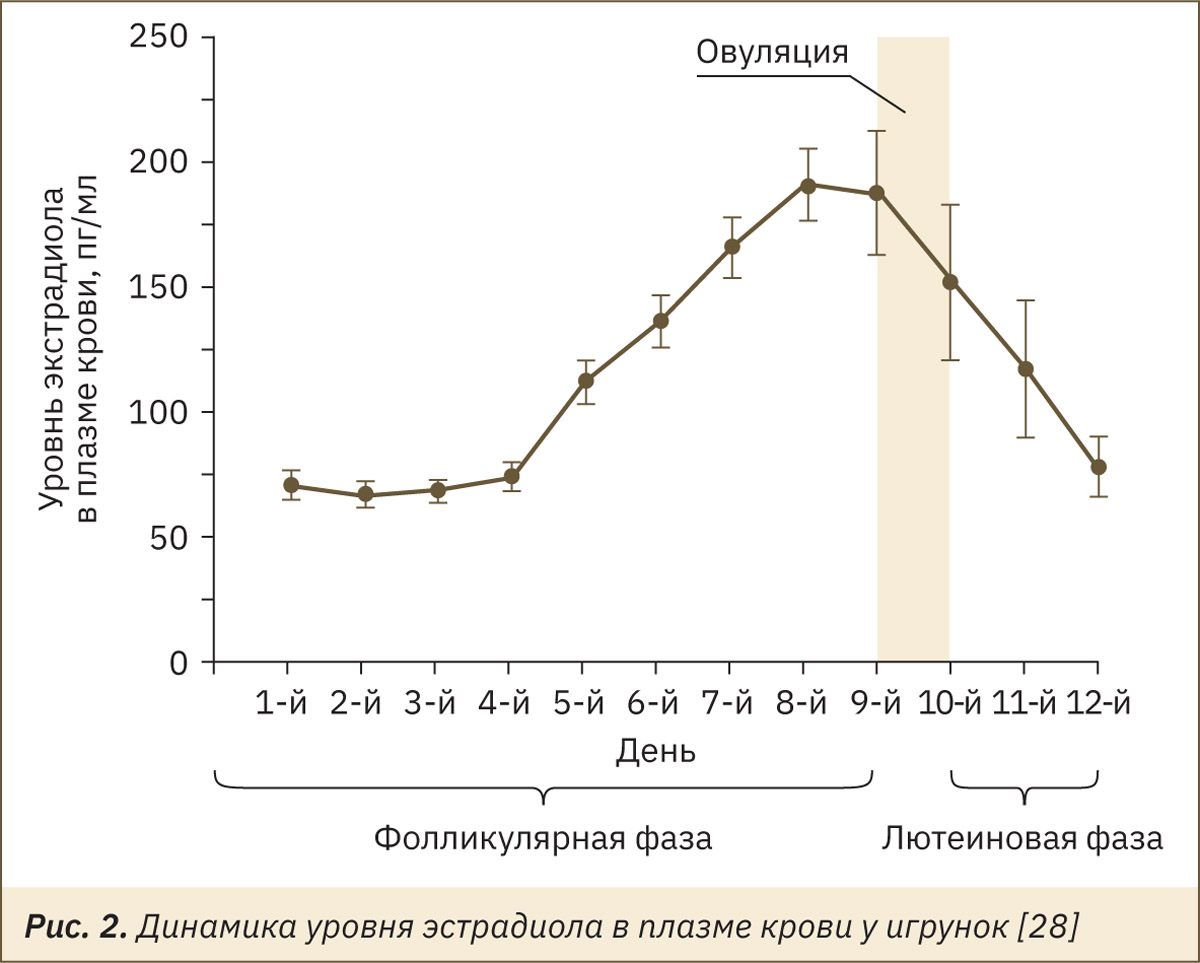
Основными гормонами яичников являются эстроген, прогестерон, релаксин, гормоны роста, простагландины и ингибин. Эстрогены секретируются в основном во время фолликулярной фазы преовуляторным фолликулом и достигают максимального уровня в плазме крови во время овуляции. В это время эстрогены увеличивают положительную секрецию ЛГ. Они вызывают изменения в поведении, эпителии влагалища, перианальной коже. В целом все изменения, вызванные эстрогеном и ЛГ, делают самку более привлекательной для самцов. Однако половая активность самок снижается при повышении уровня прогестерона в лютеиновой фазе, что свидетельствует о негативном влиянии прогестерона на возникновение сексуального поведения [16, 23]. Эта фаза также связана со значительным снижением частоты эякуляций самцов.
Овуляцию можно определить, зафиксировав преовуляторное повышение уровня эстрадиола и ЛГ в крови или моче. Хорошим предиктором овуляции при обнаружении метаболитов эстрогена в моче у игрунок является эстрон-3‑сульфат, который можно использовать для установления цикла, а также прямой анализ конъюгированных эстрогенов [24, 25].
Неинвазивный мониторинг зачатия может быть достигнут путем измерения эстрадиола-17β, прегнандиола (Pd), ЛГ и прогестерона в моче и кале. Как правило, гормональный анализ в основном используется для мониторинга циклов, при необходимости оценивают маркеры беременности, такие как гонадотропин хориона (CG) или релаксин (RLX).
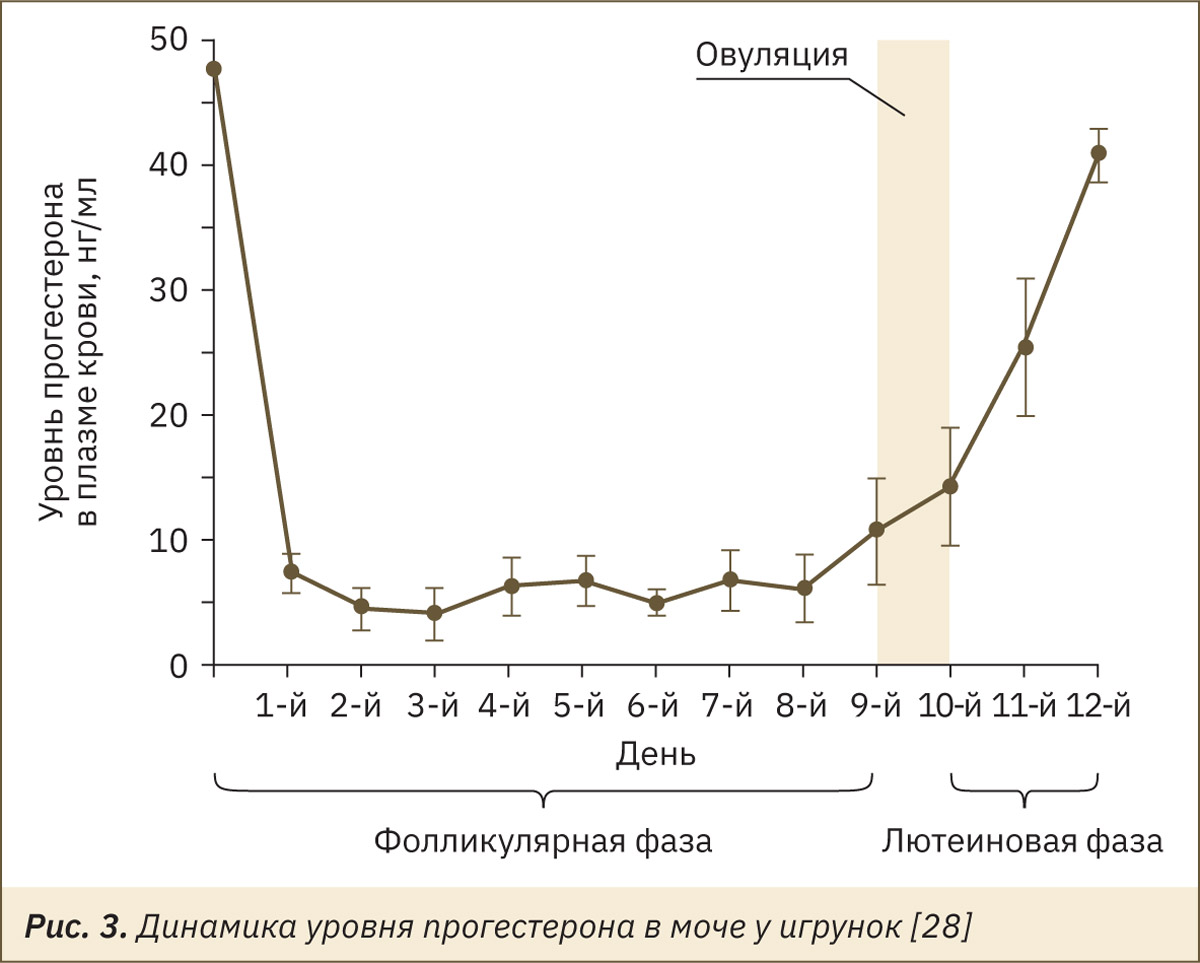
После овуляции образуется новое желтое тело, которое синтезирует гормон прогестерон, который является доминантой лютеиновой фазы и, следовательно, является хорошим индикатором того, что произошла овуляция и лютеинизация. Лютеиновая фаза и ранняя беременность также могут подтверждаться наличием RLX или CG. RLX продуцируется маткой и плацентой, а уровни RLX и CG значительно увеличиваются во время имплантации и на ранних сроках беременности. Оба гормона могут быть обнаружены в образцах сыворотки крови. Существует разница между содержанием RLX при нормальной беременности и при невынашивании беременности, когда снижение прогестерона происходит намного позже [26, 27]. Таким образом, RLX является индикатором состояния плаценты и плода. В общем поздняя концентрация RLX дает информацию о патологии и физиологии беременности.
В течение 10‑летнего периода у стареющих Callithrix jacchus наблюдается снижение активности гипоталамуса, гипофиза и яичников, что приводит к понижению концентрации стероидных и пептидных гормонов, увеличению индексов апоптоза в фолликулах и сокращению числа регулярных циклов [3, 17].
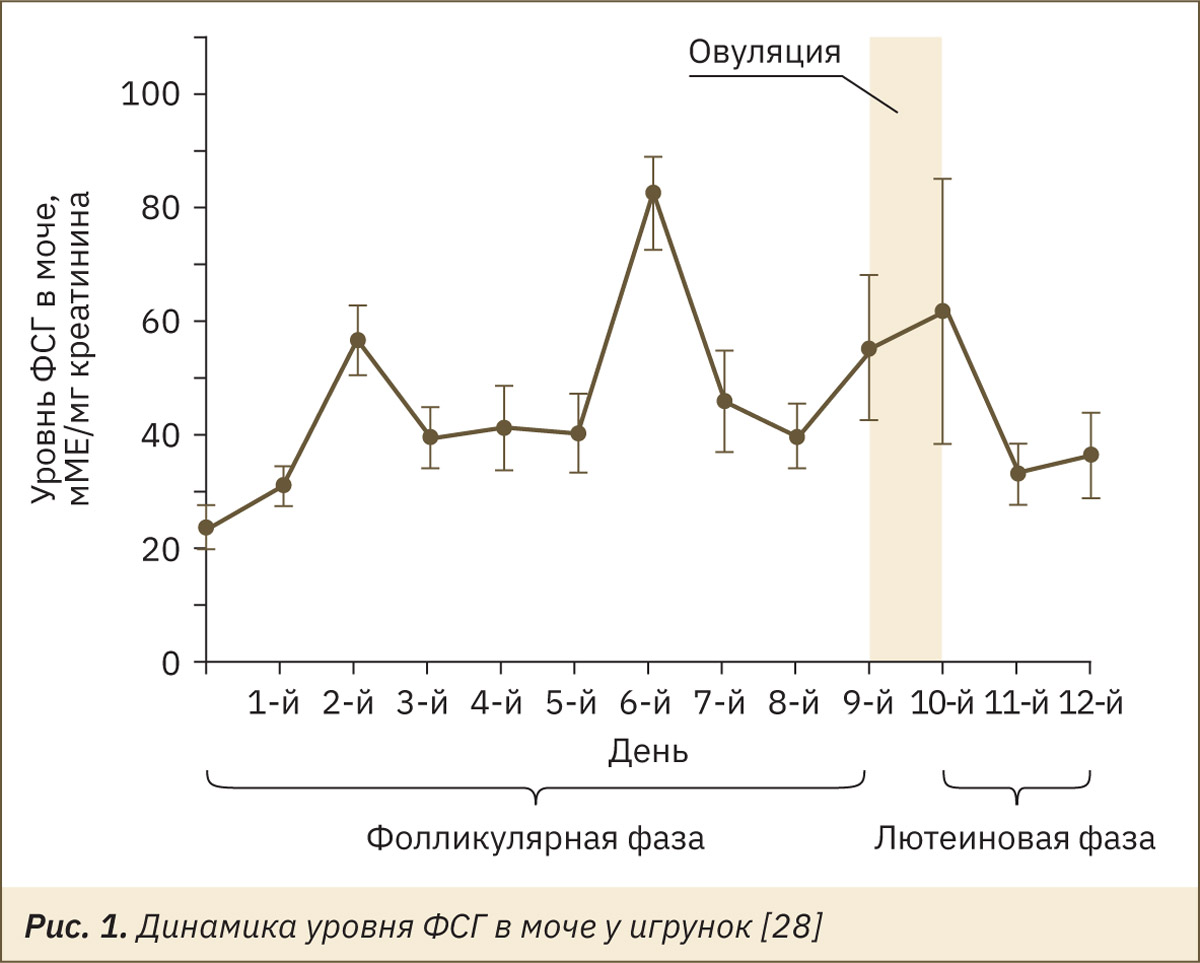
В исследовании [28] у игрунок индуцировали начало фолликулярной фазы с помощью внутримышечной инъекциий 0,8 мкг клопростенола, аналога простагландина F2α (день 0), после чего были получены данные по уровню ФСГ в моче, эстрадиола и прогестерона в плазме крови, которые можно отобразить на следующих рис. 1–3.
Репродуктивная система самцов на системном уровне
Знание функции гипоталамо-гипофизарно-тестикулярной оси является ключом к пониманию репродуктивной функции у самцов приматов. Взаимосвязь этих тканей важна как для эндокринной, так и для экзокринной функции семенников. Гонадотропин-рилизинг-гормон (GnRH) синтезируется в гипоталамусе и импульсами секретируется в переднюю часть гипофиза через портальные сосуды в ножке гипофиза. В передней доле гипофиза гонадотропные клетки стимулируются GnRH для секреции ЛГ и ФСГ. Данные гормоны у самок и самцов химически идентичны. Эти гормоны попадают в общий кровоток, а ЛГ стимулирует клетки Лейдига в интерстициальных пространствах яичек к секреции тестостерона. ФСГ стимулирует клетки Сертоли в семенных канальцах для выработки андрогенсвязывающего белка (ABP), ингибина и активина [23].
Ось гипоталамус–гипофиз–семенники имеет элементы управления с обратной связью на двух уровнях для поддержания секреции тестостерона. Тестостерон из клеток Лейдига имеет отрицательную обратную связь с гипоталамусом, уменьшая амплитуду и частоту импульсов гонадолиберина. Эстрадиол, преобразованный из тестостерона ароматазой, имеет отрицательную обратную связь с передней долей гипофиза, что делает гонадотропные клетки менее чувствительными к стимуляции GnRH. Эти два процесса уменьшают секрецию ЛГ и тем самым снижают уровень тестостерона. Ингибин и активин из клеток Сертоли имеют, соответственно, отрицательную и положительную обратную связь с передней долей гипофиза для поддержания уровня ФСГ [16, 23].
Внутриутробное развитие эпидидимидного протока является ответом на андрогены, секретируемые семенниками плода. В это время секреция андрогенов вызывает дифференцировку клеток, так что они напоминают те, что обнаруживаются у взрослых, включая клетки тела и хвоста придатков семенника. Когда уровень андрогенов падает после рождения, эпителиальные клетки регрессируют до недифференцированного состояния, пока андрогены не увеличиваются в период полового созревания.
В возрасте 50–60 дней у самцов наблюдается высокий уровень андрогенов, которые статистически неотличимы от таковых у размножающихся взрослых самцов (рис. 4) [28].
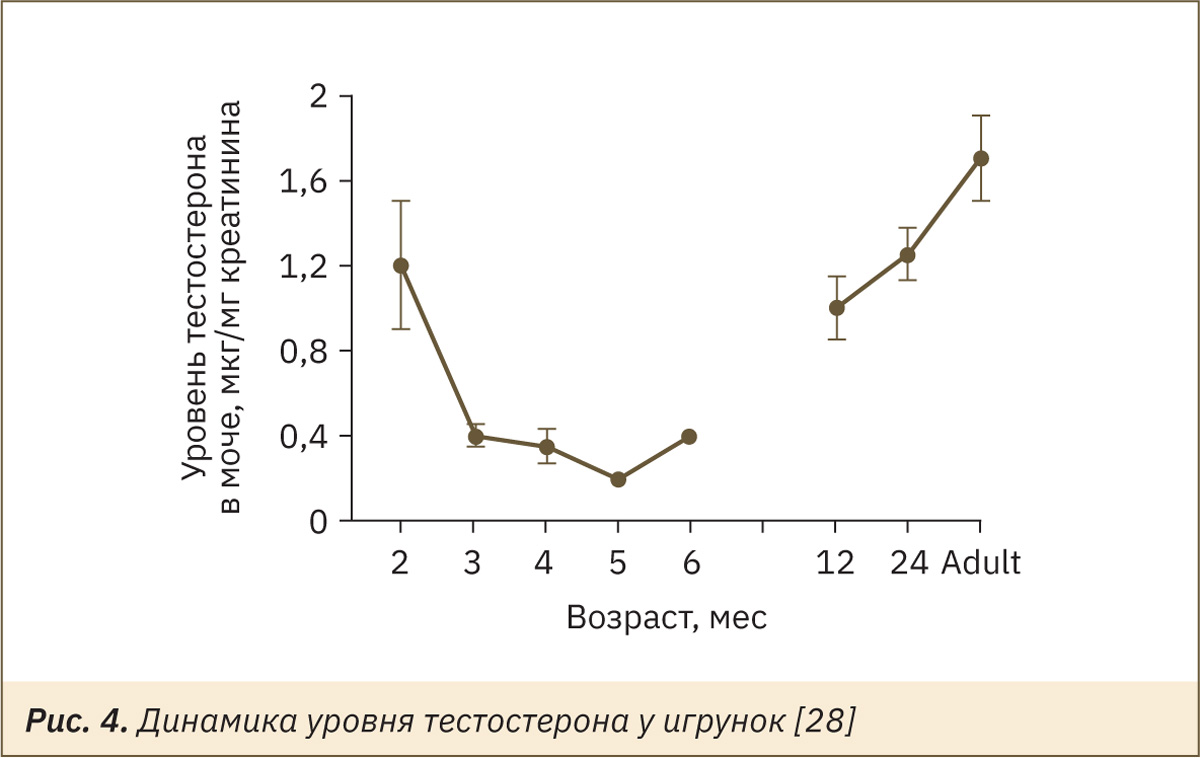
Состояние покоя яичек до наступления половой зрелости связано с ограниченной секрецией ФСГ и ЛГ из передней доли гипофиза. Это ограничение гонадотропных гормонов вызвано прерыванием пульсирующей секреции GnRH из гипоталамуса на этой стадии развития. Стимуляция нейронов GnRH в гипоталамусе молодых обезьян [29], действительно, приводила к преждевременному половому созреванию. Ось гипоталамус–гипофиз–клетки Лейдига была полностью активирована, и сперматогенез был инициирован. Это предполагает, что ограничивающим компонентом полового созревания является стимуляция нейронов, которые контролируют генератор импульсов гонадолиберина.
Система отрицательной обратной связи для ФСГ посредством ингибина не функционирует до наступления половой зрелости. По мере приближения полового созревания процесс выброса гонадолиберина повторно активируется, что приводит к повышению уровня гонадотропина, увеличению скорости роста и полному развитию репродуктивной системы.
Роль ФСГ и ЛГ в отношении инициации и поддержания сперматогенеза строго не определена. ФСГ может не требоваться для инициации сперматогенеза, и некоторые исследования показывают, что сперматогенез можно поддерживать с помощью ЛГ. Однако признано, что присутствие и ФСГ и ЛГ для стимуляции соответствующих тканей-мишеней приводит к максимальной выработке спермы у самцов [30, 31].
Репродуктивная система самок на органном уровне
В целом анатомические взаимоотношения матки с широкими связками, фаллопиевыми трубами и яичниками у игрунок аналогичны тем, которые характерны для человека. Влагалище имеет перешеек (диаметром до 1,5 мм), который разделяет его на верхний и нижний тракты, средняя длина которых составляет 25 и 17 мм соответственно. Нижнее влагалище представляет собой овальный цилиндр, выстланный многослойным плоским эпителием, с множеством продольных борозд. Верхняя часть влагалища имеет редкие вертикальные складки розового цвета [32].
Длина шейки матки составляет 4–5 мм. Тело матки грушевидной формы, задняя часть дна которой располагается на уровне дна мочевого пузыря. Яичники находятся кзади от маточных труб и широких связок. Маточные трубы заканчиваются небольшими фимбриями и примыкают к жировой ткани, окружающей яичники, которые содержат геморрагические тела [32].
Репродуктивная система самцов на органном уровне
Семенники самцов прощупываются при рождении в паховой области и могут опускаться в мошонку в возрасте 50–70 дней. Тестикулы остаются неизменными до 250 дней, а затем быстро растут, достигая размера, характерного для взрослых самцов в возрасте 650–700 дней [7, 8]. Мошонка взрослого самца покрывает половой член, она лишена меха и покрыта перламутровыми узелками [33].
Процесс сперматогенеза лучше всего характеризуют три непрерывные фазы: 1‑я — обновление стволовых клеток, 2‑я — пролиферация половых клеток и 3‑я — спермиогенез, или созревание сперматид до сперматозоидов. Процесс сперматогенеза становится функциональным с завершением полового созревания.
Обновление стволовых клеток
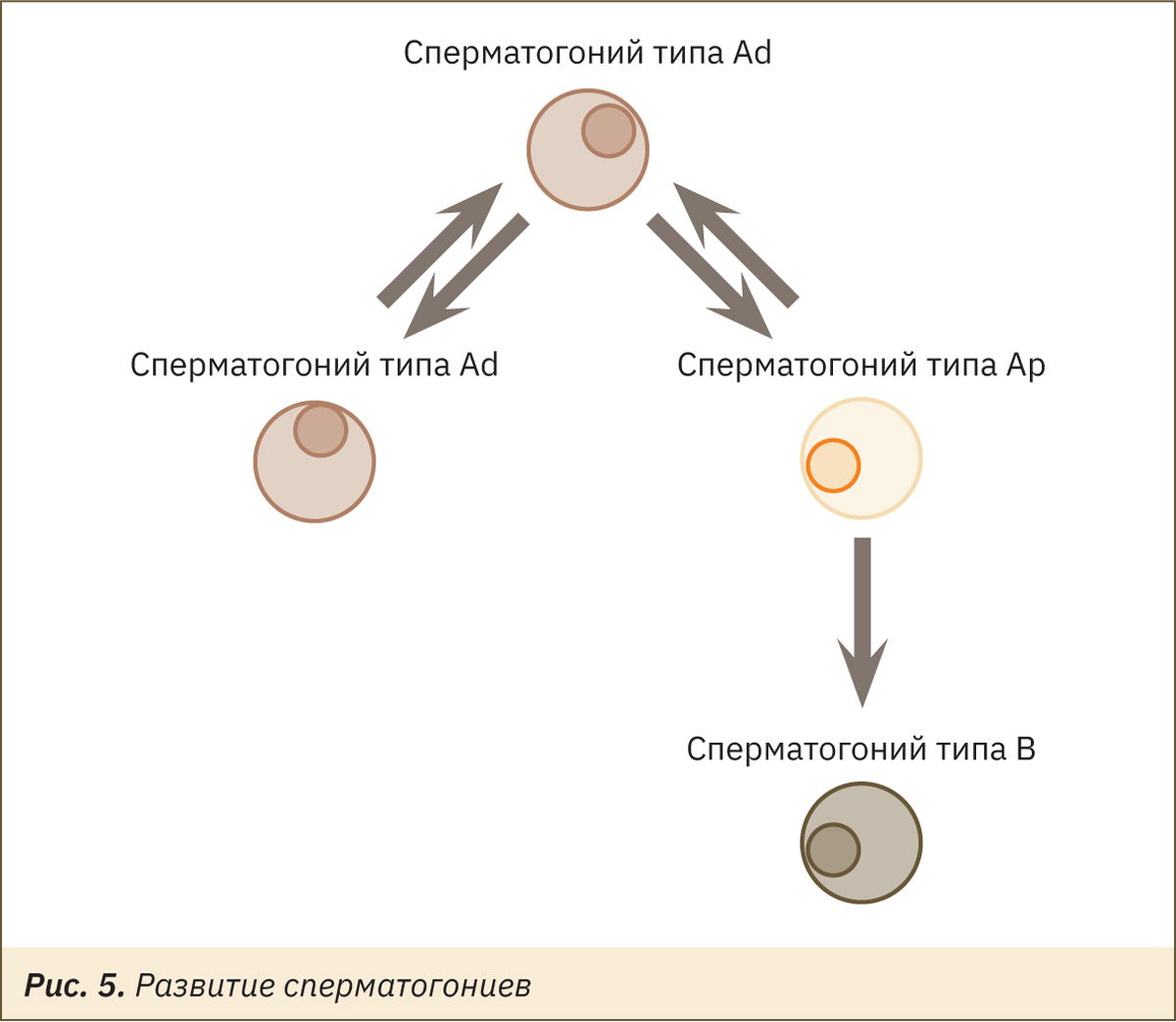
Стволовые клетки, или сперматогонии, являются началом линии половых клеток. Это диплоидные недифференцированные клетки, которые размножаются путем митоза, выделяют сперматогонии типа А темные (Ad), типа А светлые (Ap) и типа В [16, 30].
Сперматогонии Ad считаются резервными стволовыми клетками, редко вступающими в митоз. Сперматогонии Ap — полустволовые клетки, находящиеся в непрерывно следующих друг за другом клеточных циклах. В результате деления светлой клетки типа А образуется либо две клетки типа В, либо одна клетка типа В и одна светлая клетка типа А. Схематично это можно представить следующим образом (рис. 5).
Пролиферация половых клеток и спермиогенез
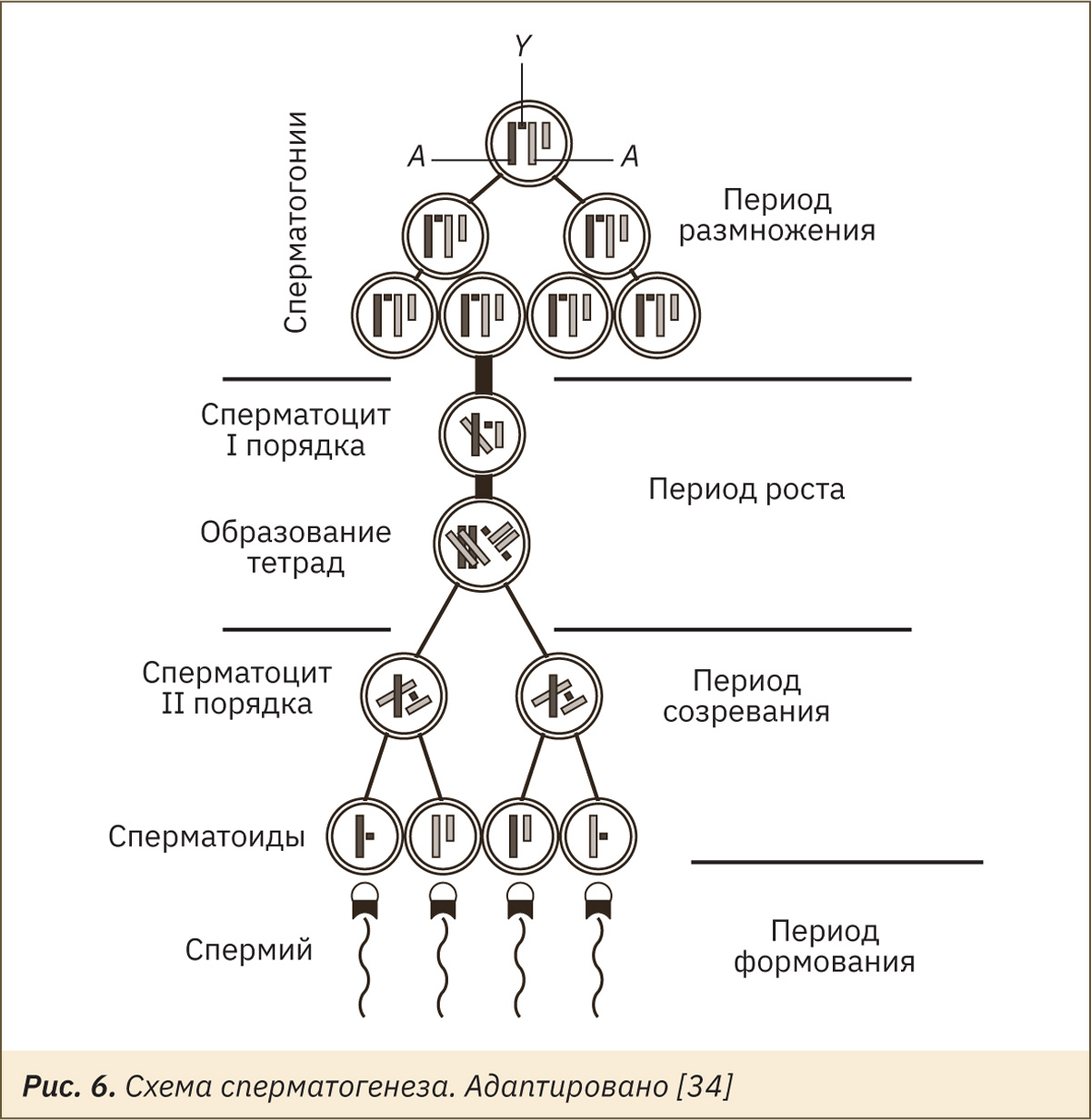
У приматов сперматогонии типа B претерпевают три митотических деления с последовательными поколениями сперматогоний В2, В3 и В4.
Сперматогонии B4 проходят еще одно митотическое деление с образованием первичных сперматоцитов. Эти первичные сперматоциты подвергаются мейозу с образованием вторичных сперматоцитов после первого деления мейоза и сперматид после второго деления. Следовательно, каждый первичный сперматоцит в конечном итоге производит 4 гаплоидных сперматида. Заключительный этап сперматогенеза — это морфологическая трансформация сперматид в высокодифференцированные оплодотворяемые зрелые сперматозоиды. Изменения включают потерю большей части цитоплазмы, развитие средней части, которая содержит митохондрии, формирование хвоста и акросомального колпачка. Таким образом, пролиферацию половых клеток можно схематически изобразить, как указано на рис. 6.
Исследования, проведенные в Индии [35], показывают, что у приматов ФСГ способствует количественному сперматогенезу и играет решающую роль в регулировании спермиогенеза.
Поскольку все части любого семенного канальца не синхронизированы, происходит непрерывное производство сперматозоидов. Начало полового созревания связано с быстрым и значительным увеличением количества клеток Сертоли, за которым следует увеличение количества стволовых сперматогоний. Сперматогенная способность семенников зависит от количества Ap-сперматогоний, которое в свою очередь зависит от увеличивающейся популяции клеток Сертоли, поскольку каждая клетка Сертоли может поддерживать только ограниченное количество половых клеток. У обыкновенной мартышки (Callithrix jacchus) продолжительность сперматогенного цикла составляет 10 дней, а сперматогенеза — 37 дней. Сообщалось, что этот вид превращает сперматогонии типа A в сперматогонии типа B со скоростью в несколько раз выше, чем сообщалось для других приматов [36–38].
Репродуктивная система на молекулярном уровне
Результаты исследования, проведенного специалистами из Центра секвенирования генома человека, показали, что геном Callithrix jacchus имеет мутацию в гене WFIKKN1, которая связана с рождением близнецов.
Интересно, что в утробе игрунки два ее детеныша, которые образуются из двух разных яйцеклеток, обмениваются стволовыми клетками крови. В результате, как выяснили ученые, в жилах одной взрослой обезьяны может содержаться от 10 до 50% клеток крови, которые являются производными от клеток другой особи. Поэтому каждая игрунка представляет собой «химеру», одновременно обладая клетками двух организмов [39].
Чтобы иммунная система не уничтожала клетки с чужеродным генетическим материалом, гены, отвечающие за иммунитет, у игрунок сильно модифицировались. В частности, гены KIR, многочисленные у других приматов, в геноме игрунок представлены всего двумя копиями. Также ученые нашли у игрунок мутации в гене GH-IGF, отвечающем за чувствительность к факторам роста. Возможно, именно с ним связаны миниатюрные размеры этих животных [39].
Заключение
В данном обзоре изложено подробное описание репродуктивной функции игрунок на популяционном, организменном, системном, органном и молекулярном уровнях, что в свою очередь дает полное понимание функционирования половой системы рассматриваемых животных.
Анализ данных литературы показал, что репродуктивный результат зависит как от самого организма, так и окружающих его факторов: половой зрелости животных, гормонального статуса, условий содержания, состава социальной группы и взаимоотношения внутри нее.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Все авторы принимали активное участие в обсуждении результатов и написании текста статьи.
Список источников
- Albert S., Wistuba J., Eildermann K. et al. Comparative marker analysis after isolation and culture of testicular cells from the immature marmoset // Cells Tissues Organs. 2012. Vol. 196. N. 6. Р. 543–554.
-
Donna G., Layne D.G., Power R.A. Husbandry, Handling, and Nutrition for Marmosets // Comparative Medicine. 2003. Vol. 53. N. 4. Р. 351–359.
-
Caro Т.M., Sellen D.W., Parish A. et al. Termination of reproduction in nonhuman and human female primates // International Journal of Primatology. 1995. Vol. 16. N. 2. Р. 205–220.
-
Cui K.H. The effect of stress on semen reduction in the marmoset monkey (Callithrix jacchus) // Human Reproduction. 1996. Vol. 11. N. 3. Р. 568–573.
-
Yoshimoto T., Takahashi E., Yamashita S. et al. Larger cages with housing unit environment enrichment improve the welfare of marmosets // Experimental Animals. 2018. Vol. 67. N. 1. Р. 31–39.
-
Акимов Д.Ю., Макарова М.Н., Акимова М.А., Бондарева Е.Д., Хан С.О. Риск-ориентированный подход к проведению мониторинга здоровья обезьян // Лабораторные животные для научных исследований. 2021. № 2. С. 69–82. [Akimov D.Yu., Makarova M.N., Akimova M.A., Bondareva E.D., Khan S.O. Risk-based approach to the health monitoring of primates // Laboratory Animals for Science. 2021. N. 2. P. 69–82. (In Russ.)]. DOI: 10.29296/2618723X-2021‑02‑09.
-
National Research Council (US) Committee on Well-Being of Nonhuman Primates. The Psychological Well-Being of Nonhuman Primates. National Academies Press, 1998. 168 р.
-
Abbott D.H., Hearn J.P. Physical, hormonal and behavioural aspects of sexual development in the marmoset monkey, Callithrix jacchus // Journal of reproduction and fertility. 1978. Vol. 53. N. 1. Р. 155–166.
-
Dixson A.F. Medial hypothalamic lesions and sexual receptivity in the female common marmoset (Callithrix jacchus) // Folia Primatologia. 1990. Vol. 54. N. 1–2. P. 46–56.
-
Dixson A.F. Effects of adrenalectomy upon proceptivity, receptivity and sexual attractiveness in ovariectomized marmosets (Callithrix jacchus) // Physiology & behavior. 1987. Vol. 39. N. 4. P. 495–559.
-
Martin R.D. Primate Origins and Evolution: A Phylogenetic Reconstruction // International Journal of Primatology. 1990. Vol. 12. Р. 77–79.
-
Rowell T.E. Female reproductive cycles and social behavior in primates // Advances in the Study of Behavior. 1972. Vol. 4. P. 69–105.
-
Harvey P.H., Martin R.D., Clutton-Brock T.H. Primate Societies. University of Chicago Press, 1987. 578 р.
-
Hearn J.P., Abbott D.H., Chambers P.C. et al. Use of the common marmoset, Callithrix jacchus, in reproductive research // Primates in Medicine. 1978. Vol. 10. Р. 40–49.
-
Dixson A.F. Primate Sexuality: Comparative Studies of the Prosimians, Monkeys, Apes, and Human Beings // International Journal of Primatology. 2012. Vol. 34. N. 1. Р. 216–218.
-
Tardif S., Carville A., Elmore D. et al. Reproduction and Breeding of Nonhuman Primates // Nonhuman Primates in Biomedical Research. 2012. Р. 197–249.
-
Einspanier A., Gore M.A. Reproduction: Definition of a Primate Model of Female Fertility // The Laboratory Primate. 2005. Р. 105–117.
-
Фридман Э.П. Занимательная приматология. 1985. 180 с. [Fridman E.P. Zanimatel’naya primatologiya. 1985. 180 p. (In Russ.)].
-
Bauer C. The baboon (Papio sp.) as a model for female reproduction studies // Contraception. 2015. Vol. 92. N. 2. P. 120–123. DOI: 10.1016/j.contraception.2015.06.007.
-
Bronson F.H. Mammalian Reproductive Biology. The University of Chicago Press, 1989. 336 р.
- Rowe N. The Pictorial Guide to the Living Primate. Pogonias Press, 1996. 263 р.
- Power M.L., Ross C.N., Schulkin J. et al. Metabolic consequences of the early onset of obesity in common marmoset monkeys // Obesity. 2013. Vol. 21. N. 12. Р. 592–598.
- Wolfe-Coote S. The Laboratory Primate: The Handbook of Experimental Animals. Elsevier Academic Press, 2005. 621 р.
- Hodges J.K., Eastman S.A.K. Monitoring ovarian function in marmosets and tamarins by the measurement of urinary estrogen metabolites // American journal of Primatology. 1984. Vol. 6. Р. 187–197.
- Eastman S.A., Makawiti D.W., Collins W.P. et al. Pattern of excretion of urinary steroid metabolites during the ovarian cycle and pregnancy in the marmoset monkey // Journal of Endocrinology. 1984. Vol. 102. N. 1. Р. 19–26.
- Einspanier A., Nubbemeyer R., Schlote S. et al. Relaxin in the marmoset monkey: secretion pattern in the ovarian cycle and early pregnancy // Biology of Reproduction. 1999. Vol. 61. N. 2. Р. 512–520.
-
Norman R.L., Lindstrom S.A., Bangsberg D. et al. Pulsatile secretion of luteinizing hormone during the menstrual cycle of rhesus macaques // Endocrinology. 1984. Vol. 115. N. 1. Р. 261–266.
-
Gilchrist R.B., Wicherek M., Heistermann M. et al. Changes in follicle-stimulating hormone and follicle populations during the ovarian cycle of the common Marmoset // Biology of Reproduction. 2001. Vol. 64. N. 1. P. 127–135.
-
Plant T.M., Gay V.L., Marshall G.R. et al. Puberty in monkeys is triggered by chemical stimulation of the hypothalamus // Proceedings of the National Academy of Sciences of the United States of America. 1989. Vol. 86. N. 7. Р. 2506–2510.
-
Plant T.M., Marshall G.R. The functional significance of FSH in spermatogenesis and the control of its secretion in male primates // Endocrine reviews. 2001. Vol. 22. N. 6. Р. 764–786.
-
Nieschlag E., Simoni M., Gromoll J. et al. Role of FSH in the regulation of spermatogenesis: clinical aspects // Clinical endocrinology. 1999. Vol. 51. N. 2. Р. 139–146.
-
Cui K.H., Matthews C.D. Anatomy of adult female common marmoset (Callithrix jacchus) reproductive system // Journal of anatomy. 1994. Vol. 185. Р. 481–486.
-
Stein F.J. Sex determination in the common marmoset (Callithrix jacchus) // Laboratory animal science. 1978. Vol. 28. N. 1. Р. 75–80.
-
Слободяник В.С., Сулейманов С.М., Антипова Л.В. Анатомия и гистология сельскохозяйственных животных, 2‑е изд. Москва: Юрайт, 2019. 387 с. [Slobodyanik V.S., Suleymanov S.M., Antipova L.V. Anatomiya i gistologiya sel’skokhozyaystvennykh zhivotnykh, 2‑ye izd. Moskva: Yurayt, 2019. 387 р. (In Russ.)].
-
Moudgal N.R., Sairam M.R. Is there a true requirement for follicle stimulating hormone in promoting spermatogenesis and fertility in primates? // Human reproduction. 1998. Vol. 13. N. 4. Р. 916–919.
-
Orth J.M., Gunsalus G.L., Lamperti A.A. Evidence from Sertoli cell-depleted rats indicates that spermatid number in adults depends on numbers of Sertoli cells produced during perinatal development // Endocrinology. 1988. Vol. 122. N. 3. Р. 787–794.
-
Millar M.R., Sharpe R.M., Weinbauer G.F. et al. Marmoset spermatogenesis: organizational similarities to the human // International journal of andrology. 2000. Vol. 23. N. 5. Р. 266–277.
-
Weinbauer G.F., Aslam H., Krishnamurthy H. et al. Quantitative analysis of spermatogenesis and apoptosis in the common marmoset (Callithrix jacchus) reveals high rates of spermatogonial turnover and high spermatogenic efficiency // Biology of reproduction. 2001. Vol. 64. N. 1. Р. 120–126.
- Worley K.C., Warren W.C., Wilson R.K. The common marmoset genome provides insight into primate biology and evolution // Nature Genetics. 2014. Vol. 46. N. 8. Р. 850–857.




