Рекомендованные и максимально допустимые объемы для ректального и интравагинального введения лекарственных средств разным видам животных
Работа выполнена без спонсорской поддержки.
Чернышова А.В., Рощина Е.А., Алексеева Л.И., Кательникова А.Е., Макарова М.Н. Рекомендованные и максимально допустимые объемы для ректального и интравагинального введения лекарственных средств разным видам животных. Лабораторные животные для научных исследований. 2023; 1. https://doi.org/10.57034/2618723X-2023-01-04
Резюме
Ректальный и интравагинальный пути введения часто используются в клинической практике, в некоторых случаях они могут быть более предпочтительными для отдельных групп пациентов: в педиатрической практике используют ректальный путь введения, для противомикробных препаратов при лечении заболеваний органов малого таза у женщин — интравагинальный путь. Для регистрации лекарственных препаратов необходимо проведение доклинических исследований на животных. Перед выполнением научно-исследовательской работы осуществляется работа биоэтической комиссии, которая в ходе своей деятельности проводит экспертизу проектов этих исследований. Ключевым этапом обсуждения комиссии является рассмотрение проекта на соответствие принципам 3Rs (принципов гуманной методики эксперимента). На сегодняшний день не существует единых требований, региональных и международных норм, которые содержали бы рекомендации по допустимым объемам введения веществ лабораторным животным ректальным и интравагинальным путями. Рассчитанные в данном исследовании объемы помогут сократить количество животных в эксперименте, а также свести к минимуму боль и дистресс. Цель настоящего исследования — определение рекомендованных и максимальных объемов веществ при ректальном и интравагинальном путях введения для животных следующих видов: хомяк сирийский, морская свинка, крыса Wistar, мышь ICR-CD1, песчанка, кролик (советская шиншилла), хорек, кошка (русская голубая), собака (бигль), карликовая свинья, мармозетка (Callithrix jacchus) и яванский макак (Macaca fascicularis). В качестве тестируемых объектов использовали коммерчески доступные суппозитории для ректального и вагинального путей применения. В зависимости от вида животных суппозитории вводили в готовой лекарственной форме или в виде расплава. Введение выполняли при фиксации животных, седацию не применяли. Критериями, относящими выбранные объемы к допустимым или максимальным, являлись показатели клинического наблюдения за животными, оцениваемые в баллах. В результате проведенной работы установлены рекомендованные (не вызывающие беспокойства или боли) и максимально допустимые (вызывающие некоторое беспокойство или кратковременную легкую боль) объемы для ректального и вагинального введения.
Введение
Ректальный и интравагинальный способы введения лекарственных препаратов, при которых реализуется доставка действующих веществ к слизистым оболочкам прямой кишки и влагалища, достаточно часто используются в доклинических исследованиях. При разработке данных лекарственных средств для местного применения требуется, чтобы готовая лекарственная форма препарата оставалась в области действия для достижения терапевтического эффекта (например, лечение запоров, геморроя, вагинита и др.). Наиболее эффективное системное действие препарат оказывает в случае, если всасывание лекарственного средства происходит через слизистые оболочки прямой кишки или влагалища (например, лечение боли, лихорадки, тошноты и т. д.) [1].
Суппозитории являются наиболее распространенной лекарственной формой для ректального и интравагинального введения, также используются пены, вкладыши и мягкие лекарственные формы [2].
Для изучения безопасности препарата требуется проведение доклинических исследований на животных1. При планировании такого исследования неправильно подобранный объем тестируемого лекарственного средства способен привести к страданию животного и оказать неблагоприятное воздействие на его организм, а полученные данные могут быть искажены или неверно интерпретированы.
Цель работы — определение объема/количества суппозиториев для интравагинального и ректального способов введения у разных видов лабораторных животных для дальнейшей разработки единых стандартов, учитывающих нормы гуманного обращения с животными.
В данной работе рекомендованный объем для однократного введения — это оптимальный объем вводимого лекарственного средства, который не вызывает у животного дискомфорт, болевые ощущения и не влияет на его поведение. Максимальный объем вводимого лекарственного средства для однократного введения — это объем, который является физиологически возможным, но может вызвать кратковременный дискомфорт или легкую кратковременную боль у животного и потребовать дополнительной подготовки перед проведением манипуляции (депривация кормом, установка внутривенного или артериального катетера, анестезия и др.). Информационная доступность и использование сведений о рекомендованных и максимальных объемах для введения лекарственных средств позволят более рационально подходить к вопросу разработки плана исследования, сводя к минимуму страдания животного [3].
Выбор вида животных в большинстве случаев не предписывается нормативными документами, чаще всего в доклинических исследованиях используются мыши, крысы, кролики, собаки, карликовые свиньи или нечеловекообразные приматы [4–6]. В данной работе, помимо выше перечисленных животных, были проведены исследования на песчанках, хомячках, морских свинках, хорьках и кошках.
При анализе литературы по теме работы были получены результаты, приведенные в табл. 1. На основании данных сведений выбраны минимальные и максимальные объемы введения лабораторным животным для исследования.

Материал и методы
Данное исследование проведено в соответствии с принципами Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей и правилами надлежащей лабораторной практики2.
Исследование проводили на следующих видах лабораторных животных:
- хомяк, морская свинка, крыса Wistar, мышь ICR-CD1, песчанка, кошка, собака, карликовая свинья, мармозетка и яванский макак. Источник получения — АО «НПО «ДОМ ФАРМАЦИИ»;
- кролик (советская шиншилла) — ФГУП ОПХ «Манихино» и хорек — ФГУП «Русский соболь».
Количество животных каждого вида указано в табл. 2.
Животных содержали в стандартных условиях в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза3. Ректальное введение осуществляли самцам или самкам, интравагинальное — самкам. В табл. 2 представлены массы тела животных и информация о лишении корма. Доступ к воде не ограничивали.
Препараты (суппозитории) выбирали таким образом, чтобы их действующие вещества не вызывали местного раздражения, побочные эффекты от приема препаратов должны быть минимальны. Для интравагинального введения использовали Хлоргексидин, суппозитории вагинальные, 16 мг (АО «Фармпроект», Россия), для ректального — Бифидумбактерин, суппозитории вагинальные и ректальные (АО «ФИРМА «ВИТАФАРМА», Россия). Выбранные препараты по своим свойствам при данных путях введения не должны оказывать токсического действия на организм животного. Подробная информация об используемых препаратах представлена в табл. 3.

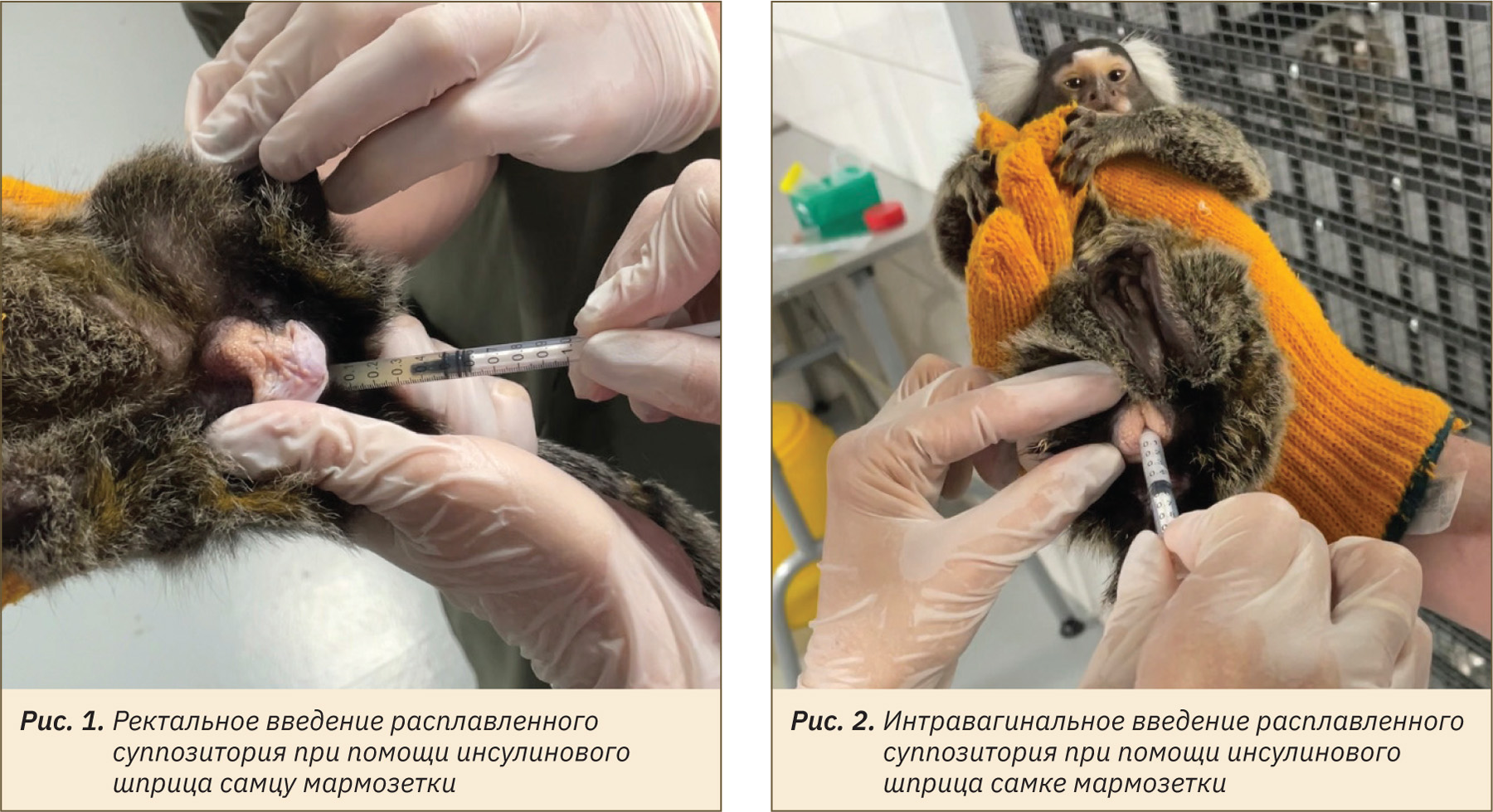
Введение суппозиториев выполняли без применения наркотизирующих ветеринарных препаратов. В случае невозможности использования готовой лекарственной формы животному вследствие малых размеров тела осуществляли предварительное расплавление суппозиториев в термостате ELMI TW-2 (СИА «ЭЛМИ», Рига) при температуре 38±2 °С в течение 10–15 мин. Введение расплавленных суппозиториев (суппозиторной массы) проводили при помощи инсулинового шприца без иглы (рис. 1 и 2).
На основании данных литературы были подобраны минимальные и максимальные объемы для интравагинального и ректального введения, представленные в табл. 4 и 5.

Введение объектов в минимальном и максимальном объемах осуществляли на одних и тех же животных. В первый день животным вводили минимальный объем, на следующий день тестировали максимальную дозу для использования, которая варьировала в зависимости от реакции и состояния животного.
Объемы введения (рекомендованные и максимальные) определяли на основании клинического наблюдения за животными в течение 30 мин после применения объектов. Оценку проводили в баллах по следующим критериям:
1) поведение животного в отношении места введения (не обращает внимания — 0; проявляет заинтересованность, вылизывает/покусывает — 1);
2) состояние готовой лекарственной формы (ГЛФ) (не вытекает — 0; выделение небольшого количества от введенного объема — 1; выделение большей части введенного объема/выпадение части или целого суппозитория — 2);
3) осмотр места введения (не отличается от состояния до введения — 0; небольшое покраснение, возможно начало отека — 1; сильное покраснение и выраженный отек — 2).
При осмотре животного регистрировали общее состояние, например, угнетение/возбуждение или другие наблюдаемые проявления дискомфорта.
Объем для введения рекомендован, если медиана баллов по результатам каждого показателя клинического наблюдения равнялась нулю, максимально возможный объем, если медиана была не более 1 балла.
Результаты и обсуждение
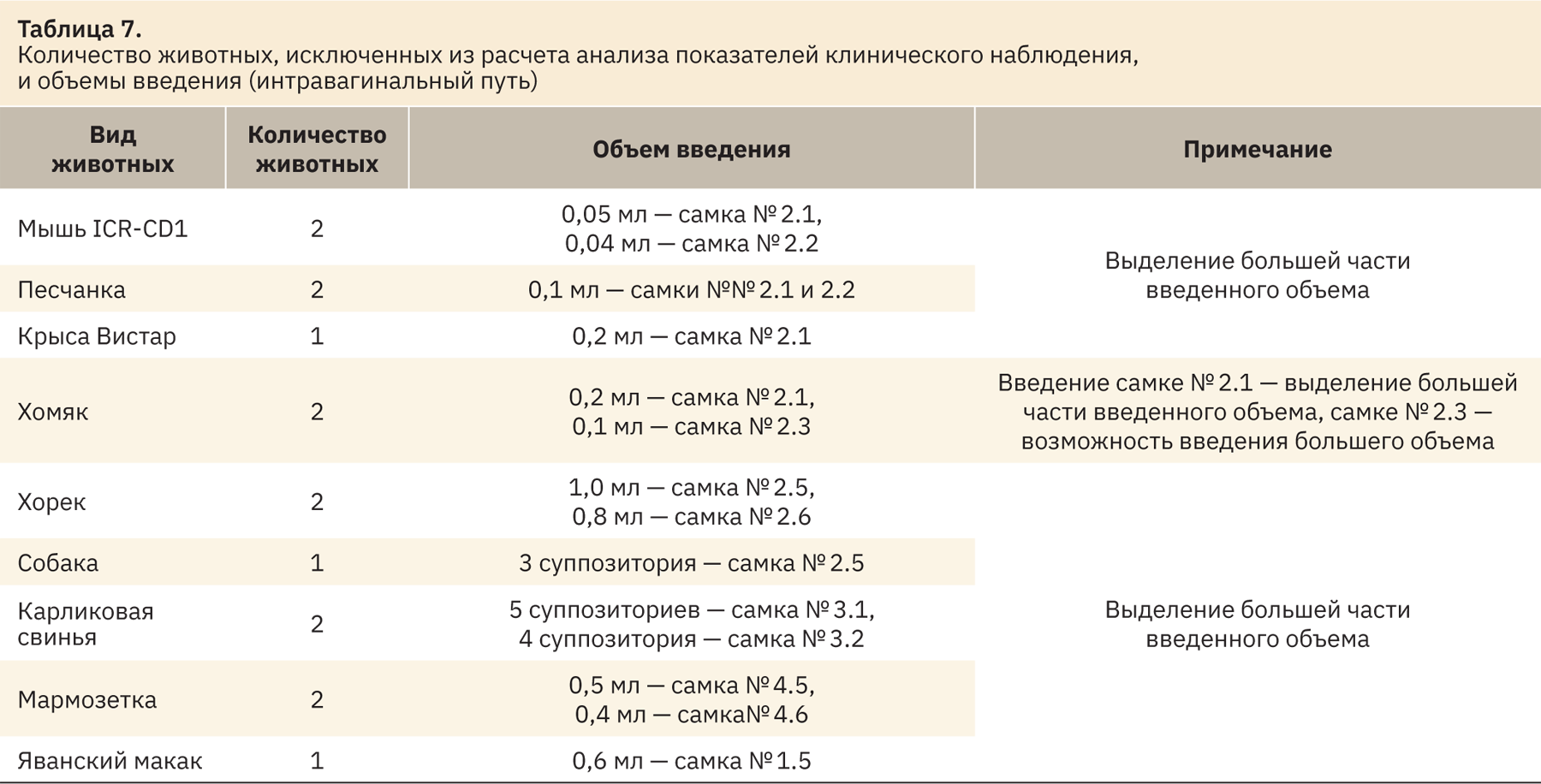
В ходе эксперимента во время использования максимальных объемов обнаружилось, что некоторые объемы введения, указанные в источниках литературы, оказались слишком большими для животных. На основе полученных данных проводилась корректировка объемов для введения последующим животным. Данные, представленные в табл. 6 и 7, отражают количество животных, исключенных из расчета медиан, и причину исключения.
Клиническое наблюдение за животными при введении минимальных объемов показало, что препарат полностью оставался в местах введения, состояние места введения не отличалось от состояния до начала процедуры, животные находились в состоянии нормы, не проявляли заинтересованность к месту введения. Данные не приводятся.
Использование максимальных объемов начинали с планируемых в соответствии с табл. 4 и 5, далее максимальные объемы введения корректировались относительно первой манипуляции, а также реакции животного. Данные объемы и количество животных указаны в табл. 6 и 7. Главным критерием изменения объема введения являлось выделение большей части используемого объема тестируемых объектов. В основном объемы введения сокращались, однако некоторым животным (песчанкам) вводились объемы, больше планируемых.
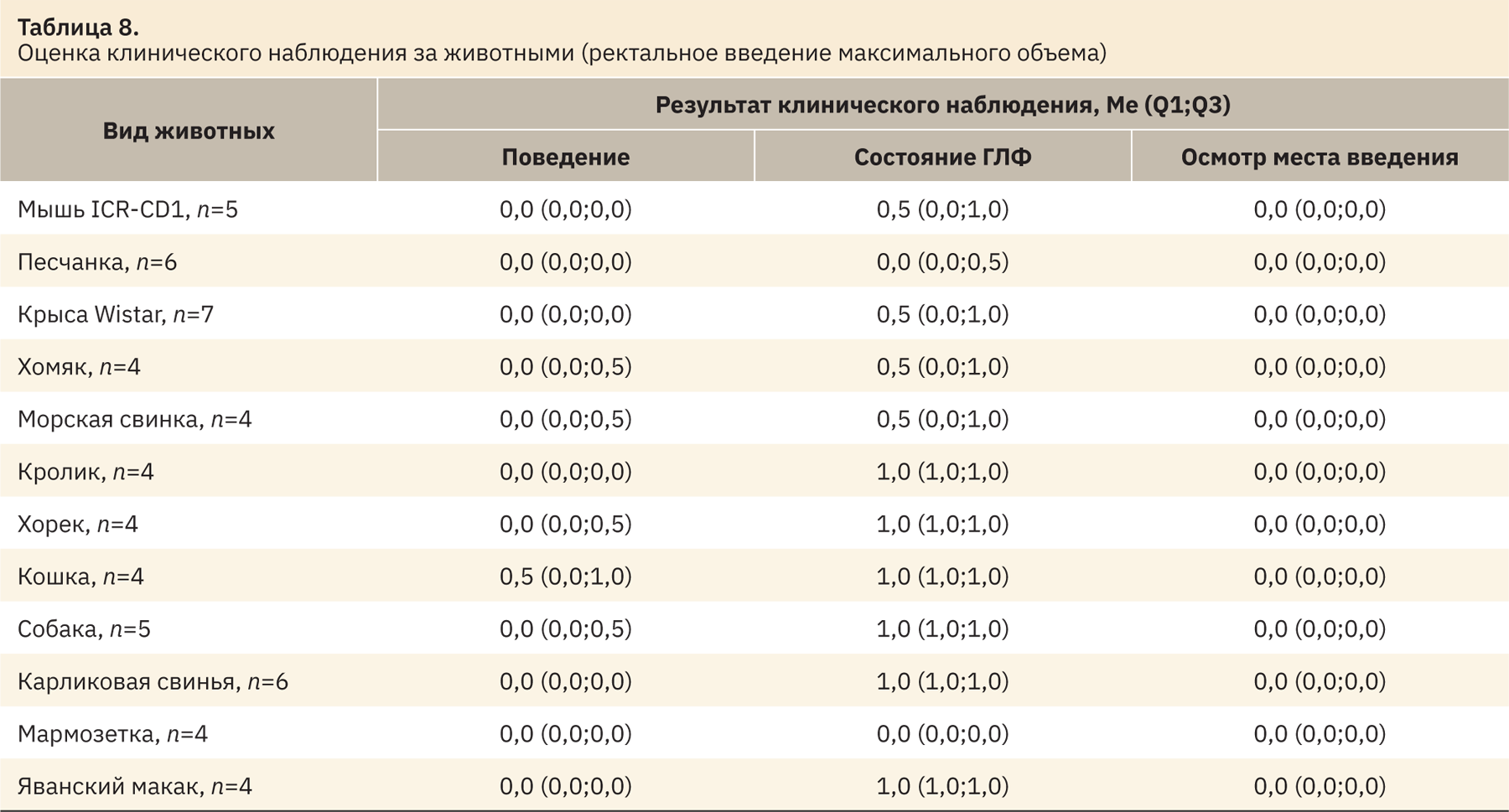
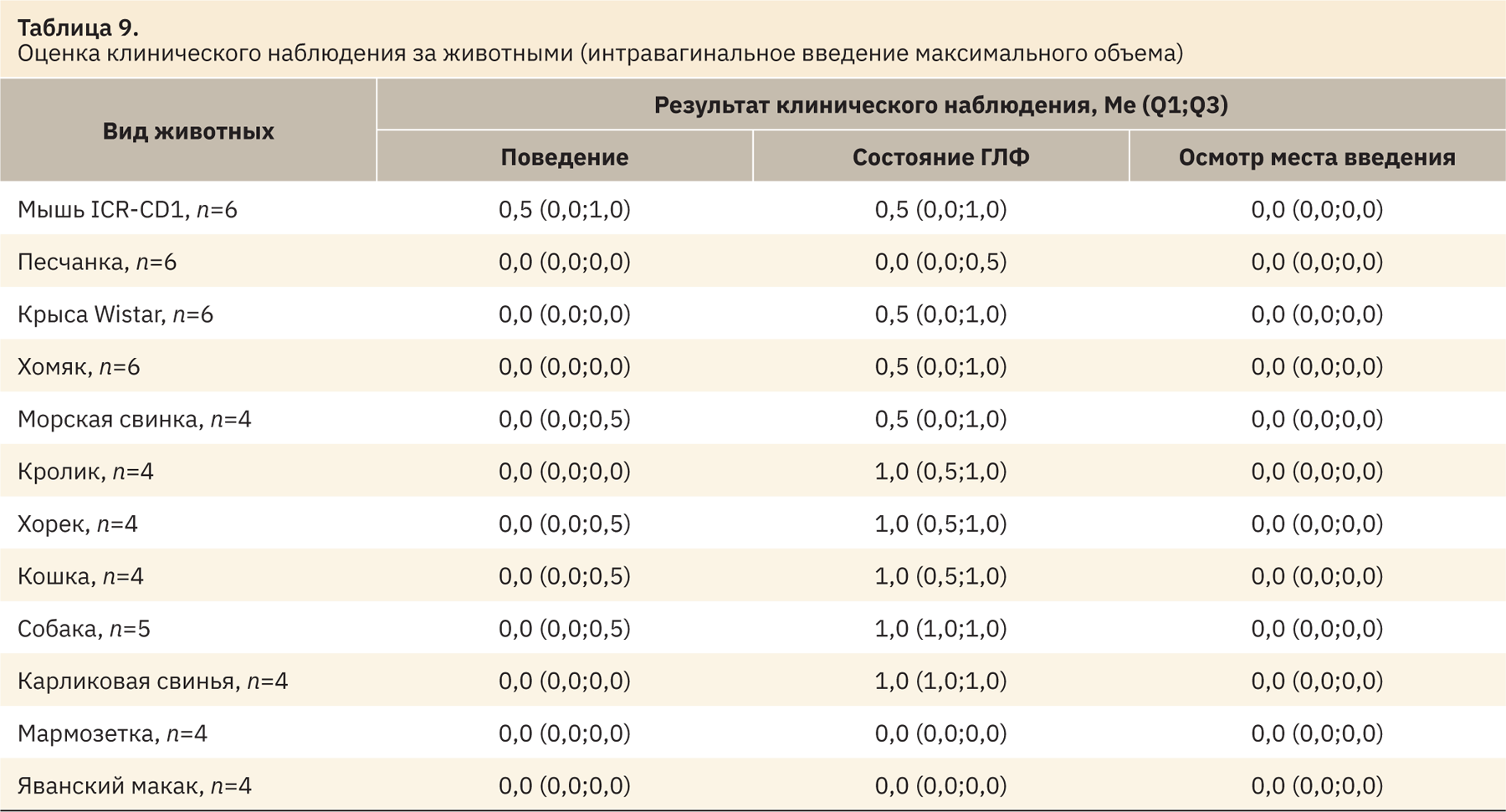
При применении максимального объема спустя 10–15 мин в месте введения наблюдали минимальное количество препарата. По результатам клинического наблюдения после процедуры, животные не испытывали дискомфорта и не проявляли внимания в отношении места введения. При использовании большого количества объема препарата фиксировали значительные потери объектов и заинтересованность животных по отношению к месту введения (за исключением грызунов и кроликов). Результаты представлены в табл. 8 и 9.
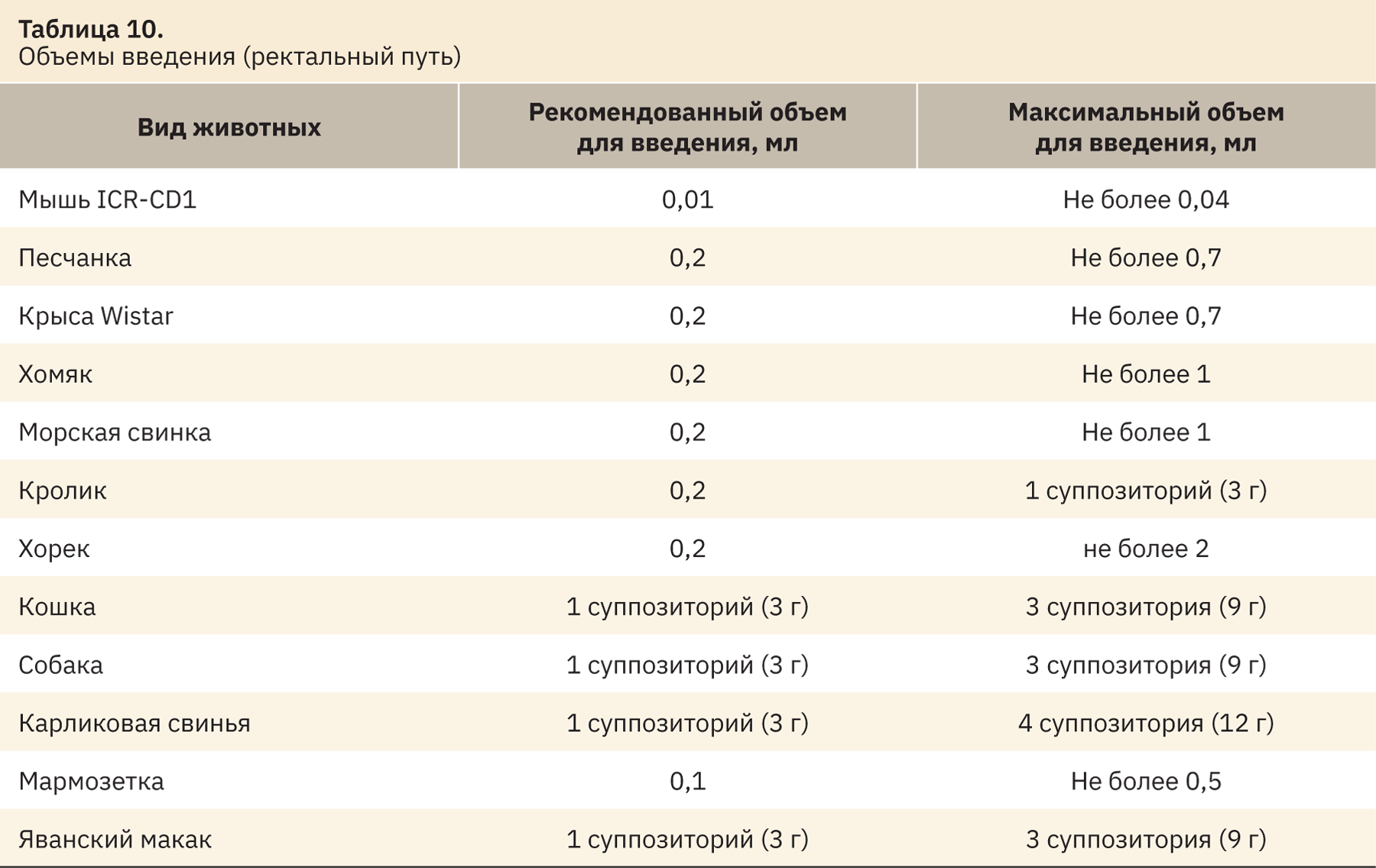
На основании полученных данных можно сделать выводы о рекомендованных и максимальных объемах введения, выводы представлены в табл. 10 и 11.
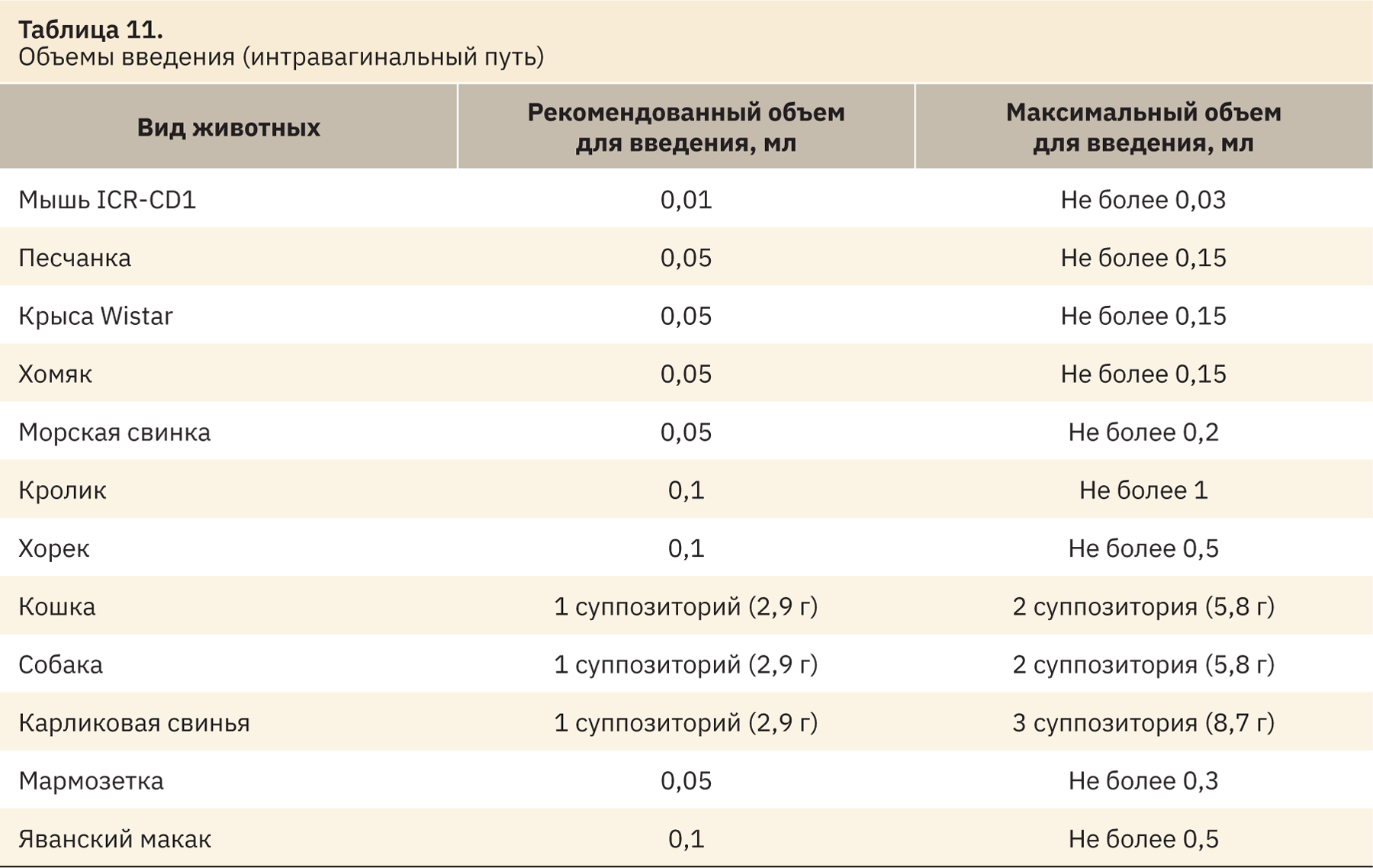
Заключение
Данное исследование позволило определить рекомендованные и максимальные объемы для ректального и интравагинального введений. В зависимости от размера животных в качестве тестируемых объектов были рассмотрены суппозитории в готовой лекарственной форме и расплавленные суппозитории.
Проведенное исследование позволило оценить и рекомендовать к применению возможные объемы введения исследуемых веществ при ректальном и интаравагинальном путях экспериментальным животным.
Проведенная работа позволит в дальнейшем гармонизировать общие вопросы дизайна доклинических исследований и ускорить процесс взаимного признания результатов, полученных в разных странах, а также будет способствовать сокращению количества лабораторных животных, ежегодно используемых для проведения экспериментов, и предотвращению получения недостоверных данных.
Сведения о конфликте интересов
М.Н. Макарова является членом редакционной коллегии журнала «Лабораторные животные для научных исследований». Остальные авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Вклад авторов
А.В. Чернышова — анализ научной и методической литературы, сбор и систематизация материала, статистическая обработка данных, написание, редактирование и доработка текста рукописи, ответственность за все аспекты работы, связанные с достоверностью данных.
Е.А. Рощина — анализ научной и методической литературы, сбор и систематизация материала, статистическая обработка данных, написание и редактирование текста рукописи.
Л.И. Алексеева — сбор и систематизация материала.
А.Е. Кательникова — анализ научной и методической литературы, редактирование текста рукописи.
М.Н. Макарова — идея исследования, редактирование текста рукописи, утверждение окончательного варианта статьи для публикации.
Список источников
-
Hua S. Physiological and Pharmaceutical Considerations for Rectal Drug Formulations // Frontiers in Pharmacology. 2019. Vol. 10. DOI: 10.3389/fphar.2019.01196.
-
Brunaugh A.D. et al. Essential Pharmaceutics // Germany: Springer Nature, 2019. 193 p.
-
Рыбакова А.В., Макарова М.Н., Кухаренко А.Е. и др. Существующие требования и подходы к дозированию лекарственных средств лабораторным животным // Ведомости Научного центра экспертизы средств медицинского применения. 2018. Т. 8. № 4. С. 207–217. [Rybakova A.V., Makarova M.N., Kuharenko A.E. et. al. Sushchestvuyushchie trebovaniya i podhody k dozirovaniyu lekarstvennyh sredstv laboratornym zhivotnym // Vedomosti Nauchnogo centra ekspertizy sredstv medicinskogo primeneniya. 2018. Vol. 8. N. 4. P. 207–217. (In Russ.)].
-
Monticello T.M., Jones T., Dambach D. et al. Current nonclinical testing paradigm enables safe entry to first-in-human clinical trials: the IQ consortium nonclinical to clinical translational database // Toxicology and Applied Pharmacology. 2017. Vol. 334. P. 100–109. DOI: 10.1016/j.taap.2017.09.006.
-
Clark M., Steger-Hartmann T. A big data approach to the concordance of the toxicity of pharmaceuticals in animals and humans // Regulatory Toxicology and Pharmacology. 2018. Vol. 96. P. 94–105. DOI: 10.1016/j.yrtph.2018.04.018.
-
Olson H., Betton G., Robinson D. et al. Concordance of the toxicity of pharmaceuticals in humans and in animals // Regulatory Toxicology and Pharmacology. 2000. Vol. 32. P. 56–67. DOI: 10.1006/rtph.2000.1399.
-
D’Cruz O.J., Waurzyniak B., Uckun F.M. Subchronic (13‑week) toxicity studies of intravaginal administration of spermicidal vanadocene dithiocarbamate in mice // Contraception. 2001. Vol. 64. N. 3. P. 177–185. DOI: 10.1016/s0010-7824(01)00245-1.
-
Ho H., Li Y., Nie G. Inhibition of embryo implantation in mice through vaginal administration of a proprotein convertase 6 inhibitor // Reproductive Biology. 2014. Vol. 14. N. 2. P. 155–159. DOI: 10.1016/j.repbio.2013.12.008.
-
Liu Y., Yang F., Feng L. et al. In vivo retention of poloxamer-based in situ hydrogels for vaginal application in mouse and rat models // Acta Pharmaceutica Sinica B. 2017. Vol. 7. N. 4. P. 502–509. DOI: 10.1016/j.apsb.2017.03.003.
-
Mahjabeen S. et al. Influence of the estrus cycle of the mouse on the disposition of SHetA2 after vaginal administration // European Journal of Pharmaceutics and Biopharmaceutics. 2018. Vol. 130. P. 272–280. DOI: 10.1016/j.ejpb.2018.07.004.
-
Nagatomi A., Mishima M., Tsuzuki O. et al. Utility of a rectal suppository containing the antiepileptic drug zonisamide // Biological and Pharmaceutical Bulletin. 1997. Vol. 20. N. 8. P. 892–986. DOI: 10.1248/bpb.20.892.
-
Sakai M., Hobara N., Hokama N. et al. Increased bioavailability of tacrolimus after rectal administration in rats // Biological and Pharmaceutical Bulletin. 2004. Vol. 27. N. 9. P. 1480–1482. DOI: 10.1248/bpb.27.1480.
-
Chen Y., Chen Y., Liu W.L. et al. Therapeutic effects of rectal administration of muscovite on experimental colitis in rats // Journal of Gastroenterology and Hepatology. 2009. Vol. 24. N. 5. P. 912–919. DOI: 10.1111/j.1440-1746.2008.05721.x.
-
Okada H., Yamazaki I., Sakura Y. et al. Desensitization of gonadotropin-releasing response following vaginal consecutive administration of leuprolide in rats // Journal of Pharmacobio-Dynamics. 1983. Vol. 6. N. 7. P. 512–522. DOI: 10.1248/bpb1978.6.512. PMID: 6417315.
-
Auletta C.S. Vaginal and Rectal Administration // Journal of the American College of Toxicology. 1994. Vol. 13. N. 1. P. 48–63. DOI: 10.3109/10915819409140655.
-
Ichikawa K., Ohata, I., Mitomi M. et al. Rectal absorption of insulin suppositories in rabbits // Journal of Pharmacy and Pharmacology. 1980. Vol. 32. N. 1. P. 314–318. DOI: 10.1111/j.2042-7158.1980.tb12927.x.
-
D’Cruz O.J., Shih M.‑J., Yiv S.H. et al. Synthesis, characterization and preclinical formulation of a dual-action phenyl phosphate derivative of bromo-methoxy zidovudine (compound WHI-07) with potent anti-HIV and spermicidal activities // Molecular Human Reproduction 1999. Vol. 5. N. 5. P. 421–432. DOI: 10.1093/molehr/5.5.421.
-
Nuttall J.P., Thake D. C, Lewis M.G. et al. Concentrations of dapivirine in the rhesus macaque and rabbit following once daily intravaginal administration of a gel formulation of [14C] dapivirine for 7 days // Antimicrobial Agents and Chemotherapy. 2008. Vol. 52. N. 3. P. 909–914. DOI: 10.1128/AAC.00330-07.
-
Eckstein P., Jackson M.C. et al. Comparison of vaginal tolerance tests of spermicidal preparations in rabbits and monkeys // Journal of Reproductive and Fertility. 1969. Vol. 20. N. 1. P. 85–93. DOI: 10.1530/jrf.0.0200085.
-
Chollet J., Mermelstein F. et al. Vaginal tamoxifen for treatment of vulvar and vaginal atrophy: Pharmacokinetics and local tolerance in a rabbit model over 28 days // International Journal of Pharmaceutics. 2019. Vol. 570. DOI: 10.1016/j.ijpharm.2019.118691.
-
Han X., Zhang Y. et al. Pharmacokinetic study of ginsenoside Re after vaginal administration in rabbits by UPLC-MS/MS determination // Chinese Herbal Medicines. 2018. Vol. 10. N. 3. P. 304–309. DOI: 10.1016/j.chmed.2018.03.014.
-
D’Cruz O.J., Waurzyniak B., Uckun F.M. Antiretroviral spermicide WHI-07 prevents vaginal and rectal transmission of feline immunodeficiency virus in domestic cats // Antimicrobial Agents and Chemotherapy. 2004. Vol. 48. N. 4. P. 1082–1088. DOI: 10.1128/AAC.48.4.1082-1088.2004.
-
Schroers M., Meyer-Lindenberg A., Reese S. et al. Pharmacokinetics of low-dose and high-dose buprenorphine in cats after rectal administration of different formulations // Journal of Feline Medicine and Surgery. 2019. Vol. 21. N. 10. P. 938–943. DOI: 10.1177/1098612X18810933.
-
Bishop S.A., Stokes C.R., Gruffydd-Jones T.J. et al. Vaginal and rectal infection of cats with feline immunodeficiency virus // Veterinary Microbiology. 1996. Vol. 51. N. 3–4. P. 217–227. DOI: 10.1016/0378-1135(96)00038-7.
-
Patton D.L., Cosgrove Sweeney Y.T. et al. Preclinical safety and efficacy assessments of dendrimer-based (SPL7013) microbicide gel formulations in a nonhuman primate model // Antimicrobial Agents and Chemotherapy. 2006. Vol. 50. N. 5. P. 1696–1700. DOI: 10.1128/AAC.50.5.1696-1700.2006.
-
Parikh U.M., Dobard C., Sharma S. et al. Complete protection from repeated vaginal simian-human immunodeficiency virus exposures in macaques by a topical gel containing tenofovir alone or with emtricitabine // Journal of Virology. 2009. Vol. 83. N. 20. P. 10358–10365. DOI: 10.1128/JVI.01073-09.
-
Pereira L.E., Clark M.R., Friend D.R. et al. Pharmacokinetic and safety analyses of tenofovir and tenofovir-emtricitabine vaginal tablets in pigtailed macaques // Antimicrobial Agents and Chemotherapy. 2014. Vol. 58. N. 5. P. 2665–2674. DOI: 10.1128/AAC.02336-13.
-
Dobard C.W., Makarova N., West-Deadwyler R. et al. Efficacy of Vaginally Administered Gel Containing Emtricitabine and Tenofovir Against Repeated Rectal Simian Human Immunodeficiency Virus Exposures in Macaques // The Journal of Infectious Diseases. 2018. Vol. 218. N. 8. P. 1284–1290. DOI: 10.1093/infdis/jiy301.
- Martlé V., Devreese M., Rauch S. et al. Comparative pharmacokinetics of imepitoin after oral and rectal administration in healthy dogs // The Veterinary Journal. 2020. Vol. 259. DOI: 10.1016/j.tvjl.2020.105459.




