Определение референтных интервалов клиренса эндогенного креатинина у лабораторных животных
Работа выполнена без спонсорской поддержки.
Мирошников М.В., Султанова К.Т., Ковалева М.А., Акимова М.А., Макарова М.Н. Определение референтных интервалов клиренса эндогенного креатинина у лабораторных животных. Лабораторные животные для научных исследований. 2022; 4. https://doi.org/10.57034/2618723X-2022-04-03
Резюме
Оценка функционального состояния почек — важная часть мониторинга здоровья лабораторных животных в доклинических исследованиях. Одними из наиболее значимых показателей для оценки функции почек являются определение концентрации креатинина в сыворотке и расчет клиренса эндогенного креатинина. Креатинин — продукт распада креатинфосфата в мышечной ткани, который в дальнейшем фильтруется из крови почками и выводится с мочой. Его уровень зависит от объема мышечной массы и интенсивности процессов метаболизма животного. Как правило, увеличение уровня креатина в крови отражает недостаточную фильтрующую способность почек, стоит отметить, что концентрация креатинина не является специфичным маркером нефропатий, что делает некорректным его одиночное использование при оценке почечной дисфункции. Одним из показателей, позволяющих отслеживать состояние здоровья животных, а также нарушения выделительной функции почек, является клиренс эндогенного креатинина, который отражает уровень клубочковой фильтрации. Как показал анализ данных литературы, информации по клиренсу эндогенного креатинина лабораторных животных недостаточно, а данные сильно разнятся не только для одного вида животных, но и для линий одного вида животных.
Цель исследования — создать базы референтных интервалов клиренса креатинина у лабораторных животных: мышей линии CD-1, монгольских песчанок, сирийских хомячков, крыс линии Wistar, морских свинок породы агути, хорьков породы тверской пастелевый, кошек породы русская голубая, собак породы бигль, карликовых свиней породы вьетнамские вислобрюхие, кроликов породы советская шиншилла, яванских макак и игрунок обыкновенных. В ходе работы был отработан метод получения образцов мочи в течение 24 ч с помощью метаболических клеток. Сбор мочи у крупных животных осуществляли, используя невпитывающий подстил (стеклянный гранулят и галька каспийская). Определение клиренса креатинина для всех животных проводили в одинаковых условиях, для чего использовали общепринятые аналитические методы. Установленные в ходе работы значения клиренса эндогенного креатинина лабораторных животных могут быть полезны при оценке нефротоксичности в рамках фармакологической безопасности, при изучении фармакологического потенциала новых нефротерапевтических агентов, а также в ходе мониторинга здоровья животных.
Введение
Оценка состояния почек в доклинических исследованиях затруднительна, поскольку показатели, используемые для этой цели (концентрация креатинина и мочевины в крови, удельный вес мочи), не изменяются до тех пор, пока не будет снижена значительная часть общей функции нефронов (более 60%) [1]. Определение клиренса эндогенного креатинина — исследование, позволяющее оценить состояние функции почек как в ходе мониторинга здоровья лабораторных животных, так и в доклинических исследованиях при оценке нефротоксичности и нефропротекции [2].
Разработано достаточно большое количество способов для определения скорости клубочковой фильтрации. Так, оценка клиренса инулина в моче и крови является «золотым стандартом» определения фильтрационной способности почек, однако ввиду высокой стоимости используется редко, поэтому более распространены определение уровня сывороточного креатинина и расчет клиренса эндогенного креатинина [3]. Креатинин обладает многими свойствами оптимального маркера фильтрации почек. В частности, он вырабатывается эндогенно и свободно фильтруется почечными клубочками, не подвергаясь метаболизму в почках [4]. Вместе с тем интерпретация изменения уровня креатинина во времени часто дает более полную и точную оценку функции почек [5, 6]. В связи с чем определение клиренса креатинина представляет собой оптимальный и практический способ измерения скорости клубочковой фильтрации, который широко используется для оценки функции почек [7, 8].
В литературе [9–12] широко представлены показатели клиренса креатинина у различных видов лабораторных животных, однако информации по методам его определения недостаточно, при этом данные сильно разнятся как среди видов, так и линий одного вида. Различия могут быть обусловлены географическими и сезонными особенностями, видом животных, индивидуальными особенностями племенного ядра определенной линии, депривацией по воде или, наоборот, усиленным питьем, эмоциональным фоном животных и др. Еще одним фактором, оказывающим влияние на полученные данные, является способ забора мочи у животных. К другим вероятным причинам различий можно отнести методы определения клиренса креатинина [13]. Оптимальная модель установления клиренса креатинина должна обладать свойствами, подходящими для большого количества лабораторных животных, и учитывать особенности каждого вида. Таким образом, клиренс креатинина — важный показатель, который необходимо использовать в доклинических исследованиях для мониторинга состояния почек, а проблема его определения у лабораторных животных актуальна и требует решения.
Цель данной работы — создать базу референтных интервалов клиренса эндогенного креатинина у лабораторных животных в доклинических исследованиях для дальнейшего применения в исследовательской и научной практике.
Материал и методы
Для формирования референтных интервалов использовали данные, полученные от интактных животных в апреле–июне 2022 г. в АО «НПО «ДОМ ФАРМАЦИИ». Все проведенные эксперименты были одобрены биоэтической комиссией. Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986), и в соответствии с правилами надлежащей лабораторной практики.
Анализу подлежали данные, полученные от мышей линии CD-1, монгольских песчанок, сирийских хомячков, крыс линии Wistar, морских свинок породы агути, хорьков породы тверской пастелевый, кошек породы русская голубая, собак породы бигль, карликовых свиней породы вьетнамские вислобрюхие, кроликов породы советская шиншилла, яванских макак и игрунок обыкновенных. Характеристики животных представлены в табл. 1.
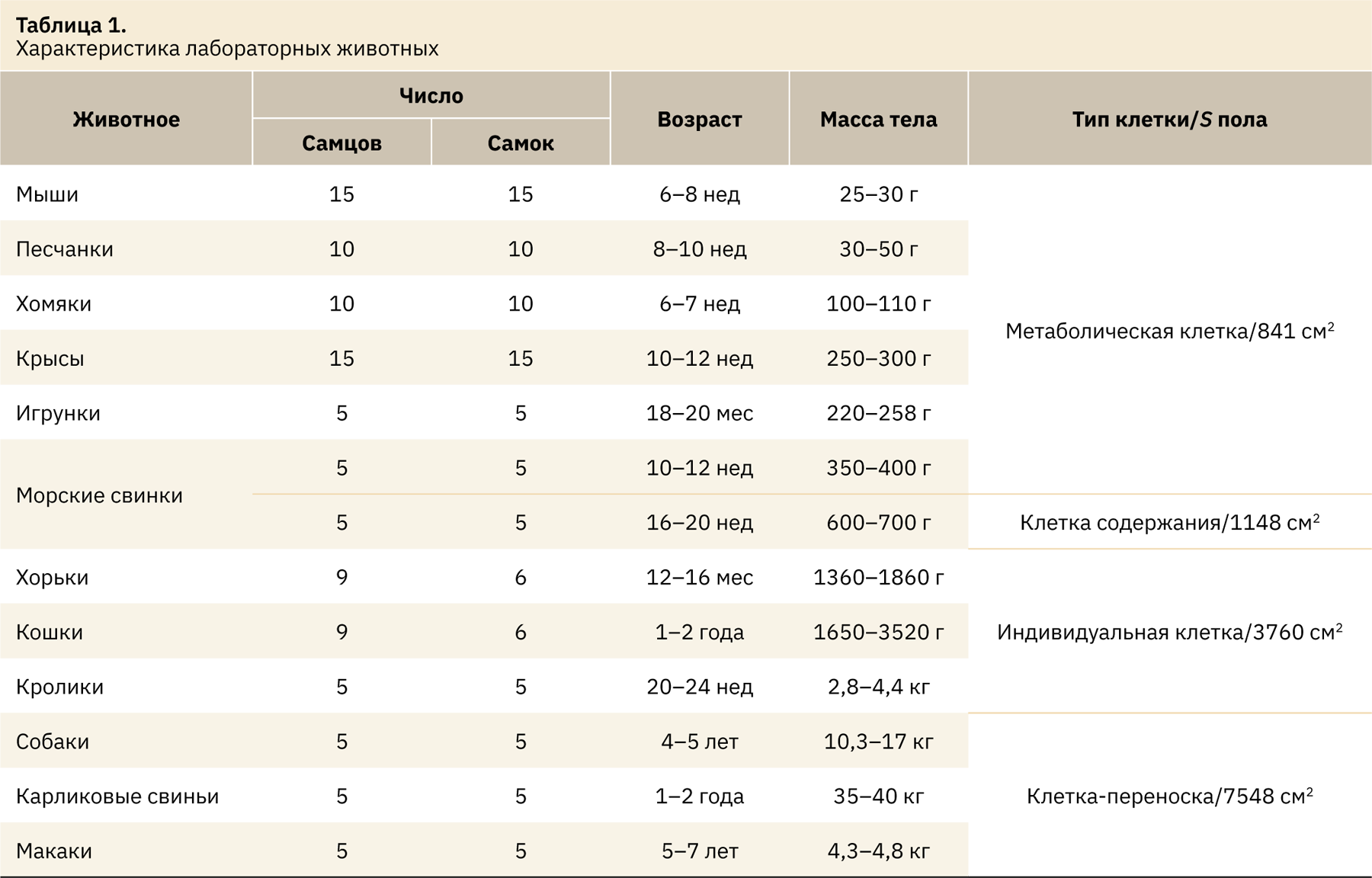
Самки были небеременными и нерожавшими, фазы менструального цикла не учитывали. Лабораторных животных содержали в помещениях с контролируемым микроклиматом, соответствующим потребностям вида, с доступом к воде и пище ad libitum.
Для сбора мочи мелких лабораторных животных помещали в индивидуальную метаболическую клетку TECNIPLAST (TECNIPLAST®, Италия) или RMC039 (Orchid Scientific, Индия) с присоединенной к ней чистой пробиркой. Процедура сбора мочи была применима к грызунам (мышам, морским свинкам массой до 450 г, песчанкам, хомякам, крысам) и мармозеткам (игрунка обыкновенная). С целью получения суточной мочи в индивидуальные клетки животных помещали на 24 ч. При необходимости всем животным проводили обработку поверхности лапок от загрязнений перед помещением в метаболические клетки. Дополнительную водную нагрузку (дополнительное вынужденное выпаивание водой) не использовали. Животным обеспечивался свободный доступ к корму и воде (ad libitum), согласно видовым потребностям. Преимуществом метода является предотвращение испарений мочи. Однако данный метод не применим для крупных животных.
Сбор мочи крупных животных осуществляли с помощью невпитывающего подстила. В качестве подстила для кроликов, хорьков и кошек использовали стеклянный гранулят (стеклярус диаметром 4–5 мм), для карликовых свиней, собак и яванских макак — гальку каспийскую (фракция от 40 до 100 мм). Для кроликов, хорьков и кошек невпитывающий подстил засыпался на дно индивидуальной клетки. Морские свинки занимали промежуточное положение по массе тела: животные с массой до 450 г помещались в метаболические клетки для мелких грызунов, животные с массой более 450 г (600–700 г) содержались в клетке на стеклянном грануляте. Стеклярус распределяли равномерно по дну клетки, высота заполнения не менее 3 см. Карликовые свиньи, собаки, макаки яванские помещались индивидуально на 24 ч в коммерческие клетки-переноски (площадь пола 7548 см2). Площадь индивидуальной клетки-переноски полностью покрывали галькой, при этом высота ее слоя была не менее 10 см. Спустя 24 ч животных возвращали в клетки/вольеры содержания или пересаживали на обычный древесный подстил. Метод сбора мочи при помощи невпитывающего подстила оказался удобен для крупных животных, однако стоит учесть возможность испарения мочи и ее загрязнения.
Также немаловажным фактором является кормление и поение животных. Во избежание загрязнения биообразцов кормом и попадания в них воды карликовым свиньям обеспечивался свободный доступ к пище согласно видовым потребностям 2 раза в день, утром и вечером с интервалом между кормлениями 8–9 ч на 10–12 мин, а собакам — 2 раза в день по 7–10 мин. Макакам и мармозеткам пищу передавали в клетку (непосредственно в лапки животного) 5 раз в день (каждые 4–5 ч), остатки еды сразу же удаляли из клетки-переноски. Поение приматов проводили при помощи бутылочки с соской объемом 0,5 л. Остальным животным (кошки, хорьки, морские свинки и кролики) обеспечивался свободный доступ к корму и воде (ad libitum) согласно видовым потребностям.
Мочу от всех видов животных собирали в лабораторные пробирки «МиниМед» (Россия), используя весь образец, насколько это было возможно. В зависимости от количества суточной мочи применяли пробирки объемом 15 мл (цена деления 0,5 мл), 60 мл (цена деления 5 мл) и 120 мл (цена деления 10 мл). В пробирках замеряли объем мочи. В случае необходимости подсчета объема мочи меньшего, чем цена деления пробирки, использовали дозатор объемом 20–200 мкл (Thermo Scientific Ленпипет).
Забор крови у мышей, крыс, песчанок, морских свинок и хомячков осуществляли посредством сердечной пункции. Вынужденную эвтаназию у данных животных проводили с применением диоксида углерода при помощи CO2‑камеры, что является гуманной конечной точкой в доклинических исследованиях (AVMA guidelines for the euthanasia of animals: 2020 edition), после чего кровь забирали из сердца. У кроликов кровь отбирали из ушной вены, у собак и кошек — из подкожной вены грудной конечности, у карликовых свиней — из яремной вены, у яванских макак — из бедренной вены, у хорьков — из локтевой вены. Кровь отбирали в вакуумные пластиковые пробирки (ООО «КОРВЕЙ», Россия) объемом 0,5 или 1 мл (в зависимости от объема циркулирующей крови животного).
Определение концентрации креатинина для всех животных проводили в одинаковых условиях с использованием общепринятых аналитических методов. Для получения сыворотки кровь центрифугировали в течение 15 мин при 3000 об/мин на центрифуге ОПн-3.04 «Дастан» (Киргизия). Полученную сыворотку переносили во вторичные пробирки, в которых проводили дальнейшую диагностику. Концентрацию креатинина регистрировали в сыворотке крови животных на автоматическом биохимическом анализаторе Rendom Access A-25 (BioSystems, Испания) с использованием соответствующего набора (Creatinine, BioSystems, Испания).
Мочу центрифугировали в течение 15 мин при 1500 об/мин на центрифуге ОПн-3.04 «Дастан» (Киргизия). Определение креатинина в моче проводили аналогично таковому в сыворотке крови, но с предварительным разведением пробы дистиллированной водой в 50 раз (согласно инструкции производителя), что было в дальнейшем учтено при подсчете клиренса креатинина. Креатинин мочи и сыворотки крови был определен с помощью кинетического метода Яффе.
Клиренс креатинина рассчитывали по формуле:
CrCl = (U×V)/S,
где U — концентрация креатинина в моче, мкмоль/л; V — объем мочи, собранной за 24 ч, мл/мин; S — концентрация креатинина в сыворотке крови, мкмоль/л.
Статистическую обработку осуществляли с использованием лицензированного программного обеспечения Prism 9.2.0 (GraphPad Software, США), статистические выбросы оценивали с помощью метода Тьюки, вид распределения определяли, используя критерий Шапиро–Уилка, сравнение между животными разного пола проводили с применением U-критерия Манна–Уитни и t-критерия Стьюдента.
Результаты и обсуждение
На первом этапе исследования были устранены статистические выбросы, которые определяли отдельно для каждого показателя животных по методу Тьюки (табл. 2). Были исключены данные, лежащие за пределами интервала Q3 и Q1 (1‑го и 3‑го квартилей). Межквартильный интервал IQR вычисляли как Q3–Q1. Верхний и нижний пределы рассчитывали следующим образом [14]:
Q1–1,5IQR и Q3+1,5IQR.
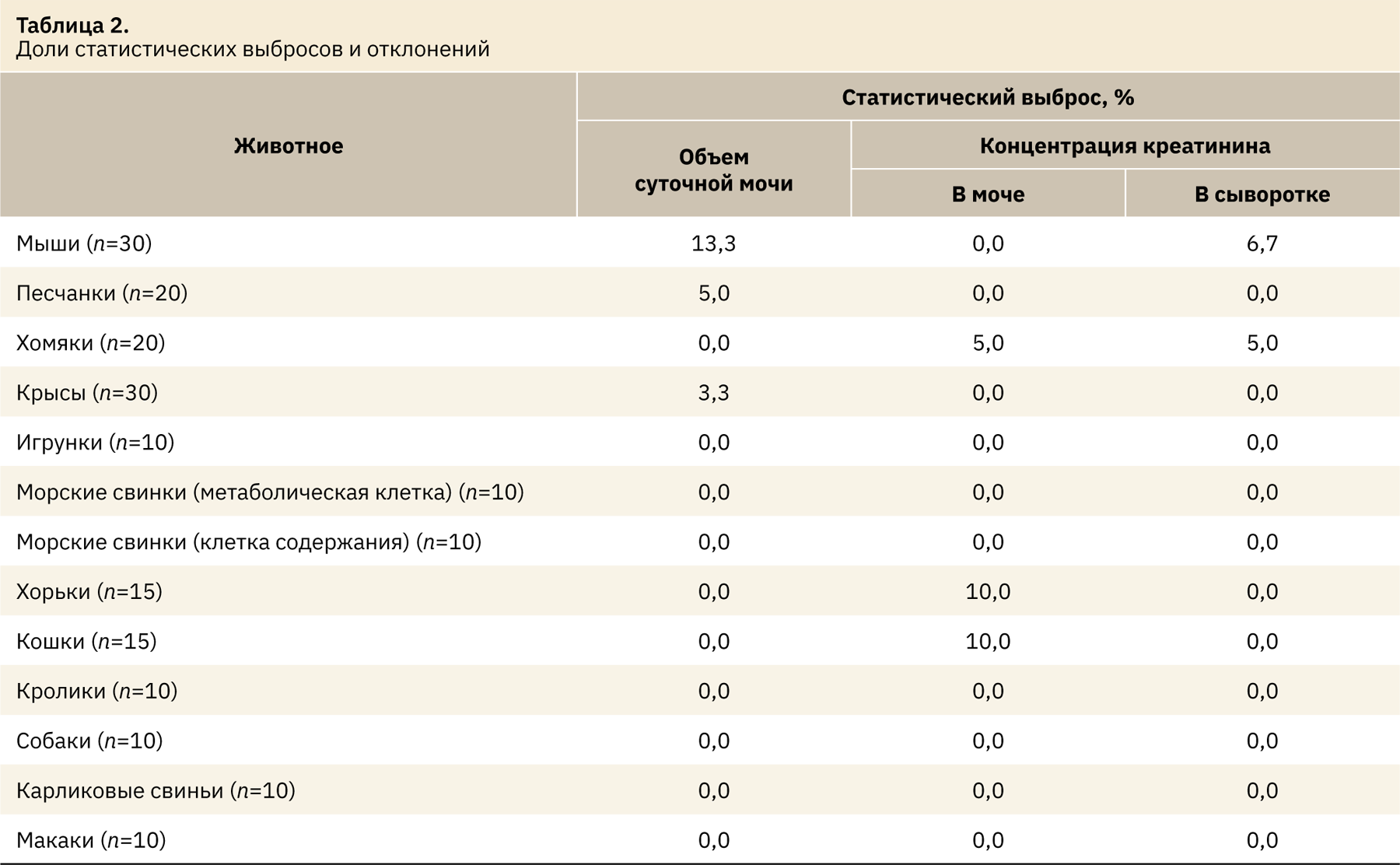
Наибольшие статистические выбросы при анализе концентрации креатинина в моче наблюдались у хорьков и кошек. Максимальные отклонения в концентрации креатинина в сыворотке крови были зарегистрированы у мышей и хомяков. Наибольшие статистические выбросы по объему суточной мочи определялись у мышей, песчанок и крыс.
В табл. 3 представлены диапазоны значений концентрации креатинина в моче, сыворотке, а также объем суточной мочи исследуемых животных.

Концентрация креатинина в крови и моче животных, участвующих в эксперименте, была сопоставима с таковой в источниках литературы [15–17] и соответствовала нормам здоровья. Объем суточной мочи некоторых видов животных оказался меньше, чем представленный в данных литературы. Так, объем суточной мочи хорьков в среднем в работе [18] составляет 23–28 мл, а в настоящем исследовании удалось собрать 11–15 мл от каждого животного. Объем суточной мочи собак в источнике литературы [16] в среднем составляет 20–40 мл/кг (206–680 мл на массу 10,3–17 кг), у животных с той же массой из нашего центра удалось собрать около 80–110 мл. Кролик выделяет в сутки 20–350 мл мочи [16], нам удалось собрать 13–31 мл мочи. У карликовых свиней в среднем в сутки выделяется 300 мл [19], в исследовании объем мочи рассматриваемых животных составлял 90–110 мл. Учитывая, что в работу были взяты здоровые половозрелые особи без хронической патологии или анатомических отклонений, выявленные различия в объемах биоматериала, вероятно, связаны с методикой сбора мочи и ее особенностями. Полученную информацию необходимо учитывать и принимать во внимание в будущих исследованиях. Ввиду отсутствия различий в объеме мочи, концентрации креатинина в сыворотке крови и моче между самцами и самками, а также небольшого количества животных, участвовавших в эксперименте, расчет клиренса эндогенного креатинина проводился без учета пола.
Референтные интервалы для полученных результатов в зависимости от вида их распределения рассчитывали как:
Хср±1,96SD — для параметрического распределения (далее Хср±1,96SD);
2,5–97,5‰ (процентили) — для непараметрического распределения.
Полученные референтные интервалы клиренса креатинина лабораторных животных представлены в табл. 4.

Стоит заметить, что значения клиренса эндогенного креатинина, рассчитанные для морских свинок (см. табл. 4), которые находились в метаболических клетках и клетках содержания, практически совпадают, что может свидетельствовать о взаимозаменяемости двух методов сбора мочи. Способ посадки животных существенно не влияет на конечный результат.
В табл. 5 представлены данные литературы, касающиеся уровня клиренса креатинина лабораторных животных, а также показатели здоровых мужчин и женщин.
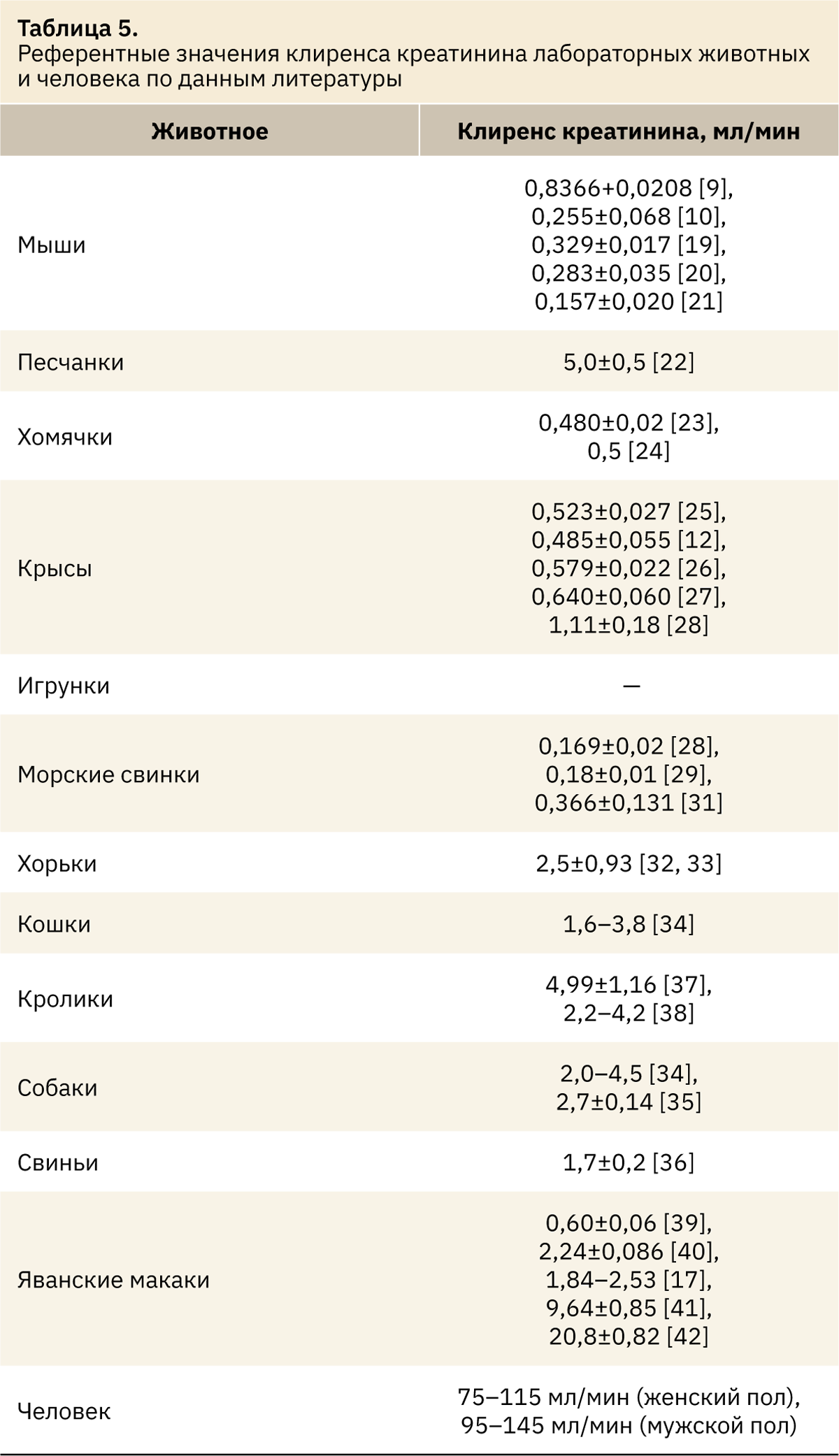
Рассчитанные значения клиренса креатинина у мышей, песчанок, хомяков и кроликов оказались ниже данных литературы более чем в 2 раза. Референтный интервал клиренса креатинина крыс, морских свинок, хорьков и кошек в целом совпадал с опубликованными данными, что может свидетельствовать о сходимости полученных результатов и значений, представленных в литературе. Диапазон значений, полученных в исследовании собак и карликовых свиней, был шире, описанных в литературе. Показатели клиренса эндогенного креатинина яванских макак, по одним данным, были выше [17, 39, 40], по другим, — значительно ниже, указанных в литературе [42]. Замеченные несоответствия, вероятно, связаны с широким спектром особенностей, описанных выше. При сравнении полученных значений и данных литературы авторам статьи не встретилась опубликованная информация об эндогенном клиренсе креатинина у игрунок.
Стоит подходить с осторожностью к оценке состояния работы почек лабораторных животных с помощью клиренса эндогенного креатинина. Слишком низкие значения, даже находящиеся в пределах референтных интервалов, регистрируемые на протяжении длительного времени, могут натолкнуть исследователя на предположение о наличии развивающейся или уже присутствующей патологии (гломерулонефрит, пиелонефрит, амилоидоз, нефролитиаз, хроническая почечная недостаточность, застойная сердечная недостаточность и др.). Токсическое воздействие на почки также оказывают и некоторые лекарственные средства (особенно в сочетании с диуретиками): нестероидные противовоспалительные средства, аминогликозиды, цефалоспорины первого поколения, сульфаниламиды, противоопухолевые препараты, йодсодержащие контрастные препараты, бензодиазепины, трициклические антидепрессанты, тяжелые металлы и др. [43]. К причинам понижения клиренса эндогенного креатинина также относится пожилой возраст животного. Патологическими причинами повышенного клиренса креатинина могут быть сахарный диабет, вплоть до развития диабетической нефропатии, хронический гломерулонефрит с нефросклерозом, ранняя стадия гипертонической болезни и др. К непатологическим причинам относится большое количество белка в рационе питания или интенсивная физическая нагрузка.
Для корректного определения эталонного интервала клиренса креатинина должны учитываться аналитические и преаналитические аспекты, а также воспроизводимость метода. Факторами для создания допустимого «нормального диапазона» являются репрезентативность отобранной выборки, достаточное количество образцов и адекватные статистические методы, используемые для расчета референтного интервала. На практике в ветеринарных лабораториях и центрах доклинических исследований часто возникают проблемы со всеми перечисленными аспектами. Для оценки статуса здоровья животных, функции почек у лабораторных животных при изучении токсичности и фармакологической эффективности лекарственных веществ референтные интервалы клиренса эндогенного креатинина целесообразнее всего рассчитывать индивидуально в каждой лаборатории.
Заключение
Клиренс эндогенного креатинина — значимый показатель уровня клубочковой фильтрации, используемый при оценке нефротоксичности и нефротерапевтического потенциала новых лекарственных веществ. Ввиду наличия широкого разброса значений рассматриваемого показателя у лабораторных животных в источниках литературы, а также большого количества факторов, влияющих на его определение, наилучшим решением является расчет клиренса эндогенного креатинина в каждой лаборатории отдельно.
В ходе исследования были определены референтные интервалы клиренса креатинина у мышей, песчанок, хомяков, игрунок, морских свинок, крыс, кроликов, хорьков, кошек, собак, карликовых свиней и яванских макак. В ходе проведения исследования было показано, что способ посадки животных для забора мочи — метаболическая клетка или клетка содержания — существенно не влияет на расчет клиренса эндогенного креатинина. Полученные значения у мышей, песчанок, хомяков и кроликов оказались ниже данных литературы. Референтные интервалы клиренса креатинина крыс, морских свинок, хорьков и кошек в целом совпадали с публикационными данными. Диапазон значений, полученных от собак и карликовых свиней, был шире указанных в литературе, а полученные показатели яванских макак, по одним данным, были выше, по другим, — значительно ниже тех, которые описаны в литературе.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
М.В. Мирошников — анализ научной и методической литературы, написание, редактирование и доработка текста рукописи, ответственность за все аспекты работы, связанные с достоверностью данных.
К.Т. Султанова — написание и редактирование текста рукописи, обобщение результатов исследования, работа с табличным материалом.
М.А. Ковалева — анализ научной и методической литературы, редактирование текста рукописи.
М.А. Акимова — работа с лабораторными животными, получение первичных данных.
М.Н. Макарова — идея, критический пересмотр содержания.
Список источников
-
Watson A.D.J., Lefebvre H.P., Concordet D. et al. Plasma exogenous creatinine clearance test in dogs: comparison with other methods and proposed limited sampling strategy // Journal of Veterinary Internal Medicine. 2002. Vol. 16. N. 1. P. 22–33. DOI: 10.1892/0891-6640(2002)016<0022:peccti>2.3.co;2.
-
Obert L.A., Elmore S.A., Ennulat D. et al. A Review of Specific Biomarkers of Chronic Renal Injury and Their Potential Application in Nonclinical Safety Assessment Studies // Toxicologic pathology. 2021. Vol. 49. N. 5. Р. 996–1023. DOI: 10.1177/0192623320985045.
-
Schwartz G.J., Furth S.L. Glomerular filtration rate measurement and estimation in chronic kidney disease // Pediatric nephrology. 2007. Vol. 22. N. 11. P. 1839–1848. DOI: 10.1007/s00467‑006‑0358‑1.
-
Von Hendy-Willson V.E., Pressler B.M. An overview of glomerular filtration rate testing in dogs and cats // The Veterinary Journal. 2011. Vol. 188. N. 2. P. 156–165. DOI: 10.1016/j.tvjl.2010.05.006.
-
Stonard MD. Assessment of renal function and damage in animal species. A review of the current approach of the academic, governmental and industrial institutions represented by the Animal Clinical Chemistry Association // Journal of Applied Toxicology. 1990. Vol. 10. N. 4. P. 267–274. DOI: 10.1002/jat.2550100407.
-
Gounden V., Bhatt H., Jialal I. Renal function tests. 2018.
-
Peake M., Whiting M. Measurement of serum creatinine — current status and future goals // Clinical biochemist reviews. 2006. Vol. 27. N. 4. P. 173.
-
Sandilands E.A., Dhaun N., Dear J.W. et al. Measurement of renal function in patients with chronic kidney disease // British journal of clinical pharmacology. 2013. Vol. 76. N. 4. P. 504–515. DOI: 10.1111/bcp.1219.
-
Заалишвили Т.В. Функционально-морфологический анализ экспериментальной модели амилоидоза почек у мышей // Влияние монотерапии милдронатом. Автореф. дисс. канд. Владикавказ. 2005. [Zaalishvili T.V. Funkcional’no-morfologicheskij analiz eksperimental’noj modeli amiloidoza pochek u myshej // Vliyanie monoterapii mildronatom. Avtoref. diss. kand. Vladikavkaz. 2005. (In Russ.)].
-
Takahashi N., Boysen G., Li F.Y.L.I. et al. Tandem mass spectrometry measurements of creatinine in mouse plasma and urine for determining glomerular filtration rate // Kidney international. 2007. Vol. 71. N. 3. P. 266–271. DOI: 10.1038/sj.ki.5002033.
-
Байрашева В.К., Бабенко А.Ю., Дмитриев Ю.В. и др. Новая модель сахарного диабета 2‑ого типа и диабетической нефропатии у крыс // Трансляционная медицина. 2016. Т. 3 № 4. С. 44–55. [Bajrasheva V.K., Babenko A.YU., Dmitriev YU. V. i dr. Novaya model’ saharnogo diabeta 2‑ogo tipa i diabeticheskoj nefropatii u krys // Translyacionnaya medicina. 2016. Vol. 3. N. 4. P. 44–55. (In Russ.)].
-
Гоженко А.И., Карчаускас В.Ю., Доломатов С.И. Влияние водной и гиперосмотической нагрузок на клиренс креатинина при экспериментальной нефропатии, вызванной хлоридом ртути // Нефрология. 2002. Т. 6. № 3. С. 72–74. [Gozhenko A.I., Karchauskas V.YU. Dolomatov S.I. Vliyanie vodnoj i giperosmoticheskoj nagruzok na klirens kreatinina pri eksperimental’noj nefropatii, vyzvannoj hloridom rtuti // Nefrologiya. 2002. Vol. 6. N. 3. P. 72–74. (In Russ.)].
-
Cockcroft D.W., Gault H. Prediction of creatinine clearance from serum creatinine // Nephron. 1976. Vol. 16. N. 1. P. 31–41.
-
Tukey J.W. et al. Exploratory data analysis. 1977. Vol. 2. P. 131–160.
-
Colby L.A., Nowland M.H., Kennedy L.H. Clinical laboratory animal medicine: an introduction. 2019. 512 p.
-
Fox J.G. Laboratory animal medicine. Elsevier. 2015.
-
Kurtz D.M., Travlos G.S. (ed.). The clinical chemistry of laboratory animals. CRC Press. 2017.
-
Крышень К.Л., Кательникова А.Е., Макарова М.Н. и др. Особенности экспериментальной работы с хорьками // Лабораторные животные для научных исследований. 2019. № 2. С. 10. [Kryshen’ K.L., Katel’nikova A.E., Makarova M.N. i dr. Osobennosti eksperimental’noj raboty s hor’kami // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2019. N. 2. P. 10. (In Russ.)].
-
Swindle M.M. Swine in the laboratory: surgery, anesthesia, imaging, and experimental techniques. CRC press. 2007.
-
Nasir O., Artunc F., Saeed A. et al. Effects of gum arabic (Acacia senegal) on water and electrolyte balance in healthy mice // Journal of Renal Nutrition. 2008. Vol. 18. N. 2. P. 230–238. DOI: 10.1053/j.jrn.2007.08.004.
-
Qi Z., Whitt I., Mehta A. et al. Serial determination of glomerular filtration rate in conscious mice using FITC-inulin clearance // American Journal of Physiology-Renal Physiology. 2003. Vol. 286. N. 3. P. F590–F596. DOI: 10.1152/ajprenal.00324.2003.
-
Nouri Z., Zhang X.Y., Wang D.H. The physiological and molecular mechanisms to maintain water and salt homeostasis in response to high salt intake in Mongolian gerbils (Meriones unguiculatus) // Journal of Comparative Physiology B. 2020. Vol. 190. N. 5. P. 641–654. DOI: 10.1007/s00360‑020‑01287‑0.
-
Shibasaki T., Xu Q.Y., Ohno I. et al. Effect of triethylenepentaminehexaacetic acid on the renal damage in cadmium-treated Syrian hamsters // Biological trace element research. 1995. Vol. 50. N. 2. P. 157–165. DOI: 10.1007/BF02789418.
-
He L., Hao L., Fu X. et al. Severe hypertriglyceridemia and hypercholesterolemia accelerating renal injury: a novel model of type 1 diabetic hamsters induced by short-term high-fat/high-cholesterol diet and low-dose streptozotocin // BMC nephrology. 2015. Vol. 16. N. 1. P. 1–12. DOI: 10.1186/s12882‑015‑0041‑5.
-
Гоженко А.И., Доломатов С.И., Лобанов А.К. и др. Влияние рифампицина на функциональное состояние почек белых крыс // Нефрология. 2005. Т. 9. № 2. С. 101–103. [Gozhenko A.I., Dolomatov S.I., Lobanov A.K. i dr. Vliyanie rifampicina na funkcional’noe sostoyanie pochek belyh krys // Nefrologiya. 2005. Vol. 9. N. 2. P. 101–103. (In Russ.)]. DOI: 10.24884/1561‑6274‑2005‑9‑2‑101‑103.
-
Гоженко А.И., Доломатов С.И., Доломатова Е.А. Реакция почек белых крыс на введение малых доз нитрита натрия // Нефрология. 2004. Т. 8. № 2. С. 86–89. [Gozhenko A.I., Dolomatov S.I., Dolomatova E.A. Reakciya pochek belyh krys na vvedenie malyh doz nitrita natriya // Nefrologiya. 2004. Vol. 8. N. 2. P. 86–89. (In Russ.)]. DOI: 10.24884/1561‑6274‑2004‑8‑2‑86‑89.
-
Van Liew J.B., Zamlauski-Tucker M.J., Feld L.G. Endogenous creatinine clearance in the rat: strain variation // Life sciences. 1993. Vol. 53. N. 12. P. 1015–1021. DOI: 10.1016/0024-3205(93)90124‑l.
-
Байрашева В.К., Бабенко А.Ю., Дмитриев Ю.В. и др. Новая модель сахарного диабета 2‑ого типа и диабетической нефропатии у крыс // Трансляционная медицина. 2016. Т. 3 № 4. С. 44–55. [Bajrasheva V.K., Babenko A.Yu., Dmitriev Yu.V. et al. Novaya model’ saharnogo diabeta 2‑ogo tipa i diabeticheskoj nefropatii u krys // Translyacionnaya medicina. 2016. Vol. 3. N. 4. P. 44–55. (In Russ.)]. DOI: 10.18705/2311‑4495‑2016‑3‑4‑44‑55.
-
Daily III J.W., Sachan D.S. Choline supplementation alters carnitine homeostasis in humans and guinea pigs // The Journal of nutrition. 1995. Vol. 125. N. 7. P. 1938–1944. DOI: 10.1093/jn/125.7.1938.
-
Morris E.R., O’dell B.L. Effect of magnesium deficiency in guinea pigs on kidney function and plasma ultrafiltrable ions // Proceedings of the Society for Experimental Biology and Medicine. 1969. Vol. 132. N. 1. P. 105–110. DOI: 10.3181/00379727‑132‑34159.
-
Oyen I., Boylan J.W. Renal Clearance in the Unanesthetized Guinea Pig: Depression of Inulin Clearance by Creatinine // Proceedings of the Society for Experimental Biology and Medicine. 1962. Vol. 111. N. 2. P. 253–257.
-
Esteves M.I., Marini R.P., Ryden E.B. et al. Estimation of glomerular filtration rate and evaluation of renal function in ferrets (Mustela putorius furo) // American journal of veterinary research. 1994. Vol. 55. N. 1. P. 166–172.
-
Morrisey J.K., Johnston M.S. Ferrets // Exotic animal formulary. 2018. P. 532.
-
Ермакова Т.А. Оценка скорости клубочковой фильтрации методом исследования клиренса эндогенного креатинина //Ветеринария Кубани. 2008. № 5. С. 29–30. [Ermakova T.A. Ocenka skorosti klubochkovoj fil’tracii metodom issledovaniya klirensa endogennogo kreatinina // Veterinariya Kubani. 2008. N. 5. P. 29–30. (In Russ.)].
-
Braun J.P., Lefebvre H.P., Watson A.D.J. Creatinine in the dog: a review // Veterinary Clinical Pathology. 2003. Vol. 32. N. 4. P. 162–179. DOI: 10.1111/j.1939-165x.2003.tb00332.x.
-
Sleeman P., Patel N.N., Lin H. et al. High fat feeding promotes obesity and renal inflammation and protects against post cardiopulmonary bypass acute kidney injury in swine // Critical Care. 2013. Vol. 17. N. 5. P. 1–15. DOI: 10.1186/cc13092.
-
Ullah N., Khan M.A., Khan T. et al. Protective effect of Cinnamomum tamala extract on gentamicin-induced nephrotic damage in rabbits // Tropical Journal of Pharmaceutical Research. 2013. Vol. 12. N. 2. P. 215–219. DOI: 10.4314/tjpr.v12i2.13.
-
Hoefer H.L. Rabbit and ferret renal disease diagnosis // Laboratory medicine: avian and exotic pets. 2000. Р. 311–318.
-
Gilmore J.P., Peterson T.V., Zucker I.H. Neither dorsal root nor baroreceptor afferents are necessary for eliciting the renal responses to acute intravascular volume expansion in the primate Macaca fascicularis // Circulation Research. 1979. Vol. 45. N. 1. P. 95–99. DOI: 10.1161/01.res.45.1.95.
-
Weekley L.B., Deldar A., Tapp E. Development of renal function tests for measurement of urine concentrating ability, urine acidification, and glomerular filtration rate in female cynomolgus monkeys // Journal of the American Association for Laboratory Animal Science. 2003. Vol. 42. N. 3. P. 22–25.
-
Gilmore J.P., Peterson T.V., Zucker I.H. Neither dorsal root nor baroreceptor afferents are necessary for eliciting the renal responses to acute intravascular volume expansion in the primate Macaca fascicularis // Circulation Research. 1979. Vol. 45. N. 1. P. 95–99. DOI: 10.1161/01.res.45.1.95.
-
Cornish K.G., Gilmore J.P. Increased left atrial pressure does not alter renal function in the conscious primate // American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 1982. Vol. 243. N. 1. P. R119–R124.
- Смирнов А.В., Румянцев А.Ш. Острое повреждение почек. Часть I (ПРОЕКТ, 2019 г.) // Нефрология. 2020. Т. 24. № 1. С. 67–95. [Smirnov A.V., Rumyancev A.SH. Ostroe povrezhdenie pochek. CHast’ I (PROEKT, 2019 g.) // Nefrologiya. 2020. Vol. 24. N. 1. P. 67–95. (In Russ.)].




