Экспериментальные модели острого бронхита на животных
Кательникова А.Е., Крышень К.Л., Макарова М.Н., Макаров В.Г. Экспериментальные модели острого бронхита на животных. Лабораторные животные для научных исследований. 2019; 1. https://doi.org/10.29296/2618723X-2019-01-10
Резюме
Острый бронхит (ОБ) в связи с высокой заболеваемостью относится к наиболее актуальным проблемам современной пульмонологии. Поэтому идет постоянный поиск и разработка новых лекарственных средств для лечения ОБ. Для регистрации новых фармакологических субстанций и препаратов на их основе необходимы экспериментальные модели, позволяющие оценить специфическую фармакологическую активность. В настоящем обзоре всесторонне рассмотрены используемые для моделирования ОБ виды животных, индукторы патологии и их механизмы повреждения ткани, а также оцениваемые показатели. Поиск статей, опубликованных на английском языке, осуществляли по базам данных Google Scholar и PubMed (1961–2018), на русском языке – по базе данных научной электронной библиотеки eLIBRARY.RU; 43 работы мы расценили как приемлемые для включения в настоящий обзор. Несмотря на то, что обзор посвящен моделированию ОБ, сюда вошли статьи, посвященные экспериментальному моделированию острого трахеобронхита, острого бронхолегочного воспаления, острого повреждения легких и острого респираторного дистресс-синдрома, поскольку для моделирования данных патологий часто используют одинаковые индукторы патологии и пути введения. Согласно данным, приводимым в рецензированных статьях, для моделирования острого повреждения нижних дыхательных путей и легких в основном используют мышей и крыс. Наиболее популярными индукторами моделирования острой бронхолегочной патологии являются липополисахарид и сигаретный дым. Чаще всего для оценки повреждения у животных рассматривают такие показатели, как анализ бронхоальвеолярного лаважа, гистопатология и измерение отека в разные моменты времени после индукции патологии. На основании исследований, целью которых являлось получение воспаления в дыхательных путях животных, подтверждено, что невозможно получить воспалительное повреждение только в бронхах, в любом случае вовлекается легочная ткань и наоборот. Этот материал поможет исследователям выбрать подходящий метод для индукции ОБ у животных и информативные показатели для разработки протокола исследования.
Введение
По данным Федеральной службы государственной статистики, в России в 2017 г. заболевания органов дыхания у взрослых по частоте встречаемости заняли 1-е место и составили 353,5 случая на 1000 населения [1]. Самым распространенным заболеванием дыхательных путей является острый бронхит (ОБ). По результатам эпидемиологических исследований именно ОБ выступает одной из наиболее частых причин обращения пациентов за медицинской помощью в амбулаторной практике [2].
С целью регистрации новых лекарственных средств (ЛС), планируемых для лечения ОБ у человека, необходимы экспериментальные модели, позволяющие провести оценку специфической фармакологической активности препарата. Для моделирования ОБ используют разные виды животных (крыс, мышей, карликовых свиней, морских свинок, собак и т.д.), разные индукторы патологии и оцениваемые показатели. Указанное выше всесторонне рассмотрено в настоящем обзоре, который поможет исследователям выбрать подходящий метод для индукции ОБ у животных и информативные показатели для разработки протокола исследования.
Материал и методы
Стратегия поиска. Поиск статей, опубликованных на английском языке, осуществляли по базам данных Google Scholar и PubMed (1961–2018), на русском языке – по базе данных научной электронной библиотеки eLIBRARY.RU. Поиск проводили по следующим семантическим полям: острый бронхит, животные, крысы, мыши, воспаление дыхательных путей, бронхолегочное воспаление, сигаретный дым, липополисахарид (ЛПС).
Критерии включения:
- статья посвящена острому воспалению дыхательных путей и легочной ткани у животных;
- в статье подробно изложен метод индукции патологии на животных;
- в статье оценены параметры, указывающие на развитие индуцируемой патологии.
- Критерия исключения:
- тезисы;
- обзоры;
- неопубликованные статьи;
- результаты клинических исследований.
Результаты и обсуждение
Из 646 предложенных статей теме обзора соответствовало 43. Несмотря на то, что обзор посвящен моделированию ОБ, сюда были включены статьи, посвященные экспериментальному моделированию острого трахеобронхита, острого бронхолегочного воспаления, острого повреждения легких и острого респираторного дистресс-синдрома, поскольку для моделирования данных патологий часто используют одинаковые индукторы патологии и пути введения. Кроме того, эндотрахеальное введение индуктора патологии не может изолированно поражать только бронхи или только легкие.
Наиболее популярными индукторами моделирования острой бронхолегочной патологии являются ЛПС и сигаретный дым, направленные на воспроизведение известных факторов риска – инфекция и курение (включая пассивное).
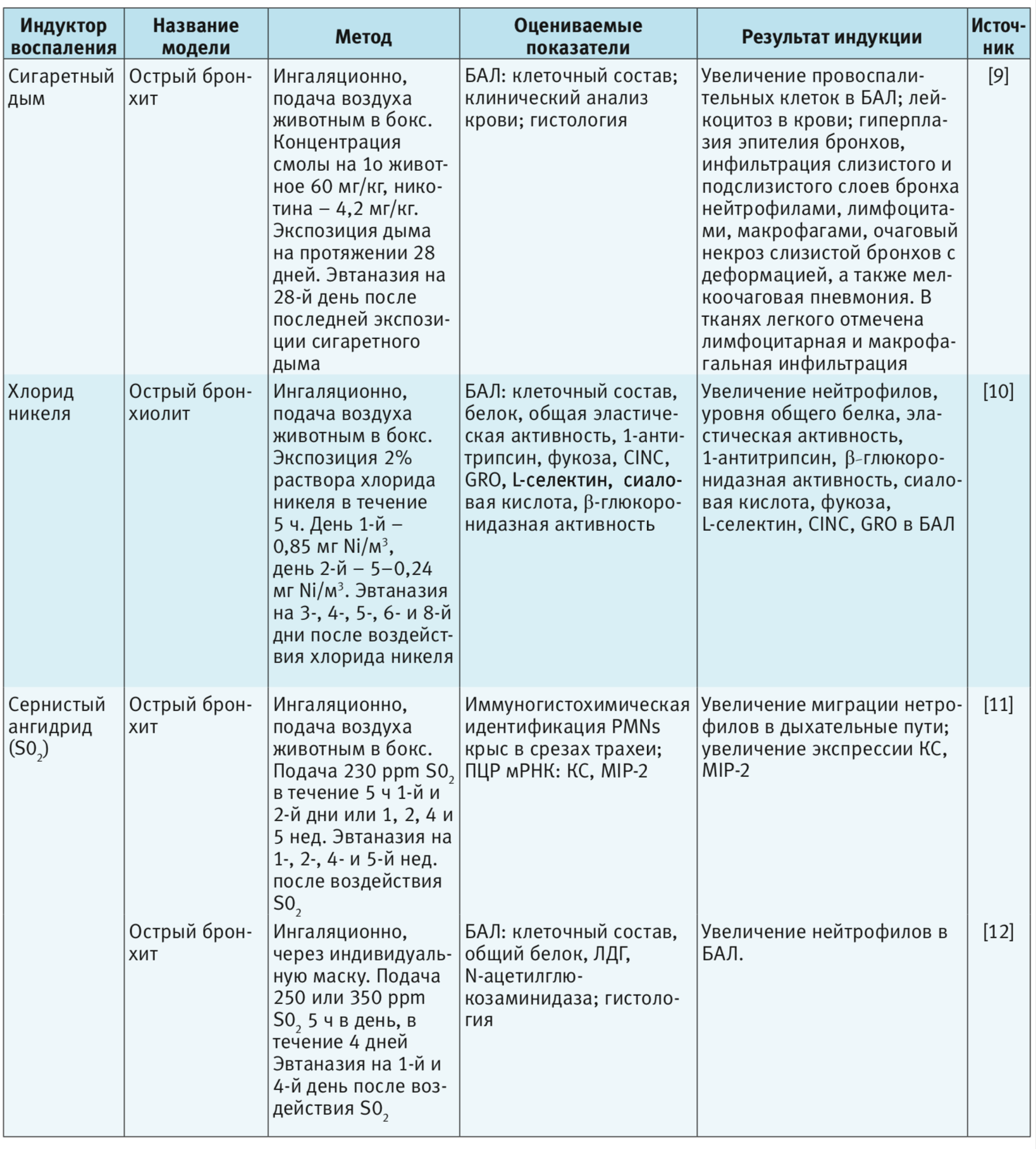
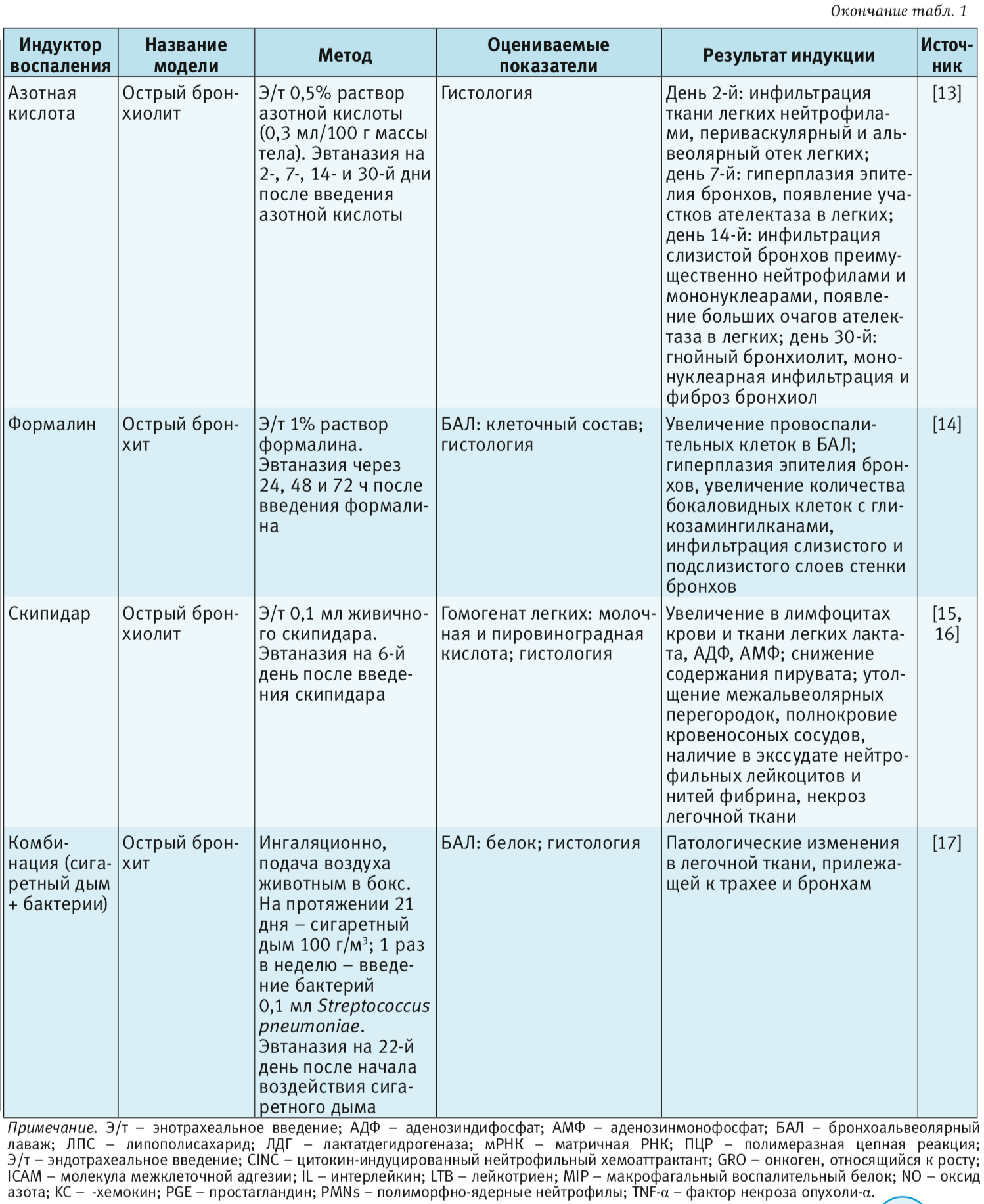
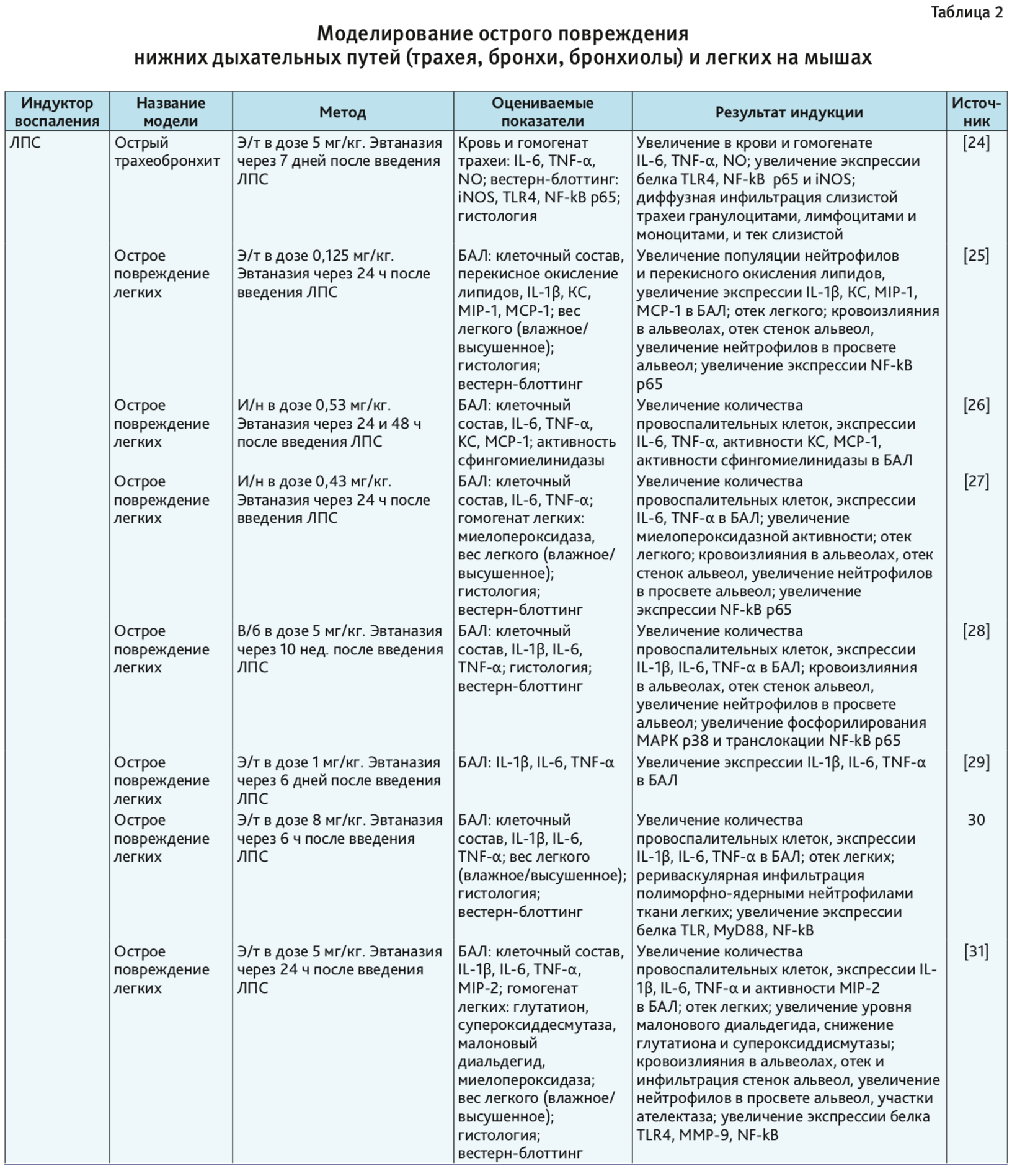
В табл. 1–4 представлены индукторы для моделирования острого повреждения нижних дыхательных путей и легких на разных видах животных. Грызуны и мелкие животные широко используются для моделирования патологий дыхательной системы, хотя есть много ограничений, включая анатомические различия и общие функции легких. Несмотря на эти ограничения, уровень, до которого они воспроизводят патологию или восстановление ткани, считается достаточным для ответа на многие фундаментальные вопросы. В то же время модели на крупных животных важны на доклинических стадиях для воспроизведения сложных клинических состояний. Крупные животные больше похожи на людей с точки зрения архитектуры легких, количества долей и характера ветвления дыхательных путей [3].
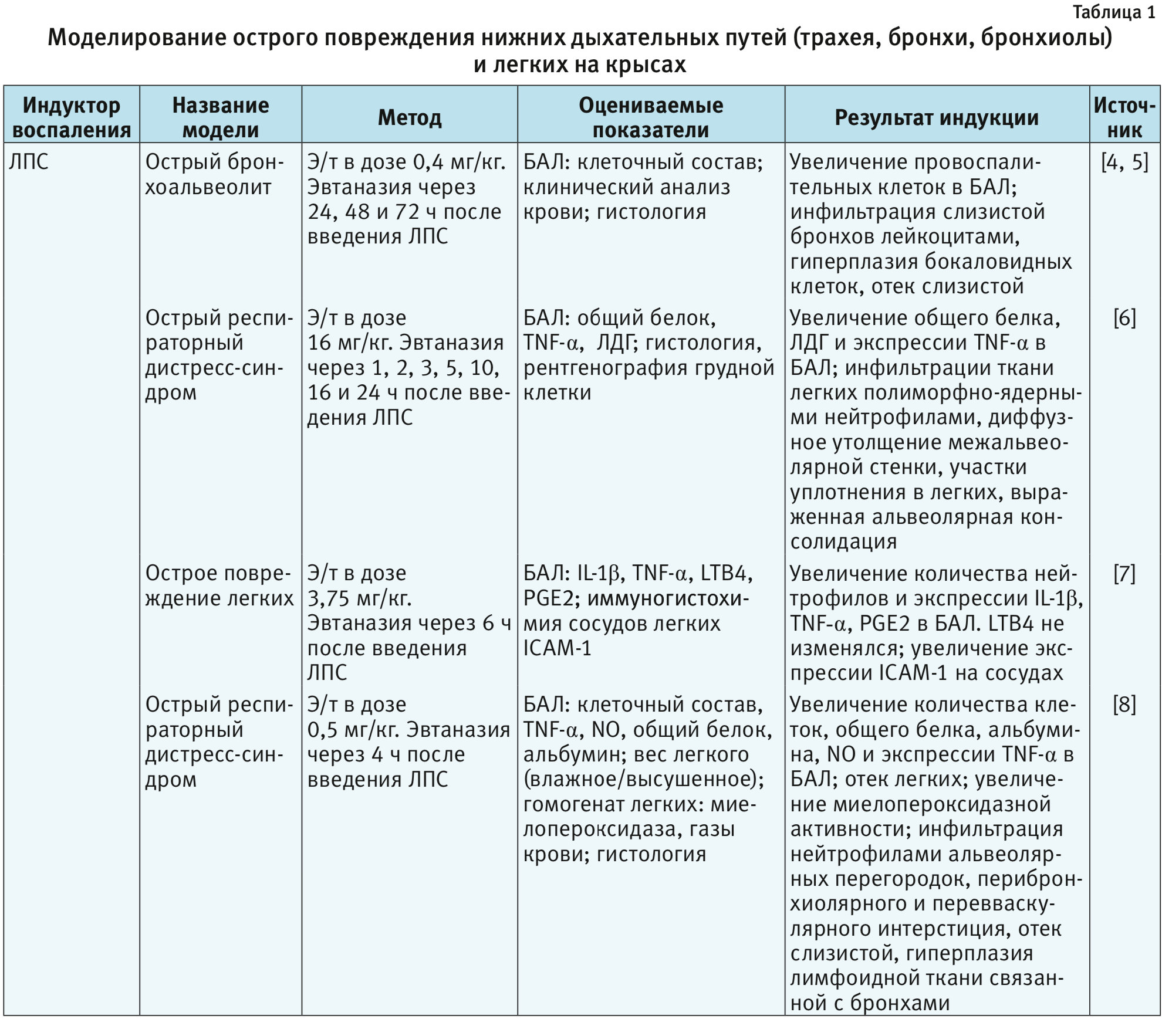
Крысы. Крыса наиболее часто используется, как в биомедицинских исследованиях по изучению токсичности лекарственных препаратов. По сравнению с другими лабораторными животными, крысы воспроизводят многие признаки аллергии дыхательных путей и аллергической астмы, которые схожи с клиническими признаками у человека. Одно из главных преимуществ, что эти данные могут быть экстраполированы из экспериментальных исследований на человека [3]. Крысы используются для моделирования острых и хронических патологий нижних дыхательных путей и легких [4–17]. Одним из важных ограничений при этом является проблема воспроизведения структуры и патологии малых дыхательных путей, так как крысы имеют только несколько уровней ветвления дыхательных путей, что сильно отличается от структуры дыхательных путей человека [18]. Из-за недостатка бокаловидных клеток у крыс регистрируют слабый метапластический ответ [19].
Мыши. В течение многих лет мыши были часто используемой тест-системой для моделирования заболеваний человека, поскольку их физиология и генетика близки человеку [20–22]. Генетический материал мыши подобен генетическому материалу человека на 99% [21, 23]. Таким образом, мышь обеспечивает превосходный молекулярный/генетический инструментарий для фармакологических исследований [3]. Их небольшой размер делает возможным проведение крупномасштабных/высокопроизводительных исследований, а также является экономически выгодным. В настоящее время иммунная система мышей очень хорошо изучена. Доступность инбредных штаммов и специфических генов, которые могут быть направлены на оценку функции конкретного гена при повреждении, позволяет широко использовать мышей в исследованиях с моделированием патологий дыхательной системы [24–47] (см. табл. 2).
Морские свинки. Роберт Кох в 1882 г. был первым, кто использовал морских свинок в качестве хозяина для бактериальных инфекций [48, 49]. С тех пор они служат в качестве лабораторных животных, хотя и не так часто, как крысы и мыши. В основном морские свинки задействованы в исследованиях анафилаксии, гнотобиотиков, астмы, иммунологии, инфекционных и пищевых заболеваний и отологии [3]. Дыхательные пути морских свинок очень чувствительны к аллергенам, как и у людей. В настоящее время их обычно применяют для тестирования новых препаратов, направленных на лечение астмы. Также морских свинок выбирают в качестве тест-системы для изучения туберкулеза из-за их высокой восприимчивости к инфекции. Они показывают отличную реакцию на стандартные пероральные химиопрепараты и вакцины. Морские свинки, инфицированные туберкулезом, считаются «золотым стандартом» для изучения различных методов доставки лекарств и вакцин и оценки их безопасности. Хемокины и цитокины являются основными регуляторами иммунных реакций на туберкулез и образование гранулемы, как у людей, так и у морских свинок. Поэтому морские свинки представляют собой отличную модель для понимания иммунологических реакций на туберкулез [49, 50].
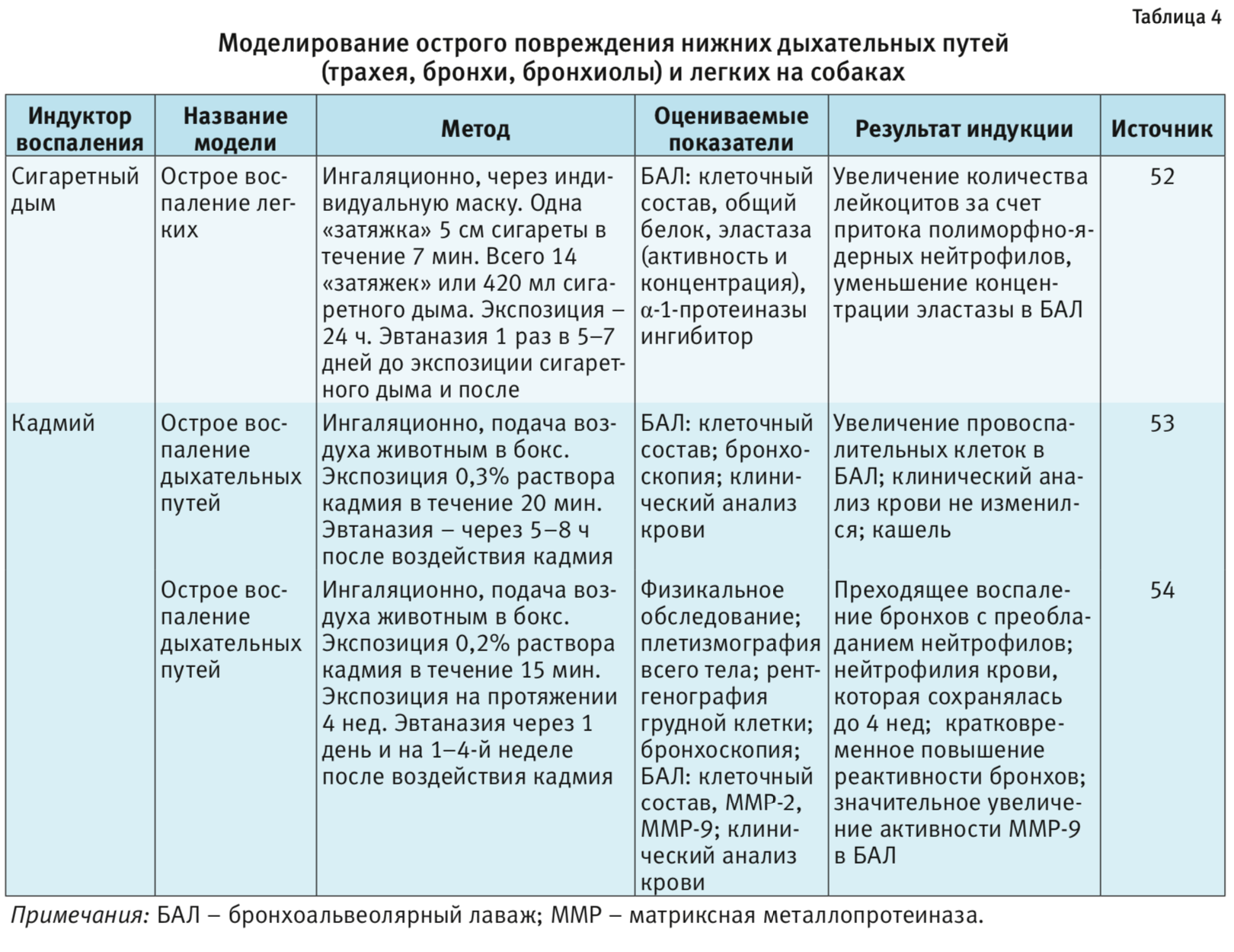
Собаки. Собак используют в качестве тест-систем в ряде исследований в области ортопедических и зубных имплантатов, систем доставки лекарств, фармакокинетики и медицинской визуализации. К их уникальным преимуществам относят спокойный характер, хорошо развитые когнитивные функции и способность к обучению [3]. Для собак доступен широкий спектр медицинских приборов и процедур. Интубацию дыхательных путей у собак легко проводить из-за относительно короткой формы рта и его способности широко открываться. Поэтому на собаках изучают модели как острого, так и хронического повреждения нижних дыхательных путей и легких [52–55]. Хотя сходство дыхательной системы человека с собачьей позволяет использовать их для оценки новых лекарственных форм и вариантов лечения, но здесь возникают этические проблемы. Кроме того, существует значительная вариабельность беспородных собак, хотя в некоторых исследованиях желательно, чтобы собаки разных пород давали больше информации о патогенезе и эффективности лечения. Эта гетерогенность вносит сложности с точки зрения анализа полученных результатов [3].
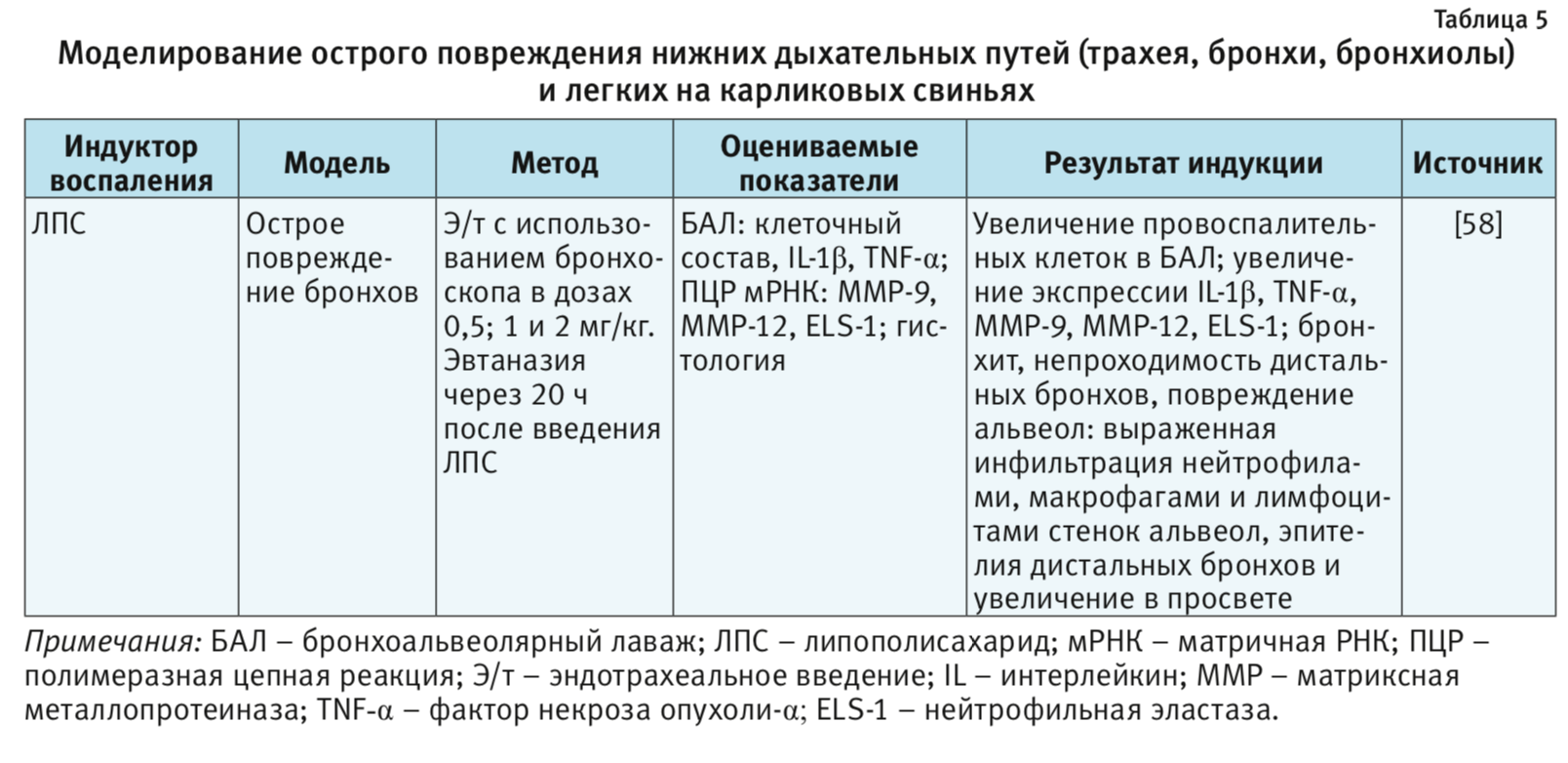
Карликовые свиньи. Свиньи имеют большие преимущества, что позволяет широко использовать их в качестве моделей в доклинических исследованиях во всем мире. Физиология, иммунология, морфология органов и метаболизм свиньи практически идентичны человеку [3, 56]. Более того, последовательности генома свиньи уже выявлены и могут быть сопоставлены с человеческими аналогами [57]. Хотя большинство медицинских устройств для человека можно применять у свиней, некоторые процедуры, включая интубацию трахеи, у свиней сложнее, чем у других животных или человека [58]. Большинство исследований в области дыхательной системы требуют интубации животного, которое у свиней осложняется из-за длинного и узкого рта, а также нет возможности открыть его так широко, как у собаки. Кроме того, их гортань маленькая по сравнению с размером их тела, что делает интубацию еще сложнее. Свиньи также чувствительны к любым устройствам или процедурам, проводимым внутри полости рта, поэтому во время интубации может развиться ларингоспазм [59].
Механизмы возникновения повреждений при соответствующем индукторе патологии
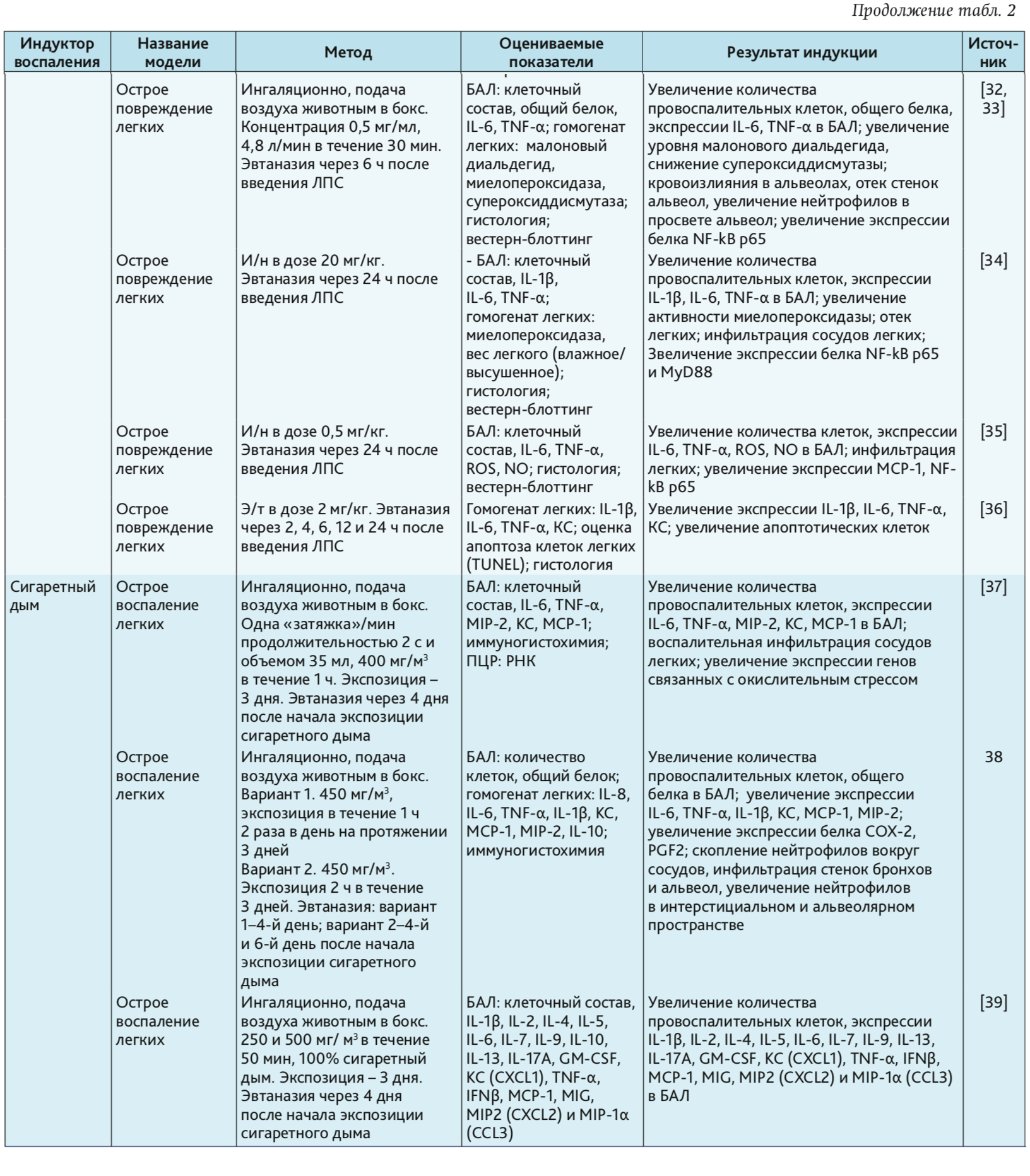
ЛПС, или эндотоксин, – составная часть наружных клеточных мембран грамотрицательных бактерий. ЛПС постоянно выделяется и циркулирует в окружающей среде. При попадании в организм ЛПС действует как провоспалительный агент [60, 61]. Например, при остром вдыхании ЛПС у человека появляются такие клинические симптомы, как лихорадка, озноб и бронхоспазм [61, 62]. Распознавание ЛПС опосредовано Toll-подобным рецептором типа 4 (TLR4). Это распознавание включает в себя связывание ЛПС с ЛПС-связывающим белком, а затем с CD14, который ассоциируется с комплексом, включающим TLR4 и MD2. Образование TLR4-центрированного рецепторного комплекса с ЛПС индуцирует сильный иммунный ответ, который способствует секреции провоспалительных цитокинов (IL-1b, IL-6, IL-8 и TNF-α) по пути MyD88. Передача сигналов ЛПС также включает MyD88-независимый каскад, который обеспечивает экспрессию IFN-индуцибельных генов [60, 63]. В результате активируются все основные клеточные функции, связанные с развитием фагоцитоза и представлением антигенов, продукцией NO и свободных форм кислорода, синтезом низкомолекулярных медиаторов воспаления и группы провоспалительных цитокинов, к которым относятся интерлейкины: IL-1, IL-6, IL-18, TNF-α, интерфероны I типа, хемокины [63]. За счет того, что ЛПС является мощным активатором врожденного иммунного ответа, его часто используют для моделирования патологий со стороны дыхательной системы [4–8, 24–36, 58]. Патологические изменения в нижних дыхательных путях и в легких на фоне введения ЛПС представлены в табл. 1, 2 и 5.
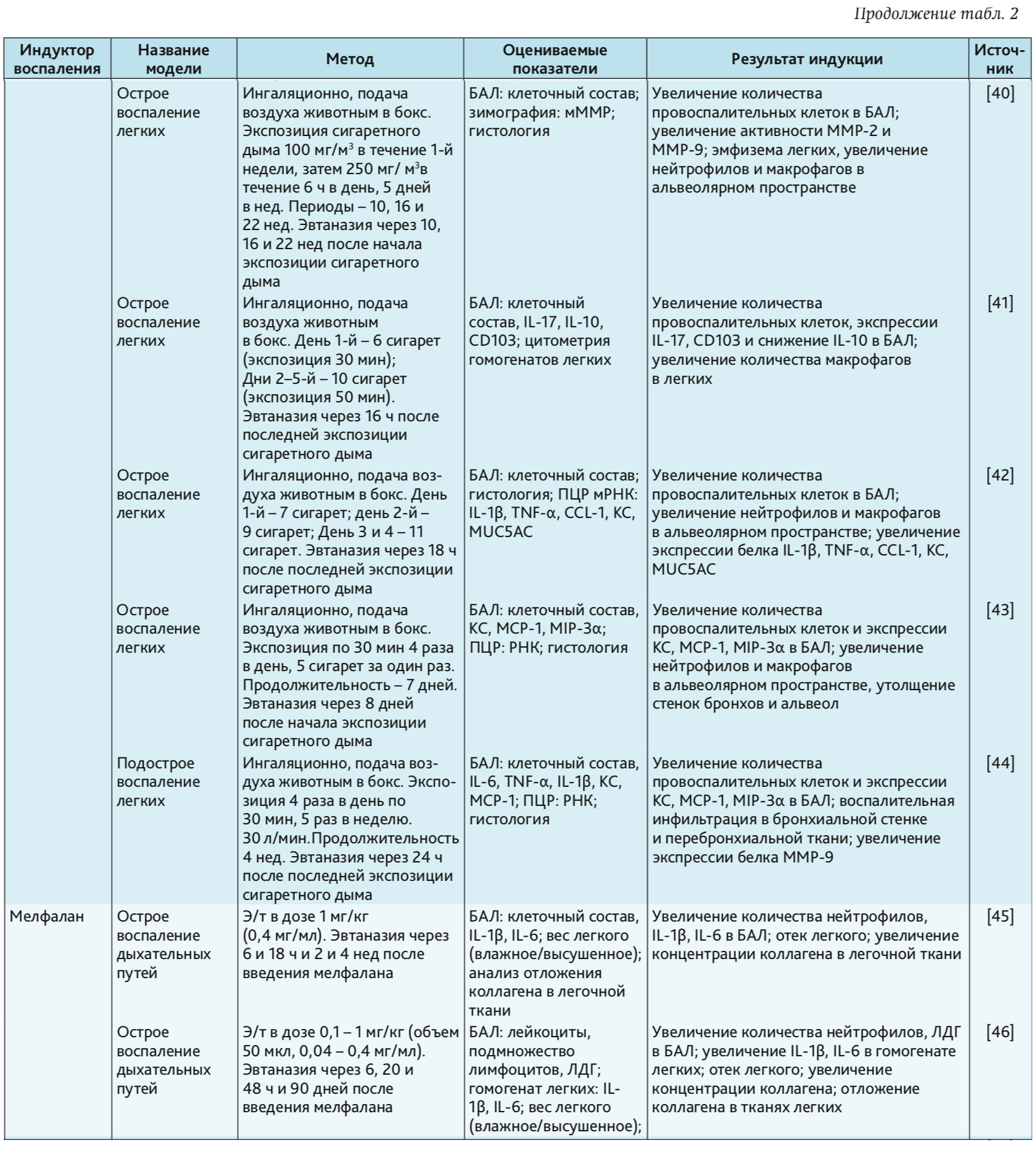
Сигаретный дым. Курение табака является важным фактор риска ОБ и хронической обструктивной болезни легких (ХОБЛ) [55]. В табачном дыме содержатся активные формы кислорода, которые повреждают эпителиальные клетки дыхательных путей, вызывая перекисное окисление липидов клеточных мембран, активируют окислительно-чувствительные клеточные пути и вызывают повреждение ДНК. Компоненты табачного дыма активируют внутриклеточные сигнальные каскады эпителиальных клеток, которые приводят к активации воспалительных генов за счет индукции АР-1 и NF-kB. Поэтому в мокроте курильщиков обычно повышена продукция цитокинов типа IL-1β, TNF-α, IL-6, а также IL-8 – с дальнейшим увеличением при обострении [64, 65].
Сигаретный дым индуцирует многие признаки острого бронхита и воспаления легких, включая инфильтрацию слизистой бронхов, изменения уровней провоспалительных цитокинов, легочную инфильтрацию макрофагами и нейтрофилами, фиброз дыхательных путей и эмфизему [3, 9, 37–44, 55]. Однако в настоящее время не существует стандартизированного метода или протокола исследования по воздействию сигаретного дыма на животных, что ограничивает его использование в качестве индуктора патологии. В эксперименте должны рассматриваться стандартизированные сигареты для доставки точной дозы взвешенных или твердых частиц, включая никотин и окись углерода, ведь тип сигарет, создающих дым (коммерческие сигареты или исследовательские сигареты, с фильтром или без него), компоненты сигаретного дыма, используемые для воздействия, системы доставки («все тело» vs «только нос») и, что наиболее важно, доза дыма – важные определяющие факторы [55, 66]. Существуют два метода экспозиции сигаретного дыма: метод называемый «только нос», когда дым подают прямо к носу и пасти животного, и окуривание «всего тела» при помещении животного помещают в камеру, наполненную контролируемой концентрацией дыма. Оба метода широко практикуются и показывают сходные результаты в отношении наличия в БАЛ популяций воспалительных клеток, уровней цитокинов и терапевтического ответа [67, 68].
Тяжелые металлы (кадмий, никель). Кадмий – токсичный элемент, представляющий серьезную опасность для человека и животных. Избыток кадмия нарушает усвоение и обмен других микроэлементов (Zn, Cu, Se, Fe), что может вызывать их дефицит. Он вытесняет кальций и замещает цинк в составе биомолекул. Накапливаясь в почках, кадмий вызывает почечный кальциевый ацидоз, вследствие чего могут развиваться 2 формы остеомаляции: кальципеническая и фосфопеническая [69].
В открытом доступе обнаружены 2 статьи с описанием использования кадмия в качестве индуктора ОБ. По результатам исследований кадмий вызывал не только воспаление в бронхах, но и в легочной ткани, т.е. сочетанное воспаление. Признаков поражения печени и почек в экспериментах при ингаляционном способе доставки кадмия не обнаружено [53, 54].
По данным литературы воздействие растворимых и нерастворимых соединений никеля активирует в организме HIF-1 (hypoxia-inducible factor-1) [70, 71]. Увеличение экспрессии HIF-1 приводит к повышению экспрессии генов, которые обеспечивают адаптацию клеток к гипоксии [70, 72]. Ингаляция хлоридом никеля в течение 5 дней приводит к развитию у крыс острого бронхиолита [10]. Хроническое воздействие никеля на крыс приводит к гиперплазии и фиброзу легочной ткани [70, 73].
Мелфалан. Мелфалан, или L-фенилаланин мустард, сегодня широко используется в качестве противоопухолевого препарата, это высокотоксичный бифункциональный алкилирующий агент [46]. Воздействие мелфалана в высоких дозах вызывает апоптоз и некроз, что приводит к серьезным повреждениям тканей, как в эпителии бронхов, так и в эндотелии [74]. Воздействие низких доз аналогов мелфалана с раздражающим действием может активировать внутриклеточные пути передачи сигнала в клетках дыхательного эпителия, приводящие к провоспалительному ответу [45, 46, 75]. Есть данные, что в дополнение к активации таких путей как стресс-индуцированной клеточной стимуляции, воздействие алкилируещего агента (так называемого «фосфорамид мустард») усиливает внутриклеточный окислительный стресс и механизмы антиоксидантной защиты [46].
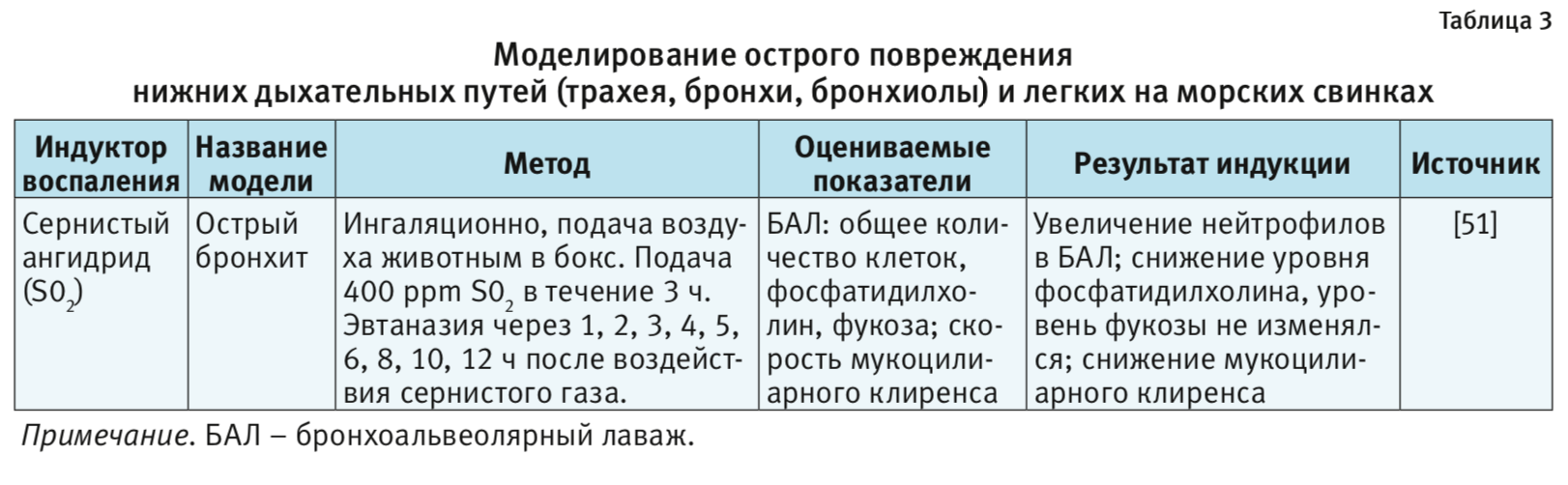
Сернистый ангидрид (SO2). Для моделирования ОБ на крысах, мышах, морских свинках и собаках в качестве провоспалительного агента использовали длительную экспозицию SO2 [11, 12, 51, 76–79]. SO2 – раздражитель верхних дыхательных путей; при вдыхании в высоких концентрациях вызывает нейтрофильное воспаление и гиперсекрецию слизи дыхательных путей [12]. Механизм SO2-индуцированной секреции слизи и воспаления включает такие нейрогенные вещества, как NK-1 и вещество P [78]. Предполагается также участие окислительного стресса [12]. По результатам ряда экспериментов воспаление дыхательных путей у мышей [80] и повышенная гиперреактивность дыхательных путей у крыс [12] были связаны с увеличением экспрессии хемокинов на фоне экспозиции SO2.
Таким образом, эффекты, вызванные SO2 у крыс, коррелируют с симптомами бронхита у людей, но их тяжесть и продолжительность отличаются. Вполне вероятно, что механизм, с помощью которого SO2 вызывает бронхит, отличается от причины возникновения бронхита у людей, причем у крыс возможно лишь ограниченное повреждение.
Азотная кислота. Модель с использованием азотной кислоты впервые была описана T. Moran и R. Heelstrom [81]. Такой способ применения азотной кислоты – это дешевый, быстрый и безопасный метод модели облитерирующего бронхиолита. Экспериментальный облитерирующий бронхиолит, индуцированный азотной кислотой, был продемонстрирован ранее у кроликов и хомяков [13]; при гистологическим исследовании были выявлены сходные изменения с описанными в аналогичной модели с введением аденовируса и гистологической картиной облитерирующего бронхиолита у детей.
Формалин. По данным литературы применение в качестве индуктора воспаления раствора формалина обосновано быстротой развития воспаления на прилежащие ткани и с сохранением признаков воспаления в течение 7 дней [82, 83]. Например, в результате введения формалина в носовые ходы у животных развиваются такие симптомы, как затрудненное дыхание, чихание, покраснение слизистой, серозные и гнойные выделения, что характерно для клинической картины острого риносинусита у человека. На микроскопическом уровне у животных развиваются: полнокровие, очаговый некроз слизистой оболочки носовых ходов, гиперплазия, выраженная инфильтрация лейкоцитами и мононуклеарами, увеличение количества бокаловидных клеток [82, 83]. Эндотрахеальное введение формалина приводит к появлению патологических изменений в месте контакта с тканями с развитием таких форм острого бронхита, как катаральный и катарально-гнойный [14].
Живичный скипидар. Эндотрахеальное введение скипидара сопровождается патологическими изменения в месте введения и переходом на легочную ткань, что обусловлено физико-химическими свойствами скипидара [15, 16]. На фоне введения скипидара в лимфоцитах крови и ткани легких крыс возникает энергодефицит.
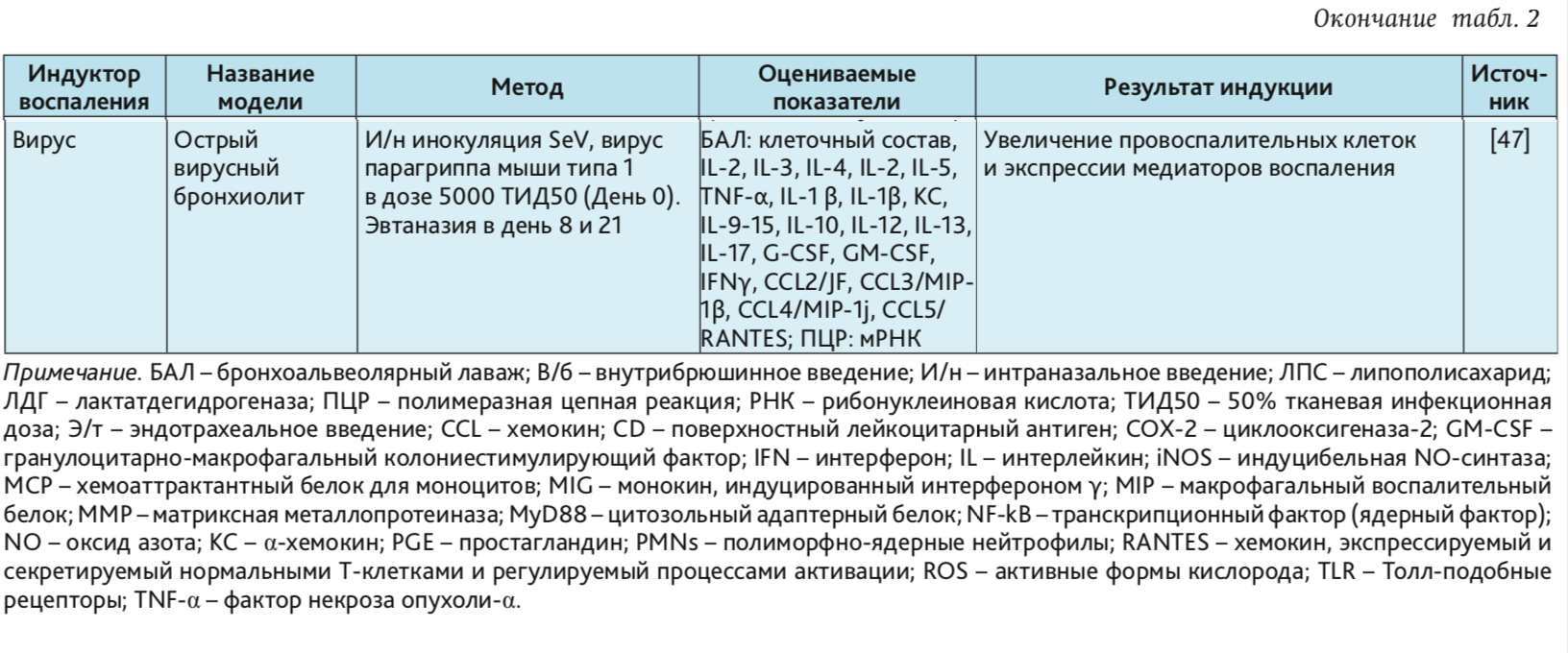
Вирусы и бактерии в комбинации с сигаретным дымом. Вирусы и бактерии в качестве индукторов позволяет воспроизвести ОБ близкий по течению к клиническому инфекционному бронхиту у человека [17, 47]. В структуре патогенеза вирусных респираторных инфекций выделяют 4 последовательно развивающиеся фазы вне зависимости от вида вируса. Это фаза внедрения и репродукции возбудителя – вначале в эпителиальных клетках респираторного тракта, а затем — в кровяном русле, с развитием реакции со стороны альвеолоцитов и макрофагов. Фаза развития токсических или токсикоаллергических реакций сопровождается повышением проницаемости капилляров и формированием микроциркуляторных нарушений [84]. В инициации воспаления в ответ на внедрение бактерий одна из ведущих ролей принадлежит TLR, которые реагируют путем активации внутриклеточных сигнальных путей, изменяя экспрессию генов [85].
Заключение
Существует много экспериментальных моделей воспаления в нижних дыхательных путях на разных видах животных, включая мелких и крупных. Однако требуется стандартный протокол, который бы определял параметры, подлежащие оценке, и необходимые процедуры. В настоящем обзоре представлена информация о способах индукции ОБ у разных видов животных, различных методах, используемых для этой цели, и различных параметрах, которые могут быть оценены. К наиболее распространенному индуктору моделирования острой бронхолегочной патологии относится ЛПС – универсальный провоспалительный агент. С помощью ЛПС индуцируются острые процессы в бронхолегочной системе на разных уровнях, что применимо как к индукции ОБ, так и индукции воспаления в легких, респираторного дистресс-синдрома и бронхиолита. Индукция ОБ сигаретным дымом по частоте встречаемости занимает 2-е место и является самостоятельным направлением. В отличие от ЛПС при воздействии сигаретным дымом характерен быстрый переход острого воспаления в подострое с затрагиванием легочной ткани. Поэтому сигаретный дым как индуктор наиболее подходит для моделирования хронической патологии дыхательных путей и в частности для хронической обструктивной болезни легких. Как свидетельствуют полученные данные, невозможно получить воспалительное повреждение только в бронхах, так или иначе вовлекается и легочная ткань. Данный факт подтверждается в исследованиях, целью которых – получение воспаления в дыхательных путях животных [9, 53, 54, 58]. Тем не менее к индукторам, способным в большей степени повреждать бронхи, чем легкие, можно отнести такие воспалительные агенты, как формалин, тяжелые металлы и кислоты, так как они оказывают выраженное местно-раздражающее действие. Кроме того, формалин в качестве провоспалительного агента применим для моделирования картины характерной для бронхита, возникающего после гриппа и острых респираторных вирусных заболеваний. Экспозиция тяжелыми металлами и кислотами подходит для воспроизведения профессиональных заболеваний дыхательной системы. В экспериментах на животных наиболее часто в качестве тест-системы применяются мелкие лабораторные животные крысы и мыши, но на заключительных стадиях доклинических исследований целесообразно привлечь крупных животных – карликовых свиней и собак. Однако использование последних ограничивается с этической точки зрения. Эта информация полезна для разработки протоколов по изучению специфической фармакологической активности новых препаратов направленных на лечение заболеваний нижних дыхательных путей.
Список источников
- Российский статистический ежегодник.. 2018: Стат.сб. М.: Росстат. 2018; 694 с.
- Зайцев А.А. Острый бронхит: диагностика и лечение. Терапия. 2017; 1(11): 31–5.
- Reczysnka K., Tharkar P., Kim S.Y., Wang Y., Pamula E., Chan H. K., Chrzanowski W. Animal models of smoke inhalation injury and related acute and chronic lung diseases. Adv. Drug Deliv. Rev. 2018. Vol. 123: 107–34. DOI: 10.1016/j.addr.2017.10.005.
- Seibel J., Pergola C., Werz O., Kryshen K., Wosikowski K., Lehner M. D., Haunschild J. Bronchipret® syrup containing thyme and ivy extracts suppresses bronchoalveolar inflammation and goblet cell hyperplasia in experimental bronchoalveolitis. Phytomedicine. 2015. Vol. 22 (13): 1172–7. DOI: 10.1016/j.phymed.2015.09.001.
- Seibel J., Kryshen K., Pongracz J.E., Lehner M.D. In vivo and in vitro investigation of anti-inflammatory and mucus-regulatory activities of a fixed combination of thyme and primula extracts. Pulm. Pharmacol. Ther. 2018. Vol. 51: 10–7. DOI: 10.1016/j.pupt.2018.04.009.
- Van Helden H.P.M. Kuijpers W.C., Steenvoorden D., Go C., Bruijnzeel P.L.B., Van Eijk M., Haagsman H.P. Intratracheal aerosolization of endotoxin (LPS) in the rat: a comprehensive animal model to study adult (acute) respiratory distress syndrome. Exp. Lung Res. 1997. Vol. 23(4): 297–316.
- Alba-Loureiro T.C., Martins E.F., Miyasaka C.K., Lopes L.R., Landgraf R.G., Jancar S., Curi R., Sannomiya P. Evidence that arachidonic acid derived from neutrophils and prostaglandin E2 are associated with the induction of acute lung inflammation by lipopolysaccharide of Escherichia coli. Inflamm. Res. 2004. Vol. 53(12): 658–63. DOI:10.1007/s00011-004-1308-7.
- Shirole R.L., Shirole N.L., Saraf M.N. Embelia ribes ameliorates lipopolysaccharide-induced acute respiratory distress syndrome. J. Ethnopharmacol. 2015. Vol. 168: 356–63. DOI: 10.1016/j.jep.2015.03.009.
- Кательникова А.Е., Крышень К.Л., Макарова М.Н., Макаров В.Г., Воробьева В.В., Шиков А.Н. Изучение специфической фармакологической активности комплекса гликозилированных полипептидов, выделенного из морских ежей вида Strongylocentrotus droebachiensis на модели острого бронхита у крыс.Биомедицина. 2018; 2: 85–94.
- Ishihara Y., Kyono H., Serita F., Toya T., Kawashima H., Miyasaka M. Inflammatory responses and mucus secretion in rats with acute bronchiolitis induced by nickel chloride. Inhal. Toxicol. 2002. Vol. 14(4): 417–30. DOI:10.1080/08958370252871032.
- Farone A., Huang S., Paulauskis J., Kobzik L. Airway neutrophilia and chemokine mRNA expression in sulfur dioxide-induced bronchitis. Am. J. Respir. Cell Mol. Biol. 1995. Vol. 12 (3): 345–50. DOI: 10.1165/ajrcmb.12.3.7873201.
- Kodavanti U.P., Schladweiler M.C., Ledbetter A.D., Ortuno R.V., Suffia M., Evansky P., Huang Y.C. The Spontaneously Hypertensive Rat: An Experimental Model of Sulfur Dioxide–Induced Airways Disease. Toxicol. Sci. 2006. Vol. 94(1): 193–205. DOI:10.1093/toxsci/kfl087.
- Costa C.L.B., Spilborghs G.M., Martins M.A., Saldiva P.H., Mauad T. Nitric acid-induced bronchiolitis in rats mimics childhood bronchiolitis obliterans. Respiration. 2005. Vol. 72(6): 642–9. DOI:10.1159/000087363.
- Кательникова А.Е., Крышень К.Л., Макарова М.Н., Макаров В.Г., Воробьева В.В., Пожарицкая О.Н., Шиков А.Н. Изучение специфической фармакологической активности комплекса гликозилированных полипептидов, выделенного из морских ежей вида Strongylocentrotus droebachiensis на модели острого бронхита, индуцированного формалином у крыс. Биофармацевтический журнал. 2016; 8 (6): 56–63.
- Болехан А.В., Зарубина И.В., Шабанов П.Д. Экспериментальное обоснование применения бемитила в сочетании с трекрезаном и полиоксидонием при бронхолегочном воспалении. Психофармакология и биологическая наркология. 2007; 7 (2): 1555–62.
- Зарубина И.В. Мокренко Е.В., Болехан А.В., Шабанов П.Д. Бронхолегочное воспаление как объект воздействия иммуномодуляторов разной химической структуры. Клиническая патофизиология. 2018; 24(2): 70–7.
- Bao Y., Gao Y., Koch E., Pan X., Jin Y., Cui X. Evaluation of pharmacodynamic activities of EPs® 7630, a special extract from roots of Pelargonium sidoides, in animals models of cough, secretolytic activity and acute bronchitis. Phytomedicine. 2015. Vol. 22 (4): 504–9. DOI: 10.1016/j.phymed.2015.03.004.
- Groneberg D.A., Chung K.F. Models of chronic obstructive pulmonary disease. Respir. Res. 2004. Vol. 5(1): 18. doi: 10.1186/1465-9921-5-18.
- Wright J.L., Cosio M., Churg A. Animal models of chronic obstructive pulmonary disease. Am. J. Physiol. Lung Cell. Mol. Physiol. 2008. Vol. 295 (1): L1-L15. DOI: 10.1152/ajplung.90200.2008.
- Guénet J.-L., Bonhomme F. Origin of the Laboratory Mouse and Related Subspecies A2 – Hedrich, Hans J, in The Laboratory Mouse, G. Bullock, Editor. Academic Press: London. 2004; 3–13 p.
- Rosenthal N., Brown S. The mouse ascending: perspectives for human-disease models. Nat. Cell Biol. 2007. Vol. 9(9): 993. doi: 10.1038/ncb437.
- Beck J.A., Lloyd S., Hafezparast M., Lennon-Pierce M., Eppig J.T., Festing M.F., Fisher E.M. Genealogies of mouse inbred strains. Nat. Genet. 2000. 24 (1): 23–5. DOI: 10.1038/71641.
- Peters L.L., Robledo R.F., Bult C.J., Churchill G.A., Paigen B.J., Svenson K.L. The mouse as a model for human biology: a resource guide for complex trait analysis. Nat. Rev. Genet. 2007. Vol. 8 (1): 58–69. DOI: 10.1038/nrg2025.
- Yang N. Li C., Tian G., Zhu M., Bu W., Chen J., Feng L. Organic acid component from Taraxacum mongolicum Hand.-Mazz alleviates inflammatory injury in lipopolysaccharide-induced acute tracheobronchitis of ICR mice through TLR4/NF-κB signaling pathway. Int. Immunopharmacol. 2016. Vol. 34: 92–100. DOI: 10.1016/j.intimp.2016.02.028.
- Takano H., Inoue K., Yanagisawa R., Sato M., Shimada A., Morita T., Yoshikawa T. Protective role of metallothionein in acute lung injury induced by bacterial endotoxin. Thorax. 2004. Vol. 59(12): 1057–62. DOI:10.1136/thx.2004.024232.
- von Bismarck P., Winoto-Morbach S., Herzberg M., Uhlig U., Schutze S., Lucius R., Krause M.F. IKK NBD peptide inhibits LPS induced pulmonary inflammation and alters sphingolipid metabolism in a murine model. Pulm. Pharmacol. Ther. 2012. Vol. 25 (3): 228-35. DOI: 10.1016/j.pupt.2012.03.002.
- Wan L.M., Tan L., Wang Z.R., Liu S.X., Wang Y.L., Liang S.Y., Lin H.S. Preventive and therapeutic effects of Danhong injection on lipopolysaccharide induced acute lung injury in mice. J. Ethnopharmacol. 2013. Vol. 149(1): 352–9. DOI: 10.1016/j.jep.2013.06.048.
- Chen J., Wang J.B., Yu C.H., Chen L.Q., Xu P., Yu W.Y. Total flavonoids of Mosla scabra leaves attenuates lipopolysaccharide-induced acute lung injury via down-regulation of inflammatory signaling in mice. J. Ethnopharmacol. 2013. Vol. 148 (3): 835–41. DOI: 10.1016/j.jep.2013.05.020.
- Yu W.W., Lu Z., Zhang H., Kang Y.H., Mao Y., Wang H.H., Shi L.Y. Anti-inflammatory and protective properties of daphnetin in endotoxin-induced lung injury. J. Agric. Food Chem. 2014. Vol. 62 (51): 12315–25. DOI: 10.1021/jf503667v.
- Jiang Q., Yi M., Guo Q., Wang C., Wang H., Meng S., Chen T. Protective effects of polydatin on lipopolysaccharide-induced acute lung injury through TLR4-MyD88-NF-κB pathway. Int. Immunopharmacol. 2015. Vol. 29 (2): 370–76. DOI:10.1016/j.intimp.2015.10.027.
- Zhang X., Sun C.Y., Zhang Y.B., Guo H.Z., Feng X.X., Peng S.Z., Huang X.D. Kegan Liyan oral liquid ameliorates lipopolysaccharide-induced acute lung injury through inhibition of TLR4-mediated NF-κB signaling pathway and MMP-9 expression. J. Ethnopharmacol. 2016. Vol. 186: 91–102. DOI: 10.1016/j.jep.2016.03.057.
- Yu P.J., Wan L.M., Wan S.H., Chen W.Y., Xie H., Meng D.M., Xiao X.L. Standardized myrtol attenuates lipopolysaccharide induced acute lung injury in mice. Pharm. Biol. 2016. Vol. 54 (12): 3211–6. DOI:10.1080/13880209.2016.1216132.
- Wan L., Meng D., Wang H., Wan S., Jiang S., Huang, S., Yu P. Preventive and therapeutic effects of thymol in a lipopolysaccharide-induced acute lung injury mice model. Inflammation. 2018. Vol. 41 (1): 183–92. DOI: 10.1007/s10753-017-0676-4.
- Yang S., Yu Z., Wang L., Yuan T., Wang X., Zhang X., Du G. The natural product bergenin ameliorates lipopolysaccharide-induced acute lung injury by inhibiting NF-kappaB activation. J. Ethnopharmacol. 2017. Vol. 200: 147–55. DOI: 10.1016/j.jep.2017.02.013.
- Lee J.W., Seo K.H., Ryu H.W., Yuk H.J., Park H.A., Lim Y., Oh S.R. Anti-inflammatory effect of stem bark of Paulownia tomentosa Steud. in lipopolysaccharide (LPS)-stimulated RAW264. 7 macrophages and LPS-induced murine model of acute lung injury. J. Ethnopharmacol. 2018. Vol. 210: 23–30. DOI: 10.1016/j.jep.2017.08.028.
- Okuro R.T., Machado M.N., Casquilho N.V., Jardim-Neto A., Roncally-Carvalho A., Atella G.C., Zin W.A. The role of sphingolipid metabolism disruption on lipopolysaccharide-induced lung injury in mice. Pulm. Pharmacol.Ther. 2018. Vol. 50: 100–10. DOI: 10.1016/j.pupt.2018.04.008.
- Thatcher T.H., Hsiao H.M., Pinner E., Laudon M., Pollock S.J., Sime P.J., Phipps R.P. Neu-164 and Neu-107, two novel antioxidant and anti-myeloperoxidase compounds, inhibit acute cigarette smoke-induced lung inflammation. Am. J. Physiol. Lung Cell. Mol. Physiol. 2013. Vol. 305 (2): L165-L174. DOI: 10.1152/ajplung.00036.2013.
- Hsiao H.M. ,Sapinoro R.E., Thatcher T.H., Croasdell A., Levy E.P., Fulton R.A., Sime P.J. A novel anti-inflammatory and pro-resolving role for resolvin D1 in acute cigarette smoke-induced lung inflammation. PloS one. 2013. Vol. 8 (3): e58258. DOI: 10.1371/journal.pone.0058258.
- John G., Kohse K., Orasche J., Reda A., Schnelle-Kreis J., Zimmermann R., Yildirim A.Ö. The composition of cigarette smoke determines inflammatory cell recruitment to the lung in COPD mouse models. Clin. Sci (Lond). 2014. Vol. 126 (3): 207–21. DOI: 10.1042/CS20130117.
- Awji E.G., Seagrave J.C., Tesfaigzi Y. Correlation of cigarette smoke-induced pulmonary inflammation and Emphysema in C3H and C57Bl/6 mice. Toxicol. Sci. 2015. Vol. 147(1): 75–83. DOI: 10.1093/toxsci/kfv108.
- Givi M.E. Akbari P., Boon L., Puzovic V.S., Bezemer G.F., Ricciardolo F.L., Mortaz E. Dendritic cells inversely regulate airway inflammation in cigarette smoke-exposed mice. Am. J. Physiol. Lung Cell. Mol. Physiol. 2015. Vol. 310(1): L95-L102. DOI: 10.1152/ajplung.00251.2014.
- Ge L.T., Liu Y.N., Lin X.X., Shen H.J., Jia Y.L., Dong X.W., Xie, Q.M. Inhalation of ambroxol inhibits cigarette smoke-induced acute lung injury in a mouse model by inhibiting the Erk pathway. Int. Immunopharmacol. 2016. Vol. 33: 90–8. DOI: 10.1016/j.intimp.2016.02.004.
- Jung K.H., Beak H., Park S., Shin D., Jung J., Park S., Bae H. The therapeutic effects of tuberostemonine against cigarette smoke-induced acute lung inflammation in mice. Eur. J. Pharmacol. 2016. Vol. 774: 80–6. DOI: 10.1016/j.ejphar.2016.02.006.
- Jung K.H., Kil Y.S., Jung J., Park S., Shin D., Lee K., Bae H. Tuberostemonine N, an active compound isolated from Stemona tuberosa, suppresses cigarette smoke-induced sub-acute lung inflammation in mice. Phytomedicine. 2016. Vol. 23 (1): 79–86. DOI: 10.1016/j.phymed.2015.11.015.
- Wigenstam E., Rocksen D., Ekstrand-Hammarstrem B., Bucht A. Treatment with dexamethasone or liposome-encapsuled vitamin E provides beneficial effects after chemical-induced lung injury. Inhal. Toxicol. 2009. Vol. 21 (11): 958–64. DOI: 10.1080/08958370802596298.
- Ekstrand-Hammarstrom B., Wigenstam E., Bucht A. Inhalation of alkylating mustard causes long-term T cell-dependent inflammation in airways and growth of connective tissue. Toxicol. 2011. Vol. 280 (3): 88–97. DOI: 10.1016/j.tox.2010.11.012.
- Beigelman A., Mikols C.L., Gunsten S.P., Cannon C.L., Brody S.L., Walter M.J. Azithromycin attenuates airway inflammation in a mouse model of viral bronchiolitis. Respir. Res. 2010. Vol. 11 (1): 90. DOI: 10.1186/1465-9921-11-90.
- Cambau E., Drancourt M. Steps towards the discovery of Mycobacterium tuberculosis by Robert Koch, 1882. Clin. Microbiol. Infect. 2014. Vol. 20(3): 196–201. DOI: 10.1111/1469-0691.12555.
- Padilla-Carlin D.J., McMurray D.N., Hickey A.J. The guinea pig as a model of infectious diseases. Comp. Med. 2008. Vol. 58 (4): 324–-40.
- Ordway D.J., Shanley C.A., Caraway M.L., Orme E.A., Bucy D.S., Hascall-Dove L., Kraft S.L. Evaluation of standard chemotherapy in the guinea pig model of tuberculosis. Antimicrob Agents Chemother. 2010. Vol. 54 (5): 1820–33. DOI: 10.1128/AAC.01521-09.
- Kimoto A., Saito M., Hirano Y., Iwai T., Tomioka K., Miyata K., Yamada T. YM-40461, a potent surfactant secretagogue, improves mucociliary clearance in SO2-exposed guinea pigs. Jpn. J. Pharmacol. 2000. Vol. 83 (3): 191–6.
- Abrams W. R. et al. Acute cigarette smoke exposure in dogs: the inflammatory response //Experimental lung research. – 1988. – Т. 14. – №. 4. – 459–75.
- Hirt R.A., Vondrakova K., de Arespacochaga A.G., Gutl A., van den Hoven R. Effects of cadmium chloride inhalation on airflow limitation to histamine, carbachol and adenosine 5′-monophosphate assessed by barometric whole body plethysmography in healthy dogs. Vet. J. 2007. Vol. 173 (1): 62–72. DOI:10.1016/j.tvjl.2005.09.016
- Bolognin M., Kirschvink N., Leemans J., De Buscher V., Snaps F., Gustin P., Clercx C. Characterisation of the acute and reversible airway inflammation induced by cadmium chloride inhalation in healthy dogs and evaluation of the effects of salbutamol and prednisolone. Vet. J. 2009. Vol. 179 (3): 443–50. DOI:10.1016/j.tvjl.2007.10.004.
- Ghorani V., Boskabady M.H., Khazdair M.R., Kianmeher M. Experimental animal model,s for COPD: a methodological review. Tob. Induc. Dis. 2017. Vol. 15 (1): 25. DOI: 10.1186/s12971-017-0130-2.
- Yahaya B., Understanding Cellular Mechanisms Underlying Airway Epithelial Repair: Selecting the Most Appropriate Animal Models. The Scientific World Journal. 2012. 2012: 961684. DOI: 10.1100/2012/961684.
- Flint J., Eskin E. Genome-wide association studies in mice. Nat. Rev. Genet. 2012. Vol. 13(11): 807–17. DOI: 10.1038/nrg3335.
- Chen P., Hou J., Ding D., Hua X., Yang Z., Cui L. Lipopolysaccharide-induced inflammation of bronchi and emphysematous changes of pulmonary parenchyma in miniature pigs (Sus scrofa domestica). Lab. Anim. (NY). 2013. Vol. 42 (3): 86. DOI: 10.1038/laban.160.
- Chen X., Liu Q., Wang D., Feng S., Zhao Y., Shi Y., Liu Q. Protective Effects of Hydrogen-Rich Saline on Rats with Smoke Inhalation Injury. Oxid. Med. Cell. Longev. 2015. 2015: 8. DOI: 10.1155/2015/106836.
- Zielen S., Trischler J., Schubert R. Lipopolysaccharide challenge: immunological effects and safety in humans. Expert Rev. Clin Immunol. 2015. Vol. 11(3): 409–18. DOI: 10.1586/1744666X.2015.1012158.
- Kharitonov S. A., Sjobring U. Lipopolysaccharide challenge of humans as a model for chronic obstructive lung disease exacerbations. Contrib. Microbiol. 2007. Vol. 14: 83–100. DOI: 10.1159/000107056
- Gupta V. Banyard, A., Mullan, A., Sriskantharajah, S., Southworth, T., & Singh, D. Characterization of the inflammatory response to inhaled lipopolysaccharide in mild to moderate chronic obstructive pulmonary disease. Br. J. Clin. Pharmacol. – 2015. Vol. 79 (5): 767–76. DOI: 10.1111/bcp.12546.
- Войтковская К.С., Черняев А.Л. Синдром оcтрого повреждения легких: определение, патогенез, экcпериментальные модели и роль мезенхимальных cтволовых клеток при лечениии животных. Вестник современной клинической медицины. 2012; 5 (2): 60–7.
- Lee J., Taneja V., Vassallo R. Cigarette smoking and inflammation cellular and molecular mechanisms. J. Den. Res. 2012. Vol. 91(2): 142–9. DOI: 10.1177/0022034511421200.
- Manzel L.J., Shi L., O'Shaughnessy P.T., Thorne P.S., Look D.C. Cigarette smoke inhibition of the NF-{kappa}B-dependent response to bacteria in the airway. Am. J. Respir. Cell Mol. Biol. 2011. Vol. 44: 155–65. DOI: 10.1165/rcmb.2009-0454OC.
- Eltom S., Stevenson C., Birrell M.A. Cigarette smoke exposure as a model of inflammation associated with COPD. Curr. Protoc. Pharmacol. 2013. Vol. 60 (1): 5–64. DOI: 10.1002/0471141755.ph0564s60.
- Leberl M., Kratzer A., Taraseviciene-Stewart L. Tobacco smoke induced COPD/emphysema in the animal model—are we all on the same page? FrontPhysiol. 2013. Vol. 4: 91. DOI: 10.3389/fphys.2013.00091.
- Perez-Rial S., Giren-Martinez O., Peces-Barba G. Animal models of chronic obstructive pulmonary disease. Arch. Bronconeumol. 2015. Vol. 51(3): 121–7. DOI: 10.1016/j.arbres.2014.06.016.
- Воронин Е.А. Биохимическое воздействие кадмия и свинца в продуктах питания на здоровье человека. Современные инновации. 2017; 6 (20): 36–7.
- Salnikow K., Li X., Lippmann M. Effect of nickel and iron co-exposure on human lung cells. Toxicol. Appl. Pharmacol. 2004. Vol. 196 (2): 258–65. DOI: 10.1016/j.taap.2004.01.003.
- Salnikow K., Kluz T., Costa M., Piquemal D., Demidenko Z.N., Xie K., Blagosklonny M.V., The regulation of hypoxic genes by calcium involves c-Jun/AP-1, which cooperates with hypoxia-inducible factor 1 in response to hypoxia. Mol. Cell. Biol. 2002. Vol. 22 (6): 1734–41.
- Semenza G., Signal transduction to hypoxia-inducible factor 1 (Review). Biochem. Pharmacol. 2002. Vol. 64 (5–6):993–8.
- Dunnick J.K., Elwell M.R., Benson J.M., Hobbs C.H., Hahn F.F., Haly P.J., Cheng Y.S., Eidson A.F. Lung toxicity after 13-week inhalation exposure to nickel oxide, nickel subsulfide, or nickel sulfate hexahydrate in F344/N rats and B6C3F1 mice. Fundam. Appl. Toxicol. 1989. Vol. 12 (3): 584–94.
- Calvet J., Gascard J., Delamanche S., Brink C. Airway epithelial damage and release of inflammatory mediators in human lung parenchyma after sulfur mustard exposure. Hum. Exp. Toxicol. 1999. Vol. 18 (2): 77–81.
- Osterlund C., Lilliehok B., Ekstrand-Hammarstrom B., Sandstrem T., Bucht A. The nitrogen mustard melphalan activates mitogen-activated phosphorylated kinases (MAPK), nuclear factor-iB and inflammatory response in lung epithelial cells. J. Appl. Toxicol. 2005. Vol. 25 (4): 328–37. DOI: 10.1002/jat.1070.
- Knauss H.J., Robinson W.E., Medici T.C., Chodosh S. Cell vs. noncell airway temporal response in rats exposed to sulfur dioxide. Arch. Environ. Health. 1976. Vol. 31 (5): 241–7.
- Lamb D., Reid L. Mitotic rates, goblet cell increase and histochemical changes in mucus in rat bronchial epithelium during exposure to sulphur dioxide. J. Pathol. Bacteriol. 1968. Vol. 96 (1): 97–111.
- Long N.C., Abraham J., Kobzik L., Weller E.A., Murthy G.K., Shore S.A. Respiratory tract inflammation during the induction of chronic bronchitis in rats: role of C-fibres. Eur. Respir. J. 1999. Vol. 14 (1): 46–56.
- Shore S.A., Kariya S.T., Anderson K., Skornik W., Feldman H.A., Pennington J., Drazen J. M. Sulfur-dioxide-induced bronchitis in dogs: Effects on airway responsiveness to inhaled and intravenously administered methacholine. Am. Rev. Respir. Dis. 1987. Vol. 135 (4): 840–847.
- Meng Z., Liu Y., Wu D. Effect of sulfur dioxide inhalation on cytokine levels in lungs and serum of mice. Inhal. Toxicol. 2005. Vol. 17(6): 303–7. DOI: 10.1080/08958370590922625.
- Moran T., Hellstrom R. Bronchiolitis obliterans. An experimental study of the pathogenesis and the use of cortisone in modifi cation of the lesions. Arch. Pathol. 1958. Vol. 66: 691–707.
- Ходько С.В., Макарова М.Н., Макаров В.Г., Михайлова В.C. Изучение специфической фармакологической активности нового препарата «FN» на экспериментальной модели острого риносинусита у крыс. Профилактич. и клинич. медицина. 2013; 3 (48): 58–64.
- Ходько С.В., Макарова М.Н., Макаров В.Г., Самусенко И.А., Ширунова М.Г. Экспериментальная модель острого риносинусита у крыс для оценки терапевтической эффективности препаратов. Профилактич. и клинич. медицина. 2013; 1 (46):57–62.
- Кательникова А.Е., Макаров В.Г., Воробьева В.В., Пожарицкая О.Н., Шиков А.Н., Шабанов П.Д. Перспективы использования лекарственных средств на основе в лечении респираторных вирусных инфекций и их осложнений. Обзоры по клинической фармакологии и лекарственной терапии. 2017;15 (1): 3–13.
- Akira S., Hemmi H. Recognition of pathogen-associated molecular patterns by TLR family. Immunol. Lett. 2003. Vol. 85 (2): 85–95




