Референтные интервалы массовых коэффициентов внутренних органов морских свинок
Работа выполнена без спонсорской поддержки.
Бородина А.Ю. Референтные интервалы массовых коэффициентов внутренних органов морских свинок. Лабораторные животные для научных исследований. 2023; 3. https://doi.org/10.57034/2618723X-2023-03-05
Резюме
При проведении токсикологических исследований для определения органов-мишеней одними из контролируемых показателей являются массовые коэффициенты органов и абсолютные массы органов лабораторных животных. Цель данной работы — определение референтных интервалов массовых коэффициентов органов относительно массы тела и массы головного мозга, а также абсолютных масс органов у морских свинок. Для расчета референтных интервалов использовался непрямой метод получения референтных значений, в анализ были включены данные 40 самцов и 61 самки аутбредных морских свинок, полученные при мониторинге здоровья животных в период с 2021 по 2023 г. Начальным этапом получения референтных интервалов является определение статистических выбросов и их исключение по каждому оцениваемому параметру отдельно.
Установлены референтные интервалы с учетом рекомендаций Института клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute) для массовых коэффициентов и абсолютных значений сердца, легких, тимуса, печени, селезенки, почек, надпочечников, головного мозга, семенников и яичников. Ввиду небольшого количества референтных значений (менее 120) использовался робастный метод расчета референтных интервалов с указанием доверительных интервалов. Для повышения прогностической значимости полученных референтных интервалов необходимо увеличение размера анализируемой выборки референтных значений (более 120). С позиции биоэтических норм для достижения данной цели необходимо использовать ретроспективный подход получения дополнительных референтных значений.
Введение
Морские свинки являются одной из часто используемых моделей в доклинических исследованиях лекарственных средств. Например, из-за высокой восприимчивости морских свинок к M. tuberculosis и схожести наблюдаемых гранулем с таковыми у человека они в течение многих лет используются для исследования противотуберкулезных вакцин и лекарственных препаратов [1]. Кроме того, морские свинки являются распространенной тест-системой в исследованиях респираторных заболеваний, в частности используются для изучения нарушений функции легких и таких патологий, как астма и гиперреактивность дыхательных путей [2, 3]. В исследованиях безопасности для выявления местных и системных иммунных реакций гиперчувствительности разработаны протоколы с использованием морских свинок [3], это исследования токсичности повторных доз в соответствии с руководствами OECD 4101 и OECD 4112, оценка фотобезопасности согласно руководству ICH S103, сенсибилизирующего потенциала в тестах максимизации Магнуссона и Клигмана и тесте Бюхлера4 [4].
При проведении токсикологических исследований для определения органов-мишеней одними из контролируемых показателей являются массовые коэффициенты органов, которые, как и абсолютные массы органов, могут дать информацию о наличии атрофических или гипертрофических изменений органов, а также быть критерием «за» или «против» в дополнение к другим определяемым параметрам. При сравнении результатов с контрольной группой выявленные отличия не всегда могут иметь клиническую значимость, в связи с чем возникает необходимость устанавливать собственные внутрилабораторные референтные интервалы для возможности вынести объективное суждение о действии ксенобиотиков.
Цель данной работы — определение референтных интервалов массовых коэффициентов органов и их абсолютных значений у морских свинок.
Материал и методы
Для получения референтных интервалов использовали данные, полученные при мониторинге здоровья животных, используемых в биомедицинских исследованиях в период с 2021 по 2023 г. в АО «НПО «ДОМ ФАРМАЦИИ». Мониторинг здоровья животных проводился на основании рекомендации Федерации европейских ассоциаций в области науки о лабораторных животных (FELASA)5.
В анализируемом массиве представлены данные, полученные от 101 аутбредной морской свинки (40 самцов и 61 самка), масса тела самцов 435–1704 г и возраст от 4 нед, масса тела самок 418–1060 г и возраст от 8 нед. Самки использовались небеременные и нерожавшие. Животные находились в стандартных условиях в соответствии с Руководством по содержанию и использованию лабораторных животных и Директивой 2010/63/EU6. Морские свинки содержались по две головы в стандартных пластиковых клетках со стальными решетчатыми крышками с кормовым углублением. Температура воздуха в помещении 15–26 °C и относительная влажность воздуха 45–65%, световой режим 12 ч света и 12 ч темноты. Морские свинки получали полнорационный комбикорм, в качестве докорма использовали травяную муку и морковь, воду ad libitum. Эвтаназию животных осуществляли с помощью диоксида углерода (CO2) с последующим обескровливанием полостей сердца или извлечением жизненно важных органов.
Регистрацию массы тела животных проводили непосредственно перед некропсией. Органы, извлеченные при некропсии, взвешивались, парные органы взвешивались вместе.
Массовые коэффициенты органов (МКО, %) были рассчитаны относительно массы тела и головного мозга по формулам:
МКО=Мо/Мт×100%, (1)
где Мо — масса органа, г; Мт — масса тела животного, г.
МКО=Мо/Мгм×100%, (2)
где Мгм — масса головного мозга животного, г.
Статистический анализ выполняли с помощью лицензированного программного обеспечения Microsoft Excel и бесплатного программного обеспечения Reference Value Advisor v2.1 (National Veterinary School, Toulouse, France) [5].
Результаты и обсуждение
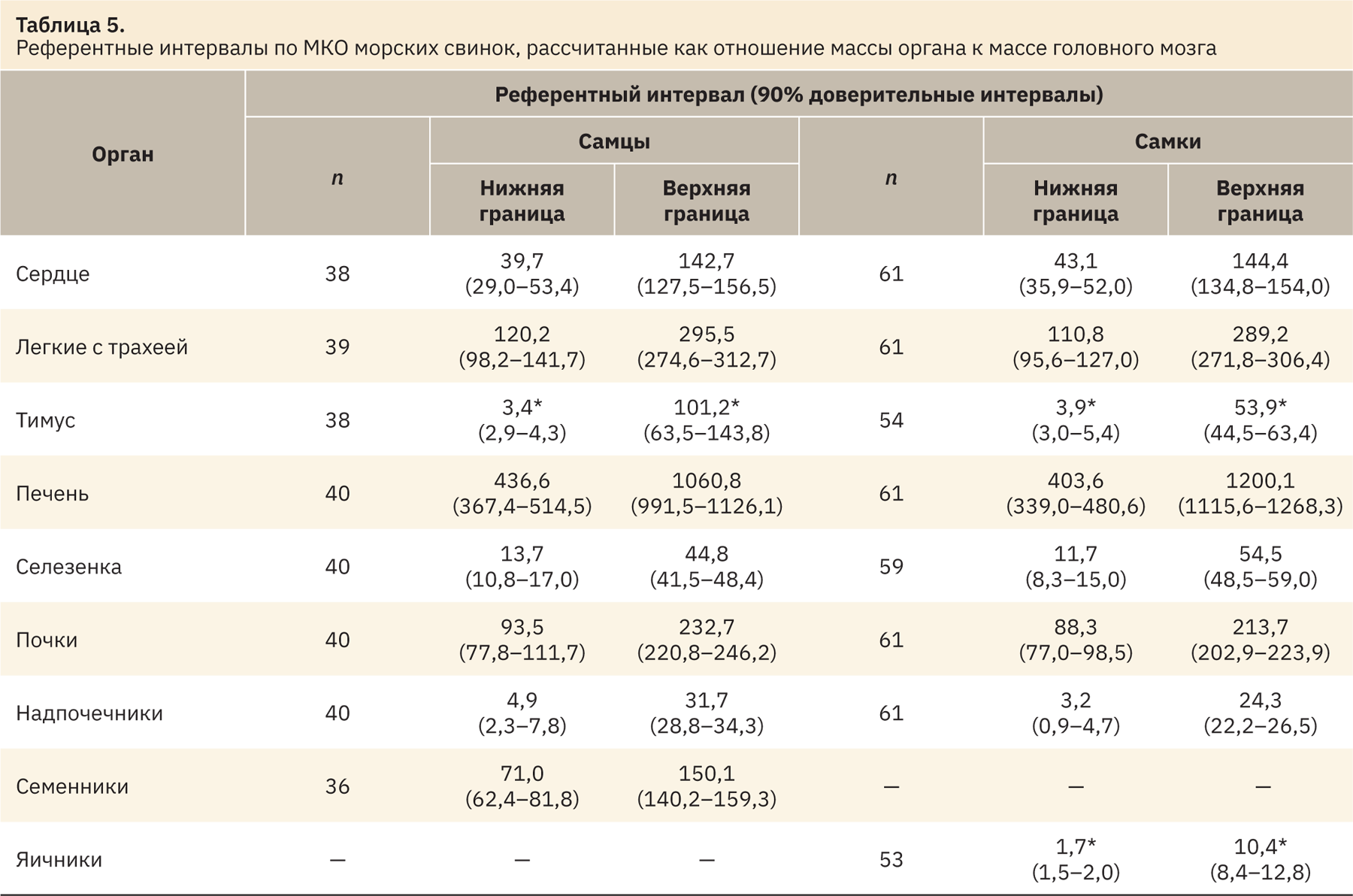
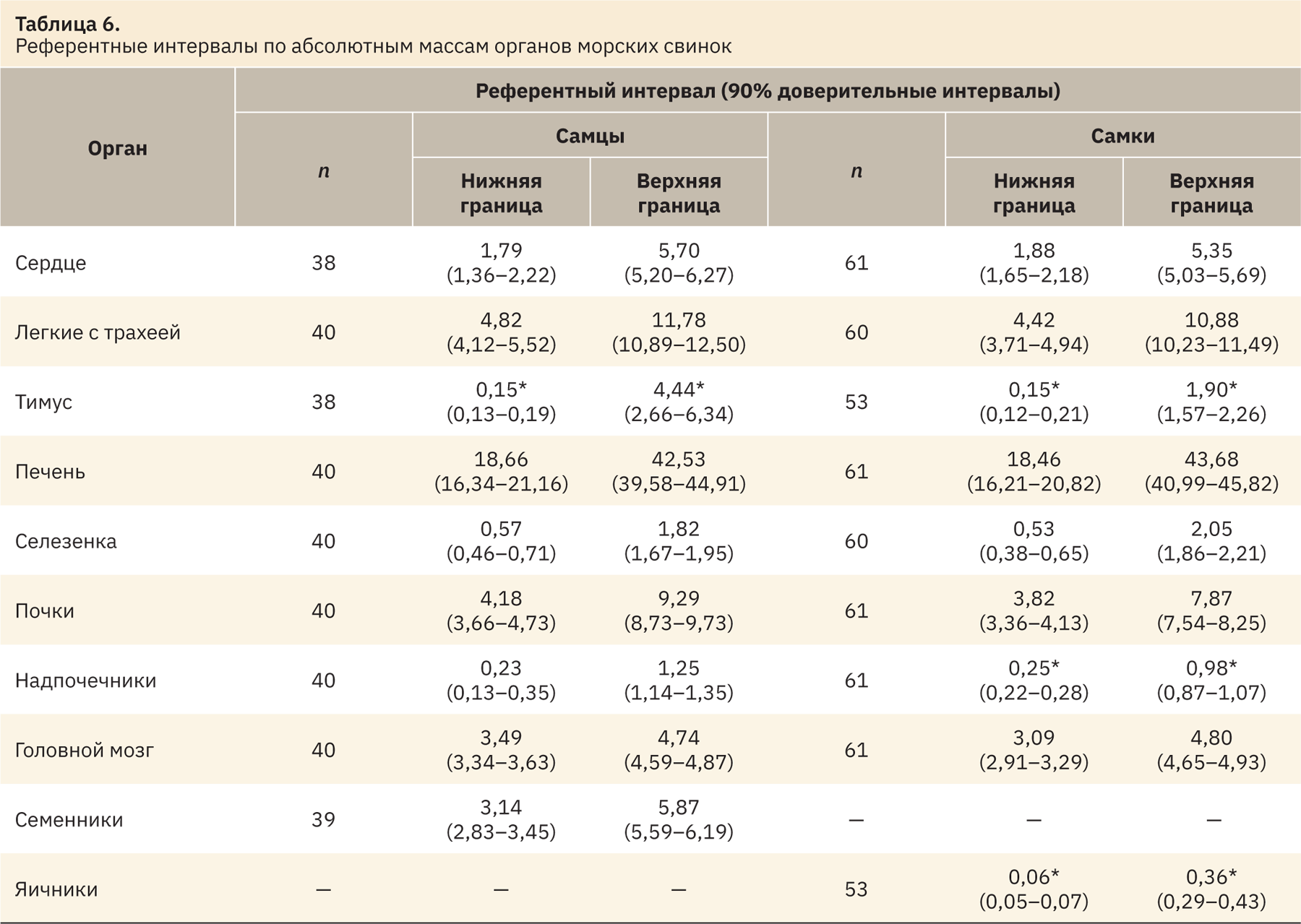
Существует два метода определения референтных интервалов (РИ), основанных на способе получения данных референтных значений (РЗ): в одном используют данные, полученные целенаправленным рекрутингом референтных индивидуумов, — прямой метод, во втором применяют массив данных, уже накопленный в организации, — непрямой метод [6]. В данном случае использовался непрямой метод определения РИ, разработанный Институтом клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute, CLSI) [7]. РИ рассчитывали для таких РЗ, как МКО относительно массы тела, МКО относительно массы головного мозга и абсолютных масс органов. Эти показатели выбраны для определения РИ, так как, например, при проведении токсикологических исследований может быть недостаточно информации только по МКО относительно массы тела, например, может произойти резкое изменение массы тела, связанное с лишением корма перед отбором крови, эвтаназией, что приводит к недостоверному изменению МКО относительно массы тела. В этом случае может помочь расчет и анализ данных МКО относительно головного мозга, так как масса головного мозга является своеобразной константой, которая не подвержена колебаниям, связанным с изменением массы тела. Кроме того, наглядным показателем изменений могут служить абсолютные массы органов.
Начальным этапом получения РИ служат определение наличия и исключение РЗ, значительно отличающихся от основного массива данных (статистические выбросы). Выбросы определяли по каждому показателю отдельно и для каждого пола по методу, созданному Тьюки и доработанному Хорном [7]. Для этого в Microsoft Excel рассчитывали значения нижнего Q1 и верхнего Q3 квартилей, а также межквартильный интервал IQR=Q3–Q1. Затем вручную исключали значения, лежащие за нижней границей Q1–1,5IQR и превышающие верхнюю границу Q3+1,5IQR (табл. 1–3).
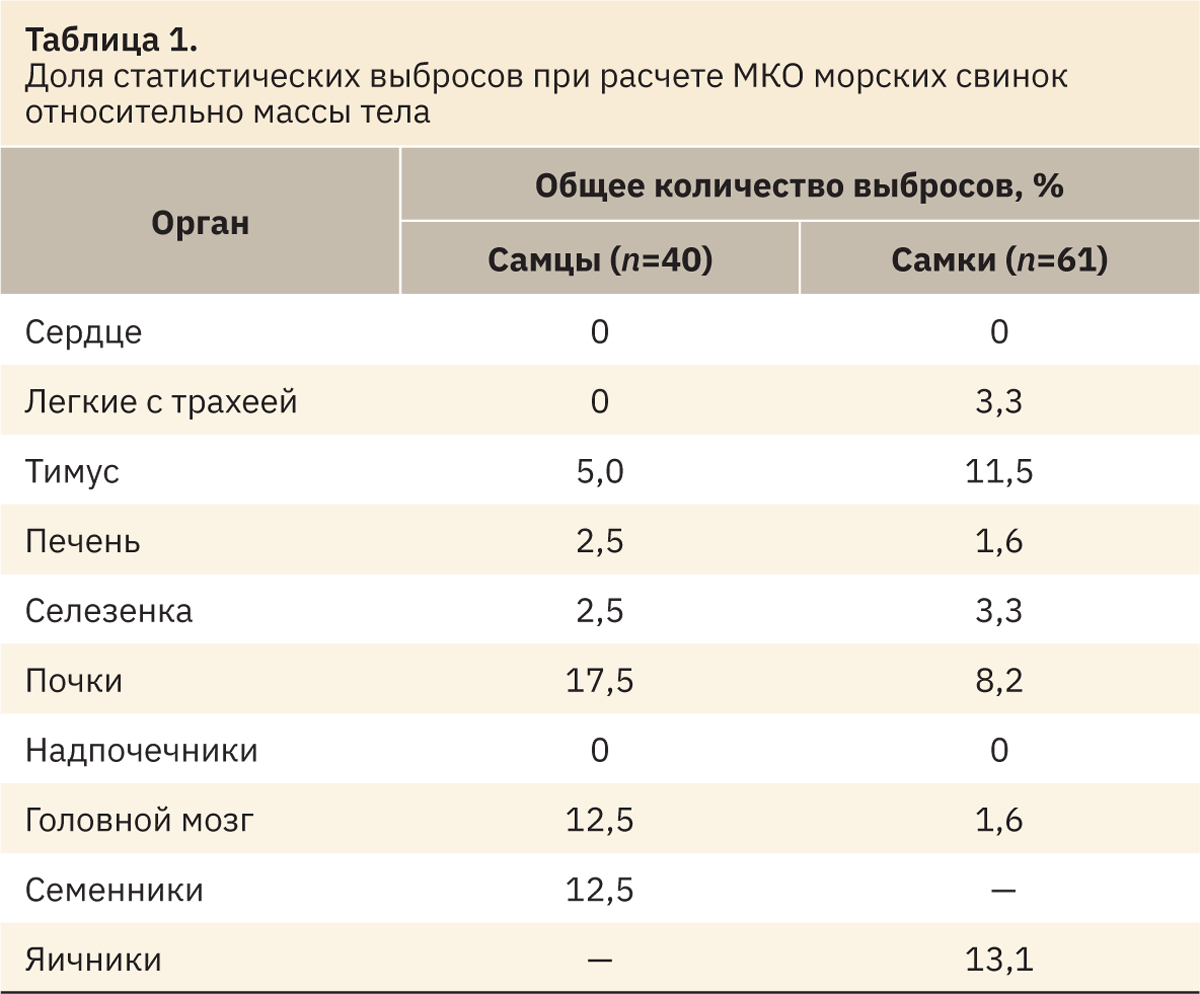
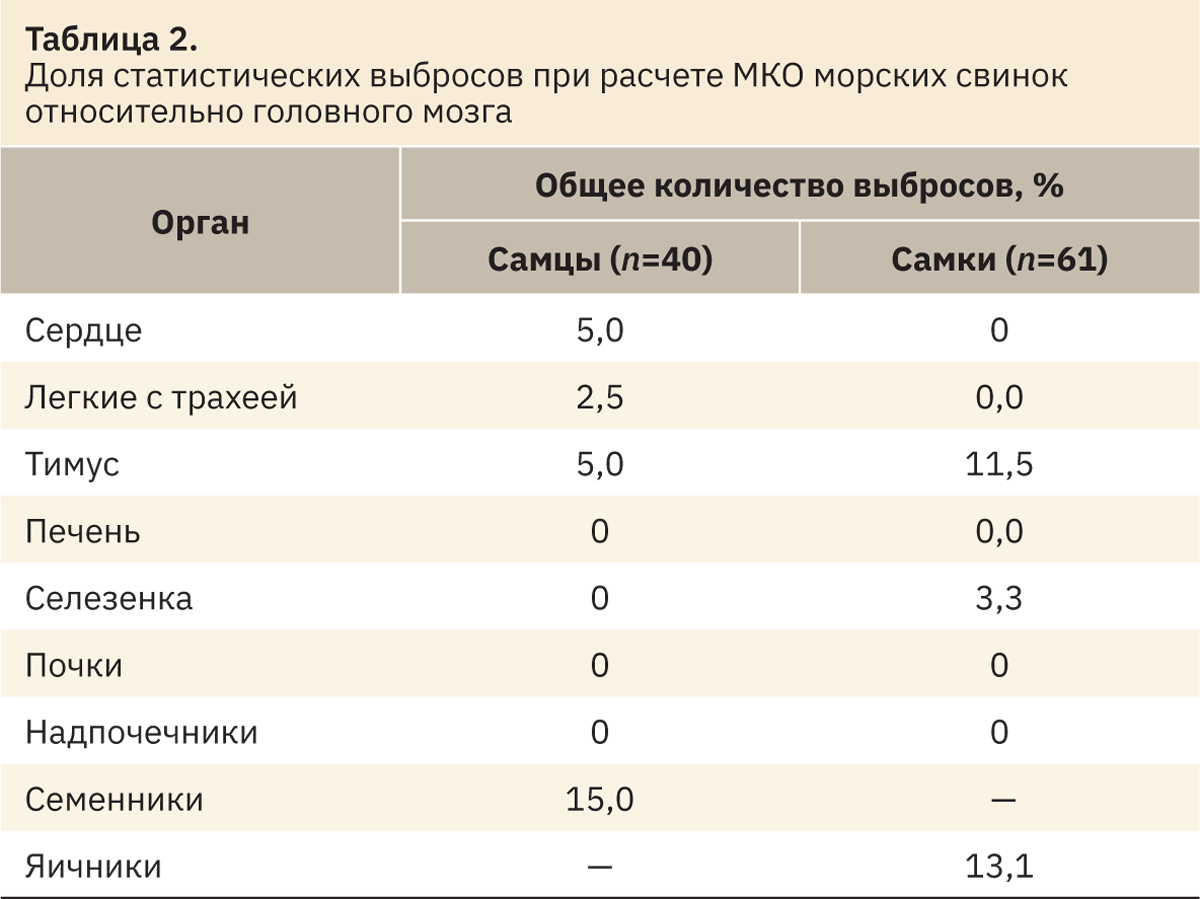
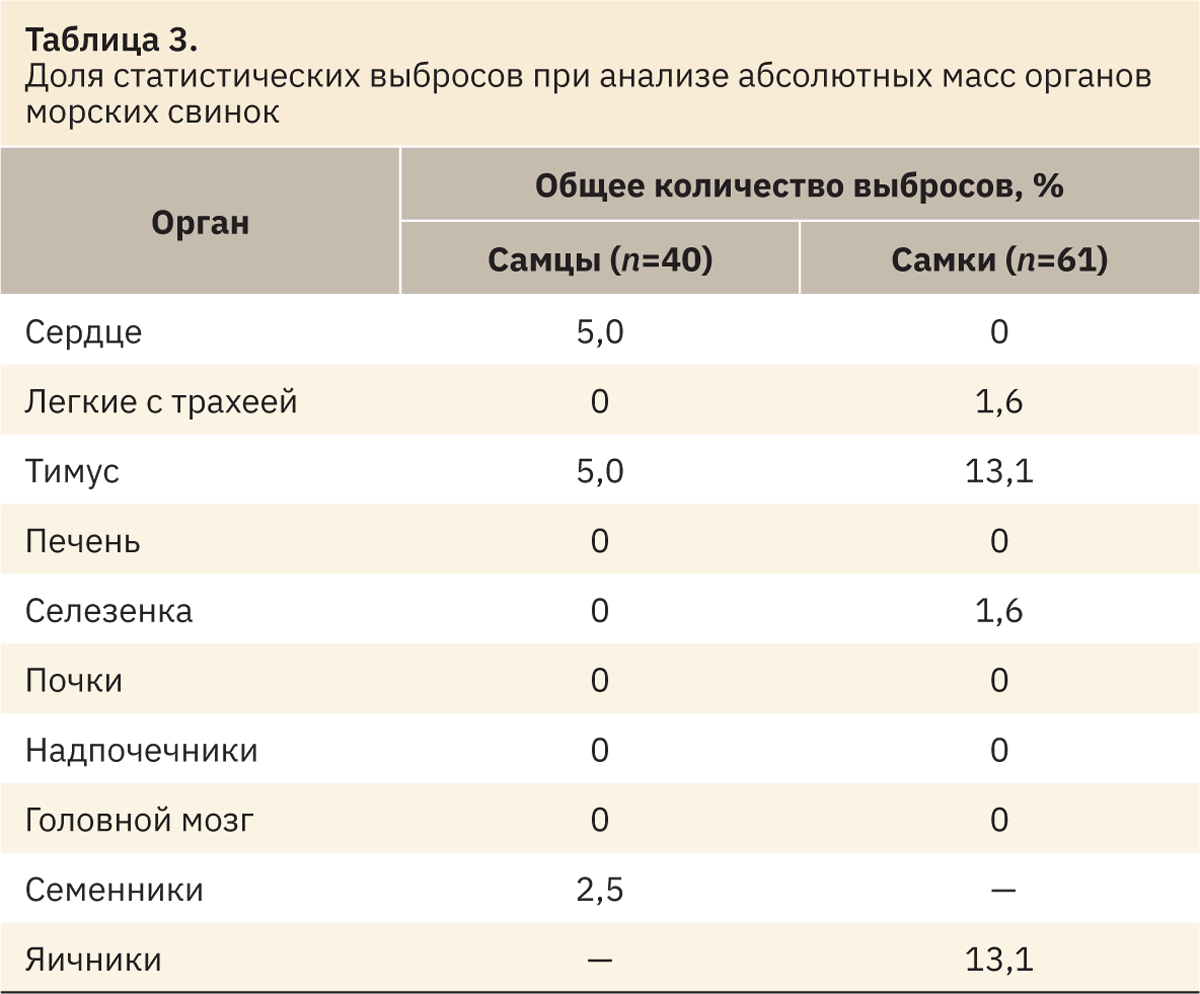
При анализе выбросов выявлено наибольшее количество выпадающих значений в данных МКО относительно массы тела. Меньшее количество выпадающих значений определено при анализе абсолютных масс органов. У самцов и самок чаще встречаются выбросы по показателю «тимус», а также «семенники» и «яичники». После выявления и устранения статистических выбросов оставшиеся РЗ использовали для определения РИ.
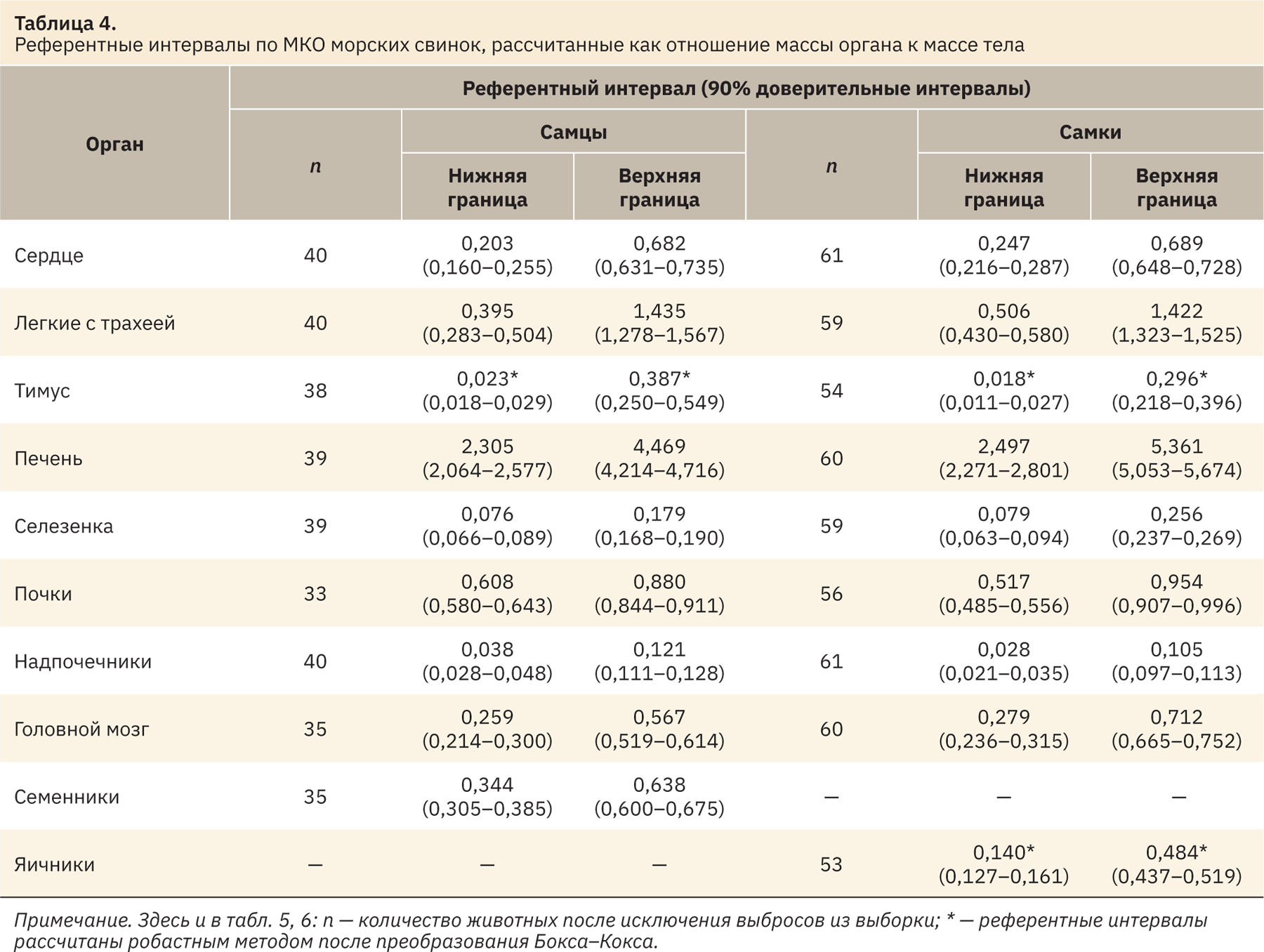
Расчет пределов РИ проводили с помощью робастного метода, в котором применяется специальный робастный алгоритм, присваивающий РЗ различный вес в зависимости от удаленности РЗ от медианы. Робастный метод применяется в тех случаях, когда доступно небольшое количество РЗ — от 20 до 120 [7]. При наличии менее 20 РЗ определение РИ не рекомендуется [8]. Робастный метод помогает обеспечить релевантные РИ при наличии небольшого числа выборок [9].
Для расчета РИ с помощью робастного метода был использован набор макросов для Microsoft Excel — Reference Value Advisor v2.1 (National Veterinary School, Toulouse, France) [5], которые вычисляют РИ на основе данных, содержащихся в электронной таблице. Программное обеспечение полностью соответствует руководству CLSI [7].
Reference Value Advisor использует тест Андерсона–Дарлинга для проверки на соответствие закону нормального распределения, поскольку тест в основном ищет отклонения от нормальности в хвостах распределения, которые имеют первостепенное значение для определения РИ. Если распределение не являлось Гауссовым, то было использовано преобразование Бокса–Кокса.
Программа также позволяет рассчитать 90% доверительные интервалы (ДИ), которые представлены в табл. 4–6 вместе с РИ. ДИ референтных интервалов должны быть указаны независимо от размера выборки, используемой для расчета. ДИ дают полезную информацию о точности вычисленного РИ [5, 6, 8].
Заключение
Рассчитанные референтные интервалы необходимо использовать как дополнительный критерий в ходе комплексного подхода к принятию решения о наличии/отсутствии токсического действия исследуемого агента в совокупности с данными о состоянии животных (клинические признаки интоксикации), патологоанатомических и клинико-лабораторных исследований. Для повышения прогностической значимости полученных референтных интервалов — расчет более точных (узких) значений — необходимо увеличение размера анализируемой выборки референтных значений. С этической точки зрения для достижения данной цели целесообразно использовать ретроспективный подход получения дополнительных референтных значений.
Сведения о конфликте интересов
Автор заявляет об отсутствии конфликта интересов.
-
OECD T. N. 410. Guideline for testing of chemicals. Repeated Dose Dermal Toxicity: 21/28-day Study N. 410. 1981.
-
OECD T. N. 411. Guideline for testing of chemicals. Subchronic Dermal Toxicity: 90-day Study. N. 411. 1981.
-
ICH S10. Photosafety Evaluation of Pharmaceuticals. Guidance for Industry. 2015.
-
OECD T. N. 406. Guideline for testing of chemicals. Skin Sensitisation. N. 406. 2022.
-
FELASA recommendations for the health monitoring of mouse, rat, hamster, guinea pig and rabbit colonies in breeding and experimental units. 2014.
- Директива 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях. Санкт-Петербург, 2012.
Список источников
-
Lin P.L., Flynn J.A.L. Tuberculosis research using nonhuman primates // Nonhuman primates in biomedical research. Academic Press. 2012. P. 173–196. DOI: 10.1016/B978-0-12-381366-4.00003-1.
-
Hargaden M., Singer L. Anatomy, physiology, and behavior // The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents. Academic Press, 2012. P. 575–602. DOI: 10.1016/B978-0-12-380920-9.00020-1.
-
Huneke R.B. Basic experimental methods // The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents. Academic Press, 2012. P. 621–635. DOI: 10.1016/B978-0-12-380920-9.00022-5.
-
Каргопольцева Д.Р., Крышень К.Л., Кательникова А.Е. и др. Опыт применения теста максимизации Магнуссона и Клигмана на морских свинках при оценке сенсибилизирующего потенциала химических веществ // Лабораторные животные для научных исследований. 2018. № 4. C. 74–87. [Kargopoltseva D., Kryshen K., Katelnicova A. et al. Opyt primeneniya testa maksimizacii Magnussona i Kligmana na morskih svinkah pri ocenke sensibiliziruyushchego potenciala himicheskih veshchestv // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2018. N. 4. P. 74–87. (In Russ.)]. DOI: 10.29296/2618723X-2018-04-06.
-
Geffré A., Concordet D., Braun J.-P. et al. Reference Value Advisor: a new freeware set of macroinstructions to calculate reference intervals with Microsoft Excel // Veterinary Clinical Pathology. 2011. Vol. 40. P. 107–112. DOI: 10.1111/j.1939-165X.2011.00287.x.
-
Евгина С.А., Савельев Л.И. Современные теория и практика референтных интервалов // Лабораторная служба. 2019. Т. 8. № 2. С. 36–44. [Evgina S.A., Savel’ev L.I. Sovremennye teoriya i praktika referentnykh intervalov // Laboratornaya sluzhba. 2019. T. 8. N. 2. P. 36–44. (In Russ.)]. DOI: 10.17116/labs2019802136.
-
CLSI Document C28-A3c. Defining, establishing, and verifying reference intervals in the clinical laboratory; approved guideline, third edition. Wayne, Pa., USA: CLSI, 2010.
-
Friedrichs K.R., Harr K.E., Freeman K.P. et al. ASVCP reference interval guidelines: determination of de novo reference intervals in veterinary species and other related topics // Veterinary clinical pathology. 2012. Vol. 41. N. 4. P. 441–453. DOI: 10.1111/vcp.12006.
- Horn P. S., Pesce A.J. Copeland B.E. A robust approach to reference interval estimation and evaluation // Clinical chemistry. 1998. Vol. 44. N. 3. P. 622–631. DOI: 10.1093/clinchem/44.3.622.



