Сравнительная морфология кожи человека и лабораторных животных (краткое сообщение)
Гущин Я.А., Ковалева М.А. Сравнительная морфология кожи человека и лабораторных животных (краткое сообщение). Лабораторные животные для научных исследований. 2019; 2. https://doi.org/10.29296/2618723X-2019-02-06
Резюме
Понимание особенностей морфологического строения, основных структурных и функциональных компонентов кожи человека и лабораторных животных служит фундаментом рационального планирования проведения доклинических исследований накожных лекарственных форм для токсикологических, так для фармакологических испытаний. Обоснованный выбор лабораторных животных позволяет обеспечить более точную трансляцию результатов доклинических исследований в фазу ранней клинической разработки лекарственного препарата. Приведена сравнительная морфология кожи человека и некоторых видов лабораторных животных (мышь, крыса, морская свинка, хомяк, кролик, хорек, мини-пиг). Описаны структурные сходства и различия слоев кожи (эпидермис, дерма, гиподерма). Приведена сравнительная характеристика толщины эпидермиса и дермы у разных видов, основанная на анализе данных литературы и результатов собственных исследований. Сравнительный анализ проведен как между человеком и лабораторными животными, так и между видами.
Введение
Кожа человека – сложнейший многофункциональный и самый большой по площади орган, который у взрослого человека достигает 1,5–2,3 м2. Ее масса составляет 4–6%, а вместе с гиподермой –16–17% от общей массы тела. Кожный покров человека представляет собой границу между организмом и окружающей средой. Функции кожи: защитная, абсорбционная, выделительная, терморегулирующая, рецепторная, метаболическая [1]. При проведении доклинических исследований накожных лекарственных форм крайне важно понимать особенности морфологического строения, основных структурных и функциональных компонентов кожи человека и лабораторных животных. Это позволяет еще на стадии доклинической разработки лекарственного препарата выбрать вид лабораторных животных, который наиболее полно удовлетворяет задачи исследования и служит достижению поставленной цели. Кроме того рациональный выбор животных обеспечивает более полную трансляцию полученных данных в клинические исследования, позволяет исключить нежелательные реакции и непредсказуемые результаты на ранних стадиях клинической разработки лекарственных препаратов, при невозможности их полного исключения позволяет выбрать правильные критерии оценки физиологических параметров клинического мониторинга потенциальных нежелательных явлений.
Строение кожи
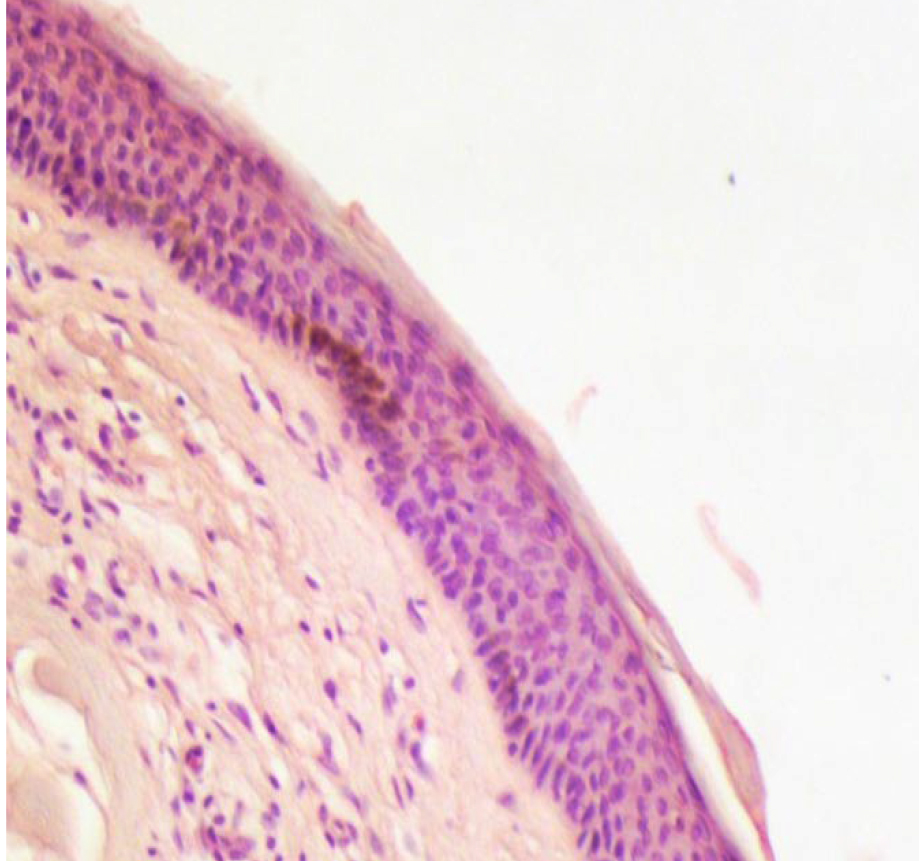
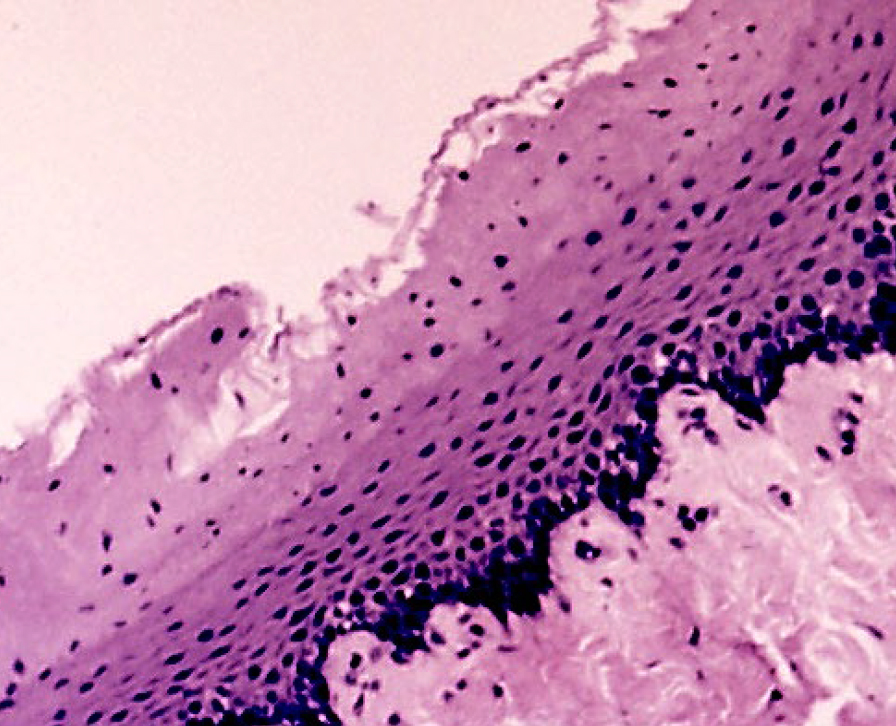
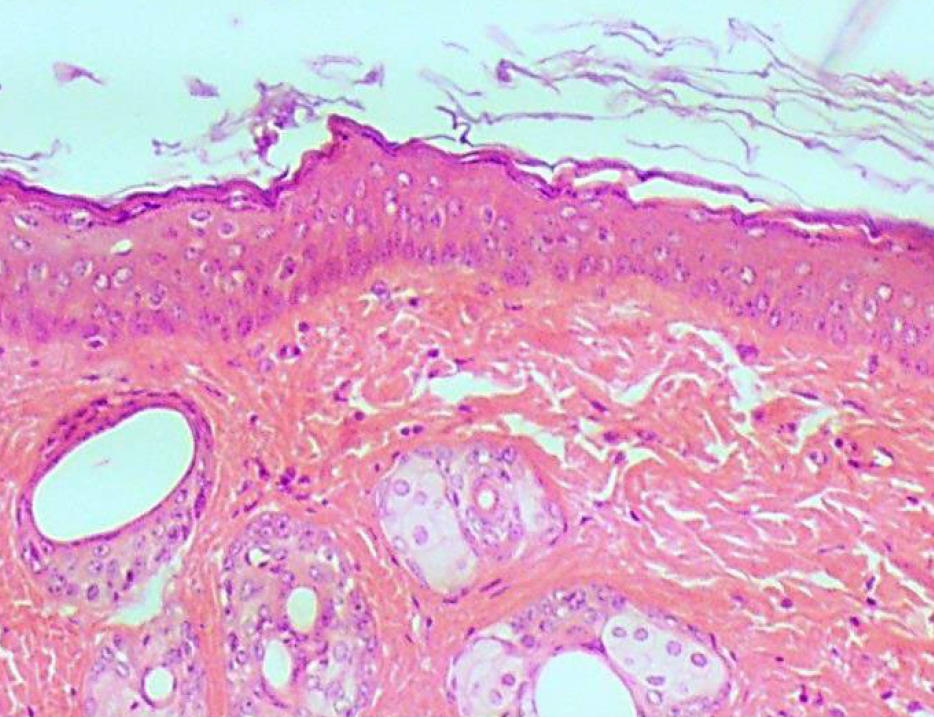
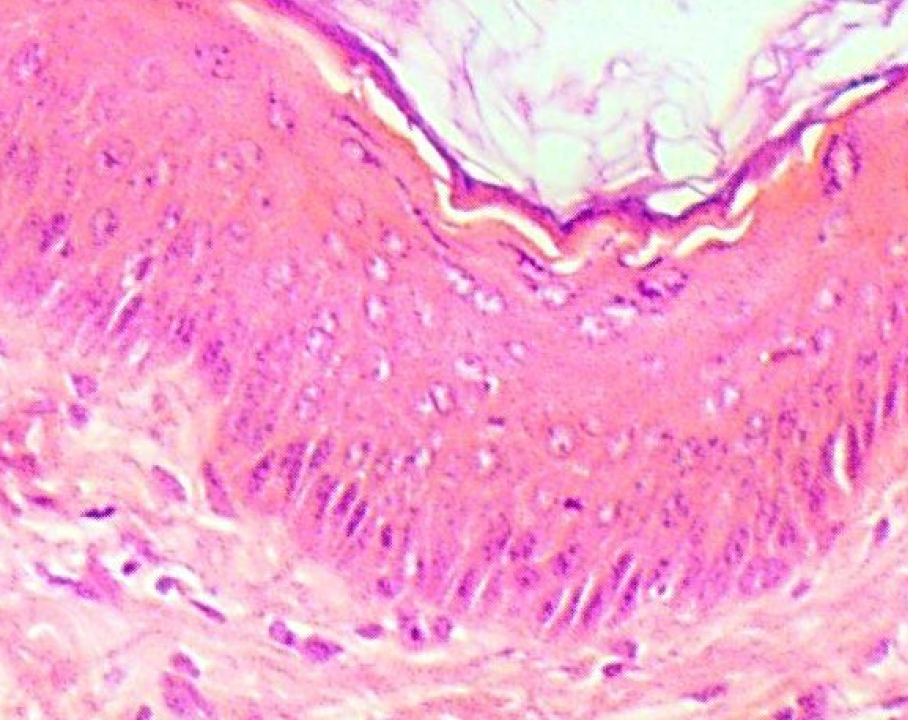
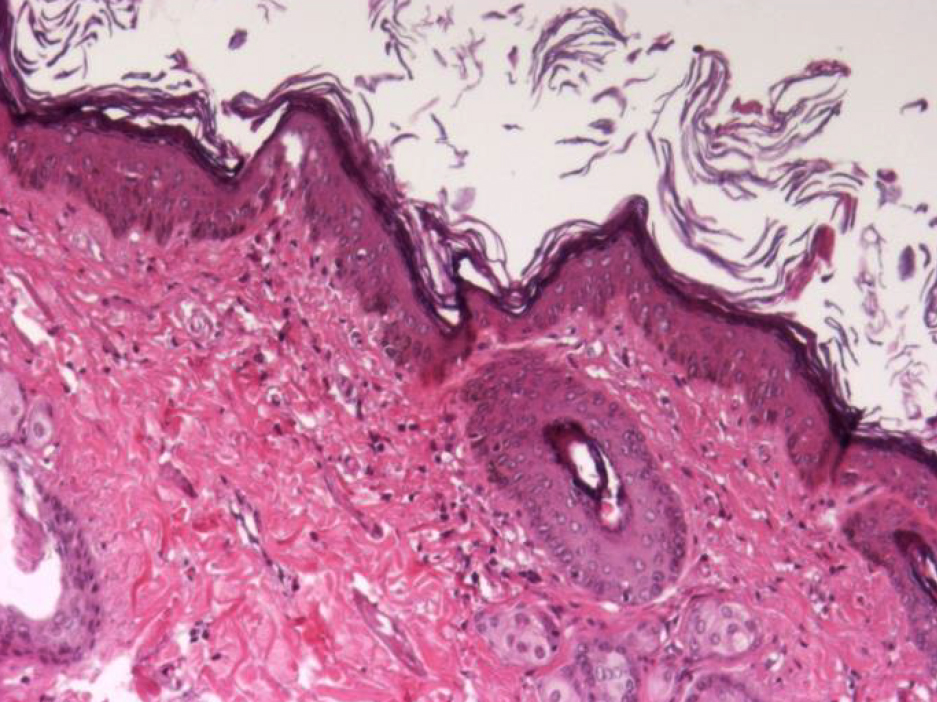
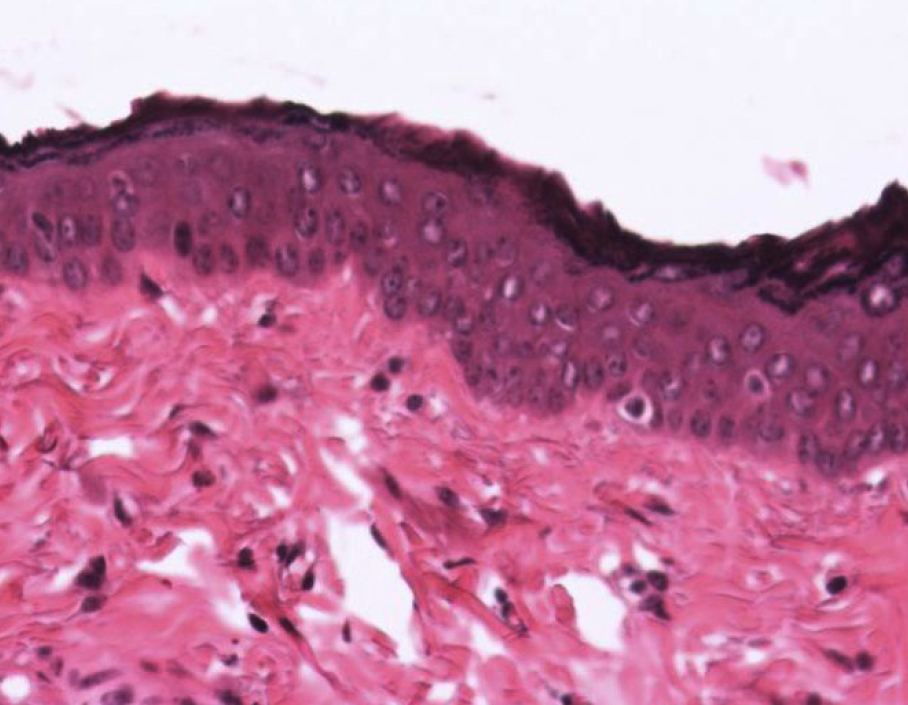
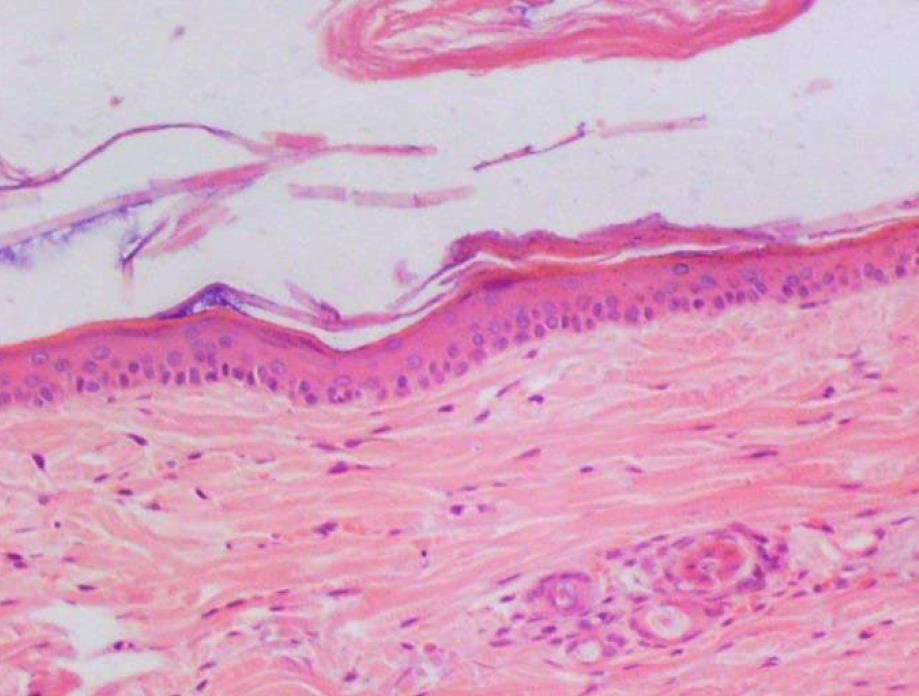
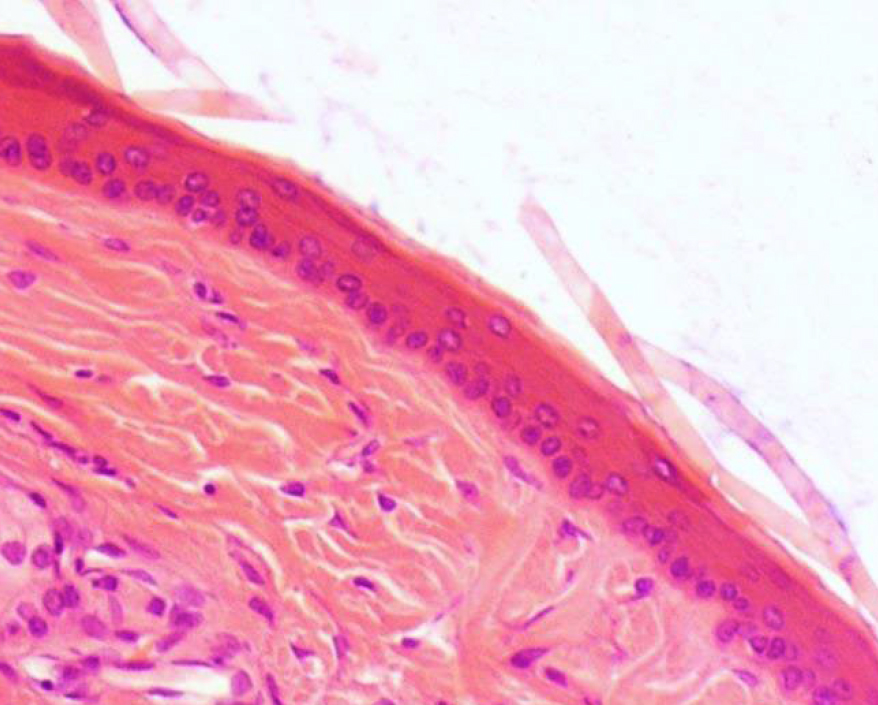
Кожа у человека состоит из 3 слоев: наружного – эпидермиса (многослойного плоского ороговевающего эпителия), среднего – двухслойной дермы и внутреннего – гиподермы (рис. 1–10) [2].
Эпидермис состоит из слоев клеток: базальный, шиповатый, зернистый, и самый верхний – роговой; выделяют также дополнительный – блестящий слой, расположенный в толстой грубой коже ладоней и стоп.
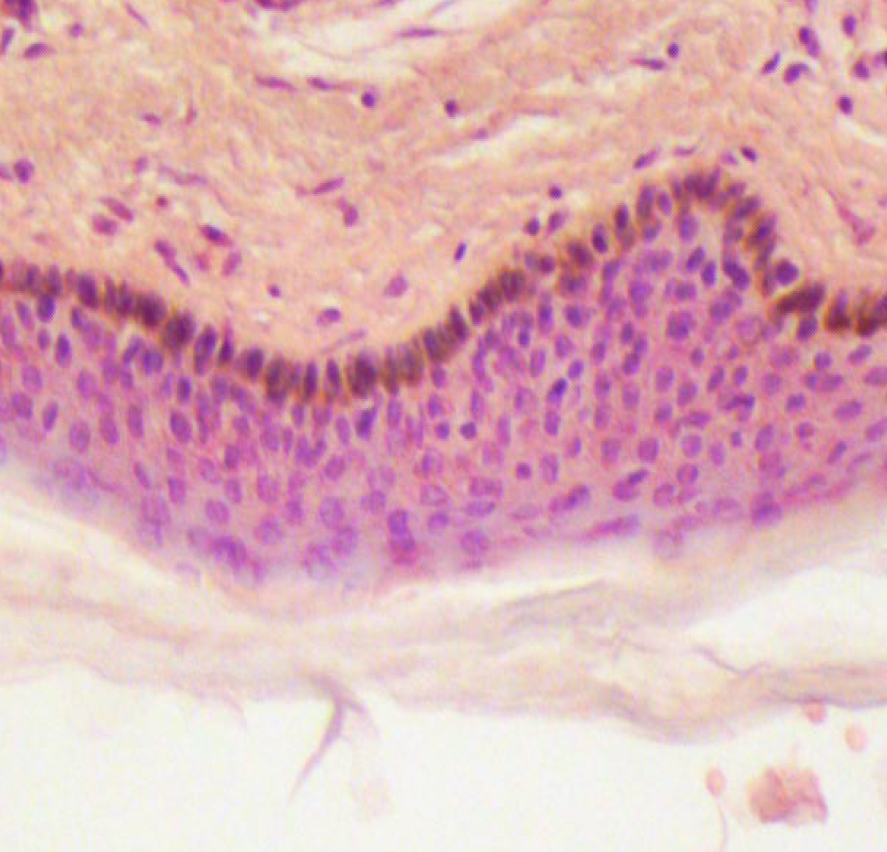
Если рассматривать гистологическое строение кожи животных, то следует отметить отсутствие принципиальных различий: у них так же, у человека, прослеживаются все слои, прежде всего, это касается крупных животных, например свиней. У мелких лабораторных животных толщина кожи значительно меньше, чем у человека (табл. 1), поэтому граница эпидермальных слоев нечеткая и количество клеточных элементов каждого разнится. Так, шиповатый слой у человека состоит из 3–6 рядов клеток (до 15 на коже стоп), у мышей и крыс [2, 3, 4] можно четко различить 1–2 слоя, то же наблюдается в зернистом и роговом слоях, где рядов в 2–3 раза меньше, чем у человека.
Есть незначительные изменения в качественном составе: в базальном слое у человека диффузно расположены меланоциты, у свиней их несколько меньше [5], у мелких лабораторных животных, и прежде всего у мышей [6] меланин сконцентрирован в области волосяных фолликулов, придавая цвет не коже, а шерсти. Стоит отметить, у белых животных (альбиносов) меланоциты присутствуют, но нет гена – тирозиназы, необходимого для производства меланина [7].
Таблица 1
Сравнительная характеристика толщины эпидермиса и дермы у разных видов
|
Источник информации |
Человек |
Мини-пиг |
Крыса |
Мышь |
Кролик |
Морская свинка |
Хомяк |
Хорек |
|
(область живота) |
(область холки) |
(область холки) |
(область холки) |
(область холки) |
(область холки) |
(область холки) |
||
|
Эпидермис, мкм |
||||||||
|
[3–9] |
50–1000 |
50–60 |
10–18 |
10–15 |
9–15 |
36 |
10–15 |
24 |
|
Собственные данные |
Нет |
40–55 |
12–19 |
9–14 |
10–17 |
25–40 |
13–15 |
25-43 |
|
Дерма, мкм |
||||||||
|
[3–9] |
50–2000 |
100–500 |
300–500 |
350 |
400 |
500 |
400 |
600-900 |
|
Собственные данные |
Нет |
300–450 |
300–570 |
260–40 |
240–410 |
320–400 |
250–380 |
420-750 |
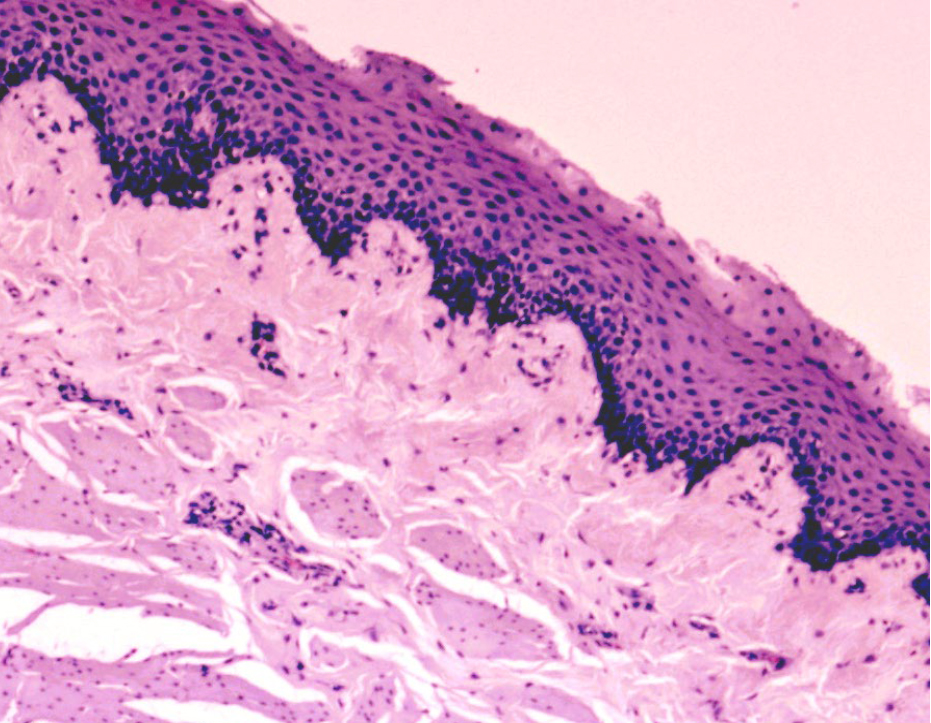
Дерма – следующий слой кожного покрова, располагается ниже эпидермиса, отграниченная от него базальной мембраной, препятствующей проникновению одного в другой. Дерма разделяется на тонкий – сосочковый и толстый соединительнотканный сетчатый слои. Эпидермис и дерма, взаимодействуя друг с другом, образуют выпячивания – эпидермальные тяжи и дермальные сосочки [2]. У грызунов эта рельефность выражена слабо, зачастую полностью отсутствуя у мышей, и сохраняясь только в области подошв. Возможно, это связано с наличием у животных шерсти, которая предохраняет кожу от излишнего механического воздействия и трения, которое у человека компенсируется этими складками [7]. Однако рыхлый сосочковый слой способствует легкому отслоению эпидермиса [5].
У человека и мини-пигов сильно развита капиллярная сеть, участвующая в терморегуляции, у грызунов, в виду развитого шерстяного покрова, кровеносные сосуды локализуются больше в области волосяных фолликулов, что обусловлено сложным циклом жизни волос [7].
У человека и животных в дерме лежит большое количество сальных желез, а вот экзокринные железы, разбросанные у людей по всей поверхности кожи, у животных присутствуют только в области морды и подошвенных отделов конечностей [4, 5, 7]
Гиподерма – самый нижний слой кожи – представлен рыхлой соединительной тканью, жировой тканью и клеточными элементами фибробластами и макрофагами. У грызунов в гиподерме, помимо белой жировой ткани, содержится и бурая [8, 9], которую у людей и свиней можно обнаружить лишь в первые месяцы жизни [9].
Заключение
Понимание морфологического строения кожи, основных структурных и функциональных особенностей у каждого вида позволяет адекватно выбирать тест-систему для проведения доклинических исследований (включая оценку местной переносимости и местно-раздражающего действия) накожных лекарственных форм. Так, более высокая проницаемость кожных покровов у грызунов [11] может быть полезна при проведении токсикологических или санитарно-гигиенических исследований абсорбции веществ через кожу, в том числе при выборе накожного нанесения в качестве 2-го пути введения препарата. Безусловно, полученные нежелательные реакции на животных у человека будут выражены в значительно меньшей степени. При изучении фармакологической активности препаратов следует выбирать наиболее схожие тест-системы, например кожа свиньи структурно аналогична коже человека по толщине и расстоянию между волосяными фолликулами, что делает ее полезной для исследований лекарственных средств, используемых для заживления ран и ожоговых повреждений [12].
Список источников
- Гребенюк Л.А. Утенкин А.А. Механические свойства кожного покрова человека. Физиология человека; 1994; №2.
- Хэм А., Кормак Д. Гистология. В 5-ти томах. М.: Мир, 1983.
- Subrtová D. Ultrastructure of the epidermis in laboratory rats under normal conditions and after percutaneous administration of an organophosphate. Sb Ved Pr Lek Fak Karlovy Univerzity Hradci Kralove. 1989. Vol. 32 (3): 221–312.
- George A Parker, Catherine A. Picut. Atlas of Histology of the Juvenile Rat. Academic Press, 2016: 462.
- Eggleston T.A., Roach W.P., Mitchell M.A., Smith K., Oler D., Johnson T.E. Comparison of two porcine (Sus scrofa domestica) skin models for in vivo near-infrared laser exposure. C omp. Med. 2000. Vol. 50 (4): 391–7.
- Avci P., Sadasivam M., Gupta A., De Melo W.C., Huang Y.Y., Yin R., Chandran R., Kumar R., Otufowora A., Nyame T., Hamblin M.R. Animal models of skin disease for drug discovery. Expert Opin Drug Discov. 2013. Vol. 8 (3): 331–5. doi: 10.1517/17460441.2013.761202.
- Treuting P.M., Dintzis S.M., Frevert C.W. et al. Comparative Anatomy and Histology: A Mouse and Human Atlas. Elsevier, Amster-dam-Boston-Heilderberg-London-NewYork-Oxford-Paris-SanDiego-SanFrancisco-Singapore-Sydney-Tokyo, 2012: 461.
- Stricker-Krongrad A., Shoemake C.R., Liu J., Brocksmith D., Bouchard G. The importance of minipigs in dermal safety assessment: an overview. Cutan Ocul Toxicol. 2016. Vol. 10: 1–9. doi: 0.1080/15569527.2016.1178277.
- Hahn P., Novak M. Development of brown and white adipose tissue. Journal of lipid research. 1975. Vol. 16: 79–91.
- Dauncey M.J., Wooding F.B., Ingram D.L. Evidence for the presence of brown adipose tissue in the pig. Research in veterinary science. 1981. Vol. 31 (1): 76–81.
- van Ravenzwaay B., Leibold E. A comparison between in vitro rat and human and in vivo rat skin absorption. Human & Experimental Toxicology. 2004. Vol. 23: 421–30.
- Sullivan T.P., Eaglstein W.H., Davis S.C., Mertz P. (2001). The pig as a model for human wound healing. Wound Repair. Regen. 2001. Vol. 9: 66–76.




