Кошки в лабораторных исследованиях. Обзор литературы
Макарова М.Н. Кошки в лабораторных исследованиях. Обзор литературы. Лабораторные животные для научных исследований. 2021; 1. https://doi.org/10.29296/2618723X-2021-01-09
Резюме
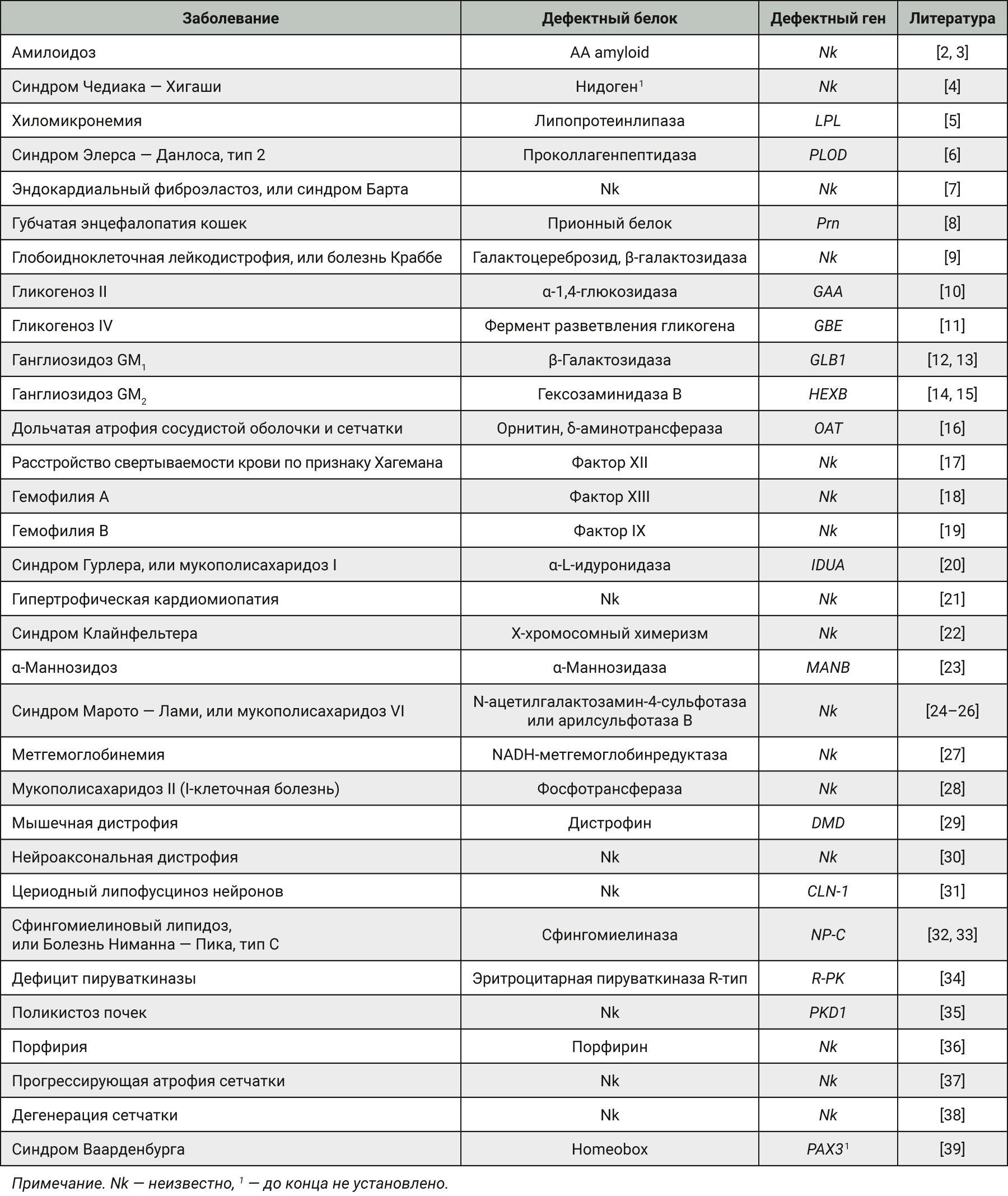
На протяжении многих лет кошек успешно используют в доклинических исследованиях (ДКИ). Следует отметить, что в условиях популяризации и активного внедрения принципов гуманного обращения с животными в исследовании (3Rs-принципы) во всем мире число животных данного вида, используемых в эксперименте, стало уменьшаться. Биоэтические комиссии детально изучают протоколы (планы) исследований с использованием данного вида животных. По данным Understanding Animal Research в Англии (2019), для проведения ДКИ была использована 131 кошка. Такая цифра несопоставима с количеством мышей и крыс, используемых в ДКИ, тем не менее кошки как тест-система вносят уникальный вклад в процесс разработки лекарственных препаратов, данный вид животных незаменим в экспериментальной неврологии, офтальмологии, исследовании ретровирусов, наследственных и иммунодефицитных заболеваний.
В ходе развития генной инженерии и селекции планировалось, что с течением времени высокоорганизованные животные, такие как кошки, для целей доклинических исследований будут полностью замещены нокаутными трансгенными мышами. Предполагалось, что нокаутные трансгенные мыши будут отражать все необходимые экспериментальные модели для изучения специфических мутаций генов. Однако на практике у нокаутных мышей с дефектами тех или иных генов могли не отмечаться клинические признаки патологии, регистрироваться заболевание в летальной форме или выявляться клинические признаки, которые не соответствуют таковым у человека. В то же время многие наследственные заболевания кошек практически идентичны аналогичным заболеваниям человека, что повышает трансляционность полученных данных. Следует отметить, что размер данного вида лабораторных животных позволяет проводить исследования, дизайн которых предусматривает забор большого объема биоматериала (кровь, моча и т.д.), эти преимущества перед грызунами (мышь, крыса, хомяк и др.) делают кошку незаменимой тест-системой для проведения исследований по оценке фармакокинетических показателей для ряда тестируемых объектов.
В статье описаны основные направления ДКИ, в которых целесообразно использовать в качестве тест-систем кошек (модели инфекционных и неинфекционных заболеваний, заболевания глаз, патологии дыхательной системы, модели на изолированных органах кошки), также рассмотрены их наследственные заболевания.
Введение
В мире среди всех лабораторных животных кошки используются не более чем в 2% экспериментов. По данным Understanding Animal Research (https://www.understandinganimalresearch.org.uk/), в Англии (2019) для проведения доклинических исследований была использована 131 кошка. Однако кошки вносят уникальный вклад в науку, и имеющиеся особые биологические характеристики делают их незаменимыми в экспериментальной неврологии, офтальмологии, исследовании ретровирусов, наследственных и иммунодефицитных заболеваний.
Домашняя кошка (Felis cattus) является одним из немногих млекопитающих, кроме людей и мышей, у которых была получена обширная информация о геноме. Этот интерес к геному кошек обусловлен большим числом наследственных заболеваний, которые интересны в качестве экспериментальных моделей. Составлена генетическая карта кошки в сравнении с человеком, которая показывает чрезвычайно высокую гомологию генов этих видов.
В середине XX века ожидалось, что нокаутные трансгенные мыши будут отражать все модели, необходимые для изучения специфических мутаций генов. Однако как показала практика, у нокаутных мышей с дефектами тех или иных генов могут не отмечаться клинические признаки заболевания, выявляться заболевание в летальной форме или регистрироваться клинические признаки, которые не соответствуют таковым у человека. В то же время многие наследственные заболевания кошек практически идентичны аналогичным заболеваниям человека (табл. 1).
Модели инфекционных заболеваний кошек
Вирусная лейкемия кошек как модель вирусного онкогенеза
У домашних кошек самый высокий уровень встречаемости в природе лимфоидных злокачественных новообразований по сравнению с любыми другими млекопитающими (не грызунами). Вирус кошачьей лейкемии (FeLV) является онковирусом, который вызывает лимфосаркому, лейкоз и апластическую анемию у кошек и сходен с вирусами лейкемии у мышей (вирус мышиной лейкемии) и цыплят (вирус птичьего лейкоза). Это заболевание у кошек может рассматриваться как модель для характеристики гематопоэтических опухолей, таких как острый лимфобластный лейкоз и лимфома. При этом вирус также вызывает иммунодефицит и миелосупрессию. После инфицирования кошки постоянно выделяют вирус, особенно через слюну и носовые выделения.
Серологические тесты основаны на обнаружении основного вирусного белка ядра FeLV (p27 gag) в сыворотке или плазме с помощью иммуноферментного анализа (ИФА). Преимуществами этой модели является то, что вирус FeLV хорошо изучен и его штаммы коммерчески доступны, индукцию инфекции легко осуществить, хорошо изучены патогенез заболевания и реакция иммунной системы на инфицирование [40].
Вирусный иммунодефицит кошек как модель ВИЧ у человека
Иммунодефицитная болезнь кошек, вызванная вирусом лентивируса кошачьего иммунодефицита (FIV), считается многими одной из наиболее актуальных естественных моделей СПИДа [41]. Преимуществами моделирования заболевания у кошек являются сходство с ВИЧ (человеческий лентивирус), похожий онтогенез и клинические признаки, легкость экспериментального инфицирования и предсказуемое течение заболевания. Недостатки модели связаны с ограниченным разнообразием реагентов, доступных для идентификации клеток иммунной системы кошки. FIV был клонирован и напоминает действие ВИЧ на тканевом и клеточном уровне, но отличается по антигенам [42].
Экспериментальная передача достигается с помощью введения инфицированной крови или культивируемых клеток. Клеточная виремия возникает в течение 1–2 нед и остается стойкой даже после выработки антител. Характерные изменения в иммунной системе включают лимфаденопатию, нейтропению, снижение пролиферативного ответа лимфоцитов и повышенную восприимчивость к оппортунистическим инфекциям. В-клеточные лимфомы и миелопролиферативные заболевания наблюдаются у некоторых инфицированных кошек.
Инфекция Helicobacter felis как модель инфицирования человека Helicobacter
Из нескольких видов Helicobacter, которыми могут быть заражены животные, H. felis является одним из наиболее интересных, поскольку имеет широкий круг хозяев и способен вызывать многие, если не все, проявления, обнаруживаемые при инфицировании Helicobacter человека. Helicobacter felis – естественный патоген у кошек, встречается в некоторых колониях, но его распространенность или значение в качестве агента клинических заболеваний в общей популяции кошек неясны [43, 44]. В работе J. Fox и соавт. [45] показано, что инфекция H. felis может достоверно воспроизводить все поражения, обнаруженные у человека (кроме язв), особенно те, которые связаны с хронической инфекцией у мышей и кошек [46, 47]. В дополнение к инфекции H. felis кошки, по-видимому, также инфицированы H. pylori, что повышает вероятность того, что домашние кошки могут служить резервуаром для этого человеческого патогена [44, 48]. Инфицирование кошек данным патогеном также может рассматриваться как модель для развития лимфомы.
Модели неинфекционных заболеваний кошек
Кардиологические модели
В соответствии с требованиями Государственной фармакопеи Российской Федерации 14-го издания наличие примесей в лекарственных средствах (ЛС) для инъекций и внутриполостных введений определяют различными методами, одним из которых является испытание на депрессорные вещества. Испытание проводится на кошках как животных, наиболее чувствительных к таким вазоактивным веществам, как гистамин, вазопрессин и простагландины [49, 50].
При этом интересно, что в ответ на применение депрессорных веществ у животных отмечаются разные по направленности и величине сдвиги давления и кровотока в легочной артерии: в 67% случаев давление в легочной артерии снижается, а в 33% – возрастает [51–53].
Во многих работах [54–56] было показано, что депрессивные реакции на гистамин у анестезированных кошек и собак включают как гистаминовые H1-, так и H2-рецепторы. У обоих видов гистамин вызывает дозозависимое снижение артериального давления, вазодилатацию, тахикардию и увеличение сердечного выброса.
Кардиомиопатии
В литературе [57] подробно рассмотрены и систематизированы три основных типа спонтанной кардиомиопатии у кошек: гипертрофическая, застойная (дилатационная) и рестриктивная. В табл. 2 мы постарались систематизировать и сравнить представленные в этой работе данные.
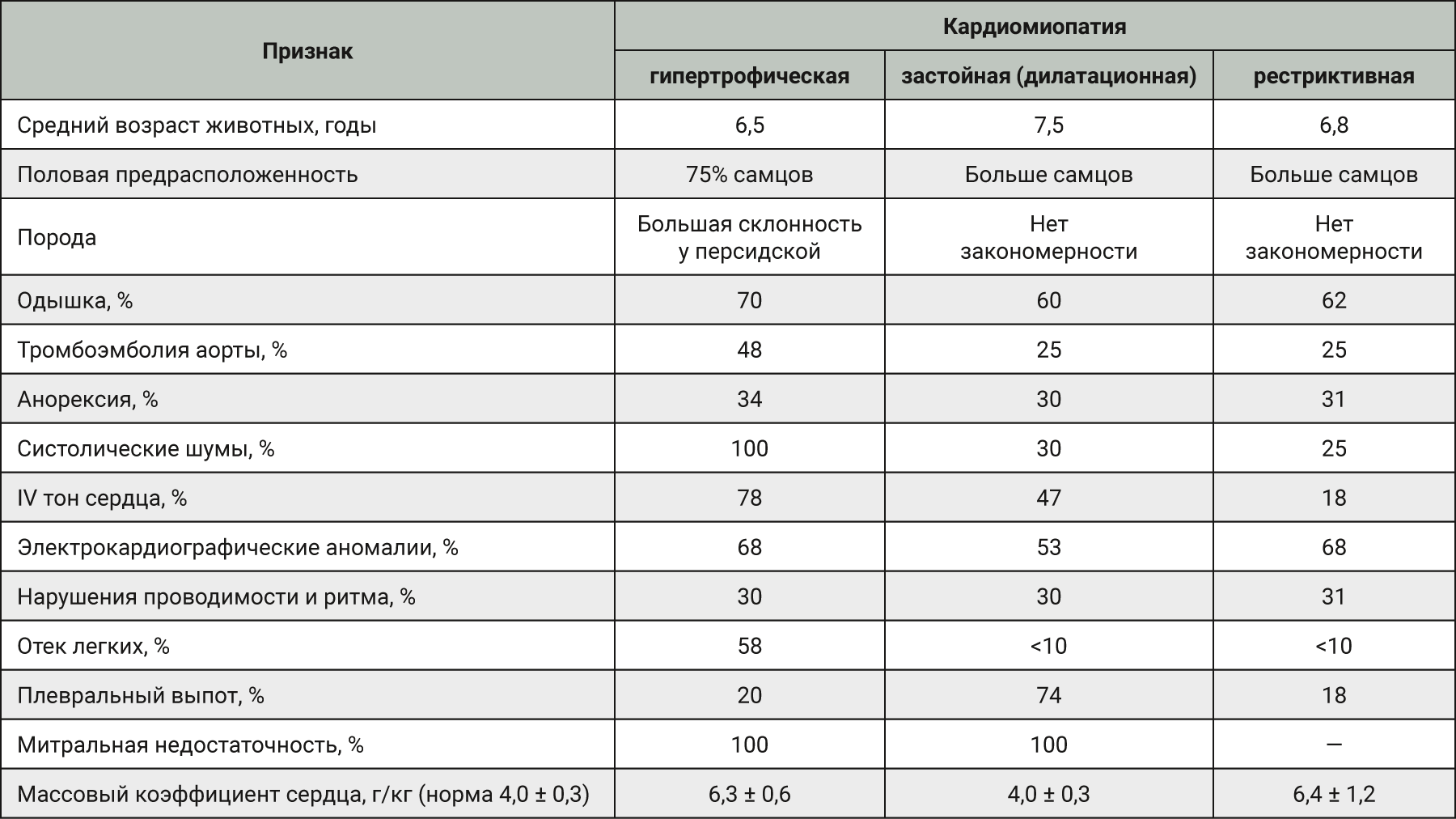
Гипертрофическая кардиомиопатия в настоящее время является наиболее распространенным спонтанным заболеванием сердца у кошек, поражающим 10–15% популяции [58], и очень похожа на это заболевание у человека [59, 60], в том числе по гистопатологическим изменениям [60]. Как и у людей, гипертрофическая кардиомиопатия у кошек характеризуется гипертрофией левого желудочка, нарушением диастолического наполнения, вторичным увеличением левого предсердия, развитием гипертрофии правого сердца. Аритмии возникают редко, если только не присутствует серьезное увеличение левого предсердия. У кошек с гипертрофической кардиомиопатией застойная сердечная недостаточность и артериальная тромбоэмболия являются частыми клиническими проявлениями [61, 62].
Отличие состоит в том, что гипертрофическая кардиомиопатия у кошек – более тяжелое и быстропрогрессирующее заболевание, чем у людей, что является преимуществом при изучении результатов наблюдения и лечения [62].
Породы мейн-кун и рэгдолл имеют генетическую мутацию миозин-связывающего протеина C. Кошки, гомозиготные по этой мутации, склонны к гипертрофической кардиомиопатии намного чаще, чем гетерозиготные кошки [63]. Особей этих пород можно использовать в качестве соответствующих моделей для изучения развития и патофизиологии гипертрофической кардиомиопатии [62, 64]. Также довольно часто это заболевание встречается у персидских кошек [62, 65]. Интересно, что, хотя сердечные заболевания распространены у собак и кошек, атеросклероз у них практически отсутствует, это связано, скорее всего, с тем, что эти виды имеют высокую концентрацию липопротеинов высокой плотности [62].
L.M. Freeman и соавт. [62] предполагают, что кошки с гипертрофической кардиомиопатией могут служить хорошей моделью для изучения новых лекарств при прогрессировании или развитии осложнений этого заболевания. Важно, чтобы в таких исследованиях принимали участие ветеринарные кардиологи. Взаимодействие может быть полезным как с клинической, так и с исследовательской точки зрения. Междисциплинарный подход дает важные преимущества для оптимального дизайна исследования, несмотря на то, что заболевание у кошки и человека имеет много общего, существуют важные метаболические, пищевые и анатомические различия между видами, которые важно понимать.
Кошка как модель ожирения и сахарного диабета у человека
Ожирение является фактором риска развития сахарного диабета не только у людей, но и у кошек [66, 67]. Ожирение хорошо выражено у людей. У кошек ожирение можно оценить субъективно с помощью системы оценки, разработанной D. Laflamme [68]. Существуют также объективные способы оценки ожирения у кошек, но обычно они не применяются в клинической практике. Индекс массы тела (ИМТ) хорошо известен из медицины, где он повсеместно используется для оценки степени ожирения. У кошек его можно рассчитать по следующей формуле [69]:
\[ИМТ = \frac{масса\: тела\: (кг)}{длина\: тела\: (м) \cdot рост\: (м)}, \]
где рост – расстояние от точки плеча через точку локтя до проксимальной границы пястной подушечки, а длина – расстояние от точки плеча до седалищной кости бугра.
Процентное содержание жира в организме кошек рассчитывается по следующей формуле:
\[ процентное\:содержание\:жира\:в\:организме = \left ( \frac{грудная\:клетка}{0,7062} - \frac{LIM}{0,9156} \right ) - LIM, \]
где грудная клетка – это окружность грудной клетки (см), а LIM – длина голени от середины надколенника до дорсального конца пяточного отростка (см) [70].
Когда кошки страдают ожирением, масса как абдоминального подкожного, так и висцерального жира увеличивается в одинаковой степени [71, 72] в отличие от людей, у которых ожирение обычно связано с большим увеличением абдоминального висцерального жира, чем подкожного [73]. На сегодняшний день нет опубликованных данных по ветеринарным стандартам конституции кошек. Однако результаты объективных измерений ожирения были описаны у худых и полных кошек, которые использовались в исследовательских проектах [71, 72], в основном это были домашние короткошерстные кошки.
Кошки с ожирением имеют повышенное количество внутримиоцеллюлярного и внемиоцеллюлярного жира [72], что у людей обычно связано с потерей чувствительности к инсулину [74]. Повышенное количество жира в мышцах связано с изменением экспрессии и активности липопротеинлипазы. Этот фермент приобретает более высокую активность в мышечной ткани, что приводит к распределению жирных кислот в мышцах [72]. Также было показано, что экспрессия фактора некроза опухоли-α (ФНО-α) выше в жировой ткани у тучных кошек [72], и сделано предположение – этот цитокин подавляет липопротеинлипазу [75, 76].
Потеря чувствительности к инсулину в мышечной ткани не всегда сопровождается потерей чувствительности к инсулину в жировой ткани. Во время гиперинсулинемического теста (клэмп-теста) уровень неэстерифицированных жирных кислот (НЭЖК) снижался в значительно большей степени у кошек на высокоуглеводной диете, но не у кошек на высокобелковой, что указывает на то, что чувствительность к инсулину регулируется тканеспецифическим образом и может зависеть от диеты [77]. Однако более высокая чувствительность жировой ткани к инсулину в этом исследовании не привела к большему отложению жира, вероятно, потому что высокие концентрации инсулина, достигнутые во время клэмп-теста, превышают физиологический ответ инсулина после регулярного приема пищи. Также, возможно, диета влияет на метаболизм НЭЖК независимо от действия инсулина. Подобное подавление образования НЭЖК также наблюдалось во время внутривенного теста на толерантность к глюкозе [78].
M. Hoenig (2012) [71] изучала метаболические пути, участвующие в метаболизме глюкозы, у худых и полных кастрированных котов мужского и женского пола. Она предположила, что инсулинорезистентность кошек с ожирением будет отражаться на активности различных метаболических путей, ведущих к производству глюкозы в печени. Однако было обнаружено, что кошки с ожирением хорошо компенсируют периферическую резистентность к инсулину, поддерживая чувствительность к инсулину в печени, что позволяет им снижать эндогенную продукцию глюкозы и поддерживать нормальную концентрацию глюкозы в крови не только натощак, но и после еды [79, 80].
За исключением одного исследования [81], всегда считалось, что в организме кошки не образуется много гликогена [82, 83], однако D.L. Rothman и соавт. [84] показали, что содержание гликогена в печени у кошек, голодавших 24 ч, аналогично содержанию такового у людей после аналогичного голодания. Таким образом, как глюконеогенный, так и гликогенолитический вклад в производство глюкозы в печени кошек (худых и страдающих ожирением) аналогичен тому, который был зарегистрирован у людей. Гликоген у кошек, голодавших в течение 24 ч, обнаруживается в большом количестве в печени как при гистологических, так и биохимических исследованиях [80].
Обнаружено, что длительное ожирение у старых кошек приводит к увеличению панкреатических островков, часто с выраженным отложением амилоида [85–88]. При этом концентрация глюкозы натощак у этих кошек остается нормальной и изменений в содержании инсулина в β-клетках у этих кошек не наблюдается. Следовательно, со временем длительная гиперсекреция инсулина, возникающая в результате инсулинорезистентности, приводит к отложению амилоида и потере β-клеток, вероятно, из-за апоптоза. Неизвестно, какое количество амилоида должно присутствовать, прежде чем секреция инсулина станет низкой и неустойчивой. Однако не у всех кошек с диабетом регистрируется амилоидоз поджелудочной железы. R.W. Nelson и соавт. [87] показали, что 3 из 5 кошек с преходящим диабетом имели выраженный островковый амилоидоз, тогда как у 2 из 5 контрольных кошек того же возраста подобная патология встречалась в гораздо меньшей степени.
Еще одним механизмом развития ожирения у кошек может быть снижение экспрессии инсулинозависимого транспортера глюкозы, транспортера глюкозы-4, в мышцах и подкожном жире, однако уровень инсулиннезависимого транспортера глюкозы, транспортера глюкозы-1, выраженно не изменяется [89].
Глюкозотолерантный тест наиболее часто используется у кошек, прежде всего, для оценки утилизации глюкозы, а иногда и чувствительности к инсулину [88–92]. Это динамический тест, при котором глюкоза вводится внутривенно в виде болюса, а образцы крови берутся с различными интервалами, обычно в течение 120 мин или дольше. В зависимости от введенной дозы глюкозы концентрация глюкозы и инсулина у худых кошек должна возвращаться к исходному уровню через 60–90–120 мин, тогда как у кошек с ожирением эти концентрации остаются выше на протяжении всего теста [88, 91]. Поскольку это динамический тест, он лучше подходит для изучения секреторной способности β-клеток, особенно в более ранние временные точки, чем для измерения чувствительности к инсулину.
Метаболический сидром у кошек
Метаболический синдром – это название группы факторов риска атеросклероза, ишемической болезни сердца, инсульта и сахарного диабета. Повышенная масса тела и инсулинорезистентность, вероятно, являются наиболее важными факторами риска у людей [93]. Они связаны с изменениями нескольких гормонов и липопротеинов, включая повышенные концентрации холестерина, триглицеридов и аполипопротеина B, а также более высокие уровни липопротеинов очень низкой плотности (ЛПОНП), липопротеинов низкой плотности (ЛПНП) и более низкие концентрации липопротеинов высокой плотности (ЛПВП) [93]. Показано, что количество липопротеиновых частиц и их размер определяют риск заболевания [94–96]. У людей соотношение ЛПОНП/ЛПНП и ЛПВП связано с инсулинорезистентностью. У кошек повышенная масса тела и инсулинорезистентность также сопровождаются нарушениями в соотношении липопротеинов (ЛП), аналогичными тем, которые наблюдаются у людей. У кошек с ожирением отмечается увеличение уровня НЭЖК, ЛПОНП и триглицеридов в плазме. Фактически увеличение концентрации триглицеридов во фракции ЛПОНП наблюдалось в среднем 5 раз чаще у кошек с ожирением, чем у худых контрольных животных [97, 98].
Нарушение метаболизма, отмечаемое у кошек с ожирением, может частично быть вызвано изменениями концентрации гормонов, участвующих в регуляции метаболизма, чаще всего адипонектина [77] и лептина [99]. У тучных кошек уровень адипонектина обратно пропорционален степени ожирения, а потеря массы приводит к увеличению адипонектина [77] до уровней, которые не отличаются от тех, которые наблюдаются у худых кошек.
Лептин связывается со специфическими рецепторами в гипоталамусе, где он изменяет экспрессию нескольких нейропептидов, участвующих в регуляции нейроэндокринной функции, что отражается на потреблении энергии и ее расходовании [100]. Кошки с ожирением устойчивы к изменению уровня лептина, на что указывает тот факт, что концентрация лептина в несколько раз выше у тучных кошек по сравнению с худыми [99]. С потерей массы уровень лептина у тучных кошек нормализуется, поэтому лептин является хорошим индикатором ожирения [99, 101]. Также показано, что уровень лептина и инсулина выше у старых худых кошек по сравнению с молодыми худыми кошками, несмотря на схожую жировую массу тела, что позволяет предположить развитие резистентности к инсулину и лептину с возрастом.
Таким образом, кошки с ожирением имеют много общего с людьми, страдающими ожирением. Основное отличие заключается в том, что у кошек не развиваются атеросклероз и клиническая гипертензия.
Модель обратимого воспаления у кошки для изучения фармакокинетики и фармакодинамики нестероидных противовоспалительных препаратов
Исследование фармакокинетики (ФК)/фармакодинамики (ФД) in vivo все чаще воспринимается как удобный подход к выбору эффективных и безопасных режимов дозирования для клинического использования [102].
В настоящее время применение ФК/ФД для определения доклинического профиля нестероидных противововспалительных препаратов (НПВП) ограничено доступностью проверенных моделей на животных и неспособностью существующих моделей обеспечить клинически значимые конечные точки ответа на лекарственный препарат. Большинство моделей воспаления, разработанных на грызунах и собаках (например, отек лапы, вызванный каррагенином, артрит, вызванный мочевой кислотой), слишком непродолжительны и могут не позволить точно определить полную взаимосвязь дозы препарата с эффектом [102, 103].
Еще одним недостатком моделей на грызунах является то, что они не позволяют легко измерить клинически значимые конечные точки (например, оценку хромоты). С другой стороны, некоторые индукторы, такие как полный адъювант Фрейнда [104–106], позволяют измерить соответствующие конечные точки. Однако по этическим причинам использование таких моделей необратимого воспаления может быть поставлено под сомнение. Следовательно, приемлемая модель воспаления не может быть необратимой, но должна быть достаточно продолжительной, позволяющей точно оценить три основных ответа на НПВП, а именно их противовоспалительное, жаропонижающее и обезболивающее действие. Такую модель следует разработать для животных среднего размера (например, собаки, кошки), чтобы обеспечить как сбор клинически значимых конечных точек, так и последовательный забор крови у одного и того же животного на разных временных точках [102].
J.M. Giraudel и соавт. [107] разработали модель воспаления с использованием подкожного введения каолина кошке. Они показали, что подкожная инъекция каолина в лапу кошки вызывает четко выраженный, воспроизводимый и обратимый воспалительный ответ. Признаки воспаления, вызванного 500 мг каолина, были относительно постоянными на 2–4-й день после инъекции каолина, что позволяло вводить НПВП на 2-й день. Эта модель также включала количественное измерение объективных конечных точек, относящихся к терапевтической эффективности, и возможность последовательного забора крови. Для модели подтверждены воспроизводимость и точность измерения по показателям: температура тела, оценка походки, время выполнения тестов на передвижение, объем лапы [107]. Таким образом, модель оказалась подходящей для одновременного изучения анальгетического, противовоспалительного и жаропонижающего действия НПВП. Для этой модели установлено, что обезболивание в большей степени зависит от дозы лекарственного препарата, а противовоспалительный эффект более тесно коррелирует с продолжительностью терапии [108]. В качестве эталонного препарата сравнения при разработке этой модели был использован мелоксикам, поскольку он широко используется как терапевтический агент не только у животных, но и у людей и его режим дозирования в настоящее время хорошо известен и у человека, и у кошек [109–113].
Модели опухолей
В связи с тем, что в естественных условиях рак встречается у кошек, сравнительные и трансляционные исследования этого заболевания могут быть выгодными как для человека, так и для ветеринарной онкологии [114–116].
Клинические испытания и сбор опухолевых тканей для исследования (например, в банках тканей) можно использовать для изучения метастазов при спонтанном раке у собак и кошек без отрицательного влияния на клинические стандарты ветеринарной терапии [117, 118].
Спонтанные метастазы в костные ткани
Обычно при исследовании метастазов в костные ткани используют мышей, крыс, собак и реже – кошек. Выбор вида часто зависит от типа рака, который исследуется, наличия животных и желаемых конечных точек [119].
В частности, у кошек есть уникальная форма спонтанных метастазов в костную ткань, при которой аденокарциномы легких могут метастазировать в кости пальцев [120].
Спонтанный кошачий плоскоклеточный рак головы и шеи (HNSCC, Head and neck squamous cell carcinoma)
Спонтанный HNSCC у домашних животных, особенно кошек, может служить хорошей моделью. HNSCC особенно часто встречается у пожилых кошек по сравнению с другими видами животных [119]. Существует высокая степень биологического сходства между HNSCC кошек и человека, не индуцированных вирусом папилломы [121, 122].
Хозяева кошки обычно обращаются за ветеринарной помощью по поводу HNSCC на поздних стадиях заболевания. Прогноз для большинства кошек неблагоприятный, а время до смерти или эвтаназии короткое (2–6 мес) [123]. Клинические испытания на кошках могут быть полезны для трансляционных исследований рака и разработки новой терапии [122, 124].
Как и у людей, плоскоклеточный рак является наиболее распространенным раком полости рта у кошек: 10% всех опухолей, диагностируемых у кошек, – опухоли полости рта, а 75% рака полости рта у кошек – плоскоклеточный рак [123, 125, 126]. Язык, особенно вентральный язык и десна, считаются наиболее часто поражаемыми участками у кошек [125]. Примечательно, что кошки и люди единственные 2 вида, у которых обычно развивается спонтанный рак языка [127–129]. Как и у людей, HNSCC часто встречается у возрастных кошек без явного различия по породе или полу [126].
Поскольку кошки чаще живут в той же среде, что и их хозяева, то они подвергаются тем же факторам риска, что и люди [121, 122, 129–131]. Воздействие табачного дыма в окружающей среде, использование ошейников от блох, консервы и папилломавирусная инфекция могут быть вовлечены в развитие плоскоклеточного рака у кошек [131–134]. Инвазия в соседние кости, метастазирование в лимфатические узлы и спонтанный рецидив являются частыми осложнениями этого рака [126, 134]. На момент постановки диагноза заболевание часто находится на поздних стадиях с обширной инвазией в кости. Как и у людей с плоскоклеточным раком, у кошек наблюдается высокая экспрессия PTHrP (белка, связанного с паратиреоидным гормоном), которая часто связана с повышенной инвазией в кости и остеокластогенезом in vivo и in vitro [125, 135].
Таким образом, спонтанный HNSCC у кошек является ценной моделью для трансляционных исследований новых лекарственных средств и методов лечения с использованием клинических исследований на кошках в условиях ветеринарных клиник.
Лимфома
Лимфома – наиболее распространенное новообразованием у кошек [136–142]. Лимфомы кошек обычно классифицируются в соответствии с анатомическим расположением, при этом распознаются различные типы, включая средостенные, многоцентровые и экстраузловые. Самым распространенным типом является алиментарная лимфома (AL), поражающая желудочно-кишечный тракт с различным вовлечением внекишечных участков, включая лимфатические узлы, печень, селезенку [138–143]. Это не только самая распространенная анатомическая форма лимфомы (от 50 до 75%), но и наиболее часто встречаемая алиментарная неоплазия у кошек [136–140, 144]. Этиопатогенез AL с низкой степенью злокачественности у кошек изучен недостаточно. Несколько факторов указываются в качестве возможных причин, но их участие остается неубедительным, особенно учитывая взаимосвязь с гистологической степенью AL и фенотипом [145].
Кошачьи ретровирусы
Инфекционная этиология была предложена, потому что риск развития AL выше у кошек, инфицированных кошачьими ретровирусами (вирусом лейкемии кошек (FeLV) или вирусом иммунодефицита кошек (FIV)). Однако эта гипотеза была оспорена из-за того факта, что большинство лимфоцитарных раковых заболеваний у всех видов не связано с ретровирусами [146].
FeLV поражает лимфоидную ткань, кишечник и костный мозг [138] и предполагается, что он является основным фактором риска развития лейкемии и лимфомы у кошек, особенно Т-клеточной лимфомы с локализацией в средостении [147–149]. Иммуногистохимические исследования показали, что от 50 до 70% всех лимфом кошек являются положительными на FeLV [138, 142, 150, 151] и его наличие связано с плохим прогнозом для всех подтипов лимфом [137, 152]. Точные механизмы, с помощью которых FeLV вызывает неопластическую трансформацию, неизвестны, но могут быть связаны со вставкой вирусного генома, что приводит к модуляции экспрессии соседнего онкогенного гена или гена-супрессора опухоли [147, 153].
Как вирус иммунодефицита у человека и обезьян FIV может вызывать иммунный дисбаланс, что приводит к частичной потере противоопухолевого иммунитета и в конечном итоге способствует развитию опухоли [138, 154, 155]. Исследования показали, что инфекция FIV может увеличить риск развития различных типов лимфомы, включая AL [142, 145, 152, 156]. Кроме того, компоненты генома FIV обнаружены в тканях 7 из 8 AL, которые развились у FIV-положительных кошек [157], 4 и 3 из которых были В- и Т-лимфомами соответственно. Затронуты различные части желудочно-кишечного тракта, у 3 кошек выявлено поражение мезентериальных лимфатических узлов. Однако к сожалению, гистологическая оценка не была проведена.
Бактериальные инфекции
Инфекция Helicobacter pylori тесно связана с развитием аденокарциномы и лимфомы слизистой оболочки у людей [158, 159].
Штаммы Helicobacter heilmannii способствовали возникновению лимфомы желудка у кошек в исследовании с участием 47 кошек, где соответственно 14 из 16 и 2 из 16 лимфобластных и лимфоцитарных лимфом были положительными на Helicobacter heilmannii [160]. Среди 33 Т-клеточных эпителиотропных лимфом тонкого кишечника инвазивные бактерии слизистой оболочки и серозная колонизация были выявлены в 18 и 11% случаев соответственно. Однако остается неясным, могут ли инвазивные бактерии запускать развитие AL или они колонизируют поврежденную слизистую оболочку после возникновения AL [161].
Хроническое воспаление
Хроническое воспаление может увеличить риск развития AL, учитывая, что одновременное воспалительное заболевание кишечника было описано в 60% случаев AL [162–166]. Также высказано предположение, что определенные формы целиакии у человека могут на самом деле представлять собой интраэпителиальную Т-клеточную злокачественную лимфому [167, 168], как и при лимфоплазмоцитарном энтерите у кошек [169].
Однако на сегодняшний день нет опубликованных ветеринарных данных, демонстрирующих развитие AL после хронического воспаления кишечника. В одном недавнем исследовании экспрессия гена MDR1 (Multiple Drug Resistance) и циклооксигеназы 2 оценивалась у кошек с хроническими энтеропатиями, было обнаружено, что у кошек с AL она выше, чем у кошек с воспалительными заболеваниями кишечника [170]. Однако у людей с воспалительными заболеваниями кишечника, наоборот, наблюдается сниженная экспрессия MDR1 в толстой кишке, а избыточная экспрессия COX2 может быть связана с пролиферацией клеток и ангиогенезом [171, 172].
Заболевания глаз
Амавроз Лебера
В настоящее время установлены мутации в 240 различных генах, которые вызывают наследственные дегенерации сетчатки.
Мутации в одном из этих генов – гене гомеобокса колбочек (CRX) – вызывают спектр ретинопатий, которые различаются по степени тяжести и возрасту начала. Эти CRX-связанные ретинопатии в основном наследуются доминантно. Среди них наиболее тяжелым, приводящим к потере зрения, начиная с детства, является врожденный амавроз Лебера. Менее тяжелые формы имеют более позднее начало и могут вызывать различные фенотипы, включая конусно-стержневую дистрофию, пигментный ретинит и макулярную дистрофию у взрослых [173–175].
При исследовании этой группы заболеваний с использованием генно-модифицированных мышей (Crx-E168d2) показано, что сетчатка мыши отличается от сетчатки человека распределением фоторецепторов, в частности мозаикой колбочек [176–180] У людей есть макула, центральная область сетчатки с более высокой плотностью фоторецепторов, особенно колбочек, включая центральную ямку, состоящую только из колбочек. Эта область макулы отвечает за цветовое зрение. Отсутствие эквивалентной области сетчатки у мышей особенно проблематично при заболевании, в первую очередь поражающем колбочки на ранних стадиях. Также неясно, совпадает ли патогенез, изученный на этой единственной модели на животных, с таковым у других видов млекопитающих, включая человека.
Чтобы преодолеть эти ограничения, L.M. Occelli и соавт. [175] провели углубленное исследование с использованием кошки с палочко-конусной дисплазией (Rdy), у которой диагностирована доминантно наследственная тяжелая дистрофия сетчатки [181–186].
Как оказалось, кошки Rdy, дефектные по гену CRX, являются полезной моделью для изучения амавроза Лебера, поскольку имеют площадь центральной области сетчатки с высокой плотностью фоторецепторов, что обеспечивает ее сходство с человеческой сетчаткой [187–189].
Хотя фенотип гетерозиготной кошки Rdy (Crx Rdy/+) был частично охарактеризован [181–184], динамика прогрессирования заболевания и лежащие в основе молекулярные изменения были исследованы лишь недавно. В исследовании L.M. Occelli и соавт. [175] показано, что у кошки Rdy (Crx Rdy/+) определяется неполное созревание фоторецепторов с более серьезным поражением колбочек, чем палочек, с последующей прогрессирующей дегенерацией фоторецепторов (рис. 1).
Таким образом, кошка Crx Rdy/+ становится отличной моделью для исследования амавроза Лебера, что может иметь неоценимое значение для доклинических испытаний.

Альбинизм
Очень интересны кошки с генетическими мутациями – тирозиназа-отрицательные альбиносы. До недавнего времени считалось, что полная форма альбинизма отсутствует у кошек. Модель альбиносов, которая была наиболее изучена, это сиамская кошка. На ее основе в университете Солт-Лейк-Сити в результате инбридинга были получены кошки-альбиносы. У кошек из этой колонии розовые глаза; их пигментный эпителий сетчатки, цилиарное тело и эпителий радужки полностью лишены пигмента меланина. Разведение в течение пяти поколений показали, что эти кошки настоящие альбиносы. Самой поразительной особенностью зрительных путей кошек-альбиносов является снижение ипсилатерального воздействия, которое было более серьезным, чем у сиамских кошек. При изучении проекции сетчатки у 2 кошек-альбиносов, отрицательных по тирозиназе, показано, что по сравнению с нормальной кошкой, а также с тирозин-положительной сиамской кошкой, тирозиназа-отрицательный альбинос имеет меньшие ипсилатеральные проекции сетчатки и такая кошка представляет собой модельную систему, аналогичную тирозиназа-отрицательному альбинизму, обнаруженному у человека [190].
Модели патологии дыхательной системы
Изменения в вентиляции легких обычно находятся под контролем корректировки дыхательного объема и частоты дыхания как у животных, так и у человека. У кошек и кроликов механизм увеличения частоты дыхания в ответ на вагусные воздействия в большей степени находится в зависимости от объема дыхания, поскольку частота дыхания обычно остается постоянной даже при ваготомии. То же самое верно и для человека, судя по экспериментам при блокировании блуждающих нервов. В работе F.J. Clark. и C. von Euler [191] показано, что у кошек и человека продолжительность фазы выдоха зависит от продолжительности предыдущего вдоха, но время при каждом вдохе не зависит от предыдущих вдохов. Различия, наблюдаемые у кошки и человека, оказались только количественными. Также у домашних кошек развивается спонтанное обструктивное расстройство дыхательных путей с клиническими и патологическими признаками, аналогичными астме человека [192].
Бронхиальная астма – распространенный диагноз среди домашних кошек в США, он затрагивает примерно 1–5%, средний возраст постановки диагноза составляет 4–5 лет. Первичные симптомы включают кашель, хрипы и респираторный дистресс-синдром. Патология легких у астматических кошек сопровождается индукцией выброса цитокинов Th2, появлением эозинофилов (особенность, которая отличает это состояние от хронического бронхита) и ремоделированием дыхательных путей в первую очередь в ответ на аэроаллергены. Экспериментальные исследования с использованием аэроаллергенов на кошках продемонстрировали развитие гиперреактивности дыхательных путей и появление эозинофилов у кошек в ответ на клеща домашней пыли и бермудскую траву, что демонстрирует схожесть аллергической реакции у кошек и людей. Кошки-астматики хорошо реагируют на стероиды с бронходилататорами или без них, но, как и у людей, это лечение является для них симптоматическим. Среди экспериментальных методов лечения, которые в настоящее время исследуются для лечения кошачьей астмы, аллергенспецифическая иммунотерапия и ингибиторы тирозинкиназы.
На основании многофакторного анализа брахицефализма у кошек и связанных с ним расстройств показано, что снижение респираторной функции тесно связано с брахицефализмом, а также с обструкцией носослезной системы и малоподвижным образом жизни. Такие изменения носят название синдрома брахицефальной обструкции дыхательных путей и представляют собой хроническое респираторное заболевание, возникающее в результате искусственного отбора по измененной форме черепа, в первую очередь характеризующегося укороченной мордой [193].
Модели на изолированных органах кошки
K.M. Lulich и соавт. [194] разработали очень удобная модель ex vivo на изолированной полоске легких кошки для исследования прямого действия лекарственных препаратов на гладкую мускулатуру периферических дыхательных путей легкого. Препарат представляет собой тонкую полоску паренхимы легких, которую можно поместить в обычную ванну для органов для регистрации изометрического натяжения. На этой модели было продемонстрировано, что тонус мышц снижался под влиянием катехоламинов, аминофиллина и флуфенамата. Под влиянием гистамина, простагландина F2α, ацетилхолина, вещества 48/80, деполяризующего раствора калия и переменного тока происходило сокращение гладких мышц. Селективные агонисты 4-β2-адренорецепторов сальбутамол и тербуталин вызывали выраженное расслабление этих мышц.
Схожие исследования влияния гистамина, 2-метилгистамина, серотонина и брадикинина на изолированной легочной вене, артерии и печеночной вене кошки разрабатывали N. Chand и P. Eyre [195]. Они же показали анафилактическое сокращение ex vivo (реакция Шульца–Дейла) на изолированных легочных и печеночных венах, бронхах и трахее у сенсибилизированной плазмой лошади кошки.
Широко изучаются механизмы локомоторной активности опорно-двигательного аппарата кошки и ее биомеханики [196–200] Так, в работе A. Ianuzzi и соавт. [199] проведена валидация модели высокоскоростной манипуляции с позвоночником с низкой амплитудой (HVLA-SM) у кошки. В работе были использованы образцы «костно-связочного» позвоночника без повреждения капсульной связки, взятые из поясничного отдела позвоночника кошек лабораторного разведения. Установлены регрессионные отношения для связи биомеханики пояснично-фасеточного сустава кошки и человека во время моделирования HVLA-SM. Полученные данные позволяют оценить значимость локальных манипуляций при лечении пациентов с болью в пояснице с учетом очевидной биомеханической безопасности процедуры.
Список источников
- Griffin B., Baker H.J. Domestic cat as laboratory animals. In: Fox JG, Anderson L.C., Loew F.M., Quimby F.W., eds. Laboratory Animal Medicine. Second ed. San Diego. Academic Press (Elsevier Science). 2002.
- Gruys, E., Van de Stadt, M., Blok, J.J., Tooten, P.C.J., Van der Linde-Sipman, J.S., Niewold, T.A. Feline amyloidosis. “Proceedings of the First International Feline Genetic Disease Conference,” Univ. of Pennsylvania. 1998.
- Boyce, J.T., DiBartola, S.P., Chen, D.J. and Gasper, P.W. Familial renal amyloidosis in Abyssinian cats // Vet. Pathol. – 1984. – Vol. 21(1). – P. 33-38. doi: 10.1177/030098588402100106
- Kramer, J.W., Davis, W.C., Prieur, D.J. The Chediak-Higashi syndrome of cats // Lab. Invest. – 1977. – Vol. 36. – P.554-562.
- Jones B.R., Hayden M.R., Lewis S., Ginzinger D.G. Chylomicronemia and inherited lipoprotein lipase deficiency in domestic cats. In “Proceedings of the First International Feline Genetic Disease Conference,” Univ. of Pennsylvania. 1998.
- Patterson, D.E, Minor, R.R. Hereditary fragility and hyperextensibility of the skin of cats: a defect in collagen fibrillogenesis // Lab. Invest. – Vol. 37. – P.170-179.
- Paasch, L.H., Zook, B.C. The pathogenesis of endocardial fibroelastosis in Burmese cats // Lab. Invest. – 1980. – Vol. 42. – P.197-204.
- Prusiner, S.B. Prion diseases. In “The Metabolic and Molecular Bases of Inherited Diseases” (C. R. Scriver, A. L. Beaudet, W. S. Sly, and D. Valle, eds.). McGraw-Hill, New York. 1995.
- Johnson, K.H. Globoid cell leukodystrophy in the cat // J. Am. Vet. Med. Assoc. – 1970. – Vol. 157. – 2057.
- Sandstrom B., Westman J., Ockerman E.A. Glycogenosis of the central nervous system in the cat // Acta Neuropathol. (Berlin). – 1969. – Vol. 14. – P. 194. Doi: 10.1007/BF00685299.
- Fyfe J.C., Kurzhals R.L. Glycogen storage disease type IV in Norwegian forest cats: molecular detection of carriers. In “Proceedings of the First International Feline Genetic Disease Conference,” Univ. of Pennsylvania. 1998.
- Baker H.J., Lindsey J.R., McKhann G.M., Farrell D.E (1971). Neuronal GM1 gangliosidosis in a Siamese cat with 3-galactosidase deficiency // Science. – 1971. – Vol. 174. – P. 838-839. doi: 10.1126/science.174.4011.838.
- Baker H.J., Smith B.E, Foureman P., Varadarajan, G.S., Varadarajan, U., Martin, D. R., and Castagnaro, M. The molecular bases of feline GM~ and GM2 gangliosidoses. In “Proceedings of the First International Feline Genetic Disease Conference,” Univ. of Pennsylvania. 1998.
- Muldoon L.L., Pagel M.A., Neuwelt E.A., Weiss D.L. Characterization of the molecular defect in a feline model for type II GM 2 gangliosidosis // Am. J. Pathol. – 1994. – Vol. 144. – P. 1109-1118.
- Martin D.R., Varadarajan G.S., Varadarajan U., Smith, B.E, Baker, H.J. A unique mutation of the beta subunit of hexosaminidase causes feline GM 2 gangliosidosis variant 0. Proceedings of the Tenth North American Collaquium on Gene Mapping and Cytogenetics of Domestic Species, Apalachicola, Florida. 1999.
- Valle, D. L., Boison, A. P., Jezyk, P., and Aguirre, G. (1981). Gyrate atrophy of the choroid and retina in a cat // Invest. Ophthalmol. Vis. Sci. – 1981. – Vol. 20. – P. 251-255.
- Kier A.B., Bresnahan J.E, White E.J., Wagner J.E. The inheritance pattern of factor XII (Hageman deficiency) in domestic cats // Can. J. Comp. Med. – 1980. – Vol. 44. – P. 309-314.
- Cotter S.M., Brenner R.M., Dodds W.J. Hemophilia A in three unrelated cats // J. Am. Vet. Med. Assoc. – 1978. – Vol. 172. – P. 166-168.
- Maggo-Price, L., and Dodds, W. J. Factor IX deficiency (hemophilia B) in a family of British shorthair cats // J. Am. Vet. Med. Assoc. – 1993. – Vol. 203. – P. 1702-1704.
- Haskins M.E., Jezyk P.E, Desnick R.J., McDonough S.K., Patterson D.F. a-L-Iduronidase deficiency in a cat: a model of mucopolysaccharidosis I. // Pediatr. Res. – 1979. – Vol. 13. – P. 1294-1297.
- Kittleson M.D., Meur, K.M., Kittleson A., Munro M., Si-Kwang L., Towbin J.A. Heritable characteristics, phenotypic expression, and natural history of hypertrophic cardiomyopathy in Maine coon cats. In “Proceedings of the First International Feline Genetic Disease Conference,”Univ. of Pennsylvania. 1998.
- Jones T.C. Sex chromosome anomaly, Klinefelter’s syndrome in tortoiseshell male cats // Comp. Pathol. Bull. – 1969. – Vol. 5.
- Berg T., Tollersrud O.K., Walkley S.U., Siegel D., Nilssen O. Purification of feline lysosomal tx-mannosidase, determination of its cDNA sequence, and identification of a mutation causing a-mannosidosis in Persian cats // Biochem. J. – 1997. – Vol. 328. – P. 863-870.
- Jezyk P.E, Haskins M.E., Patterson D.E, Mellman W.J., Greenstein M. Mucopolysaccharidosis in a cat with arylsulfatase-B deficiency: a model of Maroteaux-Lamy syndrome // Science. – 1977. – Vol. 198. – P 834-936.
- Hopwood J.J., Crawley A.C., Byers S., Yogalingam G., Bielicki J. Feline MPS VI as a model to study pathology and evaluate efficacy of therapy for Maroteaux-Lamy syndrome patients. In “Proceedings of the First International Feline Genetic Disease Conference,” Univ. of Pennsylvania. 1998.
- DiNatale P., AnneUa T., Daniele A., Spaqnuolo G., Cerundolo R., De-Capraiis D., Gravino A.E. A new case of feline MPS VI // J. Inherit. Metab. Dis. – 1992. – Vol. 15. – P. 17.
- Giger U., Wang P., Boyden M. Familial methemoglobin reductase deficiency in domestic shorthair cats. In “Proceedings of the First International Feline Genetic Disease Conference,” Univ. of Pennsylvania. 1998b.
- Haskins M.E. Lysosomal storage diseases in cats: an overview. In “Proceedings of the First International Feline Genetic Disease Conference,” Univ. of Pennsylvania. 1998.
- Gaschen EP. Dystrophin deficient hypertrophic feline muscular dystrophy in the cat. In “Proceedings of the First International Feline Genetic Disease Conference” Univ. of Pennsylvania. 1998.
- Woodard J.C., Collins G.H., Hessler, J.R. (1974). Feline hereditary neuroaxonal dystrophy // Am. J. Pathol. – 1974. – Vol. 74. – P. 551-560.
- Green P.D., Little P.B. Neuronal ceroid lipofuscin storage in Siamese cats // Can. J. Comp. Med. – 1974. – Vol. 38. – P. 207-212.
-
Baker H J. Sphingomyelin lipidosis in a cat // Vet. Pathol. – 1987. – Vol. 24. – P. 386-391.
- Lowenthal A.C., Cummings J.F., Wenger D.A., Thrall M.A., Wood EA., de Lahunta A. Feline sphingolipidosis resembling Niemann-Pick disease type C // Acta Neuropathol. (Berlin). –1990. – Vol. 81. – P. 189.
- Giger U., Wang P., Boyden M. Familial methemoglobin reductase deficiency in domestic shorthair cats. In “Proceedings of the First International Feline Genetic Disease Conference,” Univ. of Pennsylvania. 1998b.
- DiBartola S.E, Eaton K.A., Menotti-Raymond M.A., Biller D.S., Wellman M.L. Radin M.J. Autosomal dominant polycystic kidney disease in Persian cats. In “Proceedings of the First International Feline Genetic Disease Conference,” Univ. of Pennsylvania. 1998.
- Glenn B.L., Glenn H.G., Omtvedt I.T. Congenital porphyria in the domestic cat: preliminary investigations on itiheritance pattern // Am. J. Vet. Res. – 1986. – Vol. 29. – P. 1653-1657.
- Narfstrom K. Progressive retinal atrophy in Abyssinians. In “Proceedings of the First International Feline Genetic Disease Conference,” Univ. of Pennsylvania. 1998.
- Bellhorn R.W., Fischer C.A. Feline central retinal degeneration // J. Am. Vet. Med. Assoc. – 1970. – Vol. 157. – P. 842-849.
- Bergsma D. R., and Brown, K. S. White fur, blue eyes, and deafness in the domestic cat // J. Hered. – 1971. – Vol. 62. – P. 171-185.
- Hoover E.A., Mullins J.I. (1991). Feline leukemia virus infection and disease // J. Am. Vet. Med. Assoc. – 1991. – Vol. 199. – P. 1287-1297.
- Gardner M.B., Luciw P.A. Animal models of AIDS // FASEB J. – 1998. – Vol. 3. – P. 2593-2606. doi: 10.1096/fasebj.3.14.2556312.
- Bendinelli M., Pistello M., Lombardi S., Poli A., Garzelli C., Matteucci D., Ceccherini-Nelli L., Malvaldi G., Tozzini F. Feline immunodeficiency virus: an interesting model for AIDS studies and an important cat pathogen // Clin Microbiol Rev. – 1995. – Vol. 8(1). – P. 87-112. doi: 10.1128/CMR.8.1.87-112.1995.
- Lee A., Hazell S. L., O’Rourke J., Kouprach S. (1988). Isolation of a spiral-shaped bacterium from the cat stomach // Infect. Immun. – 1988. – Vol. 56. – P. 2843-2850.
- Perkins S.E., Yan L.L., Shen Z., Hayward A., Murphy J.C., Fox, J.G. Use of PCR and culture to detect Helicobacter pylori in naturally infected cats following triple antimicrobial therapy // Antimicrob. Agents Chemother. – 1996. – Vol. 40. – P. 1486-1490.
- Fox J.G., Blanco M., Murphy J.C., Taylor N.S., Lee A., Kabok Z., Pappo J. Local and systemic immune responses in murine Helicobacterfelis active chronic gastritis // Infect. lmmun. – 1993. – Vol. 61. – P. 2309-2315.
- Enno A., O’Rourke J.L., Howlett C.R., Jack A., Dixon M. E, Lee A. MALToma-like lesions in the murine gastric mucosa after longterm infection with Helicobacterfelis // Am. J. Path. – 1995. – Vol. 147. – P. 217-222.
- Wang T.C., Dangler C.A., Chen D., Goldenring J.R., Koh T., Raychowdhury R., Coffey R.J., Ito S., Varro A., Dockray G.J., Fox, J.G. Synergistic interaction between hypergastrinemia and helicobacter infection in a mouse model of gastric cancer // Gastroenterology. – 2000. – Vol. 118. – P. 36-47. doi: 10.1016/s0016-5085(00)70412-4.
- Esteves M.I., Schrenzel M.D., Marini R.P., Taylor N.S., Xu S., Hagen S., Feng Y., Shen Z., Fox J.G. Helicobacter pylori Gastritis in Cats with Long-Term Natural Infection as a Model of Human Disease // American Journal of Pathology. – 2000. – Vol. 156 (2). – P. 709-721.
- Baker D.G., Coleridge H.M., Coleridge J.C., Nerdrum T. Search for a cardiac nociceptor: stimulation by bradykinin of sympathetic afferent nerve endings in the heart of the cat // J Physiol. – 1980. – Vol. 306. – P. 519-536.
- Fu L.-W., Longhurst J.C. Interactions between histamine and bradykinin in stimulation of ischaemically sensitive cardiac afferents in felines // J Physiol. – 2005. – Vol. 15 565. – P. 1007-1017.
- Евлахов В.И., Поясов И.З., Овсянников В.И. Механизмы взаимодействия сердечно-сосудистой и дыхательной систем // Российский физиологический журнал им. И.М. Сеченова. – 2020. – Т. 106 (№ 2). – С. 189-204 [Evlakhov V.I., Poyasov I.Z., Ovsyannikov V.I. Mekhanizmy vzaimodeistviya serdechno-sosudistoi i dykhatel’noi sistem // Rossiiskii fiziologicheskii zhurnal im. I.M. Sechenova. – 2020. – Vol. 106 (№ 2). – P. 189-204. (In Russ.)].
- Евлахов В.И., Овсянников В.И., Поясов И.З., Шайдаков Е.В. Регуляция легочного кровообращения в норме и при экспериментальной патологии // Медицинский академический журнал. – 2013. – Т. 13 (№ 4). – С. 54-65 [Evlakhov V.I., Ovsyannikov V.I., Poyasov I.Z., Shaidakov E.V. Regulyatsiya legochnogo krovoobrashcheniya v norme i pri eksperimental’noi patologii // Meditsinskii akademicheskii zhurnal. – 2013. – Vol. 13 (№ 4). – P. 54-65. (In Russ.)].
- Евлахов В.И., Поясов И.З. Гемодинамические механизмы изменений давления и кровотока в легочной артерии при применении депрессорных вазоактивных веществ. Российский физиологический журнал им. И.М. Сеченова. – 2011. – Т. (№ 1). – C. 24-34. [Evlakhov V.I., Poyasov I.Z. Gemodinamicheskie mekhanizmy izmenenii davleniya i krovotoka v legochnoi arterii pri primenenii depressornykh vazoaktivnykh veshchestv. Rossiiskii fiziologicheskii zhurnal im. I.M. Sechenova. – 2011. – Vol. 97 (№ 1). – P. 24-34. (In Russ.)].
- Owen D.A. The effects of histamine and some histamine-like agonists on blood pressure in the cat // Br J Pharmacol. – 1975. – Vol. 55(2). – P. 173-179. doi: 10.1111/j.1476-5381.1975.tb07626.x.
- Tucker A., Hoffman E.A., Reeves J.T. Vascular actions of histamine H1- and H2-receptor agonists in dogs and cats // Eur J Pharmacol. – 1977. – Vol. 1(45). – P. 73-77. doi: 10.1111/j.1476-5381.1997.tb06827.x.
- Black J.W., Owen D.A., Parsons M.E. An analysis of the depressor responses to histamine in the cat and dog: involvement of both H1- and H2-receptors. 1975 // Br J Pharmacol. – 1997. – Vol. 120. – P. 420-425. doi: 10.1111/j.1476-5381.1997.tb06827.x.
- Liu S.K., Tilley L.P. Animal models of primary myocardial diseases // Yale J Biol Med. – 1980. – Vol. 53(3). – P. 191-211.
- Payne J.R., Brodbelt D.C., Luis Fuentes V. Cardiomyopathy prevalence in 780 apparently healthy cats in rehoming centres (the CatScan study) // J Vet Cardiol. – 2015. – Vol. 17. – P. S244–257. doi: 10.1016/j.jvc.2015.03.008.
- Kittleson M.D., Meurs K.M., Munro M.J., Kittleson J.A., Liu S.K., Pion P.D., Towbin J.A. Familial hypertrophic cardiomyopathy in maine coon cats: an animal model of human disease // Circulation. – 1999. – Vol. 99(24). – P. 3172-3180. doi: 10.1161/01.cir.99.24.3172.
- Fox PR. Hypertrophic cardiomyopathy. Clinical and pathologic correlates // J Vet Cardiol. – 2003. – Vol. 5(2). – P. 39-45.
- Freeman L.M., Rush J.E. Nutrition and cardiomyopathy: lessons from spontaneous animal models // Curr Heart Fail Rep. – 2007. – Vol. 4. – P. 84-90. doi: 10.1007/s11897-007-0005-6.
- Freeman L.M., Rush J.E., Stern J.A., Huggins G.S., Maron M.S. Feline Hypertrophic Cardiomyopathy: A Spontaneous Large Animal Model of Human HCM // Cardiol Res. – 2017. – Vol. 8(4). – P. 139-142. doi: 10.14740/cr578w.
- Mary J., Chetboul V., Sampedrano C.C., Abitbol M., Gouni V., Trehiou-Sechi E., Tissier R., Queney G., Pouchelon J.L., Thomas A. Prevalence of the MYBPC3-A31P mutation in a large European feline population and association with hypertrophic cardiomyopathy in the Maine Coon breed // J Vet Cardiol. – 2010. – Vol. 12. – P. 155-161. doi: 10.1016/j.jvc.2010.06.004.
- Camacho P., Fan H., Liu Z., He J-Q. Small mammalian animal models of heart disease // Am J Cardiovas Dis. – 2016. – Vol. 6(3). – P. 70-80.
- Tilley L.P., Liu S.K., Gilbertson S.R., Wagner B.M., Lord P.F. Primary myocardial disease in the cat. A model for human cardiomyopathy // Am J Pathol. – 1977. – Vol. 86(3). – P. 493-522.
- Courcier E.A., O’Higgins R., Mellor D.J., Yam P.S. Prevalence and risk factors for feline obesity in a first opinion practice in Glasgow, Scotland // J Feline Med Surg. – 2010. – Vol. 12(10). – P. 746-753. doi: 10.1016/j.jfms.2010.05.011.
- Scarlett J.M., Donoghue S. Associations between body condition and disease in cats // J Am Vet Med Assoc. – 1998. – Vol. 212(11). – P. 1725-1731.
- Laflamme D. Development and validation of a body condition score system for cats: a clinical tool // Feline Pract. – 1997. – Vol. 25(5-6). – P. 13-18.
- Nelson R.W., Himsel C.A., Feldman E.C., Bottoms G.D. Glucose tolerance and insulin response in normal-weight and obese cats // Am J Vet Res. – 1990. – Vol. 51(9). – P. 1357-1362.
- Hawthorne A., Butterwick R. Predicting the body composition of cats: development of a zoometric measurement for estimation of percentage body fat in cats // J Vet Intern Med. – 2000. – Vol. 14(3). – P 365.
- Hoenig M., Pach N., Thomaseth K., de Vries F., Ferguson D.C. Evaluation of long-term glucose homeostasis in lean and obese cats using continuous glucose monitoring // Am J Vet Res. – 2012a. – Vol. 73(7). – P. 1100-1106. doi: 10.2460/ajvr.73.7.1100.
- Hoenig M., Thomaseth K., Brandao J., Waldron M., Ferguson D.C. Assessment and mathematical modeling of glucose turnover and insulin sensitivity in lean and obese cats // Domest Anim Endocrinol. – 2006b. – Vol. 31(4). – P. 373-389. doi: 10.1016/j.domaniend.2005.12.004.
- Wagenknecht L.E., Langefeld C.D., Scherzinger A.L., Norris J.M., Haffner S.M., Saad M.F, Bergman R.N. Insulin sensitivity, insulin secretion, and abdominal fat: the Insulin Resistance Atherosclerosis Study (IRAS) Family Study // Diabetes. – 2003. – Vol. 52(10). – P. 2490-2496.
- Schrauwen-Hinderling V.B., Hesselink M.K., Schrauwen P., Kooi M.E. Intramyocellular lipid content in human skeletal muscle // Obesity (Silver Spring). – 2006. – Vol. 14(3). – P. 357-367. doi: 10.1038/oby.2006.47.
- Porat O. The effect of tumor necrosis factor alpha on the activity of lipoprotein lipase in adipose tissue // Lymphokine Res. – 1989. – Vol. 8(4). – P. 459-469.
- Kern P.A., Saghizadeh M., Ong J.M., Bosch R.J., Deem R., Simsolo R.B. The expression of tumor necrosis factor in human adipose tissue. regulation by obesity, weight loss, and relationship to lipoprotein lipase // J Clin Invest. – 1995. – Vol. 95(5). – P. 2111-2119. doi: 10.1172/JCI117899.
- Hoenig M., Thomaseth K., Waldron M., Ferguson D.C. Insulin sensitivity, fat distribution, and adipocytokine response to different diets in lean and obese cats before and after weight loss // Am J Physiol Regul Integr Comp Physiol. – 2007b. – Vol. 292(1). – P. R227–234.
- Hoenig M., Ferguson D.C. Effect of darglitazone on glucose clearance and lipid metabolism in obese cats // Am J Vet Res. – 2003. – Vol. 64(11). – P. 1409-1413.
- Kley S., Hoenig M., Glushka J., Jin E.S., Burgess S.C., Waldron M., Jordan E.T., Prestegard J.H., Ferguson D.C., Wu S., Olson D.E. The impact of obesity, sex, and diet on hepatic glucose production in cats // Am J Physiol Regul Integr Comp Physiol. – 2009. – Vol. 296(4). – P. R936-943
- Hoenig M., Jordan E.T., Glushka J., Kley S., Patil A., Waldron M., Prestegard J.H., Ferguson D.C., Wu S., Olson D.E. Effect of macro-nutrients, age, and obesity on 6 and 24-hour post-prandial glucose metabolism in cats // Am J Physiol Regul Integr Comp Physiol. – 2011. – Vol. 301(6). – P. R1798-807.
- Kettelhut I.C., Foss M.C., Migliorini R.H. Glucose homeostasis in a carnivorous animal (cat) and in rats fed a high-protein die // Am J Physiol. – 1980. – Vol. 239(5). – P. R437–444.
- Ballard F.J. Glucose utilization in mammalian liver // Comp Biochem Physiol. – 1965. – Vol. 14. – P. 437-443.
- Engelking L.R. Textbook of veterinary physiological chemistry. 2nd ed. Burlington: Academic Press. 2011.
- Rothman D.L., Magnusson I., Katz L.D., Shulman R.G., Shulman G.I. Quantitation of hepatic glycogenolysis and gluconeogenesis in fasting humans with 13C NMR // Science. – 1991. – Vol. 254(5031). – P. 573-576.
- Gal A., Hoenig M., O’Brien T.D., Wallig M., Singh K. Histopathology from life-long dietary-induced obese cats and lean controls // Vet Pathol. – 2010. – Vol. 47(6S). – P. 150. (abstract).
- Ma Z., Westermark G.T., Johnson K.H., O’Brien T.D., Westermark P. Quantitative immunohistochemical analysis of islet amyloid polypeptide (IAPP) in normal, impaired glucose tolerant, and diabetic cats // Amyloid. – 1998. –Vol 5(4). – P. 255-261.
- Nelson R.W., Griffey S.M., Feldman E.C., Ford S.L. Transient clinical diabetes mellitus in cats: 10 cases (1989-1991) // J Vet Intern Med. – 1999. – Vol. 13(1). – P. 28-35.
- Hoenig M, Alexander S, Holson J, Ferguson DC. Influence of glucose dosage on interpretation of intravenous glucose tolerance tests in lean and obese cats // J Vet Intern Med. – 2002. – Vol. 16(5). – P. 529-532.
- Brennan CL, Hoenig M, Ferguson DC. GLUT4 but not GLUT1 expression decreases early in the development of feline obesity // Domest Anim Endocrinol. –2004. – Vol. 26(4). – P. 291-301.
- Appleton D.J., Rand J.S., Priest J., Sunvold G.D. Determination of reference values for glucose tolerance, insulin tolerance, and insulin sensitivity tests in clinically normal cats // Am J Vet Res. – 2001. – Vol. 62(4). – P. 630-636.
- Backus R.C., Cave N.J., Ganjam V.K., Turner J.B., Biourge V.C. Age and body weight effects on glucose and insulin tolerance in colony cats maintained since weaning on high dietary carbohydrate // J Anim Physiol Anim Nutr (Berl). – 2010. – Vol. 94(6). – P. e318-28.
- Biourge V., Nelson R.W., Feldman E.C., Willits N.H., Morris J.G., Rogers Q.R. Effect of weight gain and subsequent weight loss on glucose tolerance and insulin response in healthy cats // J Vet Intern Med. – 1997. – Vol. 11(2). – P. 86-91.
- Schindler C. The metabolic syndrome as an endocrine disease: is there an effective pharmacotherapeutic strategy optimally targeting the pathogenesis? // Ther Adv Cardiovasc Dis. – 2007. – Vol. 1(1). – P. 17-26. doi: 10.1177/1753944707082662.
- Freedman D.S., Otvos J.D., Jeyarajah E.J., Barboriak J.J., Anderson A.J. Walker J.A. Relation of lipoprotein subclasses as measured by proton nuclear magnetic resonance spectroscopy to coronary artery disease // Arterioscler Thromb Vasc Biol. – 1998. – Vol. 18(7). – P. 1046-1053. doi: 10.1161/01.atv.18.7.1046.
- Goff D.C., Jr, D’Agostino R.B., Jr, Haffner S.M., Otvos J.D. Insulin resistance and adiposity influence lipoprotein size and subclass concentrations. results from the insulin resistance atherosclerosis study // Metabolism. – 2005. – Vol 54(2). – P. 264-270. doi: 10.1016/j.metabol.2004.09.002.
- Griffin BA. Lipoprotein atherogenicity: an overview of current mechanisms // Proc Nutr Soc. – 1999. – Vol. 58(1). – P. 163-169.
- Liu S.K., Tilley L.P. Animal models of primary myocardial diseases // Yale J Biol Med. – 1980. – Vol. 53(3). – P. 191-211.
- Hoenig M., Caffall Z., Ferguson D.C. Triiodothyronine differentially regulates key metabolic factors in lean and obese cats // Domest Anim Endocrinol. – 2008. – Vol. 34(3) . – P. 229-237
- Hoenig M., Thomaseth K., Waldron M., Ferguson D.C. Fatty acid turnover, substrate oxidation, and heat production in lean and obese cats during the euglycemic hyperinsulinemic clamp // Domest Anim Endocrinol. – 2007a. – Vol. 32(4). – P. 329-338.
- Ahima R.S., Flier J.S. Leptin // Annu Rev Physiol. – 2000. – Vol 62. – P. 413-437.
- Backus R.C., Havel P.J., Gingerich R.L., Rogers Q.R. Relationship between serum leptin immunoreactivity and body fat mass as estimated by use of a novel gas-phase Fourier transform infrared spectroscopy deuterium dilution method in cats // Am J Vet Res. – 2000. – Vol. 61(7). – P. 796-801.
- Giraudel J.M., Diquelou A., Laroute V., Lees P., Toutain P-L. Pharmacokinetic/pharmacodynamic modelling of NSAIDs in a model of reversible inflammation in the cat // British Journal of Pharmacology. – 2005c. – Vol. 146. – P. 642-653.
- Giraudel J.M., Toutain P.L., Lees P. Development of in vitro assays for the evaluation of cyclooxygenase inhibitors and application for predicting the selectivity of NSAIDs in the cat // Am. J. Vet. Res. – 2005b. – Vol. 66. – P. 700-709.
- Botrel M.A., Haak T., Legrand C., Concordet D., Chevalier R., Toutain P.L. Quantitative evaluation of an experimental inflammation induced with Freund’s complete adjuvant in dogs // J. Pharmacol. Toxicol. Methods. – 1994. – Vol. 32. – P. 63-71.
- Toutain P.L., Autefage A., Legrand C., Alvinerie M. Plasma concentrations and therapeutic efficacy of phenylbutazone and flunixin meglumine in the horse: pharmacokinetic/pharmacodynamic modeling // J. Vet. Pharmacol. Ther. – 1994. – Vol. 17. – P. 459-469.
- Toutain P.L., Cester C.C., Haak T., Laroute V.A pharmacokinetic/pharmacodynamic approach vs a dose titration for the determination of a dosage regimen: the case of nimesulide, a Cox-2 selective nonsteroidal anti-inflammatory drug in the dog // J. Vet. Pharmacol. Ther. – 2001. – Vol. 24. – P. 43-55.
- Giraudel J.M., Diquelou A., Lees P., Toutain P.L. Development and validation of a new model of inflammation in the cat and selection of surrogate endpoints for testing anti-inflammatory drugs // J. Vet. Pharmacol. Ther. – 2005a. – Vol. 28. – P. 275-285.
- Walker J.S. Pharmacokinetic–pharmacodynamic correlations of analgesics Handbook of Pharmacokinetic/Pharmacodynamic Correlation 1995 U.S.A.: CRC Press LLC. 157-168. ed. Derendorf, H., Hochhaus, G.
- Engelhardt G. Pharmacology of meloxicam, a new non-steroidal anti-inflammatory drug with an improved safety profile through preferential inhibition of COX-2. // Br. J. Rheumatol. – 1996. – Vol. 35. – P. 4-12.
- Turck D., Roth W., Busch U. A review of the clinical pharmacokinetics of meloxicam // Br. J. Rheumatol. – 1996. – Vol. 35. – P. 13-16.
- Busch U., Schmid J., Heinzel G., Schmaus H., Baierl J., Huber C., Roth W. Pharmacokinetics of meloxicam in animals and the relevance to humans // Drug Metab. Dispos. – 1998. – Vol. 26. – P. 576-584.
- Slingsby L.S., Waterman-Pearson A.E. Postoperative analgesia in the cat after ovariohysterectomy by use of carprofen, ketoprofen, meloxicam or tolfenamic acid // J. Small Anim. Pract. – 2000. – Vol. 41. – P. 447-450.
- Lascelles B.D., Henderson A.J., Hackett I.J. Evaluation of the clinical efficacy of meloxicam in cats with painful locomotor disorders // J. Small Anim. Pract. – 2001. – Vol. 42. – P. 587-593.
- Thomas R. Cytogenomics of feline cancers: advances and opportunities // Vet Sci. – 2015. – Vol. 2. – P. 246-258.
- Mwangi W., de Figueiredo P., Criscitiello M.F. One Health: Addressing Global Challenges at the Nexus of Human, Animal, and Environmental Health // PLOS Pathogens. – 2016. – Vol. 12(9). – P. e1005731. doi: 10.1371/journal.ppat.1005731.
- Yuhki N, Beck T, Stephens R, Neelam B, O’Brien SJ. Comparative genomic structure of human, dog, and cat MHC: HLA, DLA, and FLA // J Hered. – 2007. – Vol. 98. – P. 390-399.
- Khanna C., Lindblad-Toh K., Vail D. The dog as a cancer model // Nat Biotechnol. – 2006. – Vol. 24(9). – P. 1065-1066.
- Paoloni M., Khanna C. Translation of new cancer treatments from pet dogs to humans // Nat Rev Cancer. – 2008. – Vol. 8(2). – P. 147-156.
- Simmons J.K., Hildreth B.E., Supsavhad W., Elshafae S.M., Hassan B.B., Dirksen W. P., Toribio R. E., Rosol T. J. Animal Models of Bone Metastasis // Vet Pathol. – 2015. – Vol. 52(5). – P. 827-841.
- Langlais L.M., Gibson J., Taylor J.A., Caswell J.L Pulmonary adenocarcinoma with metastasis to skeletal muscle in a cat // Can Vet J. – 2006. – Vol. 47(11). – P. 1122-1123.
- Ballegeer E.A., Madrill N.J., Berger K.L., Agnew D.W., McNiel E.A.. Evaluation of hypoxia in a feline model of head and neck cancer using (6)(4)Cu-ATSM positron emission tomography/computed tomography // BMC Cancer. – 2013. – Vol. 13 (128). – P. 1-11. doi: 10.1186/1471-2407-13-218.
- MacEwen E.G. Spontaneous tumors in dogs and cats: models for the study of cancer biology and treatment // Cancer Metastasis Rev. – 1990. – Vol. 9(2). – P. 125-136.
- Tannehill-Gregg S.H., Levine A.L., Rosol T.J. Feline head and neck squamous cell carcinoma: a natural model for the human disease and development of a mouse model // Vet Comp Oncol. – 2006. – Vol. 4(2). – P. 84–97.
- Tannehill-Gregg S.H., Kergosien E., Rosol T.J. Feline head and neck squamous cell carcinoma cell line: characterization, production of parathyroid hormone–related protein, and regulation by transforming growth factor–beta // In Vitro Cell Dev Biol Anim. – 2001. – Vol. 37(10). – P. 676-683.
- Martin C.K., Dirksen W.P., Shu S.T., Werbeck J.L, Thudi N.K., Yamaguchi M., Wolfe T.D., Heller K.N., Rosol T.J. Characterization of bone resorption in novel in vitro and in vivo models of oral squamous cell carcinoma // Oral Oncol. – 2012. – Vol. 48(6). – P. 491-499.
- Soltero-Rivera MM, Krick EL, Reiter AM, Werbeck J.L, Thudi N.K., Yamaguchi M., Wolfe T.D., Heller K.N., Rosol T.J. Prevalence of regional and distant metastasis in cats with advanced oral squamous cell carcinoma: 49 cases (2005–2011) // J Feline Med Surg. – 2014. – Vol. 16(2). – P. 164-169.
- Gardner D.G. Spontaneous squamous cell carcinomas of the oral region in domestic animals: a review and consideration of their relevance to human research // Oral Dis. – 1996. – Vol. 2(2). – P. 148-154.
- Jimi E., Shin M., Furuta H., Tada Y., Kusukawa J. The RANKL/RANK system as a therapeutic target for bone invasion by oral squamous cell carcinoma // Int J Oncol. – 2013. – Vol. 42(3). – P. 803-809.
- Wypij J.M. A naturally occurring feline model of head and neck squamous cell carcinoma // Pathol Res Int. – 2013. – Vol. 2013. – P. 1-7. doi:10.1155/2013/502197.
- Bergkvist G.T., Argyle D.J., Pang L.Y., Muirhead R., Yool D.A. Studies on the inhibition of feline EGFR in squamous cell carcinoma: enhancement of radiosensitivity and rescue of resistance to small molecule inhibitors // Cancer Biol Ther. – 2011. – Vol. 11(11). – P. 927-937.
- Rathore K., Alexander M., Cekanova M. Piroxicam inhibits masitinib-induced cyclooxygenase 2 expression in oral squamous cell carcinoma cells in vitro // Transl Res. – 2014. – Vol. 164(2). – P. 158-168.
- Zygogianni A.G., Kyrgias G., Karakitsos P., Psyrri A., Kouvaris J., Kelekis N., Kouloulias V. Oral squamous cell cancer: early detection and the role of alcohol and smoking // Head Neck Oncol. – 2011. – Vol. 3(2). – P. 1-12.
- Bertone E.R., Snyder L.A., Moore A.S. Environmental and lifestyle risk factors for oral squamous cell carcinoma in domestic cats // J Vet Intern Med. – 2003. – Vol. 17(4). – P. 557-562.
- Snyder L.A., Bertone E.R., Jakowski R.M., Dooner M.S., Jennings-Ritchie J., Moore A.S p53 expression and environmental tobacco smoke exposure in feline oral squamous cell carcinoma // Vet Pathol. – 2004. – Vol. 41(3). – P. 209-214.
- Martin C.K., Tannehill-Gregg S.H., Wolfe T.D., Rosol T.J. Bone-invasive oral squamous cell carcinoma in cats: pathology and expression of parathyroid hormone–related protein // Vet Pathol. – 2011. – Vol. 48(1). – P. 302-312.
- Twomey L.N., Compendium A.A. Cytodiagnosis of feline lymphoma // Compendium. – 2005. – Vol. 27 (1).
- Richter K.P. Feline gastrointestinal lymphoma // Vet Clin North Am Small Anim Pract. – 2003. – Vol. 33. – P. 1083-1098.
- Ettinger S.N. Principles of treatment for feline lymphoma // Clin Tech Small Anim Pract. – 2003. – Vol. 18. – P. 98-102.
- Gabor L.J., Malik R., Canfield P.J. Clinical and anatomical features of lymphosarcoma in 118 cats // Aust Vet J. – 1998. – Vol. 76. – P. 725-732.
- Vail D.M., Moore A.S., Ogilvie G.K., Volk L.M. Feline lymphoma (145 cases): proliferation indices, cluster of differentiation 3 immunoreactivity, and their association with prognosis in 90 cats // J Vet Intern Med. – 1998. – Vol. 12. – P. 349-354.
-
Moore P.F., Rodriguez-Bertos A., Kass P.H. Feline gastrointestinal lymphoma: mucosal architecture, immunophenotype, and molecular clonality // Vet Pathol. – 2011. – Vol. 49. – P. 658-668.
-
Guillermo C.C. What is new on feline lymphoma? // J Feline Med Surg. – 2001. – Vol. 3. – P. 171-176.
- Barrs V., Beatty J. Feline alimentary lymphoma: 1. Classification, risk factors, clinical signs and non-invasive diagnostics // J Feline Med Surg. – 2012. – Vol. 14. – P. 182-190.
- Paulin M.V., Couronné L., Beguin J., Le Poder S. et al. Feline low-grade alimentary lymphoma: an emerging entity and a potential animal model for human disease // BMC Veterinary Research (2018) 14:306
- Willard M.D. Alimentary neoplasia in geriatric dogs and cats // Vet Clin North Am Small Anim Pract. – 2012. – Vol. 42. – P. 693-706.
- Louwerens M., London C.A., Pedersen N.C., Lyons L.A. Feline lymphoma in the post-feline leukemia virus era // J Vet Intern Med. – 2005. – Vol. 19. – P. 329-335.
- Fujino Y., Liao C.-P., Zhao Y.S., Pan J., Mathes L.E., Hayes K.A., et al. Identification of a novel common proviral integration site, flit-1, in feline leukemia virus induced thymic lymphoma // Virology. – 2009. – Vol. 386. – P. 16-22.
- Nesina S., Katrin Helfer-Hungerbuehler A., Riond B., Boretti F.S., Willi B., Meli ML., et al. Retroviral DNA-the silent winner: blood transfusion containing latent feline leukemia provirus causes infection and disease in naïve recipient cats // Retrovirology. – 2015. – Vol. 12. – P. 105.
- Sato H., Fujino Y., Chino J., Takahashi M., Fukushima K., Goto-Koshino Y., et al. Prognostic analyses on anatomical and morphological classification of feline lymphoma // J Vet Med Sci. – 2014. – Vol. 76. – P. 807-811.
- Tsatsanis C., Fulton R., Nishigaki K., Tsujimoto H., Levy L., Terry A., et al. Genetic determinants of feline leukemia virus-induced lymphoid tumors: patterns of proviral insertion and gene rearrangement // J Virol. – 1994. – Vol. 68. – P. 8296-8303.
- Jackson M.L., Wood S.L., Misra V., Haines D.M. Immunohistochemical identification of B and T lymphocytes in formalin-fixed, paraffin-embedded feline lymphosarcomas: relation to feline leukemia virus status, tumor site, and patient age // Can J Vet Res. – 1996. – Vol. 60. – P. 199-204.
- Callanan J.J., Jones B.A., Irvine J., Willett B.J., McCandlish I.A., Jarrett O. Histologic classification and immunophenotype of lymphosarcomas in cats with naturally and experimentally acquired feline immunodeficiency virus infections // Vet Pathol. – 1996. – Vol. 33. – P. 264–272.
- Mikkers H., Berns A. Retroviral insertional mutagenesis: tagging cancer pathways // Adv Cancer Res. – 2003. – Vol. 88. – P. 53-99.
- Beatty J.A., Lawrence C.E., Callanan J.J., Grant C.K., Gault E.A., Neil J.C., et al. Feline immunodeficiency virus (FIV)-associated lymphoma: a potential role for immune dysfunction in tumourigenesis // Vet Immunol Immunopathol. – 1998. – Vol. 65. – P. 309-322.
- Lutz H., Pedersen N.C., Theilen G.H. Course of feline leukemia virus infection and its detection by enzymelinked immunosorbent assay and monoclonal antibodies // Am J Vet Res. – 1983. – Vol. 44. – P. 2054-2059.
- Court E.A., Watson A.D., Peaston AE. Retrospective study of 60 cases of feline lymphosarcoma // Aust Vet J. – 1997. – Vol. 75. – P. 424-427.
- Kaye S., Wang W., Miller C., McLuckie A., Beatty J.A., Grant C.K., et al. Role of feline immunodeficiency virus in lymphomagenesis going alone or colluding? // ILAR J. – 2016. – Vol. 57. – P. 24-33.
- Farinha P., Gascoyne R.D. Helicobacter pylori and MALT lymphoma // Gastroenterology. – 2005. – Vol. 128. – P. 1579-1605.
- Wang F., Meng W., Wang B., Qiao L. Helicobacter pylori-induced gastric inflammation and gastric cancer // Cancer Lett. – 2014. – Vol. 345. – P. 196-202.
- Bridgeford E.C., Marini R.P., Feng Y., Parry N.M.A., Rickman B., Fox J.G. Gastric helicobacter species as a cause of feline gastric lymphoma: a viable hypothesis // Vet Immunol Immunopathol. – 2008. – Vol. 123. – P. 106-113.
- Hoehne S.N., McDonough S.P., Rishniw M., Simpson K.W. Identification of mucosa-invading and intravascular Bacteria in feline small intestinal lymphoma // Vet Pathol. – 2017. – Vol. 54. – P. 234-241.
- Moore P.F., Woo J.C., Vernau W., Kosten S., Graham P.S. Characterization of feline T cell receptor gamma (TCRG) variable region genes for the molecular diagnosis of feline intestinal T cell lymphoma // Vet Immunol Immunopathol. – 2005. – Vol. 106. – P. 167-178.
-
Briscoe K.A., Krockenberger M., Beatty J.A., Crowley A., Dennis M.M., Canfield P.J., et al. Histopathological and immunohistochemical evaluation of 53 cases of feline lymphoplasmacytic enteritis and low-grade alimentary lymphoma // J Comp Pathol. – 2011. – Vol. 145. – P. 187-198.
- Lingard A.E., Briscoe K., Beatty J.A., Moore A.S., Crowley A.M., Krockenberger M., et al. Low-grade alimentary lymphoma: clinicopathological findings and response to treatment in 17 cases // J Feline Med Surg. – 2009. – Vol. 11. – P. 692-700.
- Carreras J.K., Goldschmidt M., Lamb M., McLear R.C., Drobatz K.J., Sorenmo K.U. Feline epitheliotropic intestinal malignant lymphoma: 10 cases (1997-2000) // J Vet Intern Med. – 2003. – Vol. 17. – P. 326-331.
- Kiupel M., Smedley R.C., Pfent C., Xie Y., Xue Y., Wise A.G., et al. Diagnostic algorithm to differentiate lymphoma from inflammation in feline small intestinal biopsy samples // Vet Pathol. – 2011. – Vol. 48. – P. 212-222.
- Chott A, Dragosics B, Radaszkiewicz T. Peripheral T-cell lymphomas of the intestine // Am J Pathol. – 1992. – Vol. 141. – P. 1361-1371.
- Dieter R.S., Duque K. Enterotherapy associated T-cell lymphoma: a case report and literature review // WMJ. – 2000. – Vol. 99. – P. 28-31.
- ondacaro J.V., Richter K.P., Carpenter J.L., Hart J.R., Hill S.L., Fettman M.J. Feline gastrointestinal lymphoma: 67 cases (1988–1996) // Eur J Comp Gastroenterol. – 1999. – Vol. 4. – P. 5-11.
- FCastro-López J., Teles M., Fierro C., Allenspach K., Planellas M., Pastor J. Pilot study: duodenal MDR1 and COX2 gene expression in cats with inflammatory bowel disease and low-grade alimentary lymphoma // J Feline Med Surg. – 2017. – Vol. 207. – P. 214.
- Ohsawa M., Fukushima H., Ikura Y., Inoue T., Shirai N., Sugama Y, et al. Expression of cyclooxygenase-2 in Hodgkin’s lymphoma: its role in cell proliferation and angiogenesis // Leuk Lymphoma. – 2006. – Vol. 47. – P. 1863-1871.
- Panwala C.M., Jones J.C., Viney J.L. A novel model of inflammatory bowel disease: mice deficient for the multiple drug resistance gene, mdr1a, spontaneously develop colitis // J Immunol. – 1998. – Vol. 161. – P. 5733-5744.
- Daiger S.P., Rossiter B.J.F., Greenberg J., Christoffels A., Hide W.Data services and software for identifying genes and mutations causing retinal degeneration // Invest Ophthalmol Vis Sci. – 1998. – Vol. 39. – P. S295.
- Hull S., Arno G., Plagnol V., Chamney S., Russell-Eggitt I., Thompson D., Ramsden S.C., Black G.C.M, Robson A., Holder G.E., Moore A.T., Webster A.R. The phenotypic variability of retinal dystrophies associated with mutations in CRX, with report of a novel macular dystrophy phenotype // Invest Ophthalmol Vis Sci. – 2014. – Vol. 55. – P. 6934-6944. doi: 10.1167/iovs.14-14715.
- Occelli L.M., Tran N.M., Narfstr¨om K., Chen S., Petersen-Jones S.M. CrxRdy cat: a large animal model for CRX-associated Leber congenital amaurosis // Invest Ophthalmol Vis Sci. – 2016. – Vol. 57. – P. 3780-3792.
- Jeon C.J., Strettoi E., Masland R.H.The major cell populations of the mouse retina // J Neurosci. – 1998. – Vol. 18. – P. 8936-8946.
- Applebury M.L., Antoch M.P., Baxter L.C., Chun L.L., Falk J.D., Farhangfar F., Kage K., Krzystolik M.G., Lyass L.A., Robbins J.T. The murine cone photoreceptor: a single cone type expresses both S and M opsins with retinal spatial patterning // Neuron. – 2000. – Vol. 27. – P. 513-523. doi: 10.1016/s0896-6273(00)00062-3.
- Provis J.M., Dubis A.M., Maddess T., Carroll J. Adaptation of the central retina for high acuity vision: cones the fovea and the avascular zone // Prog Retin Eye Res. – 2013. – Vol. 35. – P. 63-81.
- Rossi E.A., Roorda A. The relationship between visual resolution and cone spacing in the human fovea // Nat Neurosci. – 2010. – Vol. 13. – P. 156-157.
- Volland S., Esteve-Rudd J., Hoo J., Yee C., Williams D.S. A comparison of some organizational characteristics of the mouse central retina and the human macula // PLoS One. – 2015. – Vol. 10. – P. 1-13. doi: 10.1371/journal.pone.0125631.
- Barnett K.C., Curtis R. Autosomal dominant progressive retinal atrophy in the Abyssinian cat // J Hered. – 1985. – Vol. 76. – P. 168-170.
- Curtis R., Barnett K.C., Leon A. An early-onset retinal dystrophy with dominant inheritance in the Abyssinian cat. Clinical and pathological findings // Invest Ophthalmol Vis Sci. – 1987. – Vol. 28. – P. 131-139.
- Leon A, Curtis R. Autosomal dominant rod-cone dysplasia in the Rdy cat. 1. Light and electron microscopic findings // Exp Eye Res. – 1990. – Vol. 51. – P. 361-381.
- Leon A., Hussain A.A., Curtis R. Autosomal dominant rod-cone dysplasia in the Rdy cat. 2. Electrophysiological findings // Exp Eye Res. – 1991. – Vol. 53. – P. 489-502.
- Chong N.H., Alexander R.A., Barnett K.C., Bird A.C., Luthert P.J. An immunohistochemical study of an autosomal dominant feline rod/cone dysplasia (Rdy cats) // Exp Eye Res. – 1999. – Vol. 68. – P. 51-57.
- Menotti-Raymond M., Deckman K.H., David V., Myrkalo J., O’Brien S.J., Narfstrom K. Mutation discovered in a feline model of human congenital retinal blinding disease // Invest Ophthalmol Vis Sci. – 2010. – Vol. 51. – P. 2852-2859.
- Steinberg R.H., Reid M., Lacy P.L.The distribution of rods and cones in the retina of the cat (Felis domesticus) // J Comp Neurol. – 1973. – Vol. 148. – P. 229-248.
- Rapaport D.H., Stone J. The area centralis of the retina in the cat and other mammals: focal point for function and development of the visual system // Neuroscience. – 1984. – Vol 11. – P. 289-301.
- Linberg K.A., Lewis G.P., Shaaw C., Rex T.S., Fisher SK. Distribution of S- and M-cones in normal and experimentally detached cat retina // J Comp Neurol. – 2001. – Vol 430. – P. 343-356.
- Creel D., Hendrickson A.E., Leventhal A.G. Retinal projections in tyrosinase-negative albino cats // J Neurosci. – 1982. – Vol. 2(7). – P. 907-11.
- Clark F.J., von Euler C. On the regulation of depth and rate of breathing // J Physiol. – 1972. – Vol. 222(2). – P. 267-295
- Rosenberg H.F., Druey K.M. Modeling asthma: Pitfalls, promises, and the road ahead // J Leukoc Biol. – 2018. – Vol. 104(1). – P. 41-48.
- Farnworth M.J., Chen R., Packer R.M.A., Caney S.M.A., Gunn-Moore D.A. Flat Feline Faces: Is Brachycephaly Associated with Respiratory Abnormalities in the Domestic Cat (Felis catus)? // PLoS One. – 2016. – Vol. 30; 11(8). – P. 1-12. doi: 10.1371/journal.pone.0161777
- Lulich K.M., Mitchell H.W., Sparrow M.P. The cat lung strip as an in vitro preparation of peripheral airways: a comparison of beta-adrenoceptor agonists, autacoids and anaphylactic challenge on the lung strip and trachea // Br J Pharmacol. – 1976. – Vol. 58(1). – P. 71-79.
- Chand N., Eyre P. Autacoid and anaphylactic reactivity of pulmonary and hepatic smooth musculature of the cat // Eur J Pharmacol. – 1977. – Vol. 1 (45.3). – P. 213-20.
- Carter M.C., Smith J.L. Simultaneous control of two rhythmical behaviors. I. Locomotion with paw-shake response in normal cat // J Neurophysiol. – 1986. – Vol. 56(1). – P. 171-183.
- Sandstrom, B., Westman, J., and Ockerman, E A. Glycogenosis of the central nervous system in the cat // Acta Neuropathol. – 1969. – Vol. 14. – P. 194.
- Hodson-Tole EF, Pantall A, Maas H, Farrell B, Gregor RJ, Prilutsky BITask-dependent activity of motor unit populations in feline ankle extensor muscles.//J Exp Biol. – 2012. – Vol. 1(215). – P. 3711-3722.
- Ianuzzi A., Pickar J.G., Khalsa P.S. Validation of the Cat as a Model for the Human Lumbar Spine During Simulated High-Velocity, Low-Amplitude Spinal Manipulation //J Biomech Eng. – 2010. – Vol. 132(7). – P. 1-20. doi: 10.1115/1.4001030.
- Mehta R, Prilutsky BI Task-dependent inhibition of slow-twitch soleus and excitation of fast-twitch gastrocnemius do not require high movement speed and velocity-dependent sensory feedback // Front Physiol. – 2014. – Vol. 5. – P. 410.




