Апробация модели острого бактериального цистита на кроликах
Трофимец Е.И., Боровкова К.Е., Гущин Я.А., Салмова Ю.В., Никифорова Л.Р., Кательникова А.Е., Крышень К.Л. Апробация модели острого бактериального цистита на кроликах . Лабораторные животные для научных исследований. 2021; 2. https://doi.org/10.29296/2618723X-2021-02-04
Резюме
Инфекции мочевых путей – наиболее распространенные заболевания в амбулаторной и госпитальной практике, самым частым проявлением которых является цистит. Кроме медицинской составляющей, крайне важна социальная значимость данной проблемы. В связи с неожиданным началом, острым течением, ярко выраженной симптоматикой заболевание вызывает у больных серьезные неудобства, что приводит к резкому снижению физической и психической активности, ограничению свободы передвижений. Острый цистит (ОЦ) – одно из самых частых инфекционных заболеваний, которое встречается преимущественно у молодых женщин и проявляется дизурией, странгурией и учащенным мочеиспусканием. В подавляющем большинстве случаев ОЦ является неосложненной инфекцией мочевыводящих путей, вызванной штаммами Escherichia coli. Для оценки эффективности лекарственных препаратов при лечении и профилактике заболеваний мочевых путей и изучения патогенеза урологических заболеваний в доклинических исследованиях применяют различные модели на лабораторных животных.
Цель настоящего исследования – разработка модели острого бактериального цистита (ОБП) на кроликах с визуальной оценкой развития патологии по клиническим симптомам. В качестве тест-системы для моделирования патологий мочеполовой системы использовали самок кроликов породы белый великан. Для моделирования ОБП применяли метод химического повреждения слизистой оболочки мочевого пузыря (МП) с последующим введением в его полость бактериальной взвеси. В качестве повреждающих агентов были выбраны: спиртовой раствор салициловой кислоты и комбинация 1% раствора протамина сульфата и 20% раствора мочевины. Как контрольное вещество использовали физиологический раствор. Были сформированы две группы животных, которым вводили бактериальную взвесь без предварительного химического повреждения слизистой оболочки МП. После моделирования патологии в течение 8 дней проводили наблюдение за животными с оценкой выраженности клинического проявления патологии и боли. В ходе эксперимента у животных троекратно отбирали образцы мочи для бактериологического и клинического анализов, проводили ультразвуковую диагностику МП. На 8-й день эксперимента всех животных эвтаназировали и проводили макроскопическую оценку тканей МП. Также был выполнен гистологический анализ. По полученным результатам сформирована модель ОБП путем химического повреждения слизистой оболочки МП и введения суспензии E. coli. Была разработана балльная система оценки клинического проявления патологии и боли. Выраженное проявление патологического процесса с сохранением клинических признаков патологии и боли, бактериологического обсеменения мочи на протяжении всего эксперимента (8 дней) отмечено у животных группы, получившей в качестве индуктора патологии 0,05% спиртовой раствор салициловой кислоты и E. coli из фекалий кроликов.
Введение
Инфекции мочевых путей (ИМП) – наиболее распространенные заболевания в амбулаторной и госпитальной практике, самым частым проявлением которых является цистит. Кроме медицинской составляющей, крайне важна социальная значимость данной проблемы. В связи с неожиданным началом, острым течением, ярковыраженной симптоматикой заболевание вызывает у больных серьезные неудобства, что приводит к резкому снижению физической и психической активности, ограничению свободы передвижения [1].
Острый цистит (ОЦ) – одно из самых частых инфекционных заболеваний, которое встречается преимущественно у молодых женщин и проявляется дизурией, странгурией и учащенным мочеиспусканием. В подавляющем большинстве случаев ОЦ является неосложненной ИМП, вызванной штаммами Escherichia coli [2].
По характеру течения ИМП подразделяются на неосложненные и осложненные. ОЦ относится к неосложненным ИМП, которые возникают при отсутствии структурных изменений в почках и мочевыводящих путях, а также у пациентов без серьезных сопутствующих заболеваний. Под термином ОЦ подразумевают воспаление мочевого пузыря (МП), подтвержденное с помощью клинических, лабораторных, бактериологических методов исследования и при необходимости цистоскопически. При неосложненном ОЦ поражается только слизистая оболочка МП без глубокой инвазии микроорганизмов в подслизистый слой. Пациенты с ОЦ обычно лечатся в амбулаторных условиях и не требуют госпитализации [2].
Кроме лабораторных методов, в клинической практике эффективность лекарственных препаратов при циститах оценивают по клинической картине, выражающейся в учащении мочеиспускания, боли при мочеиспускании и императивных позывах [3].
Для оценки эффективности лекарственных препаратов при лечении и профилактике заболеваний мочевых путей, а также для изучения патогенеза урологических заболеваний в доклинических исследованиях применяют различные модели на лабораторных животных [4–16]. В качестве тест-системы широко применяют крыс [12, 15, 16], но на данном виде лабораторных животных в полной мере оценить клиническое проявление болевого синдрома и дискомфорта, которое испытывают пациенты с урологическими проблемами, не представляется возможным. В доступных источниках литературы модель острого бактериального цистита (ОБП) с наглядным проявлением симптоматики описана на кошках [11], однако в соответствии с принципами «трех R» (замена (replacement), уменьшение (reduction) и уточнение (refinement)) предложена апробация данной модели на кроликах. Кроликов широко применяют для моделирования патологий мочевыделительной системы [4–9], поскольку на данной тест-системе можно в полной мере оценить проявление болевого синдрома по клиническим симптомам (например, вокализация и хрипы при мочеиспускании, принятие вынужденной позы, угнетение).
Планирование и проведение всей работы осуществлялись в соответствии с рекомендациями международных стандартов в области доклинического изучения фармакологических средств – системы GLP (Good Laboratory Practice, надлежащая лабораторная практика) и с принципами QPBR (Quality practices in basic biomedical research, качественная практика в проведении фундаментальных биомедицинских исследований).
Цель настоящего исследования – разработка модели ОБП на кроликах с визуальной оценкой развития патологии по клиническим симптомам.
Материал и методы
Животные и условия их содержания
В данном исследовании в качестве тест-системы использовали половозрелых кроликов. ОЦ встречается преимущественно у женщин [2], в связи с чем для проведения данного исследования выбрали самок кроликов. В эксперименте использовали кроликов породы белый великан массой тела 3000–3500 г (n=21) (питомник КФХ «Нера», Россия). Животных содержали в индивидуальных клетках с решетчатым полом без подстила, с зоной для отдыха (сплошной пол), снабженных автоматической ниппельной системой поения, в стандартных условиях окружающей среды (фоторежим – 12 ч свет/12 ч темнота, температура воздуха – 16–22°С, влажность – 30–70%) при свободном доступе к стандартному корму. Данная научно-исследовательская работа рассмотрена на биоэтической комиссии АО НПО «Дом Фармации», одобрена для проведения (№БЭК 1.31/20), выполнена в соответствии с рекомендациями Директивы 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных. Исследование соответствовало принципам «трех R» (Reduction, Refinement, Replacement). Все усилия были направлены на минимизацию страданий животных и сокращение количества используемых животных. Для исключения влияния предпочтений исследователя на формирование экспериментальных групп отбор животных осуществляли при помощи метода модифицированной блочной рандомизации [17, 18].
Анестезия
С целью обеспечения общей анестезии перед моделированием патологии животным внутривенно вводили комбинацию анестетиков Zoletil 100 (Virbac Sante Animale, Франция) в дозе 5 мг/кг и Xyla (Interchemie, Нидерланды) в дозе 1 мг/кг. После наркотизации для оценки глубины анестезии регистрировали наличие рефлексов: межпальцевого, роговичного и пальпебрального.
Моделирование патологии
Дизайн эксперимента и характеристика экспериментальных групп представлены в табл. 1.

Животные всех групп были эвтаназированы на 8-й день эксперимента.
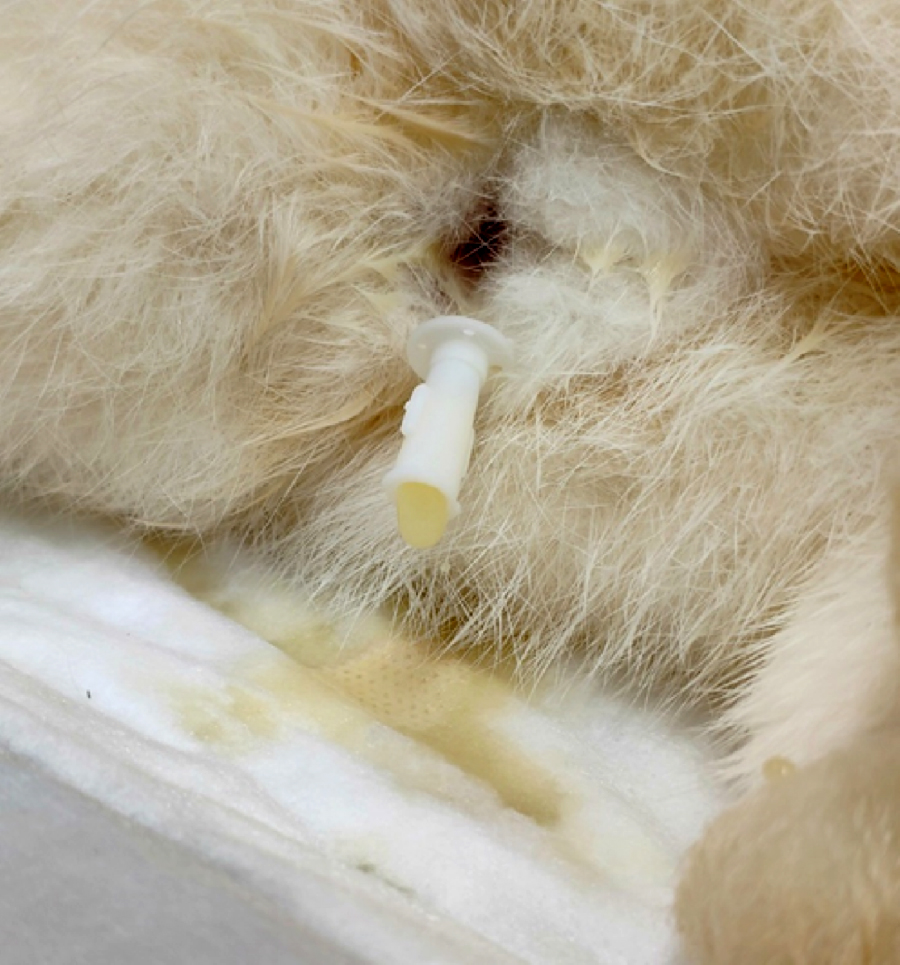
Для отработки модели данной патологии выбран метод химического повреждения слизистой оболочки МП [6, 10–14] с последующим введением в его полость бактериальной взвеси [5]. Моделирование ОБП включало несколько последовательных этапов: катетеризацию МП, повреждение слизистой оболочки МП с помощью химических веществ и заражение бактериальной культурой.
После достижения необходимой глубины анестезии проводили катетеризацию МП с помощью ветеринарных уретральных катетеров Kruuse® с закрытым концом закругленной формы размером 1×130 мм [19]. Уретральный катетер, предварительно смазанный вазелином, аккуратно вводили в мочеиспускательный канал и плавно продвигали до появления мочи, что свидетельствовало о расположении катетера в полости МП (рис. 1). Для дополнительного контроля катетеризации МП проводили ультразвуковое исследование. Уретральный катетер визуализировали в виде гиперэхогенной (светло-серой) полосы на фоне анэхогенного (черного) содержимого МП. После катетеризации МП у всех экспериментальных животных проводили забор образцов мочи для бактериологического и общего клинического анализов в качестве контроля перед индукцией патологии.
В соответствии с информацией, доступной в открытых источниках литературы, бактериальному обсеменению больше подвержены поврежденные ткани [6, 11]. Выбраны 2 схемы химического повреждения слизистой оболочки МП – с помощью спиртового раствора салициловой кислоты (ОАО «Ивановская фармацевтическая фабрика», Россия) в концентрации 0,025 и 0,05% [11] и комбинации 1% раствора протамина сульфата (ПАО «Брынцалов-А», Россия) с 20% раствором мочевины (ОАО «Акрон», Россия) [6]. Салициловая кислота при контакте со слизистой оболочкой приводит к развитию сильного раздражающего действия, в результате чего увеличивается проницаемость сосудов и образуются эрозии слизистой оболочки [11]. По данным литературы [6], применение раствора протамина сульфата и мочевины в комплексе приводит к развитию деэпителизации вплоть до базального слоя эпителия.
Принцип химического повреждения слизистой оболочки заключался в следующем: перед введением химических веществ в полость МП его максимально опорожняли через уретральный катетер. Далее соответствующим группам вводили химические вещества в качестве индукторов патологии (см. табл. 1), уретральный катетер закрывали резиновой крышкой на время экспозиции растворов в полости МП.
Растворы салициловой кислоты вводили в объеме 5 мл на 1 животное, время экспозиции растворов в полости МП составило 5 мин для обеих концентраций [11].
Раствор протамина сульфата и раствор мочевины в объеме по 10 мл вводили последовательно с обязательным промыванием полости МП между введениями химических веществ. Экспозиция для каждого раствора составила 15 мин.
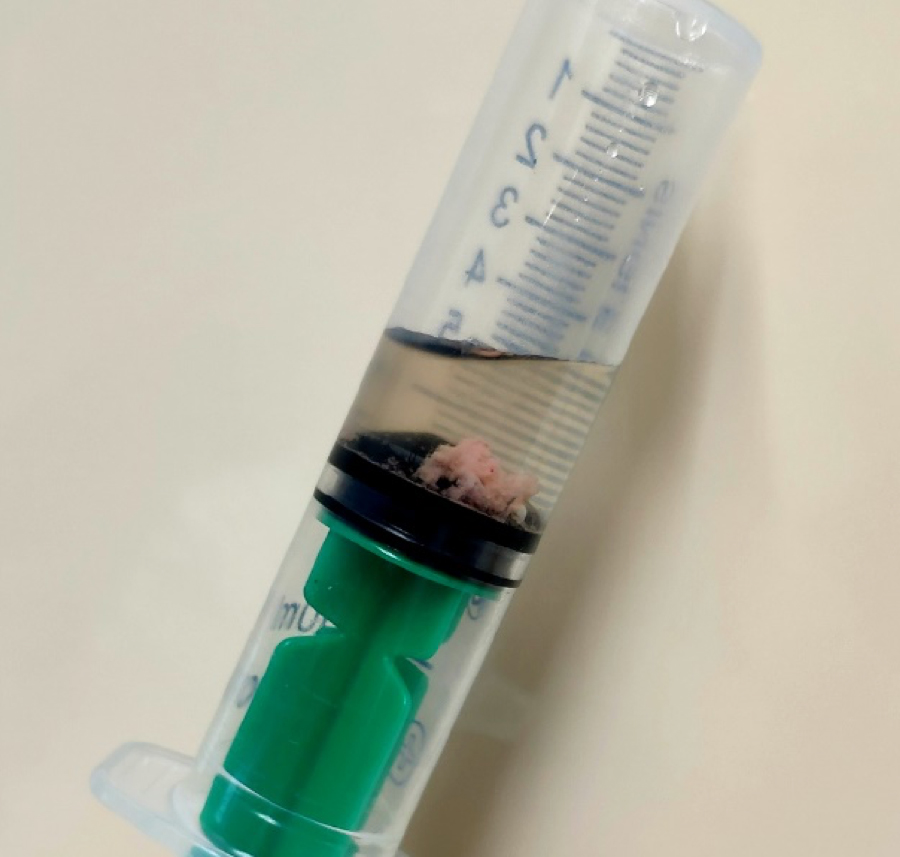
По истечении времени экспозиции химических веществ полость МП обильно промывали физиологическим раствором (50–100 мл). При первом же промывании МП во всех группах с химическим повреждением слизистой оболочки отмечали розовый цвет отведенной жидкости с включениями крови и эпителия (но наиболее выраженно в группе с введением 0,05% раствора салициловой кислоты) (рис. 2). Промывание МП проводили до тех пор, пока жидкость для промывания не становилась прозрачной (без включения крови и эпителия).
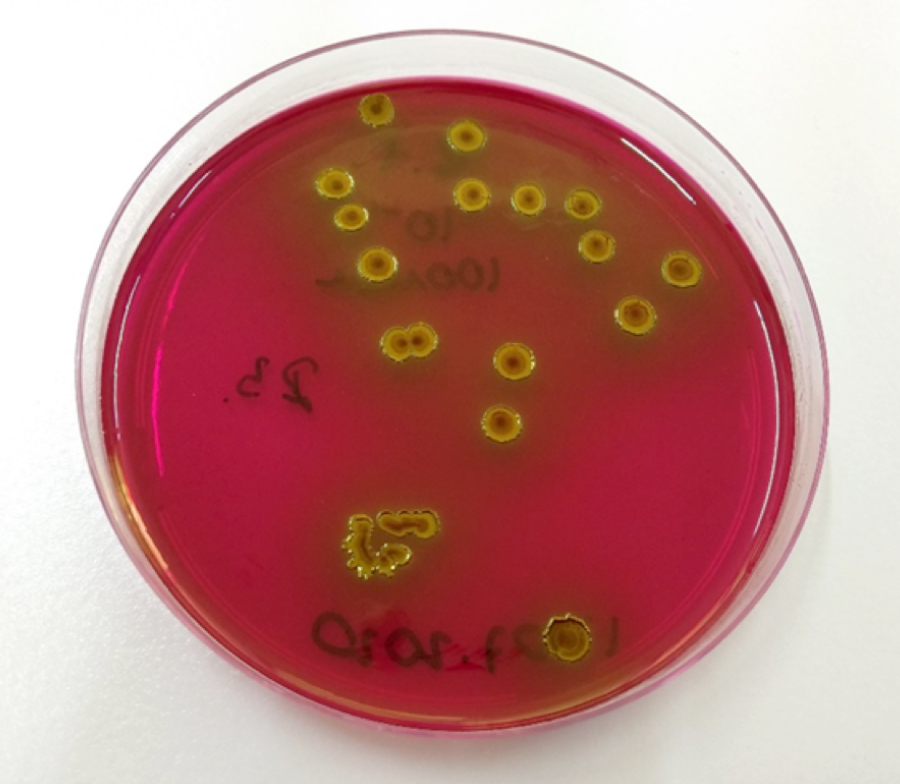
Для инфицирования МП в данном исследовании использовали штамм E. coli ATCC 25922 и образец E. coli, полученный из фекалий кроликов вивария. Фекалии для получения бактериальной культуры отбирали в стерильные пробирки в количестве 1 г за 4 сут до заражения. После отбора образцы кала разводили в физиологическом растворе в соотношении 1:10 до полного растворения. Проводили ряд 10-кратных разведений. Из каждого разведения высевали по 100 мкл на чашку Петри с питательной средой Эндо. Инкубировали посевы при температуре 37°С в течение не менее 20–24 ч. Для приготовления бактериальной суспензии изолированные колонии с характерным для E. coli металлическим блеском (рис. 3) переносили на неселективную среду. Далее посевы инкубировали в термостате при температуре 37°С в течение 20–24 ч. Суспензию готовили в физиологическом растворе (0,9% раствор натрия хлорида) до необходимой концентрации, измеряя ее с помощью денситометра. В день индукции патологии перед заражением лабораторных животных подготавливали суспензию 24-часовой культуры E. coli в концентрации 107 КОЕ/мл. Бактериальную суспензию вводили после последнего промывания физиологическим раствором, предварительно максимально опорожнив полость МП. Через уретральный катетер медленно вводили суспензию в объеме 5 мл на 1 кролика, выдерживали экспозицию 10 мин и аккуратно удаляли катетер из мочеиспускательного канала.
На 8-й день эксперимента после индукции патологии животных эвтаназировали согласно Директиве 2010/63/ ЕС Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. о защите животных, используемых в научных целях [20]. Животных эвтаназировали, применяя летальную дозу анестетика, и удаляли жизненно важные органы. Эвтаназию животных проводил компетентный персонал, поэтому вся процедура сопровождалась минимальными болевыми ощущениями.
Оцениваемые параметры
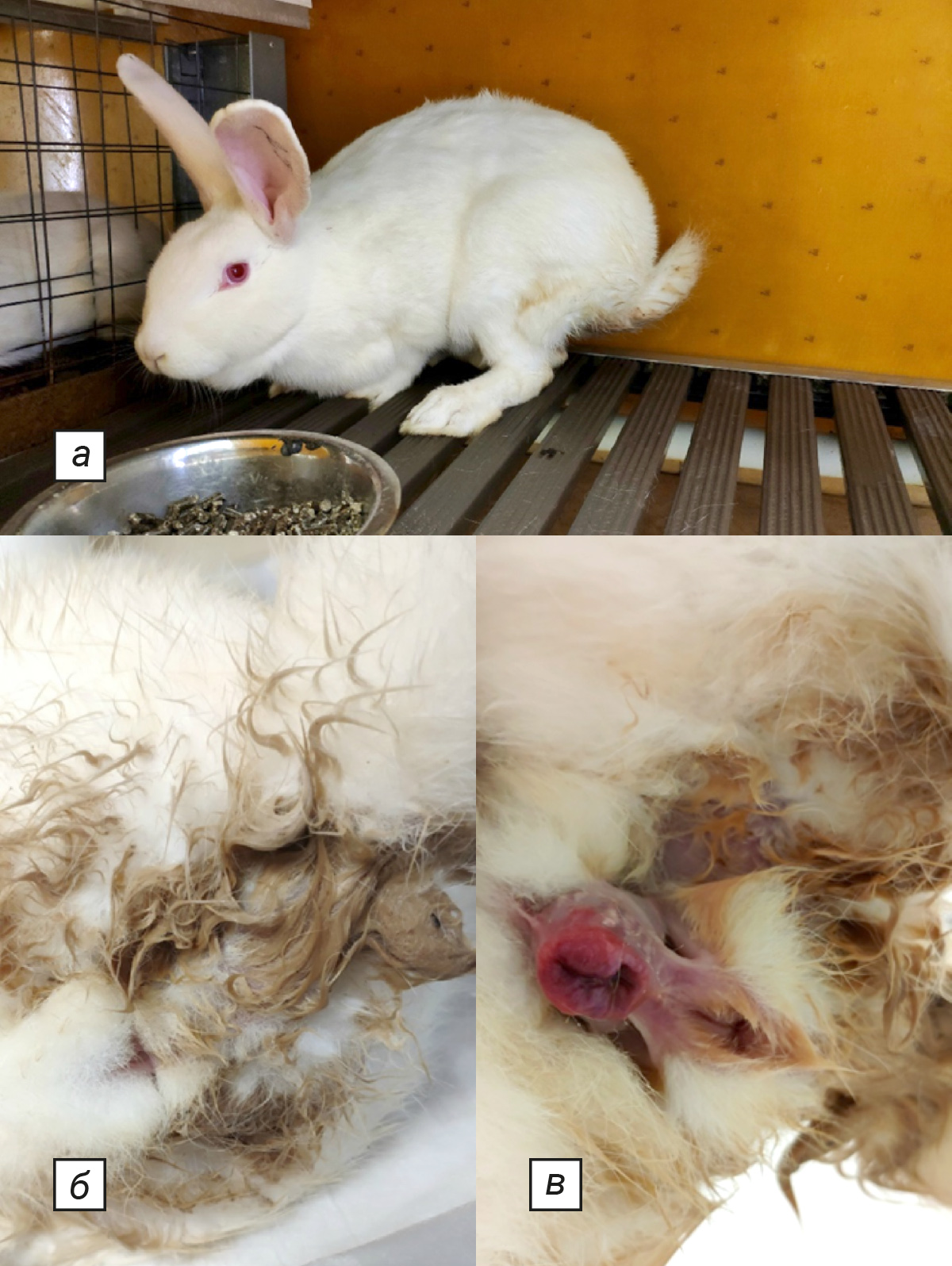
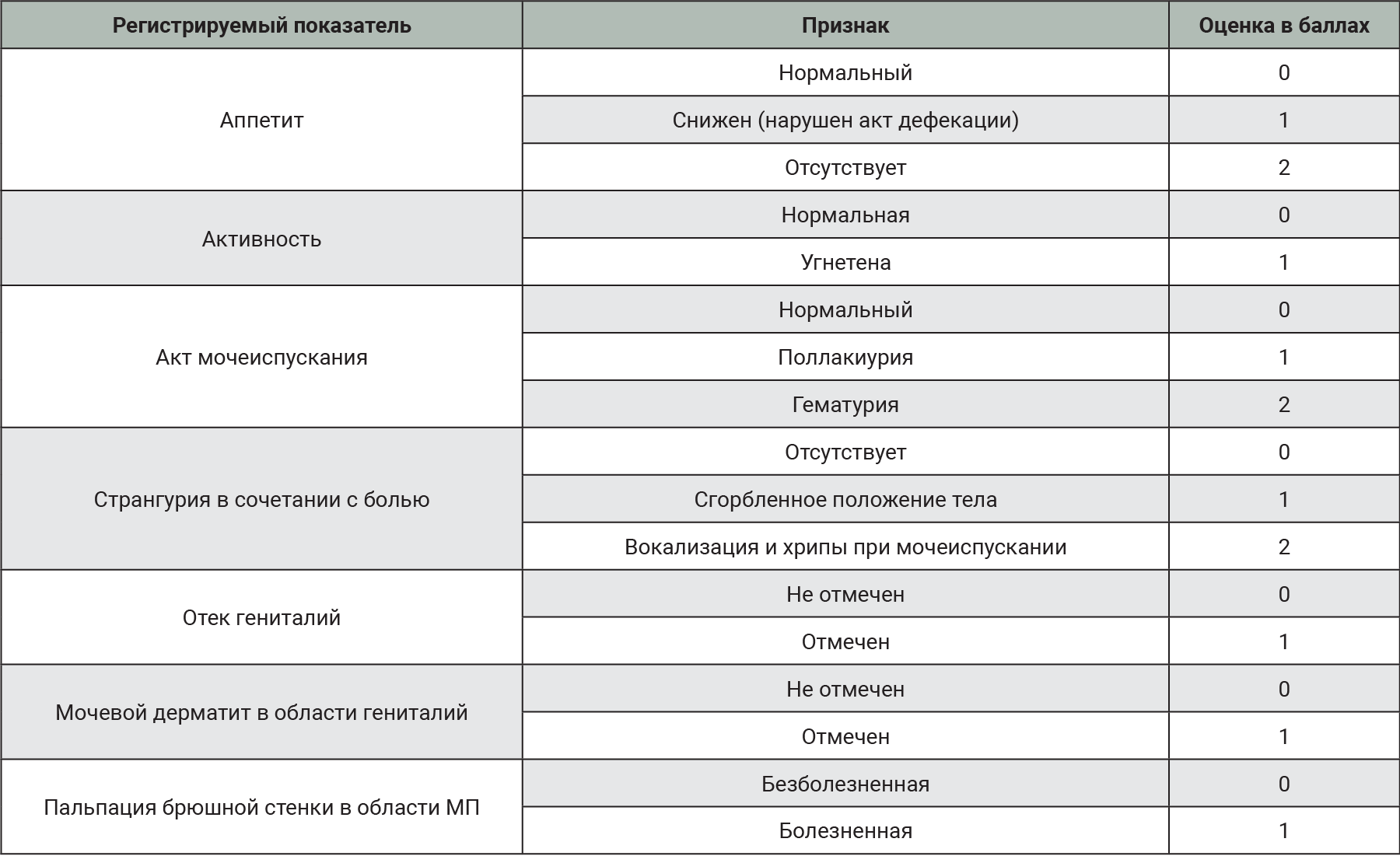
После индукции патологии за животными наблюдали в течение 8 дней, визуально оценивая клинические проявления патологии и боли. В соответствии с данными литературы [21–24] подобран определенный перечень исследуемых клинических признаков, но только некоторые из них развились в ходе данного эксперимента: нарушения аппетита, акта дефекации, активности (угнетение), мочеиспускания (поллакиурия, гематурия), странгурия в сочетании с болевым синдромом (сгорбленное положение тела, вокализация и хрипы), отек гениталий, мочевой дерматит и болезненность при пальпации в области МП (рис. 4). Болезненность при пальпации оценивали по реакции животного, включающей вокализацию и/или напряжение мышц брюшной стенки. Дополнительно оценивали интенсивность проявления боли визуально по шкале Grimace Scale, рекомендованной NC3Rs (National Centre for the Replacement, Refinement and Reduction of animals in Research) [25].
Для удобства оценки выраженности патологического процесса была разработана балльная система оценки для выявленных в ходе эксперимента клинических признаков (табл. 2).
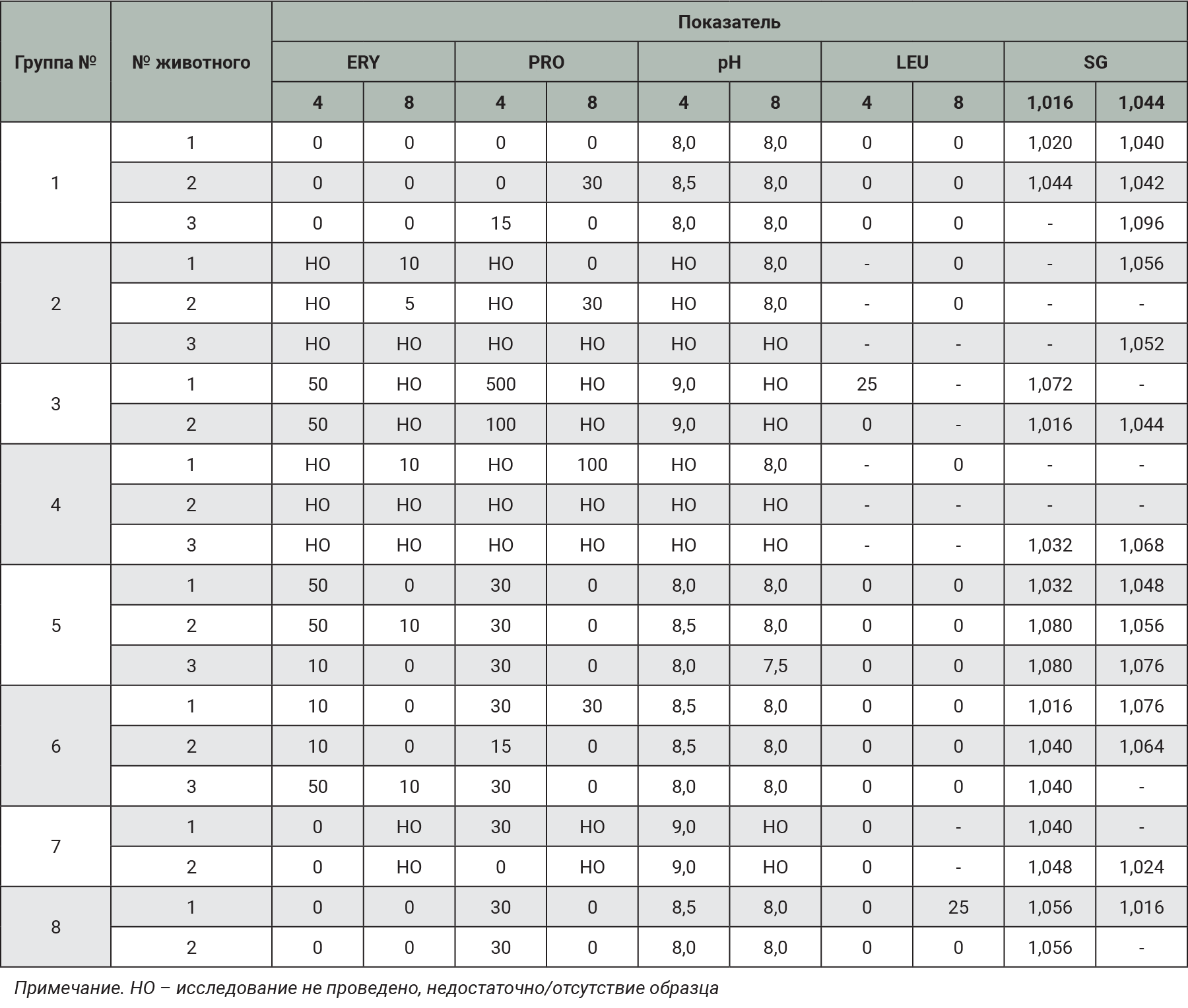
В ходе эксперимента проводили троекратно (до индукции патологии, на 4-й и 8-й день эксперимента) забор образцов мочи для бактериологического и общего клинического анализов. На 4-й день эксперимента образцы мочи получали методом катетеризации МП, на 8-й (во время эвтаназии) – методом цистоцентеза. При бактериологическом анализе в образцах определяли концентрацию возбудителя (КОЕ/мл). Бактериологическое исследование образцов мочи проводили несекторным методом [26], общий анализ мочи – с помощью диагностических тест-полосок LabStrip U-11Plus (физико-химический состав) и рефрактометра (удельный вес мочи). При наличии эритроцитов выполняли дополнительно микроскопический анализ образцов.
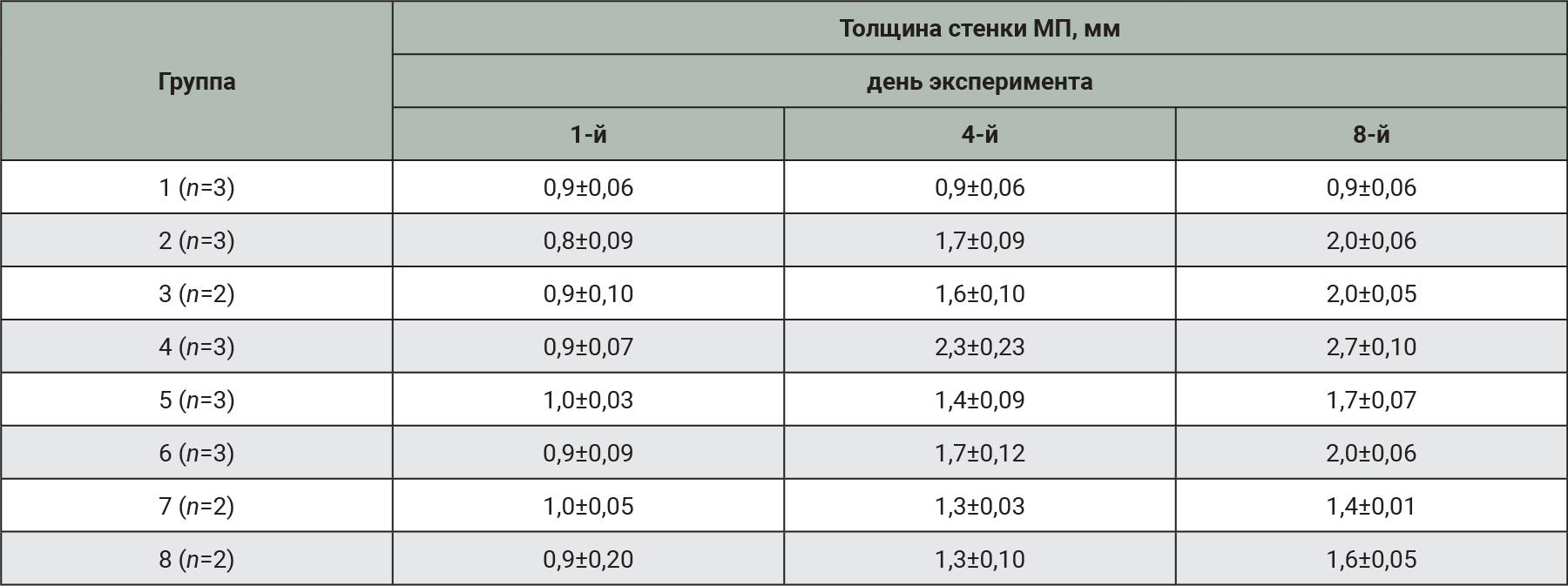
Ультразвуковое исследование также проводили троекратно с помощью аппарата Mindray DP-50 (Mindray, Китай). Оценивали степень наполнения МП, толщину и эхогенность стенок, содержимое полости МП с описанием осадка (при наличии) [27].
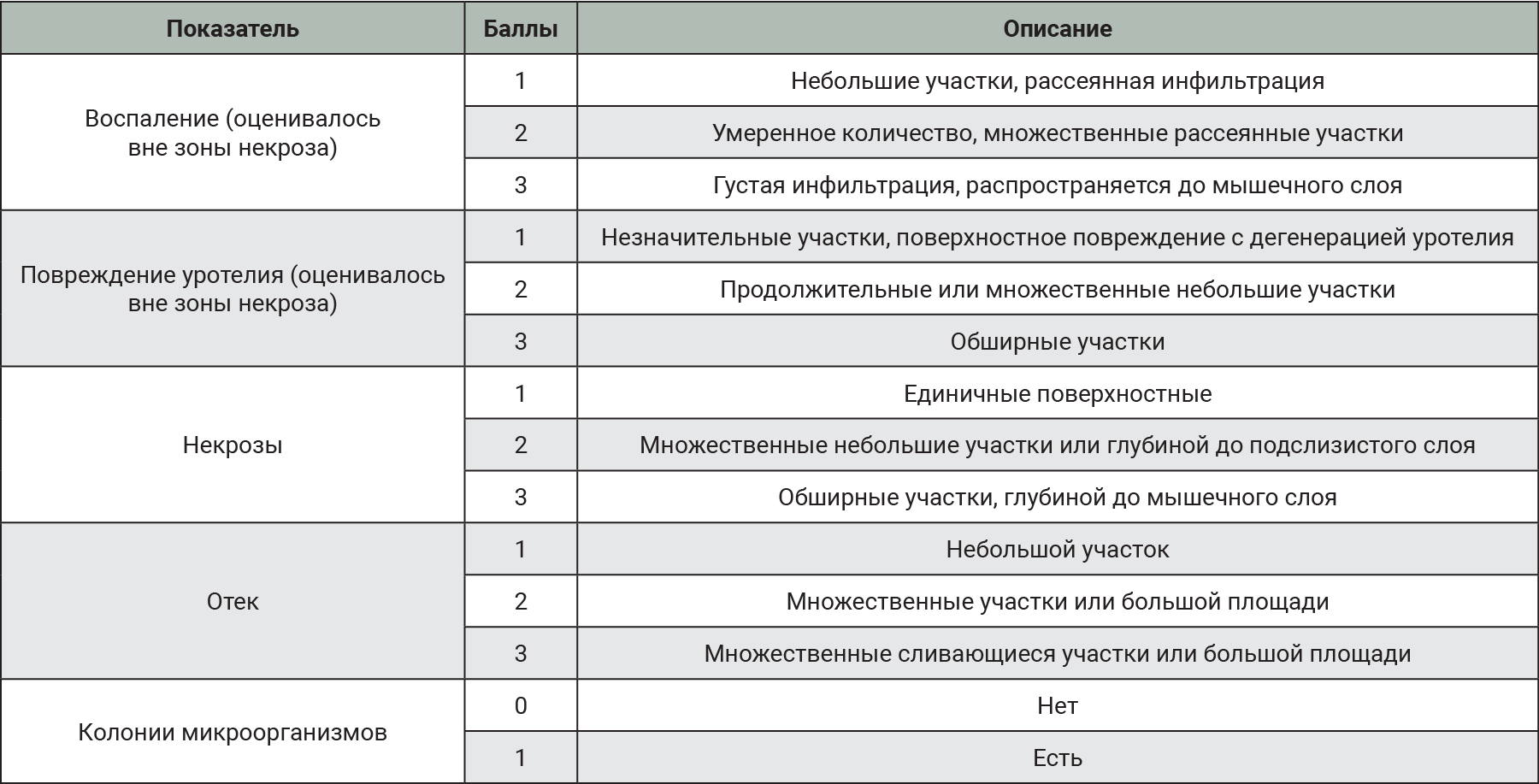
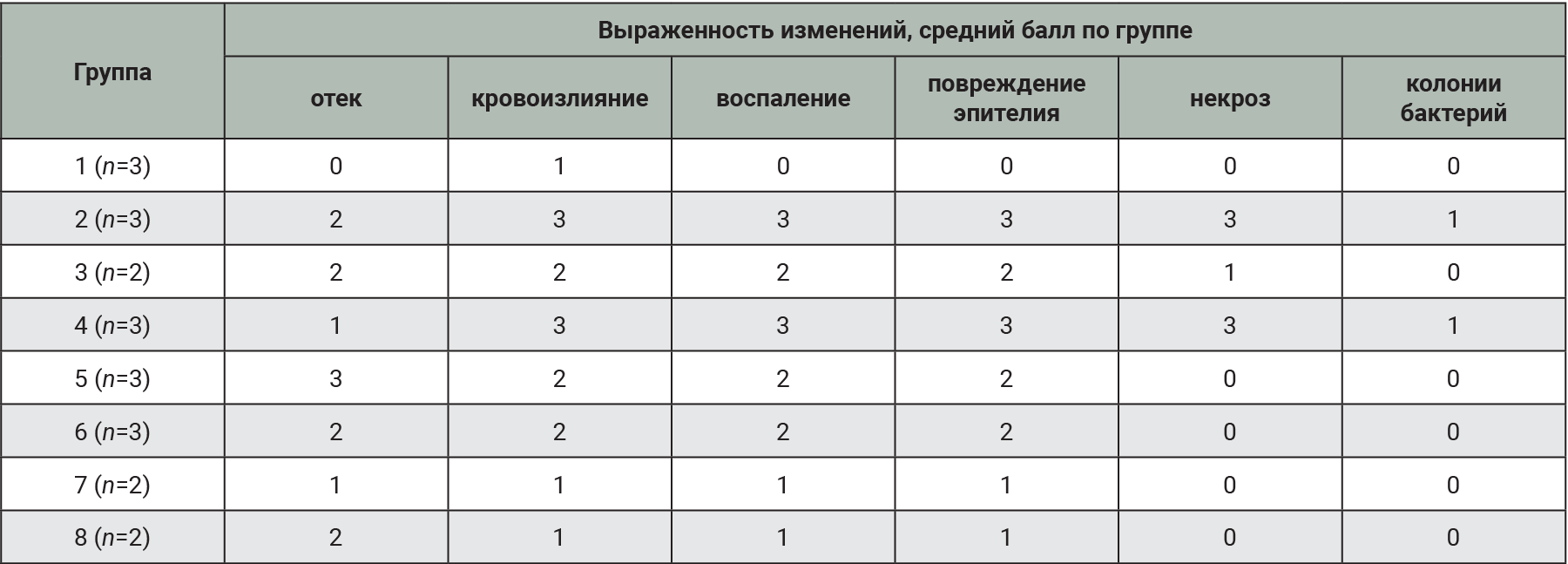
У эвтаназированных животных осуществляли макроскопическую оценку тканей МП и забирали орган для гистологического исследования. Материал фиксировали в 10% растворе нейтрального формалина в течение 24 ч [28], после чего по общепринятой методике заливали в парафин [29]. Степень выраженности повреждения МП оценивали полуколичественно в баллах (табл. 3).
Анализ данных
В связи с небольшой выборкой в исследуемых группах (2–3 животных) данные представлены в виде индивидуальных значений. Степень развития патологии оценивали по тенденциям к увеличению или снижению анализируемых показателей.
Результаты и обсуждение
Результаты оценки клинических проявлений патологии и боли

В ходе эксперимента у животных развились лишь некоторые клинические признаки, подобранные для оценки развития патологии в соответствии с данными литературы. У животных наблюдали нарушения аппетита, акта дефекации, активности (угнетение), мочеиспускания (поллакиурия, гематурия), странгурию в сочетании с болевым синдромом (сгорбленное положение тела, вокализация и хрипы), отек гениталий, мочевой дерматит и болезненность при пальпации в области МП.
Для удобства обработки данных была подсчитана сумма баллов по проявлению клинических признаков патологии у животных (см. табл. 3) и показателям по шкале Grimace Scale (рис. 5). У здорового животного без признаков патологии и боли сумма баллов равна 0. Чем выше сумма баллов, тем более выраженным является проявление патологического процесса (табл. 4).
В группах животных с введением бактериальной суспензии E. coli без предварительного химического повреждения слизистой оболочки МП отмечали единичные случаи клинических проявлений патологии продолжительностью 2–3 дня.
Начиная со 2-го дня после индукции патологии во всех экспериментальных группах с предварительным химическим повреждением слизистой оболочки МП наблюдали выраженное проявление клинических признаков патологии и боли. В данных группах в равной степени по частоте встречаемости клинических признаков среди животных регистрировали такие проявления ОБП, как поллакиурия, странгурия, боль при мочеиспускании, проявляющаяся в принятии животным сгорбленного положения тела, мочевой дерматит, болезненность при пальпации в области МП, изменение формы и положения ушей.
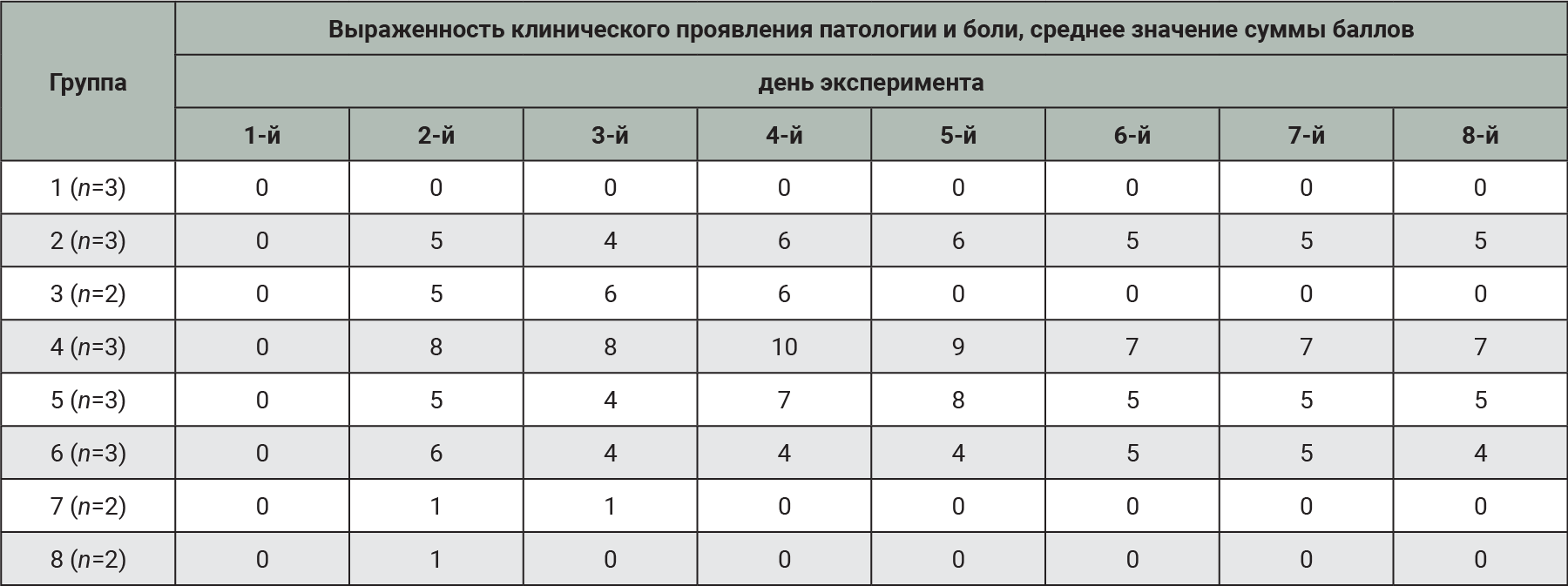
Наиболее выраженные клинические проявления отмечали в группе животных с заражением E. coli из фекалий кроликов и предварительным повреждением слизистой оболочки МП 0,05% спиртовым раствором салициловой кислоты. В отличие от остальных экспериментальных групп у животных данной группы регистрировали гематурию, вокализацию и хрипы во время акта мочеиспускания. У 1 самки кролика на протяжении всего эксперимента сохранялось снижение аппетита, чего не наблюдали в других группах. В данной группе дольше всего регистрировали отек в области гениталий (на протяжении 5 дней). Начиная со 2-го дня эксперимента у всех животных этой группы при визуальной оценке по шкале Grimace Scale наряду с изменением положения и формы ушей отмечали разглаживание щек.
Представление полученных результатов в баллах позволило наглядно определить группы с наиболее выраженными признаками клинического проявления патологии. Исходя из частоты встречаемости клинических признаков среди животных всех экспериментальных групп, можно сделать заключение о том, что пик развития патологического процесса приходится на 4–5-й день после индукции патологии.
Результаты бактериологического исследования образцов мочи
Во всех образцах мочи, полученных у самок кроликов до заражения (1-й день эксперимента), штаммы E. coli не обнаружены (табл. 5).
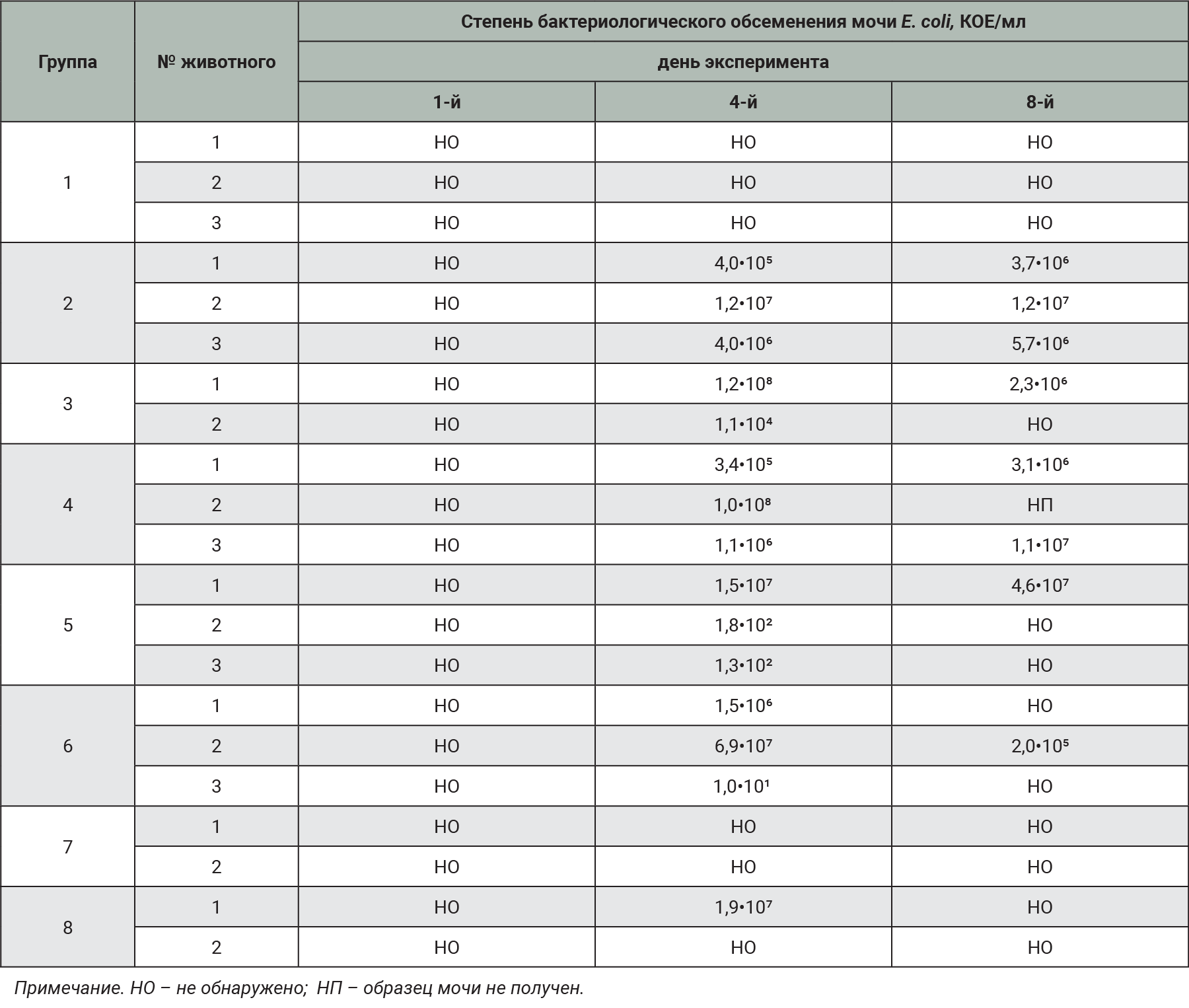
На 4-й день эксперимента после заражения штаммы E. coli выявлены в образцах мочи животных всех групп с химическим повреждением слизистой оболочки МП. Также установлено микробное обсеменение мочи у одной самки кролика в группе № 7, которой вводили бактериальную суспензию из фекалий кроликов без предварительного химического повреждения слизистой оболочки МП. В среднем степень микробного обсеменения была выше в группах животных, в которых в качестве химического агента использовали спиртовой раствор салициловой кислоты (группы № 3, 4 и 8). Самые высокие показатели микробной обсемененности отмечены в группах животных, которым проводили заражение E. coli из фекалий кроликов (самки №3.2 и №8.1). В контрольной группе животных и группе №6 (заражение E. coli ATCC 25922 без химического повреждения) возбудителя не обнаружили.
На 8-й день эксперимента во всех образцах мочи животных групп № 2 и 3, в которых в качестве индуктора патологии использовали 0,05% спиртовой раствор салициловой кислоты, обнаружены колонии E. coli. Степень микробной обсемененности в данных группах либо сохранялась на прежнем уровне, либо повышалась. В группе № 8 (0,025% спиртовой раствор салициловой кислоты + E. coli из фекалий кроликов) только у одной самки кролика сохранилось микробное обсеменение мочи E. coli, причем степень обсеменения понизилась по сравнению с 4-м днем эксперимента. Только у 1 из 3 самок кроликов в каждой из групп, получивших комбинацию 1% раствора протамина сульфата и 20% раствора мочевины (группы № 4 и 5), отмечали сохранение микробной обсемененности мочи. У животных контрольной группы и групп с заражением без предварительного химического повреждения (группы № 6 и 7) штаммы E. coli в образцах мочи не обнаружены.
Таким образом, очевидно, что без предварительного химического повреждения слизистой оболочки МП до введения возбудителя не происходит должного микробного обсеменения (у 1 самки из 4). На 4-й день эксперимента во всех образцах, полученных от самок кроликов с предварительным повреждением слизистой оболочки МП, обнаруживали E. coli. К 8-му дню эксперимента обсемененность сохранялась в большей степени в группах, получивших 0,05% спиртовой раствор салициловой кислоты (группы № 2 и 3).
Результаты клинического исследования образцов мочи
Образцы мочи отбирали в 1-й день эксперимента перед индукцией патологии. Исследуемые показатели мочи у кроликов всех экспериментальных групп находились в пределах референсных значений [30, 31].
На 4-й день эксперимента не у всех самок кроликов удалось отобрать необходимый объем образцов мочи для проведения двух видов исследований: бактериологического и клинического. В первую очередь образец мочи отбирали для бактериологического анализа, оставшуюся часть (при наличии) передавали для клинического. Стоит отметить, что у контрольной группы и в группах с заражением без химического повреждения слизистой оболочки МП (группы № 6 и 7) на протяжении всего эксперимента не возникало трудностей с получением биологических образцов. Чем выраженнее была патология, тем сложнее отобрать образцы мочи у животных. Возможно, это связано с отечностью и воспалением тканей МП.
При развитии патологии наблюдали наличие эритроцитов, повышение уровня белка в исследуемых образцах и изменение плотности мочи (табл. 6). Выявленные изменения могут служить вспомогательным материалом в комплексной оценке развития патологического процесса.
Результаты ультразвукового исследования мочевого пузыря
Ультразвуковая диагностика может служить вспомогательным методом для контроля качества проведенной катетеризации МП и цистоцентеза, ее применение может быть полезно в качестве неинвазивной оценки динамики развития и клинического течения патологии. Полученные результаты свидетельствуют о развитии патологического процесса во всех экспериментальных группах с моделированием патологии (табл. 7). Выраженные патологические изменения обнаружены в группе животных, получивших в качестве индуктора патологии 0,05% спиртовой раствор салициловой кислоты и возбудителя E. coli из фекалий кроликов.
Результаты патоморфологического исследования
При макроскопической оценке выраженные патологические изменения наблюдали в группах с введением 0,05% раствора салициловой кислоты. На поверхности слизистой оболочки отмечали некротические поражения тканей. В группах, получивших комбинацию 1% раствора протамина сульфата и 20% раствора мочевины, наблюдали выраженную инфильтрацию тканей. МП имел студнеобразную консистенцию.
По результатам макроскопического и гистологического исследований (табл. 8) видно, что выраженное повреждение тканей МП вызвано введением в полость органа 0,05% спиртового раствора салициловой кислоты. Отек в большей степени развился в группах, получивших 1% раствор протамина сульфата в комбинации с 20% раствором мочевины, что соответствует данным литературы [6].
Заключение
По результатам оценки клинических проявлений патологии и боли, данным лабораторных исследований образцов мочи (клинический и бактериологический анализы), патоморфологического и ультразвукового исследований была сформирована модель ОБП путем химического повреждения слизистой оболочки МП и введения суспензии E. coli. В соответствии с полученными результатами была разработана балльная система оценки клинического проявления патологии и боли. Выраженное проявление патологического процесса с сохранением клинических признаков патологии и боли, бактериологического обсеменения мочи на протяжении всего эксперимента (8 дней) отмечено у животных группы, получившей в качестве индуктора патологии 0,05% спиртовой раствор салициловой кислоты и суспензию E. coli из фекалий кроликов, что позволяет признать данную схему индукции патологии наиболее успешной.
Вклад авторов
Е.И. Трофимец – идея, анализ и сбор данных литературных источников, участие в проведении эксперимента, сбор и анализ полученных данных, написание и редактирование текста статьи
М.Н. Макарова – концепция и дизайн исследования, редактирование текста статьи, научное консультирование и утверждение окончательного варианта статьи для публикации
К.Е. Боровкова – проведение микробиологического исследования, анализ и учет результатов
Я.А. Гущин – проведение патоморфологического исследования
Ю.В. Салмова – подготовка бактериальной суспензии, проведение микробиологического исследования
Л.Р. Никифорова – подготовка бактериальной суспензии, проведение микробиологического исследования
А.Е. Кательникова – научное консультирование
К.Л. Крышень – научное консультирование
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов
Список источников
- Гяургиев Т.А. Тревожно-депрессивные расстройства у больных с хроническим рецидивирующим бактериальным циститом в стадии обострения // Вестник новых медицинских технологий. Электронное издание. 2013; 1. [Gyaurgiev T. A. Trevozhno-depressivnye rasstrojstva u bol'nyh s hronicheskim recidiviruyushchim bakterial'nym cistitom v stadii obostreniya // Vestnik novyh medicinskih tekhnologij. Elektronnoe izdanie. 2013; 1. (In Russ.)]
- Стручанский Л.С., Рафальский В.В. Клиническое значение и антибактериальная терапия острых циститов // Клиническая антимикробная химиотерапия. 1999; 1 (3): 84–91. [Struchanskij L.S., Rafal'skij V.V. Klinicheskoe znachenie i antibakterial'naya terapiya ostryh cistitov // Klinicheskaya antimikrobnaya himioterapiya. 1999; 1 (3): 84–91. (In Russ.)]
- Амдий Р.Э. Опыт применения канефрона при лечении острого неосложненного цистита у женщин // Урологические ведомости. 2016; 6 (2): 16–21. [Amdij R. E. Opyt primeneniya kanefrona pri lechenii ostrogo neoslozhnennogo cistita u zhenshchin // Urologicheskie vedomosti. 2016; 6 (2): 16-21. (In Russ.)]
- Desnottes J.F. et al. Experimental retrograde pyelonephritis and cystitis induced in rabbits by a group D Streptococcus sp.: serum antibody assay by a hemagglutination test // Infection and immunity. 1981; 33 (3): 647-650. PMID: 6793514
- Pugach J.L. Et al. Antibiotic hydrogel coated Foley catheters for prevention of urinary tract infection in a rabbit model // The Journal of urology. 1999; 162: 3 Part 1: 883-887. DOI: 10.1097/00005392-199909010-00084
- Niku S.D. еt al. A new method for cytodestruction of bladder epithelium using protamine sulfate and urea // The Journal of urology. 1994; 152 (3): 1025-1028. DOI: 10.1016/s0022-5347(17)32648-4
- Шолан Р.Ф. Результаты морфологического анализа стенки мочевого пузыря при интерстициальном цистите/синдроме болезненного мочевого пузыря в эксперименте // Вестник медицинского института «Реавиз»: реабилитация, врач и здоровье. 2019; 5 (41): 36-42. [SHolan R.F. Rezul'taty morfologicheskogo analiza stenki mochevogo puzyrya pri intersticial'nom cistite/sindrome boleznennogo mochevogo puzyrya v eksperimente // Vestnik medicinskogo instituta «Reaviz»: reabilitaciya, vrach i zdorov'e. 2019; 5 (41): 36-42. (In Russ.)]
- Шолан Р.Ф. Сравнительная оценка уровня фактора роста нервов в экспериментальных моделях интерстициального цистита/синдрома болезненного мочевого пузыря // Экспериментальная и клиническая урология. 2019; 3: 178-181. DOI: 10.29188/2222-8543-2019-11-3-178-181 [SHolan R. F. Sravnitel'naya ocenka urovnya faktora rosta nervov v eksperimental'nyh modelyah intersticial'nogo cistita/sindroma boleznennogo mochevogo puzyrya // Eksperimental'naya i klinicheskaya urologiya. 2019; 3: 178-181 (In Russ.)]
- Birder L., Andersson K.E. Animal modelling of interstitial cystitis/bladder pain syndrome // International neurourology journal. 2018; 22: Suppl 1: S3. DOI:10.5213/inj.1835062.531.
- Bagley R.S. The effect of experimental cystitis and iatrogenic blood contamination on the urine protein/creatinine ratio in the dog // Journal of veterinary internal medicine. 1991; 5 (2): 66-70. DOI: 10.1111/j.1939-1676.1991.tb00933.x.
- Senior D.F. Amoxycillin and clavulanic acid combination in the treatment of experimentally induced bacterial cystitis in cats // Research in veterinary science. 1985; 39 (1): 42-46. DOI: 10.1016/s0034-5288(18)31768-5.
- Choi B.H. Mast cell activation and response to tolterodine in the rat urinary bladder in a chronic model of intravesical protamine sulfate and bacterial endotoxin-induced cystitis // Molecular medicine reports. 2014; 10 (2): 670-676. DOI: 10.3892/mmr.2014.2262.
- Fraser M.O. A reliable, nondestructive animal model for interstitial cystitis: intravesical low-dose protamine sulfate combined with physiological concentrations of potassium chloride // Urology. 2001; 57 (6): 112. DOI: 10.1016/s0090-4295(01)01044-5.
- Soler R. Urine is necessary to provoke bladder inflammation in protamine sulfate induced urothelial injury // The Journal of urology. 2008; 180 (4): 1527-1531. DOI: 10.1016/j.juro.2008.06.006.
- Shao Y. Reduction of intercellular adhesion molecule 1 may play a role in anti-inflammatory effect of hyaluronic acid in a rat model of severe non-bacterial cystitis // World journal of urology. 2013; 31 (3): 535-540. DOI: 10.1007/s00345-012-0839-8
- Vysakh A. The influence of tissue antioxidant enzymes and inflammatory cascade in pathology of cystitis: an experimental rat model // Microbial pathogenesis. 2017; 113: 102-106. DOI: 10.1016/j.micpath.2017.10.035
- Altman D.G., Bland J.M. How to randomize // BMJ. 1999; 319: 703-704.
- Bland M. An Introduction to Medical Statistics (Oxford Medical Publications) 3rd edition, Oxford University Press. 2000; 422 р.
- Назарова А.В., Семенов Б: Применение усовершенствованной модели уретрального катетера для профилактики осложнений, возникающих после катетеризации мочевого пузыря у животных. 2019. С.73-75. [Nazarova A. V., Semenov B. S. Primenenie usovershenstvovannoj modeli uretral'nogo katetera dlya profilaktiki oslozhnenij, voznikayushchih posle kateterizacii mochevogo puzyrya u zhivotnyh. 2019. P.73-75. (In Russ.)]
- Директива 2010/63/EU Европейского Парламента и Совета Европейского Союза по охране животных, используемых в научных целях / пер. с англ. Под ред. М.С. Красильщиковой, И.В. Белозерцевой. СПб., 2012. 48 с.
- Sayers I. Approach to preventive health care and welfare in rabbits // In practice. 2010; 32 (5): 190-198. DOI: 10.1136/inp.c2228
- Vennen K.M., Mitchell M. A. Rabbits // Manual of Exotic Pet Practice. WB Saunders, 2009; 375-405.
- Cousquer G. Veterinary care of rabbits with myiasis // In practice. 2006; 28 (6): 342-349. DOI: 10.1136/inpract.28.6.342
- Brown C. Urolithiasis and cystotomy in the rabbit // Lab animal. 2011; 40 (3): 73-74. DOI: 10.1038/laban0311-73
- Rabbit Grimace Scale (RbtGS) Manual. https://www.nc3rs.org.uk/sites/default/files/documents/RbtGS%20Manual.pdf
- Козлов Р: Бактериологический анализ мочи: клинические рекомендации. 2014. 33 с.
- Пенник Д., д’Анжу М.-А. Атлас по ультразвуковой диагностике. Исследования у собак и кошек // М.-А. Д’Анжу. М.: Аквариум-Принт. 2015. 504 с.
- Гущин Я.А., Мужикян А.А. Влияние фиксирующих жидкостей на микроскопическую структуру органов мелких лабораторных животных // Международный вестник ветеринарии. 2014; 3: 88–95. [Gushchin YA.A., Muzhikyan A.A. Vliyanie fiksiruyushchih zhidkostej na mikroskopicheskuyu strukturu organov melkih laboratornyh zhivotnyh // Mezhdunarodnyj vestnik veterinarii. 2014; 3: 88–95. (In Russ.)]
- Мужикян А.А., Макарова М.Н., Гущин Я.А. Особенности гистологической обработки органов и тканей лабораторных животных // Международный вестник ветеринарии. 2014; 2: 103–109. [Muzhikyan A.A., Makarova M.N., Gushchin YA.A. Osobennosti gistologicheskoj obrabotki organov i tkanej laboratornyh zhivotnyh // Mezhdunarodnyj vestnik veterinarii. 2014; 2: 103–109.]
- Gallego M. Laboratory reference intervals for systolic blood pressure, rectal temperature, haematology, biochemistry and venous blood gas and electrolytes in healthy pet rabbits // Open veterinary journal. 2017; 7 (3): 203–207. DOI: 10.4314/ovj.v7i3.1
- Lippi I. et al. Evaluation of glomerular filtration rate estimation by means of plasma clearance of iohexol in domestic rabbits (Oryctolagus cuniculus) // American journal of veterinary research. 2019; 80: 6: 525–532. DOI: 10.2460/ajvr.80.6.525




