Влияние фиксирующих растворов на степень выраженности артифициальных изменений сетчатки и сосудистой оболочки в гистологических срезах глаза кролика
Устенко Ж.Ю., Петлицкая С.C., Гущина С.В., Гущин Я.А. , Макарова М.Н. Влияние фиксирующих растворов на степень выраженности артифициальных изменений сетчатки и сосудистой оболочки в гистологических срезах глаза кролика. Лабораторные животные для научных исследований. 2022; 1. https://doi.org/10.29296/2618723X-2022-01-04
Резюме
Кроликов часто выбирают в качестве животных-моделей для изучения патологии глаз, в том числе сетчатки и сосудистой оболочки. Фиксация глазного яблока кролика – сложная задача, кроме того, в процессе фиксации в нем возникает большое количество артифициальных изменений. На частоту встречаемости и степень выраженности артефактов влияет множество факторов: процедура отбора глазного яблока, вид фиксирующей жидкости, метод вырезки. К наиболее часто встречающимся артефактам при исследовании гистологических срезов глаз кроликов относятся отслойка нейроретины от пигментного эпителия, расслоение сосудистой оболочки, отслойка сосудистой оболочки от склеры, пузырчатые «выпячивания» нейроретины в направлении стекловидного тела. В данном исследовании представлен результат оценки влияния типа фиксирующей жидкости на выраженность основных артефактов в сетчатке и сосудистой оболочке глаз кроликов. Bсследовано влияние 4 видов фиксирующей жидкости: 10% нейтрального формалина, раствора Дэвидсона, свежеприготовленного 4- и 2% раствора параформальдегида.
При макроскопическом исследовании отслойку сетчатки отмечали во всех образцах, наибольшая выраженность которой макроскопически определялась в образцах, фиксированных в 10% растворе формалина. Гистологическое исследование в образцах, фиксированных в свежеприготовленном 2% растворе параформальдегида, показало наиболее сильно выраженную отслойку нейроретины от пигментного эпителия (p=0,0009). В образцах, фиксированных в 10% растворе нейтрального формалина, наблюдали наиболее сильно выраженную расслойку сосудистой оболочки (p=0,0004). Статистически значимого влияния вида фиксатора на степень выраженности отслоения сосудистой оболочки от склеры не обнаружено (p=0,0750). Артефакт «выпячивания» нейроретины был однократно зафиксирован во всех группах, кроме той, где использовался фиксированный в 2% растворе параформальдегид. Установлена зависимость между осмоляльностью фиксирующего раствора и выраженностью расслоения сетчатки в гистологических срезах. Коэффициент корреляции Спирмена 0,556 (p<0,05). Статистически значимой зависимости между осмоляльностью фиксирующего раствора и выраженностью остальных артифициальных изменений не обнаружено. Коэффициент корреляции Спирмена составил -0,218 и -0,148 соответственно (p>0,05).
Введение
Кролики часто используются в доклинических исследованиях как модель для формирования патологии глаза (в частности, сетчатки, слезных желез, век) и последующей оценки действия лекарственных препаратов [1–3]. Глазное яблоко для исследования обычно фиксируется целиком [4]. Вследствие процедуры отбора, фиксации и вырезки в готовых гистологических препаратах глаз кроликов часто обнаруживаются артифициальные изменения [5], которые могут привести к необъективным выводам [6]. Важно учитывать эти особенности при подготовке дизайна исследования, выборе фиксирующей жидкости, методики вырезки и микроскопической оценке.
Основная цель фиксации тканей, отобранных во время вскрытия, – предотвращение аутолиза посредством инактивации аутолитических ферментов [7]. При этом важно максимально, насколько это возможно, сохранить морфологию клеток и их анатомическое взаимоотношение. Кроме того, процедура фиксации уплотняет ткани, позволяя более точно и ровно проводить вырезку материала, что особенно важно для препаратов глаз [7, 4]. На результат фиксации влияет множество факторов: физико-химические свойства фиксатора, его объем, время и температура инкубации [8], а также осмоляльность раствора [6, 7].
Рекомендуемый объем фиксатора для образцов глаз, по данным разных исследователей, должен быть в 5–20 раз больше по сравнению таковым глазного яблока [8]. Необходимое время фиксации также разнится в литературе [6, 7] от 4 до 48 ч. Наиболее часто ткани предлагают фиксировать в течение ≥24 ч [8]. Некоторыми авторами [6] указано, что для достаточной фиксации в растворе формальдегида требуется ≥1 нед. Среди фиксаторов наиболее часто используют 10% раствор нейтрального формалина, растворы Дэвидсона [8] и Боуэна, глутаральдегид, смесь глутаральдегида и фомальдегида [6, 7].
Чаще всего встречаются артефакты, связанные с процедурой фиксации и изготовления препарата, при исследовании сетчатки и сосудистой оболочки отмечаются отслойка нейроретины от пигментного эпителия сетчатки, расслоение сосудистой оболочки, отслойка сосудистой оболочки от склеры. У кроликов также наблюдаются пузырчатые «выпячивания» нейроретины в направлении стекловидного тела в связи с его тракцией из-за натяжения во время фиксации [5].
Наиболее часто к отслоению сетчатки в образцах приводит фиксация в 10% формалине [5, 6]. Это связывают с необходимостью длительной фиксации и сокращением передней камеры глаза и стекловидного тела вследствие высокой осмоляльности раствора [7]. Уменьшение объема этих структур механически ведет к частичной отслойке сетчатки. В некоторых исследованиях фиксация в смеси 1,25% глутаральдегида с 1% формальдегидом по сравнению с 10% формалином приводила к лучшим результатам [6, 7]. Сообщается также, что раствор Дэвидсона обеспечивает хорошую фиксацию целых глазных структур за счет более быстрого проникновения в ткани, обусловленного присутствуем спиртового компонента в фиксаторе [8–10]. Однако по данным некоторых авторов [5], фиксация в растворе Дэвидсона >48 ч также может приводить к появлению описанных артефактов. Несмотря на преимущества глутаральдегида и раствора Дэвидсона, их использование может ограничить для некоторых конкретных маркеров дальнейшее проведение иммуногистохимического исследования [6, 11], что следует учитывать при выборе раствора-фиксатора для исследования.
Цель исследования – определить выраженность основных артифициальных изменений сетчатки и сосудистой оболочки глаз кроликов при различных типах фиксации и оценить влияние фиксирующей жидкости на степень их проявления.
Материал и методы
Для исследования использовался биологический материал, полученный от лабораторных кроликов, задействованных в качестве интактных животных в доклинических исследованиях, проведенных в январе–ноябре 2021 г. В этих научных работах не предполагалось изучение глазных яблок, следовательно, забор биологического материала не влиял на их качество и достоверность. Таким образом, специально для данного исследования животные не выделялись. В анализ включали самцов и самок кроликов породы белый великан (питомник КФХ «Нера», Россия) в возрасте 12–15 нед. Общее количество животных 16, число исследуемых образцов – 32 (оба глаза от каждого животного). В исследованиях животные содержались группами по 2 особи одного пола в стандартных условиях: температура – 5–22°C, относительная влажность воздуха – 46–65%. Световой режим составил 12 ч света и 12 ч темноты. Кролики получали корм, приготовленный согласно ГОСТу 32897-2014 «Межгосударственный стандарт. Комбикорма для пушных зверей, кроликов, нутрий. Общие технические условия». Воду животные получали ad libitum. Животных подвергали эвтаназии согласно Директиве 2010/63/ ЕС [12] путем передозировки анестетика, после которой удаляли жизненно важные органы.
Энуклеация глазного яблока
У животных предварительно удаляли кожу век, затем пинцетом удерживали соединительную ткань периорбиты в области внутреннего угла глаза и изогнутыми ножницами разрезали ее по окружности глаза. Продолжая удерживать пинцетом глазное яблоко за ткани периорбиты, ножницами перерезали мышцы глазного яблока, нерв, сосуды и окружающие глаз мягкие ткани. После извлечения глазного яблока аккуратно удаляли оставшиеся на глазном яблоке окружающие ткани. В течение процедуры старались минимизировать давление на глазное яблоко и его растяжение.
Фиксация
Для фиксации использовали 4 фиксирующих жидкости: 10% раствор нейтрального формалина (n=8) (ООО «Лабико», Россия), свежеприготовленные 2% и 4% растворы параформальдегида (n=8), раствор Дэвидсона (n=8). Раствор Дэвидсона готовили по следующей схеме: 2 части формальдегида технического, 3 части заменителя абсолютированного спирта «Дэол», 1 часть ледяной уксусной кислоты и 3 части дистиллированной воды; 4% раствор параформальдегида готовили по протоколу, представленному в табл. 1 [13], 2% раствор параформальдегида – аналогично 4% раствору, кратно уменьшив количество параформальдегида.

Энуклеированный глаз помещали в фиксирующую жидкость целиком без дополнительных манипуляций. Во всех случаях соотношение объема ткани и раствора составляло ≈ 1:10. Время фиксации образцов до вырезки составляло 48 ч.
Вырезка
Глазное яблоко разрезали поперек за лимбом. Таким образом, роговица, передняя камера глаза и хрусталик были отделены от основной части стекловидного тела и диска зрительного нерва. Разрез делали микротомными лезвиями MX35 Premier+ (Thermo Scientific, США), аккуратно, избегая сдавливания глазного яблока для предотвращения отслойки сетчатки. Далее, визуализируя интересующие на сетчатке области, вырезали образцы в виде полосок на всю толщину стенки глаза шириной ≤4 мм и помещали в кассету. Во время вырезки образцов проводили макроскопическую оценку на предмет видимого отслоения сетчатки. Области видимой отслойки не отбирали для исследования.
Проводка, заливка и изготовление срезов
Все образцы подвергали стандартной гистологической проводке, осуществляли дегидратацию в батарее изопропиловых спиртов восходящей концентрации, пропитывание в расплавленном парафине, заливку в парафиновые блоки. Во время заливки образцы ориентировали таким образом, чтобы в срез попали все слои стенки глаза. Перенос материала выполняли максимально аккуратно, стараясь фиксировать пинцет на краю образца и избегая сильного давления. Полученные парафиновые блоки охлаждали и разрезали на кусочки толщиной 2–4 мкм на ротационном микротоме Accu-Cut® SRM™ 200 (Sakura, Нидерланды). Срезы после нарезки сушили, окрашивали гематоксилином и эозином, затем помещали под покровное стекло и исследовали при помощи световой микроскопии.
Оценка выраженности артефактов
В каждом полученном образце определяли выраженность следующих артефактов: отслойку нейроретины от пигментного эпителия, расслоение сосудистой оболочки, отслоение сосудистой оболочки от склеры, «выпячивания» нейроретины в направлении стекловидного тела. Кроме «выпячиваний» нейроретины, оценивали степень выраженности каждого артефакта: его отсутствие на всей площади среза – 0 баллов; артефакт распространяется на 1–25% площади образца – 1 балл; на 26–50% – 2 балла, на 51–75% – 3 балла, на 76–95% – 4 балла, ≥96% площади образца – 5 баллов. Артефакт «выпячивания» нейроретины оценивали как «+» (присутствует в образце) или «-» – не выявлен.
Измерение осмотической концентрации фиксирующих растворов
Измерение осмотической концентрации проводили криоскопическим методом при помощи осмометра-криоскопа ОСКР-1 (Россия).
Статистическая обработка данных
Статистический анализ полученных данных выполняли с помощью пакета программы GraphPad Prism 9. Данные представлены в виде значений медианы (Me) и 1-го и 3-го квартилей (Q1:Q3). Сравнение полученных данных проводили, используя критерий Краскела–Уоллиса с последующим апостериорным анализом (критерий Данна). Оценку влияния осмоляльности фиксирующего раствора на выраженность артифициальных изменений проводили, применяя коэффициент ранговой корреляции Спирмена.
Результаты и обсуждение
Макроскопически видимая отслойка сетчатки регистрировалась во всех образцах. В рамках данной работы не проводили полуколичественную оценку степени выраженности макроскопически видимой отслойки, однако во время вырезки обратили внимание на то, что отслойка сетчатки является наиболее значительной в образцах, фиксированных в 10% растворе нейтрального формалина. Отслойка была менее значительной в образцах, фиксированных в свежеприготовленных в 4 и 2% растворах параформальдегида и растворе Дэвидсона.
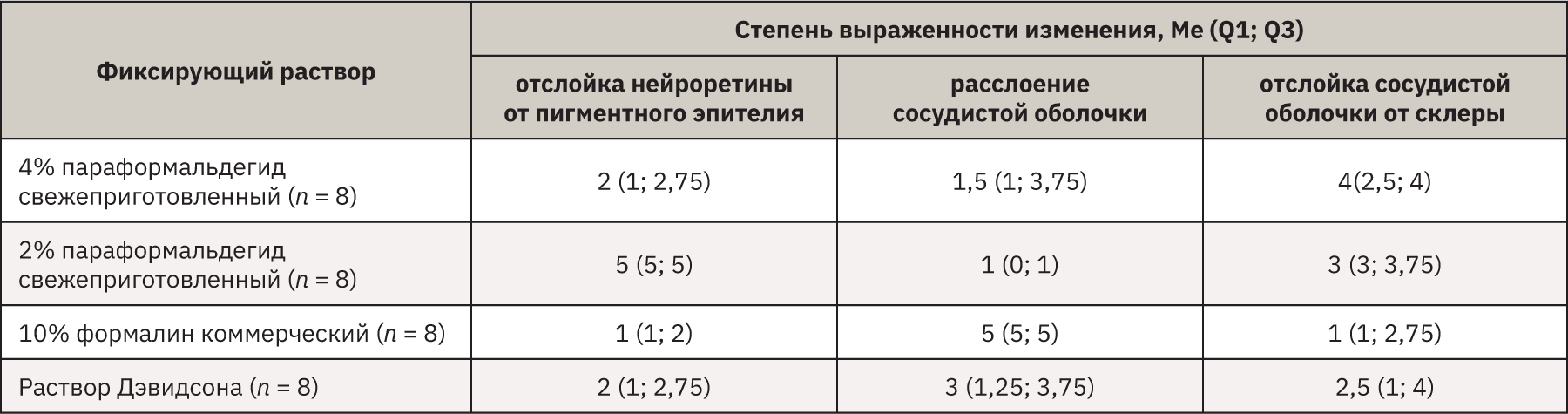
Отслойка нейроретины от пигментного эпителия разной степени выраженности наблюдалась во всех образцах. Преимущественно фиксировали отслойку на уровне фотосенсорной зоны (рис. 1, а), но также встречали образцы с отслойкой на уровне наружного ядерного слоя (рис. 1, б). В группе, фиксированной 2% параформальдегидом, степень изменения была наибольшей. Сводные данные о артефактах представлены в табл. 2. Обнаружено статистически значимое влияние используемого фиксатора на степень выраженности отслойки нейроретины (p=0,0009). При апостериорном сравнении было выявлено статистически значимое отличие группы, фиксированной в 2% растворе параформальдегида, от остальных групп. Статистически значимых различий между группами, фиксированными в растворе Дэвидсона, 10% формалина и свежеприготовленного 4% формальдегида не обнаружено.
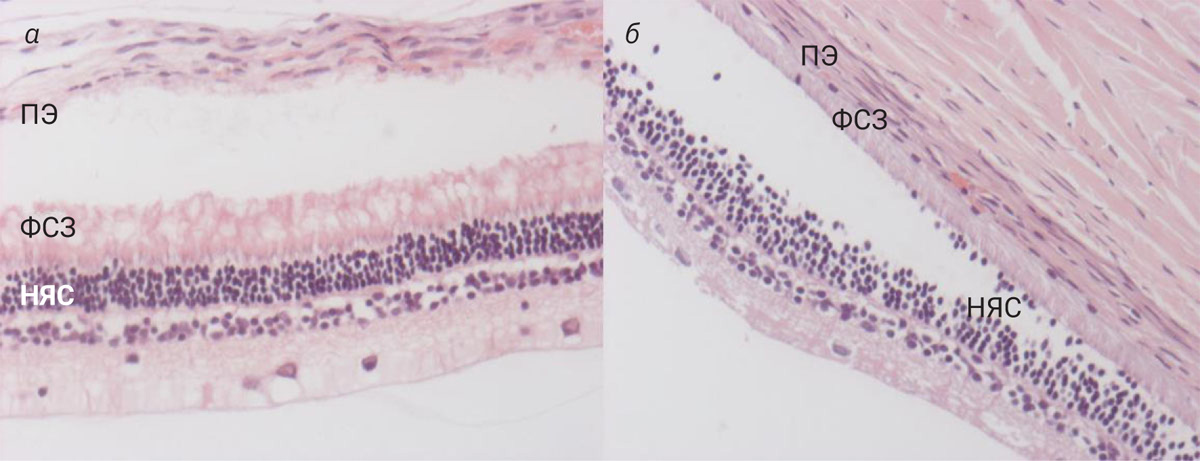
Наиболее сильное расслоение сосудистой оболочки (рис. 2, а) наблюдалось среди гистологических срезов глаза кролика, фиксированных 10% формалином (табл. 2). Обнаружено статистически значимое влияние используемого фиксатора на степень выраженности расслоения сосудистой оболочки (p=0,0004). При последующем апостериорном сравнении установлены статистически значимые различия между группой, фиксированной в 10% формалине и в свежеприготовленном 4% растворе параформальдегида, а также в 10% формалине и в свежеприготовленном 2% растворе параформальдегида. Статистически значимых различий между срезами, фиксированными в растворе Дэвидсона, и остальными не обнаружено.
Статистически значимого влияния вида фиксатора на степень выраженности отслоения сосудистой оболочки от склеры (рис. 2, б) не обнаружено (p=0,0750). Артефакт «выпячивания» нейроретины (рис. 2, в) был однократно обнаружен во всех группах, кроме срезов, фиксированнх в 2% растворе параформальдегида.
В табл. 3 представлены данные осмотической концентрации фиксирующих растворов. Данные осмотической концентрации раствора Дэвидсона представлены в виде значений, описанных в литературе [14], в связи с превышением показателей порога измерения прибора, используемого в нашем исследовании.

Обнаружена прямая статистически значимая зависимость между осмоляльностью фиксирующего раствора и степенью расслоения сетчатки в гистологических срезах. Коэффициент корреляции составил 0,556 (p<0,05). Статистически значимой зависимости между осмоляльностью фиксирующего раствора и выраженностью остальных артифициальных изменений (отслоение нейроретины от пигментного эпителия и сосудистой оболочки от склеры) не обнаружено. Коэффициент корреляции составил 0,218 и -0,148 соответственно (p>0,05).
Заключение
Подготовка глаз кроликов для гистологического исследования – сложная задача. Чувствительность к малейшим физическим воздействиям во время отбора, невозможность работать с материалом в нативном, нефиксированном виде и отсутствие идеального фиксатора вынуждают исследователей примиряться с множеством артефактов, возникающих при оценке срезов глазного яблока.
По результатам нашего исследования, ни один из фиксирующих растворов не позволяет избежать артифициальных изменений полностью. Однако использование 2% раствора параформальдегида привело к наибольшей по сравнению с другими видами фиксаторов отслойке нейроретины от пигментного слоя. Данные результаты не согласуются с данными ряда других исследователей [6, 7] о положительном влиянии снижения осмоляльности фиксирующего раствора на качество получаемого препарата. Вероятно, это может быть связано с действием, как и в нашем случае, других факторов, следовательно, при гистологической обработке тканей глаз в зависимости от целей исследования следует также учитывать методику отбора и вырезки.
По данным нашего исследования, 2 и 4% растворы параформальдегида связаны с лучшей фиксацией сосудистой оболочки и меньшим ее расслоением по сравнению с коммерчески доступным готовым 10% нейтральным формалином. В случае воспроизводимости данного результата в условиях других лабораторий эти фиксаторы могут быть рекомендованы для фиксации глаз кроликов при моделировании патологии сосудистой оболочки.
Ни один из фиксаторов не был лучше других по степени выраженности отслойки сосудистой оболочки от склеры.
Артефакт «выпячивания» нейроретины не наблюдался в образцах, фиксированных в 2% растворе параформальдегида, что может быть связано с меньшей осмоляльностью раствора и, следовательно, меньшим сжатием стекловидного тела. Однако частота встречаемости данного изменения в группах, фиксированных другими растворами (единичные случаи), не позволяет провести статистическую обработку и сделать достоверный вывод о влиянии вида фиксатора на встречаемость данного артефакта.
В результате нашего исследования не отмечено значимой разницы между влиянием фиксации в 10% нейтральном формалине и растворе Дэвидсона. Данные фиксаторы могут использоваться наравне как доступные для рутинной практики. В зависимости от целей исследования может быть сделан выбор в пользу одного из них. Так, мы обратили внимание, что раствор Дэвидсона обеспечивает большее уплотнение тканей глаза и делает более удобной вырезку материала. Раствор Дэвидсона обладает также более быстрым проникновением в ткани и, следовательно, его использование позволяет сократить время фиксации при необходимости. Однако по сравнению с ним 10% раствор формалина более доступен и позволяет выявить большее количество белков при проведении иммуногистохимической реакции.
Обнаружена прямая зависимость между осмоляльностью фиксирующего раствора и выраженностью расслоения сосудистой оболочки. Расслоение было выражено сильнее в растворах, имеющих большую осмоляльность. Значимое влияние осмоляльности фиксаторов на выраженность других исследованных артифициальных изменений не установлено.
Таким образом, по результатам нашего исследования, для фиксации глаз может быть выбран любой из указанных фиксаторов. Выбирая фиксирующий раствор, можно ориентироваться на особенности каждого из них. Однако стоит помнить о неизбежном возникновении артифициальных изменений и адекватно оценивать их при гистологическом исследовании.
Вклад авторов
Ж.Ю. Устенко – дизайн исследования, выполнение экспериментальной части, сбор и систематизация материала, написание текста статьи, подготовка фотоматериалов для статьи.
С.C. Петлицкая – выполнение экспериментальной части, сбор и систематизация материала.
С.В. Гущина – анализ и статистическая обработка данных.
Я.А. Гущин – идея, концепция исследования, редактирование текста статьи.
М.Н. Макарова – редактирование и утверждение окончательного варианта статьи для публикации.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Список источников
- Singh S, Sharma S, Basu S. Rabbit models of dry eye disease: Current understanding and unmet needs for translational research// Exp Eye Res. -2021. -206:108538. doi: 10.1016/j.exer.2021.108538
- Suetov AA, Boiko EV, Alekperov SI, Odinokaya MA, Kostina AA. Modeling of Retinal Degeneration// Bull Exp Biol Med. -2021 – Vol.171, №2. P. 286-291. doi: 10.1007/s10517-021-05213-4
- Moon SW, Sun Y, Warther D, Huffman K, Freeman WR, Sailor MJ, Cheng L. New model of proliferative vitreoretinopathy in rabbit for drug delivery and pharmacodynamic studies// Drug Deliv. -2018. –Vol.25, №1. P. 600-610. doi: 10.1080/10717544.2018.1440664.
- Folberg R., Campbell J.R., Guzak S.V., Luckenbach M., Margo C. E., Proia A. D., Schachat A. P. Basic and Clinical Science Course, Section 4, Ophthalmic Pathology and Intraocular Tumors //American Academy of Ophthalmology. -1991. -San Francisco. – 242 p.
- Sorden SD, Larsen T, McPherson LE, Turner OC, Carroll EE, Sharma AK. Spontaneous background and procedure-related microscopic findings and common artifacts in ocular tissues of laboratory animals in ocular studies // Toxicologic Pathology. – 2021. – Vol.49, №3. – P.569-580. doi:10.1177/0192623320966244.
- Nassar K, Lüke J, Lüke M, Kamal M, Soliman MM, Grisanti S, Grisanti S. Effect of different fixative solutions on eyes with experimental proliferative vitreoretinopathy // International Journal of Experimental Pathology. – 2015. – Vol. 96, №2. –P.103–110. doi: 10.1111/iep.12119
- Curtis E. M., Lee A. Fixation of whole eyes: the role of fixative osmolarity in the production of tissue artifact // Graefe's Archive for Clinical and Experimental Ophthalmology. – 1995. – Vol. 233, №6. – P. 366-70. doi: 10.1007/BF00200486.
- Guidance document on the collection of eye tissues for histological evaluation and collection of data series on testing and assesment. Second Edition. N 160 // Organisation for Economic Co-operation and Development. – 2018. – Paris. – 71p.
- Latendresse J.R., Warbrittion A.R., Jonassen H., Creasy D.M. Fixation of testes and eyes using a modified Davidson’s fluid: comparison with Bouin’s fluid and conventional Davidson’s fluid // Toxicologic Pathology. – 2002. – Vol. 30. – P. 524–533. doi:10.1080/01926230290105721.
- Morawietz G, Ruehl-Fehlert C, Kittel B, Bube A, Keane K, Halm S, Heuser A, Hellmann J; RITA Group; NACAD Group. Revised guides for organ sampling and trimming in rats and mice--Part 3. A joint publication of the RITA and NACAD groups// Exp Toxicol Pathol. – 2004. –Vol. 55, №6. –P. 433-49. doi: 10.1078/0940-2993-00350.
- Chidlow G., Daymon M., Wood J. P. M., Casson R. J. Localization of a wide-ranging panel of antigens in the rat retina by immunohistochemistry: comparison of davidson’s solution and formalin as fixatives // Journal of Histochemistry and Cytochemistry. – 2011. – Vol. 59(10). – P.884-98. doi: 10.1369/0022155411418115.
- Директива 2010/63/EU Европейского парламента и совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях. Гл. I, ст. 6 [Direktiva 2010/63/EU Evropeiskogo parlamenta i soveta Evropeiskogo soyuza ot 22.09.2010 po okhrane zhivotnykh, ispol'zuemykh v nauchnykh tselyakh. Gl. I, st. 6 (In Russ)].
- http://www.washington.edu/ [Электронный ресурс]: – URL.: http://depts.washington.edu/rubelab/protocols/Paraformaldehyde%20fixative.pdf (дата обращения 12.2021 г.).
- Tokuda K., Baron B., Kuramitsu Y. et al. Optimization of fixative solution for retinal morphology: a comparison with Davidson’s fixative and other fixation solutions // Japanese Journal of Ophthalmology. – 2018. – Vol. 62, №4. – P.481–490. doi:10.1007/s10384-018-0592-7.




