Влияние сублетальных доз хлорида кадмия на развитие доимплантационных зародышей в двух поколениях мышей
Работа выполнена в рамках государственного задания Министерства науки и высшего образования РФ: НИР № FGWG-2022-0012 (рег. № НИОКТР 122020300196-4).
Нониашвили Е.М., Сучкова И.О., Паткин Е.Л. Влияние сублетальных доз хлорида кадмия на развитие доимплантационных зародышей в двух поколениях мышей. Лабораторные животные для научных исследований. 2024; 1. https://doi.org/10.57034/2618723X-2024-01-03
Резюме
Воздействие кадмия на организм зависит от пути поступления, длительности и дозы воздействия. Одним из важных направлений исследований в этой области является изучение влияния кадмия на раннее развитие, приводящее к заболеваниям во взрослом организме и возможным отклонениям развития у потомства.
Цель данного исследования — анализ развития доимплантационных зародышей мышей, подвергшихся in utero воздействию хлорида кадмия, и зародышей, полученных от экспонированных кадмием родителей. Исследованы доимплантационные зародыши мышей-гибридов F1 (CBA×C57BL), которым in utero вводили 30 µM M хлорида кадмия (F1 — первое поколение), и зародыши аналогичного возраста, полученные от экспонированных в утробе матери самок и самцов (F2 — второе поколение). Проявление токсического эффекта хлорида кадмия исследовано по отцовской, материнской и «двойной» (экспонированы оба родителя) линиях наследования. Развитие зародышей оценивали по темпу дробления бластомеров и формирования бластоцист. Зародыши поколения F1, подвергшиеся in utero воздействию хлорида кадмия, быстрее проходили начальные стадии дробления и формирования бластоцисты по сравнению с контрольными зародышами. Развитие зародышей второго поколения при материнской линии наследования было сопоставимо с контрольной группой. В отцовской и «двойной» линиях наследования отмечалось замедление темпа дробления на стадии морулы, однако на стадии бластоцисты скорость дробления зародышей статистически не отличалась от контроля. Результаты исследований свидетельствуют, что воздействие сублетальных доз хлорида кадмия на самок мышей в дебюте беременности оказывает влияние не только на зародышей первого поколения, непосредственно подвергавшихся воздействию хлорида кадмия, но и на потомков экспонированных родителей во втором поколении, замедляя процесс пролиферации в зародышах отцовской линии наследования и в зародышах, рожденных от двух экспонированных родителей. Полученные результаты указывают на то, что негативные последствия курения, обусловленные накоплением кадмия, могут проявляться не только у детей, курящих матерей, но также и у их внуков. Наиболее вероятным молекулярным механизмом такого наследования является межгенерационная передача «измененных» эпигенетических меток (метилирование ДНК, модификации гистонов), что дает основания для разработки профилактических подходов по снятию возможных вредных последствий. Целесообразно рекомендовать прекращение курения во время беременности и в период до зачатия.
Введение
Кадмий (Cd) — тяжелый металл, экотоксикант/поллютант, связанный со многими современными производственными процессами. Воздействие Cd на организм зависит от пути поступления, длительности и дозы воздействия. Cd широко распространен и присутствует в измеряемых количествах почти во всем, что мы едим, пьем и чем дышим. Острые отравления Cd достаточно редки. В основном негативные эффекты Cd связаны с его хроническим действием, возникающим при продолжительном поступлении субтоксических доз этого металла в организм преимущественно перорально. Накапливаясь в органах и тканях, Cd может вызывать серьезные нарушения в работе ряда систем организма [1]. Период полувыведения Cd из организма составляет 15–30 лет [2]. Различные соединения Cd представляют риск для курильщиков и лиц, подверженных воздействию сигаретного дыма. Например, у курильщиков показано повышение уровня Cd в крови [3]. Поглощенный с сигаретным дымом Cd обладает относительно высокой биодоступностью, легко усваивается тканями и транспортируется кровотоком в более отдаленные части тела, в том числе в органы репродуктивной системы. В ряде исследований выявлена связь курения с преэклампсией и бесплодием [4]. Установлено, что преждевременные роды и родоразрешение при помощи кесарева сечения происходят примерно в 4 раза чаще у женщин с более высоким содержанием кадмия в организме, чем у их сверстниц с более низким [1]. Отрицательное действие Cd оказывал не только на гаметы, но и на последующее развитие эмбрионов [5, 6]. В наших предыдущих работах показано, что инъекции сублетальных доз хлорида кадмия (CdCl2) самкам мышей в дебюте беременности форсируют развитие доимплантационных зародышей на ранних стадиях дробления [7].
Гипотеза фетального происхождения болезней, впервые предложенная Дэвидом Баркером, указывает на роль различных типов токсического воздействия в ходе развития на начало заболеваний в более позднем периоде жизни. В частности, сообщалось, что ранние пищевые риски влияют на заболевания сердца [8]. В настоящее время эта теория находит свое подтверждение в многочисленных наблюдениях, связанных с возникновением рака, нарушениями развития, неврологическими заболеваниями и метаболическим синдромом [9].
Цель данного исследования — анализ развития доимплантационных зародышей в двух поколениях: первое поколение — зародыши, непосредственно подвергшиеся in utero воздействию CdCl2, и зародыши второго поколения, полученные от экспонированных in utero родителей.
Материал и методы
Все эксперименты выполняли в соответствии с принципами Европейской конвенции (Страсбург, 1986) и Хельсинской декларации Всемирной медицинской ассоциации о гуманном обращении с животными (1996), а также с требованиями Постановления Главного государственного санитарного врача Российской Федерации от 29.08.14 №51 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)». Научно-исследовательская работа проводилась согласно требованиям этического комитета по уходу и использованию лабораторных животных, принятым и обнародованным Институтом экспериментальной медицины, и протоколу № 1/22 от 18.02.22. Работа выполнена на гормонально стимулированных самках мышей F1 (CBA×C57BL) из питомника «Рапполово» (ФГУП «ПЛЖ «Рапполово», Россия). Животные содержались в условиях вивария в клетках по 5 особей в каждой при постоянном доступе к воде и стандартному комбинированному корму для грызунов, при одинаковом температурном режиме (22±2 °С), влажности, освещенности (свет 8.00–20.00) и уровне шума.
День обнаружения вагинальной пробки принимали за 1-й день беременности [10]. Беременных самок взвешивали и в течение 3 дней им интраперитонеально однократно вводили водный раствор CdCl2 (Sigma-Aldrich, США) в дозе 10 µM/кг. Доза выбрана на основании ранее проведенного исследования, в котором показано, что при введении 30 µM M/кг раствора CdCl2 самкам мышей беременность наступала в 80% случаев [11]. Суммарно каждая самка получала по 30 µM/кг CdCl2. На 4-й день одну часть экспонированных и контрольных мышей умерщвляли дислокацией шейных позвонков и вымывали зародыши из матки (первое поколение F1).
Зародышей второго поколения (поколение F2) получали путем скрещивания родившихся и достигших половозрелого возраста экспонированных in utero CdCl2 самок и самцов поколения F1 между собой («двойное» наследование) и с интактными контрольными животными того же возраста (отцовская и материнская линия наследования соответственно). Контролем в каждой группе экспериментов служили интактные зародыши аналогичного возраста и поколения. Зародыши из всех групп извлекали и исследовали на 4-й день развития. Во всех группах эксперимента подсчитывали количество зародышей на стадии морулы и бластоцисты. Затем из всех зародышей готовили суховоздушные препараты [10], на которых подсчитывали количество бластомеров в каждом зародыше, используя фазово-контрастный микроскоп AxioLab.A1, CarlZeiss.
Исследуемые выборки были проверены на нормальность распределения с помощью критерия Шапиро—Уилка. Сравнение выборок проводили с использованием непараметрических критериев Краскела Уоллиса (H), Данна (Q) и Манна—Уитни (W) для попарного сравнения. Количество морул и бластоцист указано в абсолютных значениях и процентах, а количество бластомеров в зародышах рассчитывали как среднее значение в каждой группе ± стандартная ошибка среднего (M±SEM). Различия считали статистически достоверными при p<0,05.
Результаты и обсуждение
Доимплантационное развитие зародышей млекопитающих сопровождается двумя важными процессами: компактизацией бластомеров на стадии морулы и кавитацией — формированием бластоцисты. Эти два процесса протекают независимо от темпа дробления и, как следствие, от числа бластомеров в зародыше. Поэтому критерием оценки развития доимплантационных зародышей является количество не только морул и бластоцист, но и бластомеров в каждом зародыше.
В таблице 1 представлены результаты исследований развития экспонированных CdCl2 доимплантационных зародышей мышей первого поколения (F1CdCl2) и зародышей аналогичного возраста второго поколения (F2CdCl2), непосредственно не подвергавшихся воздействию CdCl2, но родившихся от экспонированных родителей.
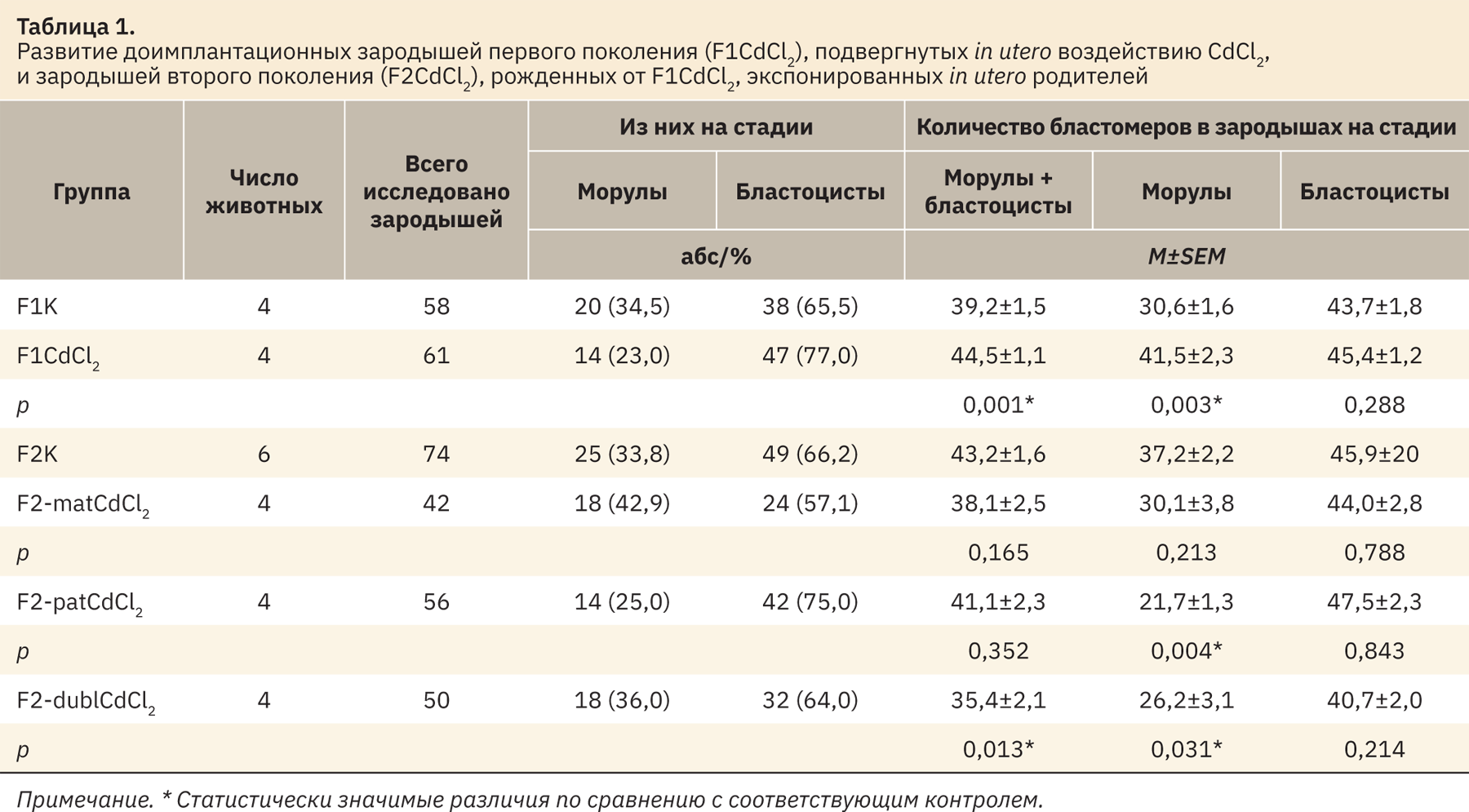
В левой части таблицы 1 представлены абсолютные и процентные значения количества зародышей на стадии морулы и бластоцисты, а в правой части отражено среднее количество бластомеров в общей группе зародышей (морулы + бластоцисты) и отдельно в морулах и бластоцистах.
Во всех группах экспериментов использовано по 4 беременные самки, кроме группы F2K, где было использовано 6 беременных самок.
В поколении F1 исследовано 58 зародышей в контрольной группе, из них 20 (34,5%) зародышей находились на стадии морулы и 38 (65,5%) — на стадии бластоцисты, а также 61 зародыш в экспериментальной группе, среди них на стадии морулы было 14 (23%) зародышей, а на стадии бластоцисты — 47 (77%) зародышей. Среднее количество бластомеров в общей группе (морулы + бластоцисты) среди экспонированных зародышей в 1,2 раза (p=0,001) превышало количество бластомеров в зародышах контрольной группы (44,5 и 39,2 соответственно). Причем на стадии морулы скорость дробления экспонированных зародышей в 1,4 раза (p=0,003) превышала контрольные значения (41,5 и 30,6 бластомера соответственно), а на стадии бластоцисты статистически значимых различий в среднем количестве бластомеров в контрольных (43,7) и экспонированных (45,4) зародышах не наблюдалось (p=0,288).
Второе поколение зародышей, непосредственно не подвергавшихся воздействию CdCl2, но родившихся от одного или двух экспонированных родителей, представлено группой материнского наследования (F2-matCdCl2), полученной от экспонированных самок и контрольных самцов; группой отцовского наследования (F2-patCdCl2), полученной от экспонированных самцов и контрольных самок; группой F2-dubCdCl2, рожденной от скрещивания экспонированных самок и самцов между собой. Контрольная группа (F2K) получена от скрещивания зародышей F1K между собой.
Сравнивая соотношение количества морул и бластоцист в каждой группе зародышей второго поколения, видно, что заметное преобладание числа бластоцист по сравнению с группой F2K (66,2%) наблюдается в F2-patCdCl2 (75%). По количеству бластомеров в общей группе зародышей (морулы + бластоцисты) замедление темпа дробления в 1,1 раза (p=0,013) по сравнению с группой F2K наблюдалось только у зародышей в группе F2-dublCdCl2 (43,2 и 35,4) бластомеров соответственно).
В поколении F2 материнской линии наследования статистически значимых различий в развитии зародышей не обнаружено ни в группе (морулы + бластоцисты) (p=0,165), ни отдельно в морулах (p=0,213) и в бластоцистах (p=0,788).
В поколении F2 отцовской линии наследования только на стадии морулы обнаружено статистически значимое замедление дробления в 1,7 раза (p=0,004) между потомками экспонированных и контрольных зародышей (21,7 и 37,2 соответственно). Снижение темпа дробления на стадии морулы тем не менее не снижало средних значений пролиферации всей группы (морулы + бластоцисты) отцовской линии наследования по сравнению с контролем F2K (p=0,352).
Уменьшенное количество бластомеров на стадии морулы, возможно, объясняется тем, что в этой группе зародышей ускорен процесс кавитации — 75% зародышей успевали сформировать бластоцисту. Количество бластомеров в бластоцистах F2-patCdCl2 статистически не отличалось от F2K (p=0,843).
В поколении F2-dublCdCl2, где оба родителя подвергались внутриутробному воздействию токсиканта, выявлено замедление темпа дробления по сравнению с контролем как на стадии морулы (p=0,031), так и в общей группе эмбрионов (морулы + бластоцисты) (p=0,013). На стадии бластоцисты отличий в темпе дробления бластомеров с контрольной группой зародышей не отмечалось (p=0,214).
Замедление процесса дробления эмбрионов группы F2-dublCdCl2 на стадии морулы не отражалось на процессе кавитации (64,0%) и было сопоставимо с контролем, где 66,2% зародышей также достигали стадии бластоцисты.
Полученные результаты свидетельствуют, что введение самкам мышей сублетальных доз CdCl2 в первые 3 дня беременности ускоряет пролиферацию зародышей первого поколения, непосредственно подвергшихся внутриутробному воздействию токсиканта, а на стадии бластоцисты темп дробления экспонированных зародышей сравнивается с контрольными показателями.
Во втором поколении токсический эффект CdCl2 проявлялся в замедлении развития зародышей, полученных от отца или обоих экспонированных родителей.
Такое различие результатов в экспериментах на зародышах первого и второго поколений, возможно, объясняется способностью плаценты задерживать частично перенос кадмия из материнского кровотока в кровоток плода [6], а небольшие его количества, поступающие в кровоток плода, оказывают стимулирующее действие на развитие доимплантационных зародышей первого поколения [9]. Поступление CdCl2 из кровотока матери в кровоток плода может возрастать и накапливаться в развивающихся в утробе матери зародышах [12]. Эффект накопленного в раннем развитии токсиканта может проявляться и в последующем поколении. Возможно, этим объясняется токсическое действие кадмия в зародышах второго поколения, полученных от экспонировнных на ранних стадиях своего развития родителей. Известно, что токсическое воздействие Cd влияет на сборку щелевых контактов в ранних зародышах, препятствуя фосфорилированию определенных коннексинов, таким образом предотвращая клональную экспансию в раннем эмбриогенезе [13]. Возможно, этим объясняется ускорение процесса кавитации в наших экспериментах в группах F2-patCdCl2 и F2-dublCdCl2. Так, воздействие на яички включает нарушение гематоэнцефалического барьера из-за неблагоприятного воздействия на клеточную адгезию, окислительный стресс и некроз при более высоких экспериментальных дозах. Также описано [14] включение Cd в хроматин развивающихся сперматозоидов. Cd может влиять на размножение и развитие по-разному и на каждой стадии репродуктивного процесса. Так, воздействие на яички включает нарушение гематоэнцефалического барьера, клеточную адгезию, окислительный стресс и некроз при более высоких экспериментальных дозах. Описано также включение Cd в хроматин развивающихся сперматозоидов [14]. Исследования показали, что токсичность Cd может быть связана с замещением преимущественно Zn или Ca во многих биологических процессах, таким образом инактивируя клеточную адгезию и каким-то образом модифицируя широкий выбор внутриклеточных реакций, вызывая окислительный стресс, аномальные пролиферации клеток и апоптоз [14]. Был предложен ряд механизмов токсичности Cd, в том числе ионный и молярный, подавление которых имеет огромное значение для передачи небольших молекул и электрических импульсов от клетки к соседней клетке [15].
Заключение
Воздействие сублетальных доз хлорида кадмия на самок мышей в дебюте беременности оказывает влияние не только на зародышей первого поколения, непосредственно подвергавшихся воздействию хлорида кадмия, но и на потомков экспонированных родителей во втором поколении, замедляя процесс пролиферации в зародышах отцовской линии наследования и зародышах, рожденных от двух экспонированных родителей. Полученные в исследовании результаты показывают, что вред от курения, обусловленный накоплением кадмия, может проявляться не только у детей, но также и внуков. Наиболее вероятен эпигенетический механизм такого наследования, что дает основания для разработки профилактических подходов по снятию возможных вредных последствий.
Целесообразно рекомендовать прекращение курения во время беременности и в период до зачатия.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Все авторы внесли существенный вклад в разработку концепции и подготовку статьи и одобрили финальную версию перед публикацией.
Е.М. Нониашвили — планирование и проведение экспериментов, написание рукописи.
И.О. Сучкова — статистический анализ, создание таблицы.
Е.Л. Паткин — дизайн исследования, редактирование рукописи.
Список источников
-
Saturg S., Moore M. Adverse Health Effects of Chronic Exposure to Low-Level Cadmium in Foodstoffs and Cigarette Smoke // Environmental Health Perspectives. 2004. Vol. 112. N. 10. P. 1099–1103. DOI: 10.1289/ehp.6751.
-
Nishijo M., Satarug S., Honda R., Tsuritani I., Aoshima R. The gender differences in health effects of environmental cadmium exposure and potential mechanisms // Mol. Cell. Biochem. 2004. N. 255. P. 87–92. DOI: 10.1023/b:mcbi.0000007264.37170.39.
-
Mortada W.I., Sobh M.A., El-Defrawy M.M. The exposure to cadmium, lead and mercury from smoking and its impact on renal integrity // Med. Sci. Monit. 2004. Vol. 10. N. 3. P. 112–116.
-
Ionheimo H., Lange R., Tolonen H., Kolossa-Gehring M. Exposure to toxic metals and per- and polyfluoroalkyl substances and the risk of preeclampsia and preterm birth in the United States: a review // J. Obstet. Gynecol MFM. 2021. Vol. 3. N. 3. P. 100–308.
-
Llanos M.N., Ronco A.M. Fetal growth restriction is related to placental levels of cadmium, lead and arsenic but not with antioxidant activities // Reprod. Toxicol. 2009. Vol. 27. N. 1. P. 88–92. DOI: 10.1016/j.reprotox.2008.11.057.
-
Piasek M., Micolic A., Sekovanic A., Grgec A., Jurasovic A.S. Cadmium in placenta — a valuable biomarker of exposure during pregnancy in biomedical research // J. Toxocol. Environ. Health. 2014. Vol. 77. N. 18. P. 1071–1074. DOI: 10.1080/15287394.2014.915779.0.
-
Нониашвили Е.М. Развитие доимплантационных зародышей мышей в условиях воздействия сублетальных доз хлорида кадмия на материнский организм // Токсикологический вестник. 2023. № 4 (31). С. 232–236. [Noniashvili E.M. Razvitie doimplantacionny’x zarody’shej my’shej v usloviyax vozdejstviya subletal’ny’x doz xlorida kadmiya na materinskij organism // Toksikologicheskij vestnik. 2023. N. 4 (31). P. 232–236. (In Russ.)].
-
Barker D.J., Clark P. M. Fetal under nutrition and disease in later life // Rev. Reprod. 1997. N. 2. P. 105–112. DOI: 10.1530/ror.0.0020105.
-
Barker D., Eriksson J., Forsen T., Osmond C. Fetal origins of adult disease: Strength of effects and biological basis // Int. J. Epidemiol. 2002. N. 31. P. 1235–1239. DOI: 10.1093/ije/31.6.1235.
-
Нониашвили Е.М., Чан В.Ч., Грудинина Н.А., Софронов Г.А., Епринцев А.Т., Паткин Е.Л. Особенности развития доимплантационных зародышей мышей в присутствии малых доз хлористого кадмия in vitro // Вестник Воронежского гос. университета. Серия: Химия. Биология. Фармация. 2019. № 1. С. 48–55. [Noniashvil E.M., Chan V.Ch., Grudinina N. A., Sofronov G.A., Eprincev A.T., Patkin E.L. Osobennosti razvitiya doimplantacionny’x zarody’shej my’shej v prisutstvii maly’x doz xloristogo kadmiya in vitro // Vestnik Voronejskogo gos. Universiteta. Seria: Chimia, Biologia, Pharmacia. 2019. N. 1. P. 48–55. (In Russ.)].
-
Dalton T., Fu K., Enders G.C., Palmiter R.D., Andrews G.K. Analysis of the effects of overexpression of metallothionein-1 in transgenic mice on the reproductive toxicology of cadmium // Environmental Health Perspectives. 1996. 1041. P. 68–76. DOI: 10.1289/ehp.9610468.
-
Shiverick K.T., Salafia C. Cigarette smoking and pregnancy I: Ovarian, uterine and placental effects // Placenta. 1999. Vol. 20. P. 65–72.
-
Fang M.Z., Mar W.C., Cho M.H. Cadmium-induced alterations of connexin expression in the promotion stage of in vitro two-stage transformation // Toxicology. 2001. Vol. 161. N. 1–2. P. 117–127. DOI: 10.1016/s0300-483x(01)00344-4.
-
Thompson J., Bannigan J. Cadmium: Toxic effects on the reproductive system and the embryo // Reprod. Toxicol. 2008. Vol. 25. P. 304–315. DOI: 10.1016/j.reprotox.2008.02.001.
- Maes M., Vinken M. Connexin-based signaling and drug-induced hepatotoxicity // Clin. Trans. Res. 2017. Vol. 3. N. 1. P. 189–198. DOI: 10.18053/jctres.03.2017S1.004.




