Ретроспективная оценка вариабельности фармакокинетических параметров в зависимости от биологического вида и числа особей в экспериментальной группе
Работа выполнена без спонсорской поддержки.
Косман В.М. , Карлина М.В. Ретроспективная оценка вариабельности фармакокинетических параметров в зависимости от биологического вида и числа особей в экспериментальной группе. Лабораторные животные для научных исследований. 2023; 1. https://doi.org/10.57034/2618723X-2023-01-06
Резюме
Оценка фармакокинетических параметров в исследованиях фармакокинетики (ФК) и токсикокинетики (ТК) — обязательная составляющая доклинического изучения лекарственных препаратов. Одним из ключевых моментов планирования таких экспериментальных исследований является выбор тест-системы и объема выборки, минимальный размер которой регламентирован нормативными документами. Увеличение объема выборки предположительно позволит снизить вариабельность получаемых данных.
Цель работы — выявление возможных закономерностей вариабельности фармакокинетических параметров в зависимости от биологического вида количества особей (n) в экспериментальной группе для дальнейшего обоснования размера выборки при проведении исследований ФК и/или ТК.
Сформирован ретроспективный массив собственных экспериментальных данных по коэффициентам вариабельности (CV, %) основных фармакокинетических параметров (Cmax, Тmax, AUC0-t, AUC0-∞, MRT и T1/2), полученных с использованием различных лабораторных животных (крысы, кролики, кошки, собаки, карликовые свиньи), человека (как примеры исследований с большими значениями n), путей введения (перорально/внутрижелудочно, внутривенно, внутримышечно, вагинально, интраназально, внутрибрюшинно, накожно, эндотрахеально, ректально) и определенного числа особей в группе (3–12 для лабораторных животных и 8–30 для добровольцев), также выполнена группировка данных и их статистическая обработка.
Наибольшая вариабельность параметров Cmax, Tmax, AUC0-t, AUC0-∞ независимо от биологического вида и путей введения выявлена для наиболее многочисленных групп (с числом особей более 18). Ретроспективный анализ накопленных данных не позволил обосновать преимущества того или иного биологического вида в качестве тест-системы, а также рекомендовать увеличение размера выборки для получения более однородных данных по фармакокинетическим параметрам.
Регуляторно рекомендованное количество животных (не менее 6 при отборе всей фармакокинетической кривой от одной особи, не менее 5 при дизайне животное—точка и не менее 4 самцов и 4 самок при исследованиях ТК следует признать достаточным при доклинических исследованиях ФК/ТК лекарственных препаратов для медицинского применения у человека. Увеличение числа животных в экспериментальных группах может быть оправдано при изучении ФК ветеринарных лекарственных препаратов на целевых видах животных, поскольку оно позволит полнее учесть индивидуальные особенности.
Введение
Данные по ФК и ТК лекарственных веществ являются неотъемлемой частью доклинических исследований как новых, так и уже применяемых лекарственных средств (ЛС), поскольку необходимы для формирования и последующего дополнения регистрационного досье, аккумулирующего как пред-, так и пострегистрационные сведения о лекарственных препаратах (ЛП). Необходимость соответствующих исследований и разделов предусмотрена рядом регулирующих документов1.
Оценка параметров ФК возможна только по результатам экспериментальных исследований, проводимых с применением различных биологических моделей. Одним из ключевых моментов планирования любого биологического эксперимента является выбор тест-системы и объема выборки. Авторы публикации [1] отмечают значимость правильного выбора вида животных и проекта будущего фармакокинетического исследования для исключения риска отвергнуть перспективное соединение в скрининговых исследованиях. В работе [2] рассмотрено влияние филогенетических связей на выбор биологической модели в зависимости от задач исследования. Вопросы релевантности биологической модели и возможности дальнейшей аппроксимации полученных данных на человека обсуждают в научной литературе, в том числе с точки зрения системы цитохрома Р450 человека и лабораторных животных [3], а также применительно к изучению особых групп ЛП, например, наноматериалов [4], препаратов белковой природы [5] и др. Наиболее подробно вопросы организации исследований ФК на доклиническом этапе охарактеризованы в рекомендациях, которые предусматривают применение в качестве экспериментальных моделей крыс, кроликов, собак, обезьян, а при проведении комплексных исследований допускают использование также мышей, морских свинок и кошек2.
Этот же документ рекомендует объем выборки для проведения эксперимента — не менее 5 животных на каждую временную точку в случае, когда у каждого(й) животного (особи) отбирают только одну пробу, и не менее 6, когда отбор проб на всех временных точках проводят у каждого животного. В практической работе, при выполнении такого рода исследований, редко увеличивают число животных, поскольку включение в эксперимент минимального количества особей (5 или 6 в зависимости от дизайна) оптимально с этической и экономической точки зрения.
Объем выборки при проведении исследований ТК, являющихся частью комплексного изучения токсичности и безопасности, предусмотрен в одном из зарубежных документов3 (рекомендовано не менее 4 особей каждого пола) и не регламентирован в отечественных нормативных документах4 — допускает проведение таких исследований на всех животных, репрезентативной доле от общей группы животных, используемой в основном исследовании, или на специальных спутниковых группах (последний вариант, как правило, используют для грызунов). Эти документы также обозначают необходимость оценки системной экспозиции для животных обоего пола (в случае, если в основном исследовании используют самцов и самок) в отличие от рекомендаций по доклиническому изучению ФК. С учетом необходимости проведения различных манипуляций в рамках оценки токсичности и безопасности ЛС и экспериментальной нагрузки на отдельных животных в практической работе для исследований ТК можно использовать половину животных из каждой экспериментальной группы (4–6 самцов и столько же самок) (см., например, [6]).
Таким образом, большинство доклинических исследований ФК и ТК проводят с выборками небольшого объема. Актуален вопрос, касающийся достаточности этого количества для дальнейшего использования доклинических данных для планирования клинических исследований, подбора доз, режима введения и других аспектов применения ЛС у человека из‑за вариабельности получаемых значений параметров ФК как индивидуальной, внутривидовой, так и межвидовой.
С математической точки зрения увеличение числа измерений (объема выборки) должно вести к снижению разброса данных. Вместе с тем для статистической оценки размера выборки до начала исследования необходимо оценить требуемую мощность (вероятность обнаружения эффекта заданной величины как статистически значимого, обычно 70–80%) и располагать предварительными (экспериментальными или литературными) данными о вариабельности исследуемого параметра [7, 8]. Очевидно, что такая информация чаще всего отсутствует на этапе доклинических исследований.
Цель данной работы — выявление возможных закономерностей по вариабельности параметров ФК в зависимости от биологического вида и количества особей в экспериментальной группе для дальнейшего обоснования размера выборки при проведении исследований ФК и/или ТК.
Материал и методы
На основании результатов исследований, проведенных в АО «НПО «ДОМ ФАРМАЦИИ» в 2009–2021 гг., сформирован ретроспективный массив данных по вариабельности (коэффициенты вариабельности, CV, %) основных фармакокинетических параметров (приведены в виде отдельного файла, включенного в метаданные к статье). К рассмотрению приняты значения CV для основных, рекомендуемых к оценке параметров ФК: максимальная концентрация — Cmax, время достижения максимальной концентрации — Tmax, площадь под кривой концентрация—время — AUC (AUC0‑t, AUC0-∞), период полувыведения — T1/2, среднее время пребывания в организме — MRT5.
Выполнена группировка данных по разным критериям и их дальнейшая статистическая обработка с помощью лицензированного программного обеспечения (Prism 9, GraphPad Software, США; Statistica 10.0, StatSoft, США). Данные проверены на соответствие закону нормального распределения с помощью критерия Шапиро—Уилка. Межгрупповые различия при сравнении трех выборок и более для данных с признаками нормального распределения анализировали параметрическими методами с использованием однофакторного дисперсионного анализа ANOVA и последующей оценкой межгрупповых различий с применением критерия Тьюки, в случае ненормального распределения применяли непараметрические методы и критерий Краскела—Уоллиса. Для статистической оценки различий при сравнении данных двух выборок применены параметрические (двухвыборочный t-тест для средних или тест Стьюдента) и непараметрические (тест Манна—Уитни) методы в зависимости от типа распределения значений. Различия определены при уровне значимости р≤0,05.
Результаты и обсуждение
При оценке нормальности в большинстве случаев получено неодинаковое распределение для данных, относящихся к одному параметру у разных групп (выборок). Поэтому для «концентрационных» параметров (Cmax, AUC0‑t и AUC0-∞) применены оба варианта статистической обработки (использованы параметрические и непараметрические критерии), в большинстве случаев получены идентичные результаты. Правомочность применения параметрических критериев может быть обоснована тем, что данные параметры относят к логнормальным6 [9] и их сопоставление, по крайней мере в исследованиях по биоэквивалентности (БЭ), рекомендовано проводить только параметрическими методами7 (проверка на нормальность распределения и выбросы не предусмотрена, а исключение результатов по фармакокинетическим критериям недопустимо). Логично поступать таким же образом и по отношению к данным по ФК, полученным в рамках доклинических и клинических исследований. Для временных параметров ФК (Тmax, MRT и T1/2) применены непараметрические критерии, так как их распределение в большинстве случаев не являлось нормальным. Такой подход также соответствовал рекомендациям в отношении данных, получаемых в исследованиях по БЭ8. Отметим, что оценка нормальности распределения для малых выборок, используемых в экспериментах ФК/ТК, не вполне правомерна с точки зрения статистики. Применение критерия Шапиро—Уилка рекомендовано для выборок с числом значений от 8 до 50 [10]9, вместе с тем в работе [11] обсуждалась возможность его использования для выборок с n<8. Право выбора приемов статистической обработки остается за исследователем, поскольку данный аспект не закреплен на регуляторном уровне. Единообразие подходов к статистической обработке данных по параметрам ФК в исследованиях ФК, ТК и БЭ, вероятно, предпочтительно и могло бы найти отражение в документах, регулирующих проведение доклинических исследований ФК/ТК.
В общий массив данных были включены результаты, полученные с использованием различных биологических видов: лабораторных животных (крысы, кролики, кошки, собаки, карликовые свиньи) и человека, разных путей введения (перорально/внутрижелудочно, внутривенно, внутримышечно, вагинально, интраназально, внутрибрюшинно, накожно, эндотрахеально, ректально) и числа особей (субъектов, n) в группе (3–12 для лабораторных животных и 8–30 для добровольцев). Результаты клинических исследований ФК и БЭ с участием добровольцев включены в рассмотрение как примеры выборок с большими значениями показателя n, в том числе статистически обоснованных для обеспечения необходимой их мощности (условие исследований БЭ).
При сопоставлении данных по биологическим видам (усреднены данные независимо от параметра n и способа введения ЛП для каждого из биологических видов; табл. 1) для большинства параметров ФК наибольшая вариабельность выявлена у человека. Исследования ФК с данным биологическим видом обычно проводят с группами, включающими сравнительно большое число субъектов (как правило, не менее 12–18). Отметим также, что вариабельность параметров ФК у человека может быть достаточно высокой, например, для нескольких препаратов в группах с числом добровольцев от 24 до 55 для параметра Cmax она варьировала в диапазоне около 20–60% [12].
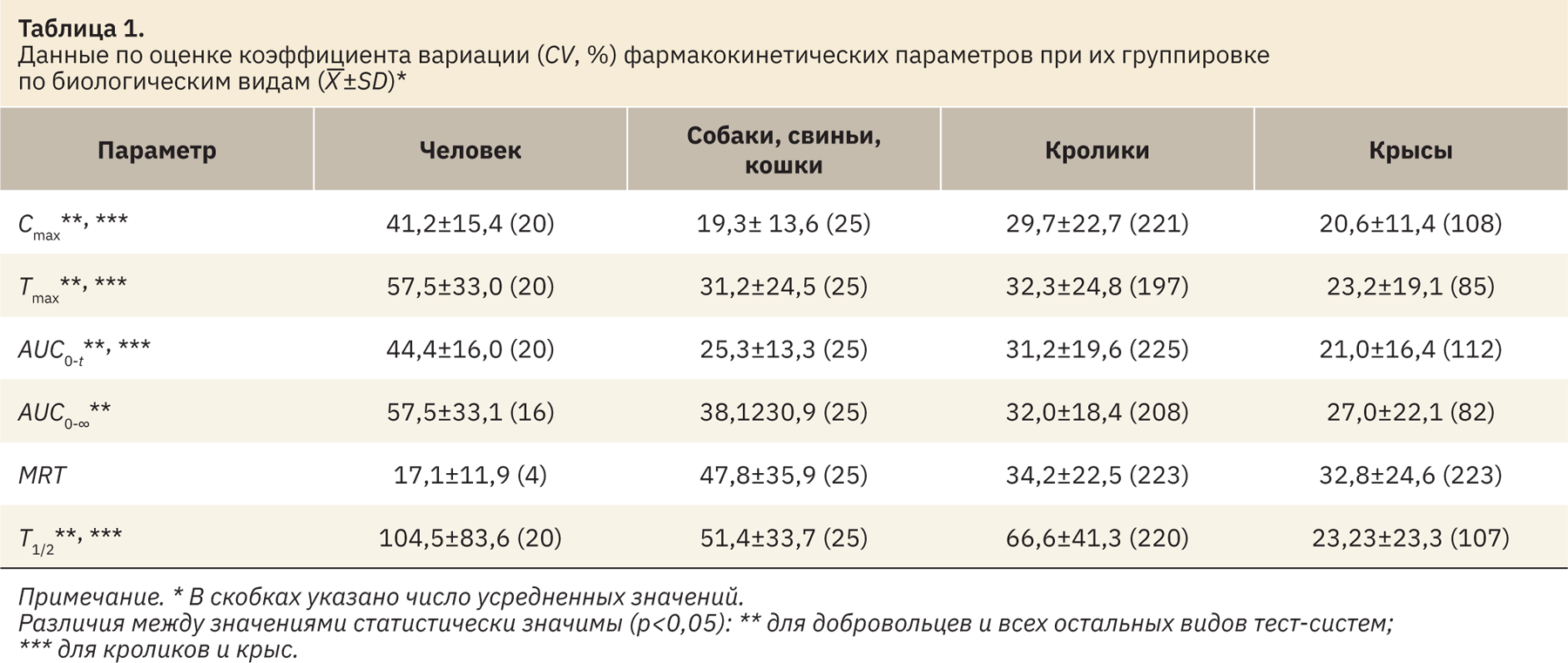
Для оценки влияния числа особей в группе (n) на вариабельность параметров ФК данные сопоставили в нескольких вариантах:
- для биологических видов, позволяющих реализовать отбор всех проб биоматериала от одной особи (табл. 2, выборки менее 5, 6, 8–12 и более 18);
- по числу особей, рекомендуемому регуляторными документами для основных биологических видов [табл. 3, выборки «человек (n более 18)», «кролики (n=6)» и «крысы (n=5)»];
- для перорального (внутрижелудочного) введения как наиболее охарактеризованного в имеющейся выборке и наиболее часто встречающегося в практике исследований (табл. 4, выборки менее 5, 6, 8–12 и более 18).
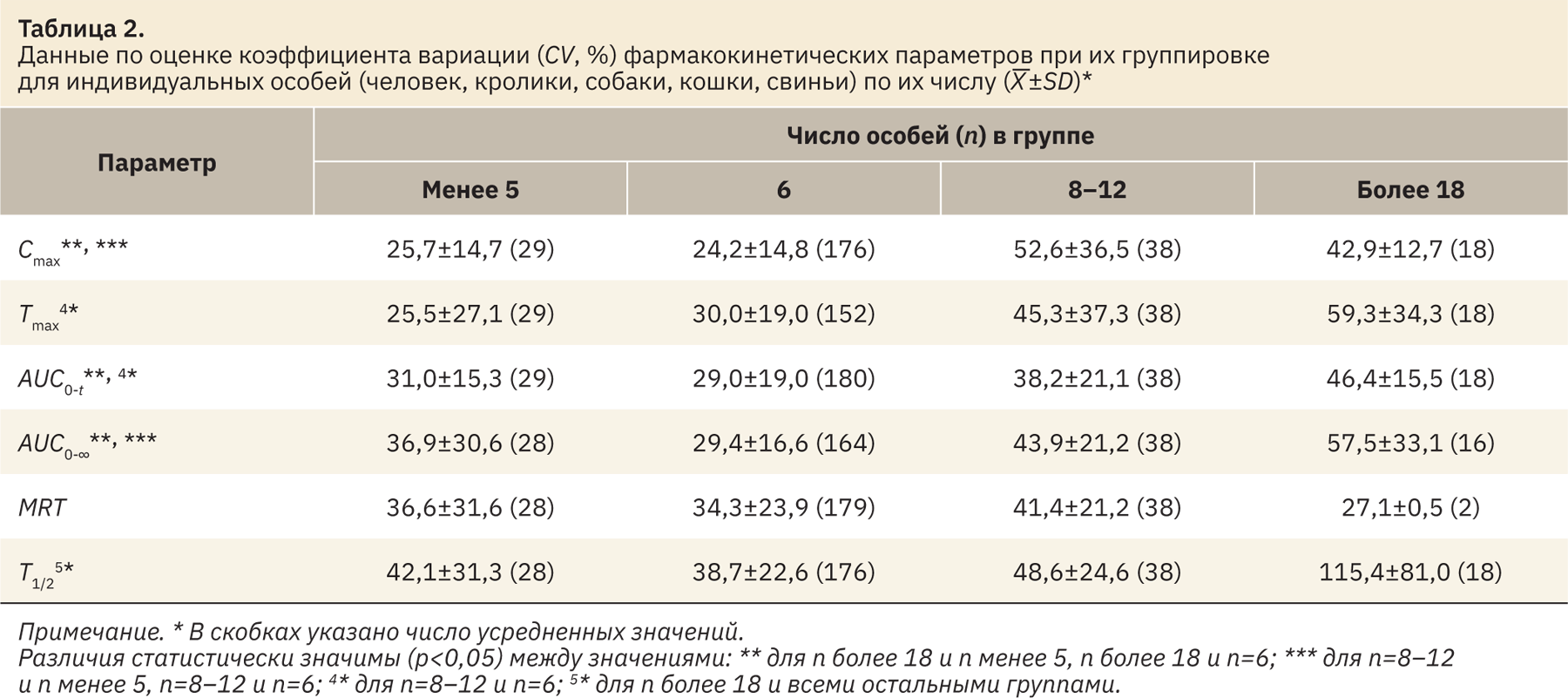
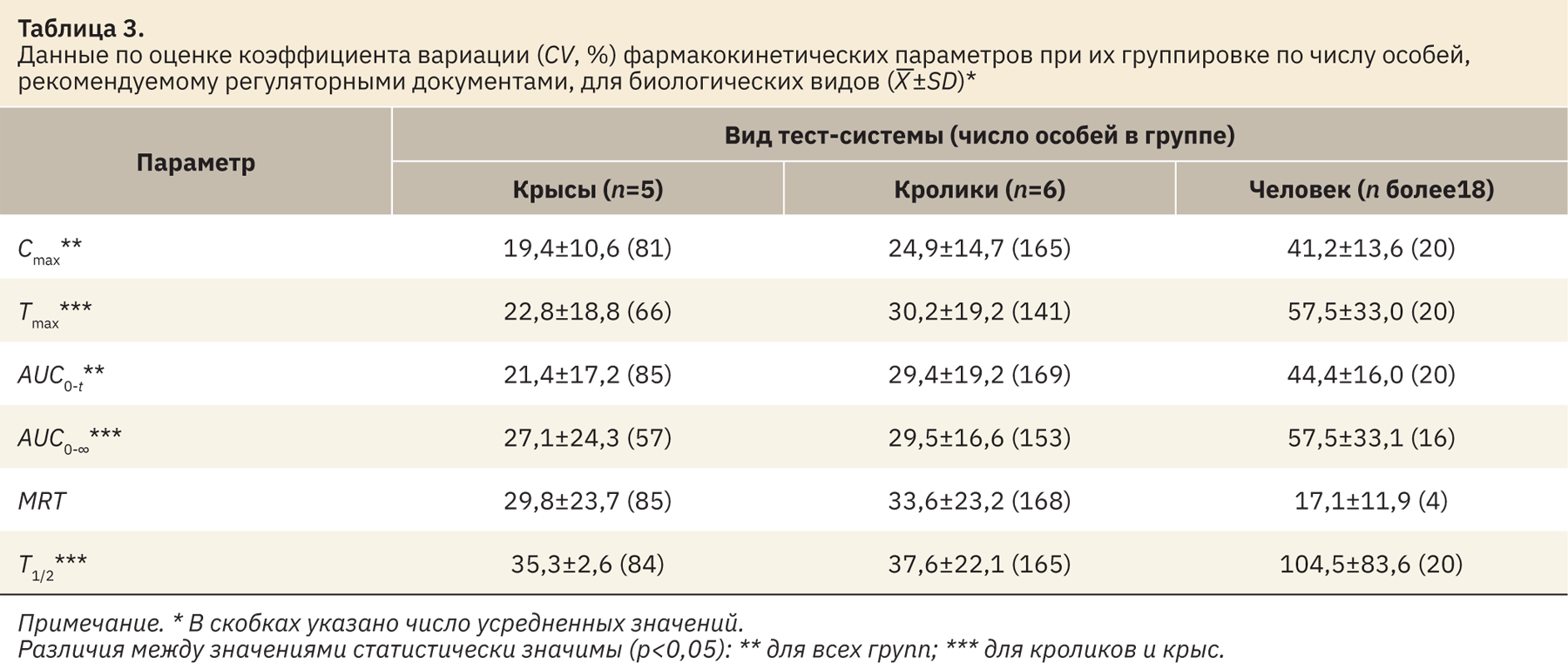
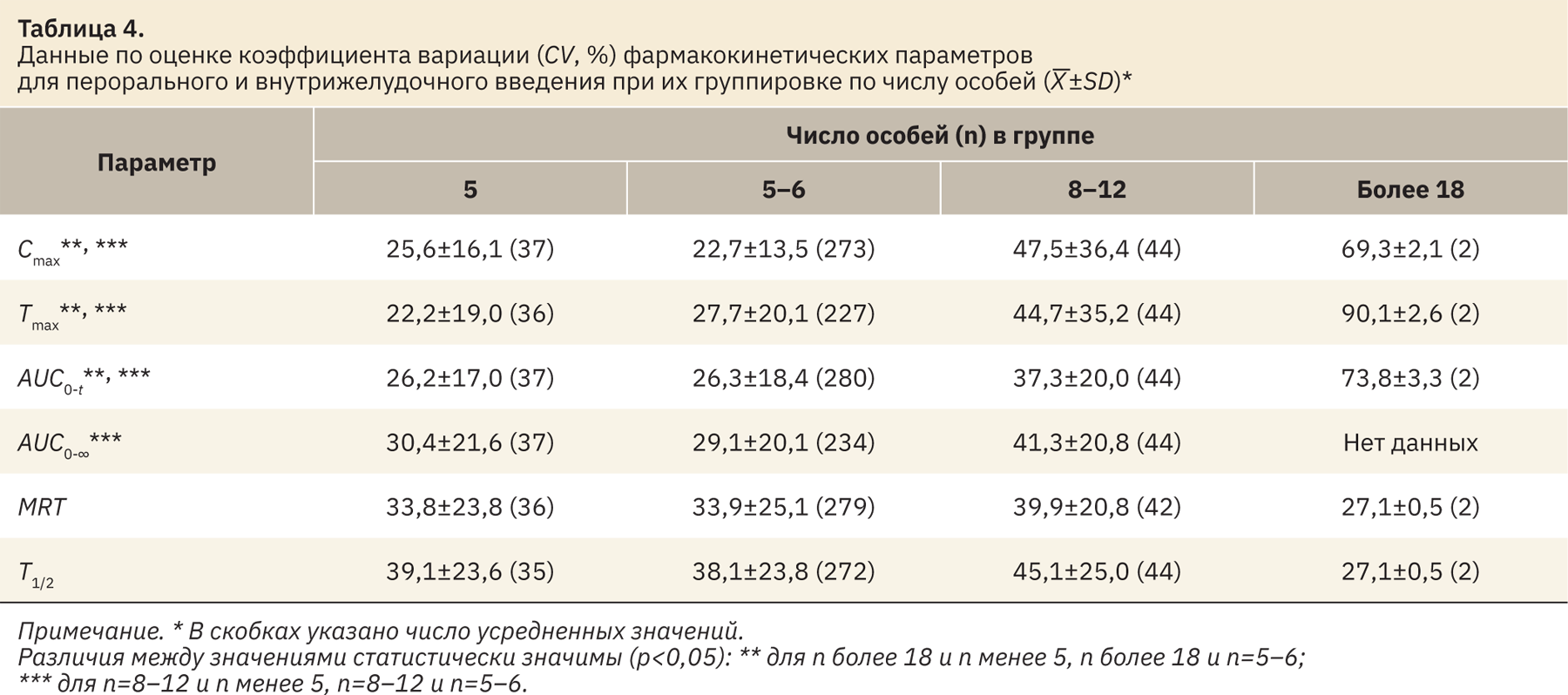
Во всех вариантах группировки данных наибольшая вариабельность в большинстве случаев выявлена для наиболее многочисленных групп (более 18 человек). В ряде случаев значения CV для группы 8–12 особей также выше, чем значения для группы с числом особей 6 (или 5–6; cм. табл. 3, 4). Схожие тенденции получены для большинства рассмотренных параметров ФК (Cmax, Tmax, AUC0‑t, AUC0-∞), исключения можно отметить для показателей T1/2 (cм. табл. 2–4) и MRT (см. табл. 4). Отчасти эти исключения могут быть объяснены малым числом усредненных значений для группы, где n более 18 (2–4), по сравнению с остальными группами.
Результаты группировки данных для двух видов лабораторных животных (кролики и крысы) и путей введения (внутривенно и перорально или внутрижелудочно), наиболее часто используемых в практике исследований ФК, представлены в табл. 5.
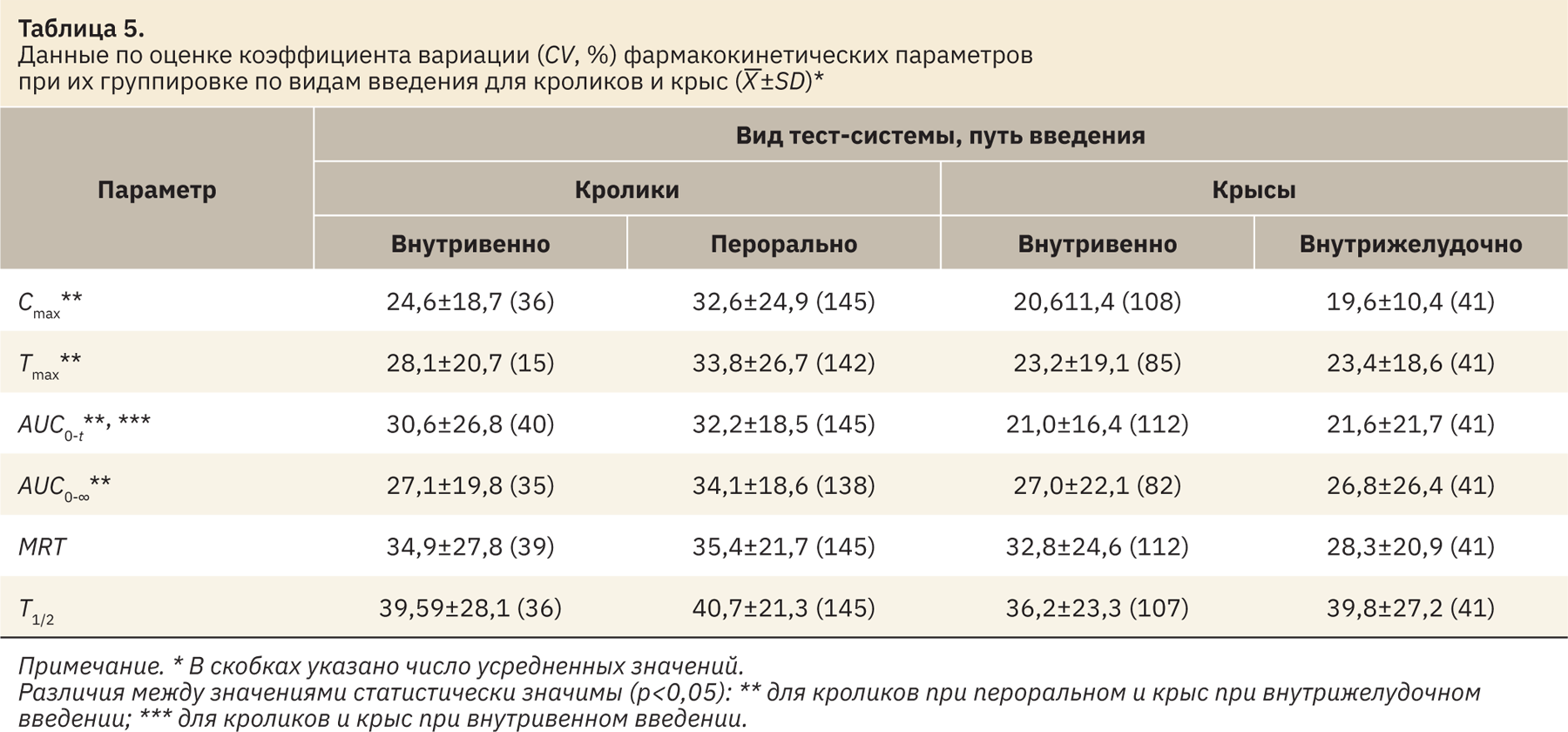
Выполнена сравнительная оценка вариабельности данных в зависимости не только от пути введения для двух видов тест-систем, но и от вида тест-системы, предполагающей два принципиально разных дизайна исследования. Для крыс и кроликов сравниваемые пути введения [внутривенный, обеспечивающий немедленное поступление действующего вещества в кровоток, и пероральный (внутрижелудочный), предполагающий всасывание действующего вещества из ЖКТ] приводили к получению всех основных параметров ФК с сопоставимыми уровнями вариабельности (значениями CV). При сопоставлении данных для разных тест-систем выявлены статистически значимые различия между пероральным введением кроликам и внутрижелудочным введением крысам для параметров Cmax, Тmax, AUC0‑t и AUC0-∞ (для данных, полученных при использовании крыс выявлена более низкая вариабельность). С одной стороны, этот факт не подтверждал предположение о том, что дизайн исследования животное—точка должен приводить к получению более вариабельных значений параметров ФК. Вместе с тем такой результат может быть связан со значительно более объемной выборкой данных для кроликов, чем для крыс (около 100 значений и 40 соответственно). При сопоставлении возможных дизайнов экспериментов ФК вариант отбора биоматериала от одной особи считают более предпочтительным [4]. Тенденции к минимизации количества биоматериала, необходимого для анализа, развитие специальных техник для отбора и работы с пробами биоматериала от грызунов [4, 13, 14] можно считать дополнительным подтверждением предпочтительности получения профиля ФК на основании проб от одной особи. В качестве недостатков изучения ФК с дизайном животное—точка отмечают значительную индивидуальную вариабельность между животными, которая может составлять 30–50% [4, 15]. Вместе с тем такого рода дизайн является единственно возможным при изучении распределения в органах и тканях.
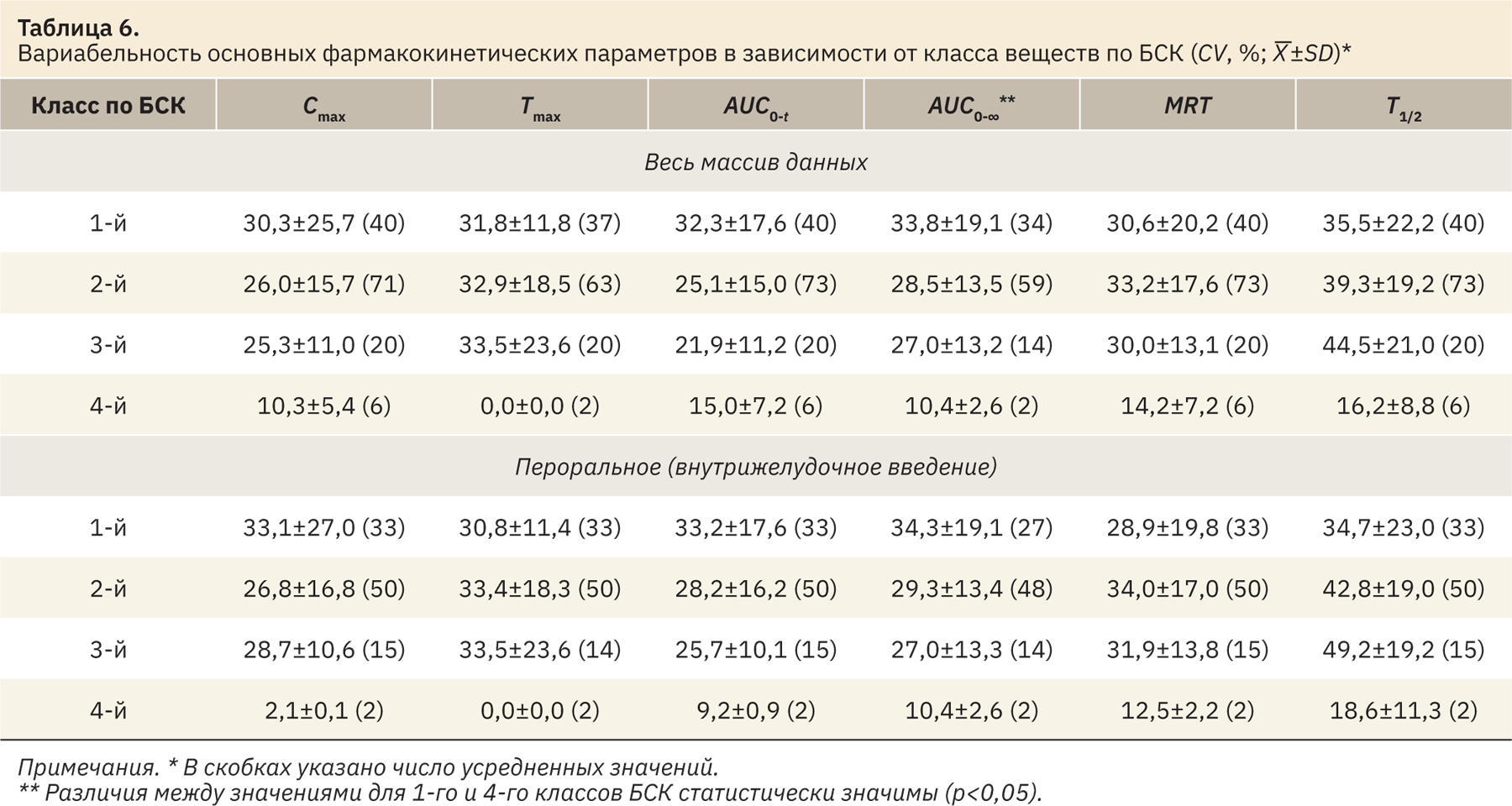
Еще одним возможным направлением стало рассмотрение взаимосвязи вариабельности данных с биофармацевтической классификацией (БСК), основанной на различной растворимости и проницаемости лекарственных веществ. Авторы работы [16] на основании обобщения данных, полученных в 1999–2013 гг. с использованием различных видов тест-систем (мышей, крыс, собак и обезьян), отмечали меньшую вариабельность параметров ФК (AUC) для соединений 1‑го и 3‑го классов БСК по сравнению с соединениями 2‑го и 4‑го классов. Средние значения параметров ФК для соединений различных классов БСК (отнесение к тому или иному классу веществ по БСК выполнено на основании источников литературы) приведены в табл. 6. При сравнении данных рассмотрен как весь массив, так и данные, относящиеся только к пероральному (внутрижелудочному) введению. Достоверные различия выявлены исключительно для вариабельности параметра AUC0-∞ при рассмотрении всего массива данных (для соединений 4‑го класса БСК вариабельность ниже, чем для соединений 1‑го класса; p<0,05, критерий Тьюки). Однако такой результат может быть связан с различным объемом выборок (6 значений для соединений 4‑го класса БСК и 20–71 для соединений других классов). В целом данный прием не позволил выявить связь между классами БСК (растворимостью и проницаемостью лекарственных веществ) и вариабельностью основных параметров ФК.
Следует подчеркнуть, что вопросам дизайна доклинического фармакокинетического эксперимента посвящено довольно ограниченное число публикаций, вопросы математического обоснования размера выборки рассмотрены преимущественно применительно к клинической и популяционной ФК [1, 17, 18], изучаемой обычно в рамках клинических исследований с привлечением добровольцев. Авторы сравнительно ранних работ по вопросам доклинической ФК отмечали высокую индивидуальную вариабельность параметров ФК [19], допускали возможность проведения исследований с применением 5 [19], 3–4 и даже 2–3 особей [15]10 для получения минимальной информации о значениях Cmax и AUC. По утверждению автора работы [20], посвященной вопросам дизайна исследований ФК у лошадей, использование 5–6 особей достаточно для простейшего исследования ФК, направленного на получение информации о ранее не исследованном продукте, и позволяет получить данные для выбора доз, режима дозирования, оптимизации дальнейшего, более подробного изучения ФК.
В целом на основании анализа накопленных данных нельзя сделать предположение или заключение о том, что с увеличением числа животных в группе можно ожидать снижение значений CV, то есть увеличение размера выборки при исследованиях ФК для получения более однородных данных по параметрам ФК, по‑видимому, не обосновано.
Можно предположить, что большие выборки позволяют полнее учесть индивидуальные особенности, что приводит к сравнительно более высоким значениям CV. Поэтому увеличение числа животных в экспериментальных группах может быть оправдано при изучении ФК ветеринарных ЛП на целевых видах животных. В случае доклинического изучения ФК ЛП, предназначенных для медицинского применения у человека, рекомендованное регуляторными документами количество животных (не менее 6 при отборе всей кривой ФК от одной особи и не менее 5 при дизайне животное—точка) следует признать достаточным. Такое число особей позволит охарактеризовать ФК свойства изучаемого ЛП, вместе с тем будет гуманным и этичным с точки зрения принципов 3R.
Заключение
Важной составляющей для получения достоверных данных в экспериментальных доклинических фармако- и токсикокинетических исследованиях является выбор вида тест-системы и числа животных.
Ретроспективный анализ накопленных данных не позволил обосновать преимущества того или иного биологического вида в качестве тест-системы, а также рекомендовать увеличение размера выборки для получения более однородных данных по параметрам ФК.
Регуляторно рекомендованное количество животных (не менее 6 при отборе всей ФК кривой от одной особи, не менее 5 при дизайне животное—точка и не менее 4 животных каждого пола при исследованиях ТК) следует признать достаточным при доклинических исследованиях ФК/ТК ЛП для медицинского применения у человека. Увеличение числа животных в экспериментальных группах может быть оправдано при изучении ФК ветеринарных ЛП на целевых видах животных, поскольку оно позволит полнее учесть индивидуальные особенности.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
В.М. Косман — идея, сбор и обработка данных, подготовка текста и иллюстраций.
М.В. Карлина — обсуждение результатов, критический анализ текста публикации.
Список источников
- Мирошниченко И.И., Кравцова О.Ю. Организация фармакокинетических исследований // Фармакокинетика и Фармакодинамика. 2021. № 3. С. 12–19. [Miroshnichenko I.I., Kravcova O.YU. Organizaciya farmakokineticheskih issledovanij // Farmakokinetika i Farmakodinamika. 2021. N. 3. P. 12–19. (In Russ.)]. DOI: 10.37489/2587‑7836‑2021‑3‑12‑19.
-
Макарова М.Н., Матичин А.А., Матичина А.А., Макаров В.Г. Принципы выбора животных для научных исследований. Сообщение 1. Выбор модельных организмов на основании филогенетических связей // Лабораторные животные для научных исследований. 2022. № 2. [Makarova M.N., Matichin A.A., Matichina A.A., Makarov V.G. Principy vybora zhivotnyh dlya nauchnyh issledovanij. Soobshchenie 1. Vybor model’nyh organizmov na osnovanii filogeneticheskih svyazej // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2022. N. 2. (In Russ.)]. DOI: 10.29296/2618723X-2022‑02‑07.
-
Мирошников М., Султанова К.Т., Макарова М.Н., Макаров В.Г. Сравнительный обзор активности ферментов системы цитохрома Р-450 человека и лабораторных животных. Прогностическая ценность доклинических моделей in vivo // Трансляционная медицина. 2022. Т. 9. № 5. С. 44–47. [Miroshnikov M., Sultanova K.T., Makarova M.N., Makarov V.G. Sravnitel’nyj obzor aktivnosti fermentov sistemy citohroma R-450 cheloveka i laboratornyh zhivotnyh. Prognosticheskaya cennost’ doklinicheskih modelej in vivo // Translyacionnaya medicina. 2022. Vol. 9. N. 5. P. 44–47. (In Russ.)]. DOI: 10.18705/2311‑4495‑2022‑9‑5‑44‑77.
-
Valic M.S., Halim M., Schimmer P., Zheng G. Guidelines for the experimental design of pharmacokinetic studies with nanomaterials in preclinical animal models // J. Control. Release. 2020. Vol. 323. P. 83–101. DOI: 10.1016/j.jconrel.2020.04.002.
-
Солдатов А.А., Авдеева Ж.И., Алпатова Н.А. и др. Фармакокинетические свойства препаратов белковой природы // БИОпрепараты. Профилактика, диагностика, лечение. 2015. № 2. С. 24–35. [Soldatov A.A., Avdeeva ZH.I., Alpatova N.A. et al. Farmakokineticheskie svojstva preparatov belkovoj prirody // BIOpreparaty. Profilaktika, diagnostika, lechenie. 2015. N. 2. P. 24–35. (In Russ.)].
-
Косман В.М., Карлина М.В., Мазукина Е.В. и др. Изучение безопасности и токсикокинетики препарата эзомепразол в доклинических исследованиях // Безопасность и риск фармакотерапии. 2023. Т. 11. № 2. (В печати). [Kosman V.M., Karlina M.V., Mazukina E.V. et al. Izuchenie bezopasnosti i toksikokinetiki preparata ezomeprazol v doklinicheskih issledovaniyah // Bezopasnost’ i risk farmakoterapii. 2023. Vol. 11. N. 2. (V pechati). (In Russ.)].
-
Charan J., Kanttaria N.D. How to calculate sample size in animal studies // Journal of pharmacology and pharmacotherapeutics. 2013. Vol. 4. N. 4. P. 303–306. DOI: 10.4103/0976-500X.119726.
-
Макарова М.Н., Шекунова Е.В., Рыбакова А.В., Макаров В.Г. Объем выборки лабораторных животных для экспериментальных исследований // Фармация. 2018. Т. 67. № 2. С. 3–8. [Makarova M.N., SHekunova E.V., Rybakova A.V., Makarov V.G. Ob’em vyborki laboratornyh zhivotnyh dlya eksperimental’nyh issledovanij // Farmaciya. 2018. Vol. 67. N. 2. P. 3–8. (In Russ.)]. DOI: 10.29296/25419218‑2018‑02‑01.
-
Драницына М.А., Захарова Т. В., Ниязов Р.Р. Свойства процедуры двух односторонних тестов для признания биоэквивалентности лекарственных препаратов // Ремедиум. 2019. № 3. С. 40–47. [Dranicyna M.A., Zaharova T.V., Niyazov R.R. Svojstva procedury dvuh odnostoronnih testov dlya priznaniya bioekvivalentnosti lekarstvennyh preparatov // Remedium. 2019. N. 3. P. 40–47. (In Russ.)]. DOI: 10.21518/1561‑5936‑2019‑3‑20‑25.
-
Лемешко Б.Ю., Лемешко С.Б. Сравнительный анализ критериев проверки отклонения распределения от нормального закона // Метрология. 2005. № 2. С. 3–24. [Lemeshko B.YU., Lemeshko S.B. Sravnitel’nyj analiz kriteriev proverki otkloneniya raspredeleniya ot normal’nogo zakona // Metrologiya. 2005. N. 2. P. 3–24. (In Russ.)].
-
Ковалевский А.П. Тестирование нормальности очень малых выборок // Сибирские математические известия. 2017. № 14. С. 1207–1214. [Kovalevskij A.P. Testirovanie normal’nosti ochen’ malyh vyborok // Sibirskie matematicheskie izvestiya. 2017. N. 14. P. 1207–1214. (In Russ.)]. DOI: https://doi.org/10.17377/semi.2017.14.102.
-
Осешнюк З.А., Ушал И.Э., Светкина Е.В. и др. Межиндивидуальные особенности фармакокинетики противоопухолевых препаратов у здоровых добровольцев // Обзоры по клинической фармакологии и лекарственной терапии. 2017. Т. 15. № 1. С. 48–52. [Oseshnyuk Z.A., Ushal I.E., Svetkina E.V. et al. Mezhindividual’nye osobennosti farmakokinetiki protivoopuholevyh preparatov u zdorovyh dobrovol’cev // Obzory po klinicheskoj farmakologii i lekarstvennoj terapii. 2017. Vol. 15. N. 1. P. 48–52. (In Russ.)]. DOI: 10.17816/RCF15148-52.
-
Joyce A.P., Wang M., Lawrence-Henderson R. et al. One mouse, one pharmacokinetic profile: quantitative whole blood serial sampling for biotherapeutics // Pharm Res. 2014. Vol. 31. N. 7. P. 1823–1833. DOI: 10.1007/s11095‑013‑1286‑y.
-
Liu L., Cao B., Aa J. et al. Prediction of the pharmacokinetic parameters of triptolide in rats based on endogenous molecules in pre-dose baseline serum // PLoS One. 2012. Vol. 7. N. 8. P. e43389. DOI: 10.1371/journal.pone.0043389.
-
Law B., Temesi D. The design of pharmacokinetic studies to support drug discovery: the selection of the optimum number of animals for a study // European journal of drug metabolism and pharmacokinetics. 2003. Vol. 28. N. 3. P. 233–235.
-
Daublain P., Feng K.I., Altman M.D. et al. Analyzing the Potential Root Causes of Variability of Pharmacokinetics in Preclinical Species // Mol. Pharm. 2017. Vol. 14. N. 5. P. 1634–1645. DOI: 10.1021/acs.molpharmaceut.6b01118.
-
Жердев В.П., Литвин А.А. Роль и организация фармакокинетических исследований // Клиническая фармакокинетика. 2005. Т. 2. № 3. С. 1–3. [ZHerdev V.P., Litvin A.A. Rol’ i organizaciya farmakokineticheskih issledovanij // Klinicheskaya farmakokinetika. 2005. Vol. 2. N. 3. P. 1–3. (In Russ.)].
-
Aarons L., Ogungbenro K. Optimal design of pharmacokinetic studies // Basic and clinical pharmacology and toxicology. 2010. Vol. 106. P. 250–255. DOI: 10.1111/j.1742-7843.2009.00533.x.
-
Ette E.I., Kelman A.W., Howie C.A., Whiting B. Influence of inter-animal variability on the estimation of population pharmacokinetic parameters in preclinical studies // Clin. Research and reg. affairs. 1994. Vol. 11. N. 2. P. 121–139.
- Bermingham E., Davis J.L., Whittem T. Study design synopsis: Designing and performing pharmacokinetic studies for systemically administered drugs in horses // Equine Vet J. 2020. Vol. 52. N. 5. P. 643–650. DOI: 10.1111/evj.13312.




