Морфофункциональные и гистохимические особенности строения левого легкого лабораторных аутбредных крыс-альбиносов
Зиновьев С.В., Плехова Н.Г., Радьков И.В. Морфофункциональные и гистохимические особенности строения левого легкого лабораторных аутбредных крыс-альбиносов. Лабораторные животные для научных исследований. 2021; 4. https://doi.org/10.29296/2618723X-2021-04-02
Резюме
Необходим поиск метода, с помощью которого возможна экстраполяция показателей метаболического процесса на органотканевой уровень организации легкого крыс альбиносов.
Цель исследования – выявить особенности строения левого легкого (ЛЛ) аутбредных крыс альбиносов на основании данных гистохимического анализа. Эксперимент проводили на половозрелых крысах-самцах Wistar (масса тела 200–250 г), возраст 12 нед. Для гистохимического выявления катионов кальция применяли метод окраски тканей ализариновым красным С (АКС) и борной кислотой. После анестезии и вивисекции цельное ЛЛ, извлеченное из грудной клетки, помещали на 48 ч в 5% раствор АКС в 96о этиловом спирте. Затем вырезали кусочки ткани и заливали в парафин, применяя для обезвоживания растворы хлороформа. Полученные на микротоме срезы депарафинировали в ксилоле и окрашивали спиртовым раствором борной кислоты (5 мин), после чего исследовали под флуоресцентным микроскопом. В ходе исследования установлено, что при суправитальном окрашивании спиртовым раствором АКС в строме и на поверхности альвеол легких крыс выявляются клетки, содержащие в цитоплазме от 1 до 7 оптически плотных гранул размером до 3 мкм. В тканях легких отмечаются базальные мембраны, клетки, содержащие структуры с диоловыми группами, и в них визуализируются ядра и ядрышки. В средней оболочке проксимальных генераций и самой каудальной вене наблюдались флюоресцирующие кардиомиоциты, около которых располагались светящиеся толстые соединительнотканные волокна. Дистальные вены паренхимы респираторного отдела не содержали кардиомиоцитов. Флюоресценция бронхов, окрашенных АКС и борной кислотой, в красном диапазоне указывала на повышенное содержание сахаров и тирозинов, тогда как яркое свечение соединительнотканных волокон слизистой оболочки и базальных мембран в желто-зеленом диапазоне – на низкое содержание тирозина и сахаров.
Таким образом, метод обработки тканей ЛЛ с окраской его тканей АКС и борной кислотой позволяет провести более четкое по сравнению с рутинным гистологическим способом визуализацию структур бронхов, вен и артерий.
Органы дыхания крыс являются экспериментальной моделью для исследования ряда пульмонологических заболеваний, в том числе хронической обструктивной болезни легких, легочной гипертензии и эмфиземы и др. [1–4]. Для строения левого легкого (ЛЛ) крыс характерно наличие одной доли, отсутствие междолевой щели, при этом левый главный бронх дает многочисленные сегментарные бронхи [2, 5]. ЛЛ белой крысы состоит из краниальной и каудальной долей, причем последняя вдвое меньше, чем первая, что отличает его от правого, которое включает 4 доли [5]. При этом наличие междолевой борозды является важнейшим фактором, определяющим эффективность экскурсии легких. Оценивая реактивность органов дыхания крыс, необходимо учитывать особенности их иннервации [6, 7]. Так, показано наличие кардиопульмонарного рефлекса Геринга–Брейера, срабатывающего для предотвращения чрезмерного раздувания легкого [8]. В отличие от большинства других органов высокая плотность иннервации в легких в сосудах большого калибра снижена в периферических отделах [6, 5]. Так, в дистальных частях трубчатых структур и периферических отделах паренхимы чувствительные и двигательные нервные окончания представлены в малом количестве. К сожалению, количество работ, включающих данные по изучению иннервации органов дыхания крыс, немногочисленны и противоречивы. Тем не менее учитывая низкий уровень иннервации периферических отделов, необходимы более углубленные знания о регуляторном функционировании гуморальной, эндокринной, аутокринной и паракринной систем дистальных отделов респираторного тракта и ацинуса легких крыс. С этой позиции известная для этого органа особенность обмена уроновых кислот, сахаров и тирозинов [8], которая оказывает влияние на антиоксидантный статус при развитии патологии, приобретает определенный интерес для исследования. На данном этапе необходим метод, дающий возможность установить связь между показателями метаболических процессов на уровне клеток и структурной организацией легких крыс. Несмотря на внедрение разнообразных биохимических и биофизических технологий, необходимых для решения многих вопросов, связанных с жизнедеятельностью клеток и тканей, гистологический метод позволяет охарактеризовать процессы, происходящие на различных структурных уровнях организации органов и тканей. В свою очередь гистохимический анализ тканей предназначен для исследования особенностей обмена веществ в тканевых структурах. В отношении органов дыхания показано, что ализарин красный С (АКС) и нитрат серебра маркируют в ацинусе легких клетки, дифферонная принадлежность которых пока остается неизвестной [8].
Цель исследования – на основании данных гистохимического анализа выявить особенности строения ЛЛ аутбредных крыс-альбиносов.
Материал и методы
Эксперимент проводили на 10 половозрелых крысах-самцах Wistar (масса тела 200–250 г, возраст 12 нед), полученных из питомника лабораторных животных (Пущино, филиал Института биоорганической химии им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН), в соответствии с положениями Хельсинкской декларации и ре-комендациям Директивы 2010/63/EU Европейского парламента и Совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Дизайн исследования одобрен междисциплинарным этическим комитетом ФГБОУ ВО ТГМУ Минздрава России (протокол заседания этического комитета №3 от 20.09.17). Эвтаназию животных осуществляли, используя передозировку анестетика – внутримышечное введение золетила (Virbac Sante Animale, Франция) в дозе 5 мг/кг с последующим извлечением жизненно важных органов, в том числе ЛЛ. За 15 мин до введения препарата подкожно вводили атропина сульфат в дозе 0,05 мг/кг. После анестезии в момент вивисекции ЛЛ извлекали из грудной клетки и помещали в 5% раствор АКС на основе 96о этилового спирта. В указанном растворе проводили одномоментную фиксацию и окрашивание АКС легкого в течение 48 ч, после чего обезвоживали кусочек ткани размером 10×10×10 мм3 в хлороформе и заливали в парафин. На микротоме изготавливали срезы толщиной 5 мкм, помещали на предметные стекла с адгезивным покрытием, депарафинировали и окрашивали спиртовым раствором борной кислоты (БК) в течение 5 мин с последующей промывкой в дистиллированной воде. Препараты изучали с помощью микроскопа Zeiss Scope A1 (Zeiss, Германия) при возбуждающей длине волны 470 нм. Оценку флюоресценции проводили при длине волны желто-зеленого (510–590 нм) и красного (630–760 нм) спектра. Контрольные препараты обесцвечивали в солянокислом спирте и окрашивали гематоксилином Эрлиха и эозином. Для выявления аскорбиновой кислоты использовали cуправитальное окрашивание криостатных срезов легких раствором азотнокислого серебра [9, 10].
Результаты
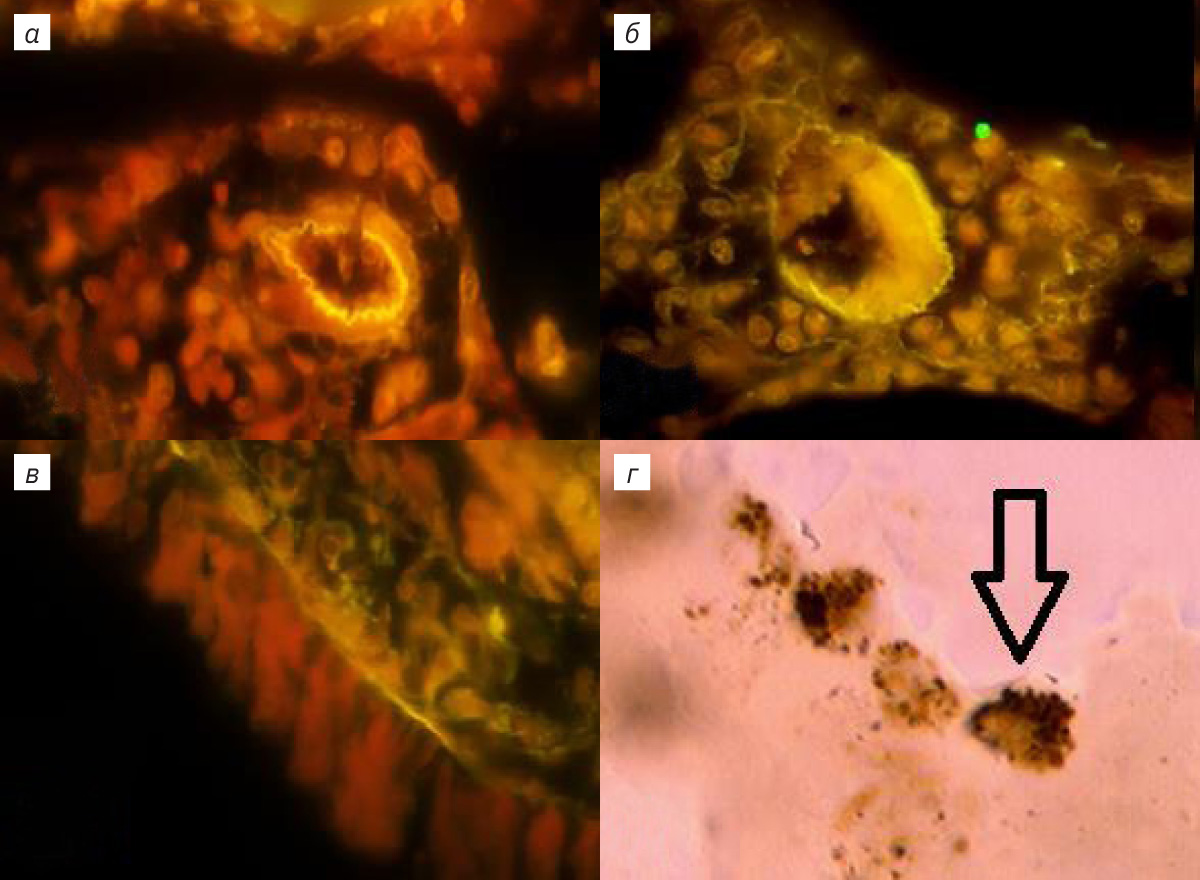
ЛЛ крысы имеет овальную, уплощенную и листовидную с заостренными краями форму. Выявляются краниальный, вентральный и дорсальный края, а также заостренный каудальный угол. Краниальный край округлой формы, вентральный и дорсальные края соединяются под углом в каудальный угол, при этом междолевая щель в ЛЛ отсутствует. В области корня легкого легочная артерия (ЛА), вена (ЛВ) и главный бронх (ГБ) окружены рыхлой соединительной тканью. Включения жировой ткани обнаруживались в интрамуральном треугольнике, находящемся в пространстве между паренхимой и адвентициальной оболочкой ГБ легких, окруженном стенками ЛА и ЛВ. Отмечались липидассоциированные лимфоидные кластеры (ЛАЛК), представляющие собой образования округлой формы с многочисленными лимфоцитами. У интактных животных ЛАЛК были обнаружены в 40% случаев, их размер составлял 25,0±1,2 мкм. При изучении ворот ЛЛ обнаружены инкапсулированные механорецепторы, расположенные на латеральной поверхности адвентициальной оболочки ГБ и вентральной поверхности экстрапульмонарного отдела ЛВ. В корне ЛЛ находятся генерации трубчатых структур ГБ, ЛА и ЛВ, локализованные в каудальном и краниальном отделах ЛЛ. Краниальные бронхи, артерии и вены занимают область размером 3–5 мм на латеральной поверхности и входят в паренхиму легких. У крыс в возрасте 12 нед каудальные трубчатые структуры длиной 15–18 мм расположены на латеральной поверхности на всем протяжении борозды области ЛВ и входят в паренхиму ЛЛ. ЛА располагается медиально, промежуточное положение занимает бронх, ЛВ размещена наиболее латерально. Между наружной стенкой каудальной ЛВ и адвентициальной оболочкой бронха располагаются инкапсулированные механорецепторы диаметром 15–25 мкм, которые выявляются при окрашивании тетраоксидом осмия, АКС и гематоксилином [4]. При использовании в качестве красителей АКС и БК в препаратах под оптическим микроскопом в тканях ЛЛ наблюдались внутренняя и средняя оболочка каудальной ЛА. Выраженная адвентициальная оболочка отмечалась во всех интрамуральных бронхах. Также определялась интенсивно окрашенная АКС слизистая оболочка терминальных бронхиол, содержащая гладкомышечные элементы и бронхиальный секрет. При увеличении в 1250 раз изучали респираторный отдел ЛЛ, окрашенный АКС. Подсчитывали в 50 полях зрения количество клеток стромы и на поверхности альвеол ацинуса, которые содержали от 1 до 8 включений в цитоплазме, при отсутствии окраски ядер (рис. 1, а). В одном поле зрения количество таких клеток достигало 0,2±0,045. При окраске ткани ЛЛ в уксуснокислом растворе нитрата серебра в ацинусе легкого выявлялись округлые клетки, содержащие аскорбиновую кислоту (рис. 1, г).
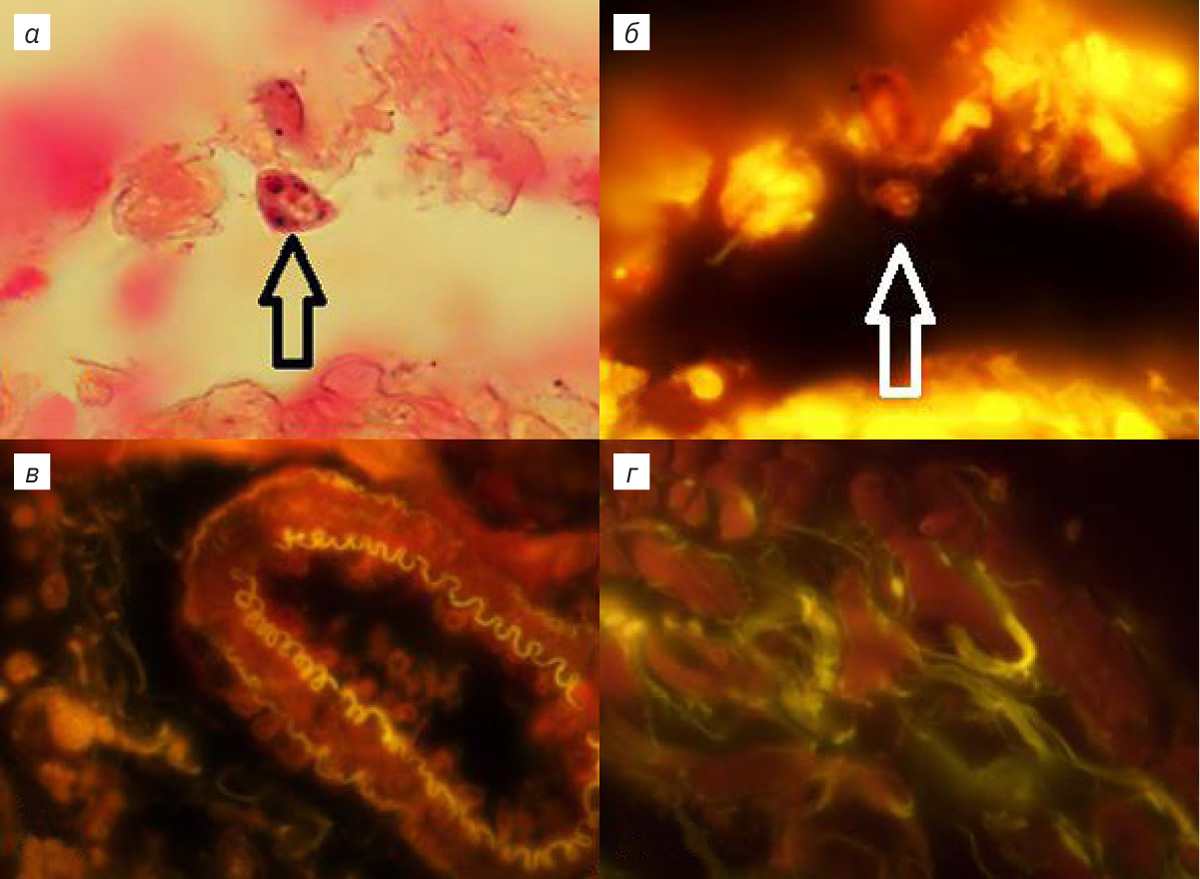
При возбуждении зеленым светом в легочных структурах отмечалось свечение клеток, окрашенных АКС, в красном диапазоне. В случае дополнительной окраски БК определялась флюоресценция клеток, а также межклеточных экстра- и интрамуральных легочных структур в желтом диапазоне (рис. 1, 2). Паренхима, клетки эпителия и стромы респираторного отдела легкого их ядрышки, ядерные мембраны и цитоплазма флюоресцировали в красном и желто-зеленом диапазоне (см. рис. 1, б, г; 2, б, в). Определялись тонкие светящиеся волокна стромы ацинуса ЛЛ толщиной 1–3 мкм и разреженные участки респираторного эпителия (см. рис. 1, б, г; 2, б). Базальная мембрана и капилляры паренхимы не флюоресцировали, тогда как выявлялось более яркое свечение артериальных сосудов с небольшим количеством форменных элементов. Диаметр их просвета составлял от 20 до 100 мкм, а клетки наружной, средней и внутренней оболочки флюоресцировали в красном диапазоне (см. рис. 1, г; 2, а), наружная и внутренняя оболочка ЛА разделялась эластическими мембранами с ярко-желтым свечением (см. рис. 1, г; 2, а). Свечение эластических волокон оболочки каудальной ЛА не обнаружено. Интрамуральные ветви ЛА в составе адвентициальной оболочки бронхов сопровождали дистальные дегенерации воздухоносных путей. Периваскулярное пространство ЛА было заполнено соединительнотканными волокнами и клетками, флюоресцирующими в красном и желто-зеленом диапазоне, в межклеточном пространстве свечение отсутствовало (см. рис. 1, г; 2, а). В средней оболочке проксимальных генераций и самой каудальной вене наблюдались флюоресцирующие кардиомиоциты, около которых располагались светящиеся толстые соединительнотканные волокна (рис. 1, в). Дистальные вены паренхимы респираторного отдела ЛЛ с нефлюоресцирующей слаборазвитой средней и наружной оболочкой не содержали кардиомиоцитов (см. рис. 2, б). В просветах этих вен обнаруживались светящиеся форменные элементы крови и внутренняя базальная мембрана (см. рис. 2, б). При спадении вен контуры внутренней эластической мембраны приобретали изломанную и зигзагообразную форму. В каудальном бронхе флюоресцировал реснитчатый цилиндрический однорядный и двухрядный эпителий (см. рис. 2, в). В проксимальных генерациях и слизистой оболочке бронха содержались кровеносные сосуды со светящимися средней оболочкой и внутренней базальной мембраной. В соединительнотканных волокнах диметром от 5 до 8 мкм базальной мембраны, на которой был расположен бронхиальный эпителий, а также в адвентициальной оболочке определялась флюоресценция желто-зеленого диапазона (см. рис. 2, в). Тогда как в проксимальных отделах и хрящевой ткани каудального бронха и слизистой оболочки дистальных генераций воздухоносных путей была отмечена слабая флюоресценция (см. рис. 2, в). В средней оболочке терминальных и респираторных бронхиол определялись клетки, флюоресцирующие в красном диапазоне.
Обсуждение
Размер ЛЛ превышает таковой правого легкого, имеет уплощенную форму, без междолевой щели, что указывает на его физиологические особенности. В момент вдоха и выдоха изменяется угол бифуркации генераций и дыхательных путей и кровеносных сосудов ЛЛ, что оказывает влияние на аэродинамику бронхов и гидродинамику кровеносных сосудов и выражается в затрудненности экскурсии. Для ЛЛ крысы характерно наличие структурного аппарата, отвечающего за рефлекс Геренга–Брейера и кардиопульмонарные рефлексы, и отсутствие рецепторных структур в области интрапульмонарных легочных артерий, что подтверждает преимущественную иннервацию вен и бронхов у крыс [6, 7]. На функциональную особенность ЛЛ указывает поверхностное, экстрапульмонарное расположение корня всех долей в области борозды каудальной вены. Каудальные и краниальные вены, артерии и бронхи размещены в противоположных длине легкого направлениях [10]. В адвентиции главного и каудальных бронхов, общей и каудальных вен ЛЛ обнаруживаются инкасулированные механорецепторы. Артериальная и венозная ветви начинались в левой части ЛЛ от ворот в ростральной четверти дорсомедиальной границы как единая ось, дальше она проходила в каудальном направлении вдоль дорсальной трети и уже в нижней части разветвлялась на шесть длинных первичных отростков. Часть отростков располагалась в вентролатеральном направлении, другая часть коротких первичных ветвей – в дорсомедиальном. Некоторые авторы, отрицая наличие двух долей в ЛЛ, признают, что первые две длинные первичные ветви ЛВ составляют общий ствол, отходящий от экстрапульмонарного отдела общей левой вены в краниальной части. Это касается и краниальной генерации главного бронха и ЛА. У крыс разветвление дыхательных путей происходит в меньшей степени, чем у людей, и нет респираторных бронхиол [2]. В самом краниальном бронхе и его проксимальных генерациях определяются реснитчатые клетки, бронхиальные железы отсутствуют. У стромы ацинуса ЛЛ отмечается высокая эластичность, что обусловлено тонкой структурой соединительнотканных волокон. Ветви ЛА следуют за дыхательными воздухоносными путями, а ЛВ располагаются от них независимо от периферии к воротам легкого. Если каудальные ЛА эластические, то проксимальные являются мышечными сосудами. У дистальных вен имеется очень тонкая и податливая стенка по причине слабого развития мышц, что указывает на перемещение в них крови при воздействии внешних механических и гравитационных факторов (например, экскурсия легких). На мышечно-эластический каркас дистальных генераций каудальных ЛФ указывает обнаруженная флюоресценция. В проксимальных венах кровь течет независимо от воздействия внешних механических и гравитационных факторов, о чем свидетельствует наличие в средней оболочке легочного миокарда и хорошо выраженного соединительного каркаса. Все перечисленные признаки позволяют дифференцировать уровень генерации трубчатых структур ЛЛ. Антиоксиданты являются регулирующими важными факторами развития заболеваний органов дыхания. Для респираторного отдела легких крыс характерно наличие клеток с сильным антиокислительным потенциалом. Однако пока нет более точных методов для окончательного уточнения дифферонной принадлежности этих клеток. При суправитальном окрашивании уксуснокислым нитратом серебра в респираторном отделе легких выявляются клетки, содержащие большое количество аскорбиновой кислоты, их цитоплазма окрашена в черный цвет [8]. В отношении молекулярных маркеров АКС и БК показано, что их флюоресценция зависит от диоловых групп производных тирозина и сахаров [11]. При суправитальном окрашивании спиртовым раствором АКС в строме и на поверхности альвеол легких крыс выявляются клетки, содержащие в цитоплазме от 1 до 7 оптически плотных гранул размером до 3 мкм. Предполагалось, что такие клетки содержат большое количество катионов кальция [8]. Флюоресцентный анализ показал, что эти клетки, окрашенные АКС и БК, не светятся, по причине высокого содержания производных тирозина, сахаров и аскорбиновой кислоты [11]. Это подтверждается данными о механизме флюоресценции использованных красителей, которые имеют большое количество Π π-π-связей, и способны отражать окислительно-восстановительный характер выявляемых морфобиохимических процессов [12]. Установлена красная флюоресценция бронхов, окрашенных АКС и БК, которая указывает на повышенное содержание сахаров и тирозинов в этих тканях. Наличие диолов гасит флюоресценцию АКС, сенсибилизированную БК [11], тогда как яркое свечение в желто-зеленом диапазоне соединительнотканных волокон слизистой оболочки и базальных мембран указывало на низкое содержание тирозина и сахаров. Незначительное количество механорецепторов в периферических отделах ЛЛ у крыс указывает на особенности ноницепции у этих лабораторных животных.
Заключение
Таким образом, результаты исследования подтверждают морфологические особенности ЛЛ у крыс, что позволяет использовать этих животных для экспериментального моделирования хронической обструктивной болезни легких, легочной гипертензии, эмфиземы легких и других заболеваний. Предложенный метод обработки легочной ткани позволяет получить четкую визуализацию структур органов дыхания, а дополнительное иммуногистохимическое окрашивание ее препаратов при дополнительной информации снизить количество экспериментальных животных в группе.
Вклад авторов
Зиновьев С.В. – концепция и дизайн работы; сбор, анализ и интерпретация результатов работы; написание текста.
Плехова Н.Г. – утверждение окончательного варианта статьи для публикации; согласие нести ответственность за все аспекты работы, надлежащее изучение и решение вопросов, связанных с достоверностью данных и целостностью всех частей статьи.
Радьков И.В. – сбор, анализ и интерпретация результатов работы.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Матичин А.А., Кательникова А.Е., Крышень К.Л. Особенности отбора бронхоальвеолярного лаважа у лабораторных животных. //Лабораторные животные для научных исследований. 2019; 4: 6. [Matichin A.A., Katel'nikova A.E., Kryshen K.L. Specific techniques of bronchoalveolar lavage collecting from laboratory animals. //Laboratornye zhivotnye dlya nauchnyh issledovanij. 2019. 4: 6. (In Russ )] doi.org/10.29296/2618723X-2019-04-06.
- Wright J.L., Cosio M., Churg A. Animal models of chronic obstructive pulmonary disease. //Am J Physiol Lung Cell Mol Physiol. 2008 ; 295(1): 1–15. doi: 10.1152/ajplung.90200.2008.
- Королев И.Б., Котельников В.Н., Кириллов О.И., Антонюк М.В. Некоторые аспекты вегетативной дисфункции при экспериментальной артериальной гипертензии у крыс//Тихоокеанский медицинский журнал. 2010; 1 (39): 18-20.[ Korolev I.B., Kotel'nikov V.N., Kirillov O.I., Antonyuk M.V. Some aspects of autonomic dysfunction in experimental arterial hypertension in rats //Tihookeanskij medicinskij zhurnal. 2010; 1 (39): 18-20. (In Russ )]
- Зиновьев С.В., Целуйко С.С., Селиверстов С.С., Горбунов М.М. Cтрессорное легкое крыс как экспериментальная модель легочной гипертензии и гиперемии. //Бюллетень физиологии и патологии дыхания. 2018. 67: 102-110. [Zinov'ev S.V., Celujko S.S., Seliverstov S.S., Gorbunov M.M. Stressing lung of rats as an experimental model of pulmonary hypertension and hyperemia Byulleten' fiziologii i patologii dyhaniya. 2018; 67: 102-110. (In Russ )].
- Петренко В.М. Aнатомия легких у белой крысы. // Международный журнал прикладных и фундаментальных исследований. 2013; 10-3: 414- 417; [Petrenko V.M. Anatomy of the lungs in a white rat. Mezhdunarodnyj zhurnal prikladnyh i fundamental'nyh issledovanij. 2013. № 10-3. С. 414-.417 (In Russ )]
- Kummer W. Pulmonary vascular innervation and its role in responses to hypoxia size matters // Proc. Am. Thorac. Soc. 2011; 8 (6):471–476. (In Russ )]. doi: 10.1513/pats.201101-013MW.
- Чумасов Е.И., Ворончихин П.А., Коржевский Д.Э. Эфферентная иннервация сосудов и бронхов легкого крысы (иммуногистохимическое исследование). Морфология. 2012; 142(4): 49-53. [Chumasov E. I., Voronchikhin P. A., Korzhevskii D. É. Efferent innervation of pulmonary blood vessels and bronchi in rat (an immunohistochemical study). //Morfologiia. 2012;142(4):49-53. (In Russ )].
- Uggere T.A., Abreu G.R., Sampaio K.N., Cabral A.M., Bissoli N.S. The cardiopulmonary reflexes of spontaneously hypertensive rats are normalized after regression of left ventricular hypertrophy and hypertension.// Braz J Med Biol Res. 2000 ; 33(5):589-94. doi: 10.1590/s0100-879x2000000500014.
- Зиновьев С.В. Гистохимическая характеристика венозного русла респираторного отдела легких экспериментальных животных, подвергнутых хроническому переохлаждению, после введения в организм дигидрокверцетина. Бюллетень физиологии и патологии дыхания. 2012; 45: 57-61. [Zinov'ev S.V., Histochemical characteristic of the vein channel of lungs respiratory part of experimental animals subjected to chronic hypothermia after dihydroquercetin intake Byulleten' fiziologii i patologii dyhaniya. 2012; 45: 57-61. (In Russ )].
- Chinoy N.J., Sanjeevan A.G. On the specificity of alcoholic acidic silver nitrate reagent for the histochemical localization of ascorbic acid. //Histochemistry. 1978; 56: 275–282. doi.org/10.1007/BF00495989
- Hosoyamada Y., Ichimura K., Koizumi K., Sakai T. Structural organization of pulmonary veins in the rat lung, with special emphasis on the musculature consisting of cardiac and smooth muscles. //Anat Sci Int. 2010; 85: 152–159 . doi.org/10.1007/s12565-009-0071-9
- Lacina, K., Skládal, P. James T.D. Boronic acids for sensing and other applications – a mini-review of papers published in 2013. //Chemistry Central Journal. 2014; 8: 60 (). Doi: 10.1186/s13065-014-0060-5
- Mako, T. L., Racicot, J. M., Levine, M. Supramolecular Luminescent Sensors. //Chem Rev. 2019; 119(1):322-477 doi: 0.1021/acs.chemrev.8b00260.




