Выбор оптимального метода детекции жизнеспособности клеточных культур для тестов на пролиферативную активность и цитотоксичность
Афанасьева А.Н., Сапарова В.Б., Сельменских Т.А., Макаренко И.Е. Выбор оптимального метода детекции жизнеспособности клеточных культур для тестов на пролиферативную активность и цитотоксичность. Лабораторные животные для научных исследований. 2021; 2. https://doi.org/10.29296/2618723X-2021-02-03
Резюме
Исследования жизнеспособности проводятся для измерения доли жизнеспособных клеток после воздействия на них вещества, лекарственного средства или манипуляции, например, в исследованиях цитотоксичности или пролиферативной активности, после криохранения или клеточного разделения и т.д. В этих исследованиях любые изменения in vitro могут быть интерпретированы для предсказания ответа in vivo таких же или похожих клеток. Европейское агентство по лекарственным средствам (EMA) поддерживает внедрение принципов 3Rs – заменять, сокращать и усовершенствовать – для этичного использования животных при тестировании лекарств. Данная статья выполнена с соблюдением принципа 3Rs и не содержит описания каких-либо исследований животных в качестве объектов.
В настоящее время для оценки жизнеспособности клеток существует несколько методов, основанных на различных биохимических процессах, происходящих внутри клетки. Такие методы могут включать как прямое детектирование АТФ, так и определение активности митохондриальных дегидрогеназ. Выбор используемого в исследовании метода будет зависеть от изучаемого агента, природы предполагаемого ответа, клеток-мишеней, в частности, вариабельности данных, применимых в каждом конкретном случае.
Цель данного исследования – проведение сравнительного анализа 3 следующих распространенных методов определения жизнеспособности клеток:
- МТТ-тест;
- анализ живых клеток с использованием резазурина;
- люминесцентный анализ CellTiter-Glo®.
Материал и методы. Выбранные методы определения жизнеспособности: МТТ-тест, анализ живых клеток с использованием резазурина, люминесцентный анализ жизнеспособности клеток CellTiter-Glo . В качестве клеточных линий использовали различные линии по типу роста культуры клеток: адгезионная (CHO-K1 – клетки яичников китайского хомячка) и смешанная (32D clone 3 – клетки костного мозга мыши). Параметры оценки: определение чувствительного диапазона концентраций клеток и коэффициента вариации (CV) внутри каждой концентрации.
Результаты. По результатам исследования наиболее чувствительным, имеющим низкие показатели вариабельности в диапазоне концентраций и соответственно наиболее оптимальным, оказался анализ живых клеток с использованием резазурина и люминесцентный анализ жизнеспособности клеток CellTiter-Glo®.
Введение
В настоящее время как альтернативная замена использования животных моделей широко применяются методы in vitro, что позволяет снизить количество тестируемого вещества, ускоряет анализы и в последующем снижает общую стоимость лекарственного средства [1]. Одним из основных цитологических тестов является определение жизнеспособности (предназначен для прогнозирования выживаемости) и пролиферации (определение динамических свойств клеточной культуры), которое применяется для большого количества химических веществ [2]. Жизнеспособность клеток – это количество живых клеток, присутствующих в образце (с губительным или обратным действием), а под пролиферацией клеток понимают механизм действия определенных генов, белков и биохимических процессов, вовлеченных в выживание, или гибель клеток после воздействия токсичных агентов. Обычно методы, используемые для определения жизнеспособности, также являются общими для обнаружения пролиферации клеток.
Существует множество методов анализа жизнеспособности, основанных на различных процессах, протекающих в клетках, таких как активность ферментов, проницаемость клеточной мембраны, адгезия клеток, продукция АТФ, производство коэнзимов и активность поглощения нуклеотидов. Эти методы могут быть по большей части классифицированы на различные категории: методы исключения красителей, например краситель трипановый синий (I), методы, основанные на метаболической активности (II), анализ количества АТФ (III), анализы с использованием сульфородамина B (IV), анализ жизнеспособности по маркерам протеазы (V), клоногенный анализ (VI), анализы пролиферации клеток по синтезу ДНК (VII) и микроспектроскопия комбинационного рассеяния (VIII) [3]. Однако в связи с трудоемкостью и/или большой погрешностью измерения не все перечисленные методы широко применяются для анализа лекарственных препаратов.
В проведенном исследовании использовали 2 наиболее распространенных в лабораторной практике метода определения жизнеспособности клеток, включенных в большинство протоколов молекулярной биологии и медицины [4, 5] – МТТ-тест и анализ живых клеток с использованием резазурина, которые относятся ко II группе методов в приведенной выше классификации, и один модифицированный: анализ жизнеспособности клеток с применением набора CellTiter-Glo®, который относится к III группе (анализ количества АТФ).
МТТ-анализ включает превращение водорастворимого желтого красителя [3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид], который при восстановлении дегидрогеназой и восстановителями, присутствующими в метаболически активных клетках, дает нерастворимый в воде пурпурный формазан [4, 6, 7] (рис. 1).
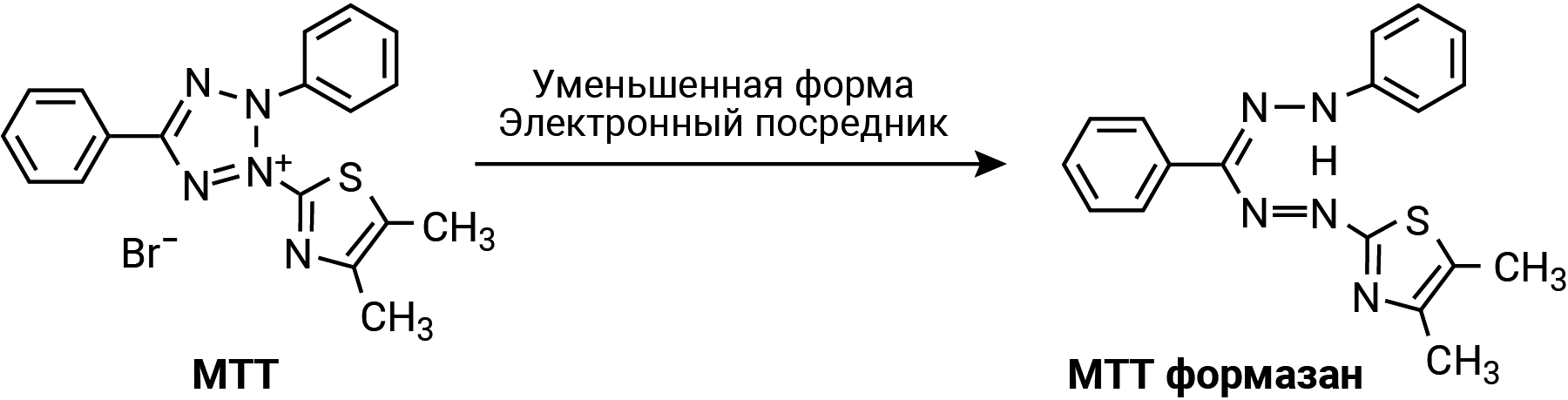
Липидорастворимый продук т форма-
зан может быть экстрагирован органическими растворителями и оценен с помощью спектрофо-тометрии. Метод с самого начала подразумевался в качестве анализа жизнеспособности культивируемых клеток [8]. На общедоступном ресурсе PubMed часто встречаются статьи, в которых описано, что местами восстановления и образования осадка формазана являются митохондрии и митохондриальная сукцинатдегидрогеназа жизнеспособных клеток восстанавливает МТТ до соответствующего формазана [9–12]. Однако встречаются статьи, в которых описано, что формазан также может локализоваться в липидных каплях клеток [13, 14].
Резазурин представляет собой водорастворимый краситель, который используется в лабораторной практике с 1950-х годов для оценки дрожжевой и бактериальной контаминации молока [15]. В отличие от МТТ, резазурин восстанавливается более широким спектром ферментов, кроме митохондриальных дегидрогеназ, его способны восстанавливать также цитохромы и дегидрогеназы, локализованные в цитоплазме клеток [16].
Резазурин проницаем для клеток и практически не флуоресцентен. При попадании в клетки резазурин восстанавливается до резоруфина благодаря активности клеточных окислительно-восстановительных ферментов (рис. 2), принимая электроны от NADPH, FADH2, FMNH2, NADH и цитохромов [17, 18].
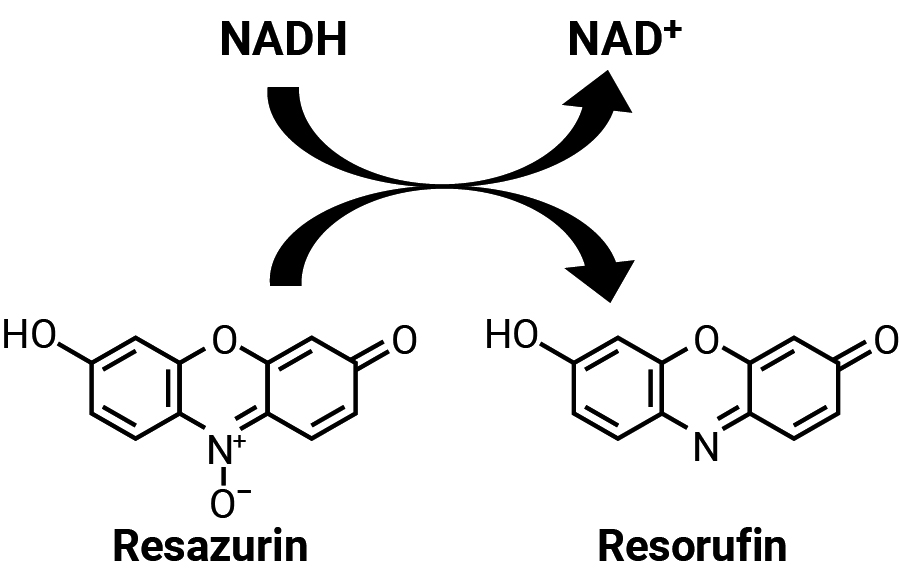
Данная реакция сопровождается изменением цвета от синего индиго до яркого флуоресцентного красного, который диффундирует из клеток в культуральную среду. Жизнеспособные клетки непрерывно превращают резазурин в резоруфин, тем самым генерируя количественную меру жизнеспособности клеток. Жизнеспособные клетки с активным метаболизмом могут преобразовать резазурин в резоруфиновый продукт, который является розовым или красновато-фиолетовым и флуоресцентным [19]. Основные преимущества анализа восстановления резазурина состоят в том, что он относительно недорогой, используется гомогенный формат и более чувствительный, чем анализы, использующие тетразолии (например, МТТ-тест).
Метод, который использует содержание АТФ в качестве маркера наряду с МТТ-тестом, широко распространен для оценки жизнеспособности клеток. Когда клетки теряют целостность мембраны, они не способны синтезировать АТФ, а эндогенные АТФазы быстро истощают любую оставшуюся АТФ из цитоплазмы.
В исследовании применялся набор для определения жизнеспособности клеток CellTiter-Glo® производства Promega. В данном наборе была модифицирована люцифераза для получения ее более стабильных молекул [19]. Стабильная форма люциферазы, как заявляет производитель, позволяет генерировать стабильный люминесцентный сигнал, одновременно ингибируя эндогенные ферменты, высвобождаемые во время лизиса клеток (например АТФазы) [20]. Схема люциферазной реакции представлена на рис. 3.
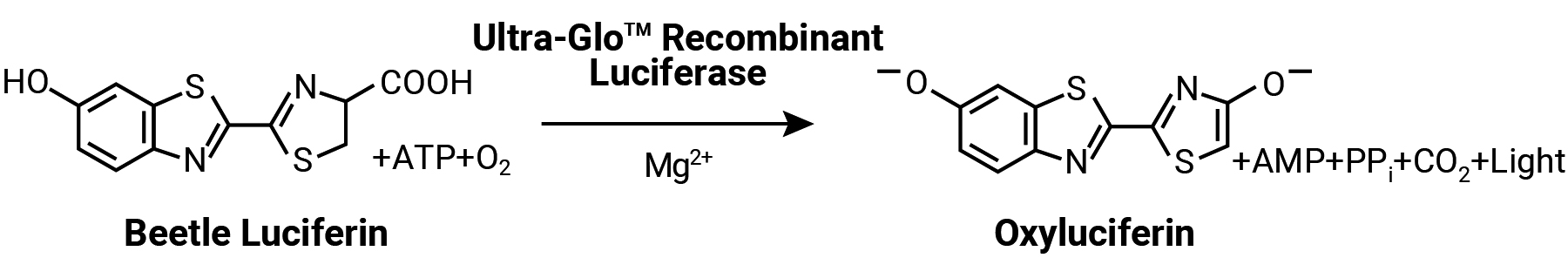
Анализ АТФ является самым быстрым в использовании при определении жизнеспособности клеток, наиболее чувствителен и менее подвержен артефактам, чем другие методы анализа жизнеспособности. Люминесцентный сигнал достигает устойчивого состояния и стабилизируется в течение 10 мин после добавления реагента. Преимущество анализа АТФ заключается в отсутствие необходимости длительно инкубировать популяцию жизнеспособных клеток для превращения субстрата (такого как тетразолий или резазурин) в окрашенное соединение [19].
Материал и методы
Культивирование клеток линии CHO-K1. Клетки яичников китайского хомячка линия CHO-K1 (ATCC «Американская коллекция клеточных культур», США) выращивали во флаконах для культивирования в среде, состоящей из смеси Ham’s F12 (Biosera, Франция) с добавлением 10% эмбриональной телячьей сыворотки (Capricorn, Польша) и смеси антибиотиков пенициллина G – 50 000 ед/фл, стрептомицина – 50 мкг/фл (Биолот, Россия) – 1 флакон на 450 мл среды при 37°C в атмосфере 5% CO2. В экспериментах использовали клетки 3–7 пассажей.
Культивирование клеток линии 32D clone 3. Клетки костного мозга мыши линии 32D clone 3 (ATCC «Американская коллекция клеточных культур», США) выращивали во флаконах для культивирования в среде, состоящей из смеси RPMI1640 (Биолот, Россия) с добавлением 10% эмбриональной телячьей сыворотки (Capricorn, Польша), 5 нг/мл интерлейкина-3 (IL-3, Sigma-Aldrich, США) и смеси антибиотиков пенициллина G – 50 000 ед/фл, стрептомицина –
50 мкг/фл (Биолот, Россия) – 1 флакон на 450 мл среды, инкубация проведена при 37°C в атмосфере 5% CO2. В экспериментах использовали клетки 3–7 пассажей.
Тест на жизнеспособность (МТТ-тест). Клетки CHO-K1 культивировали в 96-луночных планшетах (Eppendorf, Германия) в объеме 100 мкл в концентрациях 5–50 тыс. клеток на 1 лунку. В качестве нулевого контроля использовали полную питательную среду, по 8 повторов (лунок планшета) для каждой посевной концентрации. Планшет инкубировали при 37°C в 5% CO2 в течение 24±4 ч. Затем вносили в каждую лунку (в объеме 1:10) по 10 мкл 0,5% раствора красителя МТТ (Sigma-Aldrich, США). Инкубировали в тех же условиях в течение 2 ч (5% CO2, 37°C). Затем аккуратно удаляли надосадочную жидкость из лунок и добавляли по 100 мкл ДМСО. Растворяли формазан в течение 20 мин при 250 об/мин на орбитальном термостатируемом шейкере ELMI Skyline ST-3L (Латвия) при комнатной температуре и далее измеряли оптическую плотность при 570 нм на мультимодальном микропланшетном ридере CLARIOstar (BMG Labtech, Германия) с дальнейшим анализом данных в программе прибора MARS Data Analysis и статистическим анализом в программе GraphPad Prism 8.
Тест на жизнеспособность (анализ живых клеток с использованием резазурина). Клетки CHO-K1 и 32D clone 3 культивировали в 96-луночных планшетах (Sigma-Aldrich, США) по 100 мкл в концентрациях 5–50 тыс. клеток на 1 лунку. В качестве нулевого контроля использовали полную питательную среду, по 8 повторов (лунок планшета) для каждой посевной концентрации. Для CHO-K1 – Ham’s F12 + 10% FBS, а для 32D clone 3 – RPMI1640 + 10% FBS + 5 нг/мл IL-3. Планшет инкубировали при 37°C в 5% CO2 в течение 24±4 ч. Затем вносили в каждую лунку раствор красителя резазурина («Sigma-Aldrich», США) с конечной концентрацией в лунке 11,2 мкМ/мл в объеме, равном 10% от общего объема культуральной жидкости. Инкубировали в тех же условиях в течение 4 ч (5% CO2, 37°C). После встряхивали на орбитальном шейкере в течение 2 мин при 37°C и далее измеряли уровень флуоресценции при длине волны 590 нм с использованием длины волны возбуждения 560 нм на мультимодальном микропланшетном ридере CLARIOstar (BMG Labtech, Германия) с дальнейшим анализом данных в программе прибора MARS Data Analysis и статистическим анализом в программе GraphPad Prism 8.
Тест на жизнеспособность (люминесцентный анализ). Клетки CHO-K1 и 32D clone 3 культивировали в 96-луночных планшетах (Sigma-Aldrich, США) по 100 мкл в концентрациях 5–50 тыс. клеток на лунку. В качестве нулевого контроля использовали полную питательную среду. Для CHO-K1 это Ham’s F12 + 10% FBS, а для 32D clone 3 – RPMI1640 + 10% FBS + 5 нг/мл IL-3. Планшет инкубировали при 37°C в 5% CO2 в течение 24±4 ч. Затем остужали планшет до комнатной температуры с клетками в течение 1ч и вносили в каждую лунку реагент CellTitter-Glo в эквиобъемном соотношении с культуральной жидкостью. Затем клетки лизировали механически на орбитальном шейкере в течение 2 мин при комнатной температуре. Затем инкубировали планшеты в течение 10 мин для стабилизации люминесцентного сигнала, после чего регистрировали люминесценцию на мультимодальном микропланшетном ридере CLARIOstar (BMG Labtech, Германия) с дальнейшим анализом данных в программе прибора MARS Data Analysis и статистическим анализом в программе GraphPad Prism 8. Настройки на приборе включали Presets Ultra Glo, время интегрирования – 0,4 с на 1 лунку.
Анализ данных и статистический анализ. Основными показателями, при которых ориентировались в данном исследовании, были коэффициент вариации (coefficient of variation – CV), окно теста (Assay Window – AW) [21] и соотношение сигналов (Signal/Previous Ratio – SPR). Первичный анализ данных проводили, используя программное обеспечение прибора CLARIOstar (BMG Labtech, Германия) MARS Data Analysis Software 3.01 R2. Полученные результаты обрабатывали с использованием программного обеспечения Prism 8 (GraphPad Software, США).
Результаты
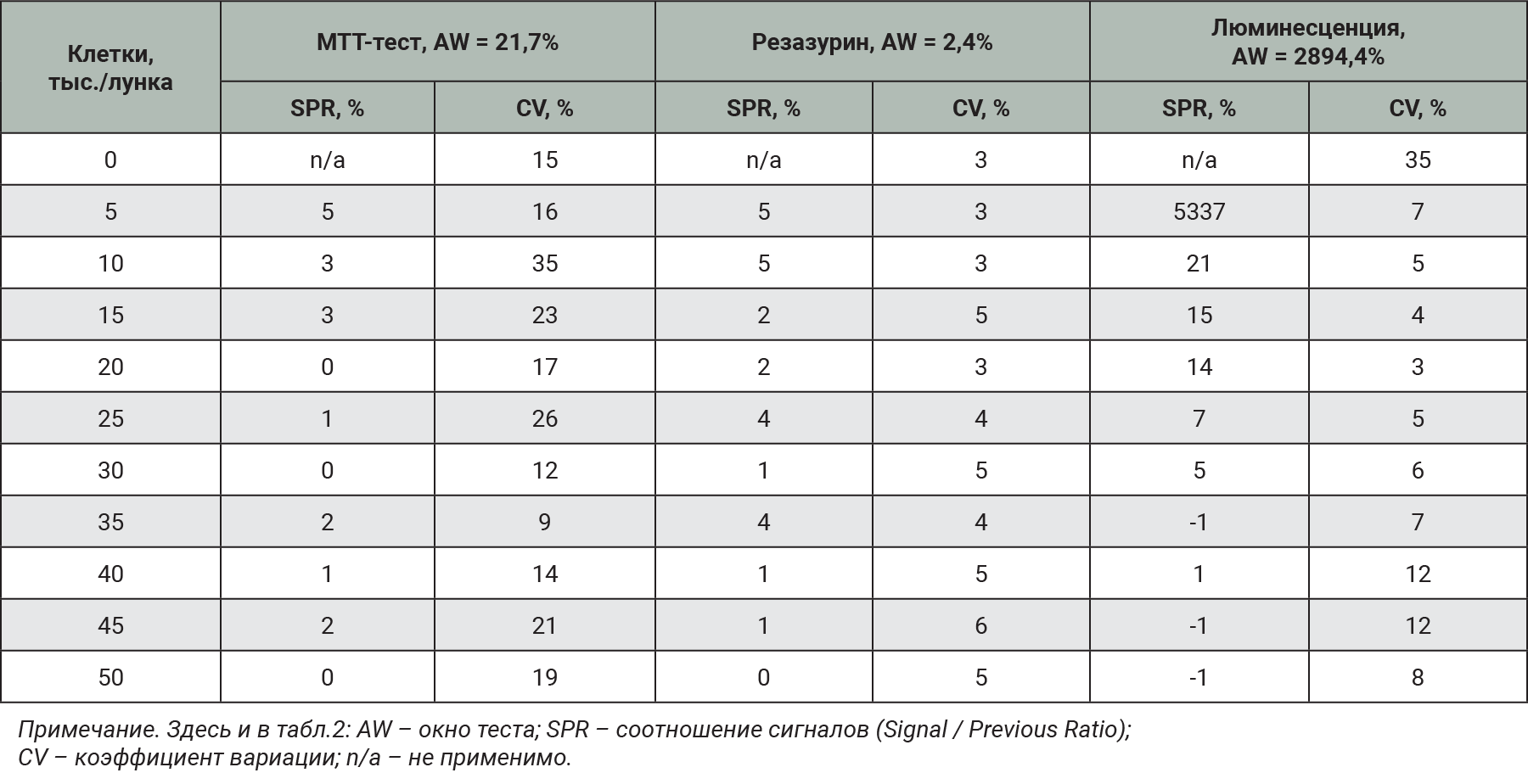
При обработке данных использовали показатели CV, SPR, AW и регрессионный анализ. CV показывает степень изменчивости по отношению к среднему показателю выборки [22]. Приемлемыми результатами считали, где CV⩽20%. SPR отражает процентное отношение сигнала каждой последующей концентрации клеток к предыдущей с поправкой на коэффициент вариации для определения чувствительного диапазона концентрации клеток в методике. Чувствительный диапазон методики определяется при значениях SPR >5%. AW – это процентное отношение максимальных и минимальных значений отклика, но без учета изменчивости сигнала. Окно теста можно считать приемлемым, если значение >30%. В регрессионном анализе рассматривали показатель R2 (коэффициент корреляции), за приемлемый результат принимали значения 0,95 и более. Для всех проведенных тестов результаты соответствуют критериям приемлемости (рис. 4, табл. 1 и 2).
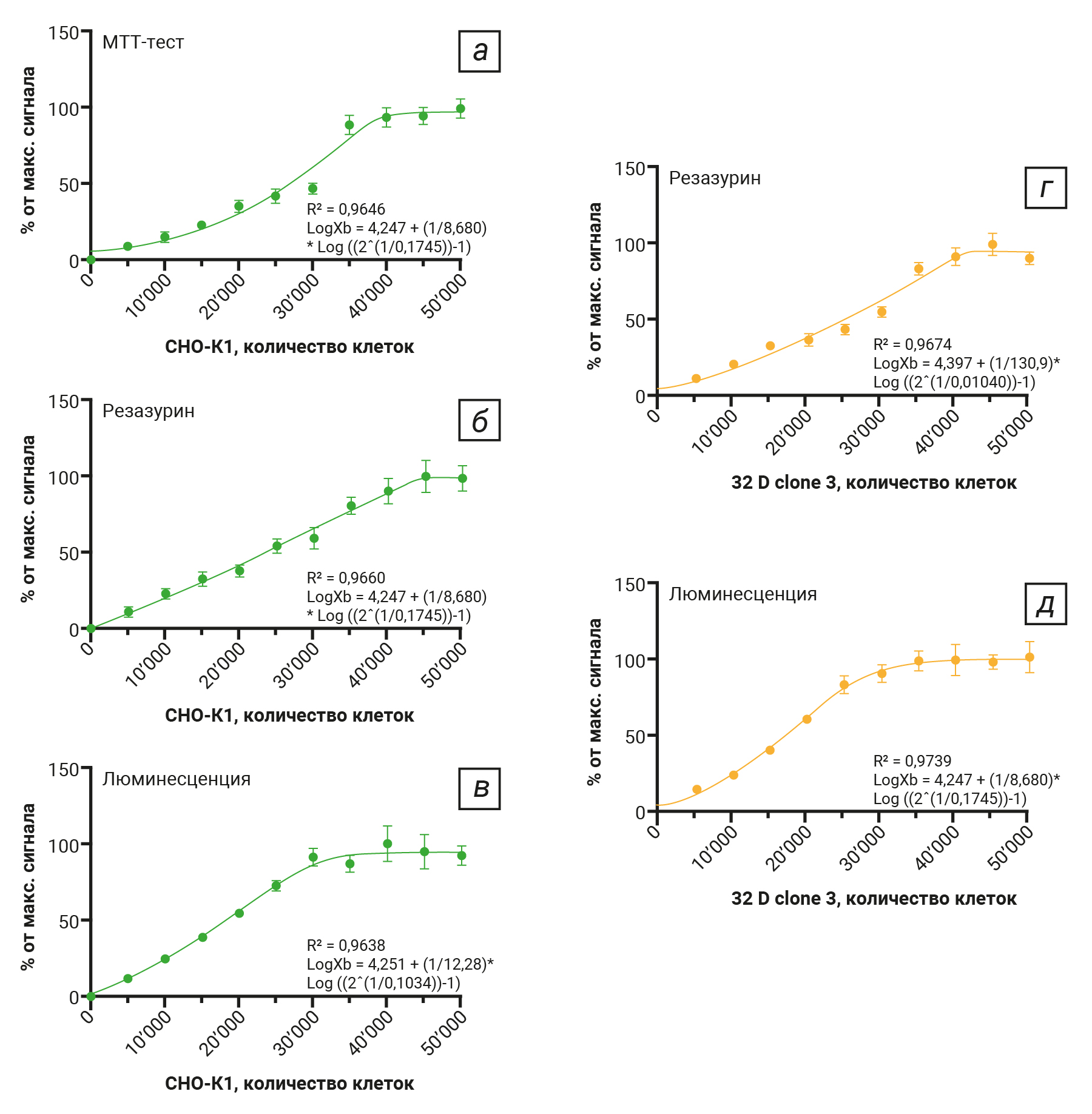
Метод с применением МТТ-теста плохо реализуется при использовании суспензионных или смешанных культур, так как подразумевает полное удаление среды культивирования на стадии растворения кристаллов формазана, данную проблему можно решить, осаждая клетки с помощью центрифугирования непосредственно в планшетах при наличии необходимого ротора. Клетки 32D clone 3 имеют смешанный тип роста и при отсутствии ротора для планшетов в тесте использовали только адгезионную клеточную линию CHO-K1, которую рассевали в концентрациях 5–50 тыс. клеток на 1 лунку. Инкубировали 24 ч и затем проводили измерение оптической плотности.
Результаты показали приемлемые значения CV ≤20%, значение AW составляло 21,7, для SPR положительные результаты были в сравнении концентрации клеток 0 и 5, 10 и 15, 30 и 35 тыс. При построении стандартной кривой наиболее подходящей стала асимметричная логистическая 5-параметрическая кривая, где при R2 в значении 0,9638 выявлена линейная зависимость, при этом R2 = 0,9646.
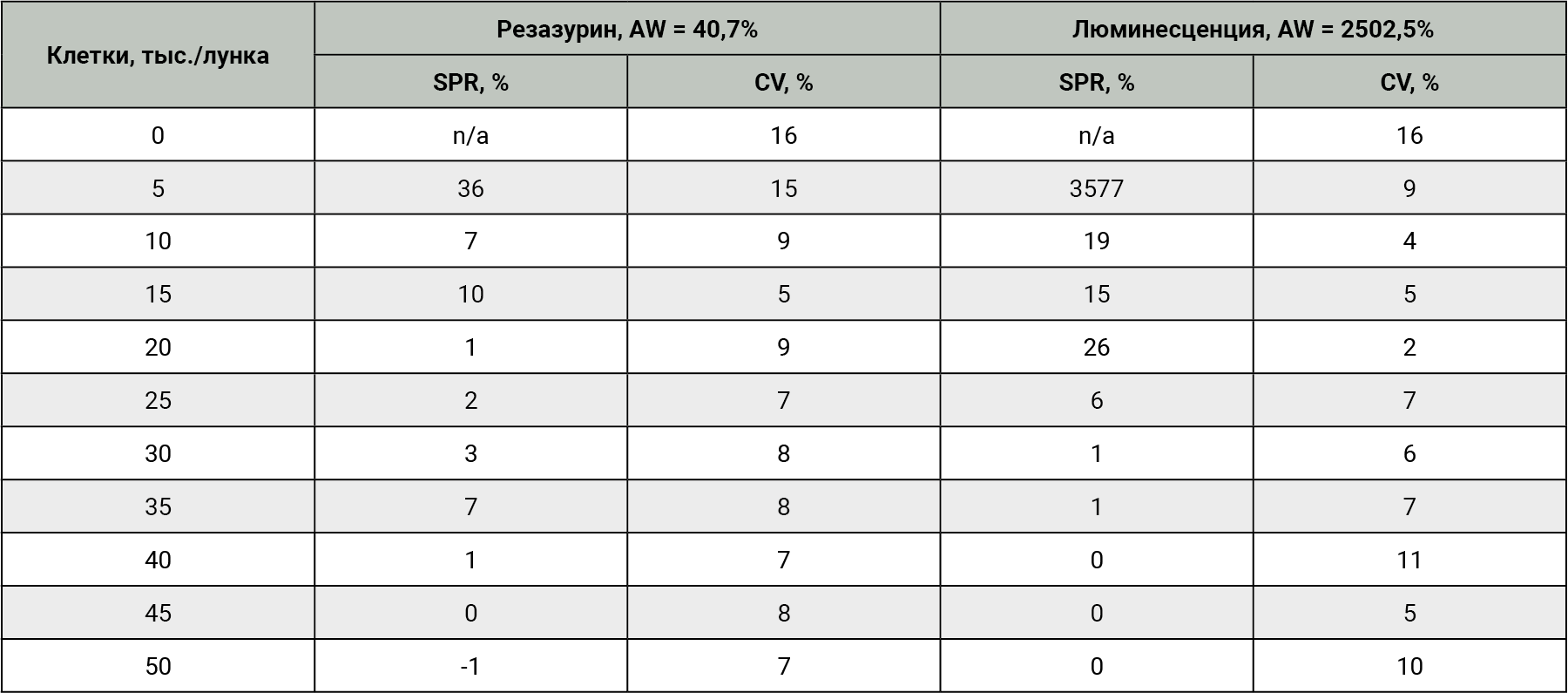
Оценку жизнеспособности методом окрашивания резазурином проводили на двух клеточных линиях CHO-K1 и 32 D clone 3, их рассевали в концентрациях от 5–50 тыс. клеток на 1 лунку. Инкубировали 24 ч, добавляли раствор резазурина, на 4 ч оставляли в CO2-инкубаторе и затем считывали флуоресценцию. Инкубационный период, необходимый для получения адекватного флуоресцентного сигнала выше фонового, обычно составляет от 1 до 4 ч и зависит от метаболической активности конкретного типа клеток, плотности клеток на лунку и других условий анализа, включая тип культуральной среды [19]. Соответственно инкубационный период должен быть оптимизирован и относительно коротким, чтобы избежать токсичности реагента, но в то же время достаточный, чтобы обеспечить адекватную чувствительность. В эксперименте для CHO-K1 результаты показали завышенный сигнал в фоновых лунках, где присутствовала только культуральная среда, для линии 32D clone 3 фоновый сигнал был гораздо ниже, значения коэффициента вариации в 2 тестах не превышали 20%, AW для линии CHO-K1 2% (высокий фоновый сигнал) и 40,7% для 32D clone 3. SPR для CHO-K1 доходит до 5% в концентрации клеток 0 и 5, 5 и 10 тыс.; для 32D clone 3 в концентрациях 0 и 5, 5 и 10, 10 и 15 тыс., 30 и 35 тыс. клеток – превышает 5%. Максимальное отличие SPR между концентрациями 0 и 5 тыс. клеток – 5% для CHO-K1 и 36% для 32D clone 3. При построении стандартной кривой выявлена линейная зависимость, где R2 в значении 0,9582 для CHO-K1 и 0,9674 для 32D clone 3.
Жизнеспособность методом люминесцентного анализа проводили на двух клеточных линиях CHO-K1 и 32 D clone 3, их рассевали в концентрациях от 5–50 тыс. клеток на 1 лунку. Инкубировали 24 ч, добавляли реагент CellTitter-Glo, 2 мин лизировали клетки и 10 мин стабилизировали сигнал, затем смотрели люминесценцию. Результаты продемонстрировали CV не более 20%, AW для CHO-K1 2894,4% и для 32D clone 3 2502,5%. Происходит увеличение сигнала при каждой последующей концентрации клеток (SPR) как для 32D clone 3, так и для CHO-K1. Максимальное отличие SPR между концентрациями 0 и 5 тыс. клеток – 5337% для CHO-K1 и 3577% для 32D clone 3. При построении стандартной кривой выявлена асимметричная логистическая пятипараметрическая кривая, где R2 в значении 0,9638 для CHO-K1 и 0,9739 для 32D clone 3.
Обсуждение
МТТ-тест является надежным методом, но различается по манипуляциям для адгезионных, суспензионных и смешанных культур, менее чувствительный в сравнении с методом окрашивания резазурином и является более длительным по времени исполнения из-за дополнительного этапа растворения кристаллов.
Метод окрашивания резазурином является более чувствительным, чем анализы с использованием тетразолия, имеет низкую вариабельность и в случае 32D clone 3 окно теста >30%. Однако в тесте для CHO-K1 зарегистрирован завышенный сигнал в фоновых лунках, что может говорить о присутствующих в культуральной среде компонентах, которые мешают адекватному определению жизнеспособности у данной культуры. Метод более простой в исполнении, по сравнению с МТТ-тестом, так как необходимо только внести раствор резазурина и оставить инкубировать клетки, после чего остается измерить флюоресценцию.
Люминесцентный анализ со стабильной люциферазой показал наибольший диапазон чувствительности. Данный метод может уловить сигнал от клеток в количестве меньшем, чем 5000 клеток/лунка, что говорит о возможности обнаружения клеток, число которых ниже пределов обнаружения стандартных колориметрических и флуорометрических анализов. Данный анализ является гомогенным и самым быстрым среди трех использованных методов.
Заключение
Из всех 3 тестов, проведенных на 2 отличных друг от друга культурах клеток, наиболее чувствительными можно назвать методы окрашивания резазурином и люминесцентный анализ.
Вклад авторов
А.Н. Афанасьева – существенный вклад в концепцию или дизайн работы; сбор, анализ или интерпретация результатов работы, написание текста, критический пересмотр его содержания, постановка экспериментов
В.Б. Сапарова – помощь в анализе и интерпретации результатов работы
Т.А. Сельменских – постановка экспериментов, сбор данных, участие в анализе результатов
И.Е. Макаренко – утверждение окончательного варианта статьи для публикации; согласие нести ответственность за все аспекты работы, надлежащее изучение и решение вопросов, связанных с достоверностью данных или целостностью всех частей статьи.
Благодарности. В работе оказывали помощь в проведении работы и подготовке статьи коллеги ЗАО «Фарм Холдинг». Спонсорская поддержка ОАО «ГЕРОФАРМ».
Сокращения
EMA – Европейское агентство по лекарственным средствам
3Rs – принципы проведения экспериментов на животных
CV – коэффициент вариации
АТФ – аденозинтрифосфат
ДНК – дезоксирибонуклеиновая кислота
МТТ – желтый тетразол
AW – Окно Теста
SPR – соотношение сигналов
R2 – коэффициент детерминации (корреляции)
NADPH, FADH2, FMNH2, NADH – коферменты
ATCC – Американская коллекция клеточных культур
ДМСО – диметилсульфоксид
FBS – эмбриональная бычья сыворотка
IL-3 – интерлейкин-3.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Abhishek K. Jain, Divya Singh, Kavita Dubey, Renuka Maurya, Sandeep Mittal, Alok K. Pandey Models and Methods for In Vitro Toxicity // In Vitro Toxicology. Elsevier, 2018. P. 45–65.
- John R. W. Masters. Animal Cell Culture. A Practical Approach. Third Edition. Oxford University Press, 2000. 315 p.
- Adan A., Kiraz Y., Baran Y. Cell Proliferation and Cytotoxicity Assays // Curr. Pharm. Biotechnol. 2016. Vol. 17, № 14. P. 1213–1221.
- Kumar P., Nagarajan A., Uchil P.D. Analysis of Cell Viability by the MTT Assay // Cold Spring Harb. Protoc. 2018. Vol. 2018, № 6.
- Kumar P., Nagarajan A., Uchil P.D. Analysis of Cell Viability by the alamarBlue Assay // Cold Spring Harb. Protoc. 2018. Vol. 2018, № 6. P. pdb. prot095489.
- Gomez Perez M. et al. Neutral Red versus MTT assay of cell viability in the presence of copper compounds // Anal. Biochem. 2017. Vol. 535. P. 43–46.
- Angius F., Floris A. Liposomes and MTT cell viability assay: an incompatible affair // Toxicol. Vitro Int. J. Publ. Assoc. BIBRA. 2015. Vol. 29, № 2. P. 314–319.
- Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays // J. Immunol. Methods. 1983. Vol. 65, № 1–2. P. 55–63.
- Du X.M. et al. Evaluation of the cytotoxicity of a two-photon absorbing fluorescence compound on human HepG2 cells and its application to tracking human hepatic cancer cells in mice // Biotech. Histochem. Off. Publ. Biol. Stain Comm. 2010. Vol. 85, № 2. P. 107–113.
- Bruzell E.M., Morisbak E., Tønnesen H.H. Studies on curcumin and curcuminoids. XXIX. Photoinduced cytotoxicity of curcumin in selected aqueous preparations // Photochem. Photobiol. Sci. Off. J. Eur. Photochem. Assoc. Eur. Soc. Photobiol. 2005. Vol. 4, № 7. P. 523–530
- Feuerstein T., Schauder A., Malik Z. Silencing of ALA dehydratase affects ALA-photodynamic therapy efficacy in K562 erythroleukemic cells // Photochem. Photobiol. Sci. Off. J. Eur. Photochem. Assoc. Eur. Soc. Photobiol. 2009. Vol. 8, № 10. P. 1461–1466.
- Meerloo J., Kaspers G.J.L., Cloos J. Cell sensitivity assays: the MTT assay // Methods Mol. Biol. Clifton NJ. 2011. Vol. 731. P. 237–245.
- Diaz G. et al. Localization of MTT formazan in lipid droplets. An alternative hypothesis about the nature of formazan granules and aggregates // Eur. J. Histochem. EJH. 2007. Vol. 51, № 3. P. 213–218.
- Stockert J.C. et al. MTT assay for cell viability: Intracellular localization of the formazan product is in lipid droplets // Acta Histochem. 2012. Vol. 114, № 8. P. 785–796.
- ГОСТ 23454-2016 Молоко. Методы определения ингибирующих веществ (с Поправкой). [GOST 23454-2016 Moloko. Metody opredeleniya ingibiruyushchikh veshchestv (s Popravkoi).] (in Russ.)
- Golovinskaya O.V. et al. Comparative Analysis of Dyes Used in the Assessment of Filgrastim Products Specific Activity by Biological in vitro Methods // Bioprep. Prev. Diagn. Treat. 2020. Vol. 20, № 3. P. 193–201.
- Borra R.C., Monica Andrade Lotufo, Sonia Maria Gagioti, Fabiana de Mesquita Barros, Priscila Maria Andrade A simple method to measure cell viability in proliferation and cytotoxicity assays // Braz. Oral Res. 2009. Vol. 23, № 3. P. 255–262.
- O’Brien J., I. Wilson, T. Orton, F. Pognan Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity // Eur. J. Biochem. 2000. Vol. 267, № 17. P. 5421–5426.
- Riss T.L., Richard A. Moravec, Andrew L. Niles, Sarah Duellman, Hélène A. Benink Cell Viability Assays // Assay Guidance Manual / ed. Sittampalam G.S. et al. Bethesda (MD): Eli Lilly & Company and the National Center for Advancing Translational Sciences, 2004.
- Auld D.S., Ya-Qin Zhang, Noel T. Southall, Ganesha Rai, Marc Landsman A basis for reduced chemical library inhibition of firefly luciferase obtained from directed evolution // J. Med. Chem. 2009. Vol. 52, № 5. P. 1450–1458.
- Nonclinical statistics for pharmaceutical and biotechnology industries. New York, NY: Springer Science+Business Media, 2015.
- Решение № 85 “Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза.” 2016. [Reshenie № 85 “Ob utverzhdenii Pravil provedeniya issledovanii bioekvivalentnosti lekarstvennykh preparatov v ramkakh Evraziiskogo ekonomicheskogo soyuza.” 2016] (in Russ.)




