Сравнительная эффективность производных этилметилгидроксипиридина сукцината при острой интоксикации тетрахлорметаном
Плиско Г.А., Ногаева У.В., Семивеличенко Е.Д., Ивкин Д.Ю., Титович И.А., Флисюк Е.В., Демакова Н.В., Ивкина А.С. Сравнительная эффективность производных этилметилгидроксипиридина сукцината при острой интоксикации тетрахлорметаном. Лабораторные животные для научных исследований. 2021; 2. https://doi.org/10.29296/2618723X-2021-02-01
Резюме
Тетрахлорметан активно используется для моделирования патологии печени, а также других органов за счет своего острого токсического действия, приводящего к системному эндотоксикозу. Этилметилгидроксипиридина сукцинат (ЭМГПС) является антиоксидантом и антигипоксантом, также в ряде исследований показана его гепатотропная активность. Метаболит данного соединения, а именно – этилметилсульфапиридин (ЭМСП), также показал положительное влияние на различные показатели печени в некоторых исследованиях, в связи с чем для оценки эффективности данных веществ решено провести моделирование острой интоксикации с помощью внутрибрюшинного введения тетрахлорметана. Для этого были рассчитаны эквимолярные дозы обоих веществ и 7-дневная модель острого отравления. Настоящее исследование проводили на 40 крысах-самцах, животные были рандомизированы на 4 группы. Тетрахлорметан является классическим токсином для моделирования повреждения печени за счет образования высокореактивных радикалов, которые являются продуктом биотрансформации посредством цитохрома P-450. Настоящее исследование показало, что внутрибрюшинное введение тетрахлорметана в масляном растворе – эффективный способ моделирования повреждения печени. По окончании эксперимента у животных забирали кровь для биохимического и гематологического анализа. После аутопсии выделяли печень для гистологического исследования. В ходе биохимического анализа уровни аланинаминотрансферазы и аспартатаминотрансферазы были повышены, что соответствует результатам похожих исследований. В группе исследуемого препарата уровни аланинаминотрансферазы и аспартатаминотрансферазы были ниже, чем в группе препарата сравнения, что говорит о положительном влиянии ЭМСП на биохимические показатели печени, а также об эффективном противодействии отравляющего агента. Уровень холестерина в исследуемой группе значимо не отличался от такового в группе препарата сравнения, однако отличался от данных, полученных в группе патологии, что подтверждает эффективное действие ЭМСП при остром отравлении тетрахлорметаном. Картина крови по гематологическому анализу также продемонстрировала улучшение показателей в группе, получавшей исследуемое вещество. Гистологические результаты исследования показали, что развитие центролобулярного холестаза в группах патологии и получавших вместе с тетрахлорметаном ЭМГПС, было примерно на одном уровне, что говорит о недостаточной эффективности ЭМГПС при острой интоксикации. Этот же показатель в группе, где был использован и тетрахлорметан, и ЭМСП, был ниже, так же, как и жировая дистрофия, выраженность которой была меньше в группе исследуемого препарата, чем в группах патологии и ЭМГПС. Гистологический анализ показал, что мелкокапельная дистрофия была менее выражена в группе исследуемого вещества. По совокупности оцененных показателей можно предположить, что ЭМСП на модели острой интоксикации тетрахлорметаном был более эффективным, чем препарат сравнения ЭМГПС.
Введение
Тетрахлорметан (ТХМ, CCl4) широко используется для создания моделей токсического гепатита, которые позволяют оценить защитные эффекты лекарственных средств [1]. Классический механизм токсичности CCl4 связан с тем, что он вызывает поражение и фиброз печени, которые могут перерасти в цирроз и даже в гепатокарциному [2].
Патология печени довольно часто приводит к развитию синдрома портальной гипертензии, характеризующейся повышением давления крови в просвете v. portae, что может привести к острому кровотечению. Острое кровотечение из варикозно расширенных вен пищевода и желудка ассоциировано с повышенным уровнем содержания активных форм кислорода, которые пагубно влияют на клеточный метаболизм и организм в целом [3, 4]. В свою очередь, острая массивная кровопотеря из варикозно расширенных вен пищевода и желудка приводит к развитию синдрома кишечной недостаточности вследствие ишемических и последующих реперфузионных повреждений стенки кишечника. Нарушение барьерных функций стенки кишки обусловливает массивное поступление внутрикишечных токсинов в портальный кровоток, кишечный лимфатический коллектор [5]. Совокупность описанных факторов приводит к формированию полиорганной дисфункции, системному эндотоксикозу [1].
В ряде исследований доказаны антиоксидантные и антигипоксические свойства, а также гепатотропная активность
2-этил-6-метил-3-гидроксипиридина сукцината (ЭМГПС) и его производного (2-этил-6-метил-3-сульфапиридина – ЭМСП) [6, 7].
В связи с этим целью данной работы явилось проведение сравнительной оценки эффективности ЭМГПС и его производного ЭМСП на модели острого отравления (тетрахлорметаном) CCl4 при внутрибрюшинном введении.
Материал и методы
В качестве тест-системы использованы 40 крыс-самцов, масса тела 200–220 г. Животных содержали в стандартных условиях в соответствии с нормативными документами [8, 9].
В период адаптации и эксперимента крыс содержали по 5 особей в прозрачных поликарбонатных клетках для грызунов с подстилом. Клетки были оборудованы стальными решетчатыми крышками с углублением для кормления, оснащены специальными фильтрами, стальными разделителями для корма и держателями этикеток. Они располагались на стеллажах, к которым подключено вентиляционно-приточное устройство Био.В.С. Vent II (Bioscape (Ehret), Германия).
В клетках сохранялось давление выше атмосферного, 1 раз в неделю клетки меняли. В качестве подстила использовали профессиональный материал – натуральный гранулят стержневой части початков кукурузы Рехофикс® (ООО «Реттенмайер Рус», Германия). Животные получали adlibitum корм стандартный гранулированный «Полнорационный экструдированный комбикорм ПК-120 для лабораторных животных (крыс, мышей)», (ООО «Лаборатормкорм», Россия). Крысам давали водопроводную воду, фильтрованную через систему фильтров «Аквафор», что соответствует СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Гигиенические требования к обеспечению безопасности систем горячего водоснабжения».
В исследование включены 40 крыс-самцов массой тела 230–250 г. Методом рандомизации животные были разделены на 4 группы по 10 животных в зависимости от вводимого препарата:
- 1-я – патология + раствор натрия хлорида изотонический;
- 2-я – патология + ЭМГПС (препарат сравнения);
- 3-я – патология + ЭМСП (исследуемый препарат);
- 4-я – интактные животные.
Животных содержали в соответствии с Директивой 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986) в соответствии с правилами надлежащей лабораторной практики.
Исследуемый препарат и препарат сравнения вводили в течение всего эксперимента в эквимолярных дозах 68 и 100 мг/кг соответственно. Для моделирования патологии в течение первых 4 сут ежедневно животным 1–3-й групп внутрибрюшинно вводили 50% масляный раствор ТХМ в дозе 0,4 мл/100 г. Параллельно с этим опытные группы животных получали исследуемый препарат и препарат сравнения, а контрольная – физиологический раствор. Следующие 3 дня животным 1–3-й группы также вводили соответствующие препараты.
В конце эксперимента перед аутопсией у крыс забирали из вены кровь для биохимического анализа. Эвтаназию осуществляли в CO2-боксе (установка для эвтаназии Bioscape ИД №БЭ/01/ЦЭФ; время программы – 720 с).
Для гистологического исследования выделяли печень, которую помещали в формалин с последующим изготовлением срезов и их окраской гематоксилином и эозином и по Ван Гизону (для уточнения визуальной картины фиброзных изменений). По балльной шкале оценивали несколько признаков: выраженность некроза, лобулярного воспаления и баллонной дистрофии, где 0 – отсутствие признака, 1 – слабовыраженный, 2 – умеренно выраженный, 3 – выраженный признак.
Статистическую обработку данных биохимического и гематологического анализа проводили с помощью программы GraphPadPrism 8.2.0. Данные соответствовали законам нормального распределения и были обработаны с помощью однофакторного дисперсионного анализа (One-Way ANOVA), множественные сравнения проведены по отношению к группе получавших препарат сравнения.
Результаты и обсуждение
В сравнительном исследовании изучена эффективность производных ЭМГПС на модели токсического гепатита, вызванного внутрибрюшинным введением 50% масляного раствора ТХМ. О фармакологической активности производных ЭМГПС судили по данным биохимического, гематологического анализа, а также на основании патоморфологического исследования.
Результаты биохимического анализа отвечали закону нормального распределения, поэтому для их оценки проведен однофакторный дисперсионный анализ. Известно, что повышенный уровень аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) наблюдается при развитии патологии [10]. В представленном исследовании уровень АСТ и АЛТ в группе, получавшей ЭМСП, оказался ниже, чем при введении ЭМГПС, что свидетельствует о большей эффективности исследуемого препарата.
Данные об уровне холестерина подтверждают, что моделирование патологии состоялось (получены статистически значимые различия между 1-й и 4-й группами). Испытуемое вещество показало способность снижать уровень холестерина при сравнении с патологией. На рис. 1 представлены результаты статистической обработки по отношению к 1-й группе (патология) в виде среднего арифметического ± стандартная ошибка среднего.
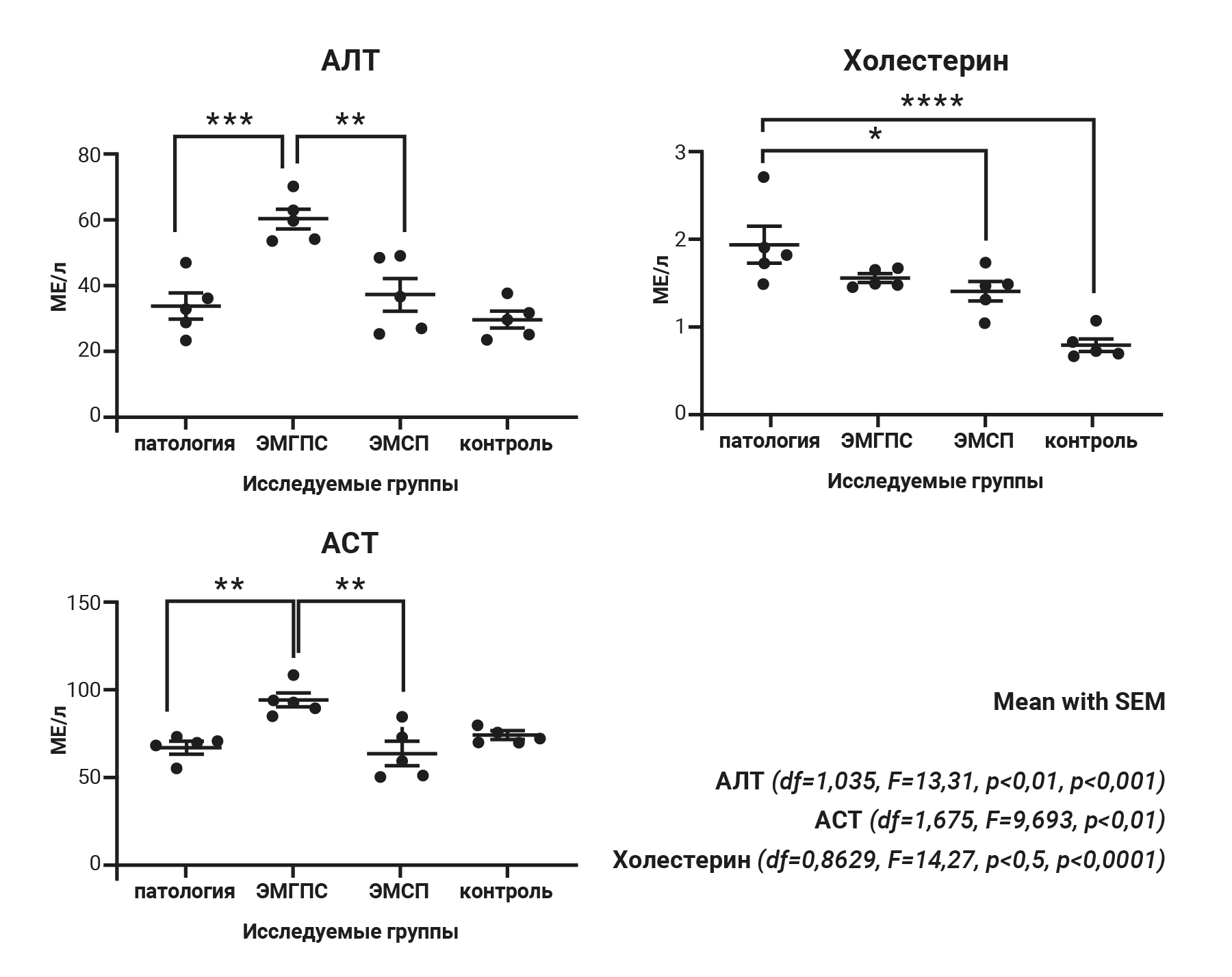
Дополнительно измерены такие биохимические показатели, как уровень холестерина, триглицеридов и глюкозы, однако статистически значимых различий между группами не выявлено.
Результаты гематологического анализа. На рис. 2 в виде тепловой диаграммы (Heat Map) представлены сводные данные гематологических показателей. Статистически значимые различия выявлены только в случае средней концентрации гемоглобина в эритроцитах (10) и уровне тромбоцитов в общем анализе крови (12).
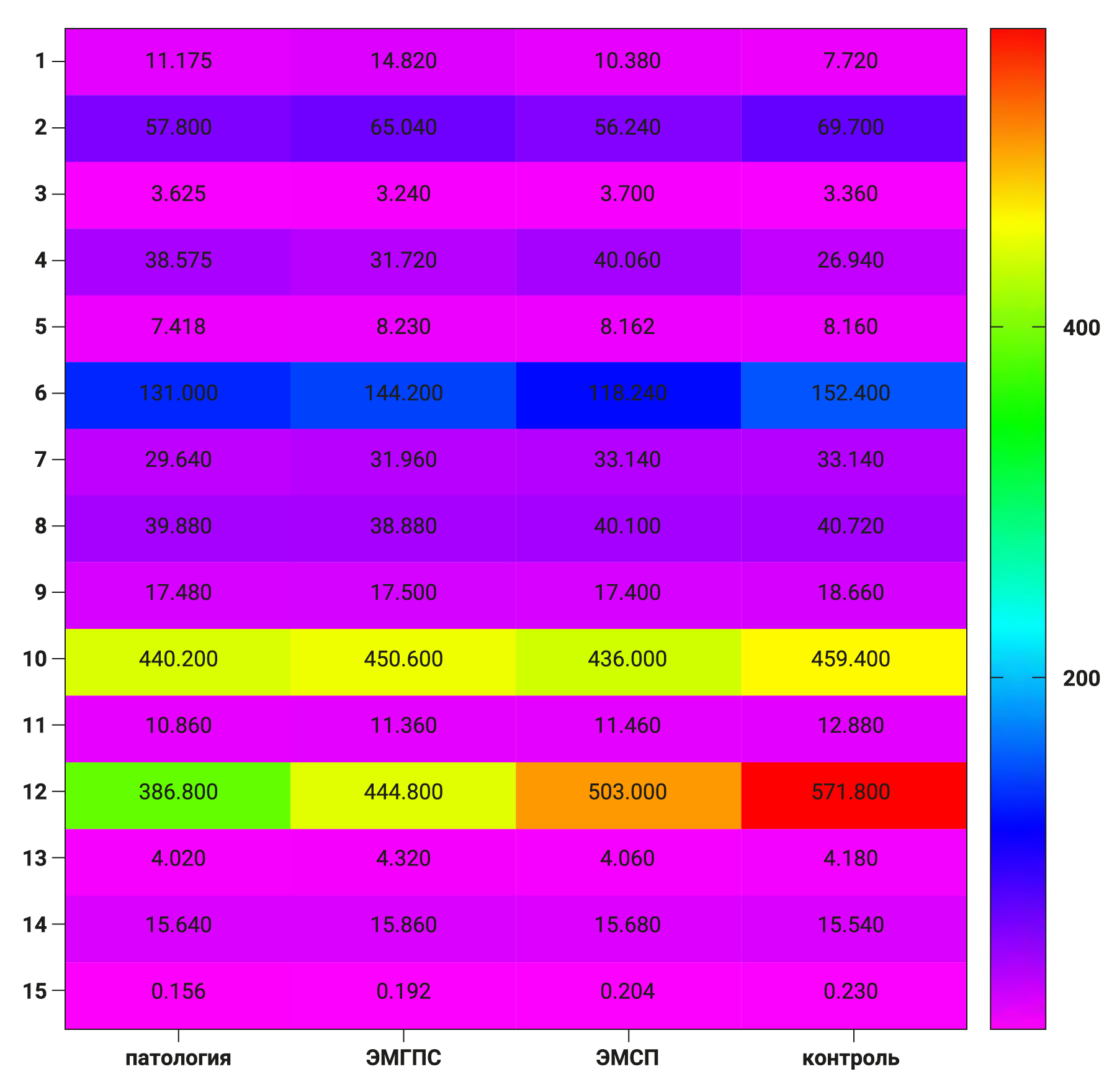
1 – WBC (лейкоциты), 109/l; 2 – LY (лимфоциты), %; 3 – Mid (моноциты), %; 4 – Gr (гранулоциты), %; 5 – RBC (эритроциты), 1012/l; 6 – Hb (гемоглобин), g/l; 7 – HCT (гематокрит), %; 8 – MCV (объем эритроцита), fl; 9 – MCH (содержание в эритроците гемоглобина), pg; 10 – MCHC (средняя концентрация гемоглобина в эритроцитарной массе), g/l; 11 – RDWC (ширина распределения эритроцитов), %; 12 – PLT (тромбоциты), 109/l; 13 – MPV (средний объем тромбоцитов в общем анализе крови), fl; 14 – PDWC (ширина распределения тромбоцитов),%; 15 – PCT (тромбокрит), %
Гистология
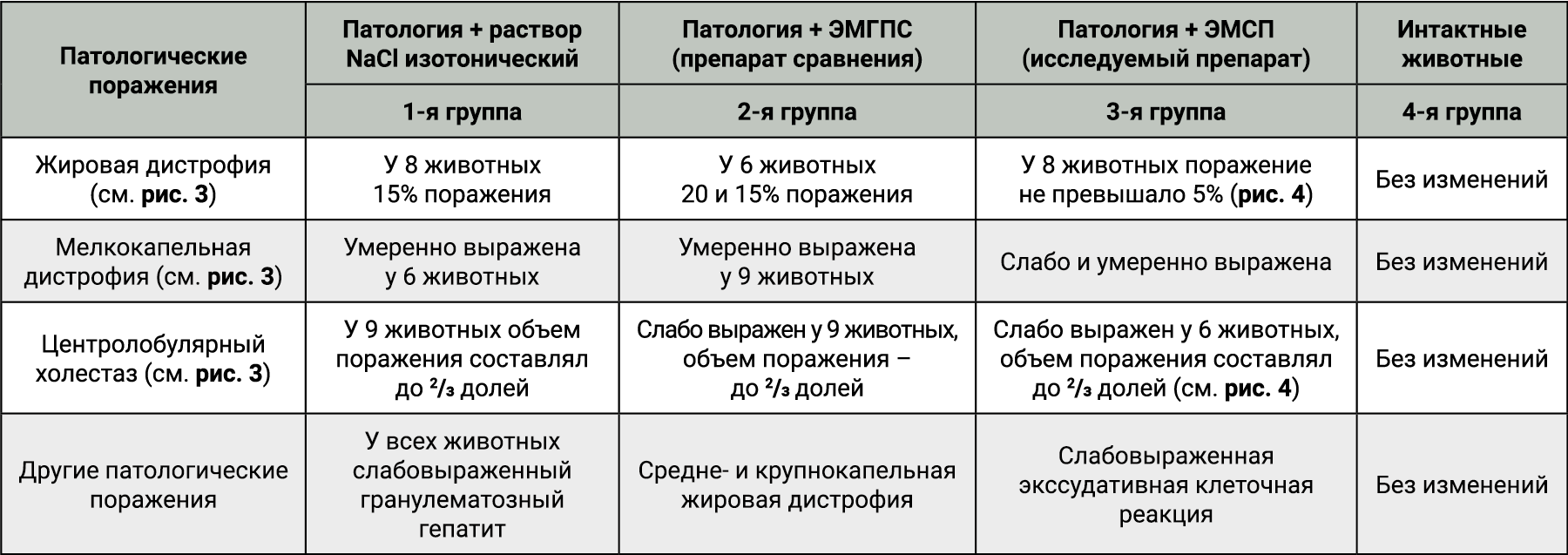
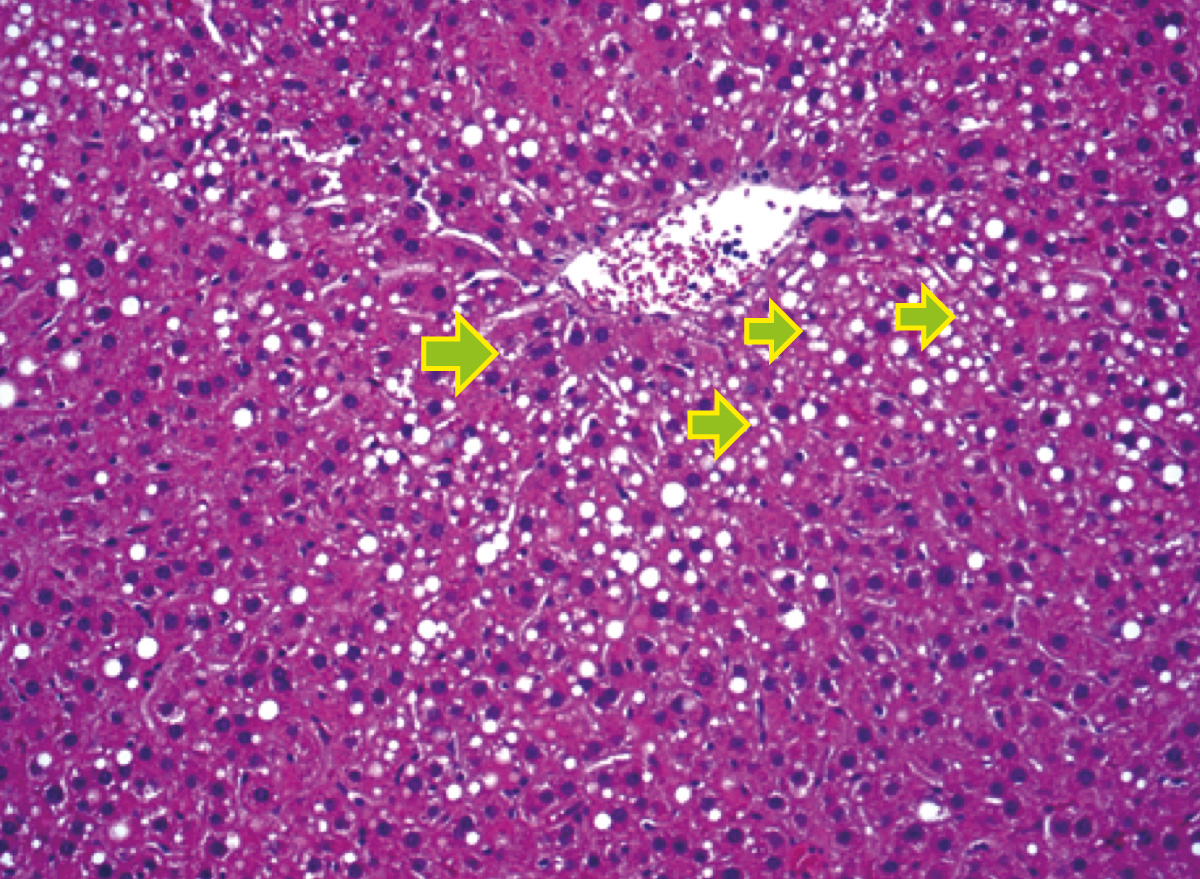
Данные гистологического исследования представлены в таблице. Степень и характер поражения печени свидетельствуют о токсичном влиянии CCl4 (рис. 3) [11]. Показано, что в 1-й группе (патология) мелкокапельная дистрофия была умеренно выражена у 6 животных, выражена – у 1, также в этой группе наблюдалась жировая дистрофия (около 10 и 15% поражения печени). Центролобулярный холестаз наблю-дался у 9 животных, объем поражения составлял до ⅔ долей. В 1-й группе (патология) выявляли слабо-выраженный гранулематозный гепатит.
Во 2-й группе (препарат сравнения) у 9 животных отмечали умеренно выраженную мелкокапельную дистрофию, у 4 – жировую дистрофию с 15% поражением, у 2 – с 20%. Центролобулярный холестаз был слабо выражен у 9 животных, объем поражения составлял до ⅔ долей. В 3-й группе (препарат ЭМСП) наблюдалась слабовыраженная экссудативная клеточная реакция. В группе исследуемого препарата мелкокапельная дистрофия была выражена слабо и умеренно, а жировая дистрофия составляла 5% у 6 животных и 2% – у 2. Слабовыраженный центролобулярный холестаз отмечен у 6 животных, объем поражения составлял до ⅔ долей.
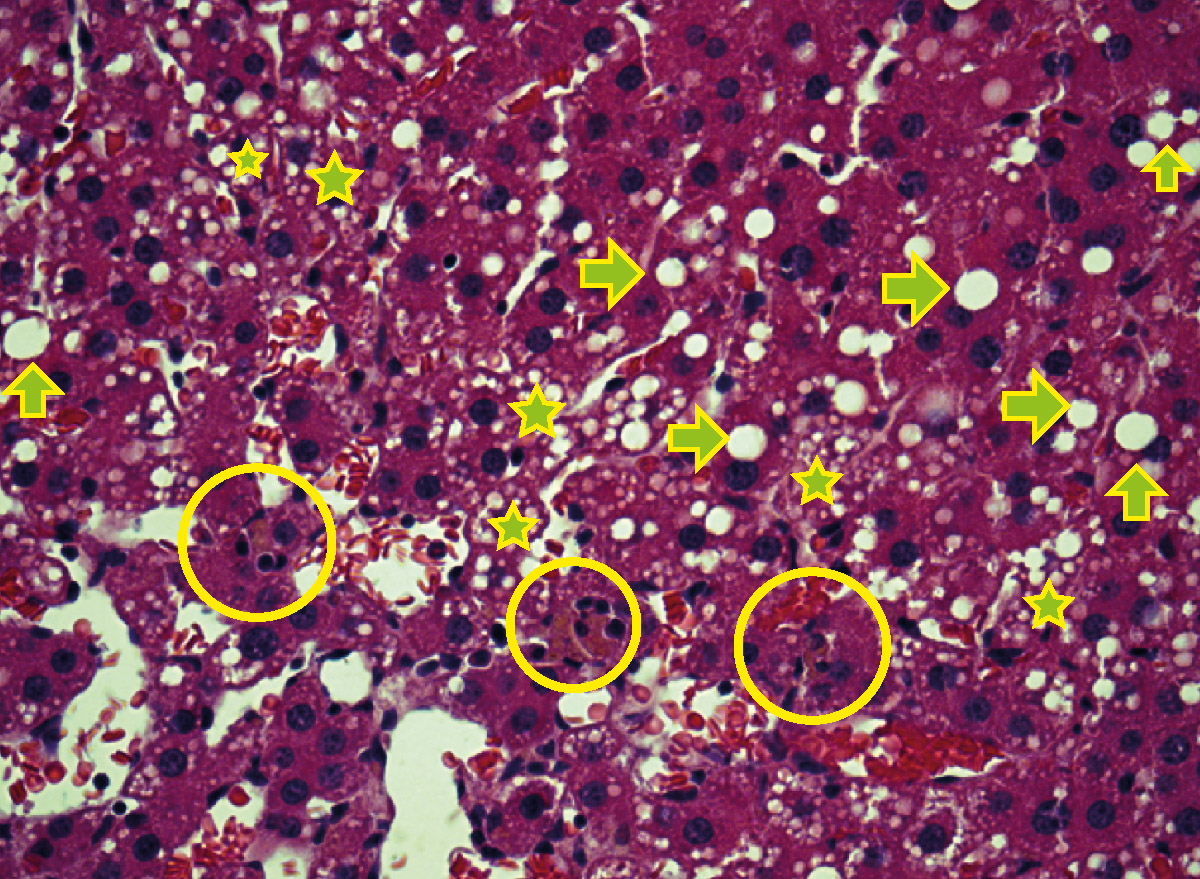
Заключение
В представленной работе описаны основные количественные показатели, характеризующие эффективность производных этилметилгидроксипиридина сукцината в условиях экспериментального токсического повреждения печени.
По результатам проведенного исследования сделаны следующие выводы о воздействии изучаемого соединения 2-этил-6-метил-3-сульфапиридин:
- по данным биохимического анализа 2-этил-6-метил-3-сульфапиридин оказывает положительное влияние на АЛТ и АСТ, характеризующие функции печени, в сравнении с группами патологии без лечения и препарата сравнения при остром токсическом отравлении CCl4;
- по влиянию на уровень холестерина этилметилсульфапиридин значимо отличался от группы патологии;
- снижает выраженность жировой дистрофии гепатоцитов.
По данным гистологического анализа продемонстрировано, что в группе получавших изучаемое соединение 2-этил-6-метил-3-сульфапиридин выраженность жировой дистрофии и центролобулярного холестаза была меньше, чем в группах патологии и препарата сравнения.
По совокупности полученных данных из всех изученных субстанций наибольшей фармакологической активностью в условиях экспериментального токсического повреждения печени обладало вещество 2-этил-6-метил-3-сульфапиридин. Именно оно является наиболее перспективным кандидатом для дальнейшего изучения.
Вклад авторов
Плиско Г.А. – идея исследования, выполнение работы, сбор данных из литературных источников, написание текста статьи.
Ивкин Д.Ю. –редактирование статьи
Ногаева У.В. – статистическая обработка данных
Флисюк Е.В. – написание текста статьи
Титович И.А. – анализ данных литературы
Семивеличенко Е.Д. – участие в выполнении эксперимента
Демакова Н.В. – участие в выполнении эксперимента, уход за животными
Ивкина А.С. – обработка первичных данных
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Евсеенко Д.А., Дундаров З.А., Надыров Э.А. Экспериментальная модель цирроза печени у лабораторных животных // Проблемы здоровья и экологии. – 2019 №1(59). – С. 72-77 [Evseenko D.A., Dundarov Z.A., Nadyrov E.A. Eksperimental'naya model' tsirroza pecheni u laboratornykh zhivotnykh // Problemy zdorov'ya i ekologii. – 2019. – №1(59). – P. 72-77 (In Russ.)].
- Dong S., Chen Q.-L., Song Y.-N., Sun Y., Wei B., Li X.-Y., Hu Y.-Y., Liu P., Su S.-B. Mechanisms of CCl4-induced liver fibrosis with combined transcriptomic and proteomic analyzes // J Toxicol Sci. – 2016. – Vol. 41(4). – P. 561-572 DOI:org/10.2131/jts.41.561.
- HalinaCichoz-Lach, AgataMichalak. Oxidative stress as a crucial factor in liver diseases // World J Gastroenterol. – 2014. – Vol. 20(25). – P. 8082-8091. DOI: 10.3748/wjg.v20.i25.8082.
- Зыблев С.Л., Дундаров З.А., Применение антиоксидантов при остром гастродуоденальном язвенном кровотечении // Новости Хирургии. – 2014. – 22(2). – C. 155-163 [Zyblev S.L., Dundarov Z.A., Primenenie antioksidantov pri ostrom gastroduodenal'nom yazvennom krovotechenii, Novosti Khirurgii. – 2014. – 22(2). – P. 155-163. (In Russ.)].
- Климович И.Н., Маскин С.С., Абрамов П.В. Диагностика и лечение синдрома кишечной недостаточности при тяжелых кровотечениях из верхних отделов желудочно-кишечного тракта // Новости Хирургии. – 2017. – 25(1). – C. 71-77. [Klimovich I.N., Maskin S.S., Abramov P.V. Diagnostika i lechenie sindroma kishechnoi nedostatochnosti pri tyazhelykh krovotecheniyakh iz verkhnikh otdelov zheludochno-kishechnogo trakta // Novosti Khirurgii. – 2017. – 25(1). – P. 71-77 (In Russ.)].
- Ивкин Д.Ю., Суханов Д.С., Плиско Г.А., Ивкина А.С., Краснова М.В., Титович И.А., Семивеличенко Е.Д., Степанова И.Л., Ильницкий В.П., Карпов А.А., Оковитый С.В., Каршин А.В. Антигипоксическая активность различных солей этилметилгидроксипиридина, Молекулярная медицина. – 2020. – 18 (4). – C. 36-41. [ Ivkin D.Yu., Sukhanov D.S., Plisko G.A., Ivkina A.S., Krasnova M.V., Titovich I.A., Semivelichenko E.D., Stepanova I.L., Il'nitskii V.P., Karpov A.A., Okovityi S.V., Karshin A.V.Antigipoksicheskaya aktivnost' razlichnykh solei etilmetilgidroksipiridina, Molekulyarnaya meditsina. – 2020. – 18 (4). – P. 36-41 (In Russ.)].
- Суханов Д.С., Ивкин Д.Ю., Плиско Г.А., Караваева А.В., Краснова М.В., Поверяева М.А., Карев В.Е., Бунят А.В., Степанова И.Л., Оковитый С.В. Влияние производного 2-этил-6метил-3-гидроксипиридина на течение неалкогольной жировой болезни печени в эксперименте // Молекулярная медицина. – 2020. – 18 (1). – С. 21-26.[Sukhanov D.S., Ivkin D.Yu., Plisko G.A., Karavaeva A.V., Krasnova M.V., Poveryaeva M.A., Karev V.E., Bunyat A.V., Stepanova I.L., Okovityi S.V.Vliyanie proizvodnogo 2-etil-6metil-3-gidroksipiridina na techenie nealkogol'noi zhirovoi bolezni pecheni v eksperimente, Molekulyarnaya meditsina. – 2020. – 18 (1). – P. 21-26 In Russ.].
- Guide for the care and use of laboratory animals. National Academy press. – URL.: https://grants.nih.gov/grants/olaw/guide-for-the-care-and-use-of-laboratory-animals.pdf (дата обращения 01.2021 г.).
- Постановление Главного государственного санитарного врача РФ от 29 августа 2014 г. №51 [Postanovlenie Glavnogo gosudarstvennogo sanitarnogo vracha RF ot 29 avgusta 2014 g. №51 In Russ.].
- Есауленко Е.Е. Метаболические эффекты льняного масла у крыс с интоксикацией тетрахлорметаном // Фундаментальные исследования. – 2014. – Т. 1. – С. 59-63 [Esaulenko E.E., Metabolicheskie effekty l'nyanogo masla u krys s intoksikatsiei tetrakhlormetanom // Fundamental'nye issledovaniya. – 2014. – Vol. 1. – P. 59-63 In Russ.].
- Lee H.Y., Lee G.H., Yoon Y., Chae H.J. R. verniciflua and E. ulmoides Extract (ILF-RE) Protects against Chronic CCl₄-Induced Liver Damage by Enhancing Antioxidation // Nutrients. – 2019. – Vol. 11(2). – P. 382. DOI: 10.3390/nu11020382




