Влияние дельтаметрина (Дельцид) на репродуктивную способность лабораторных мышей
Ильинская М.А., Акимов Д.Ю. Влияние дельтаметрина (Дельцид) на репродуктивную способность лабораторных мышей. Лабораторные животные для научных исследований. 2020; 4. https://doi.org/10.29296/2618723X-2020-04-04
Резюме
Залог успешно проведенных исследований на лабораторных животных (ЛЖ) – их качество. В условиях отечественного рынка ЛЖ существует ряд сдерживающих факторов, закупить животных в необходимом объеме практически невозможно. В связи с этим наш доклинический центр занимается разведением 11 видов ЛЖ. При подготовке ЛЖ особое внимание уделяется их здоровью, в том числе превентивным мероприятиям, включающим инсектоакарицидную обработку. В данной работе рассматривается спонтанно зафиксированный практический случай негативного влияния дельтаметрина (Дельцид) на репродуктивную функцию аутбредных мышей и мышей линии BALB/c. Препарат Дельцид применялся в тестовом режиме для проведения инсектоакарицидной обработки мышей.
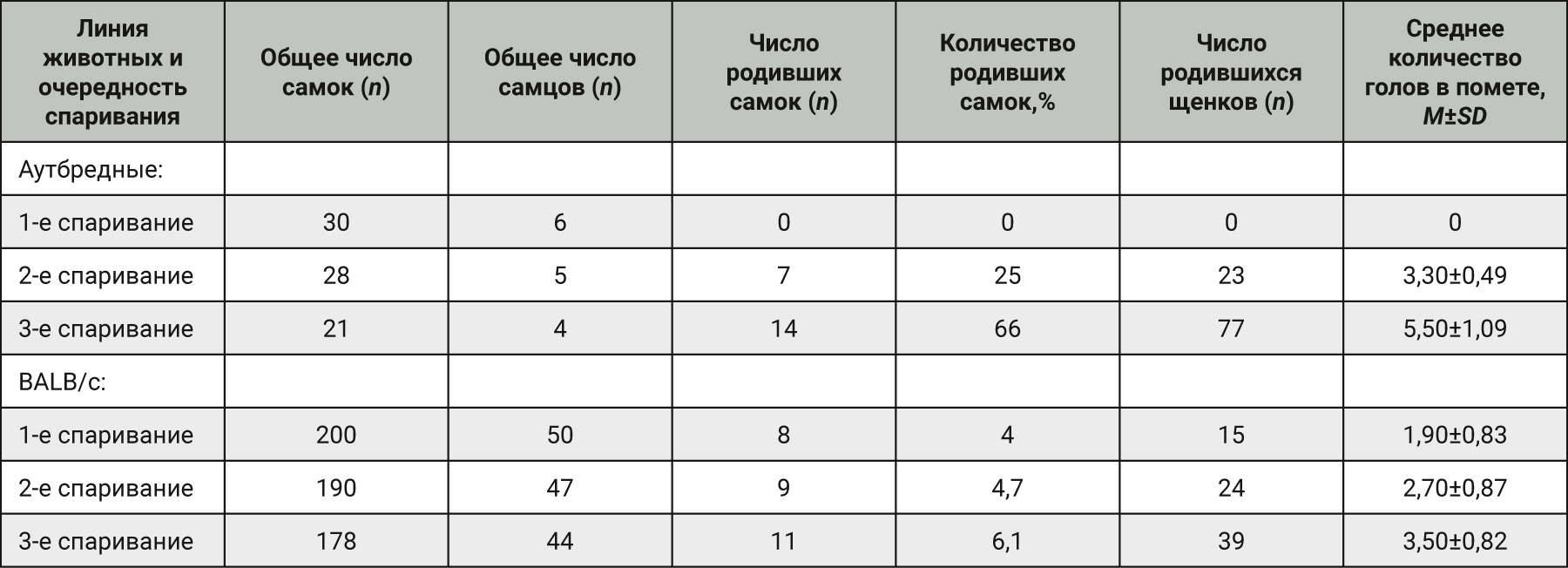
После использования препарата Дельцид зафиксировали резкое снижение выхода потомства. Проводя анализ, установили, что при 1-м спаривании аутбредных мышей через 14 дней после применения препарата Дельцид количество родивших самок было равно нулю, на момент 2-го спаривания, спустя 40 дней, не превышало 30%, а выход потомства составил 3,3±0,49 головы, что говорит о высокой яловости маточного поголовья. Результаты 3-го спаривания, которое проводили через 64 дня, также оказались неудовлетворительными, средний выход потомства составил 5,5±1,09 головы, тогда как средний выход потомства аутбредных мышей должен составлять 7–8 голов, а количество родивших самок составляло 66%. Фертильность мышей линии BALB/c при всех 3 спариваниях не превышала 10%, что говорит о высокой яловости без тенденции к восстановлению.
После установления высокой яловости мышей, обработанных препаратом Дельцид, проведен обзор отечественной и зарубежной литературы. Проанализировав публикации отечественных авторов, установили, что в России влияние дельтаметрина на репродуктивную функцию мышей не изучалось вовсе, тогда как у иностранных коллег установлены факты негативного влияния дельтаметрина на гаметогенез у мышей.
Введение
Биомедицинские и поведенческие эксперименты на животных проводятся уже несколько столетий [1]. Большинство современных знаний физиологии и патологии базируется на исследованиях с использованием животных. Современную доклиническую практику невозможно представить без использования лабораторных животных (ЛЖ) в качестве тест-системы. Естественно, здоровье ЛЖ крайне важный фактор в проведении исследований и доклинической практике, в частности. От качества тест-системы зависит конечный результат эксперимента.
По данным The American Anti-Vivisection Society, наиболее часто используемый вид ЛЖ мыши, которых применяют в 93% исследований. Сообщается также (Understanding Animal Research), что в Великобритании лабораторные мыши используются в 72% экспериментов.
Здоровье ЛЖ является объектом тщательного контроля во всех мировых питомниках. Например, Charles River Laboratories (питомник ЛЖ) исследует своих животных на вирусные, бактериальные и иные патогенные агенты. К сожалению, лишь единичные питомники в Российской Федерации проводят основательный мониторинг здоровья и благополучия (МЗЖ, МОС, КБЖ) ЛЖ. Сотрудничество с добросовестными питомниками затрудняют сложности с транспортировкой и возможные риски, связанные с ней, а также их стоимость и недостаточное количество животных в наличии. В связи с чем резко актуализируется потребность в собственном воспроизводстве лабораторных мышей. Разумеется, только от здорового племенного ядра можно получить полноценное потомство. Следуя высоким общемировым требованиям к качеству ЛЖ, в нашей организации проводится мониторинг здоровья ЛЖ. Подобный мониторинг в нашей организации базируется на основе экологии и эпизоотологии региона, требований Ветеринарного управления по Северо-Западному региону и рекомендаций FELASA [2].
Однако существует ряд сдерживающих факторов, которые могут привести к контаминации патогенными агентами поголовья мышей, в связи с чем важно проводить необходимые лечебно-профилактические мероприятия. Подбор эффективных превентивных мероприятий влияет на качество жизни животных, их здоровье, а, следовательно, и на весь ход эксперимента.
Материал и методы
При очередном мониторинге здоровья животных в питомнике АО «НПО «Дом Фармации» выявлено заражение мышей арахноэнтомозами, из 16 полученных образцов биоматериала в 9 были обнаружены паразитические членистоногие.
Оценив существующие риски распространения инвазии, принято решение о проведении дополнительных лечебно-профилактических и санитарно-гигиенических мероприятий. В виду ряда преимуществ, таких как удобство обработки, экономическая эффективность и опыт отечественных исследователей, препаратом выбора явился Дельцид.
Дельцид – инсектоакарицидное лекарственное средство в форме концентрата эмульсии для наружного применения, предназначенное для борьбы с эктопаразитами животных, дезинсекции и дезакаризации животноводческих помещений.
Дельцид в качестве действующего вещества содержит синтетический пиретроид дельтаметрин – 4%, а в качестве вспомогательных компонентов – твин-80, неонол и нефрас.
Дельтаметрин, входящий в состав лекарственного средства, относится к группе синтетических пиретроидов и оказывает выраженное кишечное инсектоакарицидное и контактное действие. Активен в отношении саркоптоидных, иксодовых и куриных клещей, постельных клопов, пухопероедов, вшей, блох, мух, слепней, комаров и других эктопаразитов животных.
Механизм действия дельтаметрина основан на блокировке нейромышечной передачи нервных импульсов на уровне ганглионов периферических нервов, что приводит к параличу и гибели паразитов.
Животные (самцы и самки) были обработаны купанием в соответствии с рекомендациями по применению от производителя. Препарат разводили в объеме 1,25 мл на 1 л воды. Количество животных указано в таблице. Обработку проводили 2 раза с перерывом в 10 дней. После осуществления целого комплекса мероприятий выполнено контрольное исследование в независимой лаборатории. На основании протокола из 32 полученных лабораторией образцов биоматериала арахноэнтомозы не обнаружены ни в одном.
Репродуктивные функции мышей после лечения препаратом Дельцид
После получения информации об инвазии мышей и за все время проведения инсектоакарицидной обработки воспроизводство поголовья было приостановлено. Когда было дано заключение лаборатории об отсутствии паразитов, сформировали группы самцов и самок для дальнейшего разведения. В ходе воспроизводства обнаружили влияние препарата Дельцид на репродуктивную функцию мышей.
Спаривание мышей проводили через 14, 40 и 64 дня после применения препарата Дельцид. Во всех 3 спариваниях учувствовали одни и те же животные, за исключением родивших и выбывших. Соотношение самцов и самок при формировании групп для спаривания аутбредных мышей было 1:5, а мышей линии BALB/c – 1:4. Дизайн воспроизводства и его результативность представлены в таблице.
Поголовье аутбредных мышей для спаривания отобрано из питомника по физиологическим параметрам, подходящим для воспроизводства данных животных. Мыши линии BALB/c завезены в качестве племенного ядра из стороннего питомника, на этапе подбора и формирования групп для спаривания оценивались их физиологические параметры.
Результаты и обсуждение
Оценивая плодовитость, учитывали количество (%) родивших самок, что отражено на рис. 1. При 1-м спаривании аутбредных мышей через 14 дней после применения препарата Дельцид установили, что количество родивших самок было равно 0, а к 3-му спариванию, которое проводили через 64 дня после использования препарата, оно увеличилось до 66%, т.е. в динамике фертильность аутбредных мышей восстанавливалась. Фертильность мышей линии BALB/c при всех трех спариваниях не превышала 10%, это говорит о высокой яловости без тенденции к восстановлению.
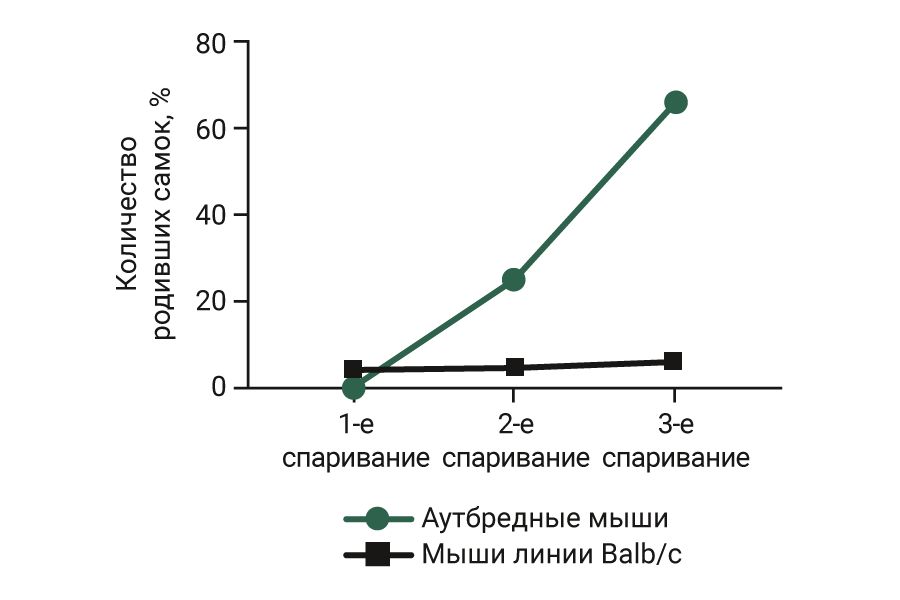
Интересно, что до применения препарата Дельцид в январе и феврале 2020 г. средний выход потомства на одну самку аутбредных мышей составлял от 7 до 8 голов, это соответствует стандартам у аутбредных мышей [8–10]. После использования препарата Дельцид (конец февраля 2020 г.) в марте наблюдался «провал» выхода потомства, а в апреле – мае отмечается явно прогрессирующая тенденция к росту среднего количества потомства на самку, что указывает на восстановление репродуктивного потенциала аутбредных мышей (рис. 2).
По результатам установленных изменений проведен обзор литературы по использованию дельтаметрина и определено его воздействие на репродуктивную функцию мышей.
В отечественной литературе влияние дельтаметрина на мышей не изучено. В работе А.Н. Токарева и С.В. Енгашева [3], использование препаратов дельтаметрина изучали на трех поколениях аутбредных крыс, которым в корм добавляли 0,15; 1 и 3,75 мг/кг действующего вещества. По данным исследования, разницы между подопытными и контрольными животными в плодовитости, продолжительности периода беременности и сохранности полученного потомства не установлено.
Также была изучена литература зарубежных авторов по влиянию дельтаметрина на репродуктивную функцию мышей.
В 2016 г. K.R. Desai с соавторами оценивали воздействие дельтаметрина на репродуктивные показатели самцов аутбредных мышей. Препарат вводили в разных дозах внутрижелудочно в течение 45 дней. Полученные результаты показали, что применение дельтаметрина привело к значительному уменьшению массы тела лабораторных мышей, также наблюдалось снижение количества сперматозоидов их жизнеспособности и подвижности [4].
Z.Z. Jia, J.W. Zhang и соавт. [5] в 2019 г. проводили исследование для оценки окислительного стресса, вызванного дельтаметрином, и определяли его влияние на мейоз, апоптоз и аутофагию ооцитов мышей.
Результаты показали, что скорость созревания ооцитов значительно уменьшилась, а также снизилось качество ооцитов, вызывая аномальное распределение в них митохондрий.
Таким образом, эти результаты показали, что дельтаметрин может ингибировать созревание ооцитов мышей и отрицательно влиять на выживание ооцитов.
A.B. Slima, F.L. Abdallah и соавт. [6] в 2010 г. изучали влияние диметоата и дельтаметрина в разных дозах, а также их смеси на репродуктивные качества самцов мышей. Препараты вводили перорально в течение 21 дня. По окончании эксперимента определяли массу яичек и параметры спермы. Полученные данные показали, что количество сперматозоидов значительно уменьшилось во всех экспериментальных группах, а также на много увеличился процент морфологически аномальных сперматозоидов в сравнении с группой контроля.
В 2017 г. A.B. Sliма, Y. Chtourou и соавт. [7] определяли воздействие дельтаметрина на самцов мышей и их потомство. Самцы получали дельтаметрин внутрижелудочно в дозе 5 мг/кг ежедневно в течение 35 дней, затем их спаривали с самками, не получавшими препарат. Исследование показало, что дельтаметрин значительно повлиял на репродуктивную функцию самцов:
- изменялись семенные канальцы;
- отслаивались зародышевые клетки;
- разрушались сперматогенные клетки;
- понижалась общая плотность сперматозоидов;
- понижалась подвижность сперматозоидов.
Заключение
В ходе проведенного наблюдения клинического случая установлено, что применение препарата Дельцид привело к полной яловости при 1-м спаривании, что говорит о высоком влиянии дельтаметрина на фертильность аутбредных мышей. Однако стоит отметить, что в динамике при повторном (через 64 дня) спаривании наблюдается тенденция к росту репродуктивного потенциала, а это может свидетельствовать о восстановлении репродуктивной функции аутбредных мышей и об обратимости репродуктивной токсичности препарата Дельцид при его отмене. Иная клиническая картина наблюдается у мышей линии BALB/c, где яловость превышала 90% при всех трех спариваниях и не имела тенденции к восстановлению, что может косвенно подтвердить необратимость репродуктивной токсичности препарата Дельцид для мышей данной линии.
Таким образом, полученные результаты негативного влияния дельцида на репродуктивную функцию у мышей полностью согласуются с данными литературы.
Применение этого инсектоакарицидного лекарственного средства для мышей, используемых для воспроизводства поголовья, является крайне нежелательным.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов
Ильинская М.А. – идея, разработка дизайна, сбор и систематизация материала, написание и редактирование текста.
Акимов Д.Ю. - написание и редактирование текста.
Список источников
- Washington D.C. Laboratory Animals in Biomedical and Behavioral Research. National Research Council (US) and Institute of Medicine (US) Committee on the Use of National Academies Press (US) - 1988. 246 р. doi: 10.17226/1098
- Mahler M., Berard M., Feinstein R., Gallagher A., Illgen-Wilcke B., Pritchett-Corning K., Raspa M. FELASA recommendations for the health monitoring of mouse, rat, hamster, guinea pig and rabbit colonies in breeding and experimental units// Laboratory Animals. – 2014, – Vol. 48(3). – P. 178–192. doi: 10.1177/0023677213516312
- Токарев А.Н., Енгашев С.В. Изучение острой токсичности препарата дельцид // Санкт - Петербургская государственная академия ветеринарной медицины. Ученые записки УО ВГАВМ. – 2011. – Т. 47. – С. 217-220. Tokarev A.N., Engashev S.V. Izuchenie ostroi toksichnosti preparata del'tsid // Sankt - Peterburgskaya gosudarstvennaya akademiya veterinarnoi meditsiny. Uchenye zapiski UO VGAVM. – 2011. – T. 47. – S. 217-220. (In Russ.)
- Desai K. R., Moid N., Patel P. B., Highland H. N. Evaluation of Deltamethrin induced reproductive toxicity in male Swiss Albino mice// Asian Pacific Journal of Reproduction. - 2016. – Vol. 5(1). – P. 24-30. doi: 10.1016/j.apjr.2015.12.004
- Jia Z.Z., Zhang J.W., Zhou D., Xu D.Q., Feng X.Z. Deltamethrin exposure induces oxidative stress and affects meiotic maturation in mouse oocyte. Chemosphere. - 2019. – Vol. 223 (5). – Р. 704-713. doi: 10.1016/j.chemosphere.2019.02.092.
- Slima A. B., Abdallah F. B., Keskes‐Ammar L., Mallek Z., Feki A. E., Gdoura R. Embryonic exposure to dimethoate and/or deltamethrin impairs sexual development and programs reproductive success in adult male offspring mice. Andrologia., 2010Vol.42 (3). Р -182-6. Doi: 10.1111 / j.1439-0272.2011.01246.
- Slima A. B., Chtourou Y., Barkallah M., Fetoui H., Boudawara T., Gdoura R. Endocrine disrupting potential and reproductive dysfunction in male mice exposed to deltamethrin. Hum Exp Toxicol., 2017. –36(3). - Р. 218-226. Doi: 10.1177/0960327116646617.
- Макарова М.Н., Ильинская М.А. Зоотехнические особенности воспроизводства мышей линии BALB/C. Лабораторные животные для научных исследований. 2020; 1: 29–41. https://doi.org/10.29296/2618723X-2020-01-04 Makarova M.N., Il'inskaya M.A. Zootekhnicheskie osobennosti vosproizvodstva myshei linii BALB/C. Laboratornye zhivotnye dlya nauchnykh issledovanii. 2020; 1: 29–41. https://doi.org/10.29296/2618723X-2020-01-04 (In Russ.)
- Макаров В.Г., Макарова М.Н. Новое в науке и практике доклинических исследований. Лабораторные животные для научных исследований. 2020; 2: 60–64. https://doi.org/10.29296/2618723X-2020-02-07 Makarov V.G., Makarova M.N. Novoe v nauke i praktike doklinicheskikh issledovanii. Laboratornye zhivotnye dlya nauchnykh issledovanii. 2020; 2: 60–64. https://doi.org/10.29296/2618723X-2020-02-07 (In Russ.)
- Макарова М.Н., Шекунова Е.В., Рыбакова А.В., Макаров В.Г. Объем выборки лабораторных животных для экспериментальных исследований // Фармация. - 2018, №2. –С. 3-8. Makarova M.N., Shekunova E.V., Rybakova A.V., Makarov V.G. Ob"em vyborki laboratornykh zhivotnykh dlya eksperimental'nykh issledovanii // Farmatsiya. - 2018, №2. –S. 3-8. (In Russ.)




