Диет-индуцированные модели метаболических нарушений. Сообщение 5: экспериментальная артериальная гипертензия
Макарова М.Н., Макаров В.Г. Диет-индуцированные модели метаболических нарушений. Сообщение 5: экспериментальная артериальная гипертензия. Лабораторные животные для научных исследований. 2019; 1. https://doi.org/10.29296/2618723X-2019-01-08
Резюме
Несмотря на использование огромного количества новейших лекарственных средств (ЛС) артериальная гипертензия (АГ) остается самым распространенным заболеванием и одной из основных причин смертности населения земного шара. Однако отсутствие полного понимания патогенеза АГ не позволяет обеспечить эффективное излечение данного заболевания: пока все лекарства снимают только основной симптом – повышенное артериальное давление (АД). В связи с этим необходимость дальнейших исследований по изучению патогенеза АГ, поиску средств ее профилактики и лечения не вызывает сомнений. Анализ современной литературы позволил установить, что для индукции солевой АГ наиболее часто применяют рационы питания, содержащие от 4 до 8% NaCl (поваренной соли), реже вводят NaCl с питьевой водой в виде 1% раствора. Длительность применения NaCl варьирует от 10 дней до 36 нед. АД растет прямо пропорционально количеству поваренной соли в рационе питания животных и длительности применения NaCl. Максимальный подъем АД происходит на 40–50-й день нахождения на высокосолевом рационе, затем наблюдается снижение АД. Лучше всего для моделей высокосолевой АГ подходят спонтанно гипертензивные крысы (SHR), у которых АД систолическое достигает ≥190 мм рт. ст., а также солечувствительные крысы Dahl, АД которых ≥170 мм рт. ст. Некоторые исследователи используют рационы питания, содержащие 60% фруктозы, или рационы питания с добавлением 10% фруктозы в воду для питья. При этом применяют в основном крыс диких аутбредных линий (Sprague Dawley и др.). Однако в моделях с применением фруктозы необходимы более длительные сроки для развития АГ, чем в солевых – от 8 нед до 12 мес (наиболее часто – 3–5 мес). Поэтому наиболее эффективными являются высокосолевые модели АГ (8% NaCl в рационе питания) с добавлением в питьевую воду 4 или 10% фруктозы. Для ускорения развития АГ содержание калия, кальция и цинка в рационах питания должно быть меньше нормы, а количество фосфора, наоборот, выше нормы. Возможно также изучение АГ на моделях метаболического синдрома, ожирения и болезней почек. Для оценки развития АГ рассматриваются показатели АД (систолическое, диастолическое, среднее), обмена веществ, состояния эндотелия, почек, окислительного стресса, провоспалительных цитокинов, массы сердца, объема выделяемой мочи и другие.
Введение
Артериальная гипертензия (АГ), являющаяся самым распространенным неинфекционным заболеванием на земном шаре (более 1 млрд больных), служит основной причиной серьезных поражений сердечно-сосудистой системы (ишемическая болезнь сердца, хроническая сердечная недостаточность и др.), почек (хроническая болезнь почек и др.) и головного мозга (острое нарушение мозгового кровообращения и др.), а также каждого 7-го летального исхода [1–3]. Причем АГ практически всегда сопутствует таким заболеваниям как метаболический синдром (МС), ожирение и сахарный диабет 2-го типа (СД 2-го типа) [4], усугубляя их течение. Однако, несмотря на наличие в настоящее время большого количества препаратов для лечения АГ, патогенез развития и течения этого заболевания еще до конца не понят, что затрудняет поиск ЛС и профилактики. Поэтому адекватные экспериментальные модели необходимы для более углубленного изучения патогенеза АГ, а также для поиска средств профилактики и лечения АГ, что является чрезвычайно актуальной проблемой.
Характеристика артериальной гипертензии
Артериальная гипертензия – это и самостоятельное заболевание (эссенциальная АГ, или гипертоническая болезнь – ГБ), и симптом при множестве других заболеваний [5]. В настоящее время научно-практическое значение имеют 2 классификации: по уровню АД и по стадиям ГБ. Настоящая статья посвящена моделированию АГ у животных, поэтому здесь нет конкретных цифр классификации АГ по уровням АД у человека, однако ниже представлены показатели АД как контрольных животных, так и животных на разных рационах питания при индукции АГ.
Классификация собственно ГБ по стадиям подразумевает 3 стадии заболевания в зависимости от наличия и интенсивности поражения органов – мишеней: сердца, головного мозга, сетчатки глаз, почек и сосудов [5]. При этом на I стадии ГБ при наличии повышенного АД изменения в органах-мишенях отсутствуют; на II – отмечается наличие одного или нескольких изменений, определяемых лабораторными или инструментальными методами; на III стадии появляются уже явные симптомы со стороны органов-мишеней и их заболевания (стенокардия, инфаркт миокарда, инсульт, почечная недостаточность и др.). Следует отметить, что первичная АГ (ГБ) составляет 95% всех случаев длительного повышения артериального давления, вторичная АГ (симптом при заболеваниях почек и других органов, участвующих в регуляции артериального давления) – около 5% [6].
В патогенезе развития АГ задействованы различные факторы. Остановимся лишь на основных, которые так или иначе связаны с питанием. АГ является многофакторным заболеванием с генетической предрасположенностью и возникает в результате сложного взаимодействия факторов окружающей среды и генетических факторов. Среди основных факторов выделяют избыток NaCl и некоторых гормонов (стероиды, инсулин), нарушение экскреции Na+, избыточный вес, некоторые заболевания (ожирение, СД 2-го типа и др.), атеросклероз артерий, в том числе почечных [4, 5]. Поэтому, в рекомендациях по изменению образа жизни больных АГ большое значение придается уменьшению потребления NaCl и снижению массы тела [5]. Некоторые исследователи вообще считают избыточное потребление NaCl основной причиной АГ [3].
На тесную связь между увеличением потребления NaCl и ростом заболеваемости АГ указывает М.А. Garfinkle [7] в аналитическом обзоре. Причем NaCl влияет на АД не только путем непосредственного воздействия на водно-солевой обмен, но и опосредованно – через эндотелий сосудов [8].
Одновременно многочисленные исследования свидетельствуют о развитии АГ при моделировании на животных МС, ожирения, атеросклероза и СД 2-го типа [4, 9–11]. В.И. Подзолков [5] приводит также результаты анализа современной литературы, свидетельствующие о важном значении инсулинрезистентности и гиперинсулинемии в патогенезе АГ.
Рационы питания и виды животных, используемые для индукции артериальной гипертензии
Экспериментальные диет-индуцированные модели АГ широко используются как для углубленного изучения патогенеза заболевания [12], так и для поиска средств его профилактики и лечения [13, 14]. В основном используются 2 модели: солевая и сахарная; причем последняя гораздо реже.
Для индукции солевой АГ наиболее часто применяют рационы питания, содержащие от 4 [8, 15, 16] до 8% NaCl [8, 15, 17]; при этом контрольные животные получают 0,1–0,5% NaCl с рационом, реже – 0,7–0,8% [8, 15, 18, 19]. Иногда применяют введение NaCl не с рационом, а с питьевой водой (1% раствор NaCl); контрольные животные получают чистую воду [20]. В качестве базового рациона питания для животных чаще всего используют рационы питания AIN-76 и AIN – 93 с различными модификациями [16, 17, 21].
Длительность применения NaCl варьирует от 10 дней [20] до 3 [17], 8–9 [8, 22], 11 [16] и 36 нед [12]. T.S. Pavlov et al. [23] показали, что АД увеличивается прямо пропорционально количеству поваренной соли (0,4, 4 и 8%) в рационе крыс, а V. McLoone et al. [18] и B.T. Endres et al. [17] свидетельствуют о повышении АД с ростом длительности применения NaCl. При этом максимальный подъем АД происходит на 40–50-й день нахождения на высокосолевом рационе, затем наблюдается некоторое снижение АД [18].
Что касается «сахарной» модели АГ, то изначально для этой цели, действительно, использовали сахарозу или глюкозу [24, 25]. Однако в дальнейшем исследователи начали применять фруктозу, потребление большого количества которой более стабильно вызывает АГ [26]. Для индукции АГ обычно используют рационы питания, содержащие 60% фруктозы, или стандартные рационы питания с добавлением 10% фруктозы в воду для питья [26, 27]. При этом как и для солевых моделей, наиболее часто используют крыс, но в основном – диких аутбредных линий (Sprague Dawley, Wistar и др.) [26]. Причем для моделей с применением фруктозы необходимы более длительные сроки для развития АГ, чем для солевых – от 8 нед до 12 мес (наиболее часто – 3–5 мес) [27].
Поэтому некоторые исследователи для более стабильного и быстрого развития АГ к рациону питания, содержащему 60% фруктозы, добавляют в питьевую воду 1% NaCl [27]. Иногда, наоборот, к рациону питания, содержащему 4 или 8% NaCl, добавляют воду для питья с 4 или 10% фруктозы [28, 29], что также ускоряет развитие АГ и ИР [29]. Так, например, максимальный подъем АД отмечается уже на 5-й неделе нахождения на рационе питания с содержанием в корме 4% NaCl и 4 г фруктозы на 100 мл питьевой воды, с последующим снижением АГ к концу 6-й недели и стабилизацией на довольно высоком уровне к 7-й неделе [28]. При этом среднее значение артериального давления на 7-й неделе использования этого рациона питания было 145±6 мм рт. ст., тогда как в контроле с 0,7% соли и без фруктозы – 126±5 мм рт. ст.
Кроме того, АГ часто развивается на моделях метаболического синдрома – высокожировой и высокоуглеводный рационы [10, 30], причем особо выраженный подъем АД у крыс линии Wistar вызывает рацион с высоким содержанием и жира и углеводов (161±3 мм рт. ст.) по сравнению с показателем в контроле (132±3 мм рт. ст.) [31]. При этом в эксперименте длительностью 16 нед высокое содержание жира обеспечивалось за счет говяжьего жира (300 г на 1 кг корма) и сгущенного молока (395 г на 1 кг корма), а углеводов – путем замены кукурузного крахмала фруктозой (175 г на 1 кг корма) [31]. АГ также развивается и на моделях ожирения – высокожировой и высокофруктозный рационы [11, 32, 33].
Вместе с тем как указывают Н.З. Клюева и соавт. [20], реакции организма на потребление NaCl зависят от количества в рационе питания некоторых минералов: дефицит калия и кальция, увеличивая чувствительность к NaCl, способствует развитию солечувствительной АГ, а высокое их содержание, наоборот, снижает риск развития солечувствительной АГ. Рацион питания с высоким содержанием фосфора и дефицитом цинка увеличивал систолическое АД у крыс линий Wistar и SHR [34]. В связи с этим для моделирования АГ логично остановиться на рационах питания не только с повышенным содержанием NaCl, но и с ограничением калия, кальция и цинка на фоне увеличения количества фосфора.
В зависимости от реакции АД на количество потребляемого CaNl выделяют солечувствительных и солерезистентных здоровых людей и больных АГ. При этом как среди людей есть солечувствительные и нечувствительные к высокому содержанию соли индивидуумы [35], так и среди животных имеются разные линии животных, у которых высокое содержание соли в рационе вызывает АГ или не оказывает такового влияния [18]. Для нас важно то, что наличие повышенной чувствительности АД к солевой нагрузке может определять более частое развитие кардиоваскулярных осложнений, чем в категории солерезистентных больных людей или животных.
Поэтому для поиска лечебных и профилактических средств при АГ наиболее часто используются экспериментальные модели на спонтанно гипертензивных крысах (SHR) [13] и солечувствительных крысах линии Dahl (Dahl/SS) [13, 16, 17]. Причем АГ у крыс Dahl/SS присущи многие черты солечувствительной АГ человека [15]. Следует иметь в виду, что АД у солечувствительных крыс Dahl даже на обычном рационе питания возрастает с возрастом до 160–170 мм рт. ст. [13]
Кроме того, АГ развивается при моделировании МС на крысах Zucker с ожирением и СД 2-го типа (ZDF), спонтанно-гипертензивных крысах с ожирением (SHROВ), крысах Otsuka Long-Evans Tokushima Fatty (OLETF), крысах Wistar Ottawa Karlsburg W (WOKW) [36]. Одновременно у крыс линии ZDF развивается эндотелиальная дисфункция, сходная с диабетической микроангиопатией у людей. Следует отметить, что АГ на фоне моделей МС и ожирения развивается позже, чем на солевых моделях АГ [36].
Для оценки эффективности исследуемых препаратов в качестве контроля часто используются не только интактные крысы на обычном рационе питания и животные, получающие гипертензивный рацион, но и животные, находящиеся на гипертензивном рационе на фоне известных гипотензивных препаратов (каптоприл и др.) [13].
При моделировании АГ следует учитывать более высокую подверженность к повышению АД у самцов по сравнению с самками, что обусловлено неблагоприятным влиянием половых гормонов самцов, в частности тестостерона, который повышает чувствительность к натрию, ухудшает функцию эндотелия сосудов и т.п., а также благоприятным влиянием половых гормонов самок [37, 38]. Причем, как указывают Х.И. Ибрагимова и соавт. [37], имеются половые различия и приверженности к лечению антигипертензивными препаратами. Поэтому в большинстве экспериментальных исследований при моделировании АГ используются самцы [ 13, 17, 20].
Показатели, используемые для оценки артериальной гипертензии у животных
Основные показатели для оценки АГ у животных – АД (систолическое – САД, диастолическое – ДАД, среднее). Именно они анализируются в первую очередь как в опытных, так и в контрольных группах животных при исследовании различных способов и средств профилактики и лечения АГ. При этом регистрация АД у животных проводится разными методами: манжеточным, при котором животному на хвост надевают окклюзионную манжетку, соединенную с электроманометром ENEMA (Швеция) [20], или аналогичным ему плетизмографическим с помощью хвостовой манжеты (Narco Bio Systems, Houston, TX) [19, 23], или с помощью имплантированных телеметрических устройств (DSI) [16, 17].
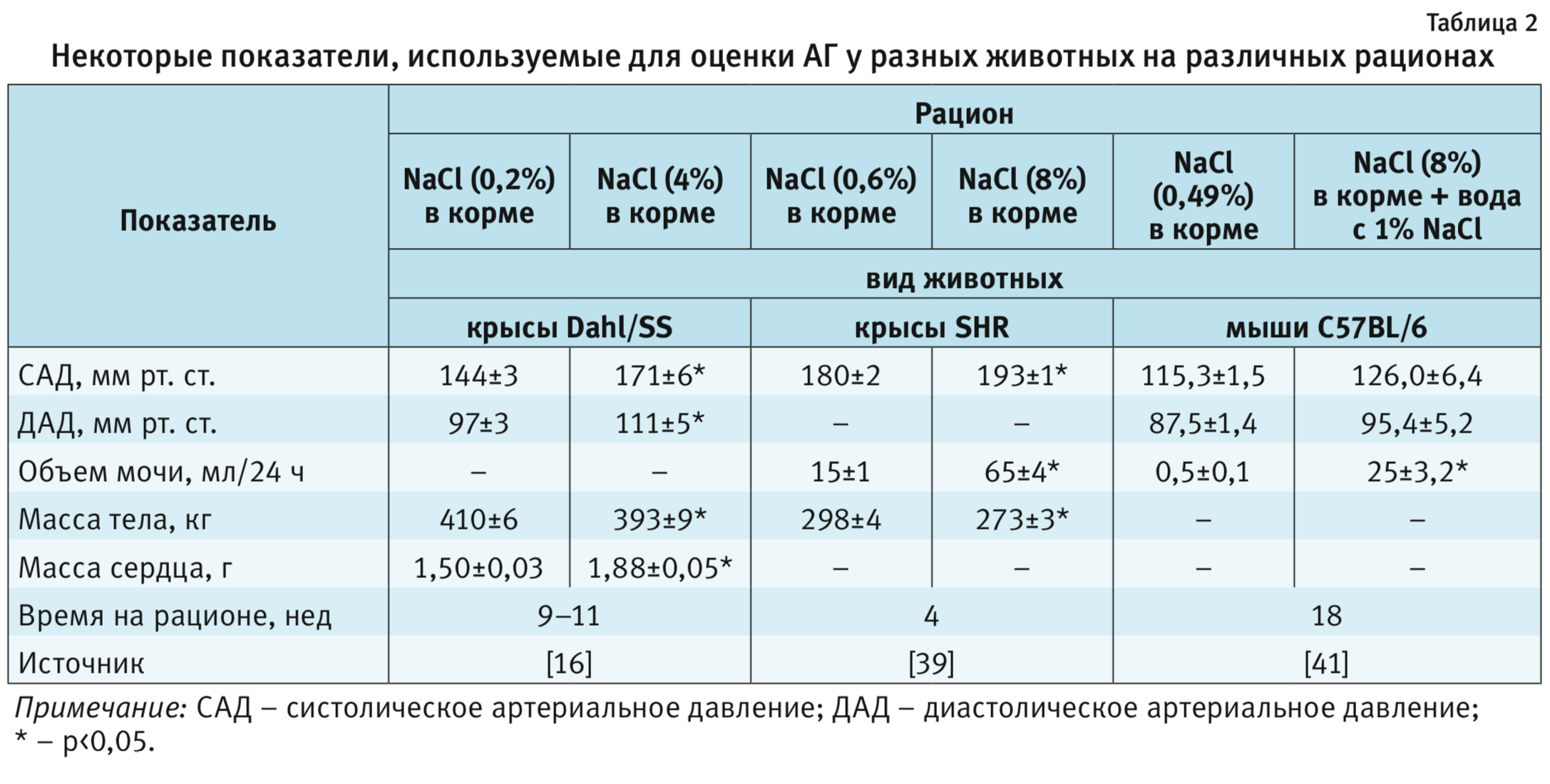
Следует отметить, что у животных, находящихся на рационах с высоким содержанием NaCl, достоверно снижается масса тела, в несколько раз возрастает потребление воды и суточный объем выделяемой мочи [16, 39, 40] (табл. 1 и 2). Эти показатели также можно использовать для оценки степени воздействия как экспериментальных рационов питания, так и исследуемых препаратов.
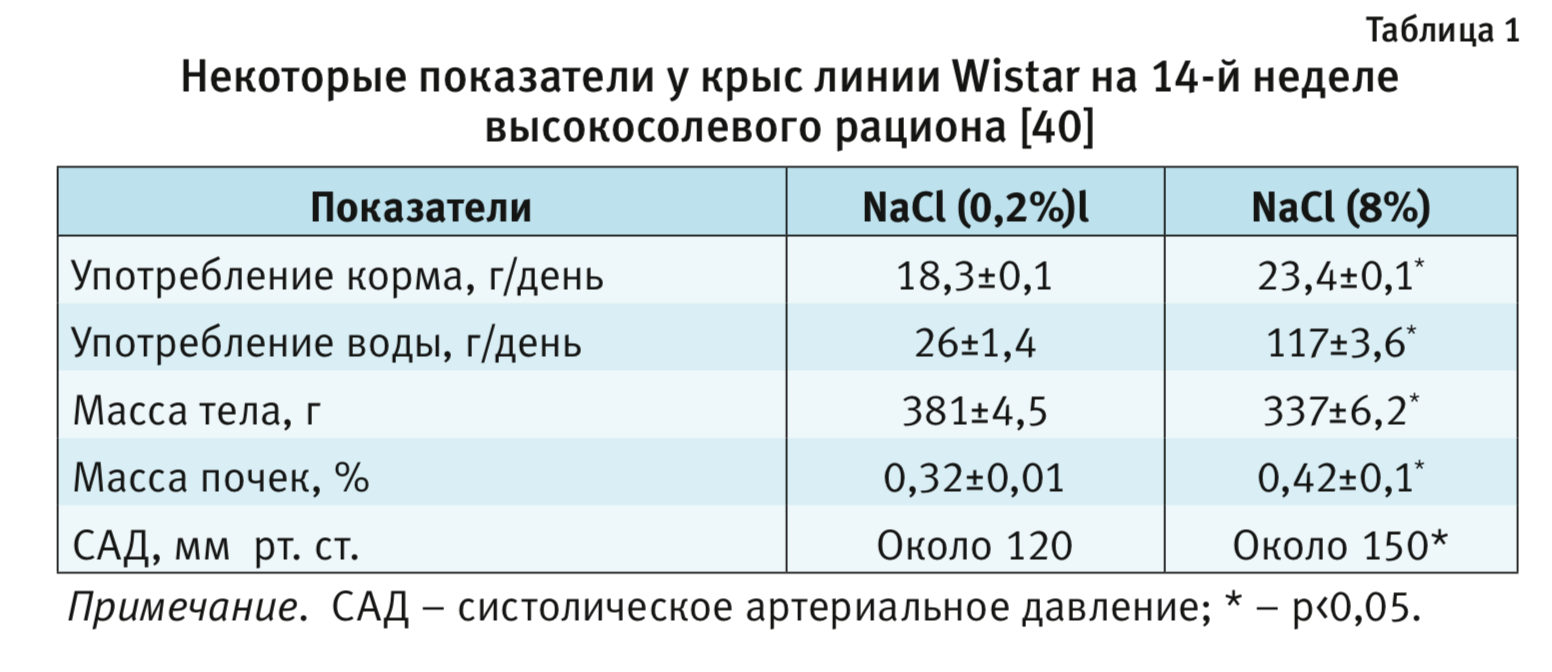
Многие исследователи для оценки эффективности средств, применяемых для снижения неблагоприятного влияния АГ на организм подопытных животных, проводят исследование состояния эндотелия сосудов [13]. Отмечая негативное воздействие высокого содержания NaCl в рационе на функции эндотелия, М.А. Boegehold [8] указывает не только на возможное развитие АГ, но и на повышение риска сердечно-сосудистых заболеваний и инсульта. В патогенезе нарушений, развивающихся в эндотелии при поступлении избыточных количеств NaCl, существенную роль играет окислительный стресс [8], показатели которого также ценны для контроля состояния животных при моделировании солевой АГ. К.А. Сысоев [42] отмечает важное значение в патогенезе АГ провоспалительных цитокинов [интерлейкин-1β (IL1β), фактор некроза опухоли альфа (TNFα), IL6], синтезируемых эндотелием, а также связывания эндотелиальными клетками липопротеинов низкой плотности, нарушаемых при АГ.
Н.Н. Крюков и соавт. [43] считают одним из маркеров риска развития АГ факт наличия инсулинорезистентности. И действительно, S. Aydin и соавт. [29] четко показали, что на фоне рациона с 8% NaCl повышается не только САД и ДАД, но и инсулинорезистентность уже к 4-й неделе эксперимента.
На фоне рациона с высоким содержанием NaCl солечувствительные крысы Dahl демонстрируют быстрое и заметное повышение значения среднего уровня АД и альбуминурии [17]. Так, уже на 7-й день АД у крыс на гиперсолевом рационе (128±1 мм рт. ст.) существенно превышало таковое у контрольных крыс (116±4 мм рт. ст.), на 14-й день разница в уровнях АД была еще больше (146±3 мм рт. ст. vs 119±4 мм рт. ст. в контроле), а к 21-му дню АД на фоне рациона с 8% NaCl составляло 172±5 мм рт. ст., в то время как на рационе с 0,4% NaCl – 122±4 мм рт. ст. Что касается альбуминурии, то исследователи установили резкое увеличение коэффициента соотношения альбумина и креатинина мочи – 131±0,1 у контроля vs 3,47±0,33 – на 3-й день, 6,75±1,27 – на 7-й день, 13,28±2,14 – на 14-й день и 17,04±2,68 – на 21-й день у животных опытной группы [17].
Соль-индуцированная АГ приводит к развитию гипертрофии левого желудочка у крыс, чувствительных к соли (Dahl/SS) [16], что выражается в достоверном росте массы сердца у животных с АГ (см. табл. 2).
Заключение
Среди моделей АГ наиболее эффективными в плане быстроты достижения АГ и ее адекватности АГ человека являются высокосолевые модели (8% NaCl в рационе питания) с добавлением в питьевую воду 4% или 10% фруктозы. Модели АГ с использованием только фруктозы (до 60% в рационе питания) менее эффективны. Для ускорения развития АГ на фоне высоко-солевых моделей можно уменьшать в рационах питания содержание калия, кальция и цинка, увеличивая при этом количество фосфора.
Для создания экспериментальных моделей АГ большинство исследователей используют линии спонтанно гипертензивных крыс (SHR) и солечувствительных крыс линии Dahl. При этом дикие породы грызунов (линии Wistar, Sprague Dawley) применяют в качестве контроля. Мыши привлекаются к экспериментам реже вследствие малых размеров, затрудняющих как измерение АД, так и отбор проб крови для анализа. Возможно также изучение АГ как симптома МС, ожирения или болезней почек, при моделировании указанных заболеваний.
Для оценки адекватности создаваемых моделей АГ у животных следует, в первую очередь, использовать показатели АД (систолическое, диастолическое, среднее) в сравнении с таковыми у контрольных животных, с тем, чтобы в дальнейшем изучать те или иные способы и средства профилактики и лечения АГ. Кроме того, надо анализировать различные показатели обмена веществ, окислительного стресса, провоспалительных цитокинов, состояния эндотелия, почек, массы сердца, объема выделяемой мочи и другие, тесно связанные с АГ.
Список источников
- Басырова И. Р., Либис Р. А. Комбинации факторов риска и частота сердечно-сосудистых событий в неорганизованной популяции города Оренбурга по данным 3-летнего проспективного наблюдения. Артериальная гипертензия. 2017; 23 (6): 589–96. DOI:10.18705/1607-419X-2017-23-6-589-596.
- Ионов М.В., Звартау Н.Э., Конради А.О. Совместные клинические рекомендации ESH/ESC 2018 по диагностике и ведению пациентов с артериальной гипертензией: первый взгляд. Артериальная гипертензия. 2018; 24 (3): 351–8. DOI:10.18705/1607-419X-2018-24-3-351-358.
- Blaustein M.P., Leenen F.H., Chen L., Golovina V.A., Hamlyn J.M., Pallone T.L., Van Huysse J.W., Zhang J., Wier W.G. How NaCl raises blood pressure: a new paradigm for the pathogenesis of salt-dependent hypertension. Am. J. Physiol. Heart. Circ. Physiol. 2012, 302:H1031-H1049.DOI: 10.1152/ajpheart.00899.2011.
- Nizar J.M., Dong W., McClellan R.B., Labarca M., Zhou Y., Wong J., Goens D.G., Zhao M., Velarde N., Bernstein D, Pellizzon M., Satlin L.M., Bhalla V. Na+-sensitive elevation in blood pressure is ENaC independent in diet-induced obesity and insulin resistance. Am. J. Physiol. Renal Physiol. 2016 May 1; 310 (9): F812–F820. DOI:10.1152/ajprenal.00265.2015
- Подзолков В.И. Артериальная гипертензия. М.: ООО «Изд. «Медицинское информационное агентство», 2016: 424.
- Смолянский Б.Л., Лифляндский В.Г. Лечебное питание. Карманный справочник. М.: «ОЛМА Медиа Групп», 2010: 394–419.
- Garfinkle M.A. Salt and Essential Hypertension: Pathophysiology and Implications for Treatment. J. Am. Society of Hypertension (2017). DOI: 10.1016/j.jash.2017.04.006.
- Boegehold M.A. The Effect of High Salt Intake on Endothelial Function: Reduced Vascular Nitric Oxide in the Absence of Hypertension. J. Vasc. Res. 2013; 50: 458–67. DOI: 10.1159/000355270
- Oliveira P.S., Gazal M., Flores N.P., Zimmer A.R., Chaves V.C., Reginatto F.H., Kaster M.P., Tavares R.G., Spanevello R.M., Lencina C.L., Stefanello F.M. Vaccinium virgatum fruit extract as an important adjuvant in biochemical and behavioral alterations observed in animal model of metabolic syndrome. Biomed. Pharmacother. 2017 Apr; 88: 939–47. DOI::10.1016/j.biopha.2017.01.121 0753-3322.
- Макарова М.Н., Макаров В.Г. Диет-индуцированные модели метаболических нарушений. Экспериментальный метаболический синдром. Лабораторные животные для научных исследований. 2018; 1. https://DOI.org/10.29296/2618723X-2018-01-08
- Макарова М.Н., Макаров В.Г. Диет-индуцированные модели метаболических нарушений. Сообщение 2: экспериментальное ожирение. Лабораторные животные для научных исследований. 2018; 2. https://DOI.org/10.29296/2618723X-2018-02-05
- Wu H., Chen L., Xie J., Li R., Li G.N., Chen Q.H., Zhang X.L., Kang L.N., Xu B. Periostin expression induced by oxidative stress contributes to myocardial fibrosis in a rat model of high salt-induced hypertension. Mol Med Rep. 2016 Jul; 14 (1): 776–82. DOI: 10.3892/mmr.2016.5308.
- Mackraj I., Govender T., Ramesar S.,. The Antihypertensive Effects of Quercetin in a Salt-sensitive Model of Hypertension. J. Cardiovasc. Pharmacol. 2008; 51: 239–45.
- Leibowitz A., Volkov A., Voloshin K., Shemesh C., Barshack I., Grossman E. Melatonin prevents kidney injury in a high salt diet-induced hypertensionmodel by decreasing oxidative stress. J Pineal Res. 2016 Jan; 60 (1): 48–54. DOI: 10.1111/jpi.12287.
- Pavlov T.S., Staruschenko A. Involvement of ENaC in the development of salt-sensitive hypertension. Am. J. Physiol. Renal. Physiol. (December 21, 2016). DOI:10.1152/ajprenal.00427.2016.
- Tran K., Han J.C., Taberner A.J., Barrett C.J., Crampin E.J., Loiselle D.S. Myocardial energetics is not compromised during compensated hypertrophy in the Dahl salt-sensitive rat model of hypertension. Am. J. Physiol. Heart Circ. Physiol. 2016. 311: 563–71. DOI:10.1152/ajpheart.00396.2016.
- Endres B.T., Sandoval R.M., Rhodes G.J., Campos-Bilderback S.B., Kamocka M.M., McDermott-Roe C., Staruschenko A., Molitoris B.A., Geurts A.M., Palygin O. Intravital Imaging of the Kidney in a Rat Model of Salt-Sensitive Hypertension. Am. J. Physiol. Renal. Physiol. (April 12, 2017). DOI:10.1152/ajprenal.00466.2016.
- McLoone V., Ringwood J., Van Vliet B. A 5-component mathematical model for salt-induced hypertension in Dahl-S and Dahl-R rats. Comput Methods Programs Biomed. 2011 Feb; 101 (2): 220-9. DOI: 10.1016/j.cmpb.2010.04.008.
- Liu L., Kashyap S., Murphy B., Hutson D.D., Budish R.A., Trimmer E.H., Zimmerman M.A., Trask A.J., Miller K.S., Chappell M.C., Lindsey S.H. GPER activation ameliorates aortic remodeling induced by salt-sensitive hypertension. Am. J. Physiol. Heart. Circ. Physiol. 2016. 310: 953–61.
- Клюева Н.З., Руденко Е.Д., Альдекеева А.С., Плеханов А.Ю., Чернышев Ю.И., Антонова О.С. Влияние солевой нагрузки на уровень обмена белка NAP‑22 – мажорного субстрата протеинкиназы С – в гиппокампе и теменной коре крыс со спонтанной гипертензией. Артериальная гипертензия. 2017; 23 (4): 325–31. DOI:10.18705/1607-419X-2017-23-4-325-331.
- Walker K.A., Cai X., Caruana G., Thomas M.C., Bertram J.F., Kett M.M. High nephron endowment protects against salt-induced hypertension. Am. J. Physiol. Renal. Physiol. 303: F253–F258, 2012; DOI:10.1152/ajprenal.00028.2012.
- Guo C.-P., Wei Z., Huang F., Qin M., Li X., Wang Y.-M., Wang Q., Wang J.-Z., Liu R., Zhang B., Li H.-L., Wang X.-C. High salt induced hypertension leads to cognitive defect. Oncotarget, 2017, Vol. 8, (№ 56): 95780–90
- Pavlov T.S., Levchenko V., Ilatovskaya D.V., Li H., Palygin O., Pastor-Soler N.M., Hallows K.R. and Staruschenko A. Lack of Effects of Metformin and AICAR Chronic Infusion on the Development of Hypertension in Dahl Salt-Sensitive Rats. Front. Physiol. 2017. 8:227. DOI: 10.3389/fphys.2017.00227
- Reaven G.M., Ho H. Sugar-Induced Hypertension in Sprague-Dawley Rats. Am. J. Hypertens., 1991 Jul; 4 (7 Pt 1): 610–14.
- Preuss H.G., Knapka J.J., MacArthy P., Yousufi A.K., Sabnis S.G., Antonovych T.T. High Sucrose Diets Increase Blood Pressure of Both Salt-Sensitive and Salt-Resistant Rats. Am. J. Hypertens., 1992 Sep; 5 (9): 585–91.
- Gradel A.K.J., Salomonsson M., Sørensen C.M., Holstein-Rathlou N.H., Jensen L.J. Long-term diet-induced hypertension in rats is associated with reduced expression and function of small artery SKCa, IKCa, and Kir2.1 channels. Clin. Sci. (Lond). 2018 Feb 28; 132 (4): 461–74. DOI: 10.1042/CS20171408.
- Lee W.C., Wu K.L.H., Leu S., Tain Y.L. Translational insights on developmental origins of metabolic syndrome: Focus on fructose consumption. Biomed J. 2018 Apr; 41 (2): 96–101. DOI: 10.1016/j.bj.2018.02.006.
- Vasdev S., Gill V.D., Randell E., Han Y., Gadag V. Fructose and moderately high dietary salt-induced hypertension: prevention by a combination of N-acetylcysteine and L-arginine. Mol Cell Biochem. 2010 Apr; 337 (1–2): 9–16. DOI: 10.1007/s11010-009-0281-4.
- Aydin S., Aksoy A., Aydin S., Kalayci M., Yilmaz M., Kuloglu T., Citil C., Catak Z. Today’s and yesterday’s of pathophysiology: Biochemistry of metabolic syndrome and animal models. Nutrition. 2014. 30 (1): 1–9. DOI: 10.1016/j.nut.2013.05.013.
- Yao L., Wei J., Shi S., Guo K., Wang X., Wang Q., Chen D., Li W. Modified lingguizhugan decoction incorporated with dietary restriction and exercise ameliorates hyperglycemia, hyperlipidemia and hypertension in a rat model of the metabolic syndrome. BMC Complementary and Alternative Medicine (2017) 17: 132.
- Bhaswant M., Poudyal H., Mathai M.L., Ward L.C., Mouatt P., Brown L. Green and Black Cardamom in a Diet-Induced Rat Model of Metabolic Syndrome. Nutrients. 2015 Sep 11; 7(9): 7691–707. DOI: 10.3390/nu7095360.
- Weisbrod R.M., Shiang T., Al Sayah L., Fry J.L., Bajpai S., Reinhart-King C.A., Lob H.E., Santhanam L., Mitchell G., Cohen R.A., Seta F. Arterial stiffening precedes systolic hypertension in diet-induced obesity. Hypertension. 2013 Dec; 62 (6): 1105–10. DOI: 10.1161/HYPERTENSIONAHA.113.01744.
- How J.M., Wardak S.A., Ameer S.I., Davey R.A., Sartor D.M. Blunted sympathoinhibitory responses in obesity-related hypertension are due to aberrant central but not peripheral signalling mechanisms. J Physiol. 2014 Apr 1; 592 (7): 1705–20. DOI: 10.1113/jphysiol.2013.269670.
- Suzuki Y., Mitsushima S., Kato A., Yamaguchi T., Ichihara S. High-phosphorus/zinc-free diet aggravates hypertension and cardiac dysfunction in a rat model of the metabolic syndrome. Cardiovasc Pathol. 2014 Jan-Feb; 23 (1): 43–9. DOI: 10.1016/j.carpath.2013.06.004.
- Фендрикова А.В., Скибицкий В.В., Гаркуша Е.С. Гендерные различия антигипертензивной эффективности комбинированной фармакотерапии у пациентов с рефрактерной артериальной гипертензией и абдоминальным ожирением с учетом солечувствительности. Артериальная гипертензия. 2016; 22 (4): 370–81. DOI:10.18705/1607-419X-2016-22-4-370-381.
- Кравчук Е.Н. Экспериментальные модели метаболического синдрома / Е.Н. Кравчук, М.М. Галагудза. Артериальная гипертензия. 2014. Том 20; 5: 377–83. Kravchuk E.N., Galagudza M.M. Jeksperimental’nye modeli metabolicheskogo sindroma. Arterial’naja gipertenzija. 2014. Vol. 20; 5: 377–83.
- Ибрагимова Х.И., Маммаев С.Н., Омарова Д.А. Половые особенности регуляции артериального давления и лечения артериальной гипертензии. Артериальная гипертензия. 2018; 24 (3): 303–8. DOI:10.18705/1607-419X-2018-24-3-303-308.
- Chappell M.C., Westwood B.M., Yamaleyeva L.M. Differential effects of sex steroids in young and aged female mRen2.Lewis rats: a model of estrogen and salt-sensitive hypertension. Gend Med. 2008; 5 Suppl A: S65–75. DOI: 10.1016/j.genm.2008.03.007.
- Susic D., Frohlich E.D., Kobori H., Shao W., Seth D., Navar L.G.. Salt-induced renal injury in SHRs is mediated by AT1 receptor activation. Hypertens. 2011 April; 29 (4): 716–23. DOI:10.097/HJH.0b013e3283440683.
- Takagi Y., Kadowaki H., Kobayashi I., Ito K, Ito K., Shirai M., Asai F. Effects of high-sodium intake on systemic blood pressure and vascular responses in spontaneously diabetic WBN/Kob-Leprfa/fa rats. Clin. Exp. Pharmacol. Physiol. 2017 Feb; 44 (2): 305–12. DOI: 10.1111/1440-1681.12700.
- Brochu I., Houde M., Desbiens L., Simard E., Gobeil F., Semaan W., Bkaily G., D’Orléans-Juste P. High salt-induced hypertension in B2 knockout mice is corrected by the ETA antagonist, A127722. British Journal of Pharmacology (2013) 170 266–77. DOI:10.1111/bph.12259.
- Сысоев К.А. Морфофункциональные изменения эндотелия в патогенезе гипертонической болезни. Артериальная гипертензия. 2017; 23 (5):447–56. DOI:10.18705/1607-419X-2017-23-5-447-456.
- Крюков Н.Н., Титова Ю.Ф., Киселева Г.И., Губарева И. В. Инсулинорезистентность у пациентов с артериальной гипертензией в зависимости от риска сердечно-сосудистых осложнений. Артериальная гипертензия. 2015; 21 (4): 378–85. DOI: 10.18705/1607-419X-2015-21-4-378-385.




