Обзор доклинических моделей сепсиса и септического шока
Никифорова Л.Р., Крышень К.Л., Боровкова К.Е., Салмова Ю.В. Обзор доклинических моделей сепсиса и септического шока . Лабораторные животные для научных исследований. 2021; 4. https://doi.org/10.29296/2618723X-2021-04-03
Резюме
Сепсис – это угрожающее жизни патологическое состояние организма, которое возникает вследствие системной воспалительной реакции на инфекцию. Развитие сепсиса может произойти в результате различных бактериальных, грибковых и вирусных инфекций, таких как COVID-19 или грипп. За последние 2 года количество смертей в мире от сепсиса и септического шока стало стремительно расти вверх в связи с распространением COVID-19. Из-за стремительного роста смертности от сепсиса и септического шока в мире как никогда стоит острая необходимость в поиске новых улучшенных методов лечения. Неотъемлемой частью при разработке и тестировании новых лекарственных препаратов являются доклинические исследования с использованием моделей на животных. В данном обзоре мы рассмотрели и обобщили материалы научных исследований в области доклинических моделей сепсиса, коснулись основных возбудителей и способов индукции патологии. Согласно данным, приводимым в научных статьях, наиболее часто сепсис моделируют на мышах, крысах, кроликах, собаках, свиньях, овцах и приматах. Среди моделей сепсиса на животных часто используются мыши и крысы из-за небольших размеров, простоты постановки экспериментов, доступности генетически модифицированных видов и относительно низкой стоимости. Наиболее подходящими и точными объектами для моделирования сепсиса считаются крупные животные, данные модели не только допускают серийный отбор проб, но у них очень схожие с людьми иммунологические и физиологические функции. Модели на нечеловекообразных приматах максимально близко имитируют клинические проявления сепсиса у человека, чем любой другой вид животных, из-за анатомического, молекулярного и физиологического сходства. Несмотря на все преимущества, использование приматов в исследованиях сепсиса несет в себе определенные ограничения, такие как риск передачи инфекционных заболеваний, высокие затраты на содержание и этические соображения. Почти все используемые в настоящее время модели сепсиса включают первичное введение инфекционных агентов, или их компонентов, которые впоследствии запускают воспалительный каскад реакций. От поставленных целей исследования зависят выбор животных, способ индукции и оцениваемые параметры.
Введение
Сепсис – это тяжелое состояние организма человека, которое развивается как системная воспалительная реакция при попадании в кровь инфекционных агентов или их токсинов и может быть значительно усилено эндогенными факторами.
В большинстве случаев возбудителями сепсиса являются бактериальные агенты. Сепсис также может быть результатом других инфекций, в том числе вирусных, таких как COVID-19 или грипп.
Тяжелый сепсис – основная причина смерти (30–50% случаев) в некоронарных отделениях интенсивной терапии [1]. Разработка экспериментальных моделей сепсиса для изучения клеточных и молекулярных механизмов и патофизиологии сепсиса, а также терапевтических средств при купировании этого состояния активно ведется последние десятилетия.
Несмотря на обширные исследования в этой области, частота возникновения сепсиса и количество смертей, связанных с ним, увеличиваются [1, 2].
Клинические проявления сепсиса начинаются с воспаления и прогрессируют до дисфункции органов кровообращения. Четко определенные клинические признаки включают тромбоцитопению, гемолитическую анемию, микротромбоз сосудов [3], синдром полиорганной дисфункции [4], коагулопатию [5] и септический шок. Другие проявления включают учащенное сердцебиение, дыхательную недостаточность, лихорадку, лейкопению, гипотензию, лейкоцитоз, цитокиновый шторм и высокую предрасположенность к оппортунистическим инфекциям [6, 7].
Во время возникновения и прогрессирования сепсиса присутствуют две динамические стадии: синдром системного воспалительного ответа (SIRS) в острой фазе и синдром компенсаторного противовоспалительного ответа (CARS) в более поздней фазе [8]. Отличительной чертой SIRS/CARS является усиленное производство про- и противовоспалительных цитокинов/хемокинов, что приводит к так называемому «цитокиновому шторму» [9–11]. Медиаторы воспаления и их производные важны для обеспечения эффективной защиты хозяина, однако их чрезмерное производство способствует активации молекул адгезии, что приводит к экстравазации лейкоцитов и инициированию этих клеток вместе с эпителиальными и эндотелиальными клетками. Результатом вышеприведенных изменений является развитие гиперкоагуляции, вследствие этого возникает дополнительная нагрузка на сосуды. В совокупности повреждение тканей, вызванное активированием иммунных клеток и патологической коагуляции, приводит к диссеминированному внутрисосудистому свертыванию (ДВС), что в свою очередь, может повлечь за собой полиорганную недостаточность, гипоксию и смерть [12–14]. Основываясь на молекулярных механизмах, лежащих в основе сепсиса, разрабатываются новые клинические методы лечения для нейтрализации ключевых молекул, участвующих в инициации и развитии сепсиса, в том числе липополисахарида (ЛПС), основного компонента клеточной стенки грамотрицательных бактерий. Хотя экспериментальные исследования с использованием моделей сепсиса на животных демонстрируют положительный эффект некоторых методов лечения, последующие клинические испытания не показывают никаких существенных положительных сдвигов в лечении сепсиса [15–17]. Эти наблюдения подтверждают идею о том, что тяжелый сепсис – это динамичное и сложное заболевание, для лечения которого пока нет полностью эффективных стратегий.
В опубликованном в январе 2020 г. исследовании по глобальной эпидемиологии сепсиса отмечается, что в 2017 г. в мире было зарегистрировано 48,9 млн случаев сепсиса и 11,0 млн смертей от него. Это составляет 19,7% всех смертей в мире [18].
Исследования молекулярных и клеточных механизмов в клинических условиях ограничены, в частности, из-за вариабельности ответов и степени тяжести, которые усугубляются неоднородностью популяции пациентов [19]. Таким образом, хорошо контролируемые модели на животных – полезная альтернатива для понимания клеточных и молекулярных механизмов, лежащих в основе сепсиса.
Какие микроорганизмы вызывают сепсис?
Инфекции, вызывающие сепсис, обычно являются бактериальными, но могут быть грибковыми, паразитарными или вирусными [20]. Грамположительные бактерии были основной причиной сепсиса до появления антибиотиков в 1950-х годах. После введения антибиотиков грамотрицательные бактерии стали основной причиной сепсиса с 1960-х по 1980-е годы [21]. После 1980-х годов считается, что грамположительные бактерии, чаще всего стафилококки, вызывают более 50% случаев сепсиса [22]. Другие наиболее часто встречающиеся бактериальные возбудители сепсиса включают Streptococcus pyogenes, Escherichia coli, Pseudomonas aeruginosa и виды Klebsiella [23]. Грибковый сепсис составляет около 5% случаев тяжелого сепсиса и септического шока; наиболее частой причиной грибкового сепсиса являются дрожжеподобные грибки Candida. Чаще всего причинами паразитарного сепсиса являются Plasmodium (возбудитель малярии), Schistostoma и Echinococcus [24, 25].
Основные очаги инфекции, приводящей к тяжелому сепсису, – легкие, брюшная полость и мочевыводящие пути. Как правило, 50% всех случаев сепсиса начинается с инфекции легких [20].
В декабре 2019 г. возникло новое заболевание, вызвавшее пандемию по всему миру, названное «коронавирусная болезнь 2019» (COVID-19). Заболевание характеризуется тяжелым острым респираторным синдромом, возбудителем является вирус из семейства коронавирусов (SARS-CoV-2). Пандемия COVID-19 вызвала беспрецедентные политические, экономические и социальные потрясения во всем мире и унесла жизни более 2 млн человек по состоянию на первые месяцы 2021 г. [26]. По мере развития понимания патогенеза COVID-19 вскоре стало ясно, что за начальной фазой репликации вируса может последовать неадекватный ответ организма, что приводит к более генерализованному течению заболевания. При тяжелой форме COVID-19 могут возникнуть цитокиновый шторм, ДВС-синдром, ОРДС (острый респираторный дистресс-синдром) и полиорганная недостаточность [27]. Согласно 3-му Международному консенсусу по определению сепсиса и септического шока (Сепсис-3), симптоматика у пациентов с вышеуказанными осложнениями соответствует диагностическим критериям сепсиса и септического шока, это означает, что при инфекции SARS-CoV-2 часто возникает сепсис [28]. Ретроспективное исследование показало, что у 100% умерших пациентов от COVID-19 был сепсис, а у 70% – септический шок [29].
Понимание основных молекулярных и клинических механизмов, вызывающих сепсис у пациентов с COVID-19, а также поиск новых терапевтических средств лечения COVID-19 являются первоочередной задачей, которую можно решить с помощью доклинических исследований. Наиболее подходящие модели для изучения COVID-19 – животные, восприимчивые к вирусу, а протекание у них заболевания должно соответствовать таковому у человека. На рисунке приведены наиболее подходящие животные для моделирования COVID-19.
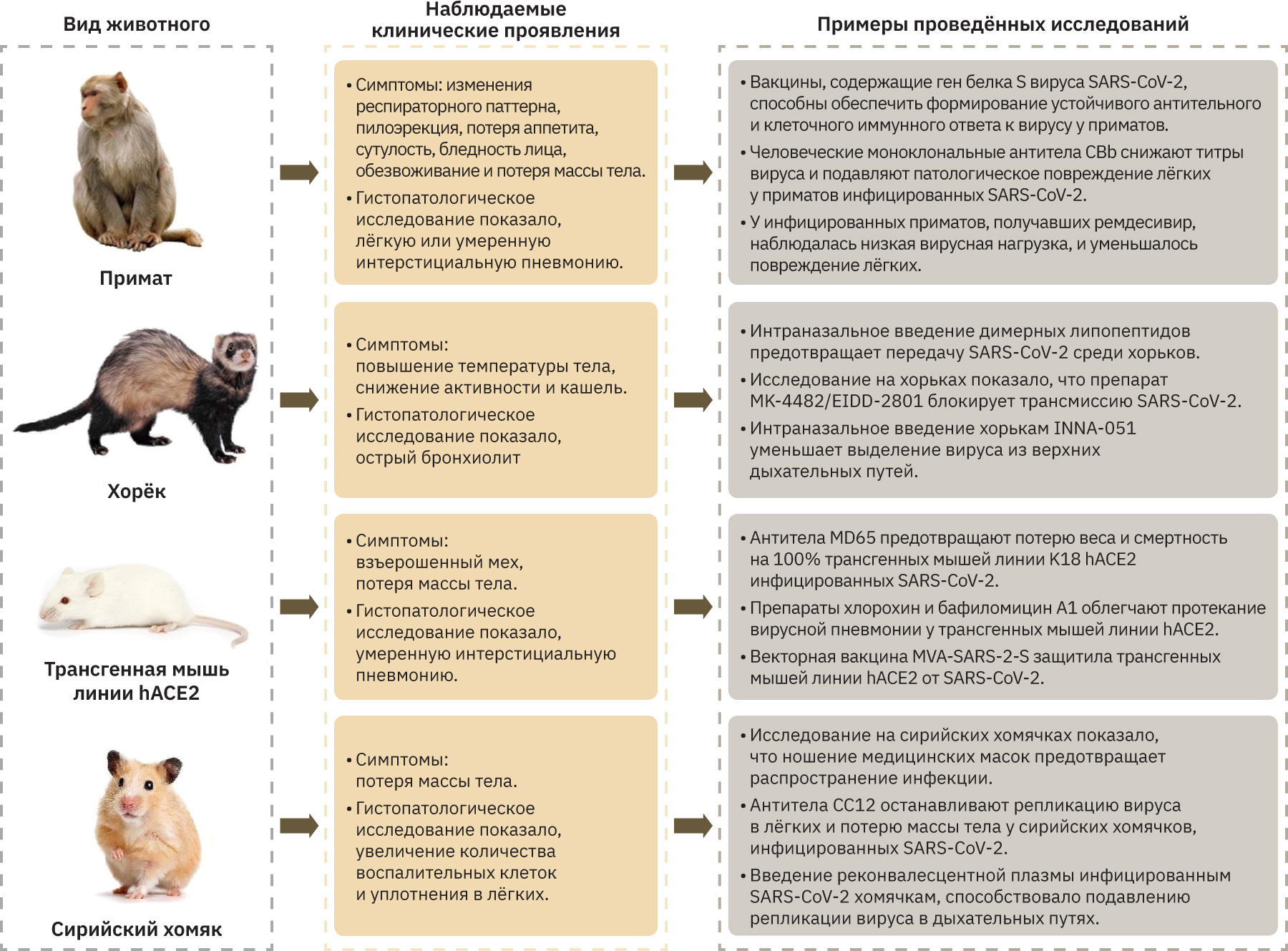
Способы моделирования сепсиса
Модель ЛПС
ЛПС эндотоксин – компонент внешней мембраны грамотрицательных бактерий, может вызывать сильные иммунные реакции у крупных млекопитающих, поэтому широко применяется в качестве патогенного фактора при исследовании сепсиса. Внутривенное и внутрибрюшинное введение ЛПС вызывает системное воспаление, которое имитирует многие из начальных клинических признаков сепсиса, включая обширную продукцию провоспалительных цитокинов, таких как фактор некроза опухоли-α (TNF-α) и интерлейкином (IL)-1, что приводит к полиорганной недостаточности и высокой летальности. Связывание ЛПС с Toll-подобным рецептором-4 (TLR-4) запускает комплекс внутриклеточных реакций с участием MAP-киназ ERK1/2, JNK, p38 и активацией факторов транскрипции NF-kB, AP-1, IRF-3, играющих ключевую роль в воспалительном ответе [31, 32].
Инъекционное введение ЛПС – это один из самых простых методов моделирования сепсиса, который имеет много общего с начальной фазой сепсиса человека. Однако модели ЛПС-индуцированного сепсиса демонстрируют некоторые недостатки в доклинических исследованиях. Во-первых, сепсис, вызванный грамотрицательной бактериальной инфекцией, указывает на очень быстрое и преходящее повышение уровня системных цитокинов, в то время как сепсис человека характеризуется длительным повышением и уровень их на несколько порядков ниже [33, 34].
Перитонит восходящей ободочной кишки
Процедура индукции при перитоните восходящей ободочной кишки (colon ascendens stent peritonitis – CASP) состоит в введении стента (катетера) в восходящую ободочную кишку путем лапаротомии. Фекалии выводятся из кишки и вытекают из стента в брюшную полость, что приводит к полимикробному перитониту и как следствие – к сепсису [35]. Тяжесть заболевания и смертность зависят от размера стента: при введении стента размером 14 G летальность достигает 100%, а при размере 20 G снижается до 50% и менее [35]. Было показано, что модель CASP на животных приводит к дисфункции органов, аналогичной той, что наблюдается у людей с сепсисом. Сообщалось об остром повреждении легких, почечной недостаточности и дисфункции клеток костного мозга после CASP [36, 37]. Считается, что провоспалительные медиаторы, такие как IL-1 и IFN-γ (интерферон гамма), также играют важную роль в этом методе моделирования сепсиса [35, 37]. Выживаемость не зависит от уровня TNF-α при методе CASP в отличие от модели CLP [35].
Прокол и лигирование слепой кишки
В модели прокола и лигирования слепой кишки (cecal ligation and puncture – CLP), как и CASP, абдоминальный септический очаг приводит к полимикробной инфекции в брюшной полости. Эта модель предусматривает перевязку под илеоцекальным клапаном с последующим сквозным проколом слепой кишки с помощью иглы. Впоследствии у животных развиваются типичные симптомы сепсиса или септического шока, приводящие к гибели [38]. Данный метод является золотым стандартом моделирования сепсиса и применяется довольно широко [39]. При развитии данной экспериментальной патологии увеличивается уровень основных провоспалительных цитокинов IL-6 (интерлейкин 6) и TNF-α и сильно коррелирует с выживаемостью при сепсисе [40, 41].
В модели CLP длина перевязанной кишки влияет на смертность и на уровень провоспалительных цитокинов, таких как IL-6 и TNF-α [39].
Другими факторами, влияющими на смертность при моделировании сепсиса с помощью метода CLP, являются размер иглы, используемой для пункции и количество проколов. Очень важно, чтобы процедура CLP выполнялась последовательно и была воспроизводима для корректной оценки результатов, полученных от животных с сепсисом [42].
Модель фекальных гранул
Модель фекального гранульного перитонита имитирует сепсис, вызванный попаданием фекалий в брюшную полость [43]. Модель фекальных гранул заключается во внутрибрюшинном введении инокулированных бактериями желатиновых капсул или фибриновых сгустков, содержащих фекальный материал и вспомогательные (адъювантные) вещества, такие как сульфат бария, за счет которых предотвращается быстрая реакция организма хозяина на инфекционные агенты [44].
После инокуляции фекальными гранулами происходит двухэтапный процесс. На начальном этапе развивается острый сепсис, смертность от которого через 3 дня составляет около 40%, а в крови преобладают аэробные бактерии (Escherichia coli и Enterococcus). У выживших животных второй этап начинается через 5–7 дней с развития внутрибрюшных абсцессов, в которых преобладают анаэробные бактерии, такие как Bacteroides fragilis и Fusobacterium varium [44]. Основываясь на этих данных, можно предположить, что модель фекальных гранул представляет собой таковую при абдоминальном абсцессе после перитонита, а не абдоминального сепсиса [45]. Кроме того, в различных исследованиях данной модели было обнаружено, что уровень смертности зависит от типа фекалий, которые в свою очередь зависят от способов кормления животных и качества используемого корма [45].
Во многих отношениях модель фекальных гранул имеет некие сходства с моделями CLP и CASP. Однако данная модель несовершенна, исследователи считают ее плоховоспроизводимой.
Модель бактериального инокулята
Метод моделирования сепсиса с помощью модели бактериального инокулята заключается во введении в организм животного известного количества бактерий, смешанных с фекальным материалом или адъювантными веществами [46]. Смертность при использовании данной модели зависит от количества введенных бактерий, путей введения (внутривенное, интратрахеальное или внутримышечное), а также от применяемых растворов и антибиотиков. Хотя эти модели являются воспроизводимыми, они имеют ряд недостатков [47]. При введении высокой дозы бактериальных штаммов невозможна колонизация в организме хозяина, так как они мгновенно распознаются и лизируются системой комплемента [48]. Таким образом, создается эндотоксемия, а не сепсис, поэтому в бактериальный суспензионный раствор необходимо вводить адъювантные вещества, предотвращающие его деградацию [49].
На исход течения болезни также влияет и вид вводимых бактерий. Так, в 1976 г. А. Ондердонк и соавт. [50] в исследовательских целях вводили мышам разные виды чистых культур бактерий или комбинации нескольких штаммов. В данном исследовании продемонстрировано, что введение чистой культуры Escherichia coli приводит к молниеносному сепсису с ранней смертностью, в то время как у животных, получавших смешанную культуру Escherichia coli с Bacteroides fragilis, – к развитию внутрибрюшных абсцессов.
Модели сепсиса с использованием лабораторных животных
При выборе животных для моделирования сепсиса модель должна повторять те же гемодинамические изменения при инфекции, которые наблюдаются у людей, такие как гипотония, низкое системное сосудистое сопротивление и компенсаторное увеличение сердечного выброса после пероральной регидратационной терапии [51, 52]. Модели на животных должны демонстрировать аналогичные признаки и симптомы инфекции: снижение активности, изменение температуры тела и количества лейкоцитов [53]. Идеальная модель на животных должна быть недорогой, простой в содержании и иметь крупные размеры для облегчения сбора физиологических показателей и хирургических манипуляций.
Модели на мышах и крысах
Самыми популярными моделями для изучения сепсиса являются мелкие грызуны (мыши и крысы). Основные преимущества мелких животных, таких как мыши и крысы, заключаются в их низкой стоимости, высокой скорости размножения и простоте содержания. Такие модели полностью соответствуют правилам 3R. На рынке имеется огромное количество иммунологических реагентов и/или наборов для анализа тех или иных видоспецифичных аналитов. Эти реагенты и наборы облегчают измерение уровня цитокинов или других медиаторов в биологических жидкостях [54–56].
Однако, несмотря на многочисленные плюсы, модели на грызунах обладают некоторыми техническими ограничениями. Мелкие грызуны отличаются небольшими размерами, вследствие чего имеют небольшой общий объем крови (примерно 2 мл у мышей и 20 мл у крыс), что затрудняет гемодинамический мониторинг, а также возможность проведения активной поддерживающей терапии (искусственная вентиляция легких, инфузионная терапия, заместительная почечная терапия, парентеральное питание и др.) [57]. Мышиный организм является более устойчивыми к ЛПС и бактериальным патогенам, чем человеческий [58]. При развитии шока гемодинамические и цитокиновые профили мелких грызунов сильно отличаются от человеческих [56].
Впервые на грызунах была разработана модель эндотоксемического сепсиса, данная модель основана на внутривенном введении ЛПС для имитации физиологических реакций грамотрицательного сепсиса у людей [56]. Используя модели ЛПС, проводят тестирование новых лекарственных средств, при этом исследование модели септического шока на мышах показало, что при одновременном введении ЛПС и тестируемого препарата габриглобин-IgM значительно снижает летальность и уровень провоспалительных цитокинов TNF- α и IL-6 [59].
Вторая модель прокола и лигирования слепой кишки (cecal ligation and puncture, CLP), основанная на грызунах, была разработана с целью имитации абдоминального сепсиса человека, вызванного полимикробной инфекцией [57]. Хотя эта модель считается «золотым стандартом» для исследований на грызунах, она ограничена вариабельностью техники (например, количество проколов, размерами прокола) и используемыми патогенами [58]. Другая модель, использующая внутривенную инъекцию живых бактерий, имитирует бактериемию, наблюдаемую у 69% людей при септическом шоке [58].
Модели на кроликах
Использование кроликов в исследовании сепсиса имеет несколько больше преимуществ по сравнению с мелкими грызунами, поскольку имеют больший размер, что облегчает измерение различных физиологических параметров (например, среднего артериального давления, частоты сердечных сокращений и др.), а их хемокиновые системы и пути биосинтеза окиси азота аналогичны человеческим [60].
Модель пневмококкового сепсиса на кроликах была разработана в 1970 г. Она охватывает несколько симптомов сепсиса, включая повышенный сердечный выброс и температуру тела [60]. Для индукции сепсиса внутрибрюшинно вводят суспензию бактериальных клеток Streptococcus pneumoniae (108–109 КОЕ/мл) [60]. Введение внутрибрюшинно суспензии, содержащей 109 КОЕ/мл, вызывает более стойкую инфекцию по сравнению с дозой 108 КОЕ/мл, в то время как доза 1010 КОЕ/мл является летальной для кроликов [61]. Благодаря данной модели было обнаружено, что функция полиморфно-ядерных лейкоцитов в брюшной полости нарушается при сепсисе [61]. В целом модель сепсиса на кроликах используется для исследования физиологических и иммунологических реакций организма на сепсис [62].
Модели на собаках
Модель сепсиса на собаках широко применяется для изучения влияния на сердечно-сосудистую систему. Собаки, подвергшиеся септическому шоку, демонстрируют реакции, аналогичные таковым у человека. Например, наблюдаются серьезное, но обратимое снижение систолической функции желудочков [63], увеличение сердечного выброса на 32–108%, снижение среднего артериального давления и лейкоцитоз, а также повышение уровня адреналина и норадреналина в плазме во время септического шока [64]. Профили цитокинов в модели сепсиса на собаках также аналогичны профилям людей с сепсисом с 62-кратным увеличением IL-6 и 4,5-кратным увеличением TNF-α в течение первых часов по сравнению с контролем [65].
Несмотря на аналогичные физиологические реакции, у этой модели есть несколько ограничений, касающихся клинической значимости. У собак есть адренергический чувствительный сфинктер вокруг печеночной вены, который сужается во время сепсиса, повышая венозное давление в кишечнике и повреждая барьер слизистой оболочки кишечника [66]. Другим важным ограничением является устойчивость собак к эндотоксинам и необходимость высоких доз ЛПС для индукции сепсиса, что приводит к тяжелой гиподинамической реакции у собак, которая не имитирует гипердинамический сепсис у человека [67].
Модели на свиньях
Модели на свиньях являются очень популярными, поскольку свиньи имеют крупные размеры и на них легко проводить различные хирургические вмешательства. Непрерывная инфузия живых бактерий, эндотоксинов, а также CLP – это одни из самых популярных методов, используемых для индукции сепсиса на свиньях. Модель сепсиса на свиньях широко применяется для исследования терапевтических средств, направленных на улучшение функции почек, печени, кишечника и сердечно-сосудистой системы [68, 69]. При моделировании септического шока на свиньях, вызванного ЛПС, исследователи наблюдали, что повышение уровня оксида азота (NO) улучшает почечный кровоток и скорость клубочковой фильтрации [68]. Модель фекального перитонита на свиньях использовалась для исследования влияния низких доз аргинин-вазопрессина, добавленных к инфузии норэпинефрина [70]. Применение аргинин-вазопрессина улучшало функцию почек и уменьшало апоптоз клеток печени [70].
Модель фекального перитонита на свиньях также применялась для изучения острого повреждения легких, связанного с сепсисом. У свиней с сепсисом наблюдаются снижение функции левого желудочка, респираторная дисфункция, а также кровотечение, застой в легких, связанный с инфильтрацией нейтрофилов, характерной для острого повреждения легких [71]. Эта модель в дальнейшем использовалась для изучения эффектов N-ацетиламринона и L-аргинина [72].
Из-за близкого сходства анатомии свиньи и человека этих животных использовали для разработки методов лапароскопии при сепсисе [71]. Модели неонатального сепсиса на свиньях также близко имитируют клиническое течение неонатального сепсиса со значительным снижением артериального давления и IL-6 [73].
Модели на овцах
Модель сепсиса на овцах имеет несколько преимуществ перед другими моделями на животных особенно в отношении сердечно-легочных реакций. У овец при сепсисе возникает периферическое расширение сосудов с большим увеличением сердечного выброса, гипердинамическое состояние, подобное тому, которое обычно наблюдается у людей [74]. В течение первого часа животное находится в гиподинамическом состоянии с низким сердечным индексом [74]. Далее следует гипердинамическое состояние со значительным увеличением сердечного выброса [74].
Овцы также являются популярным видом для изучения сепсиса, связанного с повреждением легких. Была разработана модель «вдыхание дыма» на овцах для изучения сепсиса, развившегося в результате острого повреждения легких и ОРДС после вдыхания дыма [74].
С использованием модели «вдыхание дыма» исследовано несколько терапевтических агентов для лечения сепсиса [75]. Модель сепсиса и септического шока на овцах внесла важный вклад в изучение сердечно-сосудистой системы [76] и легочных заболеваний во время сепсиса, данные исследования также позволили изучить влияние и эффективность применения новых терапевтических средств [75, 77–79].
Модели на приматах
Из-за генетического и анатомического сходства с людьми приматы являются идеальной моделью для тестирования видоспецифичных методов лечения [80]. При моделировании сепсиса и септического шока на приматах вводят внутривенно бактериальную суспензию Escherichia coli [80]. Благодаря исследованиям сепсиса на приматах было сделано несколько терапевтических открытий, например, использование антикоагулянта дротрекогина альфа [81]. Совместное введение приматам дротрекогина альфа и Escherichia coli в летальных дозах снижает коагулопатические и гепатотоксические эффекты, вызванные Escherichia coli. [81]. Дротрекогин альфа был одобрен FDA для лечения сепсиса. Однако при последующих клинических испытаниях было обнаружено, что препарат повышает риск обширного кровотечения [82]. Несмотря на все преимущества модели сепсиса на приматах, велик риск передачи инфекционных заболеваний персоналу, высокие затраты на содержание, а также этические соображения удерживают многих исследователей от использования приматов в исследованиях [83].
Альтернативные модели сепсиса
В идеальном мире модель должна быть надежной, воспроизводимой и не причинять вреда животным. К сожалению, на основе этих критериев идеальной модели сепсиса в настоящее время не существует. Модели на клеточных культурах in vitro могут быть полезны для анализа конкретных аспектов биологических реакций и использоваться на начальных этапах понимания механизмов заболевания. Полная замена моделей сепсиса на животных системами клеточных культур в настоящее время затруднена из-за сложности иммунных и многотканевых реакций, связанных с сепсисом.
Полезной альтернативой является использование модели на насекомых. Личинки Galleria mellonella могут представлять собой замену моделям на млекопитающих, где необходимо установить конечные точки выживания, обеспечивая быстрый инструмент скрининга эффективности новых противомикробных агентов. Подобно млекопитающим, личинки Galleria mellonella обладают сложной врожденной иммунной системой. Клетки в гемолимфе способны фагоцитировать или инкапсулировать микробных захватчиков, а гуморальные реакции включают индуцибельную продукцию лизоцима и антимикробных пептидов [84].
Заключение
При выборе животных для исследования сепсиса следует тщательно продумать цели исследования. Стоит учитывать, что не существует единой идеальной модели сепсиса на животных. Природа фундаментальных исследований состоит в том, что обычно отдельные пути или механизмы исследуются довольно изолированно в экспериментальных моделях, тогда как пациент с сепсисом представляет собой сложную и взаимосвязанную систему, которая находится в состоянии дисбаланса. Таким образом, необходимо помнить об ограниченных возможностях конкретной модели на животных, используемых для исследования сепсиса. Тем не менее модели на животных представляют собой важный и незаменимый инструмент для лучшего понимания основных молекулярных и клеточных механизмов сепсиса, а также изучения новых терапевтических средств.
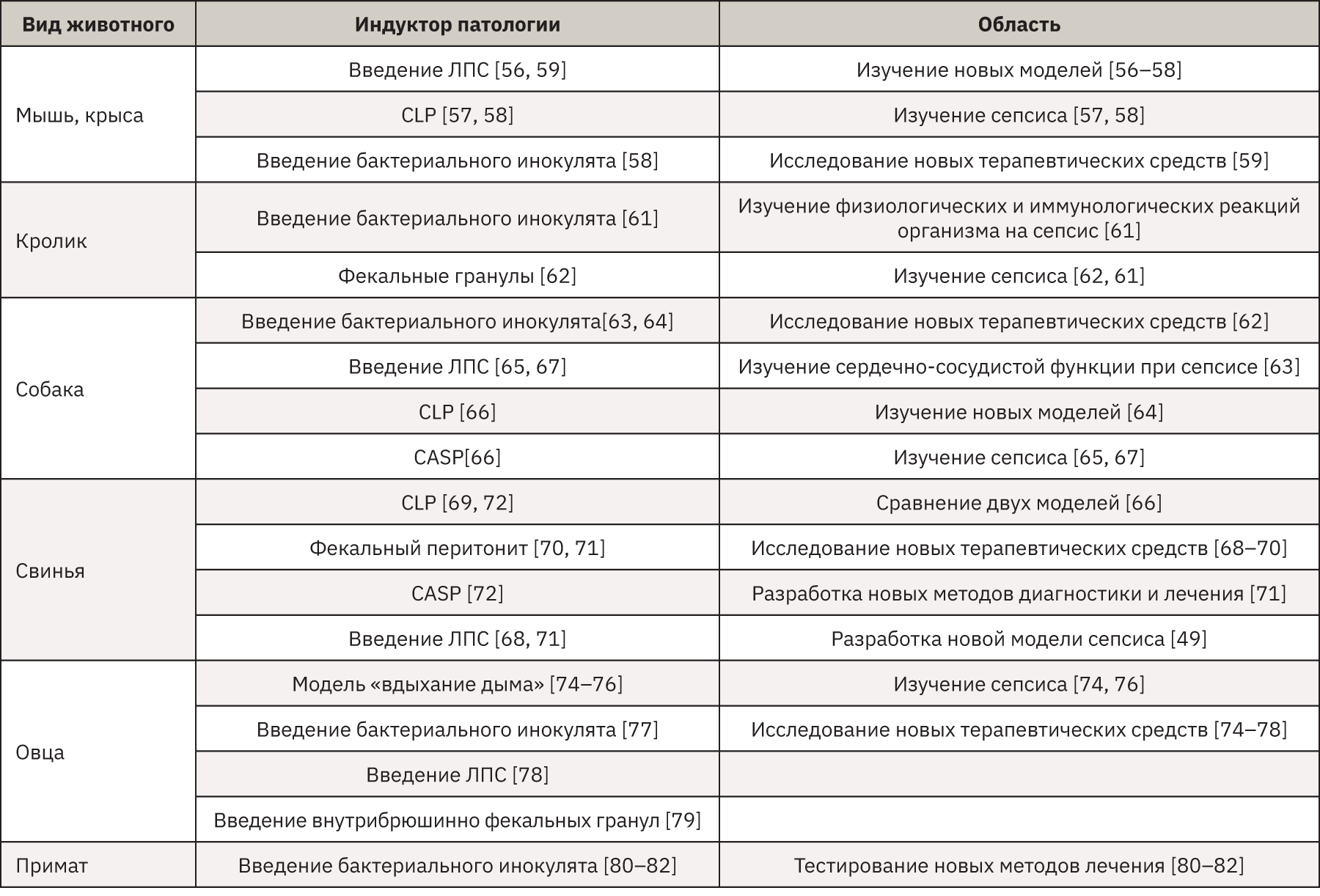
Вся информация, приведенная в данном обзоре, систематизирована в таблице, в которой отображены наиболее популярные животные, часто применяемые способы индукции и востребованные области для изучения сепсиса.
Вклад авторов
Л.Р. Никифорова – идея, сбор данных литературных источников, сбор и анализ данных, написание и редактирование текста статьи
К.Л. Крышень – концепция и дизайн исследования, редактирование текста статьи, научное консультирование и утверждение окончательного варианта статьи для публикации
К.Е. Боровкова – научное консультирование и оформление текста статьи
Ю.В.Салмова – научное консультирование и оформление текста статьи
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Wegrzyn G., Walborn A., Rondina M., Fareed J., Hoppensteadt D. Biomarkers of Platelet Activation and Their Prognostic Value in Patients With Sepsis-Associated Disseminated Intravascular Coagulopathy // Clinical and Applied Thrombosis/Hemostasis. – 2021. – Vol. 27. doi: 10.1177/1076029620943300.
- Navjot P., Yogesh S., Gigliotti J., Bajwa S. Mouse Models of Acute Kidney Injury // Animal Models in Medicine and Biology. – 2021. – Vol. 7. – P. 214-231.
- Chang J.C. Sepsis and septic shock: endothelial molecular pathogenesis associated with vascular microthrombotic disease // Thromb J. – 2019. – Vol. 17. – P. 198-14
- Chang J. C. TTP-like syndrome: novel concept and molecular pathogenesis of endotheliopathy-associated vascular microthrombotic disease // Thromb J. – 2018. – Vol. 16. – P. 1–9.
- Dempfle C.E. Coagulopathy of sepsis // Thromb Haemost. – 2004. – Vol. 91. – P. 213–24.
- Gauer R. Early recognition and management of sepsis in adults: the first six hours // Am Fam Physician. – 2013. – Vol. 88. – P.44–53.
- Cox M., Loman N., Bogaert D., O’Grady J. Co-infections: potentially lethal and unexplored in COVID-19 // Lancet. – 2020. – Vol. 11 (1). – P. 266-279.
- Riedemann N.C., Guo R.F., Ward P.A. The enigma of sepsis // J Clin Invest. – 2003. – Vol. 112. – P. 460–467.
- Cavaillon J.M., Adib-Conquy M., Fitting C., Adrie C., Payen D. Cytokine cascade in sepsis // Scand J Infect Dis. – 2003. – Vol. 35. – P. 535–544.
- Lin K.J., Lin J., Hanasawa K., Tani T., Kodama M. Interleukin-8 as a predictor of the severity of bacteremia and infectious disease // Shock. – 2000. – Vol. 14. – P. 95–100.
- Coelho A.L., Hogaboam C.M., Kunkel S.L. Chemokines provide the sustained inflammatory bridge between innate and acquired immunity // Cytokine Growth Factor Rev. – 2005. – Vol. 16. – P. 553–560.
- Horn K.D. Evolving strategies in the treatment of sepsis and systemic inflammatory response syndrome (SIRS) // Qjm. – 1998. – Vol. 9 (1). – P. 265–277.
- Riedemann N.C., Guo R.F., Ward P.A. Novel strategies for the treatment of sepsis // Nat Med. – 2003. – Vol. 9. – P. 517–524.
- Cohen J. Adjunctive therapy in sepsis: a critical analysis of the clinical trial programme // Br Med Bull. – 1999. – Vol. 55. – P. 212–225.
- Reinhart K., Karzai W. Anti-tumor necrosis factor therapy in sepsis: update on clinical trials and lessons learned // Crit Care Med. – 2001. – Vol. 29. – P. 121–125.
- Bernard G.R., Vincent J.L., Laterre P.F., LaRosa S.P., Dhainaut J.F., Lopez-Rodriguez A., Steingrub J.S., Garber G.E., Helterbrand J.D., Ely E.W. Efficacy and safety of recombinant human activated protein C for severe sepsis // N Engl J Med – 2001. – Vol. 34(4). – P. 699–709.
- Vincent J.L. Update on surgical sepsis syndrome // B. J. Surg. – 2014. – Vol. 104. – P.34-40. doi:10.1002/bjs.10451.
- Rudd K.E., Johnson S.C., Agesa K.M., Shackelford K.A., Tsoi D., Kievlan D.R. Global, regional, and national sepsis incidence and mortality, 1990–2017: analysis for the Global Burden of Disease Study // Lancet. – 2020. – Vol. 39(5). – P. 200–211. doi: 10.1016/ S0140-6736(19)32989-7.
- Deitch E.A. Rodent models of intra-abdominal infection // Shock. – 2005. – Vol. 24. – P. 19-23. doi:10.1097/01.shk.0000191386.18818.0a.
- Gauer R.L. Early recognition and management of sepsis in adults: the first six hours // Physician. – 2013. – Vol. 88 (1). – P. 44–53.
- Szakmany T., Hauser B. N-acetylcysteine for sepsis and systemic inflammatory response in adults // The Cochrane. – 2012. – Vol. 9 (9). – P. 616. doi:10.1002/14651858.
- Munford R.S., Suffredini A.F. Sepsis, Severe Sepsis and Septic Shocks. Principles and Practice of Infectious Diseases // Philadelphia: Elsevier Health Sciences. – 2014. – Vol. 8. – P. 914–34.
- Polat G., Ugan R.A. Sepsis and septic shock: Current treatment strategies and new approaches // The Eurasian Journal of Medicine. – 2017. – Vol. 49(1). – P. 53–8. doi:10.5152/2017.17062
- Bloch K.C. Infectious Diseases // Pathophysiology of Disease. – 2018. – Vol. 6. – P. 63-78.
- Ramachandran G. Gram-positive and gram-negative bacterial toxins in sepsis: A brief review // Virulence. – 2014. – Vol. 5(1). – P. 216-235.
- Romagnoli S., Peris A., De Gaudio A.R. SARS-CoV-2 and COVID-19: from the bench to the bedside // Physiol Rev. – 2020. – Vol. 100(4). – P. 1455–1466.
- Vincent J.L., Jones G., David S., Olariu E., Cadwell K.K. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis // Crit. Care. – 2019. – Vol. 23(1). – P. 196.
- Singer M., Deutschman C.S., Seymour C., Shankar-Hari M., Annane D., Bauer M. The third international consensus definitions for sepsis and septic shock (sepsis-3) // Jama. – 2016. – Vol. 315. – P. 801–10.
- Fei Z., Ting Y., Ronghui D., Guohui F., Ying L., Zhibo L., Xiang J., Wang Y., Song B., Gu X., Guan L., Wei Y., Li H., Wu X., Xu J., Tu S., Zhang Y., Chen H., Cao B. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study // The Lancet. – 2020. – Vol. 395. – P. 1054-1062.
- Wenrui J., Wang J., Sun B., Zhou J., Shi Y., Zhou Z. The Mechanisms and Animal Models of SARS-CoV-2 Infection.Frontiers in Cell and Developmental Biology // Nat Med. – 2021. – Vol. 9. – P. 1129. Doi:10.3389/fcell.2021.578825.
- Xu J., Zhang X., Pelayo R., Monestier M., Ammollo C.T., Semeraro F. Extracellular histones are major mediators of death in sepsis // Nat Med. – 2009. – Vol. 13(1). – P. 1321.
- Brandenburg K., Schromm A.B, Weindl G., Heinbockel F., Correa W., Mauss K., Martinez de Tejada G., Garidel P. An update on endotoxin neutralization strategies in Gram-negative bacterial infections // Expert Review of Anti-infective Therapy. – 2020. – P. 1-23.
- Patrícia R.S., Rodrigues, Picco N., Morgan P., Ghazal P. Sepsis target validation for repurposing and combining complement and immune checkpoint inhibition therapeutics // Expert Opinion on Drug Discovery. – Vol. 23(4). – P. 554-67.
-
Tchessalova D., Tronson N. Memory deficits in males and females long after subchronic immune challenge // Neurobiology of Learning and Memory. – 2019. – Vol. 10. – P. 320-335.
- Swathi M.R., Pawan K., Nichita Y., Karthik R., Sandhya, Sandeepta B. Haptoglobin Improves Acute Phase Response and Endotoxin Tolerance in Response to Bacterial ЛПС // Immunology Letters. – 2019. – Vol. 10. – P. 1016.
- Krivan S., Kapelouzou A., Vagios S. Increased expression of Toll-like receptors 2, 3, 4 and 7 mRNA in the kidney and intestine of a septic mouse model // Sci Rep. – 2019. – Vol. 9. – P. 4010. doi:41598-019-40537-2
- Zantl N., Uebe A., Neumann B., Wagner H., Siewert J. R., Holzmann B., Heidecke C.D., Pfeffer K. Essential role of interferon insurvival of colon ascendens stent peritonitis, a novel murine model ofabdominal sepsis // Infect. Immun. – 1998. – Vol. 66. – P. 2300 –2309.
- Neumann B., Zantl N., Veihelmann A., Emmanuilidis K., Pfeffer K., Heidecke C.D., Holzmann B. Mechanisms of acute inflammatorylung injury induced by abdominal sepsis // Int. Immunol. – 1999. – Vol. 11. – P. 217–227.
- Maier S., Emmanuilidis K., Entleutner M., Zantl N., Werner M., Pfeffer K., Heidecke C.D. Massive chemokine transcription inacute renal failure due to polymicrobial sepsis // Shock. – 2000. – Vol. 14. – P. 187–192.
- Barthlen W., Zantl N., Pfeffer K., Heidecke C.D., Holzmann B., Stadler J. Impact of experimental peritonitis on bone marrow cellfunction // Surgery. – 1999. – Vol. 12(6). – P. 41– 47.
- Maier S., Emmanuilidis K., Entleutner M., Zantl N., Werner M., Pfeffer K., Heidecke C. D. Massive chemokine transcription inacute renal failure due to polymicrobial sepsis // Shock. – 2000. – Vol. 14. – P. 187–192.
- Hubbard W.J., Choudhry M., Schwacha M.G., Kerby J.D., Rue III L.W., Bland K.I., Chaudry I.H. Cecal ligation and puncture // Shock – 2005. – Vol. 24(1). – P. 52–57.
-
Ayala A., Chaudry I. H. Immune dysfunction in murine polymi-crobial sepsis: mediators, macrophages, lymphocytes and apoptosis // Shock. – 1996. – P. 27–38.
-
Song M., Kellum J. A. Interleukin-6 // Crit. Care Med. – 2005. – Vol. 33. – P. 463-465.
- Browne M.K., Leslie G.B. Animal models of peritonitis // Surg. Gynecol. Obstet. – 1976. – Vol. 14(3). – P. 738 –740.
- Weinstein W.M., Onderdonk A.B., Bartlett J.G., Gorbach S.L. Experimental intra-abdominal abscesses in rats: development of an experimental model // Infection and Immunity. – 1974. – Vol. 10(6). – P. 1250–1255.
- Volk H.W., Schneider J., Dämmrich J., Döll W., Hörl M., Bruch H.P. Animal model for chronic-abscess-forming peritonitis: histology and microbiology // European Surgical Research. – 1990. – Vol. 22(6). – P. 347–355. doi: 10.1159/000129121.
- Hansson L., Alwmark A., Christensen P., Jeppsson B., Holst E., Bengmark S. Standardized intraabdominal abscess formation with generalized sepsis: pathophysiology in the rat // European Surgical Research. – 1985. – Vol. 17(3). – P. 155–159. doi: 10.1159/000128461.
- Hau T., Simmons R.L. Animal models of peritonitis // Surg Gynecol Obstet. – 1977. – Vol. 144(5). – P. 755-6.
- Onderdonk A.B., Bartlett J.G., Louie T., Sullivan-Seigler N., Gorbach S.L. Microbial synergy in experimental intra-abdominal abscess // Infect Immun. – 1976. – Vol. 13(1). – P.22-6.
- Groeneveld A.B., Bronsveld W., Thijs, L.G. Hemodynamic determinants of mortality in human septic shock // Surgery. – 1986. – Vol. 99. – P. 140–153.
- Parker M. M., Shelhamer J. H., Natanson C., Alling D.W., Parrillo J.E. Serial cardiovascular variables in survivors and nonsurvivors of human septic shock: heart rate as an early predictor of prognosis // Critical care medicine. – 1987. – Vol. 15. – P. 923–929.
- Angus D.C., van der Poll T. Severe sepsis and septic shock // The New England journal of medicine. – 2013. – Vol. 369. – P. 840–851.
- Wichterman K.A., Baue A.E., Chaudry I.H. Sepsis and septic shock--a review of laboratory models and a proposal // J Surg Res. – 1980. – Vol. 29. – P. 189–201.
- Buras J.A., Holzmann B., Sitkovsky M. Animal models of sepsis: setting the stage // Nat. Rev. Drug Discov. – 2005. – Vol. 4. – P. 854–865.
- Fink M.P. Animal models of sepsis // Virulence. – 2014. – Vol. 5. – P. 143–153.
- Zanotti-Cavazzoni S. L., Goldfarb, R. D. Animal models of sepsis // Critical care clinics. – 2009. – Vol. 25. – P. 703–719.
- Poli-de-Figueiredo L.F., Garrido A.G., Nakagawa N., Sannomiya P. Experimental models of sepsis and their clinical relevance // Shock. – 2008. – Vol. 30(1). – P. 53–59.
- Крышень К.Л., Кательникова А.Е., Росина Е., Акулова Е.Г., Макарова М.Н., Лютов А.Г., Макаров В.Г. Экспериментальная оценка эффективности препарата Габриглобин-IgM (обогащенный иммуноглобулинами класса M) на модели ЛПС-индуцированного септического шока у мышей // Биофармацевтический журнал. – 2016. – Т. 8(6). – С. 50-55. [Kryshen' K.L., Katel'nikova A.E., Rosina E., Akulova E.G., Makarova M.N., Lyutov A.G., Makarov V.G. Eksperimental'naya ocenka effektivnosti preparata Gabriglobin-IgM (obogashchennyj immunoglobulinami klassa M) na modeli ЛПС-inducirovannogo septicheskogo shoka u myshej // Biofarmacevticheskij zhurnal. – 2016. – Vol. 8(6). – P. 50-55(In Russ).].
- Michie H.R. The value of animal models in the development of new drugs for the treatment of the sepsis syndrome // Journal of Antimicrobial Chemotherapy. – 1998. – P. 1479.
- Guckian J.C., Morrey B.F., Kirby H.B. Role of Lysosomes and Cathepsin Inhibitor in Plasma during Pneumococcal Infection // The Journal of Infectious Diseases. – 1970. – Vol. 2. – P. 290.
- Matute-Bello G., Frevert C., Kajikawa O., Skerrett S., Goodman R., Park D. Septic shock and acute lung injury in rabbits with peritonitis // American Journal of Respiratory and Critical Care Medicine. – 2001 – Vol. 23(4). – P. 43.
- Guckian J.C. Coagulopathy in Experimental sepsis with Streptococcus pneumoniae in rabbits: effect of drug therapy and splenectomy // Journal of Infectious Diseases. – 1976. – P. 150.
- Natanson C., Fink M.P., Ballantyne H.K., MacVittie T.J., Conklin J.J., Parrillo J.E. Gram-negative bacteremia produces both severe systolic and diastolic cardiac dysfunction in a canine model that simulates human septic shock // J Clin Invest. – 1986. – P. 259.
- Nagy S., Tárnoky K. Canine model of hyperdynamic sepsis induced by intestinal ischemia // Acta Physiol Hung. – 1990. – Vol.75. – P. 303-20.
- Song R., Kim J., Yu D., Park C., Park J. Kinetics of IL-6 and TNF- changes in a canine model of sepsis induced by endotoxin // Veterinary Immunology and Immunopathology. – 2012. – Vol.14(6). – P.143-9.
- Maier S., Traeger T., Entleutner M., Westerholt A., Kleist B., Huser N. Cecal ligation and puncture versus colon ascendens stent peritonitis: two distinct animal models for polymicrobial sepsis//Shock. – 2004. – P. 505-11.
- Spapen H., Zhang H., Wisse E., Baekeland M., Seynaeve C., Eddouks M. The aminosteroid enhances hepatic blood flow preserves sinusoidal endothelial cell function structurein endotoxin-shocked dogs // Journal of Surgical Research. – 1999. – P.183-91.
- Cohen R., Hassell A., Marzouk K., Marini C., Liush S., Scharf S. Renal Effects of Nitric Oxide in Endotoxemia // American Journal of Respiratory and Critical Care Medicine. – 2001. – Vol.5. – P.1890.
- Azevedo L.C., Park M., Noritomi D.T., Maciel A.T., Brunialti M.K., Salomuo R. Characterization of an animal model of severe sepsis associated with respiratory dysfunction // Clinics. – 2007. – Vol.8 – P.491.
- JiM H., Yang J.J., Wu J., Li R.Q., Li G.M., Fan Y.X. Experimental sepsis in pigs- effects of vasopressin on renal, hepatic, and intestinal dysfunction // Ups J Med Sci. – 2012. – Vol.25(7). – P.63.
- Greif W.M., Forse R.A. Interventions to improve cardiopulmonary hemodynamics during laparoscopy in a porcine sepsis model // Journal of the American College of Surgeons. – 1999. – P.450.
- Kato T., Hussein M.H., Sugiura T., Suzuki S., Fukuda S., Tanaka T.Development and Characterization of A Novel Porcine Model of Neonatal Sepsis // Shock. – 2004. – Vol.32(9). – P.35.
- Ertmer C., Kampmeier T.G., Rehberg S., Morelli A. K., Âhler G., Lange M.Effects of balanced crystalloid vs. 0.9% saline-based vs. balanced 6% tetrastarch infusion on renal function and tubular integrity in ovine endotoxemic shock // Critical Care Medicine. – 2011. – Vol.78(3). – P.792.
- Shirani K.Z., Pruitt B., Mason A.D.The Influence of Inhalation Injury and Pneumonia on Burn Mortality.Annals of Surgery // Circ Shock. – 1987. – Vol.2(5). – P.121.
- Traber D.L., Herndon D.N., Stein M.D., Traber L.D., Flynn J.T., Niehaus G.D. The pulmonary lesion of smoke inhalation in an ovine model // Circ Shock. – 2012. – Vol.23(5). – P.311.
- Maybauer D.M., Maybauer M.O., Szab C., Cox R.A., Westphal M., Kiss L. The Peroxynitrite Catalyst WW-85 Improves Pulmonary Function in Ovine Septic Shock // Shock. – 2011. Vol. 28(4). – P.178-183.
- Calzavacca P., Ramchandra R., Booth L., Bellomo R., May C. N. Cardiovascular effects of beta-blockade in a sheep model of severe sepsis // Critical Care. – 2011. – P. 36. doi:10.1186/cc10405.
- Lange M., Ertmer C., Rehberg S., Morelli A., Köhler G., Kampmeier T.G., Van Aken H., Westphal M. Effects of two different dosing regimens of terlipressin on organ functions in ovine endotoxemia // Inflamm Res. – 2011. – Vol.60(5). – P.429-37. doi: 10.1007/s00011-010-0299-9.
- Su F., Huang H., He X., Simuen D., Xie J., Orbach A. Effects of a Novel Anticoagulant Compound in an Ovine Model of Septic Shock // Shock. – 2010. Vol. 28(4). – P.178-183.
- Redl H., Bahrami S. Large Animal Models: Baboons for Trauma, Shock, and Sepsis Studies // Shock. – 2005. Vol. 24(2). – P.88-93.
- Ranieri V. M. Drotrecogin alfa (activated) in adults with septic shock // The New England journal of medicine. – 2012. – Vol. 3. – P. 2055–2064.
- Taylor F., Chang A., Esmon C., D’Angelo A., Vigano-D’Angelo S., Blick K. Protein C prevents the coagulopathic and lethal effects of Escherichia coli infusion in the baboon // J Clin Invest. – 1987. – Vol.79. – P.918-25.
- Tsai C.J., Loh J.M., Proft T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing // Virulence. – 2016. – Vol. 7(3). – P.214-29. doi: 10.1080/21505594.2015.1135289.




