Вероятностное обучение у генетически модифицированных линий мышей
Ткаченко А.А., Раннева С.В., Лоскутова Л.В., Липина Т.В. Вероятностное обучение у генетически модифицированных линий мышей. Лабораторные животные для научных исследований. 2018; 1. https://doi.org/10.29296/2618723X-2018-01-06
Резюме
Понимание нейробиологических механизмов шизофрении представляет сложную задачу для исследователей, поскольку ее этиология до конца не выяснена, а ряд симптомов, включая бред и галлюцинации, невозможно моделировать на экспериментальных животных. Тем не менее недавно было предложено рассматривать бред как проблему, связанную с формированием странных убеждений [1], что в свою очередь можно выявить с помощью оценки вероятности событий, которое нарушено у больных шизофренией [2]. Относительно недавно феномен вероятностного обучения был успешно введен в область экспериментальных моделей шизофрении на грызунах [3, 4]. Следовательно, представлялось актуальным оценить данный эндофенотип на генетической модели шизофрении – DISC1-L100P мутантной линии мышей, а также у нокаутных мышей по гену кальсинтенин 2 (Clstn2-KO), генетической модели аутизма для выявления специфичности нарушений вероятностного обучения, связанного с тем или иным типом патологического поведения. Оказалось, что DISC1-L100P мутантные самцы не отличались от контрольных мышей дикого типа (WT) по всем исследуемым показателям в данном тесте при 100% вознаграждении. Однако при предъявлении вознаграждения в 80% случаев (тест 80/20) DISC1-L100P мыши быстрее приобретали кратковременный навык, достоверно быстрее переучивались при смене местоположения кормушки, делая меньше регрессивных ошибок в данном тесте 80/20, что в целом свидетельствует о повышенной оценке вероятности событий у DISC1-L100P мышей. В то время, как Clstn2-KO самцы мышей быстрее обучались в данном тесте при приобретении кратковременного навыка со 100% вознаграждением, однако они проявляли дефицит удержания приобретенного навыка на следующий день, что свидетельствует о дефиците долговременной пространственной памяти. Выявленное нарушение когнитивных способностей у Clstn2-KO мышей исключило дальнейшую оценку вероятностного обучения в тесте 80/20 у данной генетической линии. Таким образом, сравнительный анализ вероятностного обучения на генетически модифицированных линиях мышей – DISC1-L100P и Clstn2-KO, идентифицировал отклонения оценки вероятности событий у DISC1-L100P линии, а у Clstn2-KO мышей выявил дефицит базовых когнитивных процессов. Следовательно, вероятностное обучение может представлять собой новый когнитивный эндофенотип шизофрении, детерминируемый генотипом, что требует дальнейших исследований.
Введение
Шизофрения – хроническое заболевание мозга, ассоциированное с тяжелыми психическими симптомами, приводящими к инвалидности. Распространенность шизофрении остается стабильно высокой. Согласно данным Всемирной организации здравоохранения (ВОЗ) в настоящее время шизофренией страдают около 21 млн человек [5]. У данного заболевания есть генетическая основа, а патогенные факторы окружающей среды провоцируют начало ее проявления. Шизофрения характеризуется позитивными (аудиторные и визуальные галлюцинации, иллюзии), негативными (ангедония, отсутствие социального интереса, мотивационный дефицит) и когнитивными (дефицит рабочей памяти, внимания и когнитивной мобильности) симптомами.
Когнитивные симптомы – ключевые симптомы шизофрении [6], поскольку они наблюдаются при всех подтипах шизофрении [7]. Они включают дефицит рабочей памяти, исполнительных функций, процессы внимания, когнитивную ригидность и нарушение когнитивного контроля. В настоящее время не существует эффективного лечения когнитивных симптомов шизофрении. Так, усилители когнитивных функций (ноотропы) ослабляют когнитивные нарушения при других заболеваниях, например ингибиторы ацетилхолинэстеразы эффективны при болезни Альцгеймера, но малоэффективны при шизофрении [8, 9]. Такая ограниченная прогностическая эффективность когнитивных препаратов у людей, а также у грызунов в общепринятых тестах на когнитивные функции, представляет собой серьезную проблему для трансляционных исследований в области психиатрии, поскольку пока нет ни положительного контроля, ни прогностического теста на скрининг когнитивных препаратов [10]. Поэтому были созданы 2 специальные программы – MATRICS (Measurement And Treatment Research to Improve Cognition in Schizophrenia) и CNITRICS (Cognitive Neuroscience measures of Treatment Response) – с целью выявления особенностей когнитивных нарушений у больных шизофренией для улучшения диагностики и для создания новых тестов с использованием экспериментальных животных. В качестве отправной точки был создан список релевантных когнитивных отклонений у людей и их аналогов у грызунов [11]. Тем не менее в настоящее время по-прежнему назрела необходимость разработки таких новых тестов для грызунов, как прогностические, что будет способствовать дальнейшим трансляционным исследованиям в области диагностики и терапии шизофрении [12].
Галлюцинации и бред также являются двумя основными признаками положительных симптомов шизофрении, с помощью которых диагностируется это заболевание. Учитывая субъективную зависимость данных признаков, их очень сложно моделировать у животных, хотя недавно были предприняты некоторые попытки оценить нарушения восприятия реальности у крыс [13, 14]. Согласно теориям о нарушенном восприятии, аномальный сенсорный опыт – основная причина галлюцинаций, в то время как иллюзии – следствие галлюцинаций. Есть мнение, что основной проблемой является потеря различий между релевантными и нерелевантными стимулами [15]. Тем не менее эта теория ставится под сомнение наблюдением, что внезапное появление причудливых убеждений не всегда имеет прямую связь с аномальными сенсорными ощущениями, а проблема скорее связана с формированием странных убеждений [1].
Вера – субъективная вероятность того, что то или иное утверждение о мире истинно. Формирование верований можно объяснить с помощью оценки вероятности событий, что затруднительно у пациентов с шизофренией [2]. Вероятность события постоянно пополняется новыми доказательствами, и, следовательно, эксцентричное верование формируется в том случае, когда убеждения не обновляются соответствующим образом на основе новых доказательств [16]. Нарушенная интеграция новых доказательств в существующие убеждения была замечена у людей, испытывающих иллюзии и проявляющих бред [17]. Так, в одной экспериментальной задаче пациентам были представлены 2 ящика, в которых содержалось 80% синих и 20% красных шариков. Затем несколько шариков вытаскивали из одного ящика, и пациент должен был угадать, из какого ящика они были взяты. Пациенты, испытывающие бред, сразу переходили к заключению на основе весьма слабых рассуждений, при этом они проявляли большую уверенность в своем неправильном решении, чем здоровые люди [18, 19]. Примечательно, что при смене контекста шизофреники, напротив, переоценивали вероятность его изменений, что коррелировало с пониженной функциональностью коры головного мозга у них [20]. Нарушения вероятностного обучения и принятия решений имеют непосредственное отношение к клиническим проявлениям бреда. Шизофреники очень легко приходят к ложным убеждениям, а затем упорно сохраняют их. Следовательно, следующим этапом исследований в области психиатрии шизофрении будет глубокое понимание нейробиологических механизмов когнитивных нарушений, связанных с формированием убеждений при шизофрении. Возможность моделирования вероятностного обучения на экспериментальных моделях шизофрении в конечном итоге выявит новые молекулярно-клеточные мишени для диагностики и лечения/предотвращения бреда, наблюдаемого у больных шизофренией.
Недавно феномен вероятностного обучения был успешно транслирован в область биомоделей шизофрении на грызунах.
Так, содержание крыс или мышей в изоляции после отсадки от матерей является одной из моделей шизофрении [21].
Изоляция вызывает ряд поведенческих нарушений, соответствующих признакам шизофрении, включая дефицит
сенсорно-моторной фильтрации [22]. Крысы, хронически содержащиеся в изоляции, проявляют дефицит вероятностного
обучения при ежедневном тестировании [3]. Мыши с дефицитом экспрессии гена Sp4 (specificity protein 4; член SP1
семейства транскрипционных факторов, вовлеченных в нейроразвитие), также проявляли нарушение вероятностного
обучения [23]. Интересно, что ингибитор глицинового транспортёра 1-го типа, используемый как многообещающий препарат
для коррекции когнитивных нарушений при шизофрении, не оказывал эффекта на дефицит вероятностного обучения
у Sp4 гипоморфных мышей, хотя
корректировал нарушение внимания, предполагая различные механизмы
для
вероятностного обучения и процессов внимания.
Цель данного исследования – оценка вероятностного обучения как потенциально нового эндофенотипа шизофрении у генетически модифицированных мышей – DISC1-L100P; генетическая модель шизофрении [24]. Более того, следовало оценить вероятностное обучение также и у нокаутных мышей по гену кальсинтенин-2 – Clstn2-KO, представляющих собой генетическую модель аутизма [25], ведь один из симптомов аутизма – когнитивная ригидность. Следовательно, сравнительный анализ вероятностного обучения на генетических моделях 2 различных психопатологий может способствовать определению специфичности данного эдофенотипа.
Материал и методы
Животные. Гомозиготные нокаутные самцы мышей Clstn2-КО, мутантные самцы мышей DISC1-L100P и самцы дикого типа (C57Bl/6NCrl, wild type – WT) в возрасте 4–5 мес. Генотипирование линии DISC1-L100P проводили, как описано ранее [24] с использованием праймеров: F, 5’-CCACTGCCAAGCCTCACT-3' и R: 5'- GGCCACAGCAGGGACAA-3'. Clstn2-KO мыши были получены путем вставки неомициновой кассеты в 3 экзон гена Clstn2 с использованием 129/Ola эмбриональных стволовых клеток. Такая вставка привела к изменению рамки считывания данного гена и потери кадхеринового домена. Производилось обратное скрещивание между мышами с Clstn2 нокаутным аллелем и мышами линии C57Bl/6NCrl в 9-ти поколениях для генетической идентичности Clstn2 нокаутных мышей с диким типом. Экспериментальные животные были генотипированы с использованием следующих ПЦР праймеров: F: 5′ AAGTTTTGGGCTTGTAGATCCAGCTCTGTC и R: 5′ AAATTGCATCGCATTGTCTG AGTAGGTGTC и дикого типа R: 5′ GATGTCTTATTGAGCACCACAGCCTCAAAG. WT и Clstn2-KO ампликоны составили ∼162 и ∼364 пар оснований соответственно.
Мышей содержали в виварии НИИ физиологии и фундаментальной медицины в пластиковых клетках (OptiMice
Biotech A.S.; 34×29×15 см) в группах по
5 животных с инвертированным световым режимом
12:12 (свет – с 18:00 ч,
темнота – с 6:00 ч) при температуре около
23оС. Комбикорм (Ssniff, Германия) и воду животные получали в неограниченном количестве. Все
эксперименты проводили в соответствии с требованиями Директивы 2010/63/EU Европейского Союза от 22
сентября 2010 г. по охране животных, используемых в научных целях. Все экспериментальные протоколы были
одобрены локальным этическим комитетом НИИ Физиологии и фундаментальной медицины.
Вероятностное обучение
Тестирование проводили между 9:00 и 16:00 часами. Перед экспериментами мышей акклиматизировали в экспериментальной комнате в течение 30 мин. Оборудование для поведенческих тестов очищалось между тестированиями 70% этанолом для удаления запахов.
Экспериментальная установка. Тест «вероятностное обучение» был адаптирован, согласно данным литературы [26]. Обучение и тестирование на вероятностное обучение и память проводили в белом акриловом прямоугольном лабиринте (76 см в длину × 50 см в ширину × 30 см в высоту). Лабиринт был разделен пластиковой перегородкой (ширина 50 см × высота 49 см) на «отсек выбора» и «отсек ожидания» (рис. 1). В начале каждого испытания мышь помещали в «отсек ожидания», где в нижней части центра перегородки располагалась небольшая пластиковая дверь (ширина 10 см × высота 5 см). Данная дверь фиксировалась с помощью липкой ленты, расположенной на стороне зоны ожидания, что позволяло легко открыть и закрыть стартовую дверь. В «отсеке выбора» акриловая перегородка (высота 30 см × ширина 16 см) начинавшаяся от задней стенки, разделяла область выбора на 2 одинаковые части. Каждая часть «отсека выбора» имела четкие визуальные сигналы на задней и боковых стенках. На боковых стенках использовали двумерные черно-белые фигуры размером 8×12 см. Различные трехмерные объекты (игрушечный мячик (диаметр – 6 см) и картонная коробка (стороны – по 7,5 см) фиксировали на задней стенке каждого пространственного положения примерно в 15 см над полом. В каждом месте выбора кормушка была размещена на расстоянии 3 см от задней стенки. Каждая часть отсека выбора снабжена кормушкой с приманкой или без нее, с пространственными ориентирами на боковых и задней стенках отсека (см. рис. 1 из статьи Amodeo et al., 2012).
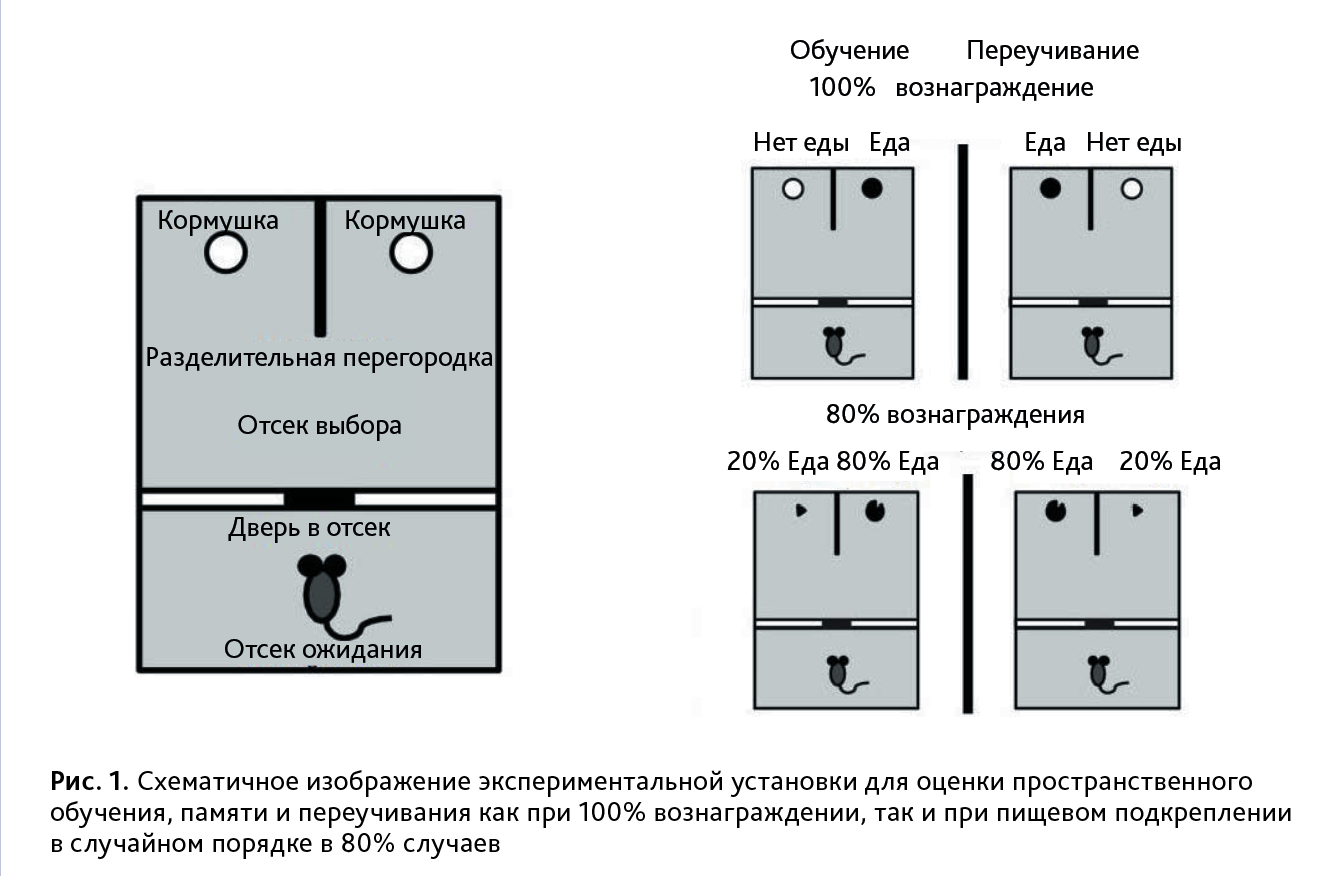
Экспериментальные процедуры. За неделю до начала эксперимента животных ежедневно лишали доступа к корму с 17:00 до 9:00 ч. Весь эксперимент состоял из 3 этапов: 1-й этап – приучение к экспериментальной установке. В течение 2–4 дней мышей приучали к потреблению приманки (3–5 зерен воздушной пшеницы с запахом карамели, компания «На здоровье») в левой и правой части «отсека выбора», затем возвращали в стартовый отсек; 2-й этап – «приобретение навыка» – проводился в течение 1 дня. На данном этапе мышь обучали находить корм только в одном из отсеков установки с определенными пространственными ориентирами. Критерий успешного обучения считался достигнутым, если мышь правильно выбирала отсек с едой в течение 6 последовательных попыток; 3-й этап – «переучивание». Спустя 24 ч после 2-го этапа мышь тестировали на запоминание приобретенного навыка нахождения отсека с кормом. В случае успешного обучения мышь выбирала отсек с кормом в 5 попытках из 6 в течение 1 дня. Затем начинался этап «переучивание», когда корм предлагался в противоположном отсеке. Соблюдался тот же критерий успешного переобучения, как и на 2-м этапе. Регистрировали количество ошибок, сделанных при тестировании на сохранение приобретенного пространственного распознавания местоположения приманки, количество персеверативных и регрессивных ошибок. Анализировали ошибки при переучивании, чтобы определить насколько животные научились игнорировать ранее выбранный шаблон (персеверативные ошибки) и способны поддерживать новый шаблон после первоначального выбора (регрессивные ошибки). Персеверативные ошибки подсчитывались, когда мышь продолжала выбирать ранее правильное пространственное местоположение в процессе переучивания. Если мышь выбрала ранее правильное пространственное местоположение на первом испытании переучивания, это не учитывалось как персеверативная ошибка. Однако, если после верного выбора, мышь снова выбирала «неправильный» отсек, то такая ошибка засчитывалась как регрессивная. Например, мышь, возможно, изначально научилась выбирать пространственное местоположение A, а затем во время переучивания должна была учиться выбирать пространственное местоположение B. Представим пример пространственного местоположения, выбранного в последовательных испытаниях во время переучивания: A, A, A, B, A, B, A, A, B, B, B, B, B, B. В этом случае 2 персеверативные ошибки выделены жирным шрифтом, а три регрессивные ошибки – курсивом. Эксперименты проводили при 100 и 80% вознаграждении.
Приобретение навыка и переучивание (100% вознаграждение). В начале тестирования
мышь была помещена в «отсек ожидания», затем стартовую дверь открывали, и мышь могла выбрать 1
из 2 отсеков. Для каждого испытания приманка находилась только в 1 из 2 кормушек. Если мышь выбирала
правильный отсек, она могла съесть приманку, после чего дверь поднимали, возвращали мышь в «отсек
ожидания» (экспериментатор медленно направлял мышь в сторону «отсека ожидания»). Если мышь
выбирала неправильное пространственное расположение приманки, ей позволяли перемещаться по выбранному отсеку,
но после исследования пустой кормушки возвращали в «отсек ожидания». При неправильном
выборе приманку из кормушки удаляли, чтобы мышь не могла быстро перейти в правильный отсек
и получить подкрепление. Критерий приобретения навыка был достигнут, когда мышь делала
6
последовательных правильных выборов. Обучение «обратному выбору» (переучивание) осуществлялось на
следующий день после тестирования на приобретение навыка. Перед переучиванием каждую мышь тестировали на
удерживание навыка (память) для определения пространственной памяти.
Критерий считали достигнутым,
если мышь выбирала правильное пространственное расположение в 5 из 6 испытаний, аналогично критерию
обучения на этапе приобретения.
Все аспекты теста реверсивного обучения («переучивания») были аналогичны тем, таковым на этапе приобретения навыка. Критерием для успешного переучивания было 6 последовательных правильных выборов.
Приобретение навыка и переучивание (80% вознаграждение). В данном тесте использовалась аналогичная процедура тестирования, как и со 100% вознаграждением, за исключением того, что при обучении 1 отсек был определен как «правильный», где находилась приманка в 80% испытаний, в то время как в «неправильном» отсеке приманка находилась в 20% испытаний. Данная вероятностная процедура обучения («тест 80/20») использовалась на этапах обучения и переучивания. Первые два испытания каждой фазы теста всегда содержали подкрепление в «правильном» отсеке. Критерий обучения считался достигнутым, когда мышь выбирала «правильное» место в 6 последовательных испытаниях. На следующий день мышь тестировали на пространственную память, как описано выше. Критерий запоминания включал выбор «правильного» местоположения в 5 из 6 последовательных испытаний. Впоследствии каждая мышь проходила тест на переучивание. При обратном обучении («переучивание») ранее «неправильное» местоположение становилось «правильным» местом. Первые два испытания всегда содержали подкрепление в «правильном» отсеке. Критерий считался успешным, когда мышь выбирала новое «правильное» место для 6 последовательных испытаниях.
Статистический анализ. Статистическую обработку проводили с помощью пакета программ Statistica 10 для Windows 8. Поведенческие данные были проанализированы с помощью однофакторного анализа ANOVA после предварительной оценки экспериментальных выборок на нормальность распределения (Shapiro-Wilk’s W критерий).
Экспериментальный дизайн. Эксперимент 1. Исследование DISC1-L100P и WT самцов
мышей в тесте на Приобретение навыка и повторное обучение при 100% вознаграждении. Эксперимент 2.
Исследование DISC1-L100P и WT самцов мышей в тесте на Приобретение навыка и повторное обучение при
80% вознаграждении. Эксперимент 3. Исследование Сlstn2-KO и WT самцов мышей в
тесте на
приобретение навыка и повторное обучение при 100% вознагражде-
нии.
Результаты
Эксперимент 1
Обучение. Не обнаружено значимого влияние генотипа [F (1, 10) = 0,6; p>0,05] на количество попыток для достижения критерия приобретения навыка (рис. 2, а). В тесте на удержание навыка также не обнаружено значимых отличий между генотипами [F (1, 10) = 4,5; p>0,05]. DISC1-L100P: 5,8±0,2 и WT: 5,2±0,2 число попыток.
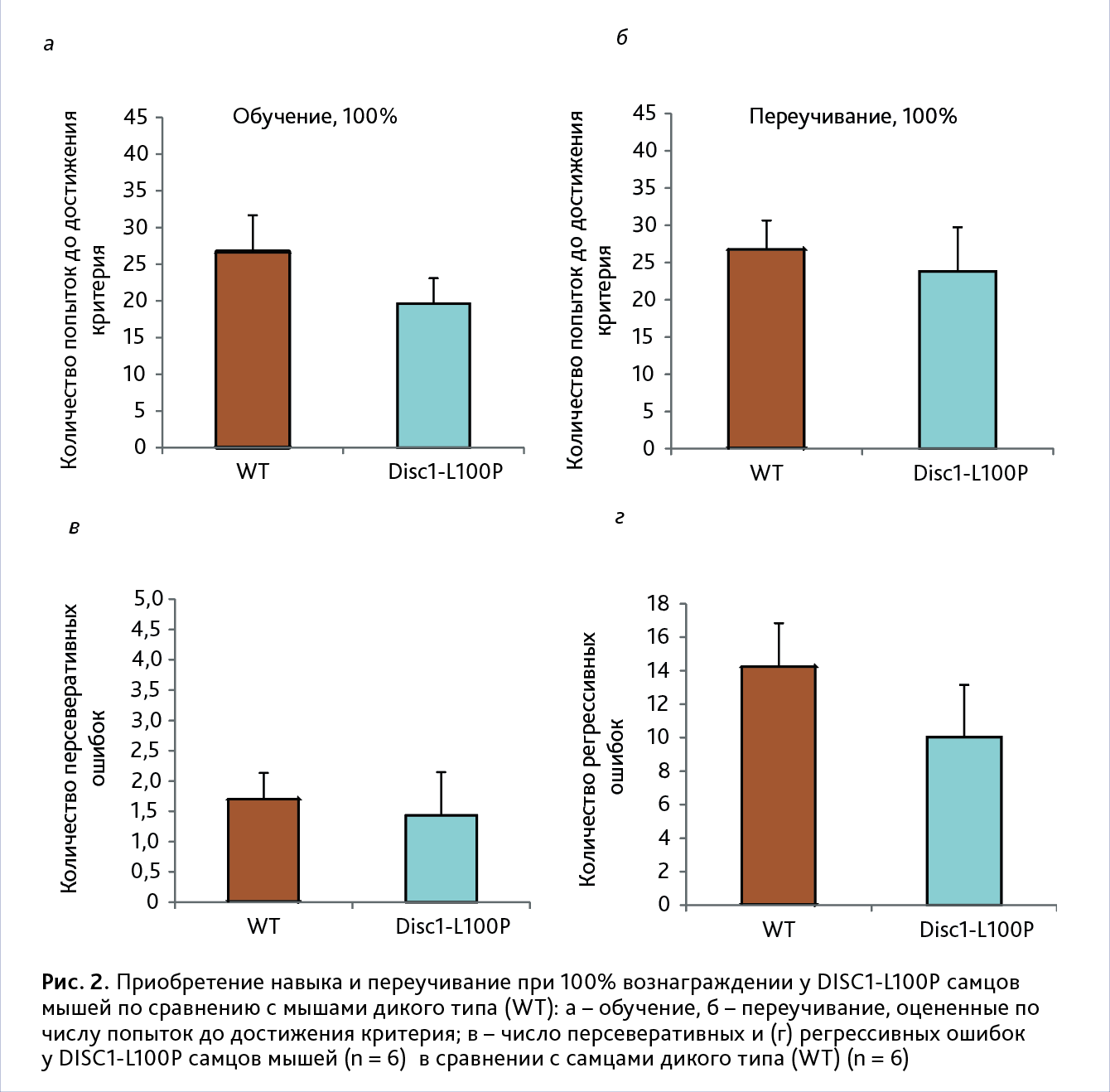
Переучивание. Выявлено значимое влияние генотипа [F(1, 10)=0,0; p<0,05] на обучение мышей на 3-м этапе
эксперимента, оцененного по количеству попыток для достижения критерия успешного переобучения (рис. 2, б).
Также обнаружено значимое влияние генотипа на количество персеверативных [F(1, 10)=1,2; p>0,05]
(рис. 2,
в) и регрессивных [F(1, 10)=0,4; p>0,05] ошибок (рис. 2, г).
Эксперимент 2
Обучение. Однофакторный анализ выявил близкое к значимому влиянию генотипа [F (1,13) = 4,5; p≤0,05] на количество попыток достичь критерия «приобретение навыка» (рис. 3, а). В тесте на память (удержание навыка) не обнаружено достоверных отличий между генотипами [F(1,13) = 0,4; p>0,05]. DISC1-L100P: 5,7±0,2 и WT: 5,5±0,2 число испытаний.
Переучивание. Также обнаружено влияние генотипа [F (1,13)=6,8; p<0,05] на обучение мышей на 3-м этапе эксперимента, оцененного по количеству попыток для достижения критерия успешного переобучения. DISC1-L100P мыши быстрее переучивались, чем WT мыши (рис. 3, б). Выявлено влияние генотипа на количество регрессивных ошибок [F(1,13)=4,2; p>0,05]. Количество регрессивных ошибок, совершенных DISC1-L100P самцами, было меньше (рис. 3, г), чем у WT мышей, но не обнаружено влияния генотипа на количество персеверативных ошибок [F(1,13)=0,7; p>0,05] (рис. 3, в).

Эксперимент 3
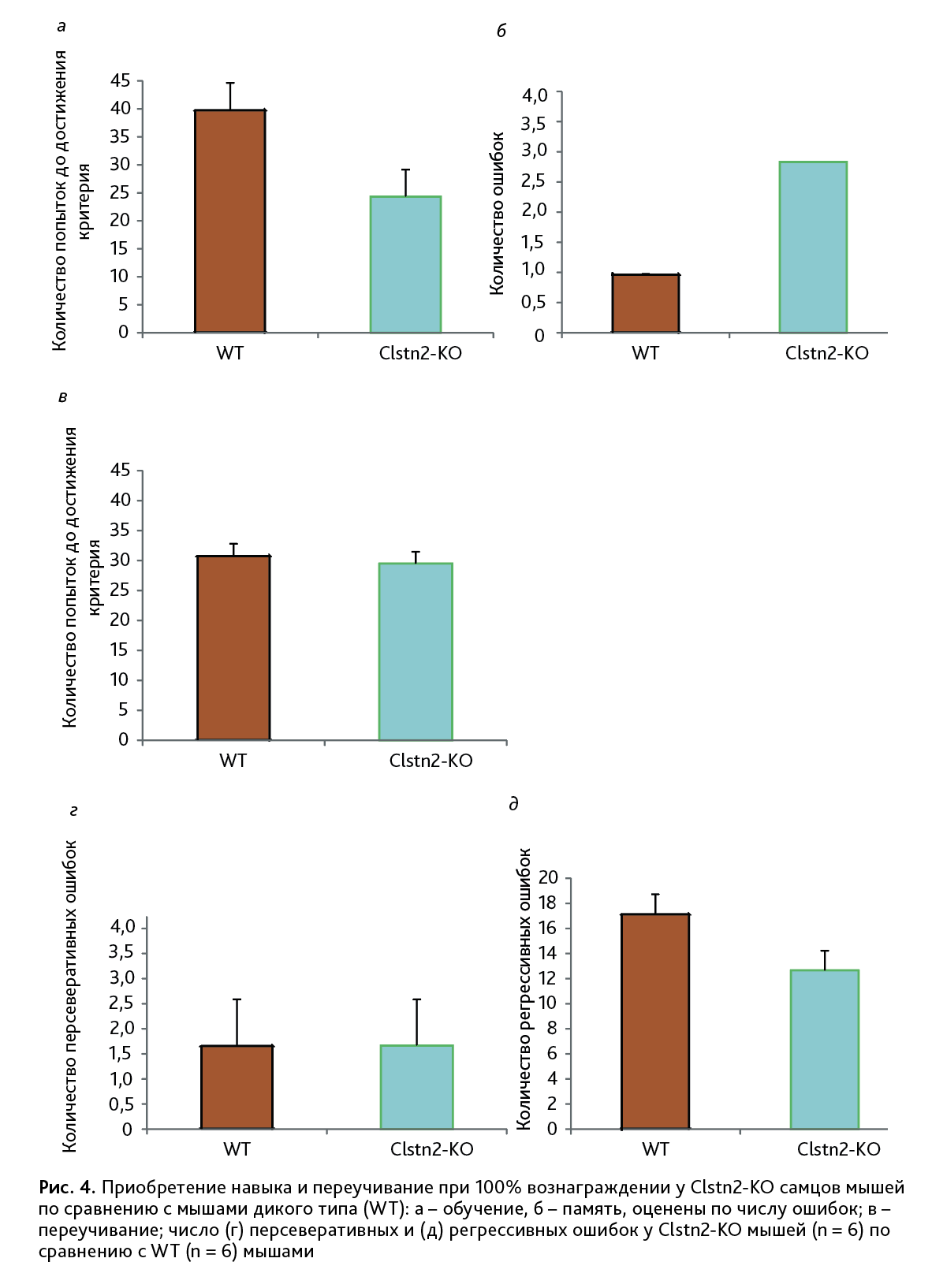
Обучение. Генотип значимо влиял на количество попыток достичь критерия «приобретения навыка» [F(1,10)=5,15; p<0,05]. Clstn2-KO мыши быстрее обучались, чем WT мыши (рис. 4, а).
Эффект генотипа также наблюдался на сохранение приобретенного пространственного распознавания у экспериментальных мышей (пространственная память) [F(1,10)=9,31; p<0,05]. Clstn2-KO мыши чаще ошибались при пространственном распознавании по сравнению с WT мышами (рис. 4, б).
Не обнаружено влияние генотипа [F(1,10)= 0,03; p=0,88] на переобучение мышей на 3-м этапе эксперимента (переучивание), оцененного по количеству попыток для достижения критерия успешного переобучения (рис. 4, в). Также не выявлено влияния генотипа на количество персеверативных и регрессивных ошибок [F(1,10)=0; p=1 и F(1,10)=1,64; p=0,23 соответственно] (рис. 4, г–д).
Обсуждение
В данном исследовании впервые применена методика «вероятностное обучение» у самцов DISC1-L100P и Clstn2-KO генетических линий мышей при 100 и 80% вознаграждении. Пространственное обучение, память и переучивание при 100% вознаграждении значимо не отличались у DISC1-L100P мутантных мышей, что исключает у них нарушения базовых процессов обучения и пространственной памяти, подтверждая раннее полученные данные [24]. Однако при 80% вознаграждении DISC1-L100P мыши продемонстрировали переоценку вероятности событий как на 1-й стадии процедуры, так и на стадии переучивания. В отличие от DISC1-L100P мышей, анализ поведения Clstn2-KO самцов в тесте на приобретение навыка уже при 100% вознаграждении выявил дефицит пространственной долговременной памяти, подтверждая ранее полученные данные в тесте Барнс [27]. Нарушение базовых когнитивных процессов у Clstn2-KO мышей на данном этапе эксперимента исключило возможность дальнейшей оценки вероятностного обучения с 80% вознаграждением. Следовательно, вероятностное обучение при 80% вознаграждении, возможно, представляет собой новый когнитивный эндофенотип шизофрении, требующий дальнейших исследований.
Анализ пространственного обучения со 100% вознаграждением на этапе приобретения навыка и переучивания у мышей дикого типа (мыши линии C57BL/6NCrl) в 2 независимых экспериментах (эксперименты 1 и 3) выявил результаты, сопоставимые с данными, полученными на самцах инбредной линии C57BL/6J [23]. Однако приобретение навыка и переучивание при 80% вознаграждении требовало меньшего числа попыток для достижения критерия у WT мышей в эксперименте 3, по сравнению с C57BL/6J мышами [23], что, возможно, отражает влияние изолированного содержания C57BL/6J экспериментальных животных, что является стрессом для социальных животных и приводит к ряду когнитивных нарушений [28].
С момента открытия гена DISC1 (Disrupted-In-Schizophrenia-1) многочисленными исследованиями были установлены
генетические ассоциации между DISC1 локусом и психиатрическими заболеваниями в различных популяциях [29,
30]. Как уже доказано, биологические пути с участием DISC1 и его интерактома (протеины, взаимодействующие
с DISC1) могут играть центральную роль в патологии
шизофрении и расстройств настроения [31,
32].
На основании этих данных было создано несколько DISC1 генетических линий мышей, экспрессирующих укороченную форму DISC1 в коре головного мозга [33–35], во всем мозге [36], а также в пре- и постнатальные периоды развития [37, 38]. Кроме того, были созданы 2 мутантные линии DISC1, вызванные химическим мутагеном N-ethyl-N-nitrosourea (ENU), каждая из которых несет точечную мутацию во 2 экзоне гена DISC1 – DISC1-Q31L и DISC1-L100P [24]. Ряд исследователей выявили соответствие DISC1-L100P линии мышей генетической модели шизофрении [24, 39-42], а DISC1-Q31L – модели депрессии [24, 43], согласно общепринятым критериям модели психического расстройства [44]. У мышей DISC1-L100P линии наблюдался дефицит тормозных вставочных ГАМК интернейронов в коре головного мозга и гиппокампе [45], что сопровождается дефицитом престимульного торможения, рабочей памяти, нарушением латентного торможения (общепринятые эндофенотипы шизофрении) [46].
В нашем исследовании рассмотрено пространственное обучения у мышей DISC1-L100P с использованием разных
факторов подкрепления. В тесте на пространственную дискриминацию со 100% вознаграждением мутантные мыши
выполняли поставленную задачу аналогично мышам дикого типа на всех этапах процедуры, включая приобретение навыка,
его удержания (память) и переучивания. Действительно, кратковременное пространственное обучение
в водном лабиринте Морриса, а также долговременная память не отличались значимо у данной линии мышей
подтверждая ранее полученные данные [24]. Однако при использовании вероятностной процедуры подкрепления
в тесте 80/20 мутантные мыши быстрее приобретали навык, а также быстрее переучивались
распознавать пространственное местоположение подкрепления, поскольку им потребовалось существенно меньшее количество
попыток для достижения критерия. При этом они почти в 2 раза реже делали регрессивные ошибки, чем мыши дикого
типа (см. рис. 3, а, б, г). Таким образом, когда условия теста сопровождались непредсказуемым
и случайным подкреплением для осуществления «правильного» выбора, DISC1-L100P мыши оценивали
вероятность подкрепления достоверно точнее и реагировали на выбор шаблонов быстрее, чем WT мыши. Интересно, что
при исследовании оценки вероятности событий у шизофреников при случайной смене контекста оказалось, что на фоне
гипофункциональности префронтальной коры головного мозга они переоценивают вероятность смены контекста по сравнению
со здоровыми волонтерами [20]. Возможно, дефицит префронтальной коры, ассоци-
ированный с шизофренией,
вовлечен в повышенную оценку вероятности изменения контекста, что в результате приводит к более
хаотичному мировоззрению, которое может впоследствии становиться более знакомым, получать чрезмерное подкрепление,
а затем может возникать бред [20].
В отличие от DISC1-L100P линии, нокаутные мыши по гену кальсинтенин 2, кодирующий синаптический белок, вовлеченный в адгезию, проявили дефицит долговременной пространственной памяти при 100% вознаграждении, несмотря на их успешное кратковременное обучение в данном тесте (см. рис. 4, а, б). Консолидация пространственной памяти затрагивает успешную работу нейронов нескольких отделов мозга, включая гиппокамп и медиальную кору головного мозга [47, 48]. У Clstn2-KO мышей был обнаружен функциональный дефицит ГАМКергических тормозных нейронов на срезах гиппокампа вместе с дефицитом пространственной долговременной памяти в тесте Барнса [27], подтверждая полученные данные. Следовательно, нарушение базовых процессов обучения и памяти у Clstn2-KO мышей при 100% вознаграждении исключило возможность анализа вероятностного обучения при 80% вознаграждении у данной линии мышей. Примечательно, что у мышей обеих генетических линий выявлен дефицит тормозных вставочных нейронов в коре головного мозга [27, 45], роль которых велика в нейробиологических механизмах вероятностного обучения [49]. Более того, ригидность процессов центральной нервной системы наблюдается как у больных аутизмом [50], так и при негативных симптомах шизофрении [51]. Возможно, идентификация специфичных популяций тормозных нейронов в коре головного мозга с внутриклеточными биохимическими особенностями поможет в дальнейшем выявить молекулярно-клеточные механизмы процессов вероятностного обучения, нарушение которых характерно для шизофрении.
Таким образом, вероятностное обучение представляет собой новый когнитивный эндофенотип шизофрении, детерминируемый генотипом, и требует дальнейших нейробиологических исследований, что в будущем позволит выявить молекулярно-клеточные мишени для ранней диагностики и лечения/предотвращения бреда у больных шизофренией.
✼ ✼ ✼
В данном исследовании были использованы генетические линии мышей из состава УНУ «Биологическая коллекция – генетические биомодели нейропсихических заболеваний» (№ 493387) НИИ физиологии и фундаментальной медицины. Данная работа частично поддержана грантом РФФИ (№16-04-00534).
Список источников
- Cahill C., Silbersweig D., Frith C.D. Psychotic experiences induced in deluded patients using distorted auditory feedback. Cogn. Neuropsychiatry. 1996. Vol. 1: 201–11.
- Fienberg S.E. When did Bayesian inference become «Bayesian»? Bayesian Anal. 2006. Vol. 1: 1–40.
- Amitai N., Young J.W., Higa K., et al. Isolation rearing effects on probabilistic learning and cognitive flexibility in rats. Cogn Affect Behav Neurosci. 2013. Vol. 14: 388–406.
- Geyer M.A. Developing treatments for cognitive deficits in schizophrenia: the challenge of translation. J. Psychopharmacol. 2015. Vol. 29: 178–96.
- World health statistics 2017: monitoring health for the SDGs, Sustainable Development Goals. Geneva: World Health Organization; 2017. Licence: CC BY-NC-SA 3.0 IGO.
- Elveveg B., Goldberg T.E. Cognitive impairment in schizophrenia is the core of the disorder. Crit. Rev. Neurobiol. 2000. Vol. 14: 1–21.
- Heinrichs R.W., Awad A.G. Neurocognitive subtypes of chronic schizophrenia. Schizophr. Res. 1993. Vol. 9: 49–58.
- Chouinard S., Stip E., Poulin J., et al. Rivastigmine treatment as an add-on to antipsychotics in patients with schizophrenia and cognitive deficits. Curr Med Res Opin. 2007. Vol. 23: 575–83.
- Fagerlund B., Soholm B., Fink-Jensen A., Lublin H., Glenthoj B.Y. Effects of donepezil adjunctive treatment to ziprasidone on cognitive deficits in schizophrenia: a double-blind, placebo-controlled study. Clin Neuropharmacol. 2007. Vol. 30 (1): 3–12.
- Sarter M. Animal cognition: defining the issues. Neurosci Biobehav Rev. 2004. Vol. 28 (7): 645–50.
- Young J.W., Geyer M.A. Developing treatments for cognitive deficits in schizophrenia: the challenge of translation. J. Psychopharmacol. 2015. Vol. 29. 178–96.
- Geyer M.A., Gross G. Novel Antischizophrenia Treatments, Springer-Verlag, Berlin, Heidelberg. 2012. Vol. 213.
- Mc Dannald M., Schoenbaum G. Toward a model of impaired reality testing in rats. Schizophr Bull. 2009. Vol. 35: 664–7.
- Mc Dannald M.A., Whitt J.P., Calhoon G.G., Piantadosi P.T., Karlsson R.M., O'Donnell P., Schoenbaum G. Impaired reality testing in an animal model of schizophrenia. Biol Psychiatry. 2011. Vol. 70: 1122–6.
- Kapur, S. Psychosis as a state of aberrant salience: a framework linking biology, phenomenology, and pharmacology in schizophrenia. Am. J. Psychiatry. 2003. Vol. 160: 13–23.
- Hemsley D.R., Garety P.A. The formation and maintenance of delusions: a Bayesian analysis. Br. J. Psychiatry. 1986. Vol. 149: 51–6.
- Freeman D., Garety P.A., Kuipers E., Fowler D., Bebbington, P.E. A cognitive model of persecutory delusions. Br. J. Clin. Psychol. 2002. Vol. 41: 331–47.
- Bentall R.P., Kaney S., Dewey M.E. Paranoia and social reasoning: an attribution theory analysis. Br. J. Clin. Psychol. 1991. Vol. 30: 13–23.
- Warman DM. Reasoning and delusion proneness – confidence in decisions. J. Nerv. Ment. Dis. 196, 9–15, 2008.
- Kaplan C.M., Saha D., Molina J.L., Hockeimer W.D., Postell E.M., Apud J.A., Weinberger D.R., Tan H.Y. Estimating changing contexts in schizophrenia. Brain. 2016. Vol. 139: 2082–95.
- Powell S.B., Khan A., Young J.W., Scott C.N., Buell M.R., Caldwell S., Tsan E., de Jong L.A., Acheson D.T., Lucero J., Geyer M.A., Behrens M.M. Early Adolescent Emergence of Reversal Learning Impairments in Isolation-Reared Rats. Dev. Neurosci. 2015. Vol. 37 (3): 253–62.
- Geyer M.A, Wilkinson L.S, Humby T., Robbins T.W. Isolation rearing of rats produces a deficit in prepulse inhibition of acoustic startle similar to that in schizophrenia. Biol Psychiatry. 1993. – Vol. 34 (6): 61–72.
- Young J.W., Kamenski M.E., Higa K.K., Light G.A., Geyer M.A., Zhou X. GlyT-1 Inhibition Attenuates Attentional But Not Learning or Motivational Deficits of the Sp4 Hypomorphic Mouse Model Relevant to Psychiatric Disorders. Neuropsychopharmacology. 2015.
- Clapcote S.J., Lipina T.V., Millar J.K., Mackie S., Christie S., Ogawa F., Lerch J.P., Trimble K., Uchiyama M., Sakuraba Y., Kaneda H., Shiroishi T., Houslay M.D., Henkelman R.M., Sled J.G., Gondo Y., Porteous D.J., Roder J.C. Behavioral phenotypes of Disc1 missense mutations in mice. Neuron. 2007. Vol. 54 (3): 387–402.
- Ranneva S.V, Pavlov K.S., Gromova A.V., Amstislavskaya T.G., Lipina T.V. Features of emotional and social behavioral phenotypes of calsyntenin2 knockout mice. Behav Brain Res. 2017. Vol. 332: 343–54.
- Amodeo D.A., Jones J.H., Sweeney J.A., Ragozzino M.E. Differences in BTBR T+ tf/J and C57BL/6J mice on probabilistic reversal learning and stereotyped behaviors. Behav Brain Res. 2012. Vol. 227 (1): 64–72.
- Lipina T.V., Prasad T., Yokomaku D., Luo L., Connor S.A., Kawabe H., Wang Y.T., Brose N., Roder J.C., Craig A.M. Cognitive deficits in calsyntenin-2 deficient mice associated with reduced GABAergic transmission. Neuropsychopharmacolocy. 2015. Vol. 41 (3): 802–10.
- Huang H., Wang L., Cao M., Marshall C., Gao J., Xiao N., Hu G., Xiao M. Isolation Housing Exacerbates Alzheimer’s Disease-Like Pathophysiology in Aged APP/PS1 Mice. Int J Neuropsychopharmacol. 2015. Vol. 18 (7): 116.
- Chubb J.E., Bradshaw N.J., Soares D.C., Porteous D.J. Millar J.K., The DISC locus in psychiatric illness. Mol Psychiatry. 2008. Vol. 13 (1): 36–64.
- Bradshaw N.J., Porteous D.J. DISC1-binding proteins in neural development, signaling and schizophrenia. Neuropharmacology. 2012. Vol. 62: 1230–41.
- Cross-Disorder Group of the Psychiatric Genomics Consortium, et al. Genetic relationship between five psychiatric disorders estimated from genome-wide SNPs. Nat. Genet. 2013. Vol. 45: 984–94.
- Network and Pathway Analysis Subgroup of Psychiatric Genomics Consortium. Psychiatric genome-wide association study analyses implicate neuronal, immune and histone pathways. Nature Neurosci. 2015. Vol. 18: 199–209.
- Hikida T., Jaaro-Peled H., Seshadri S., Oishi K., Hookway C., Kong S., Wu D., Xue R., Andrade M., Tankou S., Mori S., Gallagher M., Ishizuka K., Pletnikov M., Kida S., Sawa A. Dominant-negative DISC1 transgenic mice display schizophrenia-associated phenotypes detected by measures translatable to humans. Proc. Natl. Acad. Sci. U. S. A. 2007. Vol. 104 (36): 14501–6.
- Li W., Zhou Y., Jentsch J.D., Brown R.A., Tian X., Ehninger D., Hennah W., Peltonen L., Lönnqvist J., Huttunen M.O., Kaprio J., Trachtenberg J.T., Silva A.J., Cannon T.D. Specific developmental disruption of disrupted-in-schizophrenia-1function results in schizophrenia-related phenotypes in mice. Proc. Natl. Acad. Sci. USA. 2007. Vol. 104: 18280–5.
- Pletnikov M.V., Ayhan Y., Nikolskaia O., Xu Y., Ovanesov M.V., Huang H., Mori S., Moran T.H., Ross C.A. Inducible expression of mutant human DISC1 in mice is associated with brain and behavioral abnormalities reminiscent of schizophrenia. Mol. Psychiatry.2008. Vol. 13 (2): 173–186.
- Shen S., Lang B., Nakamoto C., Zhang F., Pu J., Kuan S.L., Chatzi C., He S., Mackie I., Brandon N.J., Marquis K.L., Day M., Hurko O., McCaig C.D., Riedel G., St Clair D. Schizophrenia-related neural and behavioral phenotypes in transgenic mice expressing truncated Disc1. J. Neurosci. 2008. Vol. 28 (43): 10893–904.
- Li W., Zhou Y., Jentsch J.D., Brown R.A., Tian X., Ehninger D., Hennah W., Peltonen L., Lönnqvist J., Huttunen M.O., Kaprio J., Trachtenberg J.T., Silva A.J., Cannon T.D. Specific developmental disruption of disrupted-in-schizophrenia-1 function results in schizophrenia-related phenotypes in mice. Proc. Natl. Acad. Sci. USA. 2007. Vol. 104: 18280–85.
- Ayhan Y., Abazyan B., Nomura J., Kim R., Ladenheim B., Krasnova I.N., Sawa A., Margolis R.L., Cadet J.L., Mori S., Vogel M.W., Ross C.A., Pletnikov M.V. Differential effects of prenatal and postnatal expressions of mutant human DISC1 on neurobehavioral phenotypes in transgenic mice: evidence for neurodevelopmental origin of major psychiatric disorders. Mol Psychiatry. 2011. Vol. 16: 293–306.
- Lipina T.V., Niwa M., Jaaro-Peled H., Fletcher P.J., Seeman P., Sawa A., Roder J.C. Enhanced dopamine function in DISC1-L100P mutant mice: implications for schizophrenia. Genes Brain Behav. 2010. Vol. 9: 777–89.
- Lipina T.V., Kaidanovich-Beilin O., Patel S., Wang M., Clapcote S.J., Liu F., Woodgett J.R., Roder J.C. Genetic and pharmacological evidence for schizophrenia-related Disc1 interaction with GSK-3. Synapse. 2011. Vol. 65 (3): 234–48.
- Lipina T.V., Haque F.N., McGirr A., Boutros P.C., Berger T., Mak T.W., Roder J.C., Wong A.H. Prophylactic valproic acid treatment prevents schizophrenia-related behaviour in Disc1-L100P mutant mice. PLOS One. 2012. Vol. 7 (12): 51562.
- Lipina T.V., Zai C., Hlousek D., Roder J.C., Wong A.H. Maternal immune activation during gestation interacts with Disc1 point mutation to exacerbate schizophrenia-related behaviors in mice. J. Neurosci. 2013. Vol. 33 (18): 7654–66.
- Lipina T.V., Fletcher P.J., Lee F.H., et al. Disrupted-in-schizophrenia-1 Gln31Leu polymorphism results in social anhedonia associated with monoaminergic imbalance and reduction of CREB and β-arrestin-1,2 in the nucleus accumbens in a mouse model of depression. Neuropsychopharmacology. 2013. Vol. 38 (3): 423–36.
- Willner P. The validity of animal models of depression. Psychopharmacology(Berl). 1984. Vol. 83: 1–16.
- Lee F.H., Zai C.C., Cordes S.P., Roder J.C. Wong A.H. Abnormal interneuron development in disrupted-in-schizophrenia-1 L100P mutant mice. Mol Brain. 2013. V.6: 20.
- Lipina T.V., Roder J.C. Disrupted-In-Schizophrenia-1 (DISC1) interactome and mental disorders: impact of mouse models. Neurosci Biobehav Rev. 2014. Vol. 45: 271–94.
- Morris R.G. Elements of a neurobiological theory of hippocampal function: the role of synaptic plasticity, synaptic tagging and schemas. Eur. J. Neurosci. 2006. Vol. 23 (11): 2829–46.
- Dudai Y. The restless engram: consolidations never end. Annu. Rev. Neurosci. 2012. Vol. 35: 227–47.
- Parker J.G., Wanat M.J., Soden M.E., Ahmad K., Zweifel L.S., Bamford N.S., Palmiter R.D. Attenuating GABA(A) receptor signaling in dopamine neurons selectively enhances reward learning and alters risk preference in mice. J. Neurosci. 2011. Vol. 31 (47): 17103–12.
- Solomon M., Smith A.C., Frank M.J., Ly S., Carter C.S. Probabilistic reinforcement learning in adults with autism spectrum disorders. Autism Res. 2011. Vol. 4: 109–20.
- Mosiolek A., Gierus J., Koweszko T., Szulc A.. Cognitive impairment in schizophrenia across age groups: a case-control study. BMC Psychiatry. 2016. Vol. 24: 16–37.




