Применение желточных антител птиц в медико-биологических исследованиях
Работа выполнена без спонсорской поддержки.
Каплин В.С., Каплина О.Н. Применение желточных антител птиц в медико-биологических исследованиях. Лабораторные животные для научных исследований. 2023; 3. https://doi.org/10.57034/2618723X-2023-03-04
Резюме
Пассивная иммунизация, предложенная E. Behring, до сих пор остается востребованным вариантом лечения с использованием антител млекопитающих. Этот принцип развил F. Klemperer в 1893 г., показав, что в желтках яиц кур, иммунизированных токсином столбняка, появляются антитела, которые способны инактивировать этот патоген. В это время E. Behring, S. Kitasato и другие исследователи изучали инактивирующие свойства сывороток млекопитающих, а статья F. Klemperer о передаче активных антител из крови курицы в желток яйца осталась без внимания. Только после публикации принципов 3Rs W.M.S. Russell и R.L. Burch в 1959 г. возникло понимание, что извлечение желтков яиц иммунизированных птиц полностью согласуется с принципами биоэтики, поскольку эта процедура физиологична и неинвазивна. Исследователи во многих странах стали изучать желточные иммуноглобулины птиц разных видов и использовать их в диагностике, терапии и профилактике заболеваний человека и животных. Для производства IgY-антител используют следующие виды птиц: курица, перепелка, утка, гусь, страус. Извлечение иммуноглобулинов из желтков яиц птиц не является сложной задачей. В литературе описано множество вариантов выделения и очистки желточных иммуноглобулинов из разных видов птиц. IgY-технология вызвала большой интерес у исследователей, особенно за последние 10 лет. Кроме того, развитие лабораторных методов и применение других технологий в этой области привели к тому, что технология IgY стала более зрелой для промышленного производства специфических антител и коммерциализации процесса. Во многих странах появляются компании, производящие трансовариальные (желточные) антитела к патогенам, вызывающим кариес зубов, язву желудка, целиакию и другие заболевания. IgY-технологии — относительно новое направление в иммунологии, основанное на технологии пассивной иммунизации E. Behring, но недостаточно оцененное в России. Замена IgG млекопитающих на птичьи трансовариальные IgY позволяет нарабатывать коммерчески значимые количества специфических антител, не вызывающих побочных эффектов, расширяет возможности методов пассивной иммунизации для лечения поражений, вызываемых вирусами, бактериями и токсинами. В данном обзоре описаны свойства IgY разных видов птиц и примеры их применения в терапии и профилактике заболеваний.
Введение
Птицы (в частности, куры) относятся к яйцекладущим животным. Из их оплодотворенных яиц при температуре 37–38 °С через 21 сут вылупляется цыпленок. Простая процедура изъятия материала для исследований привлекла внимание древних философов-естествоиспытателей. Первый из известных трудов по сравнительной эмбриологии принадлежит греческому мыслителю Аристотелю Стагириту, жившему в IV веке до н. э. В своей книге «Размножение животных» он дал первое описание последовательных этапов развития куриного зародыша. Дальнейшее развитие этого направления привело к созданию в XX веке такой дисциплины, как «Биология развития», а птицы стали незаменимыми лабораторными животными. В частности, F.M. Burnet в 1941 г. [1] разработал процедуру получения вирусов из куриных эмбрионов, которая стала классикой и до сих пор используется для получения вакцин. Птиц можно рассматривать как перспективную тест-систему для проведения доклинических исследований. Так, например, куры используются для оценки общих токсических свойств лекарственных средств [2] и нейротоксических эффектов [3]. Куринные эмбрионы — незаменимая модель экспериментального изучения физиологии и патологии сердечно-сосудистой системы [4] и механизмов миграции и инвазии клеток меланомы [5]. Также перспективным направлением использования птиц является иммунология, а именно IgY-технологии, которые за последние 10 лет наконец-то нашли понимание и применение фармацевтами, ветеринарами, медиками, промышленниками и учеными в разработке терапевтических специфических антител практически любой направленности.
Иммунология как определенное направление исследований возникла из практической необходимости борьбы с инфекционными заболеваниями, такими как оспа, столбняк, бешенство, дифтерия и многие другие. В 1546 г. выходит книга итальянского врача Джироламо Фракасторо «Зараза» («On Contagion et Contagiosis Morbis»), в которой он развивает теорию приобретенного иммунитета, выдвинутую еще в XI веке Авиценной.
Не останавливаясь на борьбе человечества с оспой и другими «заразами», следует лишь отметить, что выдающийся французский ученый L. Pasteur разработал и впервые применил вакцины против холеры кур, сибирской язвы овец и бешенства. Принципиально другое направление лечения было предложено E. Behring, получившее название «пассивная иммунизация». В 1890 г. он совместно с S. Kitasato показал, что в крови людей, переболевших дифтерией или столбняком, образуются антитоксины, которые обеспечивают иммунитет к этим болезням как самим переболевшим, так и тем, кому такая кровь будет перелита. В том же году на основе этих открытий был разработан метод лечения сывороткой крови (сывороточная терапия). Работы этих ученых положили начало изучению механизмов гуморального иммунитета.
S. Kitasato в 1889 г. изолировал чистую культуру столбнячной палочки (Clostridium tetani), что дало возможность и другим исследователям изучать этот патоген. В 1891 г. он и E. Behring создали противостолбнячную сыворотку. В нескольких лабораториях были повторены эксперименты с использованием столбнячного и дифтерийного токсинов на разных видах животных. Так, L. Vaillard в 1891 г. провел иммунизацию кур столбнячной палочкой и получил активную сыворотку из крови кур. В этом же году P. Ehrlich опубликовал статью о том, что антитела у млекопитающих могут передаваться с материнским молоком и создавать пассивный иммунитет для потомства. F. Klemperer в 1893 г., сопоставив эти два факта (передача антител из молока и наличие антител в сыворотке курицы), провел эксперимент, в котором решил проверить, не передаются ли антитела, наработанные в крови курицы на столбнячную палочку, в яйцо иммунизированных птиц.
F. Klemperer иммунизировал кур столбнячным токсином [6]. Через месяц он проверил содержимое яиц иммунизированных кур на наличие антитоксина. Выяснилось, что только в желтке обнаруживается антитоксин — специфические антитела, которые защитили подопытных мышей, зараженных столбнячной палочкой, от летального исхода. Тем не менее долгое время открытие F. Klemperer оставалось малоизвестным, так как кур не рассматривали в качестве потенциальных доноров из-за небольшого количества сыворотки, которое можно было получить от этих птиц. Однако в последствии оказалось, что из яиц иммунизированных птиц можно выделять большое количество специфических иммуноглобулинов. В 1959 г. W.M.S. Russell и R.L. Burch опубликовали свой труд «Принципы гуманной экспериментальной техники», в котором предлагали пересмотреть отношение к лабораторным животным [7]. Именно поэтому интерес к открытию F. Klemperer стал очень постепенно возрастать. Антитела предлагалось получать из яиц, а не из сыворотки кур. Название «IgY» было предложено в 1969 г. G.A. Leslie и L.W. Clem после того, как они смогли показать различия между иммуноглобулинами, обнаруженными в куриных яйцах и IgG млекопитающих [8].
IgG млекопитающих состоит из четырех полипептидных цепей — двух одинаковых тяжелых цепей и двух легких. Каждая тяжелая цепь состоит из вариабельного домена (VH) и трех константных доменов (CH1, CH2, CH3) с одним углеводным сайтом (обозначен зеленым цветом). Каждая легкая цепь содержит вариабельный домен (VL) и константный домен (CL). VL и VH являются связывающим доменом антигена. По сравнению с IgG IgY состоит из четырех константных доменов на тяжелую цепь (CH1-CH4) с двумя углеводными участками. Гибкая шарнирная область, присутствующая в IgG, отсутствует в IgY, что может ограничивать его гибкость по сравнению с IgG. Усеченная молекула IgY (ΔFc) водоплавающих птиц не имеет доменов CH3 или CH4, а две ее С-концевые аминокислоты тяжелой (H) — цепи не кодируются в доменах CH2 или CH3 полноразмерной изоформы [9] (рис. 1).
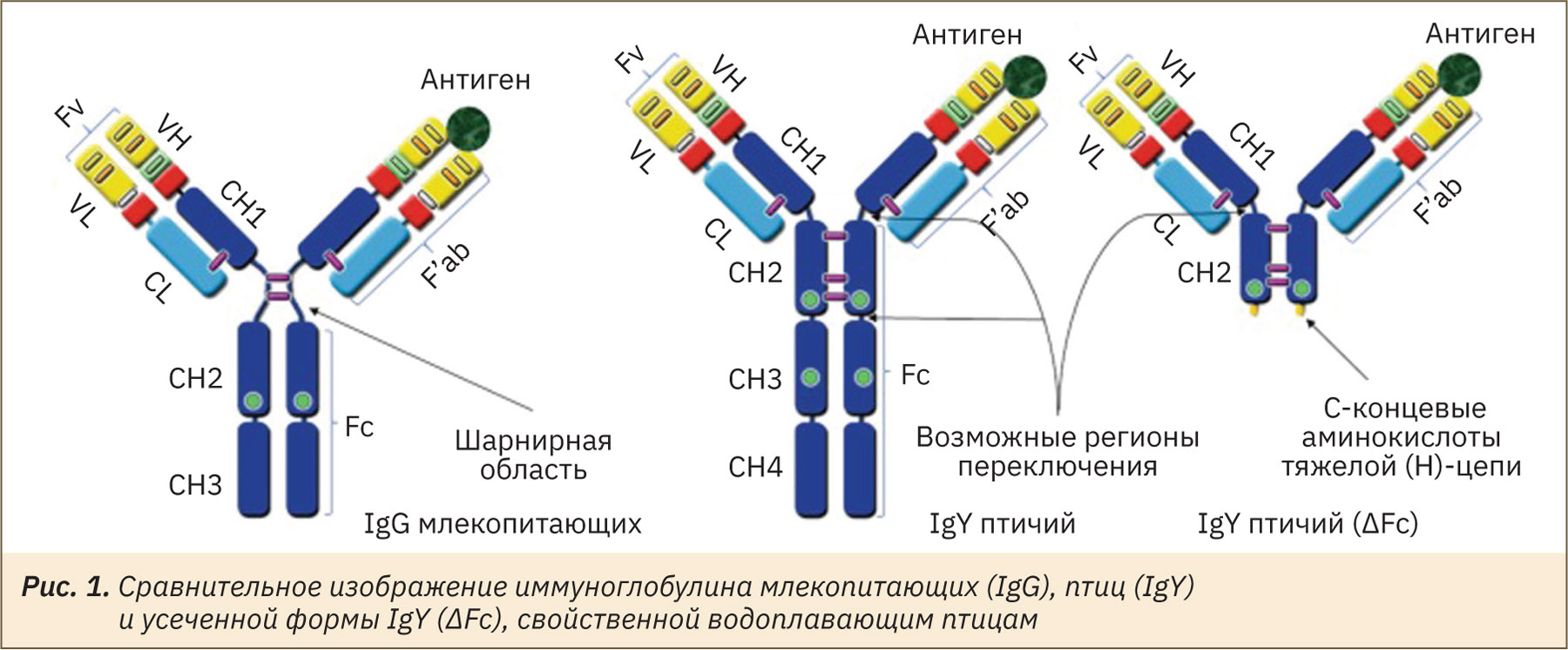
IgY является основным антителом, обнаруженным как в сыворотке крови, так и в яйцах птиц, рептилий и земноводных [10]. Яичный желток — обильный источник иммуноглобулинов, общее количество которых превышает 100 мг на одно яйцо курицы. Кроме того, выделение IgY из яичного желтка — процедура относительно простая и неинвазивная. По сравнению с кроликом из желтков одной курицы можно получить в 15–17 раз больше антител за тот же период. Это достоинство желточных IgY делает их незаменимыми при пассивной иммунизации человека и животных, что уже применяется в промышленных масштабах. Основной целью пассивного введения специфических антител является экстренное достижение быстрого лечебного эффекта и предупреждение дальнейшего развития болезни. Немедленное введение иммуноглобулина может спасти жизнь больного, представляя собой, таким образом, единственное эффективное средство для этой цели [11–13]. В настоящее время сформировалось понятие «IgY-технологии» — получение и применение IgY-антител в аналитических и терапевтических приложениях [14–21].
Птицы, используемые в медико-биологических экспериментах
Птицы относятся к яйцекладущим животным, но только одомашненные породы, лишенные инстинкта насиживания, способны нести 150 яиц в год и более, что очень ценно в практическом применении трансовариальных антител птиц. Эти породы и кроссы птиц стали широко использоваться в IgY-технологиях при производстве специфических антител, направленных к широкому кругу патогенов вирусной, бактериальной, грибковой природы, а также патогенов простейших, отдельных токсинов и искусственных генно-инженерных конструкций. Осознанная селекция пернатых на выведение пород с высокой яйценоскостью началась примерно с 7000–4000 лет до н.э., одомашниванию были подвержены такие виды птиц, как гуси, куры и утки. Значительно позже, с 900–1900 лет н.э. были одомашнены японские перепела. Хотя разведение страусов началось еще до нашей эры в Древнем Египте, новый всплеск популярности страусоводства пришелся на 1990–1995 гг. из-за ценных свойств их мяса, а также яиц, которые начали использоваться в IgY-технологиях.
Анализ специфичности IgY-антител показал, что при прямом сравнении реакций специфических IgY-антител разных видов птиц наибольшей аффинностью обладают антитела кур > фазана/куропатки > индейки > голубя > перепелки > утки [22]. В этот список не попала такая птица, как страус, так как этот вид привлек внимание японских ученых, изучавших IgY-технологии, в конце ХХ века. Это очень древний вид птиц появился в Африке 23 млн лет назад, а страусиная иммунная система адаптировалась и стала лучшей среди всех животных. Страус может начать вырабатывать антитела в течение 2 недель после контакта с антигеном, а их IgY-антитела менее термочувствительны и более кислотоустойчивы, чем у других птиц [23].
Самки перепелов и практика применения их яиц в иммунологических исследованиях
Перепела (Coturnix coturnix). В естественных природных условиях это перелетная птица. Экстерьером и общим тоном окраски напоминает обыкновенного перепела, но отличается несколько меньшей величиной.
Одомашнивание перепелов произошло в Японии в конце XIX — начале XX веков, по другим сведениям, первыми перепелов одомашнили китайцы в IX веке. В отличие от обыкновенных перепелов они менее драчливы и крикливы, поэтому лучше подходят для содержания в неволе. Существуют как яйценоские, так и мясные (бройлерные) породы перепелов. Японский перепел является модельным животным в экспериментальных и научных исследованиях поведения и развития, в области фармакологии, токсикологии, генетики, а также касающихся роста, питания и физиологии. Эмбрионы перепелов используются для приготовления вакцин против вирусов кори, краснухи и паротита.
Селекционеры вывели много пород перепелов: японские перепела, маньчжурская золотистая, фараон, эстонская и др.
Японский перепел (Japanese quails) — яичная порода. Яйцекладку самки начинают в 35–40-дневном возрасте. Масса яйца 9–11 г, из них 30–32% приходится на желток. Одна самка несет 280–300 яиц в год. Средняя продолжительность жизни перепела составляет около 7–8 лет, это зависит от кросса перепела. Эффективность использования несушек ограничивается 1–2 годами.
Фараон (Pharaoh Quail) — мясная американская порода. Половозрелость самок наступает через 42–49 дней. За год она несет 200–220 яиц массой 12–18 г. Эта порода используется для селекционных работ.
А.А. Ковган и соавт. в 1989 г. [24] провели эксперименты на перепелках для получения поликлональных антител из желтков яиц этих птиц. Самок перепела иммунизировали вирусом гриппа (А/Филиппины 2/82-H3N2) либо вирусом иммунодефицита человека HIV-1 или фрагментами HTV-1 полипептидов области env lor, которые были синтезированы в Е. coli. Для иммунизации использовали четырехкратную внутримышечную инъекцию с недельным интервалом по 4–5 мкг каждого антигена, cуспендированного в фосфатном буфере с концентрацией 1 мг/мл и смешанного с равным объемом полного адъюванта Фрейнда. После окончания иммунизации титры специфических IgY-антител стали быстро нарастать и к 15-му дню приняли максимальное значение: антитела к вирусу гриппа — 1:10 000; антитела к вирусу HIV-1 — 1:12 000; антитела к рекомбинантному антигену белка поверхности вируса HIV-1 — 1:400. Таким образом, специфические IgY-антитела перепелок взаимодействуют с целевыми антигенами вирусов HIV-1 и H3N2.
С.В. Борисенко с соавт. проанализировали возможность использования IgY-антител перепелов в диагностике гепатита В. Поверхностный антиген вируса гепатита В (Hepatitis B surface antigen) HВsAg является основным диагностическим маркером этой инфекции. Авторы разработали тест-систему ИФА на основе желточных антител перепелок породы фараон. Для иммунизации птиц использовали рекомбинантную вакцину фирмы Engerix B™ (Бельгия). Доза иммунизации составила 200 мкг на птицу однократно. В результате были получены трансовариальные антитела к HВsAg с титрами 1:8100, которые были использованы для создания ИФА тест-системы, чувствительность которой составила 91,4%, а специфичность — 87,5%. Различия значений оптической плотности между стандартной диагностической тест-системой производства ЗАО «Вектор-Бест» (Россия) и тест-системой на основе желточных иммуноглобулинов перепелок несущественны (rs>0,7; p>0,05) [25, 26].
Виды сальмонелл являются основными патогенами, представляющими угрозу в пищевой промышленности. Было показано, что пероральное введение специфических IgY является альтернативным методом лечения и профилактики желудочно-кишечных патогенов, включая Salmonella разных видов. А. Esmailnejad и соавт. [27] изучали возможность использования IgY-антител, извлеченных из желтков яиц перепелок, иммунизированных S. typhimurium и S. enteritidis. Для инактивации живых бактерий была использована термоинактивация при 100 °С или 10% формалин, который показал лучшие результаты. Реакция специфических антител стала заметной с 14-го дня после начала иммунизации и достигала пика на 49-й день после четвертой иммунизации. IgY перепелов против сальмонеллы были высокоспецифичны к соответствующим им иммуногенам. Они также проявляли умеренную перекрестную реактивность к другим членам семейства Enterobacteriaceae. Настоящее исследование продемонстрировало возможность производства специфического IgY против Salmonella typhimurium и Salmonella enteritidis в яичных желтках японских перепелов. Этих птиц можно рассматривать как недорогой источник специфических антител, которые могут найти широкое применение в иммунодиагностике и иммунотерапии.
В группе структурной биотехнологии Центра нейро- и клеточной биологии Университета Коимбры (Португалия) разработана и представлена новая система содержания перепелов, откладывающих яйца, в соответствии с Директивой 2010/63/EU об экспериментах на животных и принципами 3Rs. Эта модульная система дает уникальные технические возможности, которые позволяют использовать перепелов-несушек для извлечения IgY-антител из желтков яиц этих птиц. При этом система обеспечивает простоту обращения с птицами, сбора яиц и санитарной обработки помещения, позволяет ускорить изучение специфических антител к различным факторам вирулентности патогенов, тем самым способствуя развитию исследований, диагностики и в конечном счете терапевтических решений для борьбы с инфекциями, опосредованными бактериями, вирусами, грибами или паразитами [28]. O-P. Tiago и соавт. — разработчики этой новой методологии содержания перепелок-несушек — приводят практические примеры иммунизации этих птиц, из которых видно, что титры антител, выделенных из желтков яиц птиц, иммунизированных рекомбинантным белком Yellow fluorescent protein, показали высокие значения в ИФА, составляющие от 1:110 000 до 1:150 000. Этот флуоресцентный белок является полезным инструментом в клеточной и молекулярной биологии и иммунологии, поскольку пики возбуждения и испускания различны, что позволяет изучать несколько процессов/белков в рамках одного эксперимента.
Таким образом, методология получения яиц перепелок, предложенная O-P. Tiago и соавт., заслуживает особого внимания и может быть использована не только в аналитических научных исследованиях, но и в промышленном производстве терапевтической продукции.
Куры и практика применения их яиц в иммунологических исследованиях
Куры (Gallus gallus domesticus). В соответствии с монофилетической точкой зрения, домашние куры произошли от одного вида — диких банкивских кур, обитающих во влажных лесах Юго-Восточной Азии от Индии до Филиппин. На основании исследований митохондриальной ДНК сделано предположение, что предки современных кур были одомашнены около 3500 лет до н.э. в азиатском регионе. Однако исследования палеозоологов последних лет свидетельствуют, что костные останки кур, обнаруженные при раскопках в Северном Китае, соответствуют времени около 6000 лет до н.э.
Срок жизни курицы в домашних условиях доходит до 15–30 лет, но в возрасте 2 лет их содержание становится нерентабельным. За многие столетия селекции были отобраны наиболее удачные породы кур, отвечающие любым требованиям промышленника или исследователя. Птицы бывают яичных, мясных и универсальных пород, а также их яйца могут отличаться по цвету скорлупы. Эмбрионы кур используются для приготовления вакцин против всевозможных патогенов.
Леггорн (White Leghorns) — наиболее распространенная во всех странах мира яичная порода кур. В зависимости от окраски оперения леггорнов подразделяют на 8 разновидностей. Инстинкт насиживания утерян. Леггорн приносят первые кладки в возрасте 4–4,5 мес с момента рождения. К преимуществам разведения кур этой разновидности относятся высокие показатели яйценоскости, а к недостаткам — быстрое истощение организма птиц, которое наступает в возрасте 1,5 лет. Яйценоскость составляет 220–300 яиц в год. Масса яиц годовалых кур 57–60 г, из них желток составляет 29–32%. По яйценоскости и массе яйца местные кроссы могут существенно отличаться от средних параметров.
Хайсекс белая (Hisex White). Неприхотливая птица, идеально пригодная для производства яйца. Яйценоскость в среднем 300 яиц, масса 60–65 г, скорлупа белого или светло-коричневого цвета.
Ломанн-Браун (Lohmann Brown) имеет коричневый окрас. Цыплята достигают половой зрелости в 4,5 мес, когда у них появляется первое яйцо. Яйценоскость доходит до 300–310 яиц на среднюю несушку в год. Куры несут крупное яйцо массой 62–64 г с коричневой окраской скорлупы [29].
Наибольшее количество публикаций о применении IgY-технологий посвящено использованию куриных антител в диагностике, профилактике и терапии инфекционных и неинфекционных заболеваний человека и животных [30, 31]. Из источников литературы [32, 33] известно, что куриные IgY, полученные от интактных животных, вводимые перорально, способствуют усилению мышечной активности спортсменов и снижению болезненности мышц после тренировок. Для подтверждения этого факта В.С. Каплин и соавт. [34] провели испытание этого препарата на мышиной модели. Целью исследования было установить влияние куриных желточных иммуноглобулинов, полученных от неиммунизированных кур-несушек, на выносливость лабораторных животных, выявляемую в тесте вынужденного плавания. Испытанию подвергался лиофильно высушенный препарат IgY с чистотой 96%. Оценку работоспособности мышей проводили на модели принудительного плавания с 5% нагрузкой от массы тела животного. В результате исследования установлено, что при ежедневном пероральном введении препарата в дозе 2 мг на мышь в течение 10 сут удержание на воде у самцов в контрольной группе составило 1,4 мин, в опытной — 3 мин, то есть превышение в 2,1 раза. Таким образом, полученные данные свидетельствуют, что курсовое применение IgY способствует увеличению значений показателей физической работоспособности, что является подтверждением высокой биологической активности и перспективности дальнейшего фармакологического исследования препарата. Предлагаемый препарат может быть перспективным средством для восстановления физических сил спортсменов, ослабленных людей после тяжелой работы, болезни.
В.С. Каплин и соавт. [35] иммунизировали кур штаммом вируса осповакцины (ЛИВП) внутримышечно с полным адъювантом Фрейнда. Бустер вводили через месяц. После 2-й иммунизации титр желточных антител по результатам ИФА достигал более 1:10 000. Титр в реакции вирус-нейтрализации составил 1:25. Из источников литературы [36, 37] известно, что время биологического полураспада молекул IgY в сыворотке кур составляет в среднем около 36 ч, следовательно, титры специфических антител нарастали довольно быстро, и периоды между бустерными инъекциями могут быть существенно сокращены. Далее, изменив протокол иммунизации птиц, авторы получили возможность существенно повысить титры специфических IgY-антител. Измененный вариант иммунизации дал возможность повысить титры IgY-антител до 1:100 000–300 000. Такие антитела могут быть использованы при разработке антидотов против компонентов биологического оружия или в аварийных ситуациях на производстве.
Стоматологический кариес — инфекционное заболевание, вызванное бактериями Streptococcus mutans. Во многих странах (Китай, Корея, Япония) для лечения данного заболевания разработаны препараты (зубные пасты, жидкости и гели), в состав которых входят специфические IgY-антитела к возбудителю. В.С. Каплин и соавт. [38] проверили возможность получения специфических куриных IgY-антител к возбудителю стоматологического кариеса, вызванного Streptococcus mutans. После иммунизации 6 кур инактивированным возбудителем с последующими бустерными инъекциями были собраны иммунные яйца и извлечены IgY-антитела. В результате от 6 кур было собрано 474 яйца, из которых выделено 54,549 г IgY с титрами, определенными в ИФА, от 1:72 900 до 1:656 100, чего хватило бы для производства более 45 000 тюбиков зубной пасты массой 60 г. Авторами продемонстрирована возможность получения промышленных количеств активных IgY-антител к S. mutans, которые могут быть использованы в качестве субстанции при изготовлении зубной пасты, защитного геля, жидкости для полоскания рта, аэрозоля и гигиенических таблеток для рассасывания. Эта лабораторная методика является основой для разработки технического регламента, а после клинических испытаний может быть использована в производстве различных средств защиты при профилактике кариеса.
Вирус Эбола (Ebola virusdisease, EVD) принадлежит к семейству Filoviridae и является причиной тяжелой геморрагической лихорадки. Повторяющиеся вспышки с высоким уровнем летальности все еще происходят в Африке. Наиболее эффективной стратегией лечения является, как показали исследования [39], иммунотерапия с использованием моноклональных антител, но из-за низкой термостабильности антител млекопитающих их применение в тропиках остается неоправданным. Поэтому Y. Zhang и соавт. [40] использовали куриные IgY-антитела при пассивной иммунизации мышей, зараженных вирусом Эбола. Куры-несушки были иммунизированы различными вакцинами-кандидатами для получения IgY-антител к EVD. В результате были получены IgY-антитела с высоким титром к вирусу. Терапевтическая эффективность иммунных антител in vivo была проверена на новорожденных мышах Balb/c. Мышей, предварительно инфицированных смертельной дозой псевдовируса, лечили, используя различные дозы IgY-антител к EVD. Животные в группе, получавшей высокую дозу нейтрализующих антител, были полностью защищены и не имели симптомы заболевания, в то время как мыши в группе с низкими дозами антител были защищены лишь частично. Мыши, принимавшие контрольные IgY (неиммунные), погибали в течение 10 сут. Кроме того, авторы показали, что полученные ими анти-EVD-IgY-антитела сохраняют свою нейтрализующую активность при температуре 25 °C в течение одного года, в то время как анти-EVD-овечьи антитела и рекомбинантные mAb KZ52-антитела с той же специфичностью при той же температуре за 2 недели полностью потеряли свою активность. Таким образом, анти-EVD-IgY-антитела демонстрируют большие перспективы в плане внедрения новых схем лечения этого заболевания.
Тяжелый острый респираторный синдром, коронавирус 2 (SARS-CoV-2). Вирус впервые был обнаружен в декабре 2019 г. в Китае. Он вызывает опасное инфекционное заболевание COVID-19, которое может протекать как в легкой форме острой респираторной вирусной инфекции, так и тяжелой. Наиболее частым осложнением заболевания является вирусная пневмония, способная приводить к острому респираторному дистресс-синдрому и последующей острой дыхательной недостаточности. В последнее время стали широко использовать куриные желточные антитела для пассивной иммунизации. W. Jingchen и соавт. [41] использовали RBD шиповидного (S) белка (S-RBD) коронавируса SARS-CoV-2 в качестве антигена для иммунизации кур. Извлечение IgY из желтков проводили водным способом с замораживанием. Чистота препарата составила 85%. Результаты этого исследования подтвердили, что эти антитела могут распознавать антиген SARS-CoV-2 S-RBD и специфически связываться с ним, блокируя взаимодействие белка S и ACE2 и предотвращая инфекцию, вызванную этим взаимодействием. S-IgY может не только блокировать попадание SARS-CoV-2 в клетки-мишени, но и эффективно ингибировать репликацию SARS-CoV-2 в клетках, что было подтверждено в экспериментах in vitro на клетках Vero E6.
H. Shen и соавт., а также S. Ge и соавт. [42, 43] описали эксперимент, в котором они выделили IgY против SARS-CoV-2 из желтков яиц кур, иммунизированных инактивированным SARS-CoV-2, и оценили их ингибирующую активность против инфекции SARS-CoV-2 in vitro. Было показано, что анти-SARS-коронавирус-2-IgY-антитела связываются с белком S1 и RBD в зависимости от дозы, в то время как контрольные антитела IgY не могли взаимодействовать с S1 или RBD. Кроме того, H. Shen и соавт. проверили, являются ли анти-SARS-коронавирус-2-IgY-антитела полезными в использовании назального или орального распыления в качестве профилактической меры. Для этого мышам вводили антитела, меченные флуоресцентными молекулами, через назальную капельницу или оральный спрей. Результаты оценивали с помощью системы визуализации IVIS флуоресцентными красителями. Антитела к SARS-CoV-2-IgY сохранялись на обнаруживаемом уровне в носовой и ротовой полостях в течение 2–4 и 12–24 ч после введения соответственно. Эти результаты показывают, что желточные антитела к SARS-CoV-2 могут оставаться в верхних дыхательных путях в течение нескольких часов в зависимости от используемого метода введения. Авторы делают вывод, что культивированный в лабораторных условиях и инактивированный формальдегидом SARS-CoV-2 можно использовать для иммунизации кур для крупномасштабного производства IgY из яичного желтка, обладающий мощной ингибирующей активностью к живой и псевдотипированной инфекции SARS-CoV-2 in vitro. Учитывая, что антитела IgY безопасны для использования у человека и могут производиться в больших масштабах с низкими производственными затратами, эти антитела IgY к SARS-CoV-2 имеют хороший потенциал для дальнейшего развития в качестве иммунопрофилактического средства с помощью назального или перорального спрея для предотвращения пандемии.
Утки и практика применения их яиц в иммунологических исследованиях
Утки (Anas platyrhynchos). Родоначальником домашних уток Старого Света является кряковая утка. Ее одомашнивание происходило в разных местах и в разное время. Их иммунная система (иммуноглобулины) отличается от таковой у кур. Сывороточный и желточный иммуноглобулины уток представлены двумя изоформами: полной (IgY) изоформой и (IgYΔFc) усеченной, в то время как у кур существует только полная изоформа (см. рис. 1). Обе изоформы иммуноглобулинов уток являются продуктом одного гена. Соотношение IgY и IgY (ΔFc) в сыворотке одной утки не постоянно и составляет 15–25%: 85–75%, что было показано при гипериммунизации бычьим сывороточным альбумином. По данным Чиоу Й-Нэн, в яичном желтке сохраняются те же тенденции, что и в сыворотке. Общее количество желточных иммуноглобулинов, содержащихся в одном утином яйце, оценивается в 15–80 мг IgY и 45–240 мг IgY (ΔFc) [44, 45].
Белая пекинская (Peking Duck), одна из популярных пород уток, используемых в промышленном птицеводстве и в экспериментах. Выведена более 300 лет тому назад в Китае. Яйцекладка у различных кроссов начинается в разные сроки, но в среднем происходит в возрасте 6–7 мес. Яйценоскость уток 100–120 яиц в год, но при правильном выборе кросса и питания может достигать 220 яиц на несушку. Средняя масса яйца 85 г, из них на долю желтка приходится 33–35%. Продолжительность жизни уток составляет около 15 лет, но в промышленных условиях птицу забивают на 1–2-м году жизни. Если утка предназначена для того, чтобы нести яйца, то здоровая особь может быть использована для этих целей примерно до 7-летнего возраста с максимальной производительностью [46].
Агидель (Agidel duck) выведена на территории России (Башкирия) в результате селекции 3 пород — благоварской, супер М и индийских бегунов. Порода универсального направления. Имеет белую окраску пера. Период половой зрелости у уток этой породы наступает уже в 4,6–5,5 мес. Яйценоскость около 230–250 яиц в год, при этом яйца отличаются крупными размерами (88–110 г) [47].
Яйца птиц — источник антител, а укороченная версия IgY, IgY (ΔFc), обнаруженная у водоплавающих, является ценным иммуноглобулином, так как обладает меньшей молекулярной массой, следовательно, иммуногенностью, что важно при внутримышечном введении. V.Y.N. Chiou [48] изучал возможность применения утиных IgY (ΔFc) — антител к яду кобры и крайта. Уток использовали для иммунизации детоксицированными ядами, а из яиц выделяли антитела. Самок мышей использовали в опытах in vivo в тесте нейтрализации. LD50 ядов определяли путем подкожной инъекции различных доз яда мышам. Антитела, выделенные из яичного желтка, показали высокий титр ответа на свой иммуноген (яд кобры или крайта) в ИФА. В целом антитела из утиных яиц эффективно защищали мышей от отравления. IgY (ΔFc) — антитела, полученные из яичного желтка уток, иммунизированных ядом кобры и крайта, нейтрализовали летальные эффекты этих ядов с хорошей эффективностью на мышиной модели. Эти результаты показывают, что антитела, полученные от уток, могут служить новым источником для создания противоядий.
Вирус Анд (ANDV) является преобладающей причиной хантавирусного легочного синдрома (HPS) в Южной Америке и единственным известным хантавирусом, который передается от человека к человеку. Не существует вакцин, профилактических или терапевтических средств для предотвращения или лечения этого высокопатогенного заболевания (летальность 35–40%). Модельными животными для изучения этой патологии являются сирийские хомячки. R. Brocato и соавт. [49] использовали технологию ДНК-вакцин для получения поликлональных иммуноглобулинов утки, укороченных до IgY (ΔFc), что делает их минимально реактогенными для человека. Антитела IgY/IgYΔFc, выделенные из яиц ДНК-вакцинированных уток, эффективно нейтрализовали ANDV in vitro, что было показано в тесте нейтрализации бляшек. Введение 12 000 NAU/кг IgY/IgYΔFc, полученных из утиных яиц, защищало хомяков при введении в течение 8 дней после интраназального заражения и 5 дней после внутримышечного заражения. Подтверждена возможность использования технологии ДНК-вакцинации в сочетании с системой утка—яйцо для производства продукта, который может дополнять или заменять лечение плазмой переболевших HPS. Предлагаемая терапия может масштабироваться по мере необходимости и устраняет зависимость от использования ограниченного количества продуктов крови, полученных от небольшого числа выживших после HPS.
Практика применения яиц гусынь в иммунологических исследованиях
Гуси (Anser anser domesticus или Anser cygnoides domesticus, два отдельных вида гусей) в Европе, Африке и западной Азии и домашние гуси произошли от серого гуся (Anser anser). В Восточной Азии домашние гуси произошли от гуся-лебедя (Anser cygnoides), они широко известны как китайские гуси. Оба вида были широко представлены в обоих районах и могут состоять либо из видов, либо из гибридов между ними [50]. Так же как и у уток, гусиные иммуноглобулины в сыворотке и желтках представлены двумя формами — IgY и IgY (ΔFc). От других видов сельскохозяйственной птицы гуси отличаются относительно более поздней половой зрелостью, которая наступает у них в 8–10 мес и зависит от комплекса внешних условий развития, кормления, температуры атмосферы и породности. Продолжительность жизни гусей составляет от 20 до 32 лет и более, хотя на птицефабриках эти сроки не являются рентабельными [51, 52]. Гусыня в среднем может снести за год 40–60 яиц. При правильном кормлении некоторые породы пернатых выдают до 150 штук яиц в год. Нормальная масса гусиных яиц составляет 196–252 г, на желток приходится 31% от массы яйца.
В настоящее время селекционерами выведено большое количество гибридов китайских и европейских пород гусей, отличающихся высокой яйценоскостью, например, инбредный гибрид немецкой эмбденской, королевской китайской и королевской английской пород, который используется также и в научных исследованиях.
При изучении лихорадки Зика установлено, что сыворотка выздоравливающих в условиях in vivo обладает нейтрализующей активностью из-за наличия большого количества специфических к вирусу антител [53], но из-за антителозависимого усиления инфекции (antibody-dependent enhancement, ADE) антитела не могут выполнять протективную функцию в условиях in vitro. Чтобы противодействовать ADE при инфекции Зика, можно использовать моноклональные антитела с мутацией LALA [замена лейцина (L) на аланин (A) в положениях 234 и 235 в области Fc антитела IgG], поскольку они не могут связываться с Fc-γ-рецептором клеток (FcγR). Следовательно, такие моноклональные антитела могут устранять ADE в условиях in vitro и in vivo [54]. Однако антитела из желтков яиц водоплавающей птицы также не взаимодействуют с FcγR млекопитающих. Поэтому K.L. O’Donnell и соавт. [55] проверяли возможность подавления ADE специфическими антителами, выделенными из гусиных яиц. Авторы показали, что олигоклональные IgY-антитела способны нейтрализовать вирус Зика у мышей. При концентрации специфического IgYΔFc 25 мкг/мл наблюдалась 50% нейтрализация активности антител. Авторы показали, что предлагаемые поликлональные специфические IgYΔFc-гусиные антитела могут обеспечивать эффективную пассивную иммунотерапию инфекции Зика без индукции ADE и без применения процедуры получения моноклональных антител. Таким образом, специфические IgYΔFc-антитела, полученные из яиц самок гусей, не взаимодействуют с Fc-рецепторами млекопитающих и не активируют систему комплемента млекопитающих, поэтому они не запускают ADE и неблагоприятные воспалительные реакции.
Хантавирусный легочный синдром (HPS) вызван андским вирусом в Южной Америке. Исследования в Чили показывают, что пассивный перенос плазмы выздоравливающего человека является многообещающим в качестве возможного лечения HPS. Однако доступность реконвалесцентной плазмы от выживших после этой смертельной болезни очень ограничена. Поэтому N. Haese и соавт. [56] применили пассивную иммунизацию специфическими гусиными IgYΔFc-антителами. Гусынь вакцинировали ДНК-вакциной, кодирующей гликопротеины оболочки вируса. У всех экспериментальных птиц вырабатывались нейтрализующие антитела с высоким титром после 2-й вакцинации 1:100 000 в ИФА, а также вирус-нейтрализации. Эти антитела обладали высокой реактивностью в отношении специфических аминокислотных последовательностей гликопротеинов оболочки хантавируса. Изучение защитной эффективности антител IgYΔFc проводили на модели летального HPS у хомяков. IgYΔFc, очищенные из яиц, пассивно переносили хомякам подкожно, начиная с 5-го дня после внутримышечного заражения вирусом. IgYΔFc-антитела, полученные из иммунных яиц, защищали хомяков от летального исхода. Напротив, у всех хомяков, получавших IgYΔFc от нормальных (интактных) гусынь, развился летальный HPS. Эти результаты демонстрируют, что ДНК-вакцина/гусиная платформа может быть использована для производства противовирусного биологического продукта-кандидата, способного предотвратить смертельную болезнь при постконтактном введении.
Страусы и практика применения их яиц в иммунологических исследованиях
Страусы (Struthino camelus). Африканские страусы как вид (Struthino camelus) были известны в Древнем Египте около 300 лет до н.э. Их разводили как культовую птицу для получения красивых перьев, для упряжи в колесницы и для верховой езды.
Черный африканский страус (Struthino camelus domesticus) является результатом скрещивания малийского страуса с южно-африканским. Продолжительность жизни этих птиц составляет 60–70 лет. Самка продуктивна в течение 30 лет. На ферме птенцы страуса становятся половозрелыми в возрасте 2 лет, а в дикой природе — 4 лет. Яйценоскость самок страуса в естественной среде составляет 5–18 яиц в год, а одомашненных птиц — 50–110 яиц, но чаще всего это 40–60 яиц. Возраст максимальной яйценоскости колеблется от 7 до 11 лет [57]. Средняя масса одного яйца составляет 1500–1900 г, а отдельные экземпляры доходят до 2200 г. Инкубационный период (42 дня) намного длиннее, чем у других видов птиц. Средняя масса желтка составляет 340 г, или 21% к массе яйца, что значительно ниже, чем у других видов птиц [58].
M. Tsukamoto и соавт. [59] исследовали потенциал использования страусов для крупномасштабного и экономичного производства нейтрализующих IgY-антител к вирусам пандемического свиного гриппа A/H1N1. Самки страусов вырабатывали антитела после иммунизации вирусом свиного гриппа. Из одного желтка было выделено до 4 г IgY, это указывает, что от одной самки страуса за 1 год можно собрать 400 г антител. Поскольку нейраминидаза необходима для связывания вируса с клетками хозяина и проникновения в клетки, антигены нейраминидазы широко используются при вакцинации против гриппа у людей. Авторы утверждают, что ингибирование антигенов нейраминидазы IgY-антителами страуса защищает хозяина от вирусной инфекции. Эксперименты с использованием культуры клеток MDCK подтвердили это предположение. Заражение клеток MDCK вирусом пандемического гриппа было резко подавлено антителами. Следовательно, антитела могут нейтрализовать проникновение вируса пандемического гриппа A/H1N1 в клетки, блокируя активность нейраминидазы, что приводит к избавлению клеток от вирусной инфекции. M. Tsukamoto и соавт. провели дополнительные исследования в области создания воздушных фильтров для обеззараживания лабораторных помещений и индивидуальных защитных масок для персонала. Для этого страусиные IgY-антитела были нанесены в виде глазури на подложки для создания новых фильтров, обеспечивающих защиту от вируса гриппа за счет реакций антиген—антитело. Таким образом, большое количество нейтрализующих антител к вирусам гриппа было произведено экономически эффективным способом, что указывает на потенциальное использование страусиных антител в промышленных целях. Авторы считают, что фильтры, пропитанные страусиными антителами, станут мощным инструментом защиты от вирусов пандемического гриппа в виде промышленных фильтров или индивидуальных масок.
Гормон дигидротестостерон (DHT) и фермент 5α-редуктаза являются ключевыми факторами выпадения волос из-за андрогенной алопеции (AGA). Поэтому у людей с облысением уровень дегидротестостерона (которого особенно много в коже скальпа) выше нормы. Кроме того, к выпадению волос причастны кожные бактерии и их токсины. Y. Tsukamoto и соавт. [60] провели исследование и терапию AGA, в основе которой было лечение волосяных покровов головы добровольцев с использованием IgY-антител страуса, направленных к DHT и 5α-редуктазы, а также патогенным бактериям Pseudomonas aeruginosa, Staphylococcus aureus, которые усугубляют течение AGA. Авторы разработали препарат страусиных антител на спиртовой основе, который оказался удобным и простым в использовании. Было высказано предположение, что антитело страуса эффективно связывается с факторами выпадения волос в тканях кожи и нейтрализует их, что приводит к эффективному росту волос. Основываясь на сравнении с результатами, опубликованными в литературе [61], можно сделать вывод, что страусиные антитела значительно более эффективны, чем использование миноксидила и финастерида, традиционно применяемых для лечения AGA. Сравнительное исследование показало, что применение 5% раствора миноксидила приводило к увеличению количества волос примерно на 30% по сравнению с 71% в эксперименте, описанном Y. Tsukamoto и соавт. Страусы как сельскохозяйственные птицы обладают потенциалом не только в плане получения мяса, яиц, кожи и перьев, но и в качестве производителей иммунных яиц, использование которых эффективно при создании терапевтических препаратов в медицине и ветеринарии, вместо IgG лошадей, коров, ослов, баранов, коз и других млекопитающих, часто используемых для пассивной иммунизации, но обладающих рядом недостатков. В таблице 1 приведена обобщенная информация о результатах исследования IgY-антител к различным патогенам, полученным от разных видов птиц.
Заключение
Таким образом, в технологии IgY достигнут значительный прогресс за последние два десятилетия, и ее можно применять в диагностических, профилактических или лечебных целях. Эта технология вызвала большой интерес у исследователей, особенно за последние 10 лет. Кроме того, развитие лабораторных методов и применение других технологий в этой области привело к тому, что технология gY стала более зрелой для промышленного производства специфических антител и коммерциализации. IgY-технологии — относительно новое направление в иммунологии, основанное на технологии пассивной иммунизации E. Behring, но недостаточно оцененная в России. Замена IgG млекопитающих на птичьи трансовариальные IgY позволяет нарабатывать коммерчески значимые количества специфических антител, не вызывающих ADE, расширяет возможности методов пассивной иммунизации для лечения поражений, вызываемых вирусами, бактериями и токсинами.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
В.С. Каплин — идея, анализ научной литературы, написание, редактирование и доработка текста рукописи.
О.Н. Каплина — написание и редактирование текста рукописи, оформление рукописи, работа с таблицами и рисунками.
Список источников
-
Burnet F.M. Growth of Influenza Virus in the Allantoic Cavity of the Chick Embryo // Australian Journal of Experimental Biology & Medical Science. 1941. Vol. 19. N. 4.
-
Пономаренко В.В., Мифтахутдинов А.В. Изучение токсических и местно-раздражающих свойств фармакологического комплекса СПАО (стресс-протектор антиоксидант) для животных // Вестник Алтайского государственного аграрного университета. 2016. № 4 (138). С. 161–167. [Ponomarenko V.V., Miftakhutdinov A.V. The study of toxic and locally irritating properties of the pharmacological complex (stress protecting antioxidant) for animals // Bulletin of the Altai State Agrarian University. 2016. N. 4 (138). P. 161–167. (In Russ.)].
-
Макарова М.Н., Макаров В.Г., Шекунова Е.В. Выбор вида животных для оценки нейротоксичности фармакологических веществ // Международный вестник ветеринарии. 2017. № 2. С. 106–113. [Makarova M.N., Makarov V.G., Shekunova E.V. Selection of the animal species for assessing the neurotoxicity of pharmacological agents // Mezhdunarodnyi vestnik veterinarii. 2017. N. 2. P. 106–113. (In Russ.)].
-
Каде А.Х., Трофименко А.И., Туровая А. Ю и др. Куриный эмбрион как объект эксперимента для изучения развития сердечно-сосудистой системы // Российский медико-биологический вестник имени академика И.П. Павлова. 2018. Т. 26. № 4. С. 538–546. [Kade A.Kh., Trofimenko A.I., Turovaya A.Yu. et al. Chicken embryo as an object of experiment to study the development of cardiovascular // Russian Medical and Biological Bulletin named after Academician I.P. Pavlova. 2018. Vol. 26. N. 4. P. 538–546. (In Russ.)].
-
Лысов Е.Е., Минина Я.И., Певзнер Д.А. и др. Куриный эмбрион как модель для изучения канцерогенеза // Международный студенческий научный вестник. 2018. № 1. С. 37–44. [Lysov E.E., Minina Ya.I., Pevzner D.A. et al. Chicken embryo as a model for the study of carcinogenesis // International Student Scientific Bulletin. 2018. N. 1. P. 37–44. (In Russ.)].
-
Klemperer F. Archiv für experimentelle pathologie und pharmakologie. 1893. Vol. 31. P. 356–382.
-
Russell W.M.S., Burch R.L., Hume C. The Principles of Humane Experimental Technique: London, UK: Methuen & Co Ltd, 1959.
-
Leslie G.A., Clem L.W. Phylogen of immunoglobulin structure and function. Immunoglobulins of the chicken // J. Exp. Med. 1969. Vol. 130. N. 6. P. 1337–1352.
-
Zhang X.Y. et al. IgY-Technology: Production and Application of Egg Yolk Antibodies. Springer International Publishing, 2021. URL: https://link.springer.com/book/10.1007/978-3-030-72688-1 (дата обращения: 06.2023).
-
Marchalonis J.J. Immunity in Evolution. Cambridge, Massachusetts: Harvard University Press, 1977. P. 1–336.
-
Mine Y., Kovacs-Nolan J.J. Chicken egg yolk antibodies as therapeutics in enteric infectious disease: a review // Med. Food. 2002. Vol. 5. N. 3. P. 159–169. DOI: 10.1089/10966200260398198.
-
Каплин В.С., Каплина О.Н. Характеристики и свойства желточных антител птиц // Ветеринария Кубани. 2018. № 3. С. 7–11. [Kaplin V.S., Kaplina O.N. Characteristics and properties of yolk antibodies of birds // Veterinary of Kuban. 2018. N. 3. P. 7–11. (In Russ.)].
-
Каплин В.С. Применение птичьих желточных антител для лечения поражений, вызванных агентами биологического оружия и возбудителями особо опасных инфекций // Вестник войск РХБ защиты. 2022. Т. 6. № 2. С. 137–151. [Kaplin V.S. The use of bird yolk antibodies for the treatment of lesions caused by agents of biological weapons and pathogens of especially dangerous infections // Bulletin of the RCB Protection Troops. 2022. Vol. 6. N. 2. P. 137–151. (In Russ.)]. DOI: 10.35825/2587-5728-2022-6-2-137-151.
-
Каплин В.С., Каплина О.Н. IgY-технологии в медицине. Желточные антитела птиц в иммунотерапии // Международные обзоры: клиническая практика и здоровье. 2016. № 4. С. 59–75. [Kaplin V.S., Kaplina O.N. IgY-technologies in medicine. Avian yolk antibodies in immunotherapy // International reviews: clinical practice and health. 2016. N. 4. P. 59–75. (In Russ.)].
-
Каплин В.С., Каплина О.Н. IgY-технологии. Желточные антитела птиц // Биотехнология. 2017. Т. 33. № 2. С. 29–40. [Kaplin V.S., Kaplina O.N. IgY-technologies. Yolk antibodies of birds // Biotechnology. 2017. Vol. 33. N. 2. P. 29–40. (In Russ.)].
-
Каплин В.С., Каплина О.Н. IgY-технологии в медицине. Лечение и профилактика неинфекционных заболеваний // Международные обзоры: клиническая практика и здоровье. 2018. № 3. С. 10–21. [Kaplin V.S., Kaplina O.N. IgY-technologies in medicine. Treatment and prevention of non-communicable diseases // International reviews: clinical practice and health. 2018. N. 3. P. 10–21. (In Russ.)].
-
Каплин В.С., Каплина О.Н. Использование желточных антител птиц (IgY) для пассивной иммунизации сельскохозяйственных и домашних животных // Ветеринария Кубани. 2018. № 4. С. 19–23. [Kaplin V.S., Kaplina O.N. The use of avian yolk antibodies (IgY) for passive immunization of agricultural and domestic animals // Veterinary Kuban. 2018. N. 4. P. 19–23. (In Russ.)].
-
Pereira E.P.V., Van Tilburg M.F., Florean E.O.P.T., Guedes M.I.F. Egg yolk antibodies (IgY) and their applications in human and veterinary health: A review // International immunopharmacology. 2019. Vol. 73. P. 293–303. DOI: 10.1016/j.intimp.2019.05.015.
-
Каплин В.С. Возможности использования антител из желтков яиц в контексте продовольственной безопасности российской федерации // Инновации и продовольственная безопасность. 2022. № 4. С. 25–36. [Kaplin V.S. Possibilities of using antibodies from egg yolks in the context of food security of the Russian Federation // Innovations and food security. 2022. N. 4. P. 25–36. (In Russ.)]. DOI: 10.31677/2072-6724-2021-34-4-25-36.
-
León-Núñez D., Vizcaíno-López M.F., Escorcia M. et al. IgY Antibodies as Biotherapeutics in Biomedicine // Antibodies. 2022. Vol. 11. N. 62. P. 1–9. DOI: 10.3390/antib11040062.
-
Yakhkeshi S., Wu R., Chelliappan B. et al. Trends in industrialization and commercialization of IgY technology // Frontiers in Immunology. 2022. Vol. 13. P. 1–8. DOI: 10.3389/fimmu.2022.991931.
-
Higgins D.A. Comparative immunology of avian species // Poultry immunology. 1996. P. 149–205.
-
Tsukamoto Y., Hendler B., Greenberg S. Application of Ostrich Antibodies to the Restoration of Hair Growth, a Preliminary and Case Report // Journal of Cosmetics, Dermatological Sciences and Applications. 2018. Vol. 8. N. 4. P. 179–184. DOI: 10.4236/jcdsa.2018.84019.
-
Ковган А.А., Исаева Е.И. и др. Специфические иммуноглобулины из желтков яиц японских перепелов, иммунизированных вирусами гриппа и Hiv-I // Доклады Академии наук СССР. 1989. Т. 307. № 1. С. 229–233. [Kovgan A.A., Isaeva E.I. et al. Specific immunoglobulins from Japanese quail egg yolks immunized with influenza and Hiv-I viruses // Reports of the Academy of Sciences of the USSR. 1989. Vol. 307. N. 1. P. 229–233. (In Russ.)].
-
Сокурова А.М. Разработка тест-системы на основе желточных иммуноглобулинов иммунизированных перепелов для индикации HBsAg: дис. ГУ «Научно-исследовательский институт гриппа РАМН», 2009. [Sokurova A.M. Development of a test system based on yolk immunoglobulins of immunized quails for the indication of HBsAg. dis. State Institution “Research Institute of Influenza of the Russian Academy of Medical Sciences”, 2009. (In Russ.)].
-
Борисенко С.В., Сокурова А.М., Сбойчаков В.Б. Динамика изменений титров специфических иммуноглобулинов к HBsAg в сыворотке крови и желтках яиц перепелов при использовании различных препаратов для иммунизации // Инфекция и иммунитет. 2011. Т. 1. № 3. С. 249–254. [Sboychakov V.B., Borisenko S.V., Sokurova A.M. The dynamics of titers changes of specific immunoglobulins to hbsag in serum and yolk of quail eggs in case of using of different preparation for immunization // Infection and immunity. 2011. Vol. 1. N. 3. P. 249–254. (In Russ.)].
-
Esmailnejad A., Abdi-Hachesoo, Nasab E.H. et al. Production, purification, and evaluation of quail immunoglobulin Y against Salmonella typhimurium and Salmonella enteritidis // Molecular immunology. 2019. Vol. 107. P. 79–83. DOI: 10.1016/j.molimm.2019.01.012.
-
Tiago O-P., Marguerita R. et al. Antibody discovery using Japanese quail: towards new anti-infective strategies // Ecronicon Microbiology. 2020. Vol. 16 (6). P. 29–36.
-
Кочиш И.И., Петраш М.Г., Смирнов С.Б. Птицеводство. Москва, 2004. С. 407. [Kochish I.I., Petrash M.G., Smirnov S.B. Poultry farming. Moskva, 2004. p. 407. (In Russ.)].
-
Schade R., Terzolo H.R. IgY-technology: application and trends // Personal Communication. 2006.
-
Müller S., Schubert A., Zajac J. et al. IgY antibodies in human nutrition for disease prevention // Nutrition journal. 2015. Vol. 14. N. 1. P. 1–7. DOI: 10.1186/s12937-015-0067-3.
-
Scheett T., Martin T. et al. NSCA National Conference & Exhibit. 2007. 768 p.
-
Jacobson BH., Monaghan T., Sellers J. et al. Effect of avian immunoglobulin on post-exercise muscle damage and muscular soreness // Journal of Human Sport and Exercise, in press. 2019. P. 1–9. DOI: 10.14198/jhse.2019.144.09.
-
Каплин В.С., Сысоева Г.М., Гридунова Л.В. и др. Влияние куриных желточных иммуноглобулинов на выносливость мышей // Российский иммунологический журнал. 2019. Т. 13. № 2. С. 792–794. [Kaplin V.S., Sysoeva G.M., Gridunova L.V. et al. Influence of chicken yolk immunoglobulins on the endurance of mice // Russian Journal of Immunology. 2019. Vol. 13. N. 2. P. 792–794. (In Russ.)].
-
Каплин В.С., Зайковская А.В., Каплина О.Н. и др. Куриные желточные антитела — перспективный препарат для иммунотерапии. В кн.: Дни иммунологии в Сибири: материалы XII Всероссийской научно-практической конференции с международным участием / Под ред. академика РАН, проф. В.А. Козлова, проф. С.В. Смирновой. Новосибирск, Красноярск, 2015. С. 93–94. [Kaplin V.S., Zaikovskaya A.V., Kaplina O.N. et al. Chicken yolk antibodies are a promising drug for immunotherapy. In: Days of Immunology in Siberia: Proceedings of the XII All-Russian Scientific and Practical Conference with International Participation / Ed. academician of the Russian Academy of Sciences, prof. V.A. Kozlova, prof. S.V. Smirnova. Novosibirsk, Krasnoyarsk, 2015. P. 93–94. (In Russ.)].
-
Patterson R., Youngner J.S., Weigle W.O. et al. Antibody production and transfer to egg yolk in chickens // J. Immunol. 1962. Vol. 89. P. 272–278. DOI: 10.4049/jimmunol.89.2.272.
-
Wu J.J., Huang D.B., Pang K.R. et al. Vaccines and Immunotherapies for the Prevention of Infectious Diseases Having Cutaneous Manifestations // J. Am. Acad. Der matol. 2004. Vol. 50. P. 495–528. DOI: 10.1016/j.jaad.2003.12.003.
-
Каплин В.С., Каплина О.Н. Применение IgY-технологии для профилактики и лечения кариеса, вызванного Streptococcus mutans // Современная стоматология. 2020. № 3 (80). С. 39–42. [Kaplin V.S., Kaplin O.N. The use of IgY technology for the prevention and treatment of caries caused by Streptococcus mutans // Modern dentistry. 2020. N. 3 (80). P. 39–42. (In Russ.)]. DOI: 10.30906/2073-8099-2020-12-4-22-26.
-
Levine M.M. Monoclonal antibody therapy for Ebola virus disease // New England Journal of Medicine. 2019. Vol. 381. P. 2365–2366. DOI: 10.1056/NEJMe1915350
-
Zhang Y., Wei Y., Li Y. et al. IgY antibodies against Ebola virus possess post-exposure protection in a murine pseudovirus challenge model and excellent thermostability // PLoS Neglected Tropical Diseases. 2021. Vol. 15. N. 3. P. e0008403. DOI: 10.1371/journal.pntd.0008403.
-
Jingchen W., Yunfei L., Ying R. et al. A chicken IgY can efficiently inhibit the entry and replication of SARS-CoV-2 by targeting the ACE2 binding domain in vitro // International Immunopharmacology. 2021. P. 1–28. DOI: 10.1101/2021.02.16.430255.
-
Shen H., Cai Y., Zhang H. et al. Anti-SARSCoV-2 IgY isolated from egg yolks of hens immunized with inactivated SARS-CoV-2 for monoprophylaxis of COVID-19 // Virologica Sinica. 2021. Vol. 36. P. 1080–1082. DOI: 10.1007/s12250-021-00371-1.
-
Ge S., Wu R., Zhou T. et al. X. Specific anti-SARS-CoV-2 S1 IgY-scFv is a promising tool for recognition of the virus // AMB Express. 2022. Vol. 12. N. 1. P. 1–12. DOI: 10.1186/s13568-022-01355-4.
-
Warr G.W. IgY: clues to the origins of modern antibodies / G.W. Warr, K.E. Magor, D.A. Higgins // Immunol. Today. 1995. Vol. 16. N. 8. P. 392–398. DOI: 10.1016/0167-5699(95)80008-5.
-
Чиоу Й-Нэн (ChIOU J-Nehn). Способ селективного выделения антител IgY из яичного желтка птиц отряда гусеобразных. Заявка 2002115256/13, 10.06.2002. Патент РФ 20.08.2007. [Chiou Y-Nen (ChIOU J-Nehn). A method for the selective isolation of IgY antibodies from the egg yolk of anseriformes. Application 2002115256/13, 06/10/2002. RF patent 20.08.2007. (In Russ.)].
-
Bando Y., Higgins D.A. Duck lymphoid organs: their contribution to the ontogeny of IgM and IgY // Immunology. 1996. Vol. 89. N. 1. P. 8–12. DOI: 10.1046/j.1365–2567.1996.d01-703.x
-
Ройтер Я., Кутушев Р. Селекция уток кросса «Агидель 34» // Животноводство России. 2019. № 3. С. 13–14. [Reuter Ya. and Kutushev R. Breeding of ducks of the cross “Agidel 34” // Animal husbandry of Russia. 2019. N. 3. P. 13–14. (In Russ.)]. DOI: 10.25701/ZZR.2019.68.46.004.
-
Chiou V.Y.N. The development of IgY (ΔFc) antibody based neuro toxin antivenoms and the study on their neutralization efficacies // Clinical toxicology. 2008. Vol. 46. N. 6. P. 539–544. DOI: 10.1080/15563650701771973.
-
Brocato R., Josleyn M., Ballantyne J. et al. DNA vaccine-generated duck polyclonal antibodies as a postexposure prophylactic to prevent hantavirus pulmonary syndrome (HPS) // PloS one. 2012. Vol. 7. N. 4. P. e35996. DOI: 10.1371/journal.pone.0035996.
-
Заболотников А.А. Справочник птицевода // Московский рабочий. 1978. C. 177–182. [Zabolotnikov A.A. Reference Poultry Breeder // Moscow Worker. 1978. P. 177–182. (In Russ.)].
-
Peyton J. The Magasine of Ducke and Geese. 1962. Vol. 13. N. 2. P. 1235–1239.
-
Зеленская К.В. Холмогорские гуси и их значение в развитии отечественного гусеводства // Труды НИИ птицеводства. 1948. Т. 20. С. 5–119. [Zelenskaya K.V. Kholmogory geese and their importance in the development of domestic goose breeding // Proceedings Research Institute of Poultry Breeding. 1948. Vol. 20. P. 5–119. (In Russ.)].
-
Williams K.L., Sukupolvi-Petty S., Beltramello M. et al. Therapeutic efficacy of antibodies lacking FcγR against lethal dengue virus infection is due to neutralizing potency and blocking of enhancing antibodies // PLoS pathogens. 2013. Vol. 9. N. 2. P. e1003157. DOI: 10.1371/journal.ppat.1003157.
-
Fink A.L., Williams K.L., Harris E. et al. Dengue virus specific IgY provides protection following lethal dengue virus challenge and is neutralizing in the absence of inducing antibody dependent enhancement // PLoS neglected tropical diseases. 2017. Vol. 11. DOI: 10.1371/journal.pntd.0005721.
-
O’Donnell K.L., Meberg B., Schiltz J. et al. Zika virus-specific IgY results are therapeutic following a lethal zika virus challenge without inducing antibody-dependent enhancement // Viruses. 2019. Vol. 11. P. 301. DOI: 10.3390/v11030301.
-
Haese N., Brocato R.L., Henderson T. et al. Antiviral biologic produced in DNA vaccine/goose platform protects hamsters against hantavirus pulmonary syndrome when administered post-exposure // PLoS neglected tropical diseases. 2015. Vol. 9. N. 6. P. e0003803. DOI: 10.1371/journal.pntd.0003803.
-
Kokoszyński D. Egg innovations and strategies for improvements // Academic Press. 2017. P. 33–43.
-
Тюнина Т., Куликов Л.В. Морфологическое строение яиц африканского страуса // Птицеводство. 2009. № 12. С. 37–38. [Tyunina T.Yu., Kulikov L.V. Morphological structure of the african ostrich eggs // Poultry farming. 2009. N. 12. P. 37–38. (In Russ.)].
-
Tsukamoto M., Hiroi S. et al. Antibodies against swine influenza virus neutralize the pandemic influenza virus A/H1N1 // Molecular medicine reports. 2011. Vol. 4. N. 2. P. 209–214. DOI: 10.3892/mmr.2011.410.
-
Tsukamoto Y., Hendler B. et al. The Efficacy of Ostrich Antibodies to Dihydrotestosterone and 5α-Reductase in the Restoration of Hair Growth // Health. 2019. Vol. 11. N. 10. P. 1320. DOI: 10.4236/health.2019.1110101.
- Price V.H., Menefee E., Strauss P. C. (1999). Changes in hair weight and hair count in men with androgenetic alopecia, after application of 5% and 2% topical minoxidil, placebo, or no treatment // Journal of the American Academy of Dermatology. 1999. Vol. 41. N. 5. P. 717–721. DOI: 10.1016/s0190-9622(99)70006‑x.




