Опыт применения хлопковых крыс для моделирования респираторно-синцитиальной вирусной инфекции и иммунопатологии
Исследование выполнено в рамках государственного контракта № 0373100122120000007 с ФГБУ «ЦСП» ФМБА России. Авторы выражают благодарность заведующей виварием Крыловой В.И. и сотрудникам вивария ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России за помощь в обеспечении особых условий содержания животных.
Сергеева М.В., Пулькина А.А., Штро А.А. , Васильев К.А., Романовская-Романько Е.А., Гаршинина А.В., Галочкина А.В., Мужикян А.А., Бузицкая Ж.В., Стукова М.А. Опыт применения хлопковых крыс для моделирования респираторно-синцитиальной вирусной инфекции и иммунопатологии. Лабораторные животные для научных исследований. 2022; 4. https://doi.org/10.57034/2618723X-2022-04-06
Резюме
Хлопковые крысы широко используются в мире в качестве экспериментальной животной модели в исследованиях вакцин и химиопрепаратов против респираторно-синцитиальной вирусной (РСВ) инфекции. Востребованность данной модели обусловлена тем, что хлопковые крысы более восприимчивы к заражению РСВ, чем большинство лабораторных линий мышей, а также несут функциональный набор генов, кодирующих белки Mx1 и Mx2, которые являются важнейшими компонентами врожденной системы противовирусной защиты человека. Несмотря на небольшой размер, хлопковые крысы сложны в содержании и при проведении манипуляций, поскольку они сохранили поведенческие реакции диких животных, избегают контакта и быстро передвигаются.
В этой статье мы обсуждаем препятствия на пути внедрения РСВ-модели хлопковых крыс в лабораторные исследования и представляем собственный опыт работы с этими животными. Наиболее длительным этапом был период времени, затраченный на переговоры с питомником и подготовку документов для получения животных. По прибытии хлопковых крыс (самки, возраст 6–8 нед) размещали в отдельном помещении вивария в индивидуальных клетках, снабженных стерилизованным подстилом. Животные быстро адаптировались к новым условиям и начали стабильно набирать массу тела с первых суток карантинного периода. Для моделирования РСВ-инфекции использовали две заражающие дозы вируса — 5 или 6 lg БОЕ/животное. Животным вводили вирус интраназально без наркоза или под ингаляционным наркозом (смесь изофлурана и пропиленгликоля). При этом инфекция без использования наркоза протекала бессимптомно в независимости от заражающей дозы вируса, хотя и сопровождалась продуктивной репликацией вируса главным образом в верхних дыхательных путях. Заражение животных под наркозом приводило к активной репликации вируса в легких, значительной потере массы тела и существенным повреждениям легких при использовании высокой заражающей дозы вируса. Иммунизация хлопковых крыс инактивированным формалином респираторно-синцитиальным вирусом привела к появлению классических маркеров усиления респираторной патологии в гистологических срезах легких и к снижению массы тела животных. Полученные результаты позволяют использовать отработанную модель хлопковых крыс для изучения защитных свойств и безопасности вакцин против РСВ-инфекции.
Введение
Экспериментальные модели респираторно-синцитиальной вирусной (РСВ) инфекции являются инструментом для понимания патогенеза заболевания и оценки безопасности и эффективности новых средств терапии и профилактики. В конце 1960‑х годов, в эпоху, предшествующую широкому использованию экспериментальных моделей, разработчики формалин-инактивированной вакцины против РСВ-инфекции (ФИ-РСВ) столкнулись с феноменом вакциноассоциированного усиления респираторного заболевания, которое имело трагические последствия для вакцинированных детей младшего возраста при встрече с РСВ-инфекцией [1]. Наблюдаемое явление впоследствии было смоделировано на животных и оказалось напрямую связано с развитием иммунопатологии [2], которая характеризовалась дисбалансом цитокинов и иммунного ответа по Th2/Th17‑типу, формированием ненейтрализующих антител, эозинофилией и нейтрофилией [3]. Особенностью РСВ-инфекции является отсутствие прямой связи между вирусной нагрузкой в респираторном тракте и тяжестью течения заболевания, которая в большей мере зависит от реакции иммунной системы на инфекцию [4], что существенно ограничивает использование тестов in vitro для разработки средств терапии и профилактики РСВ-инфекции. Некоторые исследования in vitro позволяют оценить отдельные компоненты развития иммунопатологической реакции как, например, профиль цитокинов, синтезируемых мононуклеарными клетками периферической крови при РСВ- инфекции в ответ на различные антигены [5]. Также описано исследование in vitro врожденного иммунного ответа на различные вакцины против РСВ с использованием дендритных клеток, полученных из моноцитов человека (moDC) и культуры аллогенных Т-клеток. Результаты исследования [6] в отношении баланса Т-клеточного ответа на вакцины были схожи с данными, полученными на моделях животных. В перечисленных случаях для моделирования использованы клетки взрослых доноров, уже контактировавших с РСВ в течение жизни, в то время как группу риска развития иммунопатологии составляют дети раннего возраста, не контактировавшие с РСВ [7]. Поэтому наиболее надежным способом, позволяющим оценить развитие вакциноассоциированного усиления патологии при РСВ-инфекции, остается использование нативных животных.
Хлопковые крысы, мыши, овцы, сирийские хомяки, шиншиллы, морские свинки, хорьки и нечеловекообразные приматы используются для моделирования РСВ-инфекции [8]. Из всех мелких животных хлопковые крысы (Sigmodon hispidus) наиболее восприимчивы к РСВ-инфекции и превосходят таковую у большинства лабораторных линий мышей, которые демонстрируют значительные вариации восприимчивости к РСВ от штамма к штамму [9]. При иммунизации хлопковых крыс ФИ-РСВ последующая инфекция вызывает у животных признаки иммунопатологии и вакцино-ассоциированного усиления респираторного заболевания, схожие с наблюдаемыми во время испытаний подобной вакцины у детей [10, 11]. Хлопковые крысы несут функциональный набор генов, кодирующих белки Mx1 и Mx2, которые являются важнейшими компонентами врожденной системы противовирусной защиты человека [12, 13], что особенно значимо при испытаниях интраназальной вакцины на основе аттенуированного гриппозного вектора, которая в большой степени направлена на активацию врожденного компонента иммунного ответа [14].
Цель данного исследования — воспроизведение и отработка параметров модели РСВ-инфекции и иммунопатологии на хлопковых крысах для последующего применения в изучении специфической активности векторной вакцины против РСВ.
Материал и методы
Экспериментальные животные
Хлопковые крысы (Sigmodon hispidus) самки, возраст 5–8 нед были получены из питомника Envigo Inc. (США) с соответствующим ветеринарным свидетельством. Животных содержали в условиях вивария в соответствии с ГОСТом 33215–2014 и СП 2.2.1.3218–14; все работы проводили согласно СП 1.3.2322–08 и документов «Правила проведения работ с использованием экспериментальных животных» и «Международные рекомендации (биоэтический кодекс) по проведению медико-биологических исследований с использованием животных». Процедуры, проводимые с животными, были одобрены Комиссией по биоэтике ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России (протокол № 21 от 29.06.20).
Животных содержали в индивидуальных автоклавируемых поликарбонатных клетках (BENEX а.с., Чешская Республика), тип Т3А, площадь 800 см2, в которых, помимо стерилизованного подстила Lignocell Wood Fibers (JRC, Германия), также размещали укрытие (цилиндр из ПВХ-трубы диаметром 11 см, стерилизация автоклавированием) и материал для гнездования (бумажные салфетки), необходимые для снижения уровня стресса у животных [15]. Животные получали без ограничений пищу, состоящую из смеси полноценного лабораторного корма (ООО «Лабораторкорм», Россия) и корма для хомяков (Versele-Laga, Бельгия). Животных обеспечивали чистой питьевой водой, полученной при помощи системы водоподготовки (Millipore RiOs 50, США), которую наливали в стандартные поилки со стальными крышками-носиками, и кормом ad libitum. Контроль параметров окружающей среды осуществляли ежедневно на всем протяжении исследования, включая контроль температуры и влажности. Фотопериод составлял 12 ч — ночь, 12 ч — день при искусственном освещении лампами дневного света. В период карантина (7 дней) и при экспериментальном заражении (7 дней) проводили ежедневный мониторинг массы тела животных.
Респираторно-синцитиальный вирус
В работе использовали респираторно-синцитиальный вирус серотипа А штамм А2 (РСВ A2), полученный из коллекции International Reagent Resource (США). Вирус накапливался в клетках НЕр-2 (ATCC, США). Инфекционную активность вируса определяли по количеству бляшкообразующих единиц (БОЕ) методом титрования в клетках HEp-2 в 24‑луночных культуральных планшетах (Nunc, Дания). Клетки заражали 10‑кратными разведениями вируссодержащего материала, инкубировали 1 ч при 37 °С, после чего вносили полужидкое покрытие, содержащее питательную среду c 0,3% агарозой (NBCo, США). Планшеты инкубировали 4 сут при температуре 37 °С, 5% СО2, затем клетки фиксировали 80% ацетоном и окрашивали моноклональными антителами 4F2 к белку F РСВ [16]. Подсчет количества бляшек проводили визуально. Титр рассчитывали как произведение усредненного числа бляшек на использованное разведение и выражали в десятичных логарифмах lg БОЕ/мл.
Иммунизация животных прототипом ФИ-РСВ
Для подготовки прототипа ФИ-РСВ вирус РСВ А2 накапливали в культуре клеток НЕр-2, затем инактивировали добавлением 1:4000 формалина (Вектон, Россия) в течение 72 ч при 37 °С. Далее проводили очистку вируса методом ультрацентрифугирования в роторе SW-41 (Beckman, США) в режиме 36 000 rpm (~190 000 g), 4 ч, при 4 °С через подушку из 30% сахарозы (Amresco, США). Концентрацию общего белка в очищенном инактивированном вирусе измеряли с использованием набора реагентов Quant-iT Protein Assay Kit и флуориметра Qubit 2.0 (Invitrogen, США). Для иммунизации животных готовили препарат, содержащий в одной дозе 10 мкг очищенного формалининактивированного вируса и 100 мкг адъюванта гидроксида алюминия (Sigma, США), разведенные в среде без сыворотки в общем объеме 100 мкл.
Иммунизацию хлопковых крыс прототипом ФИ-РСВ проводили за 5 нед до заражения, животным внутримышечно вводили 10 мкг очищенного инактивированного РСВ, адсорбированного на 100 мкг гидроксида алюминия в течение 4 ч при 4 °C.
Заражение животных
Экспериментальное заражение хлопковых крыс проводили интраназально двумя способами — без наркоза и под легким изофлурановым наркозом. Для проведения манипуляций животное обездвиживали путем V-образного захвата (рис. 1). В качестве наркоза использовали смесь изофлурана и пропиленгликоля [17]. Для заражения под наркозом переднюю часть головы хлопковой крысы помещали в стеклянный конус, в котором располагали два слоя марли — первый слой, смоченный смесью изофлурана и пропиленгликоля (1:1), и второй сухой слой, как описано в [18]. О действии наркоза судили по расслаблению и опусканию задних конечностей, после чего животное располагали горизонтально и вводили вируссодержащую жидкость в носовые ходы в объеме 100 мкл. При заражении без наркоза обездвиженному и горизонтально расположенному животному вводили интраназально 50 мкл вируссодержащего материала. После заражения ежедневно контролировали массу тела. Плановую эвтаназию животных проводили путем помещения в СО2‑бокс (VetTech Solutions Auto CO2 Workstation, США) и последующей цервикальной дислокации. Образцы тканей верхних и нижних дыхательных путей были получены на 4, 5 или 6‑й день после заражения и проанализированы на репродуктивность вируса. Также ткань легких подвергали гистопатологическому анализу.

Гистологическое исследование
Гистологическому анализу были подвергнуты парафиновые срезы легких хлопковых крыс, окрашенные гематоксилином и эозином. Полуколичественный анализ ткани легких был выполнен в двух вариантах со следующей оценкой степени повреждений: 0 — отсутствие; 1 — минимальные повреждения; 2 — незначительные; 3 — умеренные; 4 — выраженные; 5 — тяжелые. При этом визуально оценивали общий процент пораженной ткани легких на срезе, а также выраженность острого воспаления и инфильтрацию лимфоцитов отдельно для функциональных элементов ткани легкого — бронхиол, сосудов, интерстиция и альвеол. Суммарный индекс поражения рассчитывали как максимальный индекс, полученный при анализе различных элементов. Также оценивали наличие и выраженность следующих характерных изменений элементов ткани — гипертрофию и гиперплазию эпителия, атипию плоского эпителия, некроз эпителия (первые четыре признака оценивали отдельно для бронхов и бронхиол), гипертрофию пневмоцитов II типа, гиперемию межальвеолярной перегородки, альвеолярную эмфизему, альвеолярную геморрагию, бронхит, бронхиолит, перибронхит, перибронхиолит, инфильтрацию интерстиция, альвеолит, васкулит, периваскулит.
Морфометрическую оценку количества эозинофилов проводили не менее чем в 10 полях зрения от каждого образца при увеличении в 200 раз. Морфометрическую оценку количества бокаловидных клеток проводили путем подсчета количества клеток в пересчете на 1 мм2 эпителия воздухоносных путей. Для морфометрической оценки количества эозинофилов и бокаловидных клеток выбирали поля зрения с наибольшим количеством оцениваемых клеток.
Анализ данных
Статистический анализ первичных данных проводили в программных пакетах Microsoft Office Exсel 2010 (США) и GraphPad Prism v6.01 (США). Для графического представления динамики массы тела хлопковых крыс у каждого животного вычисляли относительное значение массы тела в процентах к массе в 1‑й день, затем вычисляли среднее арифметическое, стандартное отклонение (СО) и строили кривую зависимости группового среднего от дня после начала эксперимента. Для графического представления вирусной нагрузки использовали логарифмированные данные, представленные на точечных диаграммах.
Результаты и обсуждение
Получение и адаптация хлопковых крыс
Наиболее длительным этапом в работе с хлопковыми крысами был период времени, затраченный на переговоры с питомником и подготовку документов для получения животных, который в совокупности занял около 5 мес. По прибытии животных размещали в отдельном помещении вивария в индивидуальных клетках. Такой способ размещения связан с тем, что хлопковые крысы сохраняли поведенческие реакции диких животных, избегали контакта, быстро передвигались, что существенно затрудняло проведение манипуляций. Несмотря на стресс во время транспортировки, хлопковые крысы быстро адаптировались к новым условиям и начали стабильно набирать массу тела с первых суток карантинного периода. В период адаптации никаких отклонений в состоянии и поведении животных отмечено не было. За время 7‑дневного карантина масса тела хлопковых крыс в среднем увеличилась с 41±5 до 49±5 г (рис. 2, область выделена голубым).
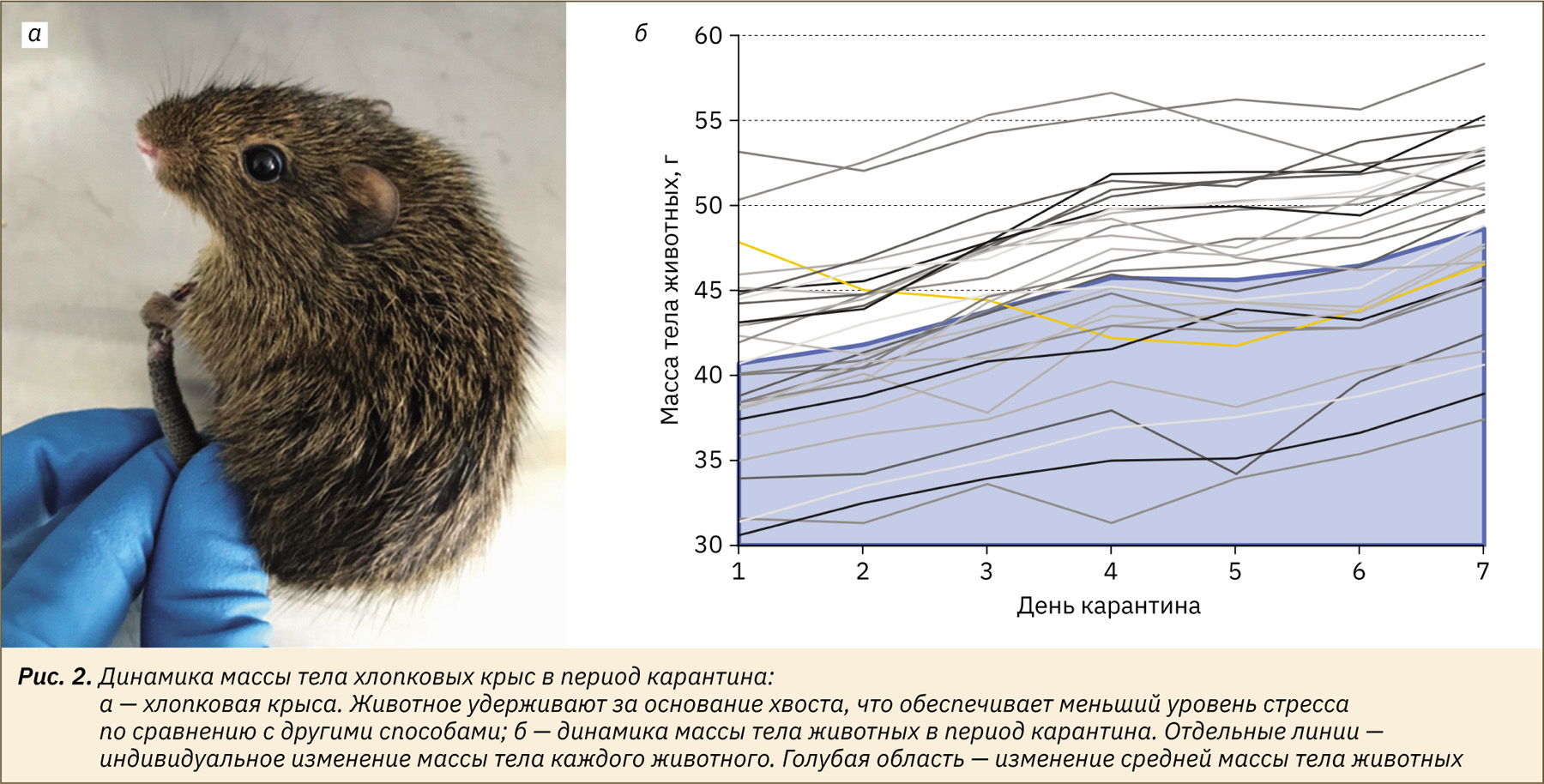
Подбор оптимальной инфекционной дозы РСВ при моделировании инфекции у хлопковых крыс
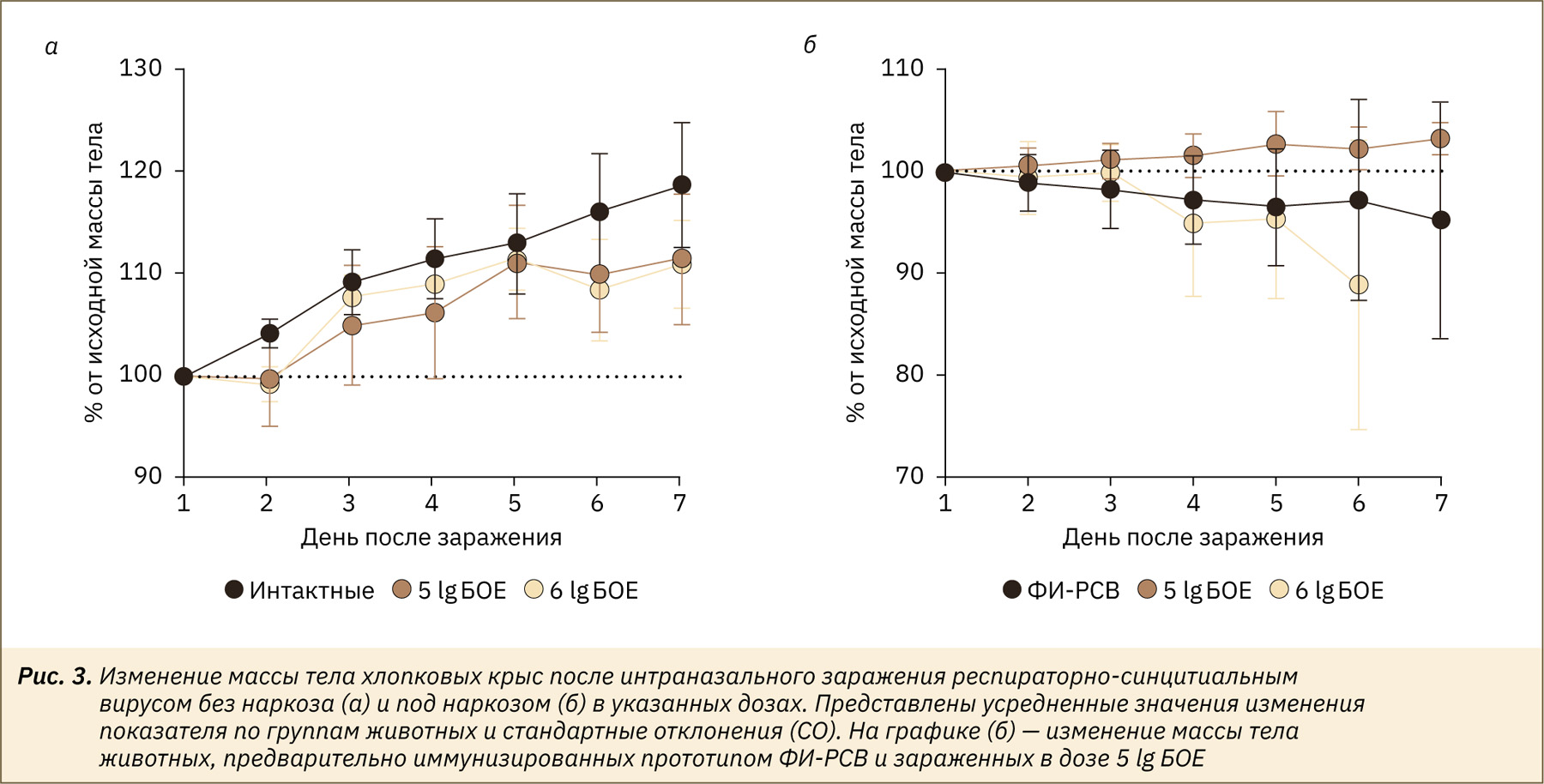
Для моделирования РСВ-инфекции проводили заражение хлопковых крыс двумя инфекционными дозами РСВ — 5 или 6 lg БОЕ/животное. Заражение проводили интраназально (см. рис. 2) без наркоза (по 4 животных на 1 экспериментальную точку) или под изофлурановым наркозом (по 3 животных на 1 точку). В течение 6 дней после заражения животных ежедневно взвешивали, на 4‑й и 6‑й день после заражения часть животных вскрывали, извлекали легкие, носовые ходы и трахею, в которых определяли наличие инфекционного вируса. Из соображений гуманности в высокой дозе под наркозом заражали только 2 животных, которых вскрыли на 5‑й день эксперимента.
По итогам наблюдения у животных, зараженных без наркоза, вне зависимости от инфекционной дозы наблюдали тенденцию к приросту массы тела, который, однако, был более медленным по сравнению с интактными животными. При этом максимальные различия между группами были зафиксированы на 6‑й день инфекции (рис. 3а). Инфекция под наркозом в дозе 5 lg БОЕ не отразилась на значениях массы тела хлопковых крыс (рис. 3б). В группе с высокой заражающей дозой вируса (6 lg БОЕ) наблюдали отрицательную динамику массы тела животных, достигшую 10% от исходного уровня к концу периода наблюдения (см. рис. 3б).
Выделение инфекционного вируса в носовых ходах было зафиксировано у всех животных, получивших РСВ без наркоза, на 4‑й день после заражения вне зависимости от заражающей дозы. Вирусовыделение из верхних дыхательных путей было на уровне 3–4 lg БОЕ/мл суспензии органа (рис. 4а). На 6‑й день после заражения вирус обнаружен в носовых ходах у 2 (из двух) животных, зараженных высокой дозой вируса (6 lg БОЕ/животное), и у 1 (из двух), зараженных низкой дозой (5 lg БОЕ/животное). В легких инфекционный вирус обнаружен только у 2 животных (в разные дни, разные дозы заражения), в трахее — только у 1 животного из группы с низкой заражающей дозой на 6‑й день. Выделение инфекционного вируса в носовых ходах зафиксировано у всех животных, получивших РСВ под наркозом, примерно на одном уровне, составляющем 3–4 lg БОЕ/мл суспензии ткани, вне зависимости от заражающей дозы (рис. 4б). У всех животных, зараженных в дозе 5 lg БОЕ, зафиксирован инфекционный вирус в нижних отделах респираторного тракта, — трахее и легких. У хлопковых крыс, зараженных в дозе 6 lg БОЕ, на 5‑е сутки после инфекции вирусовыделение из легких не отмечено или было на очень низком уровне, что, по‑видимому, связано с более ранним началом и высокой интенсивностью воспалительного процесса при заражении вирусом в высокой дозе.
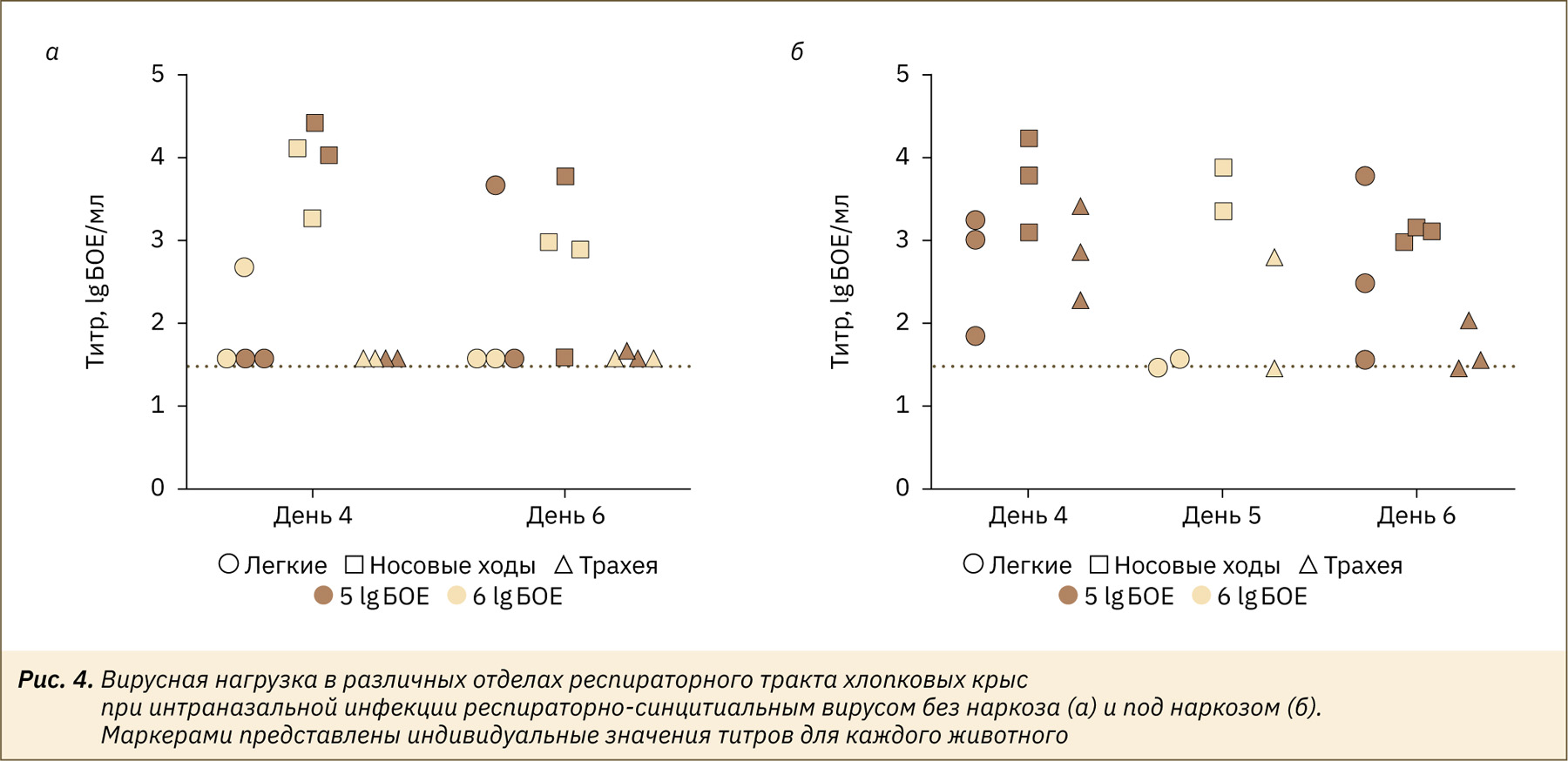
По итогам данного раздела можно заключить, что интраназальное введение вируса под наркозом необходимо для моделирования РСВ-инфекции в нижних дыхательных путях хлопковых крыс, так как заражение без наркоза приводит к вирусной репликации только в верхних дыхательных путях.
Патологические изменения в легких хлопковых крыс при заражении РСВ и вакциноассоциированном усилении инфекции
Для моделирования иммунопатологии на фоне РСВ-инфекции часть хлопковых крыс была иммунизирована прототипом ФИ-РСВ за 5 нед до заражения. После введения вируса в дозе 5 lg БОЕ у животных зарегистрировано снижение массы тела в среднем на 5% от исходного уровня в течение 6 дней (см. рис. 3б). При этом иммунизация прототипом ФИ-РСВ полностью предотвратила появление инфекционного вируса в нижних отделах респираторного тракта, а в носовых ходах вирус выделялся только на 4‑е сутки после заражения в среднем титре 3,5±1,2 lg БОЕ/мл. По данным аналогичных исследований, описанных в литературе [19], иммунизация хлопковых крыс оригинальным препаратом ФИ-РСВ (lot 100) приводила к частичному снижению вирусной нагрузки в легких животных. При этом до конца неясна доза РСВ-антигена, входящего в состав оригинального препарата, и исследователи оперируют разведениями исходного материала (1:25, 1:125), а не конечной концентрацией вирусного белка [10]. Однако для вакцин на основе рекомбинантных белков показана зависимость между вирусной нагрузкой в легких и дозой антигена. Так, например, иммунизация хлопковых крыс рекомбинантным белком F в дозе 0,5–5 мкг/животное полностью предотвращала репродукцию РСВ в легких [20, 21]. Можно предположить, что полное подавление вирусной нагрузки в нашем исследовании также связано с высокой дозой антигена, которая составляла 10 мкг ФИ-РСВ/животное.
Другая картина наблюдалась при гистологическом анализе срезов легких животных, привитых прототипом ФИ-РСВ и далее зараженных РСВ, по сравнению с непривитыми зараженными животными (рис. 5). Степень выраженности патологических изменений в легких непривитых крыс, зараженных под наркозом в дозе 5 lg БОЕ, была умеренной, проявлялась в незначительной смешанно-клеточной инфильтрации интерстициальной ткани и альвеолярных перегородок; наблюдалась гиперплазия бронхиального и бронхиолярного эпителия, сопровождавшаяся развитием слабо выраженного и умеренного бронхита. У крыс, иммунизированных прототипом ФИ-РСВ, степень выраженности и частота встречаемости отмеченных выше патологических изменений была выше, чем у контрольных животных. С большей частотой наблюдался альвеолит, сопровождавшийся накоплением в просвете альвеол клеток мононуклеарного ряда. В целом картина поражений совпадала с описанной ранее в литературе [20]. У животных группы ФИ-РСВ наблюдались тяжелые перибронхиальные и перибронхиолярные смешанно-клеточные инфильтраты с вовлечением в воспалительный процесс большого количества эозинофилов. Также регистрировалось утолщение интерстициальной ткани легких и альвеолярных перегородок с диффузно-очаговой полиморфно-клеточной воспалительной инфильтрацией, сопровождавшейся развитием выраженного альвеолита с накоплением в просвете альвеол большого количества альвеолярных макрофагов, лимфоцитов, в умеренном количестве дегенеративно-измененных и активированных нейтрофилов, эозинофилов с признаками частичной дегрануляции.
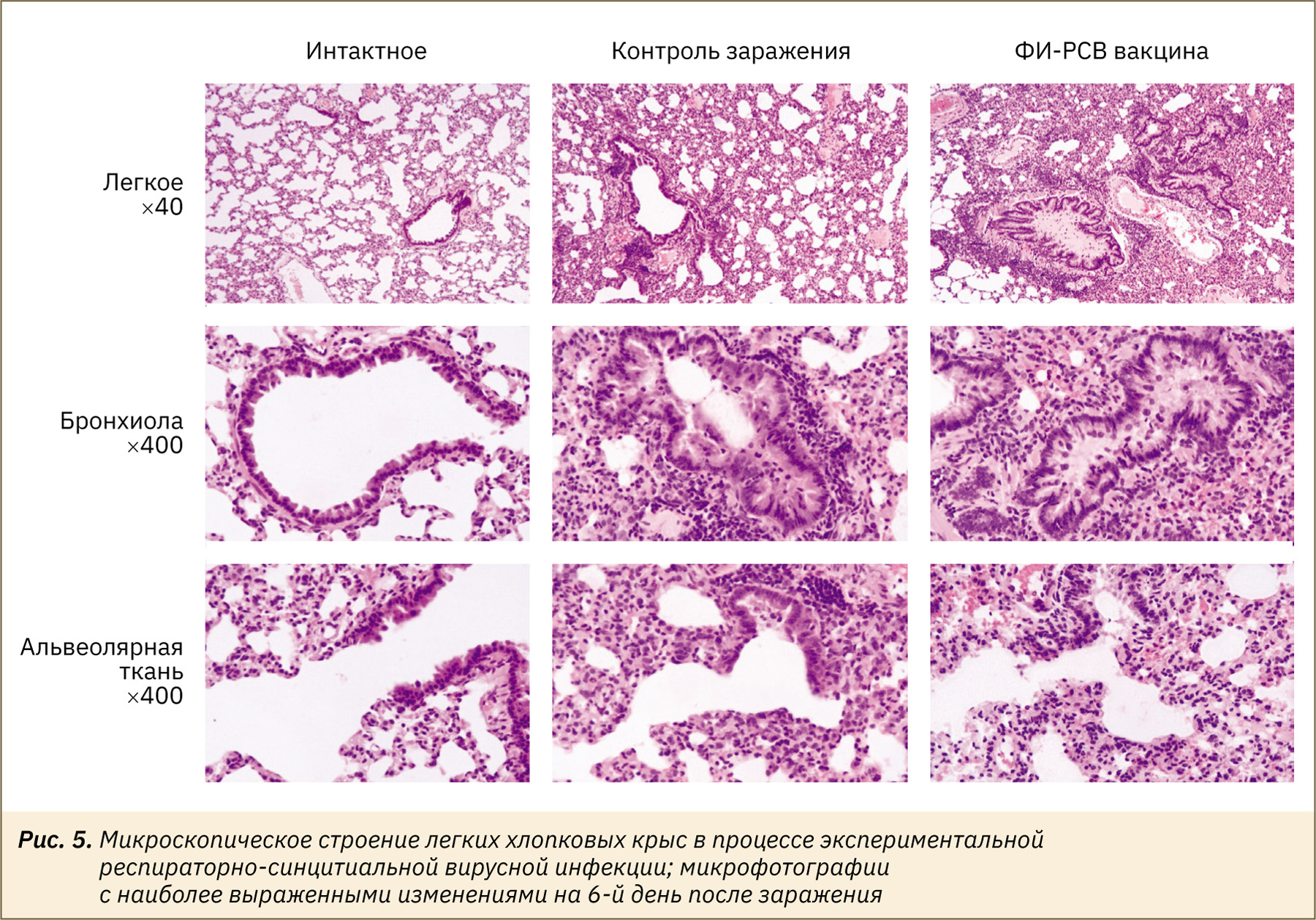
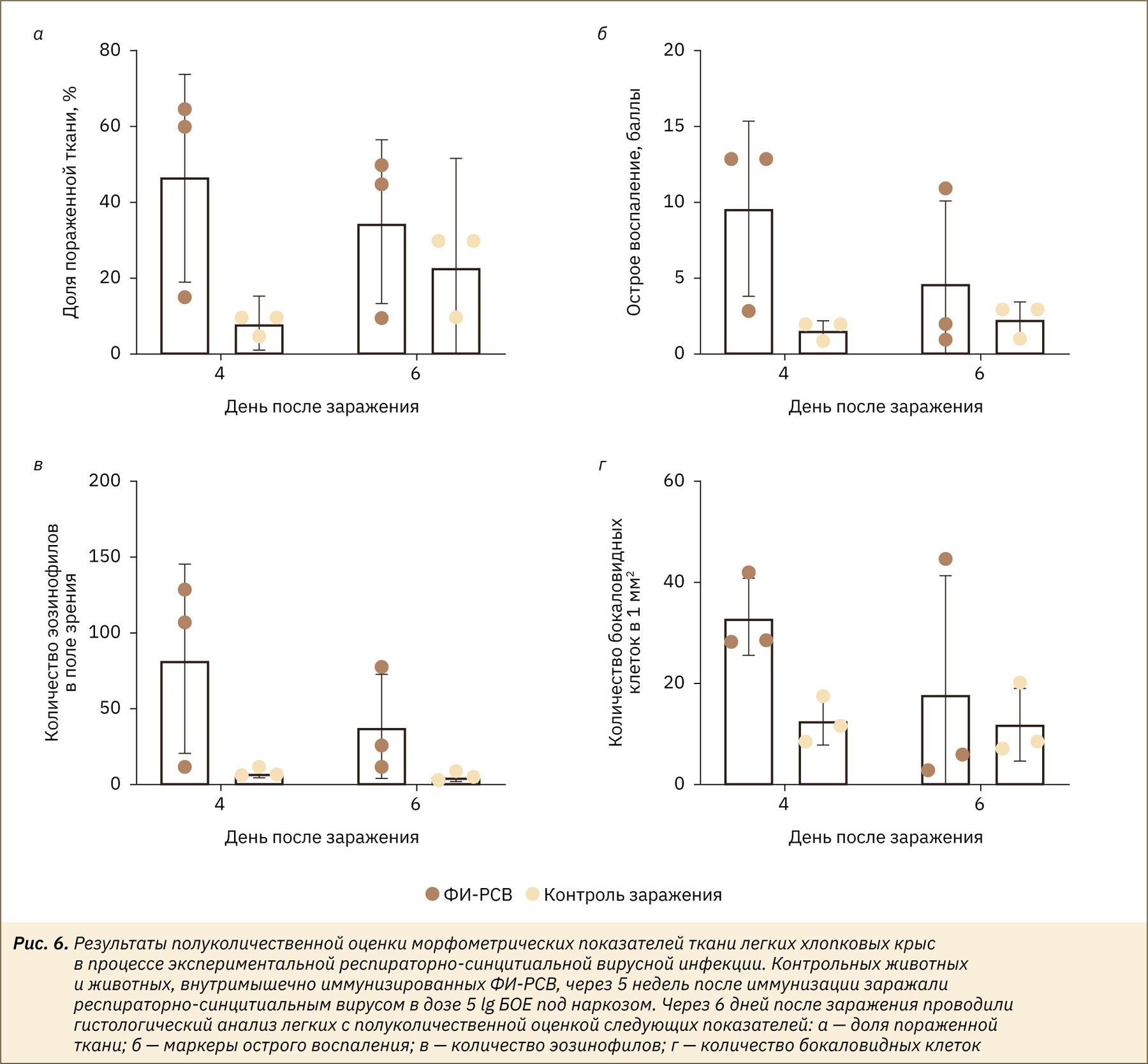
Проведенная полуколичественная оценка морфометрических показателей повреждения различных элементов ткани легких показала усиление респираторной патологии у животных, иммунизированных прототипом ФИ-РСВ, по сравнению с животными из группы контроля заражения (рис. 6а, б). У животных, привитых прототипом ФИ-РСВ, наблюдалось повышенное количество эозинофилов и бокаловидных клеток в ткани (рис. 6в, г), что является классическим маркером вакцино-ассоциированного усиления патологии при РСВ-инфекции [20]. В целом использованный подход (предварительная иммунизация хлопковых крыс прототипом ФИ-РСВ) позволил смоделировать эффект вакцино-ассоциированного усиления респираторной патологии при последующем заражении РСВ.
Обсуждение результатов
Модель респираторно-синцитиальной вирусной (РСВ) инфекции у хлопковых крыс была впервые описана в 1971 г. группой советских ученых, показавших высокую восприимчивость животных к респираторно-синцитиальному вирусу и развитие патологии в респираторном тракте [22]. Несколько лет спустя модель была воспроизведена в США и дополнена исследованиями зависимости тяжести инфекции от возраста животных [23, 24]. Позднее на данных животных удалось воспроизвести вакцино-ассоциированное усиление респираторной патологи при РСВ-инфекции [25], что определило выбор хлопковых крыс в качестве незаменимой модели при исследованиях данного эффекта.
Несмотря на давнюю историю и достоинства модели хлопковых крыс, применение этих животных имеет целый ряд ограничений. Хлопковые крысы сложны в содержании и при проведении манипуляций, поскольку сохранили поведенческие реакции диких животных, избегают контакта, быстро передвигаются, а также способны высоко прыгать [26]. В нашем опыте обучение обращению с животными занимало в среднем 2–3 дня на каждого оператора. Дополнительную сложность вносило отсутствие необходимых обучающих ресурсов на русском языке. Для освоения способов проведения манипуляций с хлопковыми крысами мы использовали ресурсы на английском языке [18, 26, 27], при этом критическое значение имели видеозаписи [15, 28].
Кроме того, существует лишь весьма ограниченное количество питомников хлопковых крыс. В России и Европе таких питомников в настоящее время нет. В связи с этим первые контакты с дистрибьютором хлопковых крыс были инициированы за год до эксперимента. Время от начала переговоров по соглашению до доставки хлопковых крыс из питомника Envigo Inc. (США) в виварий института составило около 5 мес, однако на длительность этого периода, очевидно, могла повлиять пандемия COVID-19.
Несмотря на описанные трудности, нам удалось получить хлопковых крыс, адаптировать их и воспроизвести у них инфекцию верхних и нижних дыхательных путей при интраназальном заражении РСВ. У большинства хлопковых крыс, зараженных без наркоза, экспериментальная инфекция была ограничена преимущественно верхней частью респираторного тракта и не приводила к появлению существенных микро- и макроскопических патологических изменений в легких независимо от заражающей дозы. При интраназальном заражении хлопковых крыс под наркозом наблюдаемые признаки инфекции были дозозависимыми, вирусовыделение наблюдалось как в верхней, так и в нижней части респираторного тракта, в легких выявлялись гистологические признаки поражения. Заражение в высокой дозе (6 lg БОЕ на животное) приводило к развитию выраженных макропоражений в легких и существенному ухудшению состояния животных. Предварительная иммунизация хлопковых крыс прототипом препарата формалин-инактивированной вакцины ограничивала репликацию вируса в респираторном тракте животных, однако приводила к усилению гистологических признаков поражения в легких, что свидетельствует о проявлении вакциноассоциированной иммунопатологии.
Заключение
В целом в рамках данного исследования успешно смоделирован инфекционный процесс при заражении хлопковых крыс респираторно-синцитиальным вирусом, в том числе воспроизведено вакциноассоциированное усиление респираторной патологии, что позволит использовать данную модель для изучения защитных свойств и безопасности вакцин против респираторно-синцитиальной вирусной инфекции.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
М.В. Сергеева — концепция и дизайн экспериментов, визуализация данных и подготовка текста рукописи, критический анализ полученных результатов.
А.А. Штро — концепция и дизайн экспериментов.
М.А. Стукова — концепция и дизайн экспериментов, редактирование рукописи.
А.А. Пулькина — культивирование и титрование вирусов, интерпретация результатов.
К.А. Васильев — манипуляции с животными, сбор первичных данных.
Е.А. Романовская-Романько — культивирование и титрование вирусов, интерпретация результатов.
А.В. Гаршинина — манипуляции с животными, сбор первичных данных.
А.В. Галочкина — манипуляции с животными, сбор первичных данных.
А.А. Мужикян — гистологический анализ.
Ж.В. Бузицкая — редактирование рукописи.
Список источников
-
Kim H.W., Canchola J.G., Brandt C.D. et al. Respiratory syncytial virus disease in infants despite prior administration of antigenic inactivated vaccine // Am. J. Epidemiol. 1969. Vol. 89. P. 422–434. DOI: 10.1093/oxfordjournals.aje.a120955.
-
Prince G.A., Jenson A.B., Hemming V.G. et al. Enhancement of respiratory syncytial virus pulmonary pathology in cotton rats by prior intramuscular inoculation of formalin-inactiva ted virus // J. Virol. 1986. Vol. 57. N. 3. P. 721–728. DOI: 10.1128/JVI.57.3.721-728.1986.
-
Bergeron H.C., Tripp R.A. Immunopathology of RSV: An Updated Review // Viruses. 2021. Vol. 10. N. 13 (12). P. 2478. DOI: 10.3390/v13122478.
-
Openshaw P.J., Tregoning J.S. Immune responses and disease enhancement during respiratory syncytial virus infection // Clin. Microbiol. Rev. 2005. Vol. 18. N. 3. P. 541–555. DOI: 10.1128/CMR.18.3.541-555.2005.
-
Jackson M., Scott R. Different patterns of cytokine induction in cultures of respiratory syncytial (RS) virus-specific human TH cell lines following stimulation with RS virus and RS virus proteins // J. Med. Virol. 1996. Vol. 49. N. 3. P. 161–169. DOI: 10.1002/(SICI)1096-9071(199607)49:3<161::AID-JMV2>3.0.CO;2-2.
-
Chirkova T., Ha B., Rimawi B.H. et al. In vitro model for the assessment of human immune responses to subunit RSV vaccines // PLoS One. 2020. Vol. 19. N. 15 (3). P. e0229660. DOI: 10.1371/journal.pone.0229660.
-
Anderson L.J., Dormitzer P.R., Nokes D.J. et al. Strategic priorities for respiratory syncytial virus (RSV) vaccine development // Vaccine. 2013. Vol. 18. N. 31 (Suppl 2). P. B209–215. DOI: 10.1016/j.vaccine.2012.11.106.
-
Taylor G. Animal models of respiratory syncytial virus infection // Vaccine. 2017. Vol. 35. N. 3. P. 469–480. DOI: 10.1016/j.vaccine.2016.11.054.
-
Boukhvalova M.S., Yim K.C., Blanco J. Cotton rat model for testing vaccines and antivirals against respiratory syncytial virus // Antivir. Chem. Chemother. 2018. Vol. 26. P. 1–13. DOI: 10.1177/2040206618770518.
-
Prince G.A., Curtis S.J., Yim K.C., Porter D.D. Vaccine-enhanced respiratory syncytial virus disease in cotton rats following immunization with Lot 100 or a newly prepared reference vaccine // J. Gen. Virol. 2001. Vol. 82. N. 12. P. 2881–2888. DOI: 10.1099/0022‑1317‑82‑12‑2881.
-
Muralidharan A., Li C., Wang L., Li X. Immunopathogenesis associated with formaldehyde-inactivated RSV vaccine in preclinical and clinical studies // Expert Rev Vaccines. 2017. Vol. 16. N. 4. P. 351–360. DOI: 10.1080/14760584.2017.1260452.
-
Pletneva L.M., Haller O., Porter D.D., Prince G.A., Blanco J.C. Interferon-inducible Mx gene expression in cotton rats: cloning, characterization, and expression during influenza viral infection // J. Interferon Cytokine Res. 2006. Vol. 26. N. 12. P. 914–921. DOI: 10.1089/jir.2006.26.914.
-
Pletneva L.M., Haller O., Porter D.D., Prince G.A., Blanco J.C.G. Induction of type I interferons and interferon-inducible Mx genes during respiratory syncytial virus infection and reinfection in cotton rats // J. Gen. Virol. 2008. Vol 89. Pt 1. P. 261–270. DOI: 10.1099/vir.0.83294-0.
-
Vasilyev K.A., Yukhneva M.A., Shurygina A.‑P.S., Stukova M.A., Egorov A.Y. The enhancement of influenza A virus immunogenicity by the inhibition of the immunosuppressive function of NS1 protein // MIR J. 2018. Vol. 5. N. 1. P. 48–58. DOI: 10.18527/2500‑2236‑2018‑5‑1‑48‑58.
-
Cuddington B., Verschoor M., Mossman K. Handling of the cotton rat in studies for the pre-clinical evaluation of oncolytic viruses // J. Vis. Exp. 2014. Vol. 93. P. e52232. Published 2014 Nov 24. DOI: 10.3791/52232.
-
Кривицкая В.З., Петрова Е.Р., Сорокин Е.В. и др. Получение и характеристика моноклональных антител, специфичных к респираторно-синцитиальному вирусу // Биотехнология. 2016. Т. 32. № 1. С. 65–75. [V.Z. Krivitskaya, E.R. Petrova, E.V. Sorokin et al. Design and Characteristics of Monoclonal Antibodies Specific to Respiratory Syncytial Virus // Biotekhnologiya. 2016. Vol. 32. N. 1. P. 65–75. DOI: 10.21519/0234‑2758‑2016‑1‑65‑75 (In Russian)].
-
Nagate T., Chino T., Nishiyama C. et al. Diluted isoflurane as a suitable alternative for diethyl ether for rat anaesthesia in regular toxicology studies // J. Vet. Med. Sci. 2007. Vol. 69. N. 11. P. 1137–1143. DOI: 10.1292/jvms.69.1137.
-
Division of Laboratory Animal Resources. UK Research. Open-Drop or Nose Cone Method of Isoflurane Anesthesia in Mice and Rats. Electronic resource: https://www.research.uky.edu/division-laboratory-animal-resources/open-drop-or-nose-cone-method-isoflurane-anesthesia-mice-and. Access free, 10.09.2020.
-
Boukhvalova M.S., Prince G.A., Blanco J.C. The cotton rat model of respiratory viral infections // Biologicals. 2009. Vol. 37. N. 3. P. 152–159. DOI: 10.1016/j.biologicals.2009.02.017.
-
Murphy B.R., Sotnikov A.V., Lawrence L.A., Banks S.M., Prince G.A. Enhanced pulmonary histopathology is observed in cotton rats immunized with formalin-inactivated respiratory syncytial virus (RSV) or purified F glycoprotein and challenged with RSV 3–6 months after immunization // Vaccine. 1990. Vol. 8. N. 5. P. 497–502. DOI: 10.1016/0264-410x(90)90253‑i.
-
Schneider-Ohrum K., Cayatte C., Bennett A.S. et al. Immunization with Low Doses of Recombinant Postfusion or Prefusion Respiratory Syncytial Virus F Primes for Vaccine-Enhanced Disease in the Cotton Rat Model Independently of the Presence of a Th1‑Biasing (GLA-SE) or Th2‑Biasing (Alum) Adjuvant // J. Virol. 2017. Vol. 29. N. 91 (8). P. e02180–16. DOI: 10.1128/JVI.02180-16.
-
Дрейзин Р.С., Вышневецкая Л.О., Багдамян Е.Ф. и др. Изучение экспериментальной РС вирусной инфекции в хлопковых крысах. Вирусологические и иммунофлуоресцентные исследования // Вопросы вирусологии. 1971. Т. 16. С. 670–676. [Dreizin R.S., Vyshnevetskaia L.O., Bagdamian E.F. et al. Experimental RS virus infection of cotton rats. A viral and Immunofluorescent study // Voprosy Virusologii. 1971. Vol. 16. P. 670–676. (In Russ.)].
-
Prince G.A., Jenson A.B., Horswood R.L., Camargo E., Chanock R.M. The pathogenesis of respiratory syncytial virus infection in cotton rats // Am. J. Pathol. 1978. Vol. 93. N. 3. P. 771–791.
-
Prince G.A., Horswood R.L., Berndt J., Suffin S.C., Chanock R.M. Respiratory syncytial virus infection in inbred mice // Infect. Immun. 1979. Vol. 26. N. 2. P. 764–766. DOI: 10.1128/IAI.26.2.764-766.1979.
-
Prince G.A., Jenson A.B., Hemming V.G. et al. Enhancement of respiratory syncytial virus pulmonary pathology in cotton rats by prior intramuscular inoculation of formalin-inactivated virus // J. Virol. 1986. Vol. 57. N. 3. P. 721–728. DOI: 10.1128/JVI.57.3.721-728.1986.
-
Niewiesk S., Prince G. Diversifying animal models: the use of hispid cotton rats (Sigmodon hispidus) in infectious diseases // Lab. Anim. 2002. Vol. 36. N. 4. P. 357–372. DOI: 10.1258/002367702320389026.
-
Green M.G., Huey D., Niewiesk S. The cotton rat (Sigmodon hispidus) as an animal model for respiratory tract infections with human pathogens // Anim. (NY). 2013. Vol. 42. N. 5. P. 170–176. DOI: 10.1038/laban.188.
- Hanson J.M., Anderson L.J., Williams C.M., Jorquera P., Tripp R.A. Passive narcosis for anesthesia induction in cotton rats (Sigmodon hispidus) // Lab. Anim. (NY). 2016. Vol. 23. N. 45 (9). P. 333–337. DOI: 10.1038/laban.1084.




