Определение содержания бактерий рода Bacillus в корме и фекалиях лабораторных мышей при содержании в стерильных и нестерильных условиях
Морозова М.В., Калмыкова Г.В., Акулова Н.И., Литвинова Е.А. Определение содержания бактерий рода Bacillus в корме и фекалиях лабораторных мышей при содержании в стерильных и нестерильных условиях. Лабораторные животные для научных исследований. 2021; 3. https://doi.org/10.29296/2618723X-2021-03-02
Резюме
В настоящее время эталон содержания лабораторных животных – барьерные виварии со стерильными условиями содержания и кормления. Однако такие условия не естественны и могут быть вредны для животных, поскольку лишают их пробиотической нагрузки бактерий-космополитов Bacillus spp. Эти бактерии не являются представителями естественной микрофлоры, населяющей кишечник, а попадают в него при случайном поедании, поскольку в окружающей среде они не редки. При иссякании источника Bacillus spp. кишечник естественным образом от них очищается, т.е. бактерии Bacillus spp. не колонизируют кишечник млекопитающих. В настоящее время накоплен большой массив данных о положительном действии представителей Bacillus spp. на пищеварение, устойчивость к бактериальным и вирусным инфекциям, репродуктивное здоровье животных и человека. Разработаны пробиотические препараты для ветеринарии и медицины на основе Bacillus spp. Наиболее распространены пищевые пробиотические добавки на основе B. subtilis и B. licheniformis. В данной работе мы исследовали неавтоклавированные и автоклавированные корма и подстил лабораторных мышей на наличие бактерий рода Bacillus как фактора, влияющего на благополучие и здоровье лабораторных животных. Было установлено, что неавтоклавированный корм для грызунов содержит 103 спор/г, а фекалии животных, поедающих неавтоклавированный корм, –104 спор/г. Стерильный подстил, автоклавированный корм, а также фекалии от животных, питающихся автоклавированным кормом, не содержали ни вегетативных, ни споровых форм Bacillus spp. ПЦР с праймерами к гену 16S рибосомальной РНК бактерий показал наличие бактериальной ДНК в неавтоклавированном корме и сильную деградацию бактериальной ДНК в автоклавированном. Таким образом, животные, потребляющие неавтоклавированный корм, имеют пробиотическую нагрузку в виде представителей Bacillus spp. в основном в споровой форме. Мыши, содержащиеся в стерильных условиях, лишены положительного влияния метаболитов представителей рода Bacillus. Активация иммунной системы у этих животных также снижена из-за фрагментации бактериальной ДНК.
Данная работа может быть полезна специалистам при принятии решения о необходимости поддержания стерильности корма для содержания лабораторных животных, а также для разработки и внедрения пробиотических бактериальных культур в рацион лабораторных животных в условиях барьерного содержания.
Введение
Лабораторных животных в научных исследованиях используют с конца ХIX века, однако регламент гуманного содержания лабораторных животных начал оформляться только во второй половине ХХ века с формулирования концепции 3R: замещение (replacement), сокращение (reduction), усовершенствование (refinement). Эталоном содержания животных в настоящее время считаются барьерные виварии, в которых содержатся SPF (свободные от патогенов) животные в условиях, соответствующих рекомендациям ECVAM, FELASA, OECD, FDA, EPA и др. Для этого в вивариях организованы «чистые» и «грязные» зоны и определены потоки движения персонала и оборудования. Для содержания животных и снижения риска контаминации используют системы с индивидуальной вентиляцией клеток, а также стерильный подстил, корм, воду и клетки. Стерилизацию осуществляют, используя автоклавирование, облучение гамма-лучами, обработку парами перекиси водорода или газом. Однако небольшие институты и лаборатории часто используют для содержания животных конвенциональные или улучшенные конвенциональные виварии, где животных содержат в открытых клетках, разделение зон по чистоте и потоки движения соблюдены условно или вообще не соблюдены, стерильность оборудования, корма и подстила не предусмотрена. Тем не менее риск заражения животных патогенами через корм минимален, так как в вивариях используют специальный корм промышленного производства. При этом велика вероятность наличия в корме бактерий рода Bacillus, поскольку они являются космополитами и распространены повсеместно. Многолетняя история изучения представителей Bacillus spp. показала, что они важны для нормальной работы пищеварительной и иммунной систем, оказывая противовоспалительное, антиоксидантное, иммуномодулирующее и антимикробное действие [1], а также могут повышать репродуктивные способности как самок, так и самцов [2].
Созданная искусственная среда, свободная от любых микроорганизмов, не является естественной для животных. Зная, что многие представители Bacillus spp. встречаются в почве и растениях, то можно предположить, что природные кормовые базы Mus musculus содержат достаточное количество представителей этого рода на протяжении всего периода сосуществования. Это может означать, что многие физиологические и метаболические процессы мышей обязательно связаны с метаболитами Bacillus spp. Стерильность в барьерных вивариях, включая корма, может дать негативный эффект на здоровье и благополучие лабораторных животных. Особенно это касается различного рода трансгенных животных с нарушением иммунных процессов или недостатком ферментов, участвующих в пищеварении. Именно роль Bacillus spp. в формировании иммунитета и пищеварения привела к созданию пробиотиков на их основе. Наиболее часто в качестве пробиотиков используются B. subtilis [3] и B. licheniformis, менее известные – B. clausii, B. pumilus, B. coagulans и некоторые B. сereus [4].
Таким образом, цель данного исследования – изучить содержание Bacillus spp. как пробиотического микроорганизма в корме и подстиле у мышей, содержащихся в условиях барьерных и улучшенных конвенциональных вивариев. Для достижения этой цели были поставлены задачи исследовать автоклавированные и неавтоклавированные корма, подстил, а также фекалии мышей, содержащихся на стерильных и нестерильных кормах и подстиле.
Материал и методы
В качестве объекта исследования был взят корм Дельта Фидс «Корм для лабораторных крыс и мышей категории разведение» (Р-22, БиоПро, Россия). Условия автоклавирования: давление 2 атм, температура 132оС, время 30 мин, автоклав GE 91415 AR-2 (Getinge Sterilization AB, Швеция).
Фекалии были собраны от 12–13-недельных мышей линии С57BL/6, из Российского национального центра генетических ресурсов лабораторных животных на базе SPF-вивария Института цитологии и генетики СО РАН, содержащихся в условиях барьерного вивария (индивидуально-вентилируемые клетки, автоклавированные корм и подстил), и от этих же животных через 2 нед содержания в условиях улучшенного конвенционального вивария (открытые клетки, неавтоклавированные корм и подстил) сектора разведения экспериментальных животных Научно-исследовательского института нейронаук и медицины (НИИНМ). В обоих вивариях животные содержались по 3–4 особи в группах, доступ к корму и воде не ограничивался, температура поддерживалась на уровне 22–24°C, настройка светового режима 14/10 ч. Все животные проходили ежеквартальную проверку на отсутствие патогенов, рекомендованных для мониторинга FELASA 2014. Работа с животными была одобрена локальным этическим комитетом НИИНМ (выписка из Протокола от 11.03.21 № 3). После проведения данного исследования все животные были использованы для других научных задач.
Определение общего количества спорообразующих бактерий в образцах корма и фекалий мышей проводили высевом на Dextrose Casein-peptone agar (Merck, Германия). Образцы готовили в 3 повторах: 10 г корма вносили в 90 мл стерильного физиологического раствора или 100 мг фекалий мышей – в 0,9 мл стерильного физиологического раствора; 500 мкл гомогенизированного раствора корма или фекалий высевали на чашку Петри. Удаление вегетативных форм бактерий осуществляли прогреванием суспензии в течение 15 мин при 85°C.
Концентрацию спор и вегетативных форм бактерий или только спор после прогрева определяли методом посева в серийных разведениях по ГОСТу 26670-91 «Продукты пищевые. Методы культивирования микроорганизмов». Посевы на чашках Петри инкубировали в термостате ТСО-1/80 при 36±1°С. Через 48 ч подсчитывали число выросших колоний.
Лецитиназную активность – дифференцирующий признак бактерий Bacillus cereus определяли точечным посевом изолированных колоний на среду Донована (ТУ 9229-163-00419785-98). Положительная реакция – образование зоны матового коагулята и просветления вокруг колонии.
Спорообразование у отобранных по морфологическим признакам изолятов подтверждали микроскопией после окрашивания метиленовой синью на микроскопе Olympus BX46 (Olympus Corp., Япония).
ДНК выделяли из автоклавированного и неавтоклавированного корма с помощью QIAamp DNA Stool Mini Kit (Qiagen, Hilden, Германия) согласно рекомендациям производителя. Общее количество бактериальной ДНК определяли по участку гена 16S rRNA методом полимеразной цепной реакции (ПЦР) в реальном времени с помощью BioMaster HS-qPCR SYBR Blue (BioLabMix, Новосибирск, Россия), 5 мкл ДНК из корма и 300 нмоль/л специфического праймера (16S rRNA: F-TCCTACGGGAGGCAGCAG, R-ATTACCGCGGCTGCTGG). Положительный контроль – ДНК из фекалий, отрицательный – деионизированная вода (Milli-Q тип I, Merck Millipore, Германия). ДНК денатурировали в течение 5 мин при 95°C, а затем амплифицировали в 45 циклах денатурации при 95°C в течение 15 с, отжиг праймеров и синтез ДНК осуществляли при 62°C в течение 50 с.
Обработку полученных данных проводили с помощью пакета статистических программ Statistica 10.0. (США, StatSoft). Все данные представлены как среднее ± стандартная ошибка среднего (SEM).
Результаты и обсуждение
Роста бактерий с образцов подстила обоих типов (до и после стерилизации) и автоклавированного корма не за-фиксировано. Количество спор и вегетативных форм бактерий рода Bacillus в неавтоклавированном корме и фекалиях от мышей, потребляющих неавтоклавированный корм, составило 2,14±0,32•103 и 1,80±0,25•104 КОЕ/г соответственно. В тех же образцах корма и фекалий количество только спор было 4,87±0,41•103 спор/г и 2,00±0,42•104 спор/г соответственно (рис. 1). В составе нормальной микрофлоры мышей, которые потребляют стерильный корм, ни споры, ни вегетативные формы бактерий рода Bacillus не обнаружены.
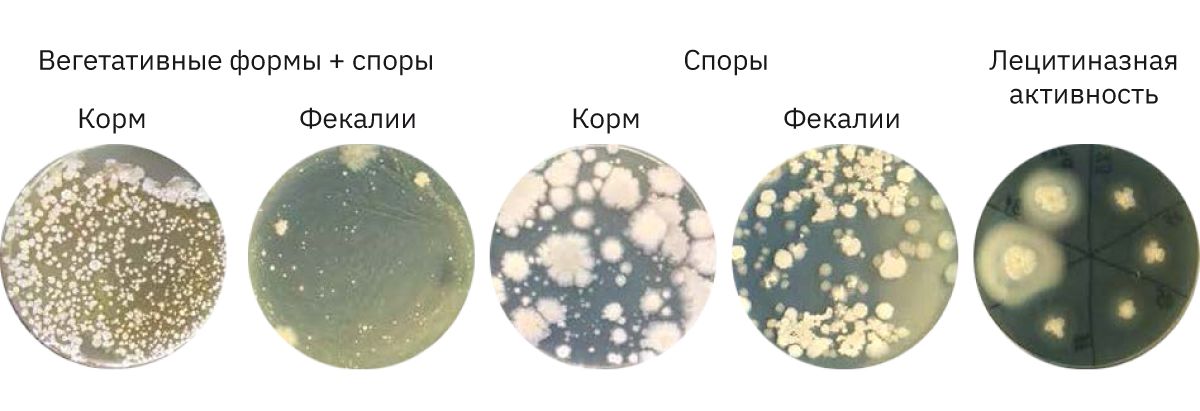
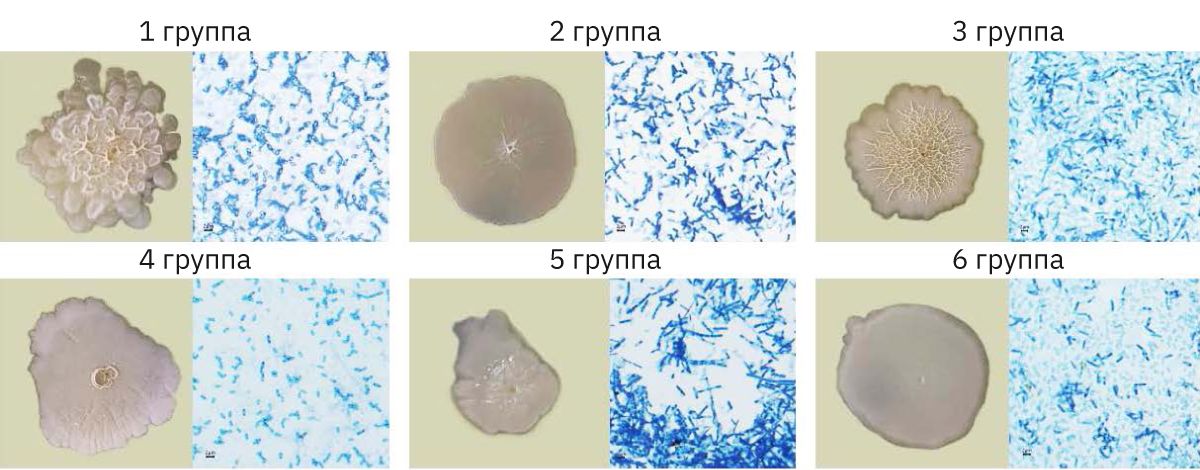
Рассев 36 изолированных бактериальных колоний, полученных из образцов неавтоклавированного корма и фекалий, и микроскопический анализ подтвердили, что все отобранные колонии способны образовывать споры. По морфологии колоний изоляты были разделены на 6 групп: 1-я – крупные колонии диаметром >12 мм со складчатым центром и слизистыми краями в виде накладывающихся лепестков; 2-я – округлые диаметром до 20 мм сероватые плоские матовые колонии с радиальными морщинками; 3-я – белые с фестончатым краем морщинистые с мелкими радиальными складками колонии диаметром до 15 мм; 4-я – крупные 25 мм в диаметре белые с волнистым краем и кратерообразным центром колонии; 5-я – небольшие белые колонии диаметром 10 мм округлые или неправильной формы плоские со слабым блеском; 6-я – одна колония белая диаметром 30 мм с ровным краем, блестящей сметанообразной поверхностью (рис. 2). Таким образом, было показано, что во всех образцах корма и фекалий присутствовали спорообразующие бактерии первых трех морфологических групп, только бактерии 4-й группы обнаружены в образцах фекалий мышей; бактерии 5-й группы выявлены в вегетативной форме в корме и фекалиях, а 6-й – в вегетативной форме в корме. Род Bacillus объединяет обширную группу строго аэробных или факультативно-анаэробных грамположительных хемоорганотрофных микроорганизмов палочковидной формы, образующих термоустойчивые эндоспоры. С учетом использования предпочтительной для Bacillus spp. среды, морфологии колоний, способности образовывать споры, устойчивые к прогреванию, мы заключили, что в неавтоклавированном корме присутствуют представители рода Bacillus. Полагаем, что корм – основной источник Bacillus spp. для лабораторных животных, поскольку в подстиле бактерий не обнаружено. Так как с нестерильного корма рост колоний Bacillus spp. составил примерно 5•103 спор/г, то считаем, что половозрелая мышь, съедая 4 г корма в сутки, потребляет около 24•103 спор. Соответственно животные, содержащиеся в стерильных условиях, лишены этой пробиотической нагрузки.
Обнаружение Bacillus в гранулах корма не удивительно, поскольку они способны колонизировать различные среды, включая водную [5]. В состав использованного корма входят зерновые и молочные компоненты. Наиболее распространенными видами Bacillus, обнаруживаемыми в молоке, на всех этапах обработки являются B. Licheniformis и B. сereus [6]. Bacillus из почвы может приникать в растительные органы зерна, поэтому продукты из переработанного зерна тоже содержат представителей рода Bacillus. Так, в панировочных сухарях выявляли B. subtilis, B. licheniformis, B. cereus и изоляты B. clausii и B. firmus [7].
Проверка 36 бактериальных изолятов для определения лецитиназной активности показала, что 3 изолята из 13, выделенных из корма, 1 изолят из 9 колоний, выделенных из фекалий мышей, давали большую зону помутнения среды вокруг колоний, а 2 других из тех же фекалий – небольшую зону слабого помутнения. Такую же зону давали 2 изолята из 9 колоний спор, полученных из фекалий. В изолятах из прогретого корма помутнения среды вокруг колоний спор не обнаружено (см. рис. 1). Это свидетельствует о присутствии в корме вегетативных форм Bacillus, которые обладают лецитиназной активностью. Полученные данные говорят о том, что в корме и фекалиях присутствуют B. cereus, что ожидаемо, поскольку эти бактерии обнаруживаются в небольших количествах повсеместно [8]. Среди B. cereus встречаются штаммы, вырабатывающие токсины и вызывающие отравления, но некоторые не вырабатывают токсины и являются пробиотическими. В случае токсичных штаммов количество бактерий для отравления должно составлять ≥105–108 КОЕ/г [9], у нас в корме всех бактерий было 103 КОЕ/г.
Таким образом, возможные преобладающие микроорганизмы из рода Bacillus, обсеменяющие корм для лабораторных животных, это: B. subtilis, B. licheniformis и B. cereus. Эти микроорганизмы являются пробиотическими, и препараты на их основе используются в ветеринарии и медицине [10].
Представители рода Bacillus в норме не колонизируют кишечный тракт млекопитающих, а являются аллохтонными микроорганизмами, которые попадают туда в результате либо случайного поедания, либо осознанного употребления. Показано, что споры B. subtilis (PY79) и B. indicus остаются жизнеспособными после попадания в желудочный и кишечный соки в отличие от чувствительных к таким факторам вегетативных форм [11]. Споры бактерий могут достигнуть тощей и подвздошной кишок и там прорасти. Показано, что B. subtilis может пройти весь свой жизненный цикл от спор к вегетативным клеткам и снова в споры в желудочно-кишечном тракте [12]. Однако если животное перестает употреблять B. subtilis и B. indicus, то через 14 дней представители данного рода полностью элиминируют [11]. Таким образом, для поддержания пробиотического эффекта животные должны регулярно получать с кормом бактерии рода Bacillus.
Пробиотические микроорганизмы оказывают воздействие на организм хозяина, участвуя в метаболизме и активируя иммунную систему. Очевидно, что животные, содержащиеся в стерильных условиях, лишены влияния метаболитов этих бактерий. Для активации иммунной системы необходимы составляющие бактериальной стенки (полисахариды, белки) и ДНК. Известно, что бактериальная ДНК может модулировать иммунный ответ хозяина, снижая воспаление [13]. Автоклавирование приводит к серьезной деградации ДНК на короткие фрагменты [14]. Определение количества бактериальной ДНК в стерилизованном и нестерилизованном корме выполнили с помощью ПЦР в реальном времени консервативного участка гена 16S рибосомальной РНК. Анализ автоклавированного и неавтоклавированного корма показал, что только в неавтокливируемом корме детектировалась бактериальная ДНК. Таким образом, в стерильном корме ДНК бактерий сильно фрагментирована и не может вызвать реакции организма хозяина со стороны иммунной системы.
Заключение
Таким образом, лабораторные животные, получающие неавтоклавированный корм, вместе с ним потребляют бактерии рода Bacillus как в вегетативной, так и в споровой форме, которые могут положительно влиять на их здоровье. Животные из барьерных вивариев, конечно, в большей степени защищены от патогенной микрофлоры, однако стерильность условий содержания и кормления лишает их пробиотических микроорганизмов рода Bacillus, что непременно сказывается на их здоровье. В связи с этим можно рекомендовать при содержании лабораторных животных по возможности ограничить использование автоклавированного корма или для барьерных вивариев и исследований, где важны стерильность корма, искусственное обогащение корма бактериальной культурой Bacillus spp. до уровней естественного обсеменения кормов для обеспечения надлежащих условий содержания.
Представленная в статье методика определения Bacillus spp. в корме может быть полезна для принятия решения о необходимости дополнительного введения в корм бактерий рода Bacillus при отсутствии или малом их количестве в используемом корме.
Вклад авторов
М.В. Морозова – исполнение молекулярной части исследования (ПЦР), написание, редактирование текста статьи.
Г.В. Калмыкова и Н.И. Акулова – проведение микробиологических исследований
Е.А. Литвинова – утверждение окончательного варианта статьи для публикации.
Благодарность
Работа выполнена при поддержке исследовательского гранта Rus-LASA (Договор № НИ2 от 04.03.2021) и средств федерального бюджета на проведение фундаментальных научных исследований № 0533-2019-0003.
Список источников
- Grant A., Gay C.G., Lillehoj H.S. Bacillus spp. as direct-fed microbial antibiotic alternatives to enhance growth, immunity, and gut health in poultry // Avian Pathology. – 2018. – Vol. 47 (4). – P. 339-351. doi: 10.1080/03079457.2018.1464117.
- M. S. Mazanko, Gorlov I.F., Prazdnova E.V., Makarenko M.S., Usatov A.V., Bren A.B., Chistyakov V.A., Tutelyan A.V., Komarova Z.B., Mosolova N.I., Pilipenko D.N., Krotova O.E., Struk A.N., Lin A., Chikindas M.L. Bacillus Probiotic Supplementations Improve Laying Performance, Egg Quality, Hatching of Laying Hens, and Sperm Quality of Roosters // Probiotics Antimicrob. Proteins. – 2018. – Vol. 10 (2). – P. 367-373. doi: 10.1007/s12602-017-9369-4.
- Suva M., Sureja V., Kheni D. Novel insight on probiotic Bacillus subtilis: Mechanism of action and clinical applications // J. Curr. Res. Sci. Med. – 2016. – Vol. 2 (2). – P. 65. doi: 10.4103/2455-3069.198381.
- Hong H.A., Le H.D., Cutting S.M. The use of bacterial spore formers as probiotics // FEMS Microbiology Reviews. – 2005. – Vol. 29 (4). – P. 813–835. doi: 10.1016/j.femsre.2004.12.001.
- Earl A.M., Losick R., Kolter R. Ecology and genomics of Bacillus subtilis // Trends in Microbiology. – 2008. – Vol. 16 (6). – P. 269-275. doi: 10.1016/j.tim.2008.03.004.
- Crielly E.M., Logan N.A., Anderton A. Studies on the Bacillus flora of milk and milk products // J. Appl. Bacteriol. – 1994. – Vol. 77 (3). – P. 256-263. doi: 10.1111/j.1365-2672.1994.tb03072.x.
- Pepe O., Blaiotta G., Moschetti G., Greco T., Villani F. Rope-producing strains of Bacillus spp. from wheat bread and strategy for their control by lactic acid bacteria // Appl. Environ. Microbiol. – 2003. – Vol. 69(4). – P. 2321-2329. doi: 10.1128/AEM.69.4.2321-2329.2003.
- Stenfors Arnesen L.P., Fagerlund A., Granum P.E., From soil to gut: Bacillus cereus and its food poisoning toxins // FEMS Microbiology Reviews. – 2008. – Vol. 32(4). – P. 579-606. doi: 10.1111/j.1574-6976.2008.00112.x.
- Granum P.E., Lund T. Bacillus cereus and its food poisoning toxins // FEMS Microbiol. Lett. – 2006. – Vol. 157 (2). – P. 223-228. doi: 10.1111/j.1574-6968.1997.tb12776.x.
- Lee N.K., Kim W.S., Paik H.D., Bacillus strains as human probiotics: characterization, safety, microbiome, and probiotic carrier // Food Science and Biotechnology. – 2019. – Vol. 28(5). – P. 1297-1305. doi: 10.1007/s10068-019-00691-9.
- Hong H.A., Huang J.M., Khaneja R., Hiep L.V., Urdaci M.C., Cutting S.M. The safety of Bacillus subtilis and Bacillus indicus as food probiotics // J. Appl. Microbiol. – 2008. – Vol. 105 (2). – P. 510-520. doi: 10.1111/j.1365-2672.2008.03773.x.
- N.K.M. Tam Uyen N.Q., Hong H.A., Duc L.H., Hoa T.T., Serra C.R., Henriques A.O., Cutting S.M. The intestinal life cycle of Bacillus subtilis and close relatives // J. Bacteriol. – 2006. – Vol. 188 (7). – P. 2692-2700. doi: 10.1128/JB.188.7.2692-2700.2006.
- Calderón-Franco D., Lin Q., van Loosdrecht M.C.M., Abbas B., Weissbrodt D.G. Anticipating Xenogenic Pollution at the Source: Impact of Sterilizations on DNA Release From Microbial Cultures // Front. Bioeng. Biotechnol. – 2020. – Vol. 8. – P. 171. doi: 10.3389/fbioe.2020.00171.
- K. M. Lammers, Brigidi P., Vitali B., Gionchetti P., Rizzello F., Caramelli E., Matteuzzi D., Campieri M. Immunomodulatory effects of probiotic bacteria DNA: IL-1 and IL-10 response in human peripheral blood mononuclear cells // FEMS Immunol. Med. Microbiol. – 2003. – Vol. 38 (2). – P. 165-172. doi: 10.1016/S0928-8244(03)00144-5.




