Патогенез инфицированной ожоговой раны у крыс
Работа выполнена без спонсорской поддержки.
Султанова К.Т., Крышень К.Л., Боровкова К.Е., Гущин Я.А., Полюга Н.Л. Патогенез инфицированной ожоговой раны у крыс. Лабораторные животные для научных исследований. 2023; 2. https://doi.org/10.57034/2618723X-2023-02-03
Резюме
Термическая травма — тяжелый и распространенный вид повреждений, сопровождается местными и системными осложнениями, приводящими к инвалидизации и смерти. Инфекция является основным осложнением ожоговой травмы, так как термические ожоги способны вызывать нарушения гуморального и клеточного иммунитета, а некротизированная ткань перестает выполнять нормальную барьерную функцию, что приводит к развитию инфекции, вызванной условно-патогенными микроорганизмами окружающей среды и комменсалами, что ограничивает способность кожи к заживлению. Кроме того, струп ожоговой раны представляет собой среду, богатую питательными веществами, которая легко колонизируется микроорганизмами. Грамположительные бактерии первые колонизируют раневое ложе, поскольку они составляют микрофлору микробиома кожи. Наиболее часто ожоговые раны ассоциированы с Staphylococcus aureus, который способен вырабатывать факторы вирулентности, замедляющие заживление ран. Частота возникновения термических травм и их последующее инфицирование обусловливают необходимость создания новых терапевтических средств, а также разработки и адаптации релевантных модельных систем для доклинических исследований. Разработано достаточное количество моделей in vivo для изучения патогенеза ожоговых травм, а также проведения специфических исследований в рамках доклинических исследований потенциальных терапевтических агентов. Крысы являются адаптируемой моделью для воспроизведения инфицированных ожоговых ран и изучения их течения. Цель исследования — оценка патогенеза инфицированного ожога у крыс, позволяющая дальнейшее использование такой модельной патологии в изучении широкого спектра потенциальных антисептических и противоожоговых агентов. В исследовании успешно сформирована модель инфицированного ожога кожи у крыс Вистар. Создание ожоговых ран было проведено контактным способом, индуцирующая повреждение температура составила 100 °C, в качестве инфекционного агента был использован Staphylococcus aureus АТСС 25923. Оценка динамики течения инфицированной ожоговой раны была проведена по результатам планиметрического, микробиологического, цитологического и гистологического исследований. Разработанная модель инфицированного ожога кожи у крыс является релевантной для изучения фармакологической активности антисептических средств и местных противоожоговых агентов с противомикробным компонентом механизма действия.
Введение
Ожог — серьезное нарушение целостности тканевого покрова, которое может привести к снижению основных функций организма, инвалидизации и смерти. По своей сути ожог представляет собой повреждение ткани, вызванное воздействием тепла, холода, электричества, ионизирующего излучения и некоторых химических веществ. Степень повреждения зависит от типа действующего фактора, его силы и продолжительности воздействия [1]. Ожоговая травма является тяжелым и распространенным видом повреждений, которые наиболее часто индуцируются термическим фактором [2, 3].
Течение термической раны — сложный процесс, при котором патологические нарушения затрагивают многие органы и системы [4–6]. Сравнительно часто при термической ожоговой ране возникают местные инфекционные осложнения [7]. Инфекция замедляет заживление раны и способствует образованию рубцов. Колонизация раны бактериями начинается практически сразу после термической травмы и обычно включает условно-патогенные бактерии из окружающей среды или собственного микробиома человека. Зачастую в ране развивается и сохраняется лишь небольшая популяция микроорганизмов, что не представляет существенного препятствия для заживления. Однако ожоговые раны обычно содержат экссудат, который облегчает первоначальную инокуляцию и прикрепление патогенных микроорганизмов. Бактерии начинают формировать микроколонии, из которых впоследствии высвобождаются патогенные микроорганизмы, способные колонизировать новые участки в ране. В некоторых случаях микробная популяция увеличивается до уровня, который превышает иммунный клиренс, что препятствует нормальному процессу заживления и приводит к распространению инфекции [8]. Бактериальные инфекции ожоговых ран наиболее часто ассоциированы с Pseudomonas aeruginosa, Acinetobacter baumannii и Staphylococcus aureus [9–12]. Staphylococcus aureus способен вырабатывать клеточные факторы вирулентности, замедляющие заживление ран, мешающие пролиферации кератиноцитов, оказывающие неблагоприятное воздействие на миграцию и жизнеспособность фибробластов путем индукции апоптоза [13].
Принимая во внимание частоту возникновения термических травм, сохраняется необходимость в создании новых терапевтических средств, а также разработке и адаптации релевантных модельных систем. Хотя моделирование ожоговых ран широко распространено в доклинических исследованиях при изучении фармакологических агентов на большом количестве лабораторных моделей, сохраняется ряд некоторых практических вопросов. Какие лабораторные животные в большей степени подходят для проведения данного типа эксперимента; каким образом и в какой области тела животного моделировать ожог; какой инфекционный агент использовать для инфицирования раны, если стоит такая задача?
Как правило, выбор вида животных для модели основан на его наибольшей трансляционной способности [14–17]. Так, сходство между физиологией и анатомией кожи свиньи и человека делает свинью релевантной тест-системой в качестве основной доклинической модели для изучения ожоговых ран [18]. Однако стоит отметить, что молодые свиньи обладают высокой устойчивостью к заражению и инфекции, а это является существенным ограничением при изучении инфицированных ожоговых ран. Кроме того, свиньи относительно дороги. Их большой размер и необходимость проведения общей анестезии обычно требуют дополнительного высококвалифицированного персонала во время процедур.
Хотя архитектоника кожи, а также механизмы ранозаживления у грызунов отличаются от таковых у человека [19], мыши и крысы часто используются в качестве тест-систем в исследованиях [20], в том числе связанных с заживлением ожоговых ран [14, 21]. Кроме того, стоит отметить, что грызуны являются адаптируемой моделью для изучения различных возбудителей ожоговых ран человека, включая грамположительные и грамотрицательные, анаэробные и аэробные бактерии и грибы [12, 22, 23], это качество дает им несомненное преимущество при изучении инфекционного компонента патогенеза ожоговых ран.
Цель исследования — оценка патогенеза инфицированного ожога на крысах, позволяющая в дальнейшем использовать этот вид животных для моделирования патологии при изучении широкого спектра потенциальных антисептических и противоожоговых агентов.
Материал и методы
Животные. Исследование было одобрено биоэтической комиссией на соответствие проекта исследования принципам 3Rs и Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях, и выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей, и в соответствии с правилами надлежащей лабораторной практики. В качестве тест-системы использовали 7 самцов крыс Вистар, релевантный и экономически обоснованный вид животных для доклинических исследований [24–26]. Масса тела животных составила 260–300 г, возраст — 10–12 нед. Животных содержали в специализированной зоне лаборатории микробиологии в индивидуально-вентилируемых клетках (Shanghai Pretty Industries Co., Ltd, Китай) по одному животному, на подстиле. В помещениях для животных поддерживали цикл день/ночь, температуру 20–26 °C и влажность 30–70%. Животным был предоставлен доступ к еде и воде ad libitum.
Проведение общей анестезии и анальгезии. Для обеспечения общей анестезии перед оперативным вмешательством при моделировании патологии экспериментальным животным и для инокуляции инфекционного патогена внутривенно однократно вводили комбинацию анестетиков — Золетил®100 (Virbac, Франция) в дозе 25 мг/кг и Ксила в дозе 5 мг/кг (Interchemie, Нидерланды). Внутривенный путь введения комбинации анестетиков позволил обеспечить животным необходимую глубину наркотического сна с короткой продолжительностью и ускоренным восстановлением. Для профилактики высыхания роговицы во время операции использовали глазные капли Систейн® Ультра («Алкон», США). В послеоперационный период животные получали препарат Флексопрофен® (ВИК — здоровье животных, Беларусь) в дозе 2,5 мг/кг внутримышечно 1 раз в день на протяжении первых 4 дней с целью снижения болевых ощущений, которые могли развиться в результате формирования патологии.
Индукция патологии. Учитывая распространение термических ожоговых травм и последующее бактериальное обсеменение, формирование раны было осуществлено контактным способом, а в качестве инфекционного агента был выбран Staphylococcus aureus как наиболее часто ассоциированный с ожоговыми инфекциями микроорганизм. Формирование ожоговых ран произведено в 1‑й день эксперимента. Для этого предварительно покров шерсти в области холки по средней линии спины крысы, на границе между средней и верхней третью, удален с помощью электротриммера. Оперативное вмешательство выполнено в стерильных условиях под общей анестезией. Дезинфекцию кожного покрова проводили 70% этиловым спиртом. Формирование ожоговых ран осуществили при помощи электрического паяльника ЭПЦН-100/220 (ООО «Слюдяная фабрика», Россия). Для обеспечения необходимых условий проведения индукции патологии паяльник был модифицирован. Было произведено спиливание жала паяльника, таким образом диаметр наконечника составил 8 мм. Для обеспечения массы 300 г на паяльнике была зафиксирована металлическая шайба. Продолжительность манипуляции 5 с, температура 100 °С. Размер сформированной раны составил примерно 200 мм2.
На 4‑й день эксперимента для инфицирования ожоговой раны был использован возбудитель Staphylococcus aureus АТСС 25923, 109 КОЕ/мл, для этого у животных под наркозом скальпелем удаляли струпную корочку. После чего суспензию возбудителя при помощи шприца наносили поверхностно на область дна раны.
Планиметрическое исследование. Для оценки скорости заживления раны ежедневно, начиная с 5‑го по 14‑й день эксперимента, проводили оценку планиметрических параметров [27]. На рану накладывали простерилизованный лист полимерной пленки, на котором маркером наносили ее контуры. Пленку с полученным контуром прикладывали на миллиметровую бумагу, измеряли длину большой и малой полуоси и определяли площадь раны. Площадь раны рассчитывали по формуле:
S = πab, (1)
где S — площадь раны, мм2; a — длина большой полуоси, мм; b — длина малой полуоси, мм; π — 3,1415.
Эвтаназия. Эвтаназия экспериментальных животных была проведена на 15‑й день эксперимента. В соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях, от 22 сентября 2010 г. была выполнена эвтаназия животных при помощи передозировки анестетиков (начальный этап) с последующим перерезанием основных кровеносных сосудов (конечный этап). Данный вид эвтаназии сопровождался у животных минимальными болью, страданиями и дистрессом и был проведен компетентными сотрудниками.
Микробиологическое исследование. Микробиологическое исследование включало количественное определение микроорганизмов в 1 г ткани раны на 15‑й день эксперимента. После эвтаназии осуществляли забор участка раны в стерильные пробирки. Для этого стерильным лезвием иссекали участок мягких тканей дна и прилежащего края раны с захватом здоровой ткани и помещали в пробирки, взвешивали на электронных лабораторных весах Adventurer AR2140 (Ohaus Europe, Швейцария). Биологический материал измельчали с помощью гомогенизатора Даунса. К измельченным образцам добавляли стерильный физиологический раствор в соотношении 1:9. Далее пробирки встряхивали на мульти-вортексе V-32 (SIA «Biosan», Латвия) до получения однородной суспензии. Из полученной суспензии готовили ряд 10‑кратных разведений в стерильном физиологическом растворе до 10–4. Из каждого разведения проводили посев 0,1 мл суспензии в чашки Петри с плотной селективной питательной средой (BAIRD-PARKER Agar, Merck KGaA, Германия) и добавлением желточно-теллуритовой эмульсии Egg Yolk Tellurite Emulsion (Merck KGaA, Германия). Посевы инкубировали в термостате ТС-1/80 СПУ (ОАО «Смоленское СКТБ СПУ», Россия) при температуре 35±2 °С в течение 48 ч. После инкубации проводили подсчет колоний, выросших на чашке, и делали соответствующий пересчет на 1 г ткани. Количественное содержание микроорганизмов в 1 г биоптата определяли по формуле:
N = n×10×10 (или ×100, или 1000), (2)
где N — количество микроорганизмов в 1 г биоптата; n — количество микроорганизмов, выросших на чашке; 10 — пересчет на 1 г суспензии; 10, 100 или 1000 — разведение материала, засеянного на чашку, где вели подсчет колоний.
Цитологическое исследование. Образцы для цитологического исследования получали методом поверхностной биопсии [28] на 15‑й день эксперимента. Материал для исследования отбирали посредством легкого соскоба поверхностного слоя раны ручкой хирургического скальпеля во время проведения эвтаназии и переносили тонким слоем на подготовленное предметное стекло. В дальнейшем проводили окраску препаратов по Романовскому—Гимзе и подсчет клеток (сегментоядерные нейтрофилы, фибробласты, лимфоциты и макрофаги) на различных участках. При оценке клеточного состава обращали внимание на преобладающее количество клеток в ране, характеризующее течение раневого процесса.
Гистологическое исследование. Раневые биоптаты для гистологического исследования были отобраны на 15‑й день эксперимента у эвтаназированных животных. Стерильным лезвием иссекали участок мягких тканей дна и прилежащего края раны с захватом здоровой ткани. Отобранный биологический материал фиксировали в 10% растворе нейтрального формалина в течение 24 ч, после чего образцы заливали в парафин. Затем изготавливали срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином.
Анализ гистологических препаратов проводили при помощи светооптического микроскопа Accu-Scope 3000 SERIES (Accu Scope Inc., СШA) при увеличении в 40, 100, 200 и 1000 раз. Микрофотографирование проводили, используя цифровую фотокамеру «Toupcam UCMOS05100kpa» (Китай) и программное обеспечение ToupView 3.7.7892 (Китай).
При оценке гистологических препаратов обращали внимание на выраженность воспалительных реакций, состояние грануляционной ткани, возникновение краевой эпителизации, структурную полноценность вновь образованного эпителия.
Анализ данных. Для всех данных была применена описательная статистика — результаты проверены на соответствие закону нормального распределения с помощью критерия Шапиро—Уилка. Для данных, подчиняющихся закону нормального распределения, подсчитаны среднее значение (М) и ошибка среднего (SEM). Для оценки связанных результатов использовали дисперсионный анализ c повторными измерениями (Repeated measures ANOVA) и проведением в последующем post-hoc-теста Даннетта (Dunnett’s test). Статистический анализ и построение графиков выполняли с помощью GraphPad Prism 9.2.0 (GraphPad Software, США).
Результаты и обсуждение
Ожоговая травма разрушает защитный кожный барьер, вызывая различные реакции, в том числе усиление метаболизма, потерю влаги и нарушение работы иммунной системы [29]. Заживление ожоговой раны состоит из трех перекрывающихся фаз — воспаления (реактивной), пролиферации (репаративной) и созревания (ремоделирования). При воспалении вначале происходит очищение раны, обеспечивающее дальнейшую защиту от бактериальной инфекции [30].
На рис. 1 отражено изменение площади ран у крыс на протяжении эксперимента.
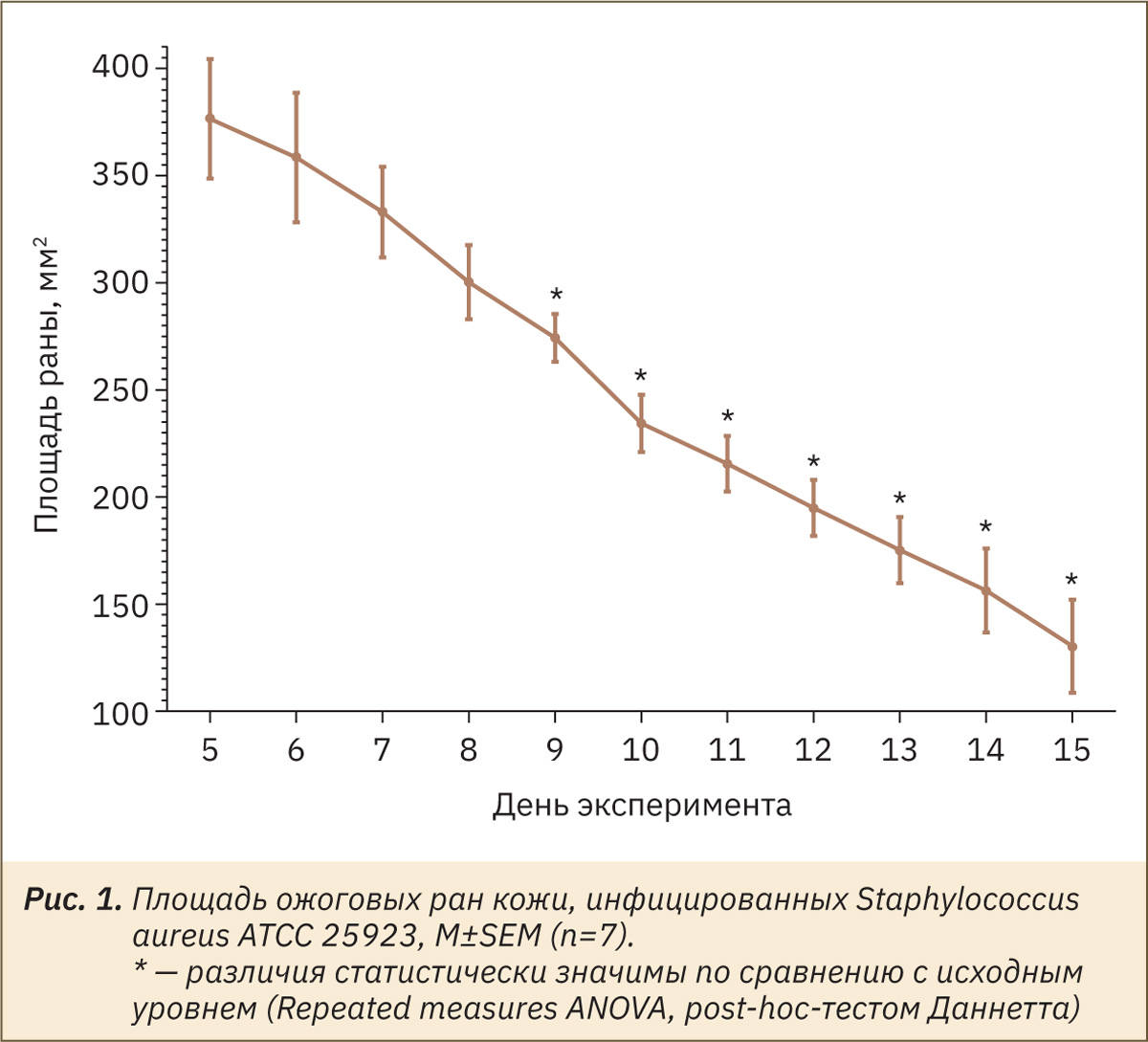
В ходе планиметрического исследования была отмечена тенденция к ранозаживлению на 5‑й день эксперимента. Уже на 9‑й день выявлено статистически значимое уменьшение площади раны у крыс по сравнению с исходным значением (5‑й день). Так, площадь раны сократилась на 27% на 9‑й день, а к 15‑му дню данный показатель достиг 65%.
Микробиологическое исследование показало сохранение бактериальной обсемененности раны животных. Так, титр Staphylococcus aureus ATCC 25923 log10 составил 6,7 КОЕ/г.
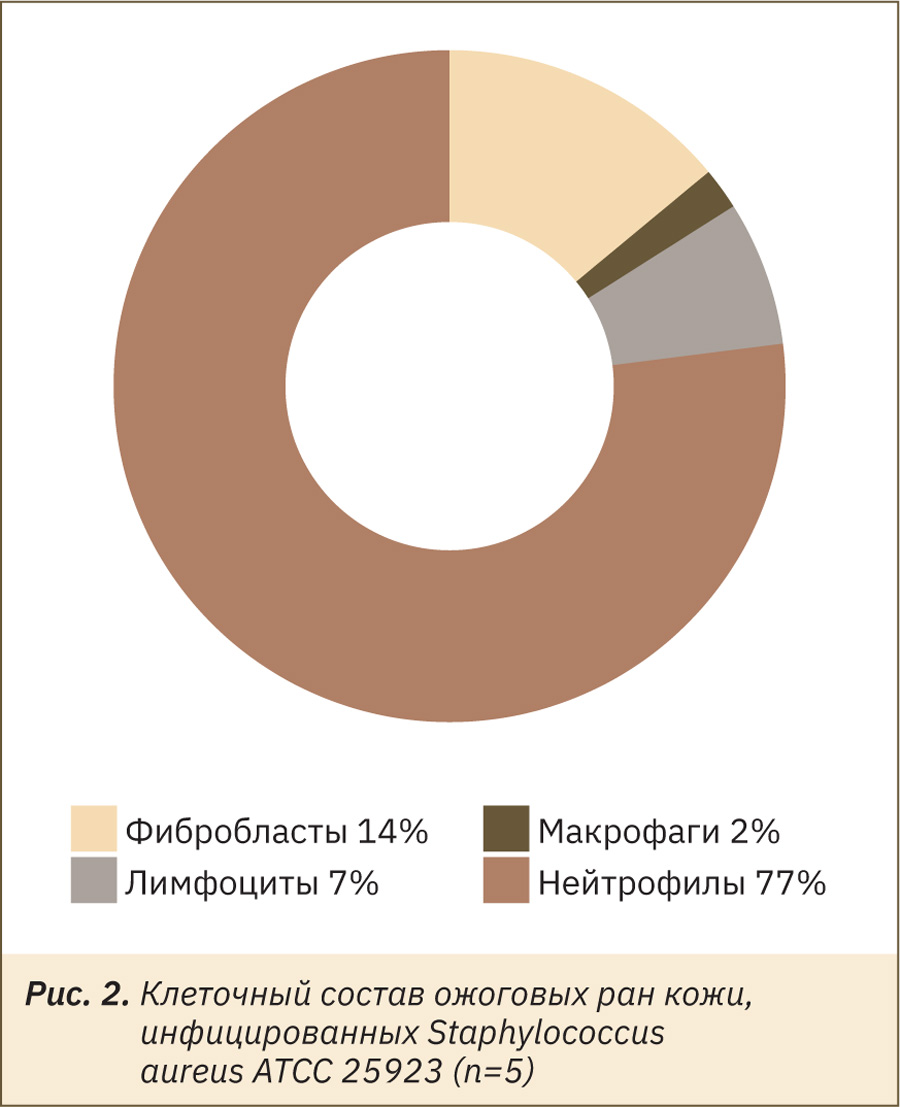
Цитологическое исследование образцов раневой поверхности также подтвердило сохранность воспалительного процесса в ране. В первое время после ожоговой травмы популяция лимфоцитов снижается, а впоследствии лимфоциты активно привлекаются цитокинами нейтрофилов в ожоговую рану и играют важную роль в переходе от фазы воспаления к фазе ремоделирования ткани при заживлении посредством дифференцировки фибробластов [31]. На 15‑й день эксперимента в цитограммах животных отмечали преобладание сегментоядерных нейтрофилов над другими типами клеток, свидетельствующее о протекании воспалительного процесса в тканях (рис. 2). Нейтрофилы являются первыми иммунными клетками, проникающими в рану [32, 33], и представляют собой наиболее распространенный тип иммунных клеток, отвечающих за удаление патогенов [34]. Нейтрофилы, выполнившие свои задачи, подвергаются апоптозу, а это приводит к ослаблению воспалительной реакции. При этом меньше всего в клеточном инфильтрате содержалось макрофагов, что характерно для ожоговых ран [35].
Фаза пролиферации обычно происходит с образованием грануляционной ткани и продолжается около 2 нед. На этой стадии формируются новые кровеносные сосуды с целью обеспечения трофики ткани, а фибробласты мигрируют в рану для последующей пролиферации [36, 37].
В ходе гистологического исследования были зафиксированы начальные этапы формирования грануляционной ткани, которая заполняет дефект и необходима для сокращения поверхности раны и последующего заживления. Среди незрелой соединительной ткани наблюдали диффузный выраженный воспалительный инфильтрат, представленный большим количеством гранулоцитов и фибробластов. Краевая эпителизация не полная, слабо выражена, а в строении регенерирующего эпителия не прослеживалась структурированность (рис. 3).
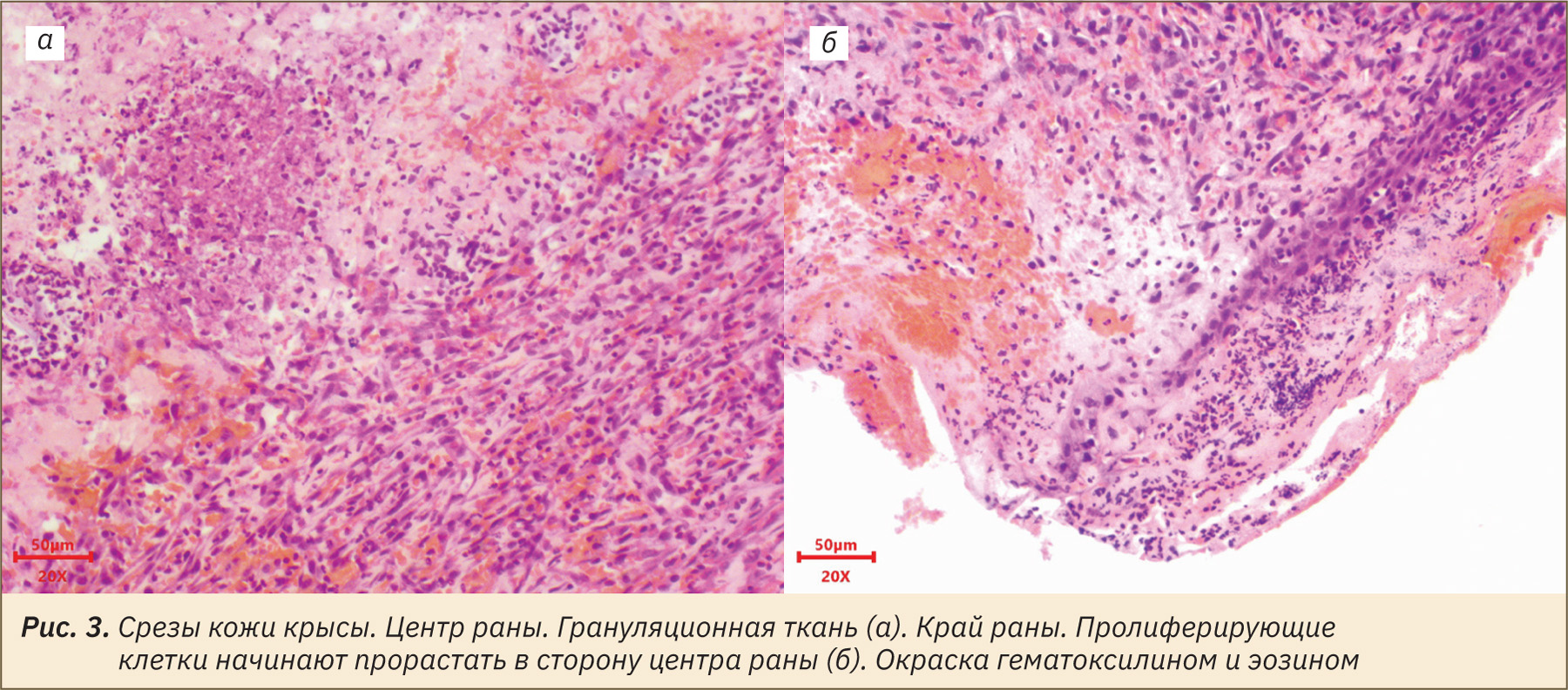
В центре раны сохранялись небольшие участки некроза, постепенно замещаемые грануляционной тканью, в которой присутствовало большое количество капилляров. Однако ближе к периферии раны процесс ангиогенеза более выражен, и можно наблюдать вновь образованные толстостенные сосуды, которые прорастали к центру раны. Вероятно, процесс ангиогенеза начинается относительно быстро после ожоговой травмы [38]. В целом это динамическое протекание ангиогенного процесса согласуется с развитием грануляционной ткани для последующего замещения ее зрелой соединительной, а также эпителизации раневого дефекта.
Заключение
Разработанная модель инфицированной ожоговой раны кожи у крыс является релевантной и доступной для доклинических исследований противоожоговых терапевтических агентов. Показатели, полученные в планиметрическом, микробиологическом, цитологическом и гистологическом исследованиях, наиболее значимо отображают очищение раны и происходящие репаративные процессы. Данная модель является релевантной для изучения фармакологического действия антисептических средств и местных противоожоговых агентов с противомикробным компонентом механизма действия. Принимая во внимание естественную скорость заживления ожоговой раны у крыс, оптимальный курс введения тестируемого объекта составляет 10 дней. Описанная модель является подходящей для изучения лекарственных средств со следующими кодами анатомо-терапевтическо-химической классификации (АТХ): D03; D06; D08; G01.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
К.Т. Султанова — анализ научной и методической литературы, написание и редактирование текста рукописи,
обобщение результатов исследования.
К.Л. Крышень — идея, критический пересмотр содержания, редактирование текста рукописи.
К.Е. Боровкова — выполнение микробиологического исследования.
Я.А. Гущин — выполнение гистологического исследования.
Н.Л. Полюга — выполнение экспериментальной части, отбор биоматериала.
Список источников
-
Манаков В.Ю. Ожоги. Классификация и лечение ожогов // Современные научные исследования и инновации. 2020. № 11. URL: https://web.snauka.ru/issues/2020/11/93833 (дата обращения: 12.2022).
- Щетинин С.А. Анализ частоты и последствий травматизма в России // Современные проблемы науки и образования. 2015. № 2–1. URL: https://science-education.ru/ru/article/view?id=17871 (дата обращения: 12.2022).
-
Morgan M., Deuis J.R., Frøsig-Jørgensen M. et al. Burn pain: a systematic and critical review of epidemiology, pathophysiology, and treatment // Pain medicine. 2018. Vol. 19. N. 4. P. 708–734. DOI: 10.1093/pm/pnx228.
-
Симонян Е.В., Осиков М.В., Агеева А.А. и др. Современные аспекты патофизиологии термической травмы // Современные проблемы науки и образования. 2020. № 3. С. 141–141. [Simonyan E.V., Osikov M.V., Ageeva A.A. et al. Sovremennye aspekty patofiziologii termicheskoj travmy // Sovremennye problemy nauki i obrazovaniya. 2020. N. 3. P. 141–141. (In Russ.)]. DOI: 10.17513/spno.29723.
-
Ватутин Н.Т., Игнатенко Г.А., Тарадин Г.Г. и др. Поражение сердца при ожоговой болезни (обзор литературы) // Бюллетень сибирской медицины. 2020. Т. 19. № 4. C. 198–206. [Vatutin N.T., Ignatenko G.A., Taradin G.G. et al. Porazhenie serdca pri ozhogovoj bolezni (obzor literatury) // Byulleten’ sibirskoj mediciny. 2020. Vol. 19. N. 4. P. 198–206. (In Russ.)].
-
Саедгалина О.Т., Осиков М.В., Симонян Е.В. Иммунологические аспекты патогенеза термической травмы // Современные проблемы науки и образования. 2016. № 5. C. 1–9. [Saedgalina O.T., Osikov M.V., Simonyan E.V. Immunologicheskie aspekty patogeneza termicheskoj travmy // Sovremennye problemy nauki i obrazovaniya. 2016. N. 5. P. 1–9 (In Russ.)].
-
Морозов А.М., Сергеев А.Н., Жуков С. В. и др. Профилактика инфекции области хирургического вмешательства // Современные проблемы науки и образования. 2020. № 6. [Morozov A.M., Sergeev A.N., Zhukov S.V. et al. Profilaktika infekcii oblasti hirurgicheskogo vmeshatel’stva // Sovremennye problemy nauki i obrazovaniya. 2020. N. 6. (In Russ.)].
-
Alves D.R., Booth S.P., Scavone P. et al. Development of a high-throughput ex-vivo burn wound model using porcine skin, and its application to evaluate new approaches to control wound infection // Frontiers in cellular and infection microbiology. 2018. Vol. 8. P. 196. DOI: 10.3389/fcimb.2018.00196.
-
Воробьева О.Н., Денисенко Л.И., Жилина Н.М. Этиология гнойно-септических процессов у ожоговых больных // Сибирский научный медицинский журнал. 2010. Т. 30. № 6. С. 57–63. [Vorob’eva O. N., Denisenko L.I., ZHilina N. M. Etiologiya gnojno-septicheskih processov u ozhogovyh bol’nyh // Sibirskij nauchnyj medicinskij zhurnal. 2010. Vol. 30. N. 6. P. 57–63. (In Russ.)].
-
Haisma E.M., de Breij A., Chan H. et al. LL-37‑derived peptides eradicate multidrug-resistant Staphylococcus aureus from thermally wounded human skin equivalents // Antimicrobial agents and chemotherapy. 2014. Vol. 58. N. 8. P. 4411–4419. DOI: 10.1128/AAC.02554-14.
-
Branski L.K., Al-Mousawi A., Rivero H. et al. Emerging infections in burns // Surgical infections. 2009. Vol. 10. N. 5. P. 389–397. DOI: 10.1089/sur.2009.024.
-
Maslova E., Eisaiankhongi L., Sjöberg F. et al. Burns and biofilms: Priority pathogens and in vivo models // npj Biofilms and Microbiomes. 2021. Vol. 7. N. 1. P. 1–9. DOI: 10.1038/s41522‑021‑00243‑2.
-
Thakur K., Sharma G., Singh B. et al. Nano-engineered lipid-polymer hybrid nanoparticles of fusidic acid: an investigative study on dermatokinetics profile and MRSA-infected burn wound model // Drug Delivery and Translational Research. 2019. Vol. 9. N. 4. P. 748–763. DOI: 10.1007/s13346‑019‑00616‑3.
-
Grada A., Mervis J., Falanga V. Research techniques made simple: animal models of wound healing // Journal of Investigative Dermatology. 2018. Vol. 138. N. 10. P. 2095–2105. e1. DOI: 10.1016/j.jid.2018.08.005.
-
Lukomskyj A.O., Rao N., Yan L. et al. Stem cell-based tissue engineering for the treatment of burn wounds: a systematic review of preclinical studies // Stem Cell Reviews and Reports. 2022. P. 1–30. DOI: 10.1007/s12015‑022‑10341‑z.
-
Masson-Meyers D.S., Andrade T.A., Caetano G.F. et al. Experimental models and methods for cutaneous wound healing assessment // International journal of experimental pathology. 2020. Vol. 101. N. 1–2. P. 21–37. DOI: 10.1111/iep.12346.
-
Макарова М.Н., Матичин А.А., Матичина А.А. и др. Принципы выбора животных для научных исследований. Сообщение 1. Выбор модельных организмов на основании филогенетических связей // Лабораторные животные для научных исследований. 2022. № 2. [Makarova M.N., Matichin A.A., Matichina A.A. et al. Principy vybora zhivotnyh dlya nauchnyh issledovanij. Soobshchenie 1. Vybor model’nyh organizmov na osnovanii filogeneticheskih svyazej // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2022. N. 2. (In Russ.)].
-
Lunney J.K., Van Goor A., Walker K.E. et al. Importance of the pig as a human biomedical model // Science translational medicine. 2021. Vol. 13. N. 621. P. eabd5758. DOI: 10.1126/scitranslmed.abd5758.
-
Гущин Я.А., Ковалева М.А. Сравнительная морфология кожи человека и лабораторных животных (краткое сообщение) // Лабораторные животные для научных исследований. 2019. № 2. С. 6. [Gushchin YA.A., Kovaleva M.A. Sravnitel’naya morfologiya kozhi cheloveka i laboratornyh zhivotnyh (kratkoe soobshchenie) // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2019. N. 2. P. 6. (In Russ.)].
-
Мирошников М.В., Макарова М.Н. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 4: мыши // Лабораторные животные для научных исследований. 2021. № 3. [Miroshnikov M.V., Makarova M.N. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referensnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 4: myshi // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2021. N. 3. (In Russ.)].
-
Zomer H.D., Trentin A.G. Skin wound healing in humans and mice: challenges in translational research // Journal of dermatological science. 2018. Vol. 90. N. 1. P. 3–12. DOI: 10.1016/j.jdermsci.2017.12.009.
-
Cancio L.C. Topical antimicrobial agents for burn wound care: history and current status // Surgical Infections. 2021. Vol. 22. N. 1. P. 3–11. DOI: 10.1089/sur.2020.368.
-
Rahimzadeh G., Gill P., Saeedi M. et al. Evaluation of bacteriophage products against burn wound Methicillin-resistant Staphylococcus aureus (MRSA) infections // Wound Medicine. 2020. Vol. 28. P. 100182.
-
Добрейкин Е.А. Экспериментальное обоснование способа моделирования инфицированной ожоговой раны кожи у лабораторных животных // Саратовский научно-медицинский журнал. 2013. Т. 9. № 2. [Dobrejkin E.A. Eksperimental’noe obosnovanie sposoba modelirovaniya inficirovannoj ozhogovoj rany kozhi u laboratornyh zhivotnyh // Saratovskij nauchno-medicinskij zhurnal. 2013. Vol. 9. N. 2. (In Russ.)].
-
Пахомова А.Е., Пахомова Ю.В., Пахомова Е.Е. Новый способ экспериментального моделирования термических ожогов кожи у лабораторных животных, отвечающий принципам Good Laboratory Practice (надлежащей лабораторной практики) // Journal of Siberian Medical Sciences. 2015. № 3. [Pahomova A.E., Pahomova YU.V., Pahomova E.E. Novyj sposob eksperimental’nogo modelirovaniya termicheskih ozhogov kozhi u laboratornyh zhivotnyh, otvechayushchij principam Good Laboratory Practice (nadlezhashchej laboratornoj praktiki) // Journal of Siberian Medical Sciences. 2015. N. 3. (In Russ.)].
-
Дуданов И.П., Виноградов В.В., Криштоп В.В. и др. Сравнительная характеристика ранозаживляющего эффекта ксерогеля на основе нейтрального гидрозоля диоксида титана для терапии ожоговых ран // Research’n Practical Medicine Journal. 2021. Т. 8. № 1. [Dudanov I.P., Vinogradov V.V., Krishtop V.V. et al. Sravnitel’naya harakteristika ranozazhivlyayushchego effekta kserogelya na osnove nejtral’nogo gidrozolya dioksida titana dlya terapii ozhogovyh ran // Research’n Practical Medicine Journal. 2021. Vol. 8. N. 1. (In Russ.)].
-
Маскин С.С., Павлов А.В., Иголкина Л.А. и др. Экспериментальное моделирование гнойного процесса в мягких тканях: сравнение методов инфицированной раны и подкожного // Международный журнал экспериментального образования. 2017. № 4–2. С. 165–167. [Maskin S.S., Pavlov A.V., Igolkina L.A. et al. Eksperimental’noe modelirovanie gnojnogo processa v myagkih tkanyah: sravnenie metodov inficirovannoj rany i podkozhnogo // Mezhdunarodnyj zhurnal eksperimental’nogo obrazovaniya. 2017. N. 4–2. P. 165–167. (In Russ.)].
-
Камаев М.Ф. Инфицированная рана и ее лечение // Москва: Медицина. 1970. Т. 158. [Kamaev M.F. Inficirovannaya rana i ee lechenie // Moskva: Medicina. 1970. Vol. 158. (In Russ.)].
-
Zheng W., Yu A. EZH2‑mediated suppression of lncRNA-LET promotes cell apoptosis and inhibits the proliferation of post-burn skin fibroblasts // International journal of molecular medicine. 2018. Vol. 41. N. 4. P. 1949–1957. DOI: 10.3892/ijmm.2018.3425.
-
Egberts G., Vermolen F., van Zuijlen P. Sensitivity and feasibility of a one-dimensional morphoelastic model for post-burn contraction // Biomechanics and Modeling in Mechanobiology. 2021. Vol. 20. N. 6. P. 2147–2167. DOI: 10.1007/s10237‑021‑01499‑5.
-
Rani M., Schwacha M.G. The composition of T-cell subsets are altered in the burn wound early after injury // PLoS One. 2017. Vol. 12. N. 6. DOI: 10.1371/journal.pone.0179015.
-
Lin F., Nguyen C.M. C., Wang S.J. et al. Effective neutrophil chemotaxis is strongly influenced by mean IL-8 concentration // Biochemical and biophysical research communications. 2004. Vol. 319. N. 2. P. 576–581. DOI: 10.1016/j.bbrc.2004.05.029.
-
Futosi K., Fodor S., Mócsai A. Reprint of Neutrophil cell surface receptors and their intracellular signal transduction pathways // International immunopharmacology. 2013. Vol. 17. N. 4. P. 1185–1197. DOI: 10.1016/j.intimp.2013.11.010.
-
Rodero M.P., Legrand J.M., Bou-Gharios G. et al. Wound-associated macrophages control collagen 1α2 transcription during the early stages of skin wound healing // Experimental dermatology. 2013. Vol. 22. N. 2. P. 143–145. DOI: 10.1016/j.intimp.2013.11.010.
-
Xiu F., Jeschke M.G. Perturbed mononuclear phagocyte system in severely burned and septic patients // Shock (Augusta, Ga.). 2013. Vol. 40. N. 2. P. 81. DOI: 10.1097/SHK.0b013e318299f774.
-
Lenselink E.A. Role of fibronectin in normal wound healing // International wound journal. 2015. Vol. 12. N. 3. P. 313–316. DOI: 10.1111/iwj.12109.
-
Čoma M., Fröhlichová L., Urban L. et al. Molecular changes underlying hypertrophic scarring following burns involve specific deregulations at all wound healing stages (Inflammation, proliferation and maturation) // International Journal of Molecular Sciences. 2021. Vol. 22. N. 2. P. 897. DOI: 10.3390/ijms22020897.
- Honnegowda T.M. Kumar P. Udupa E.G. P. et al. Role of angiogenesis and angiogenic factors in acute and chronic wound healing // Plastic and Aesthetic Research. 2015. Vol. 2. P. 243–249. DOI: 10.4103/2347-9264.165438.




