Патоморфология желудочно-кишечного тракта крыс Вистар при многократном внутрижелудочном введении носителей, применяемых в доклинических исследованиях
Работа выполнена без спонсорской поддержки.
Гущин Я.А., Шабанов П.Д., Гущина С.В. Патоморфология желудочно-кишечного тракта крыс Вистар при многократном внутрижелудочном введении носителей, применяемых в доклинических исследованиях. Лабораторные животные для научных исследований. 2022; 4. https://doi.org/10.57034/2618723X-2022-04-02
Резюме
При разработке новых лекарств одной из важнейших задач, стоящих перед разработчиком, является не только оценка активности потенциального лекарственного вещества, но и тестирование на безопасность, в том числе его готовой лекарственной формы (ГЛФ).
Принимая во внимание, что наиболее распространенным путем введения лекарственных препаратов является пероральный, то и в доклинических исследованиях он также широко востребован. Однако в целом виде таблетки или капсулы не пригодны при работе со многими видами животных, особенно с небольшими мышами и крысами. Поэтому твердые ГЛФ в большинстве случаев приходится переводить в жидкие формы. С этой целью используют широкий спектр различных носителей, основными из которых являются вода, растительное масло, крахмальный гель, сиропы, а также поверхностно-активные вещества, такие как твин. Часто данные вещества приходится применять в больших объемах, а значит, они должны хорошо переноситься животными и не вызывать побочные эффекты. Однако мы в своей работе периодически встречаемся у контрольных животных с патологией органов и тканей, которые не могут быть объяснены воздействием тестируемых веществ или моделей, а являются фоновыми. В литературе, особенно отечественной, очень мало точных данных о влиянии носителей на органы желудочно-кишечного тракта (ЖКТ) животных, причем авторы ограничиваются лишь заключениями: «не токсично» или «хорошо переносится». В связи с этим была поставлена задача — выявить и определить распространенность фоновых заболеваний, а также частоту развития патоморфологических изменений в органах ЖКТ крыс Вистар в ответ на внутрижелудочное введение носителей, чаще всего используемых в нашем исследовательском центре. Был проведен ретроспективный анализ доклинических исследований, в которых носителями выступали вода, 1% крахмальный гель, 0,5% метилцеллюлоза, 64% сахарный сироп, кукурузное масло и 1% твин-80. В результате выявлено, что непосредственно процедура внутрижелудочного введения оказывает травмирующее действие на верхние отделы ЖКТ, при этом крахмальный гель и метилцеллюлоза способствуют повреждению слизистой оболочки пищевода с последующим развитием воспаления тканей. Кукурузное масло, сахарный сироп и твин, наоборот, облегчают введение, но в нижних отделах ЖКТ провоцируют энтеропатии, а также метаболические нарушения печени. Полученные данные в последующем помогут дифференцировать патологию фоновую от вызванной воздействием тестируемых веществ, что значительно улучшит выявление возможных нежелательных токсических эффектов препаратов.
Введение
При разработке новых лекарств одной из важнейших задач, стоящих перед разработчиком, является не только оценка активности потенциального лекарственного вещества, но и тестирование на безопасность, в том числе его готовой лекарственной формы. Основной этап, позволяющий выявить возможные побочные эффекты, — доклинические исследования с использованием лабораторных животных. Однако среди основных путей введения лекарств животным выделяется пероральный, поскольку для него очень редко можно применить готовые лекарственные формы (ГЛФ) [1]. В целом виде таблетки или капсулы не пригодны при работе с грызунами, такими как мыши или крысы ввиду их небольшого размера, и даже для более крупных животных (кролики или карликовые свиньи) размер ГЛФ очень ограничен. Кроме того, есть проблема дозирования действующего вещества, которое при исследованиях безопасности приходится вводить в намного больших количествах, чем предполагаемая терапевтическая доза. Не менее важным моментом является трудность в точном индивидуальном дозировании. Таким образом, «физическая» форма вещества, предназначенного для перорального введения, представляет собой серьезную проблему в доклинических исследованиях. В идеале тестируемое вещество должно сохранять стабильность, гомогенность и точную дозируемость в пределах диапазона доз, подлежащих тестированию [1]. Жидкости можно вводить в исходном виде или воспользоваться для разбавления соответствующим растворителем, который зачастую предоставляется разработчиком, или сведения о нем указаны в сопроводительной документации. Однако твердые ГЛФ, особенно таблетки или капсулы, в большинстве случаев все же приходится переводить в жидкие [2], что требует от исследовательской организации проведения дополнительного этапа пробоподготовки с подбором необходимой дисперсной системы [3].
Для разведения жидких лекарственных средств или приготовления жидких форм из твердых лекарственных средств можно использовать довольно широкий спектр различных носителей, основными из которых можно выделить несколько. Прежде всего это вода, которая является универсальным растворителем, но к сожалению, многие вещества являются гидрофобными. В таком случае можно применять жирные масла растительного происхождения, такие как абрикосовое, подсолнечное, кукурузное или оливковое. Они терапевтически инертны, обеспечивают стабильность действующего компонента, а также обладают антиоксидантными свойствами, предотвращая окисление тестируемого вещества [4]. Ряд твердых субстанций плохо или вовсе не растворимы ни в гидрофобных, ни в гидрофильных носителях. Их можно подвергнуть суспендированию или солюбилизации. Для суспендирования, то есть образования дисперсного раствора со взвешенными частицами твердого вещества, чаще всего применяют крахмальный гель, но нередко используют метилцеллюлозу или карбоксиметилцеллюлозу. В большинстве случаев оптимальной формой для внутрижелудочного введения являются именно суспензии [5]. Солюбилизация — процесс самопроизвольного образования устойчивой системы за счет перехода нерастворимого в данной дисперсной среде вещества в разведенный водный раствор поверхностно-активных веществ с высоким гидрофильно-липофильным балансом. Наиболее распространенным поверхностно-активным веществом в доклинических исследованиях является твин-80. Отдельно стоит рассмотреть сиропы — это жидкая лекарственная форма, являющаяся смесью концентрированного раствора сахаров с лекарственным веществом. Обычно они содержат от 60 до 65% сахаров, что, с одной стороны, обеспечивает стабильность действующего вещества, а с другой — защищает от микробного обсеменения, оказывая антимикробное действие [6, 7]. Также их часто используют в качестве корригирующих вспомогательных веществ, улучшающих вкусовые качества продукта, при производстве ГЛФ для энтерального применения, поэтому не редкостью является тестирование подобных препаратов, что также требует приготовления различных разведений исходного продукта.
Несмотря на широкий выбор, точных указаний по использованию носителей не существует. Очевидно, они не должны иметь токсических эффектов в применяемых концентрациях и химического взаимодействия с исследуемым соединением. Также необходимо предусмотреть контрольную группу животных, которым будут вводить растворитель в эквивалентных количествах [8]. Поэтому носители часто приходится применять в относительно высоких объемах, а значит, они должны хорошо переноситься животными, чтобы не вызывать побочные эффекты, мешающие интерпретировать изменения, опосредованные тестируемыми объектами. В литературе можно найти отдельные статьи, описывающие профиль безопасности используемых носителей, есть отдельные исследования их влияния на организм лабораторных животных, но наблюдения эти затрагивают ограниченную выборку животных [7, 9, 10]. Существуют работы, объединяющие данные, касающиеся безопасности носителей, полученные из большого числа отчетов, и включающие анализ различных дозировок и путей их введения [11, 12], но даже в них авторы не дают подробную информацию, зачастую ограничиваясь общими заключениями: «не токсично» или «хорошо переносится». Однако в работе периодически встречаются случаи, когда у контрольных животных диагностируется патология органов и тканей, которую нельзя объяснить воздействием используемых веществ или моделей. Данные состояния являются фоновыми, то есть отклонениями от нормальных значений, которые возникли до начала исследования и не были диагностированы ранее, поскольку имеют крайне незначительные клинические или лабораторные проявления. Они могут быть врожденными, приобретенными, ятрогенными, как физиологическими, так и патологическими, а могут являться уникальным свойством для данного вида [13, 14]. Поскольку в большинстве проводимых исследований вещества вводят животным перорально, то при всестороннем изучении органов желудочно-кишечного тракта (ЖКТ) обнаружение подобных изменений может мешать интерпретации результатов.
В связи с вышесказанным была поставлена цель — выявить и определить частоту развития патоморфологических изменений в органах ЖКТ крыс Вистар в ответ на внутрижелудочное введение наиболее распространенных носителей, используемых для приготовления или разведения лекарственных веществ. Для решения данной проблемы был проведен ретроспективный анализ доклинических исследований, в которых носителями выступали вода, 1% крахмальный гель, 0,5% метилцеллюлоза, 64% сахарный сироп, кукурузное масло и 1% твин-80.
В дальнейшем полученные сведения помогут дифференцировать патологию фоновую от патологии, вызванной воздействием тестируемых веществ, что значительно улучшит выявление возможных нежелательных токсических эффектов препаратов.
Материал и методы
Для проведения ретроспективного исследования были использованы данные патоморфологических наблюдений, полученные в ходе работы по изучению общих токсических свойств и фармакологической безопасности веществ, проводимой в период с 2016 по 2021 г. в АО «НПО «ДОМ ФАРМАЦИИ» (Россия). Было сформировано 7 групп (табл. 1).

В 1‑ю группу контрольных (сентинельных) животных вошли крысы Вистар, которые не подвергались какому‑либо воздействию и не получали тестируемые или иные вещества. Во 2–7‑ю группу животных отбирали согласно следующим критериям:
- животные были задействованы в исследованиях по оценке безопасности веществ;
- половозрелые крысы Вистар без учета половой принадлежности массой тела 200–300 г;
- животным осуществляли многократное 14‑дневное внутрижелудочное введение контрольных веществ 1 раз в сутки;
- для введения использовали специальный, оснащенный «оливой» на конце, жесткий металлический зонд, диаметр и длина которого не превышали рекомендованные для данного вида животных, так же как и объемы введения [15, 16].
При планировании исследования в программе Statistica 10 был вычислен объем выборки, который составил 1400 животных. Этого количества достаточно для выявления статистической значимости α=5% при статистической мощности 80% и частоте встречаемости фоновой патологии крыс 7–11% [17–21].
Поскольку воду и крахмальный гель в нашей лаборатории используют чаще всего, то материал для анализа был набран в полном объеме. Однако, исходя из немногочисленности исследований, в которых в качестве носителя используют 0,5% метилцеллюлозу, 64% сахарный сироп или твин-80, в данный анализ вошли все доступные животные, подходящие под заданные критерии отбора. Характеристика групп и информация о количестве образцов в исследовании представлены в табл. 1.
Все животные находились в стандартных условиях в соответствии с Директивой 2010/63/EU от 22 сентября 2010 г. по охране животных, используемых в научных целях. Рацион питания животных не менялся на протяжении всего обозначенного периода (2016–2021 гг.). Качество воды соответствовало требованиям СанПиН, а корма — ГОСТа, действующим на момент проведения исследований. Все проводимые манипуляции осуществляли опытные лаборанты, прошедшие соответствующее обучение.
Во всех случаях эвтаназию осуществляли при помощи диоксида углерода (СО2) в специальной камере на 14‑й день исследования, после чего проводили внешний осмотр животных, вскрытие с последующей эвисцерацией внутренних органов. Полученный материал был зафиксирован в 10% формалине, обезвожен в спиртах восходящей плотности, залит в парафин, затем из него были изготовлены микропрепараты, окрашенные гематоксилином и эозином.
Статистический анализ
Программа Statistica 10 (StatSoft, США) была использована при расчете объема выборки.
Для всех полученных данных применена описательная статистика: данные проверены на соответствие закону нормального распределения, проверку осуществляли с помощью критерия Шапиро–Уилка. Сравнение номинальных данных проводили при помощи точного критерия Фишера. Статистическую значимость оценивали на уровне значения р<0,05. Статистический анализ выполняли с помощью программного обеспечения GraphPad Prism 9.0 (GraphPad, США).
Результаты
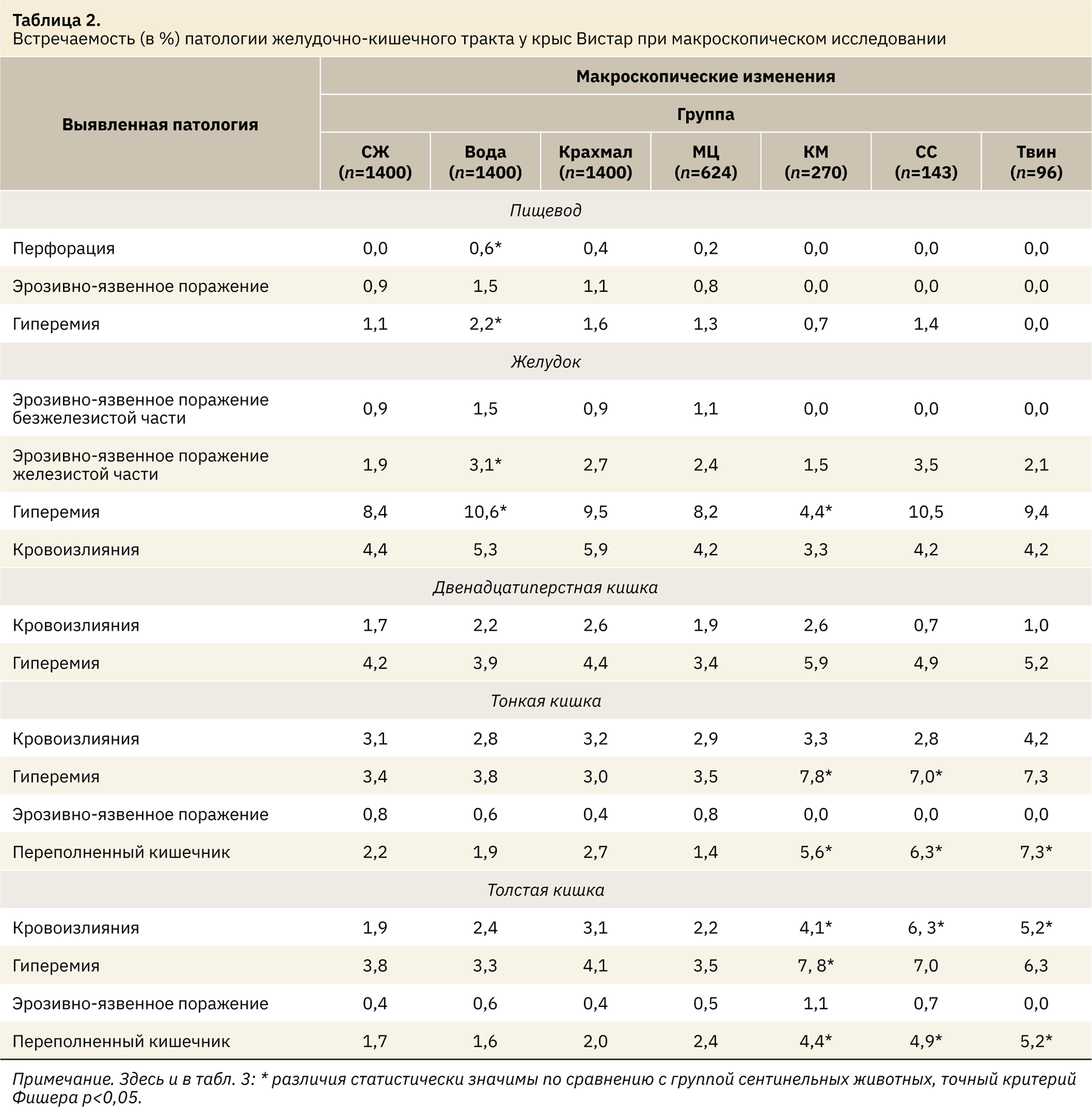
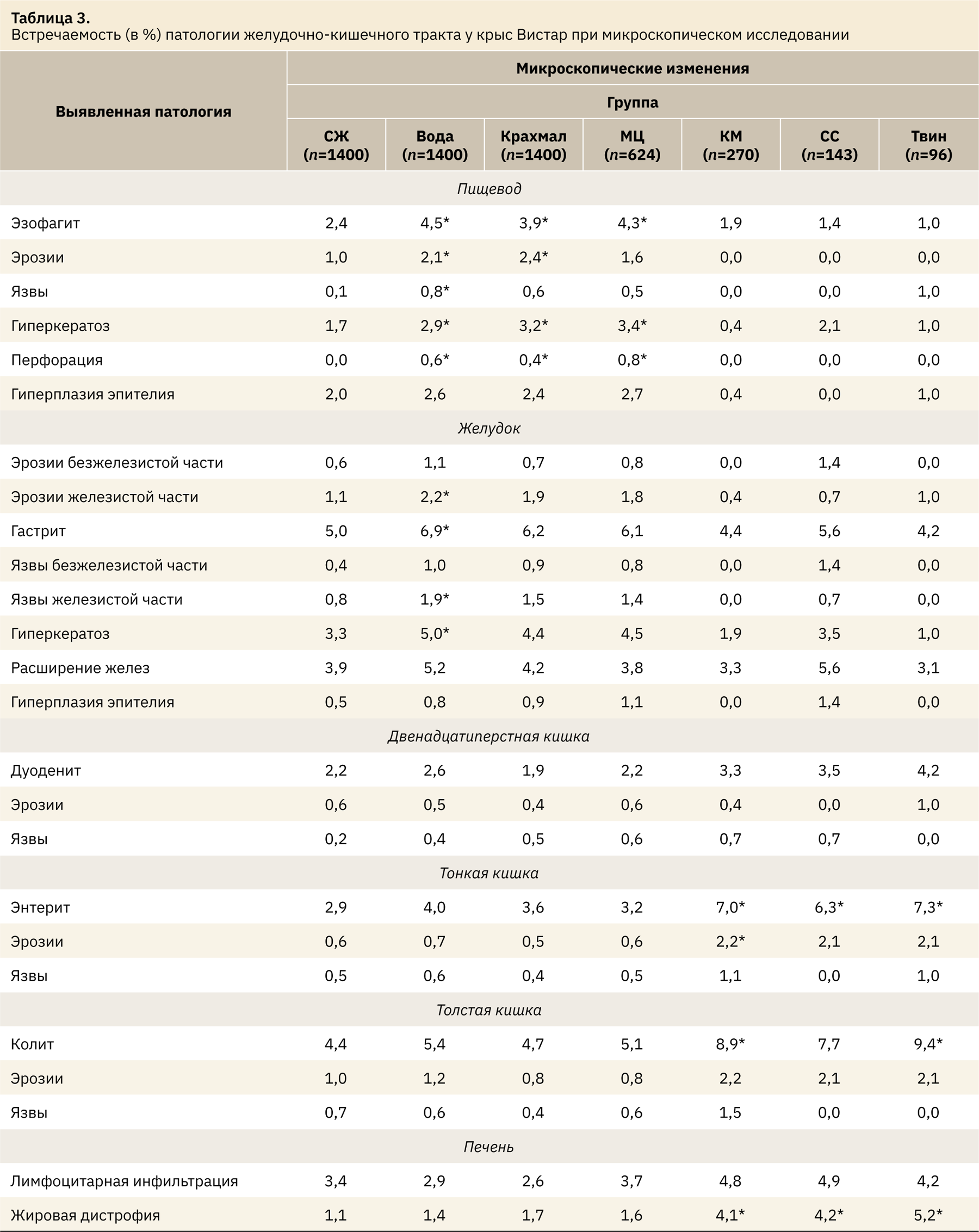
При макроскопической и микроскопической оценке тканей органов ЖКТ у большинства животных во всех группах строение соответствовало норме. Однако у ряда животных можно было наблюдать слабовыраженные изменения как видимые глазом, так и выявленные гистологически. Результаты представлены в табл. 2 и 3.
Пищевод
При сравнении сентинельных животных и животных, получавших воду на протяжении 14 дней, выявлено статистически значимое увеличение количества воспалительных заболеваний в верхних отделах пищеварительного тракта и желудке. При микроскопическом анализе тканей отмечено значительное, статистически значимое увеличение частоты развития эзофагита (с 2,4 до 4,5%; p=0,036), эрозий (с 1 до 2,1%; р=0,030), острых язв (с 0,1 до 0,8%; р=0,022), а также очагов гиперкератоза (с 1,7 до 2,9%; р=0,044). Микроскопическая картина не так выражена, но была сопоставима с макроскопическими изменениями: на фоне внутрижелудочного введения воды у 2,2% животных слизистая оболочка пищевода была гиперемирована и отечна на отдельных участках. Данные изменения характеризуют не раздражающее действие носителя на ткани, а механическое повреждение слизистой оболочки зондом во время проведения манипуляции.
При применении крахмала и МЦ у животных также возрастало количество случаев воспаления слизистой оболочки пищевода по сравнению с сентинельными животными, увеличивался и процент особей с развившимся гиперкератозом плоского эпителия пищевода. При использовании крахмала эрозии были выявлены в 2,4%, что статистически выше показателя группы сентинельных животных (точный критерий Фишера p=0,008).
Однако в группах при применении в качестве носителей КМ, СС и твина статистически значимые различия от группы сентинельных животных не обнаружены ни микроскопически, ни макроскопически. При этом даже наблюдалась тенденция к снижению патологических изменений, что объясняется прежде всего физическими свойствами данных носителей, поскольку они обладают вязкой консистенцией и действуют как смазывающие агенты, облегчая прохождение твердого зонда по слизистой оболочке. Кроме того, СС имеет приятный для животных вкус, в результате чего они легче приспосабливались к процедуре введения и охотно принимали вещество, не сопротивляясь в момент проведения манипуляции. В данных группах в отличие от остальных экспериментальных групп не отмечены и случаи перфорации пищевода, которые возникают чаще всего в результате активного сопротивления животного.
Желудок
Как и при изучении пищевода, у животных во время проведения манипуляции внутрижелудочного введения воды в качестве контрольного вещества по сравнению с сентинельными животными статистически значимо возросло количество случаев развития острого воспаления слизистой оболочки желудка. Данные изменения проявлялись в увеличении количества животных с острым катаральным гастритом (с 5 до 6,9%; p=0,045), эрозиями и язвами железистой части слизистой оболочки (с 1,1 и 0,8% до 2,2 и 1,9%; р<0,05), гиперкератозом плоского эпителия безжелезистой части (с 3,3 до 5%; р=0,028). Во время вскрытия у животных, получавших воду, было зафиксировано возрастание частоты развития гиперемии и отека отдельных участков слизистой оболочки желудка: 10,6% против 8,4% у сентинельных животных (р=0,045), а также эрозивно-язвенного поражения железистой части: у 1,9% в группе сентинельных животных и у 3,1% при проведении манипуляции (р=0,039). Таким образом, сама манипуляция внутрижелудочного введения провоцировала развитие воспалительных явлений в желудке, однако при анализе данных, зарегистрированных в группах, получавших крахмал и МЦ, статистическая значимость отсутствует, хотя и наблюдается тенденция к увеличению встречаемости. У животных при применении КМ и твина также не было статистических различий от группы сентинельных животных, но в данном случае процент выявленной патологии был ниже, чем в остальных группах.
Кишечник
Частота выявленных патологических изменений в двенадцатиперстной кишке не имела статистических различий между сентинельными животными и группами животных, получавших исследуемые носители. У небольшого числа животных были выявлены слабовыраженный дуоденит, единичные эрозии и язвы.
В тонкой кишке частота развития патологии не различалась между группами сентинельных животных и группами, получавшими воду, крахмал и МЦ. Так, развитие энтерита было отмечено у 2,9–4% животных (p>0,05).
Однако при сравнении групп сентинельных животных и животных, получавших КМ, СС и твин, обнаружено значительное увеличение случаев развития катарального энтерита. Также возрастало количество эрозий с 0,6% у сентинельных животных до 2,2% (р=0,016) на фоне применения масла. Макроскопические изменения в этих же группах были более выражены. У 5,6–7,3% животных кишка умеренно или выраженно расширена за счет большого количества газа в просвете, что значительно отличается (р<0,05) от проявлений у 1,4–2,7% в группах сентинельных животных и при применении воды, крахмала и МЦ. Кроме того, отмечено почти двукратное повышение количества животных (с 3,8% до примерно 7%) с развитием полнокровия участков кишки.
Такие же изменения можно было наблюдать и в толстой кишке. Введение воды, крахмала или МЦ не повлияло на частоту развития спонтанной патологии, и ее уровень встречаемости соответствовал таковому у сентинельных животных — 4,4% (р>0,05). При этом КМ и твин достоверно (p=0,004 и р=0,039) способствовали развитию воспаления в кишке. При использовании СС хотя и не была установлена статистическая значимость (точный критерий Фишера р=0,092), однако все же была близка к таковой, а доля животных с колитом увеличилась до 7,7%. Макроскопически наиболее выраженными изменениями являлись расширение кишечника за счет усиленного газообразования, разжижение кишечного содержимого, а также единичные или множественные кровоизлияния со стороны серозной оболочки кишки, сопровождающиеся гиперемией стенки. Данные изменения имели как выраженную тенденцию (точный критерий Фишера приближался к 0,05), так и статистически значимые различия с таковыми у группы сентинельных животных (p<0,05). Выявленная патология не связана с прямым токсическим действием веществ, а является следствием изменения микробиоты кишечника, что неоднократно было исследовано. При пероральном введении масла в краткосрочных исследованиях наблюдалось незначительное снижение и изменение микробного состава в кишечнике, а также повышение провоспалительных цитокинов [22] и усиление пролиферации [23], что в долгосрочной перспективе могло привести к неопластическим заболеваниям [5, 24, 25]. Немало исследований посвящено и воздействию твина [26–29] и сахаров [30–33] на организм животных, где описаны их негативные эффекты, способность провоцировать развитие дисбактериоза. Так, было изучено, что эмульгаторы, в том числе твин, при длительном пероральном применении способствуют снижению защитных свойств слизи кишечника, усиливают адгезию патогенных и условно-патогенных бактерий к энтероцитам [34], увеличивают высвобождение лактатдегидрогеназы [35], что в совокупности может привести к развитию симптомов раздраженного кишечника.
Печень
Во всех группах (2,6–4,9% животных) были обнаружены небольшие единичные участки лимфоплазмоцитарной инфильтрации, расположенные как перипортально, так и фокально в разных отделах долек, а также гепатоциты в очаге воспаления с признаками дистрофии. При этом не более чем у 1,1% животных можно было выявить небольшие, единичные очаги некроза гепатоцитов. Различий в частоте встречаемости данных изменений обнаружено не было, точный критерий Фишера во всех случаях был больше 0,05.
Не редкостью являлось наличие отдельных небольших участков мелкокапельной жировой дистрофии гепатоцитов, которые преимущественно располагались центролобулярно у центральной вены. Патология была выявлена в равной мере (р>0,05) у сентинельных животных и в группах, получавших воду, крахмал и МЦ, и составляла от 1,1 до 1,7%. Однако на фоне применения КМ, СС и твина очаги были обнаружены у 4,1–5,2% животных, что статистически отличалось от уровня у сентинельных животных (точный критерий Фишера р<0,05). При этом очаги поражения были более выражены, а жировые вакуоли в гепатоцитах крупнее, но воспалительная инфильтрация или некрозы были нехарактерны. Эти изменения также были описаны в литературе и отмечены как редкие или случайные, кроме того, указано, что мыши более чувствительны к воздействию данных веществ, чем крысы [29, 30, 33, 36, 37]. В данных исследованиях выявлено повышение активности печеночных ферментов, а также изменение уровня желчных кислот в просвете кишечника, что в свою очередь усиливало проявления дисбактериоза за счет нарушения взаимоотношений кишечной микрофлоры, активируя ее провоспалительный потенциал [28, 29]. Длительное применение КМ влияло на антиоксидантную систему печени, снижая активность каталазы, что также может способствовать усилению дистрофии гепатоцитов [38].
Обсуждение
Фоновые заболевания органов ЖКТ крыс Вистар не являются редким явлением, но их частота возникновения не велика и по отдельным патологиям не превышает 5% в популяции. Кроме того, данный показатель не является всеобъемлющим, поскольку отражает состояние здоровья животных в конкретном виварии и может меняться в зависимости от множества факторов, например, климата, времени года, размера вивария и, конечно, профессионализма персонала. Поэтому крайне важно вести периодический контроль здоровья животных и формировать базы данных.
Процедура перорального введения тестируемых веществ в течение 14 дней с использованием специального зонда может оказывать негативное влияние на верхние отделы тракта за счет травмирования слизистой оболочки пищевода и желудка, вызывая воспалительные заболевания, эрозивно-язвенные поражения, а также способствовать пролиферации эпителия, вероятно, в результате длительного воспалительного процесса. Однако использование носителей, таких как КМ, СС и твин-80, дающих эффект смазывания поверхности, облегчает проведение манипуляции, уменьшает не только травматизацию слизистых оболочек зондом, но и частоту развития патологии. Кроме того, СС, имея приятный для животных вкус, позволяет приучить их к манипуляции, а значит, проводить ее с меньшим стрессом для крыс, что влечет за собой и менее значительные повреждения. Стоит отметить, что проблема стресса поднималась исследователями неоднократно, и многие из них рекомендуют использовать подсластители при приготовлении тестируемых субстанций, если это не влияет на тестируемое вещество [39–41].
Процедура внутрижелудочного введения, а также использование в качестве носителей 1% крахмала и 0,5% метилцеллюлозы не оказали какого‑либо влияния на ткани кишечника и печени. Преимущественно были выявлены слабовыраженная воспалительная инфильтрация слизистой оболочки тонкой и толстой кишки, а также единичные эрозии и язвы. Однако прием внутрь масла, СС и твина-80 со статистической достоверностью приводило у животных к увеличению частоты встречаемости воспалительной патологии кишечника по сравнению с сентинельными животными. У данных животных отмечались макроскопические признаки энтероколита, такие как гиперемия стенки, расширение просвета кишечника за счет газа, большого объема химуса и неоформленных каловых масс, что при микроскопическом анализе было подтверждено наличием отека, полнокровия и преимущественно умеренно выраженной воспалительной инфильтрации слизистой оболочки тонкой и толстой кишки. Энтерит был выявлен примерно у 7%, а колит — у 9% животных. В этих же группах в ткани печени чаще фиксировали наличие участков жировой дистрофии гепатоцитов. Данные изменения связаны с неблагоприятным воздействием веществ на микробиоту кишечника, а также на метаболическую и антиоксидантную функцию печени, синтез желчных кислот.
Данная статья будет полезна специалистам, работающим в области доклинических исследований. Она показывает, что используемые животные в своей популяции не являются абсолютно здоровыми, как бы нам того хотелось, часть патологии желудочно-кишечного тракта, выявляемой в ходе научно-исследовательских работ, не относится к эффектам исследуемых субстанций, а является следствием проводимых манипуляций, применяемых носителей или условий содержания. Именно поэтому исследователи должны всесторонне рассматривать и анализировать полученные результаты, чтобы достоверно выявить все эффекты тестируемых веществ и учитывать наличие фоновой патологии. Также крайне важно постоянно контролировать здоровье животных, вести учет исторических контрольных данных, в том числе по фоновой патологии колоний лабораторных животных, и проводить ретроспективную оценку этих показателей.
Выводы
- Процедура внутрижелудочного введения оказывает провоспалительное действие на ткани верхних отделов желудочно-кишечного тракта (пищевода и желудка).
- При использовании крахмального геля и метилцеллюлозы можно ожидать повреждение слизистой оболочки пищевода с последующим развитием воспаления тканей.
- Крахмальный гель, сахарный сироп и твин в силу своих физических свойств облегчают введение, не влияют на морфологию верхнего отдела желудочно-кишечного тракта, но провоцируют энтеропатии, а также метаболические нарушения печени.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Вклад авторов
Я.А. Гущин — получение данных для анализа, описание и анализ патоморфологических исследований, критический анализ статьи.
П.Д. Шабанов — разработка концепции и дизайна исследования, анализ рукописи и литературы с внесением ценного интеллектуального содержания.
С.В. Гущина — обзор публикаций по теме статьи, анализ данных.
Список источников
- Thackaberry E.A. Vehicle selection for nonclinical oral safety studies // Expert Opin Drug Metab Toxicol. 2013. Vol. 9. N. 12. P. 1635–1646. DOI: 10.1517/17425255.2013.840291.
-
Gad S.C. Drug Safety Evaluation: Third Edition. 2016. 920 p.
-
Гущина С.В., Косман В.М., Макарова М.Н., Шиков А.Н. Доклинические исследования стабильности суспензий, приготовленных из готовых лекарственных препаратов // Фармация. 2017. Т. 66. № 3. С. 27–32 [Gushchina S.V., Kosman V.M., Makarova M.N., Shikov A.N. Doklinicheskie issledovaniya stabil’nosti suspenzii, prigotovlennykh iz gotovykh lekarstvennykh preparatov // Farmatsiya. 2017. Vol. 66. N. 3. P. 27–32 (In Russ)].
-
Краснюк И.И., Михайлова Г.В.. Фармацевтическая технология. Технология лекарственных форм: учебник. Москва: ГЭОТАР-Медиа. 2011. 656 с. [Krasnyuk I.I., Mikhailova G.V.. Farmatsevticheskaya tekhnologiya. Tekhnologiya lekarstvennykh form: uchebnik. Moskva: GEHOTAR-Media. 2011. 656 p. (In Russ)].
-
Wu B., Iwakiri R., Ootani A. et al. Dietary corn oil promotes colon cancer by inhibiting mitochondria-dependent apoptosis in azoxymethane-treated rats // Exp. Biol. Med. (Maywood). 2004. Vol. 229. N. 10. P. 1017–1025. DOI: 10.1177/153537020422901005.
-
Ким М.Е., Степанова Э.Ф., Евсеева С. Б. Сиропы: состав, технология, современное состояние исследований (обзор литературы) // Фармация и фармакология. 2014. № 2 (3, 4). С. 7–14. DOI: 10.19163/2307‑9266‑2014‑2‑3(4)-7-14 [Kim M.E., Stepanova EH. F., Evseeva S.B. Siropy: sostav, tekhnologiya, sovremennoe sostoyanie issledovanii (obzor literatury) // Farmatsiya i farmakologiya. 2014. N. 2 (3, 4). P. 7–14. (In Russ)].
-
Авдеева О.И., Макарова М.Н., Кательникова А.Е., Симановская М.С. Оценка токсического действия некоторых носителей, используемых в доклинических исследованиях // Международный вестник ветеринарии. 2016. № 4. С. 90–96. [Avdeeva O.I., Makarova M.N., Katel’nikova A.E., Simanovskaya M.S. Otsenka toksicheskogo deistviya nekotorykh nositelei, ispol’zuemykh v doklinicheskikh issledovaniyakh // Mezhdunarodnyi vestnik veterinarii. 2016. N. 4. Р. 90–96. (In Russ.)].
-
Руководство по проведению доклинических исследований лекарственных средств / ФГБУ «НЦЭСМП» Минздравсоцразвития России. Москва: Гриф и К. 2012. 944 с. [Rukovodstvo po provedeniyu doklinicheskikh issledovanii lekarstvennykh sredstv / FGBU «NTSEHSMP» Minzdravsotsrazvitiya Rossii. Moskva: Grif i K. 2012. 944 p. (In Russ.)].
-
Гущина С. В., Макарова М.Н., Пожарицкая О.Н. Сравнительное токсикологическое изучение носителей для лекарственных средств, применяемых в доклинических исследованиях // Международный вестник ветеринарии. 2015. № 3. С. 92–98. [Gushchina S.V., Makarova M.N., Pozharitskaya O.N. Sravnitel’noe toksikologicheskoe izuchenie nositelei dlya lekarstvennykh sredstv, primenyaemykh v doklinicheskikh issledovaniyakh // Mezhdunarodnyi vestnik veterinarii. 2015. N. 3. P. 92–98. (In Russ.)].
-
Healing G., Sulemann T., Cotton P. et al. Safety data on 19 vehicles for use in 1 month oral rodent pre-clinical studies: administration of hydroxypropyl-ß-cyclodextrin causes renal toxicity // J. Appl. Toxicol. 2016. Vol. 36. N. 1. P. 140–150. DOI: 10.1002/jat.3155.
-
Gad S.C., Cassidy C.D., Aubert N., Spainhour B., Robbe H. Nonclinical vehicle use in studies by multiple routes in multiple species // Int.J. Toxicol. 2006. Vol. 25. N. 6. P. 499–521. DOI: 10.1080/10915810600961531.
-
Thackaberry E.A. Vehicle selection for nonclinical oral safety studies // Expert Opin Drug Metab Toxicol. 2013. Vol. 9. N. 12. P. 1635–1646. DOI: 10.1517/17425255.2013.840291.
-
Long G.G., Hardisty J.F. Regulatory forum opinion piece: thresholds in toxicologic pathology // Toxicol. Pathol. 2012. Vol. 40. P. 1079–1081.
-
McInnes E.F. Background Lesions in Laboratory Animals. A Color Atlas. Elsevier Health Sciences, 2011.
-
Макаренко И.Е., Авдеева О.И., Ванатиев Г.В. Рыбакова А.В., Ходько С.В., Макарова М.Н., Макаров В.Г. Возможные пути и объемы введения лекарственных средств лабораторным животным // Международный вестник ветеринарии. 2013. № 3. С. 78–84. [Makarenko I.E., Avdeeva O.I., Vanatiev G.V. Rybakova A.V., Khod’ko S. V., Makarova M.N., Makarov V.G. Vozmozhnye puti i ob’emy vvedeniya lekarstvennykh sredstv laboratornym zhivotnym // Mezhdunarodnyi vestnik veterinarii. 2013. N. 3. P. 78–84. (In Russ.)].
-
Рыбакова А.В., Макарова М.Н., Кухаренко А.Е., Вичаре А.С., Рюффер Ф. Существующие требования и подходы к дозированию лекарственных средств лабораторным животным // Ведомости Научного центра экспертизы средств медицинского применения. 2018. Т. 8 № 4. С. 207–217. DOI: 10.30895/1991‑2919‑2018‑8‑4‑207‑217 [Rybakova A.V., Makarova M.N., Kukharenko A.E., Vichare A.S., Ryuffer F. Sushchestvuyushchie trebovaniya i podkhody k dozirovaniyu lekarstvennykh sredstv laboratornym zhivotnym // Vedomosti Nauchnogo tsentra ehkspertizy sredstv meditsinskogo primeneniya. 2018. Vol. 8 N. 4. P. 207–217. DOI: 10.30895/1991‑2919‑2018‑8‑4‑207‑217 (In Russ.)].
-
Turner P.V., Pekow C., Vasbinder M.A., Brabb T. Administration of substances to laboratory animals: equipment considerations, vehicle selection, and solute preparation // J. Am. Assoc. Lab. Anim. Sci. 2011. Vol. 50. N. 5. P. 614–627.
-
Blankenship B., Skaggs H. Findings in Historical Control Harlan RCCHanTM: WIST Rats from 4-, 13-, 26‑Week Studies // Toxicol Pathol. 2013. Vol. 41. N. 3. P. 537–547. DOI: 10.1177/0192623312460925.
-
Tucker M.J. Diseases of the Wistar rat. London: Taylor & Francis, 1997.
-
Damsch S., Eichenbaum G., Looszova A. et al. Unexpected Nasal Changes in Rats Related to Reflux after Gavage Dosing // Toxicologic Pathology. 2011. Vol. 39. N. 2. P. 337–347. DOI: 10.1177/0192623310388430.
-
Damsch S., Eichenbaum G., Tonelli A. et al. Gavage-Related Reflux in Rats: Identification, Pathogenesis, and Toxicological Implications (Review) // Toxicologic Pathology. 2011. Vol. 39. N. 2. P. 348–360. DOI: 10.1177/0192623310388431.
-
Gokulan K., Kumar A., Lahiani M.H., Sutherland V.L., Cerniglia C.E., Khare S. Differential Toxicological Outcome of Corn Oil Exposure in Rats and Mice as Assessed by Microbial Composition, Epithelial Permeability, and Ileal Mucosa-Associated Immune Status // Toxicol Sci. 2021. Vol. 26. N. 180 (1). P. 89–102. DOI: 10.1093/toxsci/kfaa177.
-
Anderson R.L. Intestinal responses in the male rat to gavaged corn oil // Cancer Lett. 1987. Vol. 36. N. 1. P. 55–63. DOI: 10.1016/0304-(87)90102-9.
-
National Toxicology Program. NTP Comparative Toxicology Studies of Corn Oil, Safflower Oil, and Tricaprylin (CAS Nos. 8001‑30‑7, 8001‑23‑8, and 538‑23‑8) in Male F344/N Rats as Vehicles for Gavage // Natl Toxicol Program Tech Rep Ser. 1994. 426. P. 1–314.
-
Haseman J.K., Rao G.N. Effects of corn oil, time-related changes, and inter-laboratory variability on tumor occurrence in control Fischer 344 (F344/N) rats // Toxicol Pathol. 1992. N. 20 (1). P. 52–60. DOI: 10.1177/019262339202000107.
-
Laudisi F., Stolfi C., Monteleone G. Impact of Food Additives on Gut Homeostasis // Nutrients. 2019. N. 1; 11(10). P. 23–34. DOI: 10.3390/nu11102334.
-
Naimi S., Viennois E., Gewirtz A.T., Chassaing B. Direct impact of commonly used dietary emulsifiers on human gut microbiota // Microbiome. 2021. N. 22; 9(1). P. 66. DOI: 10.1186/s40168‑020‑00996‑6.
-
Li Y., Xiao H., Dong J. et al. Gut Microbiota Metabolite Fights Against Dietary Polysorbate 80‑Aggravated Radiation Enteritis // Front Microbiol. 2020. N. 26. P. 11–1450. DOI: 10.3389/fmicb.2020.01450.
-
Singh R.K., Wheildon N., Ishikawa S. Food Additive P-80 Impacts Mouse Gut Microbiota Promoting Intestinal Inflammation, Obesity and Liver Dysfunction // SOJ Microbiol Infect. Dis. 2016. N. 4(1). DOI: 10.15226/sojmid/4/1/00148.
-
Wang X., Zhu L., Li X., Wang X., Hao R., Li J. Effects of high fructose corn syrup on intestinal microbiota structure and obesity in mice // NPJ Sci Food. 2022. N. 2; 6(1). P. 17. DOI: 10.1038/s41538‑022‑00133‑7.
-
Matsuo T. et al. Ninety-day oral toxicity study of rare sugar syrup in male Wistar rats // Current topics in toxicology. 2011. N. 7. P. 41–50.
-
Sun S., Araki Y., Hanzawa F. et al. High sucrose diet-induced dysbiosis of gut microbiota promotes fatty liver and hyperlipidemia in rats // J. Nutr. Biochem. 2021. Vol. 93. P. 108621. DOI: 10.1016/j.jnutbio.2021.108621.
-
Alam YH, Kim R, Jang C. Metabolism and Health Impacts of Dietary Sugars // J. Lipid Atheroscler. 2022. Vol. 11. N. 1. P. 20–38. DOI: 10.12997/jla.2022.11.1.20.
-
Chassaing B., Koren O., Goodrich J.K., Poole A.C., Srinivasan S., Ley R.E., Gewirtz A.T. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome // Nature. 2015. Vol. 519. N. 7541. P. 92–96. DOI: 10.1038/nature14232.
-
Oberle R.L., Moore T.J., Krummel D.A. Evaluation of mucosal damage of surfactants in rat jejunum and colon // J. Pharmacol Toxicol Methods. 1995. N. 33(2). P. 75–81. DOI: 10.1016/1056-8719(94)00060‑h.
-
Jensen T., Abdelmalek M.F., Sullivan S. et al. Fructose and sugar: A major mediator of non-alcoholic fatty liver disease // J. Hepatol. 2018. N. 68(5). P. 1063–1075. DOI: 10.1016/j.jhep.2018.01.019.
-
Thackaberry E.A., Kopytek S., Sherratt P., Trouba K., McIntyre B. Comprehensive investigation of hydroxypropyl methylcellulose, propylene glycol, polysorbate 80, and hydroxypropyl-beta-cyclodextrin for use in general toxicology studies // Toxicol Sci. 2010. N. 117(2). P. 485–492. DOI: 10.1093/toxsci/kfq207.
-
Dauqan E., Sani H.A., Abdullah A., Kasim Z.M. Effect of four different vegetable oils (red palm olein, palm olein, corn oil, coconut oil) on antioxidant enzymes activity of rat liver // Pak J. Biol. Sci. 2011. N. 15; 14(6). P. 399–403. DOI: 10.3923/pjbs.2011.399.403.
-
Teixeira-Santos L., Albino-Teixeira A., Pinho D. An alternative method for oral drug administration by voluntary intake in male and female mice // Lab. Anim. 2021. N. 55(1). P. 76–80. DOI: 10.1177/0023677220950782.
-
Diogo L.N., Faustino I.V., Afonso R.A. et al. Voluntary Oral Administration of Losartan in Rats // J. Am. Assoc. Lab. Anim. Sci. 2015. N. 54(5). P. 549–556.
- Chesler K.C., Motz C.T., Bales K.L., Allen R.A., Vo H.K., Pardue M.T. Voluntary oral dosing for precise experimental compound delivery in adult rats // Lab. Anim. 2021 N. 56. P. 147–156. DOI: 10.1177/00236772211016926.




