Рекомендуемые способы поения лабораторных животных. Технические особенности. Обеспечение благополучия и здоровья лабораторных животных
Работа выполнена без спонсорской поддержки.
Бондарева Е.Д., Акимова М.А., Веснина Е.В. Рекомендуемые способы поения лабораторных животных. Технические особенности. Обеспечение благополучия и здоровья лабораторных животных. Лабораторные животные для научных исследований. 2022; 2. https://doi.org/10.29296/2618723X-2022-02-08
Резюме
В статье представлен опыт использования различных систем поения лабораторных животных. Рассмотрены способы поения с учетом видоспецифичных особенностей животных.
Гранулированные корма не всегда могут отвечать всем требованиям, предъявляемым к необходимому составу микроэлементов. При отсутствии какого‑либо компонента корм необходимо поменять или рассмотреть возможность добавки недостающего компонента в питьевую воду, что будет способствовать нормальному функционированию организма животных, например, обеспечит потребность морских свинок в витамине С. Однако витамин C быстро разрушается под действием света, тепла и влаги. Поэтому для лабораторных морских свинок потребуются поилки из темного стекла или правильный расчет дозы с учетом скорости разрушения витамина С.
Инвентарь, использующийся при поении животных, должен быть безопасен для их здоровья. Большинство поилок, предлагаемых для этих целей, изготовлено из наиболее дешевого материала — пластика, в частности, поликарбоната. Для производства поликарбоната масштабно используют бисфенол А (BPA), который способен выделяться из посуды в пищу и воду. По нашему опыту наиболее приемлемым материалом для изготовления элементов системы поения [емкости для хранения воды (поилки), трубки для подачи воды] является стекло. Стеклянные поилки легко поддаются мытью и дезинфекции, имея гладкую поверхность, загрязнения биологической, химической и иной природы не задерживаются на стенках поилок. Благодаря прозрачности легко отслеживается загрязненность поилок и воды визуально.
Имеют большое значение методы дезинфекции всех элементов системы поения и материалы, из которых изготовлены поилки, так как любое микробное загрязнение питьевой воды может повлиять на здоровье лабораторных животных и результаты экспериментов.
Однако стоит помнить, что поилки из стекла тяжелее изготовленных из пластика, это требуется учитывать при разработке норм подъема и перемещения тяжестей для персонала. Сотрудникам, осуществляющим работу со стеклянными поилками, необходимо соблюдать технику безопасности.
Введение
Поение лабораторных животных — естественный и непременный технологический процесс испытательного центра, проводящего доклинические испытания лекарственных средств. Как и любой другой технологический процесс, процедура поения должна иметь четко определенную структуру и алгоритм действия. Во избежание вопросов и путаницы при обслуживании животных процесс поения описывают в инструкции как стандартную операционную процедуру.
Поение как технологический процесс затрагивает несколько объектов, каждый из которых может повлиять на качество поения в целом. Среди этих объектов основными являются следующие: питьевая вода и средства поения.
1. Питьевая вода должна соответствовать утвержденным нормативам по бактериологическим, химическим и органолептическим показателям. На качество воды может повлиять сразу несколько факторов — остатки биологических загрязнений или дезинфицирующих химических веществ на поверхностях поилок вследствие некачественного мытья, присутствие вредных веществ в воде, выделяющихся из материала, потеря свежести вследствие длительного хранения и др.
2. Средства поения изготавливаются из разных материалов, которые не всегда могут быть безопасны. Это в первую очередь касается изделий из пластика, содержащего в составе вредные вещества. Некоторые элементы систем поения могут вызывать не только сложности у молодых животных при питье, но также быть травмоопасны.
Рассмотрим каждый объект отдельно для установления полного контроля над всем процессом, минимизируя потенциальные риски, способные повлиять на качество процесса.
Питьевая вода
Питьевая вода, подаваемая лабораторным животным, обязана соответствовать требованиям СанПиН 2.1.3684–21 «Санитарно-эпидемиологические требования к содержанию территорий городских и сельских поселений, водным объектам, питьевой воде и питьевому водоснабжению, к атмосферному воздуху, почвам, жилым помещениям, эксплуатации производственных, общественных помещений, организации и проведению санитарно-противоэпидемических (профилактических) мероприятий» (табл. 1), иначе она может представлять серьезную угрозу как для здоровья и благополучия животных, так и для достоверности экспериментальных данных [1, 2].

Лабораторные исследования качества и безопасности питьевой воды централизованного водоснабжения проводят минимум 1 раз в 6 мес. Отбор проб воды проводят из всех точек водораздачи.
Корма, как и вода, также служат источником микроэлементов для животных. Рацион питания лабораторных животных составляют зоотехники испытательного центра, учитывая индивидуальные особенности видов и необходимые животным микроэлементы. При использовании комбинированных гранулированных кормов рекомендуется проводить оценку их качественного и количественного состава в аккредитованных лабораториях. В случае отсутствия какого‑либо компонента корм необходимо поменять или рассмотреть возможность добавки недостающего компонента в питьевую воду.
Для примера рассмотрим морских свинок, которые в лабораторных условиях чаще потребляют комбинированные корма, в которых отсутствует витамин С (или содержится в недостаточном количестве), поэтому животные нуждаются в обогащении витамином питьевой воды и корма. Количество витамина С, необходимое взрослым морским свинкам, составляет около 20–25 мг/день, а для беременных морских свинок — до 30–40 мг/день [3–6].
Следуя тактике добавления витамина С в питьевую воду, важно иметь в виду, что витамин C быстро разрушается под действием света, тепла и влаги. Подсчитано, что примерно через 8 ч количество активного витамина С в воде составляет менее 50% от первоначально добавленного количества в прозрачных поилках. Поэтому для лабораторных морских свинок потребуются поилки из темного стекла или правильный расчет дозы с учетом скорости разрушения витамина С, возможно также дополнительное кормление свежими овощами [7].
В связи с неудовлетворительными результатами поиска поилок из темного стекла и специальных кормов с добавлением стабилизированной формы витамина С (финансово не осуществимо даже для крупного испытательного центра) было решено провести исследование по оценке стабильности витамина С в поилках из прозрачного стекла при поении морских свинок с целью пересмотра исходной концентрации. До проведения исследования в соответствии с утвержденной стандартной операционной процедурой для поения морских свинок готовили 10% раствор аскорбиновой кислоты, 1 мл раствора добавляли в поилку с водой, доводили до 450 мл, что соответствовало концентрации 0,22 мг/мл в поилке. Из расчета потребления воды в сутки 10–12 мл на 100 г массы тела фактическое количество получаемого витамина С морскими свинками должно было удовлетворить суточную потребность при условии сохранения исходной концентрации раствора.
Исследование проводили в помещении содержания морских свинок в условиях искусственного освещения (люминесцентные лампы). Световой режим составил 12 ч света и 12 ч темноты с уровнем освещенности около 200 лк на нижних полках и около 250 лк на верхних полках стеллажей с клетками для содержания животных. Оценку остаточной концентрации витамина С в нескольких временных точках в течение суток проводили методом высокоэффективной жидкостной хроматографии с ультрафиолетовым детектированием.
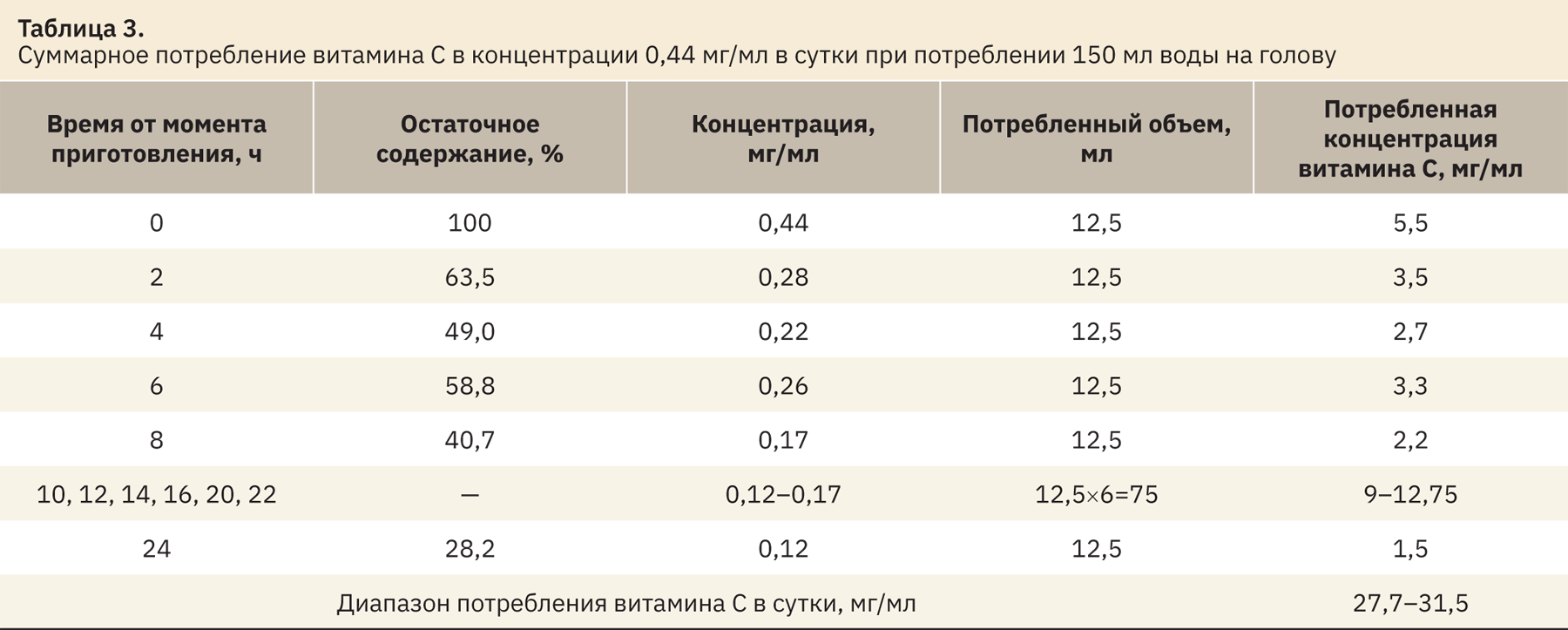
Проведенное исследование показало, что концентрация витамина С в растворе уменьшается на 75% в течение суток. Эксперимент повторили, увеличив начальную концентрацию витамина С в поилках в 2 раза (до 0,44 мг/мл).
Остаточная концентрации витамина С в растворе питьевой воды в процентах на временных точках была пересчитана на миллиграммы в 1 мл. При потреблении 150 мл в сутки на каждые 2 ч потребление составило 12,5 мл. На каждую исследованную временную точку (0, 2, 4, 6, 8, 24 ч) рассчитали потребленную концентрацию витамина С (например, 12,5 мл · 0,22 мг/мл). На временных точках 10, 12, 14, 16, 20 и 22 ч измерения концентрации витамина С не проводили, в связи с чем для расчета потребленной концентрации витамина С в указанный период оставшийся объем раствора 75 мл умножали на концентрацию последней точки 24 ч и на концентрацию точки 8 ч для получения диапазона концентраций. Результаты представлены в табл. 2 и 3.
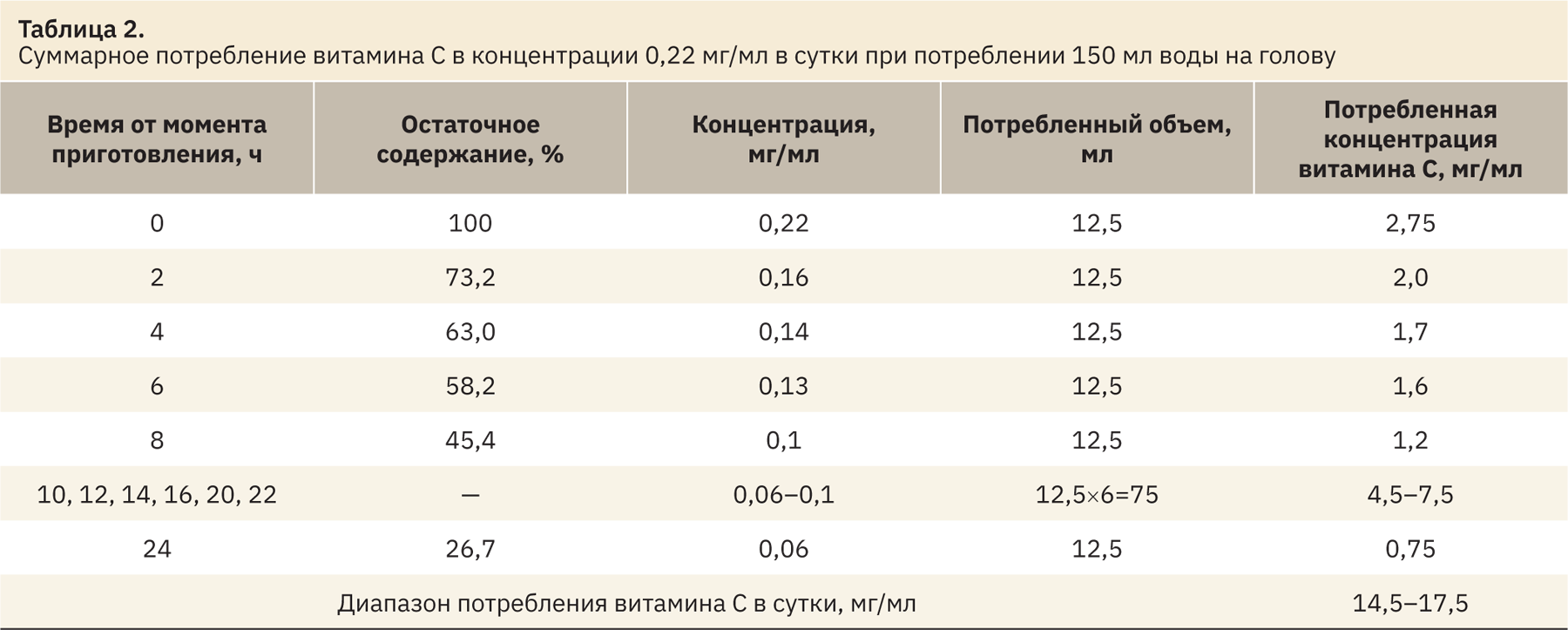
В ходе разрушения витамина С в поилке при исходной концентрации раствора 0,22 мг/мл фактическое количество потребленного витамина С морскими свинками составляет 14,5–17,6 мг/сут, при норме потребления 20–25 мг/сут (30–40 мг/мл для беременных самок).
При использовании раствора витамина С в исходной концентрации 0,44 мг/мл фактическое потребление составляет 27,7–31,5 мг/сут.
Полученные результаты легли в основу изменений стандартной операционной процедуры: была увеличена концентрация витамина С в растворе для поения морских свинок до 0,44 мг/мл.
Средства поения
Инвентарь, использующийся для поения животных, должен быть безопасен для их здоровья. Ассортимент систем поения лабораторных животных довольно широко представлен на рынке. Большинство поилок, предлагаемых для поения животных, изготовлено из наиболее дешевого материала — пластика, в частности, поликарбоната. Для производства поликарбоната масштабно используют бисфенол А (BPA), который способен выделяться из посуды в пищу и воду. Бисфенол А, синтетический эстроген, который может провоцировать нарушения эндокринной системы, сердечно-сосудистые и онкологические заболевания, вызывать нарушения ЦНС и др. [8].
К сожалению, степень воздействия бисфенола А на лабораторных животных не достаточно освещена в источниках литературы, однако во избежание рисков следует внимательно относиться к материалам, из которых изготавливаются поилки для лабораторных животных.
Учитывая небезопасность использования пластика в качестве материала для поения животных, а также проблематичность его мытья и дезинфекции, предпочтительными для обслуживания лабораторных мелких грызунов являются поилки из стекла. Для крупных животных (лабораторных хорьков, кроликов) устанавливать стеклянные системы поения рискованно, так как животные могут выбить поилки из держателей и разбить их, а также легко разгрызть стеклянные носики. В данном случае использование пластиковых поилок является неизбежным, а вместо стеклянных трубок для поения лучше использовать металлические. При выборе пластиковых поилок следует обращать внимание на маркировку. Безопасным считается пластик с маркировкой BPA free и PP5. PP (Polypropylene): полипропилен считается одним из наиболее безопасных видов пластика. Используется при производстве контейнеров для йогурта, трубочек для питья и полупрозрачных пластиковых контейнеров, включая бутылочки для младенцев. BPA-free означает, что при производстве тары не использовался бисфенол А.
Для лабораторных собак, карликовых свиней, приматов используются металлические миски, так как требуется очень прочный к повреждениям материал. Самыми надежными и удобными оказались гастроемкости из нержавеющей стали (рис. 1, 2).


Обеспечение лабораторных животных питьевой водой надлежащего качества и периодический мониторинг качества воды крайне важны для здоровья лабораторных животных, используемых в исследованиях.
Кроме химических загрязнений, в питьевой воде могут присутствовать бактериологические загрязнения. Лабораторные животные в процессе питья загрязняют носики поилок (трубки для питья) остатками пищи и слюны, что приводит к загрязнению и воды.
У большинства видов лабораторных животных поилки с водой нужно менять ежедневно, у мелких грызунов (хомячки, мыши, крысы) — не реже 1 раза в 3 дня. Для контроля замены поилки следует маркировать, указывая дату разлива воды. Наиболее удобным вариантом маркировки поилок, по собственному опыту, является этикет-пистолет, позволяющий маркировать большое количество поилок за максимально короткое время.
Поилки для лабораторных животных должны проходить регулярную мойку и дезинфекцию. Методы обработки поилок следует тщательно оценивать, поскольку остатки дезинфицирующих средств на поверхности поилок и, как следствие, в питьевой воде могут вызывать снижение потребления воды, влиять на состояние здоровья лабораторных животных и результаты экспериментов. Рекомендуется избегать использования хлорсодержащих средств для дезинфекции инвентаря по уходу за лабораторными животными, предпочтительно использовать дезинфицирующие средства на основе четвертично-аммониевых соединений и альдегидов [9, 10].
Для дезинфекции и мытья стеклянных поилок и их составляющих рекомендуется использовать комбинированные методы — ручной метод для предварительной очистки и аппаратный — посудомоечную машину, ультразвуковую ванну. Посудомоечная машина обеспечивает ополаскивание поилок сильной струей горячей воды и смывание возможных оставшихся загрязнений после ручного ополаскивания, а также остатков дезинфицирующих средств. Ультразвуковая ванна позволяет очистить устойчивые загрязнения в виде отложений, которые проблематично убрать вручную ввиду строения некоторых элементов системы поения, например, стеклянных носиков, имеющих строение лабораторных пипеток с очень маленьким внутренним диаметром.
В качестве примера ниже представлен опыт по подбору режима дезинфекции стеклянных поилок и трубок для поения (носиков). Для определения эффективности проведения дезинфекции ориентировались на остаток дезинфицирующего средства в поилках, визуальную чистоту и наличие санитарно-показательных микроорганизмов в смывах (бактерии группы кишечной палочки, стафилококк). Остаток дезинфицирующего средства на поилках определяли с помощью салфеток индикаторных. Салфетки индикаторные представляли собой пропитанную специальным раствором бумагу желтого цвета, при наличии следов дезинфицирующих средств на основе четвертично-аммониевых соединений на проверяемой поверхности салфетка окрашивается в голубой или синий цвет. Чувствительность индикаторных салфеток составляет 0,5 мг/л. Минимальная, но эффективная концентрация используемых дезинфицирующих средств определена как 0,5% для «Бианол» (ФГУП «ГНЦ «НИОПИК», Россия) и 1% для «Ника-Экстра» (ООО НПФ «Геникс», Россия). Применение большей концентрации не позволяло полностью удалить дезинфицирующее средство с поверхности поилок. Дезинфицирующее средство применяется при замачивании на этапе ручной мойки, а также использовании специализированной моечной машины (тип автомоечных машин высокого давления для предприятий пищевой промышленности), при ополаскивании в посудомоечной машине (тип машин для применения в ресторанах) дезинфицирующее средство не применяется (табл. 4).

Добавление пенообразующего дезинфицирующего средства непосредственно в бойлер посудомоечной машины оказалось непрактично, так как в результате образуется большое количество пены, оставшегося дезинфицирующего средства в самой маленькой концентрации при этом на поилках больше, при этом на поилках, пусть и в незначительной концентрации, его остается все же больше, чем при ручном ополаскивании.
Самым подходящим методом обработки поилок оказалось проведение тщательного ручного ополаскивания при концентрации дезинфицирующего средства «Бианол» (ФГУП «ГНЦ «НИОПИК», Россия) 0,5% или повторного промывания в посудомоечной машине после проведения мойки в специализированной моечной машине.
Для дезинфекции и мытья носиков, представляющих собой стеклянные пипетки, были проработаны варианты ручной мойки и специальные ультразвуковые ванны (табл. 5). Ручная мойка носиков недостаточно эффективна, так как наружный диаметр сливного кончика составляет всего 2,5 мм, в связи с чем внутренние поверхности трудно очистить. Дезинфекция носиков с помощью ультразвуковой ванны с минимальными настройками (15 мин, 45°) показала удовлетворительный результат очистки внутренних поверхностей от налипших загрязнений. Ввиду строения вода через стеклянные носики проходит медленно, поэтому чтобы избавиться от остатков дезинфицирующих средств в носиках, их необходимо длительно, не менее 30 с, промывать в проточной воде после окончания дезинфекции. Бактериологические исследования показали удовлетворительный результат во всех проведенных смывах с поверхностей стеклянных поилок и носиков при каждом опробованном режиме дезинфекции.

Металлические носики подвержены образованию налета на внутренних поверхностях и не позволяют проводить их визуальный осмотр. В связи с чем металлические носики следует использовать только в случае необходимости, например, для поения лабораторных хорьков и кроликов. Дезинфекцию металлических носиков рекомендуется проводить так же, как и носиков из стекла, с дополнительной предварительной механической очисткой. Диаметр металлических носиков позволяет прочистить их вручную, для этого подходящим инструментом является зонд урогенитальный или щеточки туши для ресниц.
В табл. 6 представлены сводные данные по видам животных и предпочтительным системам поения.

Чтобы обеспечить надлежащее техническое обслуживание, чистоту и работоспособность систем поения, устройства для поения (поилка, носик, иные составляющие) должны часто проверять на наличие трещин и сколов (особенно устройства из стекла), а также ежедневно осматривать для выявления загрязнений. При установлении вышеперечисленного поилки с водой меняют полностью, доливать воду в поилки не рекомендуется из‑за возможности микробиологического перекрестного заражения.
Заключение
На первый взгляд процесс поения лабораторных животных не должен вызывать никаких трудностей. Однако, не уделяя внимания важным особенностям поения, можно нанести вред здоровью и благополучию животных.
Питьевая вода является одним из ключевых факторов поддержания здоровья лабораторных животных и качества медико-биологических экспериментов. Более того, в ряде экспериментов вода служит носителем объектов исследования при необходимости перорального введения с питьем. Любые изменения качественного и вкусового состава питьевой воды могут повлечь за собой отказ от потребления воды, развитие обезвоживания и получение некорректных экспериментальных данных. Повлиять на это способны материал, из которого изготовлены поилки, ненадлежащее качество подаваемой питьевой воды, наличие остатков дезинфицирующих средств на поверхности поилок.
Необходимо регулярно проводить лабораторный анализ питьевой воды для определения органолептических, микробиологических и химических показателей. Следует внимательно относиться к выбору поилок, предлагаемых на рынке. Подбор режимов дезинфекции выполняют тщательно, проверяя бактерицидную эффективность и химическую безопасность. Рекомендуется прописать в инструкции или стандартной операционной процедуре несколько приемлемых методов дезинфекции, что позволит их чередовать в зависимости от различных обстоятельств (смена дезинфицирующего средства, неисправность оборудования, необходимость ускорения процесса др.).
Также нельзя забывать о риске травмирования персонала при работе с животными, со стеклом, с тяжелыми и травмоопасными предметами. Все манипуляции должны быть подробно описаны в стандартных операционных процедурах.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Е.Д. Бондарева — концепция и дизайн исследования, разработка технических деталей исследования, анализ литературы, написание текста статьи.
М.А. Акимова — анализ данных, редактирование текста статьи.
Е.В. Веснина — сбор данных, анализ данных, контроль результатов исследования.
Список источников
- Edstrom E.K., Curran R. Quality assurance of animal watering systems // Lab. animal. 2003. N. 32 (5). P. 32–35. https://doi.org/10.1038/laban0503-32.
- Руководство по использованию лабораторных животных для научных и учебных целей в СПбГМУ им. акад. И.П. Павлова / под ред. И.В. Белозерцевой. СПбГМУ им. акад. И.П. Павлова, 2003. 57 с. [Rukovodstvo po ispol’zovaniyu laboratornykh zhivotnykh dlya nauchnykh i uchebnykh tselei v SPbGMU im. akad. IP Pavlova / pod red. I. V. Belozertsevoi. SPbGMU im. akad. IP Pavlova, 2003. 57 p. (In Russ.)].
- Ross B. Code of practice for the housing and care of laboratory mice, rats, guinea pigs and rabbits // Victorian Government department of primary industries. Australia. 2004. P. 70.
- Tveden-Nyborg P., Vogt L., G. Schjoldager J. et al. Maternal vitamin C deficiency during pregnancy persistently impairs hippocampal neurogenesis in offspring of guinea pigs // PLoS One. 2012. N. 7 (10). P. e48488. https://doi.org/10.1371/journal.pone.0048488.
- Drouin G., Godin J.R., Pagé B. The genetics of vitamin C loss in vertebrates // Current genomics. 2011. N. 12 (5). P. 371–378. https://doi.org/10.2174/138920211796429736.
- Hooper M.H., Carr A., Marik P.E. The adrenal-vitamin C axis: from fish to guinea pigs and primates // Critical Care. 2019. N. 23 (1). P. 1–2. https://doi.org/10.1186/s13054‑019‑2332‑x.
- Frikke-Schmidt H., Tveden-Nyborg P., Lykkesfeldt J. L-dehydroascorbic acid can substitute l-ascorbic acid as dietary vitamin C source in guinea pigs // Redox biology. 2016. N. 7. P. 8–13. https://doi.org/10.1016/j.redox.2015.11.003.
- Honeycutt J.A., Nguyen J., Kentner A., Brenhouse H. Effects of water bottle materials and filtration on Bisphenol A content in laboratory animal drinking water // Journal of the American Association for Laboratory Animal Science. 2017. N. 56 (3). P. 269–272.
- National Research Council et al. Committee for the Update of the Guide for the Care and Use of Laboratory Animals // Guide for the care and use of laboratory animals. 2011. N. 327 (3). P. 963–965.
- Richardson S.D. Disinfection by-products and other emerging contaminants in drinking water // TrAC Trends in Analytical Chemistry. 2003. N. 22 (10). P. 666–684. https://doi.org/10.1016/S0165-9936(03)01003-3.




