Хроническая катетеризация мочевого пузыря, но не метаболические камеры, позволяет получать точные данные о диурезе мышей
Работа поддержана: ООО «НИИ Митоинженерии МГУ»; Программой фундаментальных исследований Института медико-биологических проблем РАН (тема 65.4); исследовательским грантом Rus-LASA (№ НИ1, 01.03.21) и МГУ им. Ломоносова (научное задание № 121032300071-8). Источники финансирования не принимали участия в разработке, сборе данных, анализе, интерпретации или принятии решения о публикации.
Андреев-Андриевский А.А., Лагерева Е.А., Панькова Н.В., Машкин М.А., Манских В.Н., Фролова О.Ю., Фадеева О.В., Телятникова Е.В. Хроническая катетеризация мочевого пузыря, но не метаболические камеры, позволяет получать точные данные о диурезе мышей. Лабораторные животные для научных исследований. 2022; 2. https://doi.org/10.29296/2618723X-2022-02-01
Резюме
Метаболические камеры (МК) рутинно используются для длительного сбора мочи у мелких лабораторных грызунов. При получении индивидуальных проб суточной мочи в МК от мышей объем диуреза составляет 20–40 мл/кг, что при сведении водного баланса указывает на недоучет экскретируемой жидкости в объеме 60–80 мл/кг.
В серии модельных экспериментов с МК для мышей показано, что открываемость (recovery) внесенного в МК объема резко (двукратно) снижается в случае внесения жидкости небольшими аликвотами, близкими к объему мочеиспускания мышей (примерно 0,1 мл) вследствие потерь, связанных с ее высыханием. Высыхание происходит преимущественно на собирательной воронке МК, а не с поверхности мочесборника. Силиконизация МК не приводит к существенному росту открываемости. Открываемость возрастает до приемлемых величин (примерно 80%) при увеличении внесенного объема, поэтому возможный путь повышения эффективности сбора мочи в МК — групповое содержание мышей в них. Очевидным недостатком этого подхода является невозможность определения диуреза у конкретной особи. Следует также упомянуть, что животных необходимо приучать к содержанию в МК для минимизации влияния стресса на диурез.
Мы предложили новый метод сбора мочи у мышей с помощью хронически вживленных в мочевой пузырь катетеров. Метод позволяет с высокой точностью непрерывно регистрировать диурез у бодрствующих самцов и самок мышей на протяжении не менее 30 суток. Регистрируемый таким способом диурез составляет у самцов и самок соответственно 100,0±6,9 и 135,7±28,4 мл/кг, что почти в 3 раза превышает таковой у интактных самцов и самок мышей в МК — 39,0±5,4 и 37,2±3,2 мл/кг. Физико-химические свойства собираемой через катетеры мочи не искажены вследствие высыхания, в частности, осмолярность мочи составляла 2026±47 и 1870±41 мОсм у самцов и самок катетеризированных мышей по сравнению с 2985±78 и 3413±105 мОсм у интактных самцов и самок в МК.
Катетеризация мочевого пузыря пригодна для ряда физиологических, фармакологических и токсикологических исследований и не оказывает выраженного негативного воздействия на животных.
Введение
Сбор мочи является необходимым этапом ряда физиологических, токсикологических и фармакологических исследований. Образцы мочи у мелких лабораторных грызунов можно получить во время спонтанного диуреза при помощи капилляров, пробирок, салфеток, пленок [1] либо с использованием специальных приспособлений, закрывающих выделительные органы [2]. Для точного измерения скорости мочеотделения проводят катетеризацию мочеточников, однако данный метод требует наркотизации животных, применим преимущественно для крыс, но не мышей и является терминальной процедурой. Основным методом длительного (часы—дни) мониторинга диуреза у мышей и крыс является использование метаболических камер (МК) [1].
У крыс МК позволяют регистрировать диурез с достаточной точностью [3]. Однако при сборе мочи у индивидуальных мышей обнаружили, что регистрируемый диурез составляет 20–50 мл/кг [4–6], что существенно меньше ожидаемой величины, исходя из среднесуточного потребления воды (примерно 150 мл/кг), ее продукции в ходе метаболизма (около 60 мл/кг) и неощутимых потерь с дыханием и потоотделением (приблизительно 110 мл/кг) [7]. Мы предположили, что «недостача» мочи обусловлена испарением жидкости во время ее сбора в МК. Высыхание в совокупности с небольшим абсолютным объемом мочеиспускания у мыши приводит к существенному (двукратному) искажению уровня диуреза и физико-химических свойств мочи в случае использования МК для сбора мочи от индивидуальных мышей.
В настоящем исследовании, во‑первых, проведена количественная оценка обусловленных высыханием потерь жидкости в метаболических камерах; во‑вторых, определены возможные способы повышения эффективности сбора мочи у мышей в МК и, в‑третьих, предложен новый метод для длительного и точного мониторинга диуреза у бодрствующих мышей, основанный на катетеризации мочевого пузыря.
Материал и методы
Животные
В экспериментах использовали животных СПФ-категории, источник — Институт цитологии и генетики СО РАН. В эксперименте с групповым содержанием использовали 17 самцов и 18 самок мышей линии CD-1, в эксперименте с катетеризацией мочевого пузыря — 14 самцов и 13 самок. На момент начала исследования возраст животных составлял 3–4 мес, масса тела — 29±1 г.
Животных содержали в стандартных условиях (температура 20–24 °C, влажность 30–70%) с 12‑часовым световыми циклом (включение света в 09:00). Ежедневно проводили учет корма (комбикорм полнорационный для лабораторных животных ЛБК-120, Тосно, Россия) и деионизированной воды, которые находились в свободном доступе. До использования в экспериментах мышей содержали однородными по полу группами из 3–5 особей в индивидуально-вентилируемых клетках GM500 (Tecniplast, Италия).
Для содержания животных и в экспериментах по оценке потерь воды использовали МК для мышей (3600M021, Tecniplast, Италия).
План исследования был одобрен комиссией по биоэтике ООО «НИИ Митоинженерии МГУ» (протокол № 150 от 02.03.20) и включал заранее определенные гуманные конечные точки (снижение массы тела на 20% и более, отсутствие тока мочи через катетер), которые, однако, не были использованы. Все процедуры были проведены в соответствии с Директивой ЕС 2010/63/EU.
Схемы экспериментов
Эксперименты с модельными средами
Чтобы оценить потери мочи при испарении во время стекания по воронке МК, измеряли открываемость (recovery) внесенного в МК объема жидкости в зависимости от объема мочеиспускания. Использовали две модельные жидкости: воду и 1% раствор бычьего сывороточного альбумина на натрий-фосфатном буфере (1% БСА). Состав второй модельной среды (1% БСА) был выбран таким образом, чтобы моделировать содержание белка, солей и осмолярность мочи мышей. Всего было проведено 3 эксперимента.
В эксперименте № 1 измеряли открываемость внесенного в МК объема жидкости в зависимости от объема вносимых аликвот. За 8 ч эксперимента в МК суммарно вносили 4 мл сред аликвотами по 0,1, 0,25, 1 или 4 мл с равными временными интервалами между внесениями. Наибольшую из аликвот (4 мл) вносили однократно за 1 ч до измерения собранного объема. Измерения повторяли троекратно.
В эксперименте № 2 оценивали высыхание воды и 1% БСА в мочесборниках. Для этого в мочесборники вносили 0,1, 0,5 или 2 мл среды и измеряли массу мочесборников в течение 8 ч с интервалом 1 ч. Измерения проводили троекратно. Скорость высыхания рассчитывали индивидуально для каждого образца как угловой коэффициент линейной регрессии массы мочесборника против времени.
В эксперименте № 3 определяли возможность повышения эффективности сбора жидкости в МК силиконизацией собирательных воронок. Эксперимент проводили по той же схеме, что и при первичной оценке открываемости объема; половина МК была силиконизирована с использованием жидкости XIAMETER MEM-0346 Emulsion (Dow, Бельгия), а контрольные МК оставляли необработанными.
Данные экспериментов с модельными средами анализировали при помощи методов дисперсионного анализа с последующими попарными сравнениями по Сидаку.
Оценка диуреза мышей при групповом содержании
Поскольку относительный вклад обусловленных высыханием потерь увеличивается по мере уменьшения собираемого в МК объема, возможным (и относительно часто используемым) решением является сбор мочи не от индивидуальной мыши, а от группы мышей. Для количественной оценки объема диуреза при сборе мочи от группы животных провели эксперимент, в котором на протяжении 3 суток измеряли диурез у содержавшихся парами самцов и самок мышей в сравнении с животными, размещенными в МК индивидуально. Диурез измеряли 1 раз в сутки (24±1 ч) по разности масс полного и пустого мочесборника. Собирательную воронку заменяли ежедневно. В конце эксперимента мыши были подвергнуты эвтаназии. Данные об объеме диуреза нормировали на массу тела населявших МК особей, усредняли за 3 дня наблюдения и подвергали статистическому анализу методом двухфакторного дисперсионного анализа с последующими попарными сравнениями по Сидаку.
Катетеризация мочевого пузыря для точного измерения диуреза у индивидуальных мышей
Для точного сбора мочи от индивидуальных мышей была разработана методика хронической катетеризации мочевого пузыря мышей [8]. Самцов и самок мышей в равном количестве случайным образом распределяли в одну из двух групп с катетером или без. После 7 дней адаптации в МК и 2 дней сбора фоновых данных мышам либо имплантировали катетер в мочевой пузырь, либо их оставляли интактными. У катетеризированных мышей мочу собирали из катетера. Собирательная система из полиэтиленовых трубок включала вертлюг (375/20PS, Instech, США). Сборную трубку от вертлюга опускали примерно на 2 см ниже пола клетки, формируя таким образом сифон.
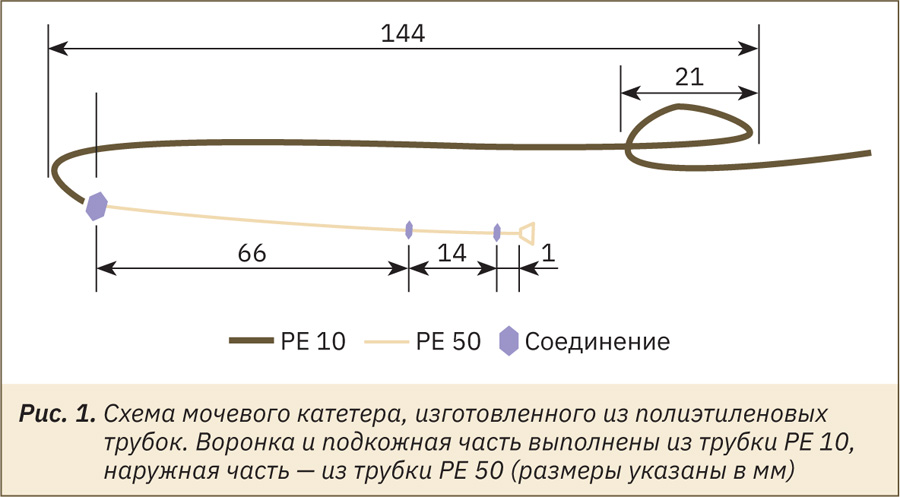
Катетеры для мочевого пузыря (рис. 1) изготавливали из полиэтиленовых трубок PE10 и PE50 (Медсил, Россия) и стерилизовали, замачивая в 3% перекиси водорода. Мышей наркотизировали, для этого внутрибрюшинно введили 15 мг/кг золазепама и 15 мг/кг тилетамина в составе ветеринарного препарата Золетил 100 (Verbac, Франция) в сочетании с 6 мг/кг ксилазина (Ксила, Interchemie, Эстония). Операционное поле готовили на брюхе и над основанием хвоста, для чего состригали шерсть и обрабатывали кожу антисептиками АХД 2000 (Lysophorm GmbH, Германия) и Бетадином (EGIS Pharmaceuticals, Венгрия). Для доступа к мочевому пузырю делали разрез кожи длиной 17–20 мм от препуция в краниальном направлении, разрезали апоневроз мышц брюшной стенки и тупым способом раздвигали мышцы. Пупочную складку разрывали. Затем мочевой пузырь отгибали вперед для доступа к шейке пузыря с дорсальной стороны. Под микроскопическим контролем шейку отделяли от окружающих тканей и накладывали на нее шелковую лигатуру 5-0 (Политехмед, Россия) так, чтобы концы лигатуры были как можно короче и не достигали мочеточников. Затем на верхушке пузыря готовили кисетный шов диаметром около 2 мм из шелковой лигатуры 7-0 (Политехмед, Россия). В центре подготовленного узла делали прокол инъекционной иглой G20, через который в просвет мочевого пузыря вводили воронку катетера и затягивали узел. Для дополнительной фиксации на место вхождения катетера дополнительно накладывали шелковую лигатуру 5-0.
Вживленный катетер выводили из брюшной полости через прокол в брюшной стенке, расположенный на 10–12 мм краниальнее верхушки пузыря и несколько в стороне от средней линии, после чего ушивали брюшную стенку шелком 6-0 (Политехмед, Россия). Катетер проводили подкожно при помощи зонда с ушком и выводили из‑под кожи хвоста (на расстоянии около 5 мм от основания). Подкожную часть катетера располагали широкой дугой во избежание перегибов трубки.
Наружную часть катетера проводили через защитную пружину, которую фиксировали на хвосте при помощи стальных лигатур диаметром 0,1 мм через проколы между I–II и III–IV хвостовыми позвонками. Пружину соединяли с вертлюгом Модель (Instech, США), к которому подсоединяли и наружную часть катетера. До пробуждения мышей согревали и вводили 5% раствор глюкозы из расчета 10 мл/кг в час подкожно. В первые 3 суток после операции мышам 2 раза в сутки вводили 2 мг/кг мелоксикама (Доминанта-Сервис, Китай) и 20 мг/кг ципрофлоксацина (Ciprolet, Dr. Reddy's, Индия) подкожно, а место выхода катетера опудривали местным антисептиком (Банеоцин, Sandoz, Австрия).
Диурез измеряли 1 раз в сутки (24±1 ч) по разности масс полного и пустого мочесборника. Осмолярность мочи определяли на криоскопе K-7400 (Knauer, Германия). Анализ мочи проводили с использованием URISCAN-strip (Эйлитон, Россия) и тест-полосок Uriscan 11 (YD Diagnosctics, Корея). В образцах мочи, полученных на 30‑й день, дополнительно измеряли концентрацию креатинина. Животных подвергали эвтаназии и некропсии, в ходе которой изымали органы мочеполовой системы для гистологического исследования. Подробнее результаты валидации метода катетериации мочевого пузыря у мышей изложены в работе [8].
Статистический анализ
Статистический анализ данных проводили с использованием программного обеспечения Prism (версия 9.1, GraphPad, США). Использованные методы анализа указаны при описании схем экспериментов. Различия считали значимыми при р<0,05. Данные представлены в виде среднего ± стандартная ошибка среднего.
Результаты и обсуждение
Открываемость внесенного в МК объема
Как показано на рис. 2, открываемость внесенного в МК объема зависела от объема аликвоты (F(3, 16)=30,48; р<0,0001), а в диапазоне объемов типичного мышиного мочеиспускания (примерно 100 мкл) [9, 10] открываемость была ниже 50%. Открываемость 1% БСА была в целом выше, чем воды (F(1, 16)=6,94, p=0,0180), что ожидаемо ввиду большей осмотической силы раствора БСА. Таким образом, именно испарение во время сбора в МК определяет потерю около 50% объема экскретируемой мочи у мышей.
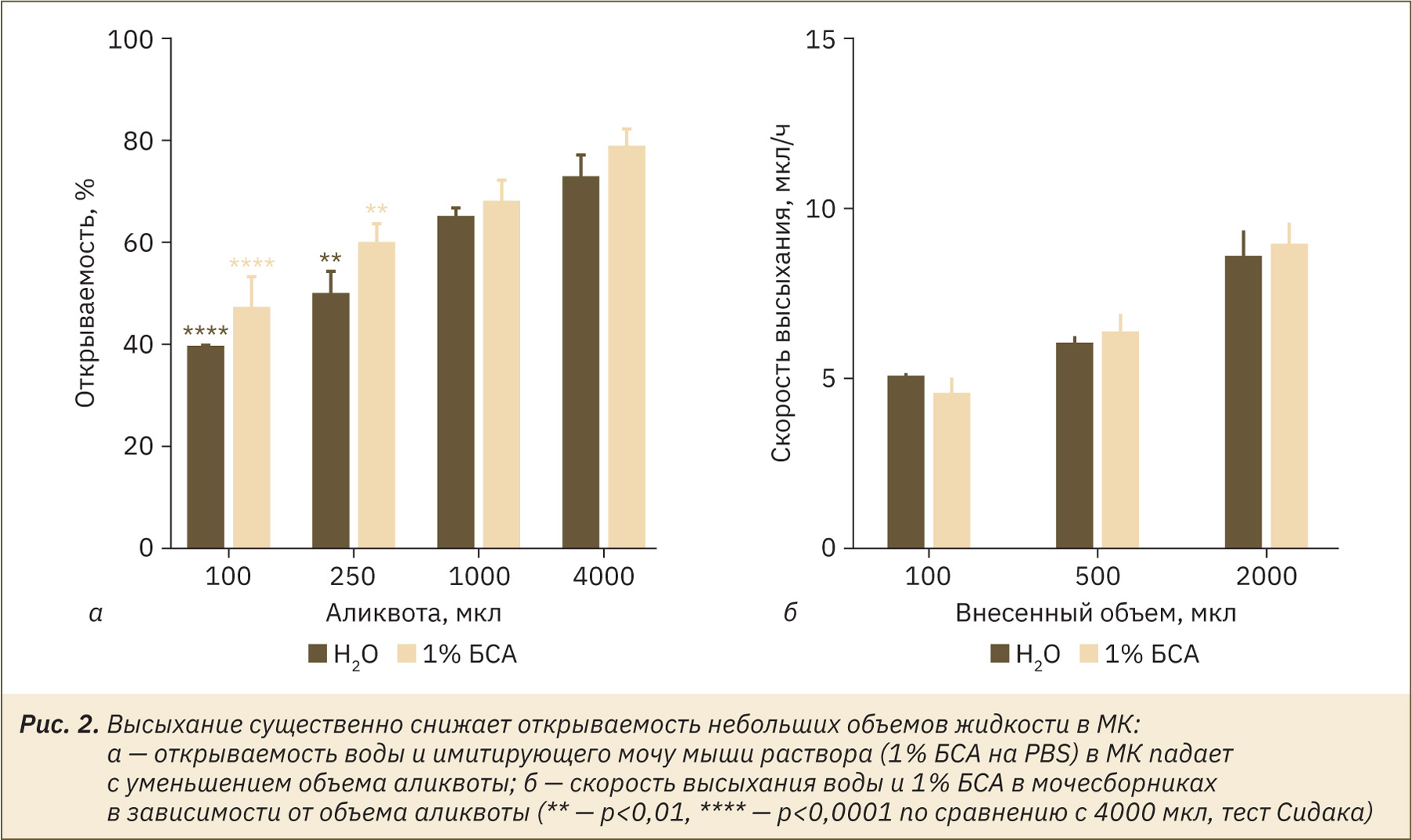
Высыхание мочи во время сбора при помощи МК может происходить за время стекания по собирательной воронке и в мочесборнике. Измеряли скорость высыхания воды и 1% БСА в мочесборнике МК (см. рис. 2б) и обнаружили, что эта величина относительно невелика и составляет около 0,37 мкл/ч в см2 для воды и 1% БСА. Тем не менее за сутки из мочесборника может испариться примерно 240 мкл, что составляет около 10% от суточного диуреза мыши. Для предотвращения испарения мочи из мочесборника рекомендуют использовать минеральное масло или специальные охлаждающие блоки для сборников экскретов, однако в последнем случае возможно разбавление мочи конденсированной из воздуха водой.
На основании данных модельных экспериментов можно заключить, что при сборе мочи от индивидуальных мышей высыхание приводит к существенному (двукратному и более) занижению диуреза и искажению физико-химических свойств мочи. Основной вклад в обусловленные высыханием потери мочи вносит высыхание за время стекания по имеющей большую поверхность собирательной воронке, в то время как высыхание с поверхности мочесборника относительно невелико. Также следует отметить выраженную зависимость величины обусловленных высыханием потерь от параметров микроклимата: при снижении относительной влажности до нижнего диапазона (30%), допустимого для комнат, где содержатся животные, потери достигают 80% для близких к мышиному объему мочеиспускания аликвот (см. рис. 2а, рис. 3а).
Проблема потери мочи с испарением в определенной степени признана исследователями и производителями МК. Для снижения испарения мочи из мочесборников применяют масло [11] или специальные охлаждающие устройства [6]. Значительные обусловленные высыханием потери отмечены и при других способах сбора мочи, например, с использованием гидрофобного песка, обладающего большой удельной поверхностью [12].
Влияние силиконизации МК на эффективность сбора мочи
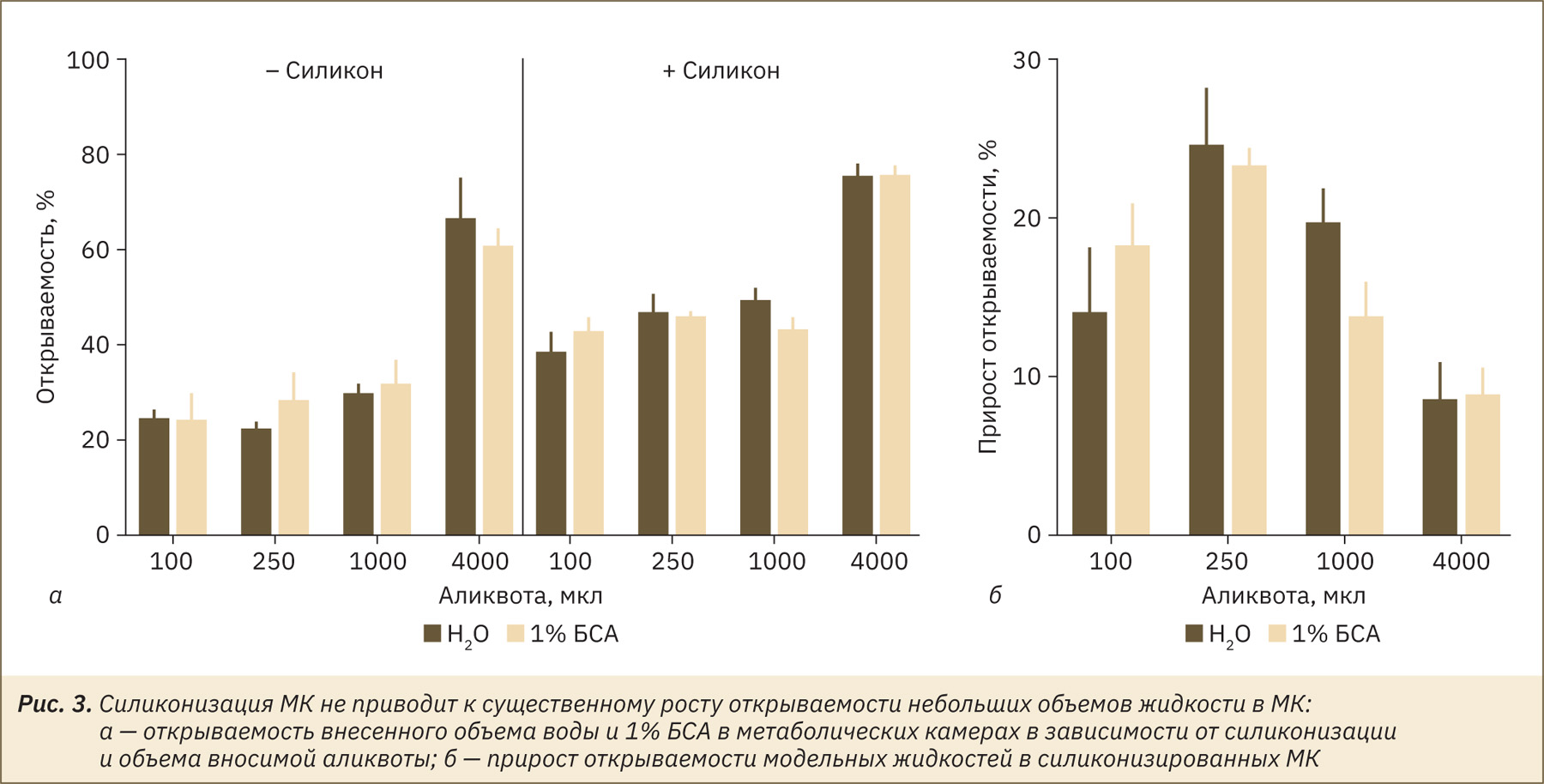
Одним из возможных способов повысить эффективность сбора мочи в МК является силиконизация поверхности собирательной воронки. Как показано на рис. 3а, открываемость не зависела от типа жидкости, но существенно зависела от объема (F(3, 6)=195; р<0,0001). В целом открываемость внесенного объема в силиконизированных камерах возрастала (F(1, 2)=88,9; р=0,0111). Следует, однако, отметить, что прирост открываемости имел сложную зависимость от объема аликвоты (см. рис. 3б; F(3, 6)=15,4; р=0,0032). Важно, что в диапазоне объемов, близких к объему мочеиспускания у мышей, силиконизация только несущественно повышала открываемость объема, которая составляла 24% в несиликонизированных и около 40% в силиконизированных МК.
Сбор мочи от мышей при групповом содержании
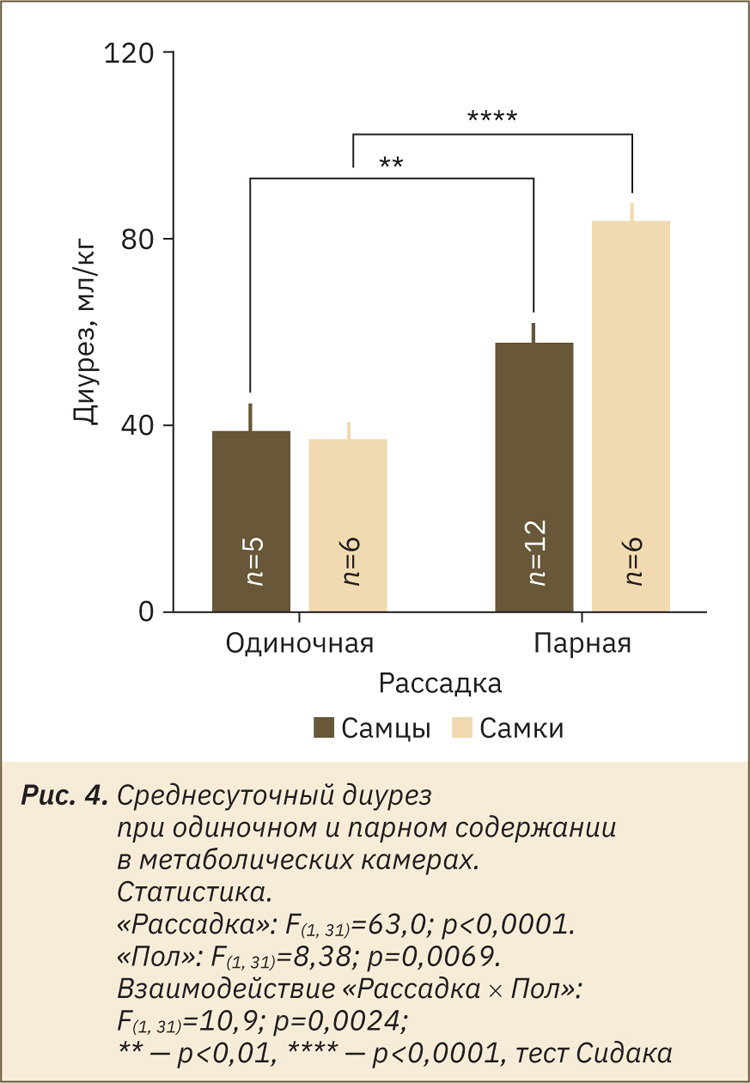
Как же можно получить более точную оценку диуреза? Одним из возможных решений является сбор мочи от содержащихся группой мышей. При сборе мочи от мышей при парном содержании среднесуточный диурез в условиях нашего вивария составил около 60 и 80 мл/кг для самцов и самок соответственно, что значительно выше, чем при сборе мочи от индивидуальных особей (рис. 4). Таким образом, увеличение абсолютного объема собираемой мочи (за счет размещения в МК группы животных) приводит к ожидаемому увеличению открываемости объема.
Катетеризация мочевого пузыря для точного измерения диуреза
Очевидным недостатком сбора мочи от группы мышей является потеря индивидуальной привязки данных. Мы разработали новый метод сбора мочи при помощи хронически вживляемых в мочевой пузырь катетеров, которые позволяют собирать мочу от индивидуальных мышей без значительных потерь, характерных для МК. Как показано на рис. 5, диурез оперированных мышей после приблизительно 7 дней восстановления стабилизировался на уровне 100,0±6,9 и 135,7±28,4 мл/кг у самцов и самок соответственно, что почти в 3 раза превышает таковой у интактных самцов и самок мышей: 39,0±5,4 и 37,2±3,2 мл/кг, моча собрана с помощью МК при одиночном содержании. В целом вариабельность диуреза определялась методом сбора мочи (F(1, 18)=37,98; p<0,0001), временем (F(4.286, 77.15)=7,81; p<0,0001) и взаимодействием этих факторов (F(22, 396)=5,66; p<0,0001). Влияние пола животных на диурез не было значимым, однако регистрируемый при помощи катетеров диурез у самок мышей приблизительно на 30% превышал значения для самцов. Выраженный в процентах от объема потребленной воды диурез у катетеризированных мышей составлял 43,0±1,3 (самцы) и 48,4±4,1 (самки). Объем мочи у интактных животных составлял 19,3±0,8% (самцы) и 16,0±1,6% (самки) от объема потребляемой воды, что более чем в 2 раза ниже по сравнению с катетеризированными животными (F(1, 19)=181,7; р<0,0001).
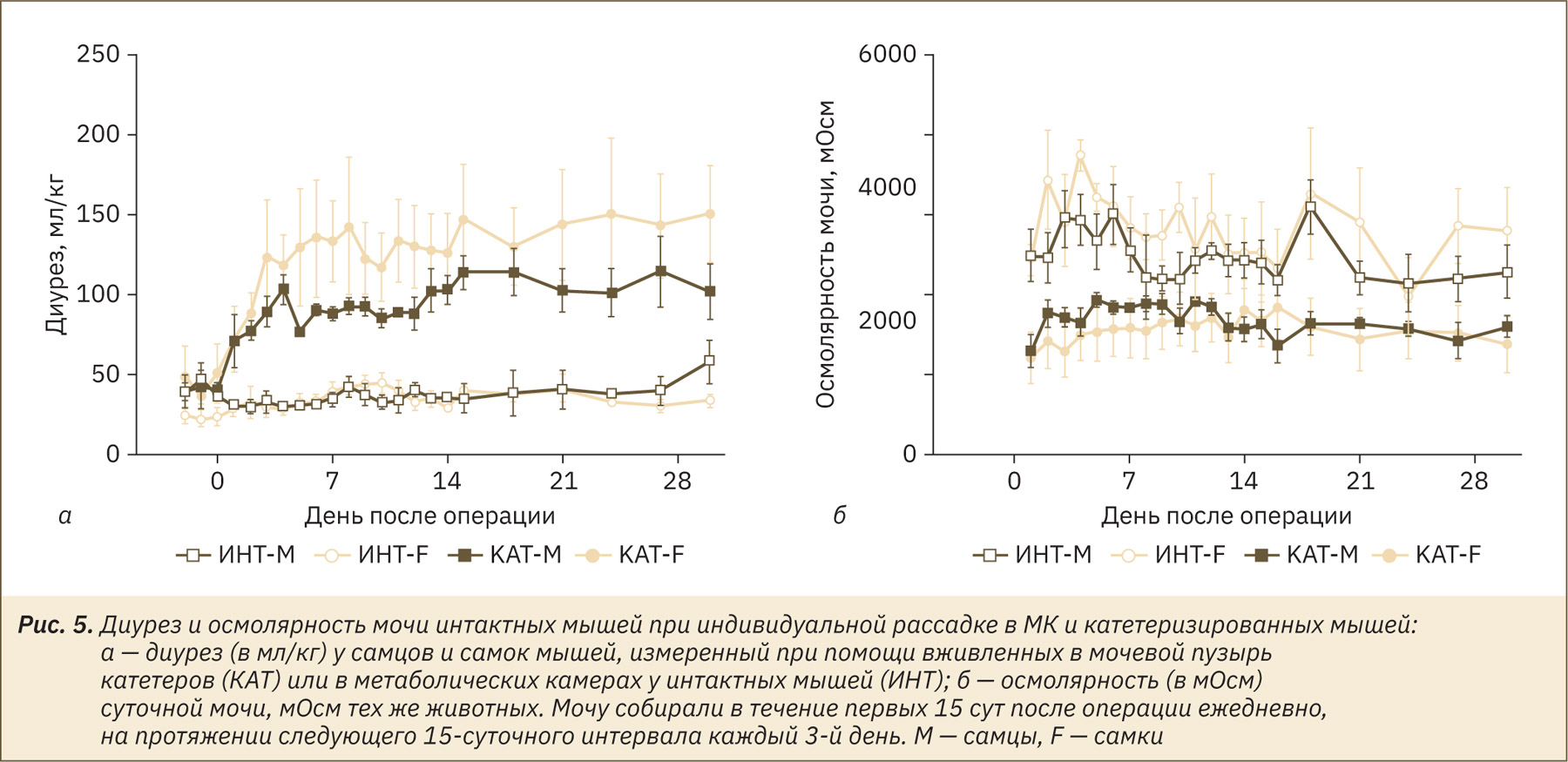
Осмолярность мочи (см. рис. 5б) у интактных мышей была примерно в 2 раза выше по сравнению с катетеризированными (F(1, 19)=17,96; р=0,0004), очевидно, из‑за потерь, обусловленных испарением. Не было обнаружено зависимости осмолярности мочи от пола или времени. Усредненные показатели мочи за последние 3 нед (после стабилизации состояния мышей) приведены в таблице. Таким образом, по окончании послеоперационного восстановления мышей с имплантированными в мочевой пузырь катетерами можно использовать в исследованиях диуреза в течение 1 мес.
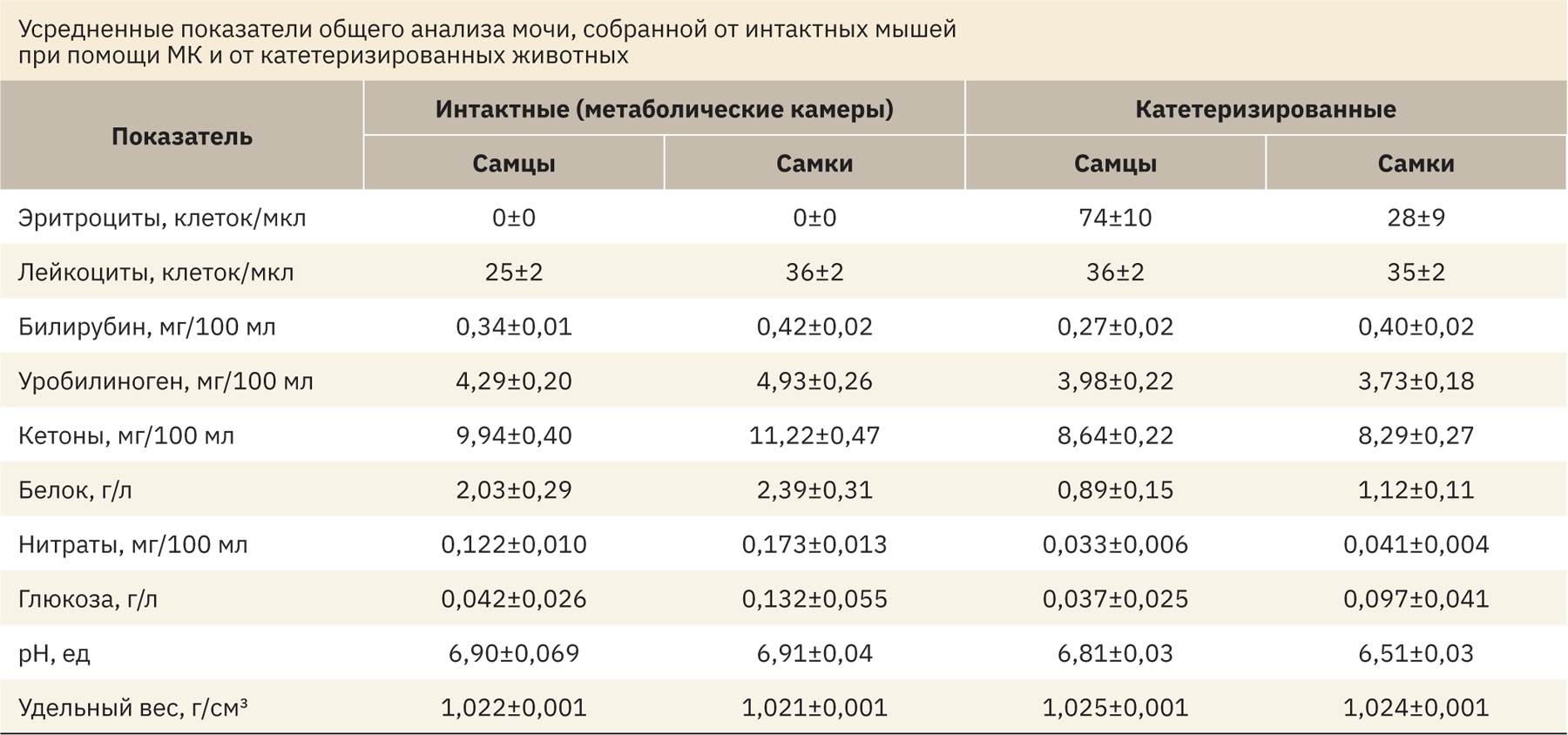
Результаты анализа мочи катетеризированных животных свидетельствуют о ее более высоком качестве и отсутствии контаминации остатками пищи или кала. Собранная через катетеры моча была стерильна, в то время как полученная при помощи МК, была обсеменена кишечной флорой. В тестах с водной нагрузкой при использовании фуросемида и десмопрессина, в которых диурез измеряли с временным разрешением 1 точка/10 мин, сохранялись кратные различия в объеме диуреза при двух способах регистрации, катетеров и МК. Наконец, у катетеризированных животных были получены кривые экскреции фенолового красного после его внутривенного введения, что демонстрирует пригодность метода катетеризации мочевого пузыря для исследования фармакокинетики экскретируемых с мочой веществ. Прижизненное наблюдение за оперированными животными, биохимическое и гематологическое исследования крови, а также гистопатологическое исследование органов мочеполовой системы не выявили негативного влияния катетеризации на здоровье мышей, за исключением утолщения и увеличения массы мочевого пузыря. Клиренс креатинина был примерно в 2 раза выше у катетеризированных мышей из‑за отсутствия обусловленных высыханием потерь жидкости [8].
Обнаруженные различия в диурезе и осмолярности мочи (см. рис. 5) свидетельствует о том, что примерно половина выделенного объема мочи теряется в результате испарения в ходе сбора в МК, что хорошо согласуется с оценками, полученными на основе опубликованных данных о водном балансе у мышей и экспериментально измеренной открываемости внесенного в метаболические камеры объема (см. рис. 2, 3).
Один из способов оценки объема потерь мочи — сведение баланса между потреблением и экскрецией воды. Потребление воды мышами составляет 140–150 мл/кг в сутки, что хорошо совпадает с нашими результатами. Около 15 мл/кг в сутки воды мыши потребляют с пищей (с учетом влажности корма 10%). Другим важным источником воды является метаболическая вода, объем продукции которой составляет около 60 мл/кг в сутки при стандартном рационе мышей (6% белка, 5% жира, 50% углеводов) [13–15]. Неощутимые потери воды 110 мл/кг в сутки [7]. Следует отметить, что потери воды с дыханием и в результате испарения с кожи зависят от температуры и влажности окружающей среды, а также от активности животных [16]. Количество выделенной воды с калом у мышей составляет 6 мл/кг в сутки. Значения диуреза, полученные в МК, от 20 до 50 мл/кг в сутки [4–6]. Суммирование всех этих значений демонстрирует разрыв в балансе воды в 60–80 мл/кг в день, что предположительно отражает потери мочи в результате испарения в метаболических камерах.
Другой способ оценки обусловленных высыханием потерь — анализ экскретов на собирательной воронке МК, что является обычной практикой в фармакокинетических исследованиях с использованием радиоактивных меток [17]. В смывах с воронки МК при сборе мочи у крыс обнаруживается до 40% выведенной с мочой радиоактивности, в то время как у мышей этот показатель составляет до 100% [18], то есть в некоторых случаях до мочесборника введенная метка не доходит вовсе вследствие того, что моча полностью высыхает на стенках собирательной воронки. Таким образом, обе оценки объема мочи, потерянной при испарении, хорошо согласуются между собой. Следует также отметить, что относительные потери объема при сборе мочи в МК выше у мышей, чем у крыс, что обусловлено большей массой тела крыс и бóльшим абсолютным объемом мочеиспускания.
Заключение и выводы
Можно заключить, что сбор мочи при помощи МК у индивидуальных мышей сопряжен с потерей 50% и более экскретированного объема жидкости, при этом вследствие ее концентрирования пропорционально искажаются и физико-химические показатели мочи. Высыхание происходит преимущественно во время стекания по собирательной воронке, а не после попадания мочи в мочесборники. Силиконизация собирательной системы для мочи с целью придания ее поверхностям гидрофобных свойств не приводит к существенному приросту открываемости внесенного в МК объема. Снизить относительный вклад ошибки, обусловленной высыханием мочи, помогает увеличение абсолютного объема внесенной в МК жидкости, что может быть практически реализовано при групповом содержании мышей в МК. Недостаток этого решения — потеря индивидуальности получаемых данных. Альтернативным способом точной регистрации диуреза у самцов и самок мышей является катетеризация мочевого пузыря. Разработанный метод позволяет регистрировать диурез у самцов и самок мышей на протяжении не менее чем 30 суток. Метод пригоден для использования в ряде физиологических, фармакологических и токсикологических исследований и не оказывает выраженного негативного воздействия на здоровье животных.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
А.А. Андреев-Андриевский — концепция и дизайн исследования, сбор и анализ данных, составление и рецензирование рукописи.
Е.А. Лагерева — сбор и анализ данных, составление и рецензирование рукописи.
Н.В. Панькова — сбор и анализ данных, составление и рецензирование рукописи.
М.А. Машкин — сбор и анализ данных, рецензирование рукописи.
В.Н. Манских — сбор и анализ данных, рецензирование рукописи.
О.Ю. Фролова — сбор и анализ данных, рецензирование рукописи.
О.В. Фадеева — сбор и анализ данных, рецензирование рукописи.
Е.В. Телятникова — сбор и анализ данных.
Все авторы одобрили версию для публикации.
Список источников
- Trofimets E.I., Katel’nikova A.E., Kryshen’ K.L. Urine collecting samples from laboratory animals // Laboratory Animals for Science. – 2021. – P. 30–47. DOI: 10.29296/2618723X-2021-01-04.
- Jackson A.J., Sutherland J.C. Novel device for quantitatively collecting small volumes of urine from laboratory rats // Journal of Pharmaceutical Sciences. – 1984. – Vol. 73, N. 6. – P. 816–818. DOI: 10.1002/jps.2600730627.
- Rafecas I., Esteve M., Fernández-López J.A. et al. Water balance in Zucker obese rats // Comparative Biochemistry and Physiology. Part A: Physiology. – 1993. – Vol. 104. N. 4. – P. 813–818. DOI: 10.1016/0300-9629(93)90159-2.
- Åsrud K.S., Bjørnstad R., Kopperud R. et al. Epac1 null mice have nephrogenic diabetes insipidus with deficient corticopapillary osmotic gradient and weaker collecting duct tight junctions // Acta Physiologica. – 2020. – Vol. 256. N. 4. – P. 1–16. DOI: 10.1111/apha.13442.
- Mendoza L.D., Hyndman K.A. The contribution of collecting duct NOS1 to the concentrating mechanisms in male and female mice // American Journal of Physiology-Renal Physiology. – 2019. – Vol. 317. N. 3. – P. F547–F559. DOI: 10.1152/ajprenal.00180.2019.
- Tecniplast. Improvement of urine retrieval and separation efficiency in a metabolic cage for single mouse // Techniplast. – 2017. URL: https://www.tecniplast.it/usermedia/en/2016/brochures/metabolics_whitepaper.pdf (дата обращения: 10.07.2021).
- Schmidt-Nielsen B., Schmidt-Nielsen K. Pulmonary water loss in desert rodents // American Journal of Physiology-Legacy Content. –1950. – Vol. 162. N. 1. – P. 31–36. DOI: 10.1152/ajplegacy.1950.162.1.31.
- Andreev-Andrievskiy A.A., Lagereva E.A., Pankova N.V. et al. Chronic bladder catheterization for precise urine collection in awake mice // Journal of Pharmacological and Toxicological Methods. – 2021. – Vol. 113. – P. 107–128. DOI: 10.1016/j.vascn.2021.107128.
- Eichel L.S., Sessions A.E., Messing E.M. et al. Continuous bladder infusion methods for studying voiding function in ambulatory mice // Urology. – 2001. – Vol. 57. N. 6. – P. 115. DOI: 10.1016/s0090-4295(02)01810-1.
- Mann-Gow T.K., Larson T.R., Wøien C.T. et al. Evaluating the Procedure for Performing Awake Cystometry in a Mouse Model // Journal of Visualized Experiments. – 2017. – Vol. 123. – P. e55588. DOI: 10.3791/55588.
- Moro D., Bradshaw S.D. Water and sodium balances and metabolic physiology of house mice (Mus domesticus) and short-tailed mice (Leggadina lakedownensis) under laboratory conditions // Journal of Comparative Physiology B. – 1999. – Vol. 169. N. 8. – P. 538–548. DOI: 10.1007/s003600050253.
- Hoffman J.F, Fan A.X., Neuendorf E.H. et al. Hydrophobic Sand Versus Metabolic Cages: A Comparison of Urine Collection Methods for Rats (Rattus norvegicus) // Journal of the American Association for Laboratory Animal Science : JAALAS. – 2018. – Vol. 57. N. 1. – P. 51–57. PMID: 29402352.
- Barbour H.G., Trace J. Standard metabolism in the white mouse // American Journal of Physiology-Legacy Content. – 1936. – Vol. 118. N. 1. – P. 77–86.
- Frank C.L. Diet Selection by a Heteromyid Rodent: Role of Net Metabolic Water Production // Ecology. – 1988. – Vol. 69. N. 6. – P. 1943–1951.
- Morrison S.D. A method for the calculation of metabolic water // The Journal of Physiology. – 1953. – Vol. 122. N. 2. – P. 399–402. DOI: 10.1113/jphysiol.1953.sp005009.
- Nicolaus M.L., Bergdall V.K., Davis I.C., Hickman-Davis J.M. Effect of Ventilated Caging on Water Intake and Loss in 4 Strains of Laboratory Mice // Journal of the American Association for Laboratory Animal Science : JAALAS. – 2016. – Vol. 55. N. 5. – P. 525–33. PMID: 27657706.
- Aimone L.D. Overview of pharmacokinetics // Current Protocols in Pharmacology. – 2005 – Vol. 30. – N. 1. – P. 1–26. DOI: 10.1002/0471141755.ph0701s30.
- Waidyanatha S., Black S.R., Patel P.R. et al. Disposition and metabolism of N-butylbenzenesulfonamide in Sprague Dawley rats and B6C3F1/N mice and in vitro in hepatocytes from rats, mice, and humans // Toxicology Letters. – 2020. – Vol. 319. – P. 225–236. DOI: 10.1016/j.toxlet.2019.11.015.




