Исследование применения компрессорного небулайзера для введения аэрозолей в дыхательные пути мелких лабораторных животных
Рощина Е.А., Зуева А.А. Исследование применения компрессорного небулайзера для введения аэрозолей в дыхательные пути мелких лабораторных животных . Лабораторные животные для научных исследований. 2021; 2. https://doi.org/10.29296/2618723X-2021-02-02
Резюме
В доклинических исследованиях при оценке безопасности и фармакологической активности лекарственных препаратов и фармацевтических субстанций часто возникает необходимость тестирования препаратов при ингаляционном поступлении. На сегодняшний день существует довольно широкий спектр специализированного оборудования, позволяющего обеспечить данный путь введения как для мелких, так и для крупных лабораторных животных. В большинстве своем установки для ингаляционного введения дорогостоящие и крупногабаритные.
В качестве альтернативы ингаляционным системам в настоящей работе рассмотрена возможность применения компрессорного (струйного) небулайзера, который предназначен для лечения бронхиальной астмы (БА), хронических обструктивных заболеваний легких и других заболеваний дыхательной системы. Работа данного типа небулайзера основана на эффекте Бернулли, при котором образуется аэрозоль с фиксированным размером частиц. Компрессорный небулайзер применяется в экспериментальных исследованиях для индукции таких заболеваний, как БА, воспаление легких, а также для формирования анафилактического шока с помощью раствора овальбумина. В источниках литературы описаны различные методические подходы к использованию небулайзера. Ингаляционное введение крысам Wistar осуществляли 2 способами (в ингаляционной камере и в маске) при разной экспозиции (5, 10, 15 и 20 мин). Для ингаляционного введения использовали физиологический раствор, который с целью визуализации и оценки глубины проникновения окрашивали красителем синим Эванса. Эксперимент показал, что ингаляция, проведенная путем помещения животного в ингаляционную камеру, не приводила к попаданию распыляемого раствора в дыхательные пути. Напротив, при ингаляции в маске зафиксировано окрашивание легких, что указывает на проникновение распыляемого раствора в дыхательные пути. Таким образом, компрессорный небулайзер может быть использован с целью моделирования различных заболеваний в тех случаях, когда не требуется точное дозирование индуктора патологии, вводимого ингаляционно.
Введение
Респираторные болезни – это заболевания, поражающие дыхательные пути (ДП), включая носовые ходы, бронхи и легкие. Они варьируют от острых инфекций, таких как пневмония и бронхит, до хронических состояний – бронхиальная астма и обструктивная болезнь легких. При данных заболеваниях наиболее эффективен физиологичный, безболезненный и быстрый ингаляционный способ введения лекарственных препаратов. При проведении ингаляции в ДП создается высокая концентрация лекарственного средства, снижается системное действие на организм. Одним из эффективных ингаляционных аппаратов является компрессорный небулайзер [1].
В доклинических исследованиях ингаляционный способ введения осуществляется при помощи специализированных ингаляционных крупногабаритных систем с большим количеством мест для животных, различным функционалом и высокоточным дозированием. Недостатками таких установок являются высокая стоимость и большие размеры аппарата [2].
В качестве альтернативы рассмотрен компрессорный небулайзер, который по сравнению с ингаляционными системами имеет низкую стоимость и небольшие размеры.
Принцип работы компрессорного (струйного) небулайзера основан на эффекте Бернулли. Воздух из компрессора проходит через специальное отверстие небольшого размера (Вентури), на выходе из которого вследствие увеличения скорости потока воздуха образуется отрицательное давление, в результате его воздействия жидкость из резервуара камеры засасывается через систему капилляров, где распадается на мелкие частицы, образуя аэрозоль (собственно эффект Бернулли) [3].
Для того чтобы объект исследования попал в определенный отдел ДП, частицы аэрозоля должны быть соответствующего размера – более крупные для верхних ДП и носоглотки, более мелкие – для нижних отделов ДП. Это позволяет добиться максимального эффекта от поступления распыляемого вещества. Компрессорные небулайзеры имеют общее свойство: большая разница в размере частиц аэрозоля, при этом часть ингалируемых веществ попадает не по назначению. С целью повышения эффективности ингаляций (небулизации) приборы оснащают распылителями для разных отделов ДП [4].
Провести точное дозирование веществ, распыляемых в легкие небольших животных (мыши, крысы, морские свинки и др.) при ингаляции, невозможно, поэтому небулайзер не подойдет для исследования лекарственных препаратов на таких животных. Однако данному аппарату нашлось применение в моделировании патологии, например, бронхиальной астмы, воспаления легких и анафилактического шока с помощью раствора овальбумина (табл. 1).
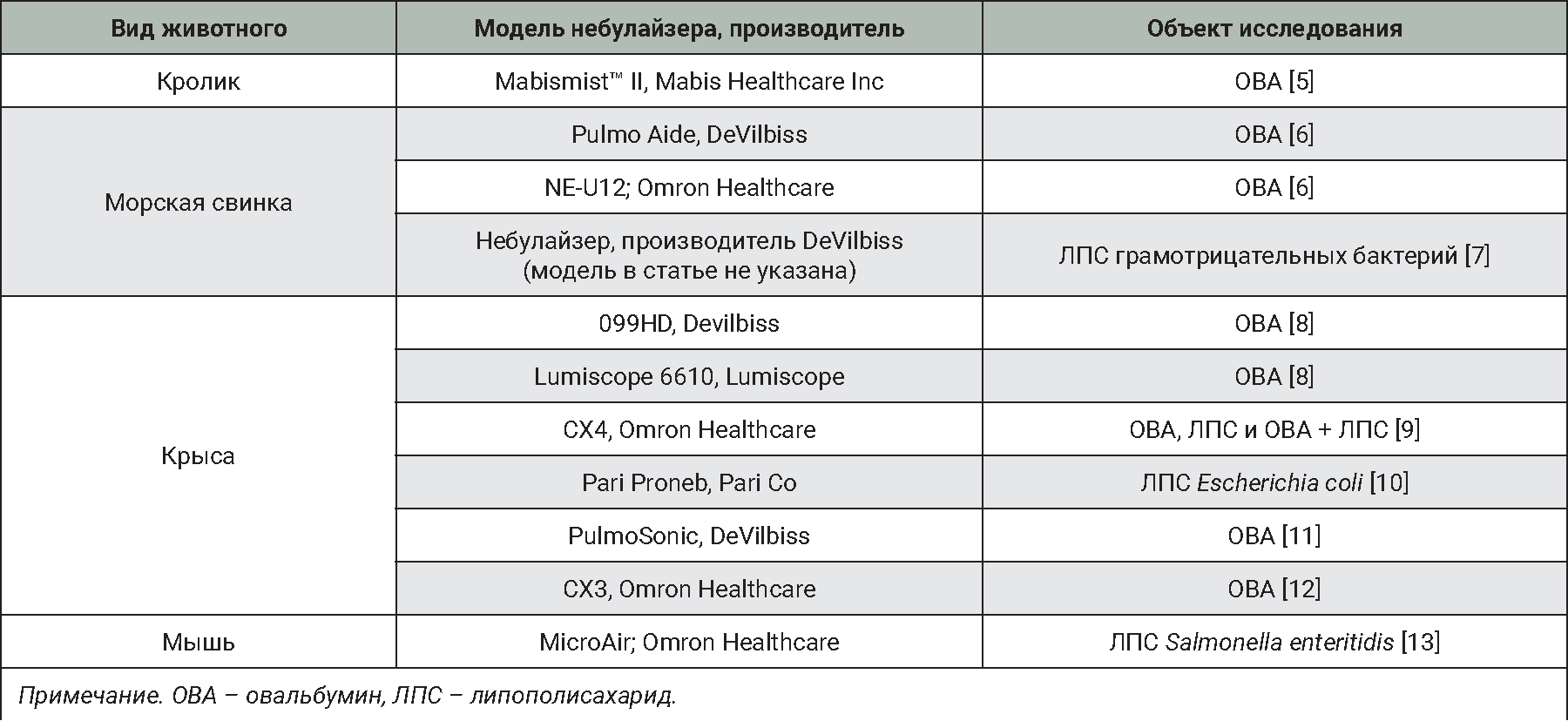
На основании изученной литературы [4–13] данные по таким параметрам, как способ проведения ингаляции, глубина проникновения и время экспозиции распыляемого объекта, разнятся или отсутствуют, поэтому проведено исследование этих параметров при использовании компрессорного небулайзера LD-210C (Little Doctor International, Сингапур) на крысах.
Материал и методы
Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986), в соответствии с правилами надлежащей лабораторной практики [14] и Директивой 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях.
В эксперименте использованы 24 крысы линии Wistar в возрасте 8–12 нед, полученных из питомника АО «НПО «Дом Фармации» (Ленинградская обл., Россия). Характеристика групп представлена в табл. 2. В качестве корма использовали «Корм для содержания лабораторных животных» ПК-120-1, приготовленный по ГОСТу Р50258-92. Воду в стандартных поилках со стальными крышками-носиками давали adlibitum. В качестве подстила использовали древесные гранулы размером 6 мм из лиственных пород древесины.


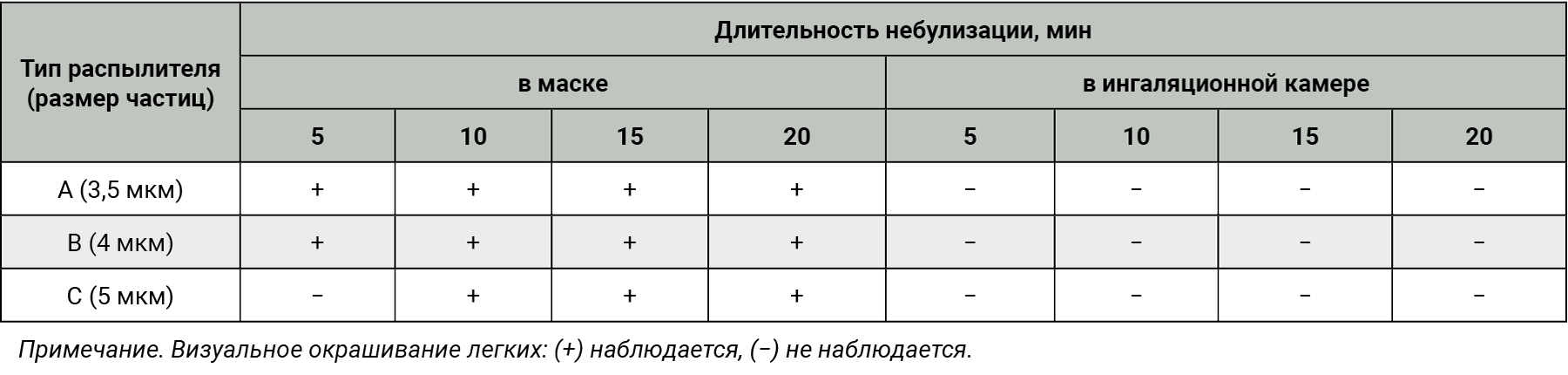
В качестве жидкости для ингаляций использовали физиологический раствор (ООО «Гематекс», Россия), который распыляли животным с помощью компрессорного небулайзера LD-210C (Little Doctor International, Сингапур). В комплект прибора входят 3 распылителя (А, В и С), которые позволяют получать аэрозоль с разным размером частиц (3,5; 4 и 5 мкм соответственно). Для визуальной оценки ингалируемой жидкости в ДП использовали 2% раствор синий Эванса (Sigma-Aldrich, США), для этого физиологический раствор смешивали с субстанцией красителя синий Эванса. Его распыление проводили с разным временем экспозиции (5, 10, 15 и 20 мин), а также в 2 модификациях (применяли ингаляционную камеру и маску для ингаляции).
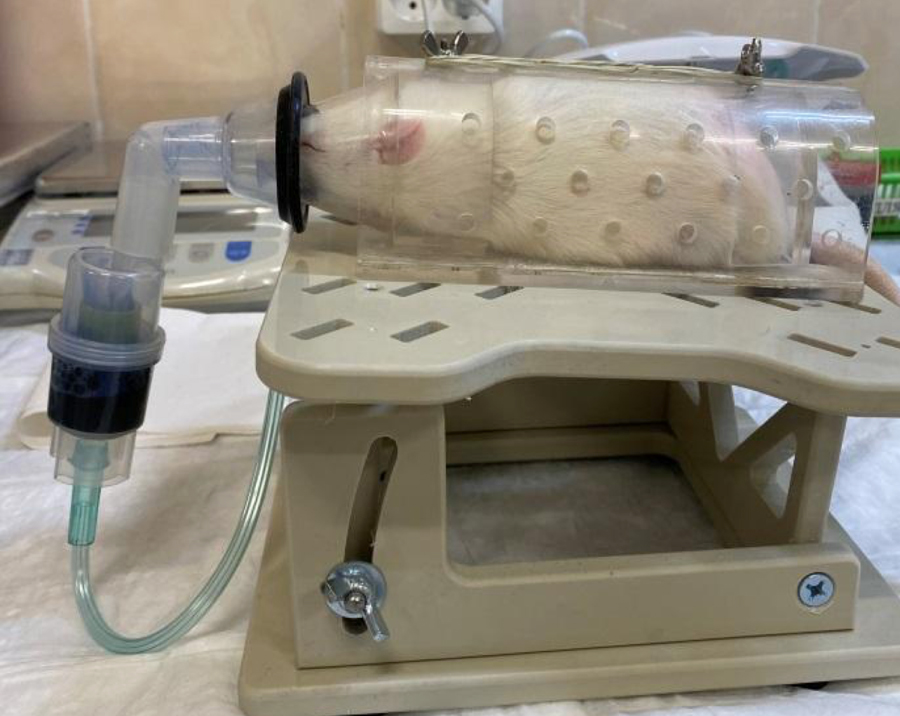
Ингаляционная камера (рис. 1) представляла собой емкость с крышкой, в которой сделано несколько отверстий для воздухообмена, подача аэрозоля осуществлялась через трубку, прикрепленную как к камере, так и к мундштуку небулайзера.
Для ингаляции в маске животное фиксировали в рестрейнере и присоединяли маску к носовой части фиксатора (рис. 2).
Эвтаназию животных проводили сразу после небулизации в соответствии с Директивой 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях путем передозировки анестетика с последующим извлечением жизненно важных органов. Далее у животных осматривали органы дыхания на наличие видимого окрашивания.
Результаты и обсуждение
При небулизации в ингаляционной камере и использовании всех 3 распылителей видимого окрашивания легких не обнаружено (рис. 3, табл. 2), у животных отмечали только окрашивание ротовой полости и трахеи, а также пищевода.
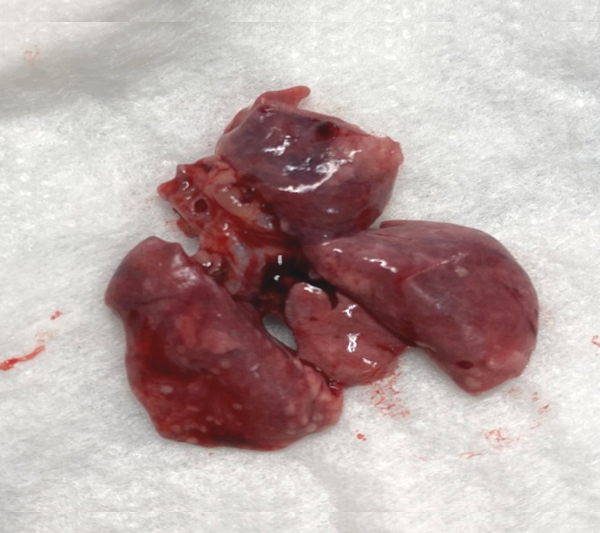
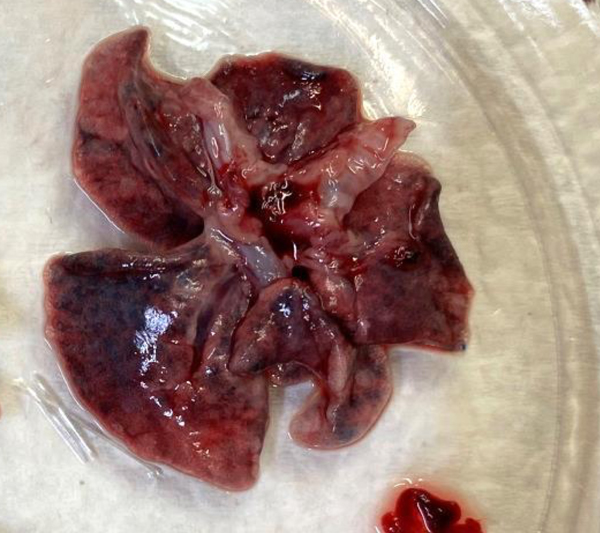
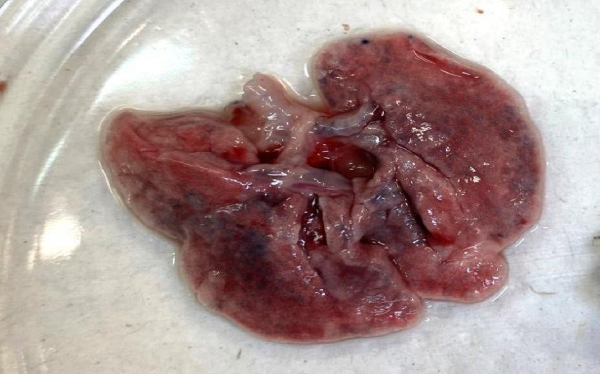
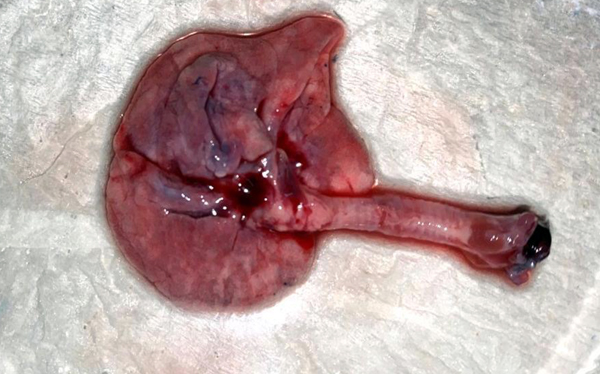
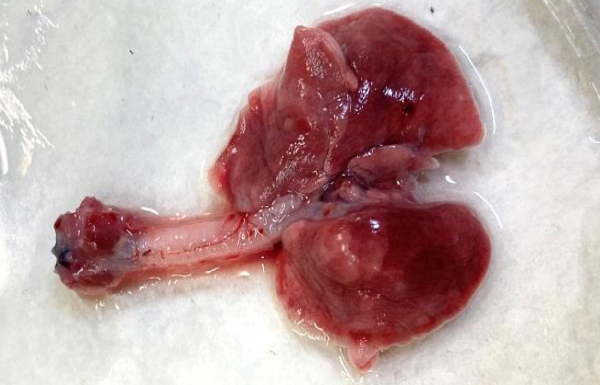
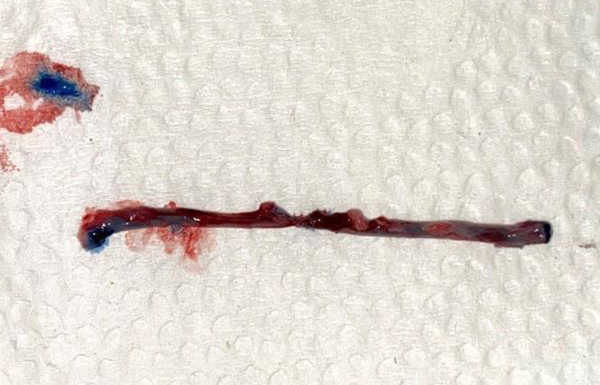
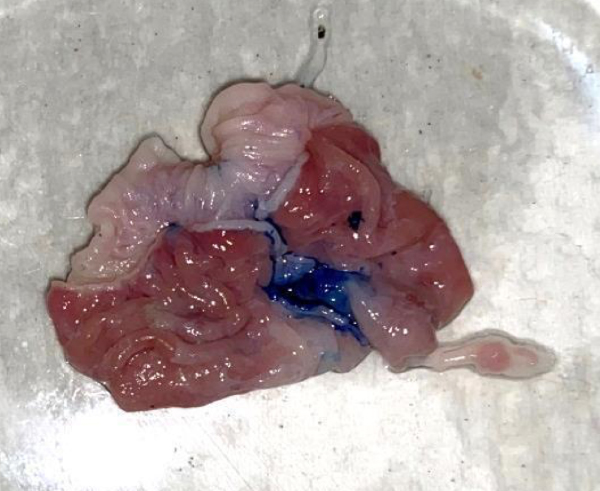
При небулизации в маске с использованием распылителя А (3,5 мкм) аэрозоль достигал нижних ДП во всех временных промежутках (рис. 4). Распылитель В (4 мкм) – аэрозоль также достигал нижних ДП во всех временных промежутках (рис. 5). Распылитель С (5 мкм) – аэрозоль достигал нижних ДП только через 20, 15 и 10 мин (рис. 6), а через 5 мин окрашивание доходило только до гортани (рис. 7). Также после всех ингаляций наблюдалось окрашивание пищевода и части желудка (в месте соединения желудка и пищевода – кардиальный отдел) (рис. 8 и 9). Результаты проведения ингаляций показаны в табл. 3.
Заключение
При исследовании 2 способов ингаляции видимый эффект небулизации крыс достигался при ингаляции в маске с использованием всех 3 распылителей при разном времени экспозиции, кроме 5-минутной с распылителем С (5 мкм). Точный расчет дозы на животное произвести невозможно, так как при ингаляции часть жидкости в виде аэрозоля рассеивается в воздухе через отверстие в самом небулайзере, часть конденсируется в маске и рестрейнере, а некоторое количество поступает не в легкие, а по пищеводу в желудок. Таким образом, компрессорный небулайзер может быть использован с целью моделирования различных заболеваний, в случаях, когда не требуется точное дозирование индуктора патологии, вводимого ингаляционно.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов
Е.А. Рощина – разработка дизайна исследования, проведение исследования, работа с источниками литературы, написание текста статьи.
А.А. Зуева – работа с животными.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Закирова А.М., Пикуза О.И., Шаяпова Д.Т., Рашитова Э.Л., Волянюк Е.В. Эффективность небулайзеров в терапии респираторного поражения дыхательных путей у детей разных возрастных групп // Медицинский совет. – 2020; 1: 152-157. [Zakirova A.M., Pikuza O.I., Shayapova D.T., Rashitova E.L. Volyanyuk E.V. Effectiveness of nebulizers in the treatment of respiratory tract infections in children of different ages // Meditsinskiy sovet. – 2020; 1: 152-157. (In Russ.)] DOI: 10.21518/2079-701X-2020-1-152-157.
- Wong B.A. Inhalation Exposure Systems: Design, Methods and Operation // Toxicologic Pathology. – 2007; 35: 3–14. DOI: 10.1080/01926230601060017.
- Терехова Е.П., Бодня О.С., Терехов Д.В., Ненашева Н.М. Возможности небулайзерной терапии бронхиальной астмы // Эффективная фармакотерапия. – 2018; 6: 30-39. [Terekhova Ye.P., Bodnya O.S., Terekhov D.V., Nenasheva N.M. Possibilities of bronchial asthma nebulizer therapy // Effective pharmacotherapy. – 2018; 6: 30-39 (In Russ.)].
- Малахов А.Б., Колосова Н.Г., Гребенева И.В. Выбор ингалятора (небулайзера) в клинической практике: вопросы и ответы // Педиатрия (Прил. к журн. Consilium Medicum). – 2018; 6: 55–58. [Malakhov A.B., Kolosova N.G., Grebeneva I.V. The choice of an inhaler (nebulizer) in clinical practice: questions and answers. Pediatrics (Suppl. Consilium Medicum). – 2018; 3: 55–58.] DOI: 10.26442/2413-8460_2018.3.55-58.
- Kamaruzaman N.A., Sulaiman S.A., Kaur G., Yahaya B. Inhalation of honey reduces airway inflammation and histopathological changes in a rabbit model of ovalbumin-induced chronic asthma // BMC Complementary and Alternative Medicine. – 2014; 14 (176). DOI: 10.1186/1472-6882-14-176.
- Nabe T., Shinoda N., Yamashita K., Yamada M., Yamamura H., Kohno S. Comparative studies on nebulizers for antigen inhalation in experimental asthma // Allergology International. – 1997; 46 (4): 261-267. DOI: 10.2332/allergolint.46.261.
- Lowe A.P.P., Thomas R.S., Nials A.T., Kidd E.J., Broadley K.J., Ford W.R. LPS exacerbates functional and inflammatory responses to ovalbumin and decreases sensitivity to inhaled fluticasone propionate in a guinea pig model of asthma // British Journal of Pharmacology. – 2015; 172: 2588-2603. DOI: 10.1111/bph.13080.
- Zhang G., Lin R., Wiggers M.E., Lee L. Sensitizing Effects of Chronic Exposure and Acute Inhalation of Ovalbumin Aerosol on Pulmonary C-fibers in Rats // Journal of Applied Physiology. – 2008; 105 (1): 128-138. DOI: 10.1111/bph.13080.
- Thakur V.R., Khuman V, Beladiya J.V., Chaudagar K.K., Mehta A.A. An experimental model of asthma in rats using ovalbumin and lipopolysaccharide allergens // Heliyon. – 2019; 5 (11). DOI: 10.1016/j.heliyon.2019.e02864.
- Chiang P., Hu Y., Blom J.D., Thompson D.C. Evaluating the Suitability of Using Rat Models for Preclinical Efficacy and Side Effects with Inhaled Corticosteroids Nanosuspension Formulations // Nanoscale Res Lett. – 2010; 5: 1010-1019. DOI: 10.1007/s11671-010-9597-y.
- Kianmehr M., Ghorani V., Boskabady M.H. Animal Model of Asthma, Various Methods and Measured Parameters: A Methodological Review // Iranian Journal of Allergy, Asthma, and Immunology. – 2016; 15 (6): 445-457.
- Salmon M., Walsh D.A., Huang T., Barnes P.J., Leonard T.B., Hay D.W.P., Chung K.F. Involvement of cysteinyl leukotrienes in airway smooth muscle cell DNA synthesis after repeated allergen exposure in sensitized Brown Norway rats // British Journal of Pharmacology. – 1999; 127: 1151-1158. DOI: 10.1038/sj.bjp.0702669.
- Mahmoudabady М., Neamati A., Somayyeh Vosooghi, Heydar Aghababa. Hydroalcoholic extract of Crocus sativus effects on bronchial inflammatory cells in ovalbumin sensitized rats // Avicenna Journal of Phytomedicine. – 2013; 3 (4): 356-363.
- European Convention for the Protection of Vertebrate Animals used for Experimental and Other Scientific Purposes. European Treaty Series - No. 123. – 1896: 11.




