Основные требования и особенности методологии модели проницаемости сосудов
Гайдай Е.А., Гайдай Д.С., Крышень К.Л., Макарова М.Н., Макаров В.Г. Основные требования и особенности методологии модели проницаемости сосудов. Лабораторные животные для научных исследований. 2018; 3. https://doi.org/10.29296/2618723X-2018-03-06
Резюме
При ряде патологий барьерная функция эндотелия нарушается, для оценки которой широко используется модель увеличения проницаемости сосудов. К факторам, вызывающим острое повышение проницаемости эндотелия сосудов, относятся такие естественные агенты, как тромбин, гистамин, брадикинин, активные формы кислорода и азота, фактор роста эндотелия сосудов (VEGF), фактор некроза опухоли, бактериальные эндотоксины, некротоксины, избыточная механическая стимуляция. Вследствие воздействия указанных факторов происходит экстравазация жидкости и плазменных белков в ткани, образуются отеки. Эти эффекты могут быть нейтрализованы Н1-антигистаминными средствами, ингибиторами метаболизма арахидоновой кислоты, антагонистами лейкотриеновых рецепторов, мембраностабилизирующими средствами, способными снижать сосудистую проницаемость, а также путем активации рецепторов эндотелия сосудов, способствующих стабилизации сосудистой стенки. В экспериментальных условиях, как правило, увеличение проницаемости сосудов индуцируют веществом 48/80 (Compound 48/80), которое вызывает дегрануляцию тучных клеток. Проницаемость сосудов оценивается при помощи красителя синего Эванса. Рассматриваются основные требования и особенности методологии модели проницаемости сосудов. В рамках данной модели увеличение проницаемости сосудов вызывали путем внутрикожной инъекции вещества 48/80, и подтверждали инфильтрацией красителя синего Эванса в инъецированные участки кожи. Проницаемость оценивали путем измерения диаметра окрашенных участков кожи и экстракции красителя синего Эванса. На экспериментальной модели показано, что внутрикожное введение вещества 48/80 приводит к увеличению проницаемости сосудов кожи крыс. Стандартный объект фенилэфрин при внутрибрюшинном введении крысам в дозе 15 мг/кг статистически значимо снижает проницаемость сосудов. Установлены оптимальные для данного типа исследований доза красителя синего Эванса и временной интервал, при котором достигается максимальная концентрация красителя в ткани. Согласно результатам проведенных исследований, данная модель является простой, нетрудоемкой и достаточно информативной.
Введение
Изучение состояния проницаемости стенок сосудов – одна из весьма актуальных проблем физиологии и патологии. Нарушение проницаемости тканей и клеток играет определенную роль в патогенезе ряда заболеваний и механизме лечебного действия различных фармакологических средств. Изменение проницаемости стенок кровеносных сосудов отмечается при таких заболеваниях, как аллергические, инфекционные, пищевые интоксикации, алиментарные расстройства, тиреотоксикозы, авитаминозы, поражения боевыми отравляющими веществами и лучистой энергией, ожоги, электротравмы, опухоли и т.д. Изменение степени проницаемости стенок кровеносных капилляров сопровождается нарушением обмена веществ, гипоксией, аутоинтоксикацией и отражается на исходе заболевания [12].
Сосудистое русло выстлано изнутри монослоем эндотелиальных клеток, который выполняет важные функции в организме, такие как регуляция свертывания крови, контроль сосудистого тонуса и гемодинамики, участие в иммунных реакциях, обмен веществ между кровью и тканями. Последняя функция эндотелия непосредственно связана с его свойством активного полупроницаемого барьера. Нарушение барьерной функции эндотелия сопровождается повышением проницаемости сосудистой стенки и развитием отека ткани, последствия которого могут варьировать от незначительных до катастрофических, когда поражаются легкие, мозг и другие жизненно важные органы.
Проницаемость стенки сосуда определяется контактными взаимодействиями и сократительной активностью эндотелиальных клеток, а также работой систем трансэндотелиального переноса веществ.
Клетки эндотелия соединяются друг с другом посредством 3 типов контактов (плотные контакты, адгезивные и щелевые) [3].
При ряде патологий барьерная функция эндотелия нарушается. К факторам, вызывающим острое повышение проницаемости эндотелия сосудов относятся такие естественные агенты, как тромбин, гистамин, брадикинин, активные формы кислорода и азота, фактор роста эндотелия сосудов (VEGF), фактор некроза опухоли, бактериальные эндотоксины, некротоксины, избыточная механическая стимуляция. Вследствие этого происходит экстравазация жидкости и плазменных белков, и образуются отеки тканей [3,10].
Молекулярные механизмы действия перечисленных факторов на эндотелий различны, но все они приводят к снижению адгезивных свойств и повышению сократительных свойств эндотелия. Сокращение эндотелиальных клеток не позволяет соседним эндотелиальным клеткам приблизиться друг к другу, таким образом, препятствуя восстановлению целостности монослоя [3]. Так, например, под влиянием VEGF и ангиопоэтина-2 в эндотелии образуются фенестры, что приводит к увеличению сосудистой проницаемости и экстравазации плазменных белков [1].
Вслед за увеличением проницаемости эндотелия развивается обратная реакция восстановления барьерной функции. Идентифицирован ряд естественных соединений, которые способствуют поддержанию целостности эндотелия сосудов [3, 5].
Изменение проницаемости сосудов может быть оценено при помощи индикаторов, один из них – краситель синий Эванса (Evans blue, Т-1824).
Краситель синий Эванса – диазокраситель, широко применяемый в физиологии и гистохимии (рис. 1). Данный краситель быстро образует связи с сывороточным альбумином и неспособен включаться в клетки, благодаря этим свойствам его концентрация в плазме крови остается относительно постоянной на протяжении нескольких часов после внутривенного введения [11].
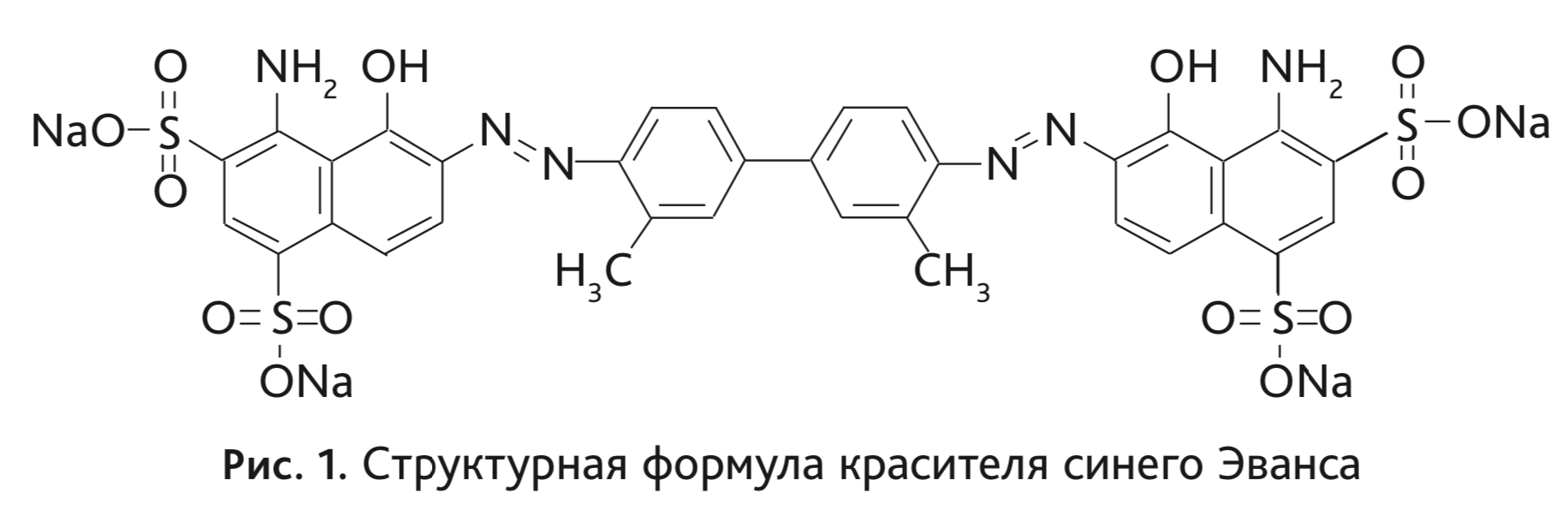
После инъекции краситель попадает в кровеносное русло. Связывание синего Эванса с альбумином происходит в результате реакции сульфирования аминогруппы на поверхности белка с сульфонил-группой красителя (рис. 2) [9]. Максимум поглощения красителя приходится на 620 нм [7].
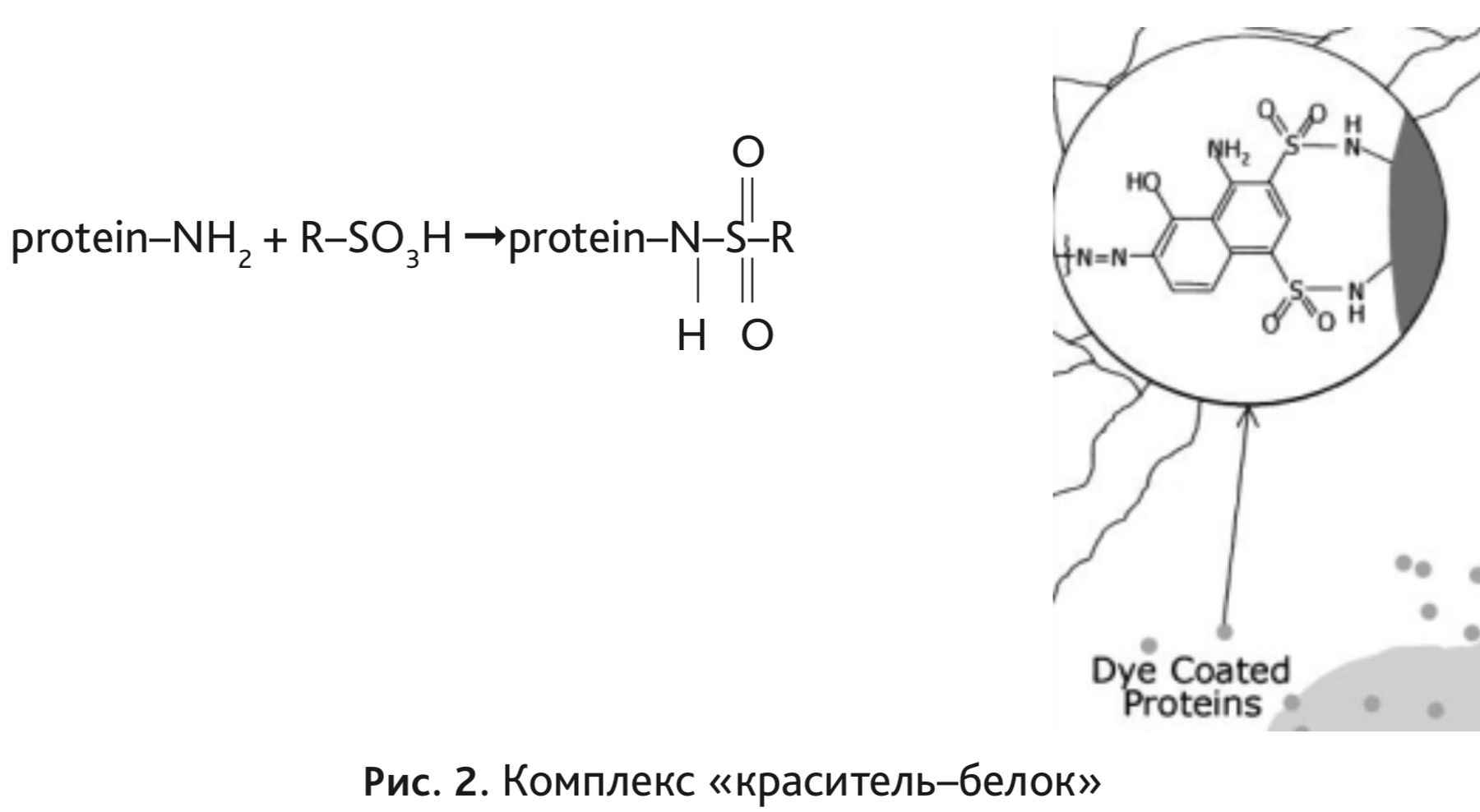
Краситель синий Эванса используют также для:
- измерения проницаемости гематоэнцефалического барьера [13];
- измерения объема плазмы крови [7];
- изучения противовоспалительного действия препаратов [8];
- выявления повреждений сосудов и скелетных мышц [8];
- прижизненного окрашивания мукополисахаридно-протеиновых комплексов [13];
- иммунофлюоресцентного анализа с целью подкрашивания фона препарата.
При этом структуры, окрашенные специфическими антителами, светятся ярко-зеленым светом, а все остальные структуры – темно-красным за счет флюоресценции синего Эванса [13].
При изучении данной модели в литературе не удалось найти данных о подборе оптимальных условий проведения эксперимента, дозы и времени воздействия красителя, а также сведений об ожидаемых результатах.
Цель данного исследования – подбор оптимальных условий проведения эксперимента, дозы и времени воздействия красителя (синего Эванса), а также оценка эффекта фенилэфрина как стандартного объекта (позитивного контроля) в этой модели.
Материал и методы
Для моделирования увеличения проницаемости сосудов была использована внутрикожная инъекция вещества 48/80 – дегранулятора тучных клеток, которая сопровождается экстравазацией белков плазмы крови и подтверждается инфильтрацией красителя синего Эванса в инъецированные участки кожи [10].
Под влиянием вещества 48/80 происходит стимуляция тучных клеток и высвобождение посредников воспаления, в частности гистамина, простагландинов и лейкотриенов.
Это приводит к расширению артериол и венул и повышению проницаемости сосудов. Данный метод подходит для изучения фармакологической активности блокаторов H1-гистаминовых рецепторов, ингибиторов метаболизма арахидоновой кислоты, вазодилататоров, альфа-адреномиметиков, антагонистов рецепторов лейкотриенов, мембраностабилизаторов и др.
Исследование было одобрено биоэтической комиссией НПО «Дом Фармации», протокол от 21 июня 2017 г. №2.36/17.
Исследование проводили на крысах. Количество животных для эксперимента должно быть достаточным для полной статистически значимой регистрации изучаемых эффектов и быть минимальным с точки зрения этических принципов. По рекомендации Vogel следует брать 10 животных для каждой группе [10].
В нашем исследовании были использованы 84 самки аутбредных крыс возрастом 10–12 нед средней массой 400 г. Животные были распределены на 2 основные группы по 10 особей: негативный контроль (физиологический раствор) и позитивный контроль (фенилэфрин). Для пилотного исследования были сформированы 16 групп по 4 животных в группе в соответствии со схемой эксперимента.
За 1 сут до проведения исследования животным аккуратно выбривают шерсть на вентральной стороне так, чтобы не вызвать травматизации наружных кожных покровов. На следующий день, за 1 ч до введения исследуемых веществ, внутривенно вводят 1% раствор красителя синего Эванса в дозе 5 мл/кг (50 мг/кг) [4, 10].
Для определения оптимальной дозы красителя и времени экспозиции было проведено пилотное исследование. Были исследованы 4 дозы: 10, 25, 50, 75 мг/кг и 4 временные точки. Краситель синий Эванса вводили за 15, 30, 60 и 90 мин до введения вещества 48/80. Через 90 мин после введения вещества 48/80 животных эвтаназировали и измеряли диаметр синих пятен и экстракцию красителя для определения его количества в ткани.
Согласно Н. Vogel (2008), фенилэфрин эффективен в дозе 15 мг/кг в аналогичных экспериментах. Он оказывает сосудосуживающее и альфа-адреномиметическое действие [14]. Стимулирует постсинаптические альфа-адренорецепторы. Как вазоконстриктор он оказывает антиконгестивное действие: уменьшает отек и гиперемию, выраженность экссудативных проявлений. Кроме этого, эффект от воздействия вещества 48/80 может быть обратим действием стабилизаторов мембраны тучных клеток.
В качестве позитивного контроля мы использовали фенилэфрин, 2,5% раствор в дозе 15 мг/кг. Для изучения эффектов препаратов в модели проницаемости сосудов могут быть применены различные пути введения, но наиболее распространенный способ – аналог планируемого пути введения человеку в клинической практике. Фенилэфрин и физиологический раствор вводили однократно через 1 ч после введения красителя [10].
Индукцию проницаемости сосудов проводили через 30 мин после введения исследуемых веществ. Животных наркотизировали и вводили 50 мкл 0,01% раствора вещества 48/80 внутрикожно в 3 точки на выбритом участке живота. Для контроля реактивности кожи по аналогичной схеме (по 50 мкл в 3 точки) вводили физиологический раствор.
По результатам проведенных исследований, расстояние между инъекциями должно составлять не менее 2,5–3 см (рис. 3), поскольку может происходить пересечение синих пятен, в таком случае данные будут не информативны. Мы пользовались стандартным методом индукции увеличения проницаемости сосудов.

Через 90 мин после внутрикожных инъекций животных эвтаназировали.
В соответствии с Директивой 2010/63/EU Европейского Парламента и Совета Европейского Союза по охране животных, используемых в научных целях, от 22 сентября 2010 г. [2], животных эвтаназировали помещением их в СО2-камеру при постепенном заполнении камеры диоксидом углерода.
Далее отделяли лоскут кожи для последующего анализа.
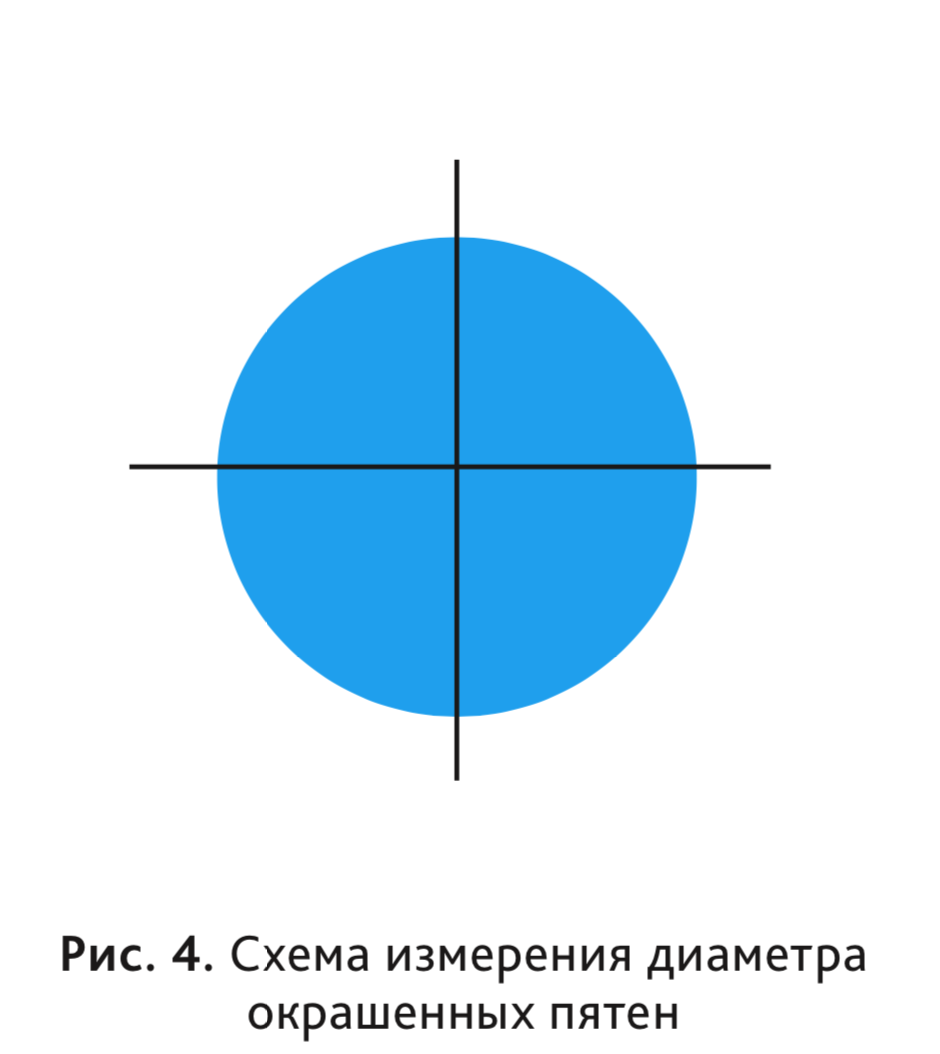
Согласно H.G. Vogel, проницаемость сосудов следует оценивать путем измерения диаметра окрашенных областей в 2 перпендикулярных направлениях (рис. 4) и вычислять среднее значение для всех мест инъекции у каждого животного [10]. Затем вычисляют процент ингибирования у животных, получавших исследуемые вещества, и сравнивают эти показатели с таковыми в контрольной группе.
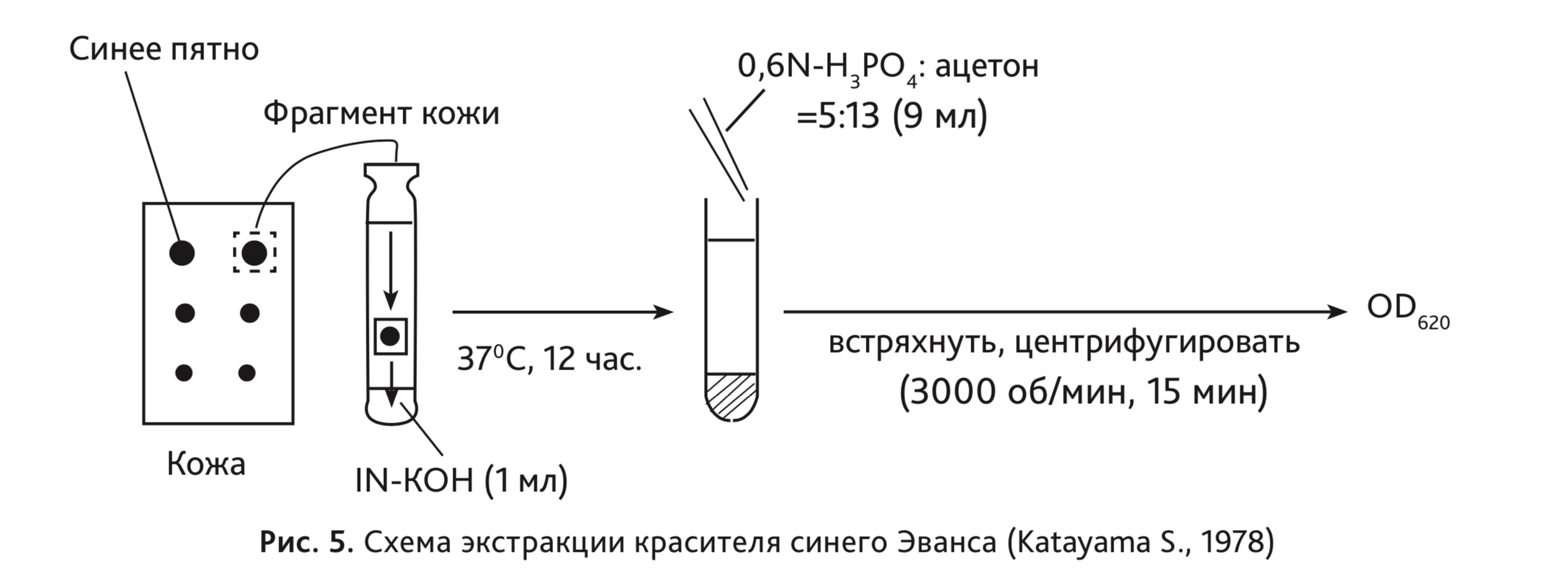
S. Katayama и соавт. предложили другой метод оценки – определение концентрации красителя путем экстракции из кожи. Лоскут кожи с синим пятном помещают в 1 мл однонормального раствора KOH (1N KOH), инкубируют 12 ч при температуре 37ºC. Затем pH нейтрализуют 2,5 мл 0,6N H3PO4. Для экстракции красителя pH H3PO4 должна находиться в пределах от 6 до 9. После реакции нейтрализации добавляют 6,5 мл ацетона, энергично встряхивают несколько секунд, после чего центрифугируют 15 мин при 3000 g. Затем измеряют оптическую плотность при помощи спектрофотометра при длине волны 620 нм. Схема экстракции красителя представлена на рис. 5 [6].
В такой модификации, определяя концентрацию красителя методом спектрофотометрии, недопустимо разметку мест инъекции проводить маркером, поскольку пигмент маркера может оказать влияние на величину оптической плотности.
Существуют также другие модификации методов оценки проницаемости сосудов. Так, например, McClure с соавт. (1992) для количественной оценки проницаемости сосудов использовали анализатор изображений Olympus CUE-2 Image Analyzer. Teixeira с соавт. (1993) для измерения инфильтрации меченых индием-111 эозинофилов и нейтрофилов, и оценки образования отеков использовали меченый йодом-125 сывороточный альбумин человека. Различные модификации предлагают также другие красители, например понтамин небесно-голубой, или другой индуктор повышенной проницаемости сосудов – капсаицин.
В нашей работе были использованы 2 метода оценки: по диаметру окрашенных областей, измеренных с помощью
калиброванной линейки в 2 перпендикулярных направлениях, и по концентрации красителя синего Эванса
в экстракте.
Результаты и обсуждение
Результаты исследования по определению оптимальной дозы красителя и времени экспозиции представлены на рис. 6 и 7.
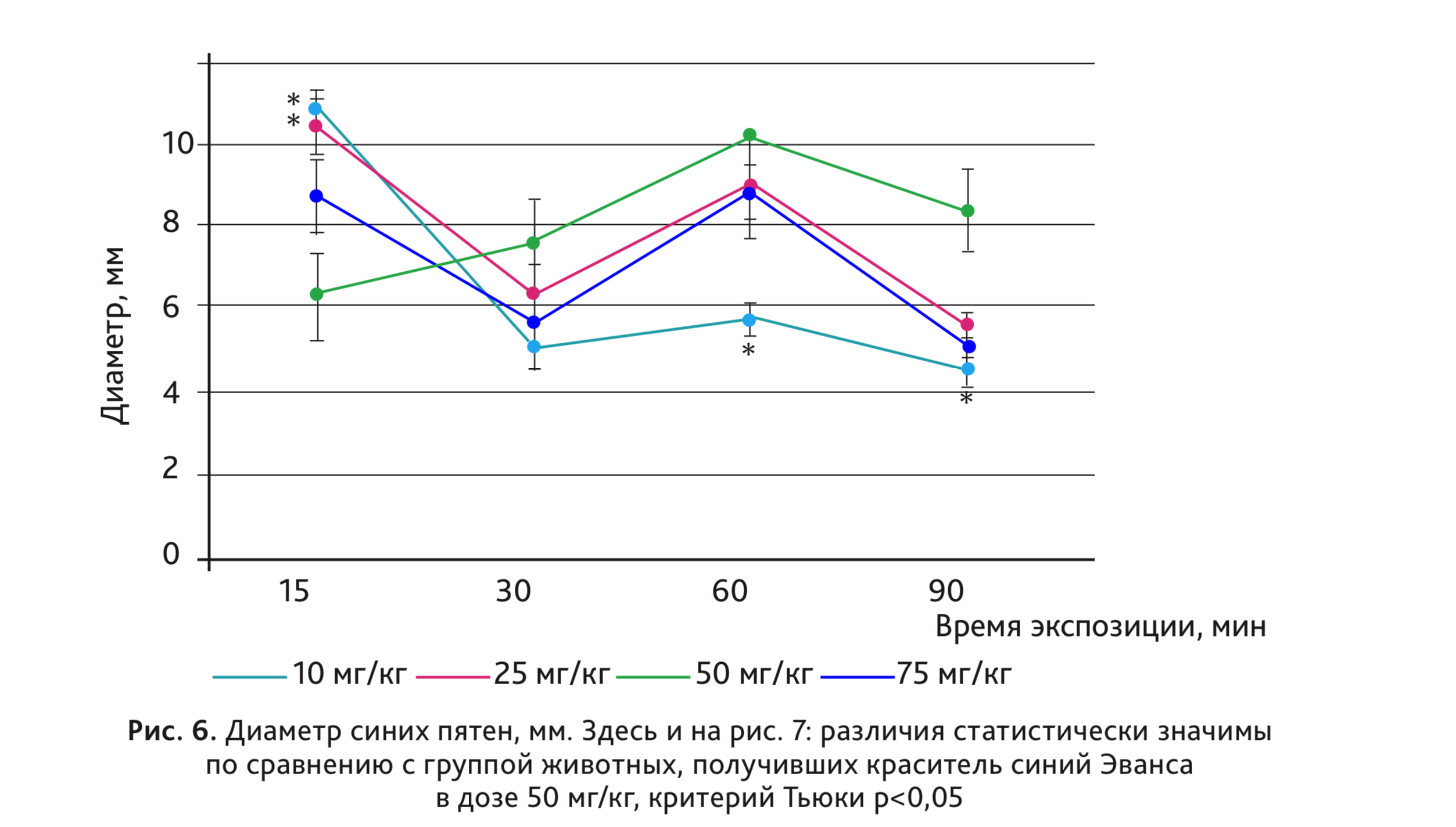
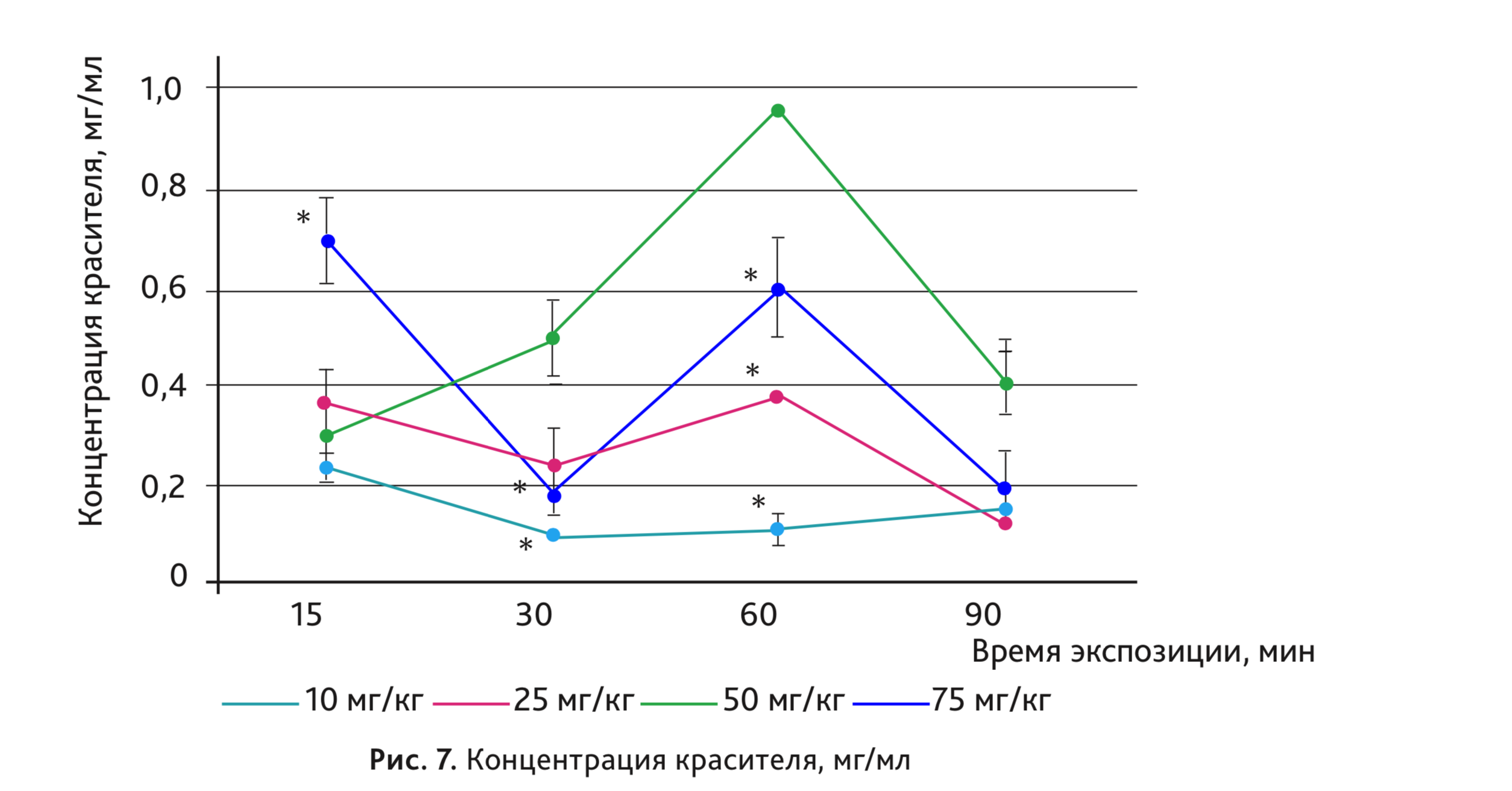
При использовании синего Эванса в дозах 10 и 25 мг/кг не было отмечено выраженного увеличения концентрации красителя в тканях кожи. Наиболее выраженную реакцию наблюдали при введении дозы 50 мг/кг. Интересно отметить, что дозозависимость была более выражена при спектрофометрической оценке.
При использовании красителя синего Эванса практически во всех дозах максимальный выход красителя в ткани наблюдался при экспозиции 60 мин.
На рис. 8 представлены диаметры пятен животных, получавших краситель синий Эванса в разных дозах при экспозиции 60 мин. Как видно на рисунках, в дозах 10, 25 и 75 мг/кг отмечается большая «размытость» пятен, чем при дозе 50 мг/кг. Таким образом, оптимальная доза красителя синего Эванса – 50 мг/кг.

При экспозиции 90 мин отмечено снижение концентрации и уменьшение диаметра пятен во всех исследованных дозах синего Эванса.
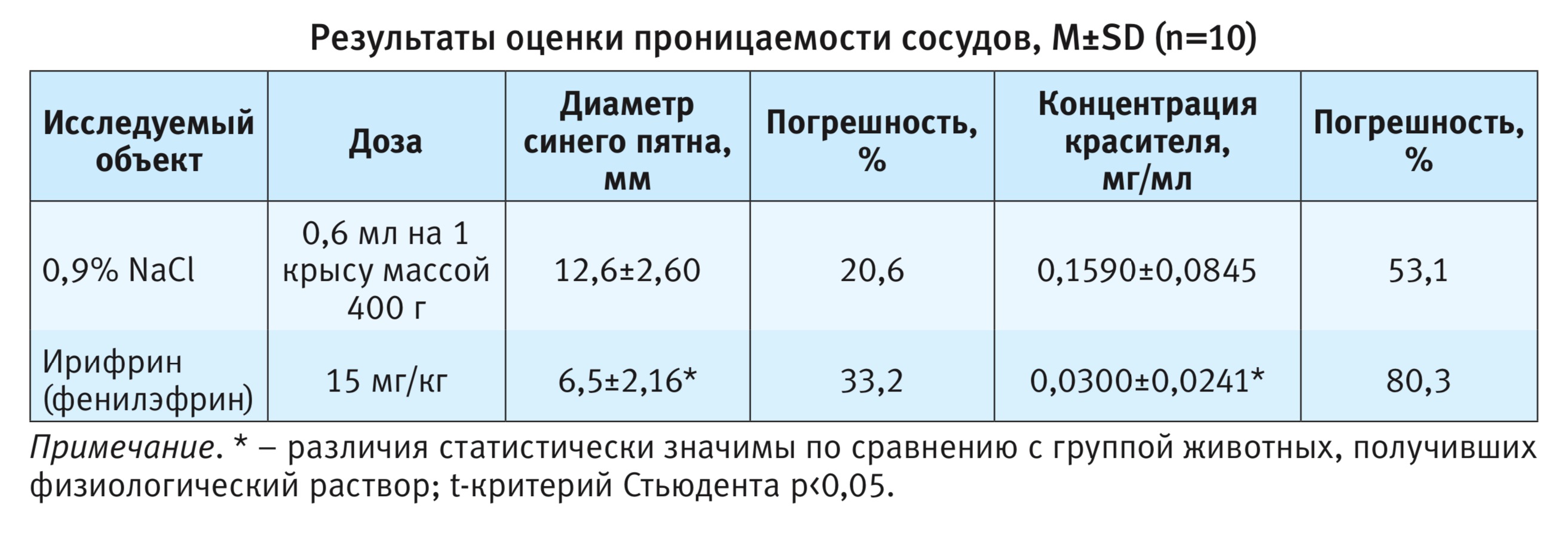
Результаты оценки проницаемости сосудов представлены в таблице.
Спектрофотометрический анализ экстракта красителя проводили в соответствии с методикой S. Katayama. Оптическую плотность надосадочной жидкости анализировали на длине волны 620 нм с помощью планшетного спектрофотометра xMark (BioRad, США) [6].
Расчет концентрации выполняли по калибровочному графику. Для его построения готовили водный раствор красителя синего Эванса с разными концентрациями.
Согласно представленным данным, точность измерения оказалась выше при линейных измерениях диаметра пятна в 2 перпендикулярных направлениях и вычислении среднего значения всех мест инъекции у каждого животного.
Анализ данных при помощи t-критерия Cтьюдента (р<0,05) выявил статистически значимые отличия показателей в группе животных, получивших сосудосуживающее средство фенилэфрин от таковых в группе животных, получивших физиологический раствор, что подтверждает адекватность используемой методологии. По диаметру пятна снижение проницаемости сосудов составило около 50%, по концентрации красителя в тканях около 80%, однако с учетом большей погрешности в измерениях, следует признать наиболее целесообразным метод измерения диаметра пятна.
Проведенное экспериментальное исследование позволило сделать следующие выводы:
- внутрикожное введение вещества 48/80 приводит к увеличению проницаемости сосудов кожи крыс, оцененному по размеру окрашенного пятна и концентрации красителя синего Эванса;
- оптимальным для данного типа исследований является краситель синий Эванса в дозе 50 мг/кг при временном интервале от 60 мин в зависимости от фармакокинетики исследуемого препарата.
- стандартный объект фенилэфрин при внутрибрюшинном введении крысам в дозе 15 мг/кг статистически значимо снижает проницаемость сосудов, что подтверждает корректность поставленного эксперимента.
Заключение
Как показали результаты исследований, данная модель является простой, нетрудоемкой и достаточно информативной. Этот метод подходит для изучения фармакологической активности блокаторов H1-гистаминовых рецепторов, ингибиторов метаболизма арахидоновой кислоты, вазодилятаторов, альфа-адреномиметиков, антагонистов рецепторов лейкотриенов, мембраностабилизаторов и других препаратов, способных снижать проницаемость капилляров.
Список источников
- Гарбузенко Д.В. Механизмы адаптации сосудистого русла к гемодинамическим нарушениям при портальной гипертензии. Вестник РАМН. 2013; 1: 52–7.
- Директива 2010/63/EU Европейского Парламента и Совета Европейского Союза по охране животных, используемых в научных целях. НП «Объединение специалистов по работе с лабораторными животными» (Rus-LASA). СПб. 2012: 48.
- Ширинский В.П. Молекулярная физиология эндотелия и механизмы проницаемости сосудов. Успехи физиол. наук. 2011; 42 (1): 18–32.
- Bennett A.J., G.B. West. Measurement of the changes in vascular permeability in rat skin. Journal of Pharmacological and Toxicological Methods. 1978; 1: 105–8.
- Huang H., Bhat A., Woodnutt G. et al. Targeting the ANGPT-TIE2 pathway in malignancy. Nature Reviews Cancer. 2010; 10 (8): 575–85.
- Katayama S., Shionoya H., Ohtake S. A new method for extraction of extravasated dye in the skin and the influence of fasting stress on passive cutaneous anaphylaxis in guinea pigs and rats. Microbiology and Immunology. 1978; 22 (2): 89–101.
- Lawrence A.C.K., Walters G. The extraction of Evans blue (T1824) from plasma and the measurement of plasma volume. Journal of Clinical Pathology. 1959; 12: 123.
- Ramesh B.N., Mahalakshmi A.M., Mallappa S. Vascular permeability and Evans blue dye a physiological and pharmacological approach. Journal of Applied Pharmaceutical Science. 2014; 4 (11): 106–13.
- Tsopelas C., Sutton R. Why certain dyes are useful for localizing the sentinel lymph node. The Journal of Nuclear Medicine. 2002; 43 (10): 1377–82.
- Vogel H.G. Drug Discovery and Evaluation:Pharmacological Assays. Springer. 2008.
- Wang H.-L., Lai T.W. Optimization of Evans blue quantitation in limited rat tissue samples.Scientific Reports.2014; 4: 6588.
- Электронный ресурс: http://bono-esse.ru/blizzard/RPP/M/Infekcionka/pronicaemost_ kapilljarov.html
- Электронный ресурс: http://www.ysam.ru/kras/80.html
- Электронный ресурс: https://www.rlsnet.ru/mnn_index_id_931.htm




