Влияние отечественного противоопухолевого соединения из класса нитрозоалкилмочевин хлонизола на общую выживаемость лабораторных грызунов с интракраниальными опухолями: метаанализ результатов доклинических исследований
Работа выполнена без спонсорской поддержки.
Муразов Я.Г. , Стуков А.Н., Змитриченко Ю.Г., Точильников Г.В. Влияние отечественного противоопухолевого соединения из класса нитрозоалкилмочевин хлонизола на общую выживаемость лабораторных грызунов с интракраниальными опухолями: метаанализ результатов доклинических исследований. Лабораторные животные для научных исследований. 2022; 2. https://doi.org/10.29296/2618723X-2022-02-05
Резюме
Потребность в новых, эффективных и доступных средствах лекарственной терапии первичных и метастатических опухолей головного мозга остается неудовлетворенной. Поисковые доклинические исследования хлонизола (2-[3-(2‑хлорэтил)-3‑нитрозоуреидо]-1,3‑пропандиола) показали многообещающие результаты при лечении экспериментальных интракраниальных опухолей. Цель исследования — применить метааналитический подход для получения обобщенной величины эффекта хлонизола в отношении общей выживаемости (ОВ) у грызунов с трансплантированными опухолями головного мозга. Данные для метаанализа были получены из внутренней базы данных лаборатории из отчетов о доклинических исследованиях хлонизола. Исследованиями, соответствующими критериям включения, были параллельные доклинические испытания на грызунах (мышах, крысах) с интракраниально трансплантированными опухолями. Противоопухолевую активность хлонизола сравнивали с активным контролем (ломустином или темозоломидом). Все цитостатики вводили в максимально переносимой дозе (МПД). Продолжительность исследований составляла не менее 90 дней. Основным оцениваемым исходом была ОВ и отношение риска смерти (hazard ratio, HR). Для метаанализа HR были выбраны модель случайных эффектов и метод обратной дисперсии для вычисления общего размера эффекта. Анализ включал 7 исследований и суммарно 132 грызуна. Исследования были проведены в период с 2016 по 2022 г. В качестве интракраниальных трансплантатов у мышей использовали карциному Эрлиха, саркому 180 и HER2‑положительную опухоль молочной железы, полученную от самки трансгенной мыши FVB/N HER-2/neu. Глиому 35 трансплантировали крысам. По сравнению с активным контролем пероральное или внутрибрюшинное введение хлонизола в МПД 20 мг/кг значительно снижало риск смерти на 63% (HR=0,37; 95% CI: 0,24–0,56; P<0,00001) у животных с интракраниальными опухолями. Направленность эффекта в пользу хлонизола была стабильной во всех исследованиях, несмотря на использование разных животных и трансплантатов, путей введения хлонизола и препаратов сравнения. Между исследованиями не наблюдалось значимой гетерогенности (Tau2=0,03; Chi2=6,52; df=6; P=0,33; I2=8%). По сравнению с ломустином и темозоломидом лечение хлонизолом в МПД обеспечивало существенное преимущество в ОВ животных с интракраниальными опухолями. Полученные результаты могут служить обоснованием для дальнейшего изучения хлонизола в качестве химиотерапевтического средства при первичных и метастатических опухолях головного мозга.
Введение
Первичные опухоли головного мозга (ГМ) у взрослых встречаются нечасто и составляют около 3% от всех видов злокачественных новообразований. При этом именно опухоли ГМ приводят к наибольшему количеству лет потерянной жизни среди всех видов рака [1]. Опухоли ГМ являются наиболее распространенным типом солидных опухолей у детей и основной причиной смерти от рака в этой популяции [2]. Метастазы в ГМ встречаются в 10 раз чаще, чем первичные опухоли [3]. Наиболее часто метастазы в центральной нервной системе наблюдаются при опухолях легкого, молочной железы и меланоме [4]. Общая выживаемость (ОВ) пациентов с первичными опухолями ГМ за последние 10 лет практически не изменилась, несмотря на внедрение новых методов лечения и прогресс в понимании биологии роста опухолей данной локализации. Поиск эффективных и доступных средств лекарственной терапии первичных опухолей и метастазов в ГМ остается актуальной задачей современной онкофармакологии.
Объектом представленного исследования является отечественное противоопухолевое соединение 2-[3-(2‑хлорэтил)-3‑нитрозоуреидо]-1,3‑пропандиол (хлонизол). Хлонизол относится к классу нитрозоалкилмочевин (НАМ) (рис. 1). Молекулярные механизмы действия НАМ связаны с алкилированием и карбамоилированием макромолекул продуктами биодеградации соединений. По уровню цитогенетической активности хлонизол превосходит все другие исследованные ранее препараты класса НАМ [5].
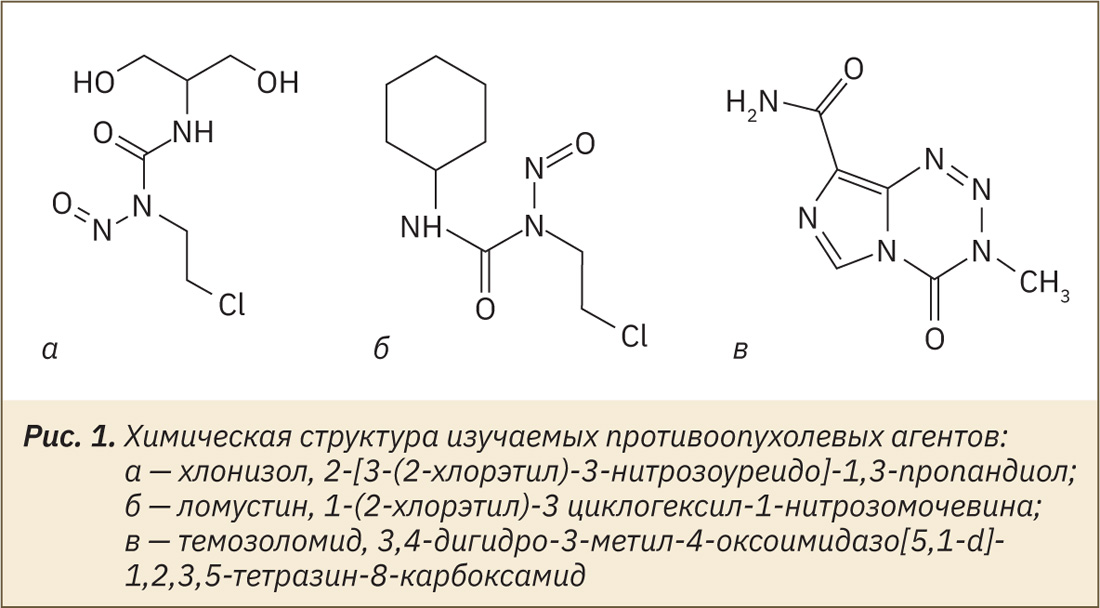
Метаанализ — это статистический анализ, обобщающий результаты нескольких сопоставимых исследований, изучающих одну и ту же проблему (обычно эффективность методов лечения, профилактики, диагностики). Объединение исследований обеспечивает бо́льшую выборку для анализа и бо́льшую статистическую мощность. Метаанализ в здравоохранении стал активно применяться в течение последних двух десятилетий в ответ на необходимость критической оценки результатов клинических исследований. Метаанализ позволяет практикующим врачам и пациентам принимать информированные решения об оказании медицинской помощи и проведении того или иного вмешательства [6]. Идея обобщенной статистической оценки доклинических исследований (ДКИ) сравнительно новая. Цели и задачи метаанализа ДКИ кардинально отличаются от таковых для метаанализа результатов клинических исследований [7]. Во-первых, систематические обзоры и метаанализы ДКИ являются гипотезогенерирующими и преследуют исследовательские (exploratory) цели, они позволяют включать все имеющиеся данные по интересующему вопросу. Во-вторых, метаанализ ДКИ позволяет повысить трансляционность результатов для последующих клинических исследований, обеспечивает объективность результатов при соблюдении принципов 3Rs (replacement, reduction, refinement) и снижает общие затраты на проведение ДКИ. В-третьих, важная задача метаанализа ДКИ состоит в том, чтобы выявить источники возможных систематических ошибок для дальнейшей подготовки дизайна клинических исследований и повышения качества их выполнения. И наконец, для метаанализа ДКИ не совсем важна общая оценка размера эффекта вмешательства, куда важнее оценить направленность эффекта, включая его «устойчивость», а также выявить возможные источники гетерогенности между исследованиями [8].
Цель метаанализа в настоящем исследовании — представить обобщенную статистическую оценку эффектов хлонизола в отношении ОВ мышей и крыс с интракраниально трансплантированными опухолями в сравнении с известными средствами химиотерапии.
Материал и методы
Поиск и отбор исследований. Критерии включения ДКИ в метаанализ. Данные для метаанализа были получены из внутренней базы данных научной лаборатории химиопрофилактики рака и онкофармакологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России. Критерии включения исследований в метаанализ были следующие:
1) изучение противоопухолевой активности хлонизола на мышах или крысах;
2) интракраниальная трансплантация сингенных или линейно-неспецифичных штаммов по методике, описанной в работе [9];
3) наличие группы сравнения с активным препаратом;
4) введение хлонизола и препаратов сравнения в максимально переносимой дозе (МПД);
5) длительность исследования не менее 90 дней;
6) в качестве конечной точки исследование включало оценку ОВ.
Протоколы всех исследований были рассмотрены и одобрены локальным этическим комитетом. Уход и все манипуляции с животными выполнялись в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS N 123), Директивой Европейского парламента и Совета Европейского союза 2010/63/ЕС о защите животных, использующихся для научных целей.
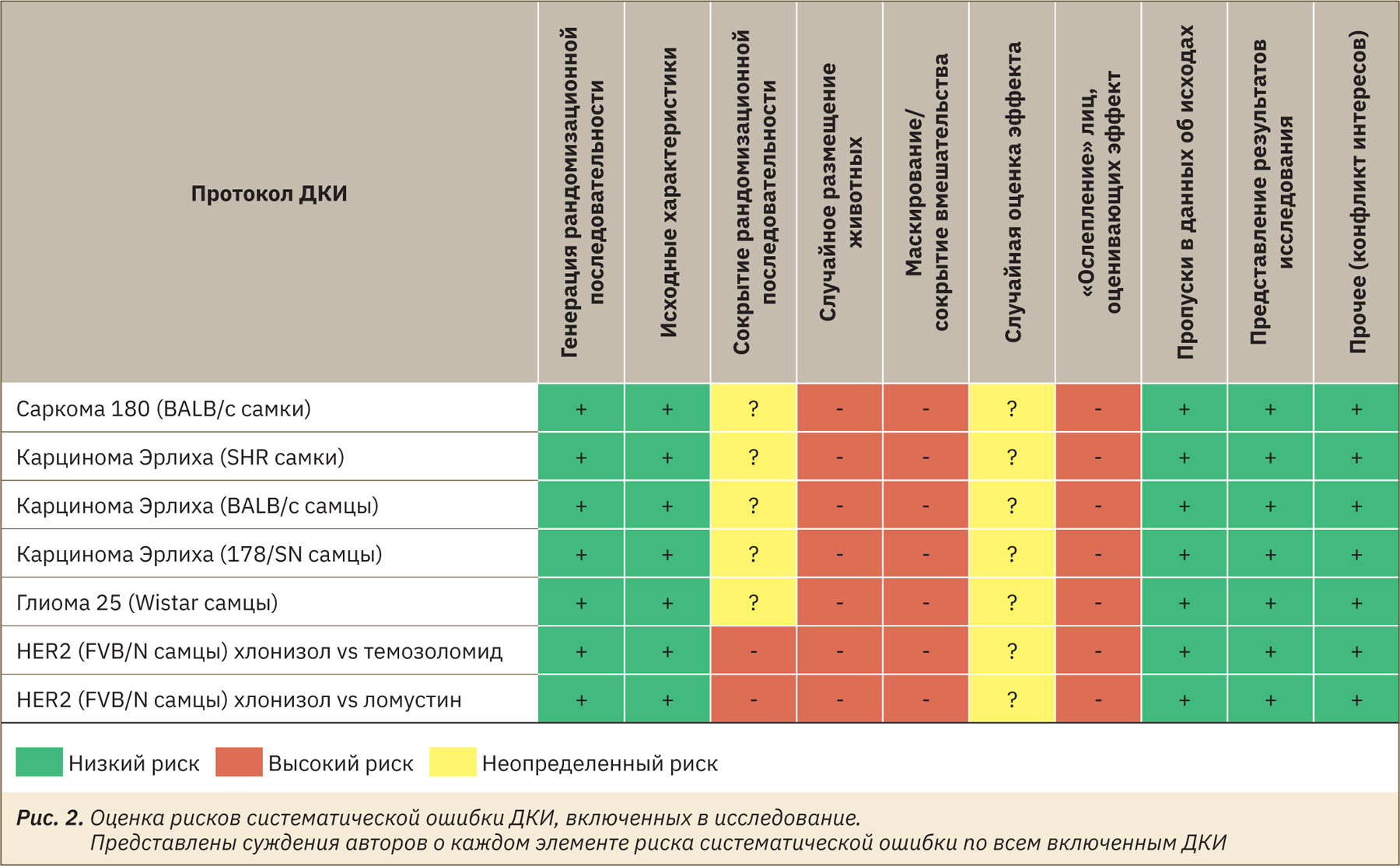
Оценка риска систематической ошибки. Оценку риска систематической ошибки отдельных исследований в отношении исходов эффективности проводили два соавтора с помощью модифицированного вопросника Кокрановского сотрудничества для оценки риска систематических ошибок (The Cochrane Collaboration’s tool for assessing risk of bias) [10]. Общий риск систематической ошибки оценивали по следующим доменам.
- Систематическая ошибка отбора (selection bias) — генерация рандомизационной последовательности; исходные характеристики; сокрытие рандомизационной последовательности.
- Систематическая ошибка, связанная с ходом исследования (performance bias) — случайное размещение животных; маскирование/сокрытие вмешательства.
- Систематическая ошибка выявления исходов (detection bias) — случайная оценка эффекта; «ослепление» лиц, оценивающих эффект.
- Cистематическая ошибка пропуска данных (attrition bias) — пропуски данных об исходах.
- Cистематическая ошибка представления результатов (reporting bias) — полнота представления результатов исследования.
- Прочее (others) — наличие конфликта интересов.
Общее смещение считалось низким, если все домены имели низкий риск смещения, и высоким, если по крайней мере один домен имел высокий риск смещения или несколько доменов вызывали опасения. Разногласия в оценке решались путем обсуждения.
Статистический анализ. Статистическую обработку данных выполняли в программах GraphPad Prism версии 8.0.1 и Review Manager (RevMan) версии 5.4.1 (The Cochrane Collaboration, 2020). Интегральные показатели ОВ представлены в виде отношения рисков (Hazard Ratio, HR) и границ его 95% доверительного интервала — 95% ДИ. Для метаанализа была выбрана модель случайных эффектов с применением метода обратной дисперсии, так как в исследованиях использовали различные виды животных, линии/стоки мышей, разными были препараты сравнения, отличались пути введения хлонизола и препаратов сравнения. Результаты метаанализа представляли в виде блобограммы (forest plot). Оценку статистической гетерогенности выполняли с использованием критерия хи-квадрат (χ2) Пирсона, а также индекса гетерогенности I2.
Результаты и обсуждение
Результаты поиска. Всего в базе данных лаборатории было найдено 7 исследований, в которых оценивали ОВ животных, получавших хлонизол и препараты сравнения — ломустин и темозоломид (см. рис. 1). ДКИ были проведены в период с 2016 по 2022 г., в общей сложности было включено 132 животных. В качестве интракраниального трансплантата у мышей использовали карциному Эрлиха, саркому 180, HER2‑положительную опухоль молочной железы, полученную от трансгенной по гену HER2 мыши-самки FVB/N. Крысам перевивали интракраниально глиому 35 (см. таблицу). ОВ определяли как время с момента рандомизации до гибели животного от любой причины. Результаты этих исследований были обработаны с помощью статистического анализа.
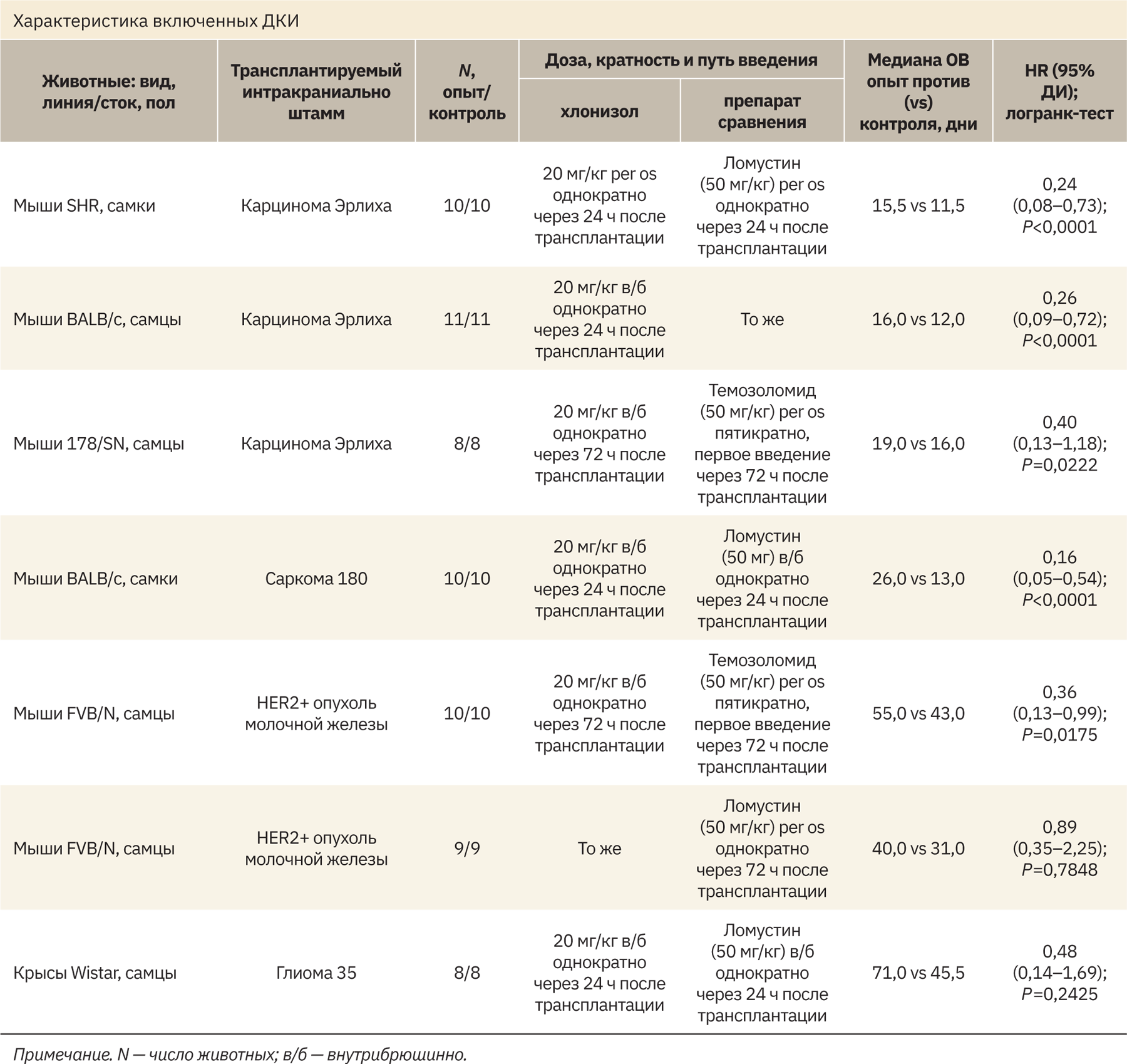
Оценка риска систематической ошибки. Все 7 исследований вызывают определенную озабоченность относительно оценки общего риска смещения. В частности, для всех протоколов характерно отсутствие случайного размещения животных, отсутствие маскирования/сокрытия вмешательства, а также «ослепления» лиц, оценивающих эффект. Кроме того, в двух исследованиях с трансплантируемой HER2+ опухолью отсутствовало сокрытие рандомизационной последовательности. Определенные опасения связаны с отсутствием достаточной информации относительно случайной оценки эффекта во всех исследованиях и наличием сокрытия рандомизационной последовательности (рис. 2).
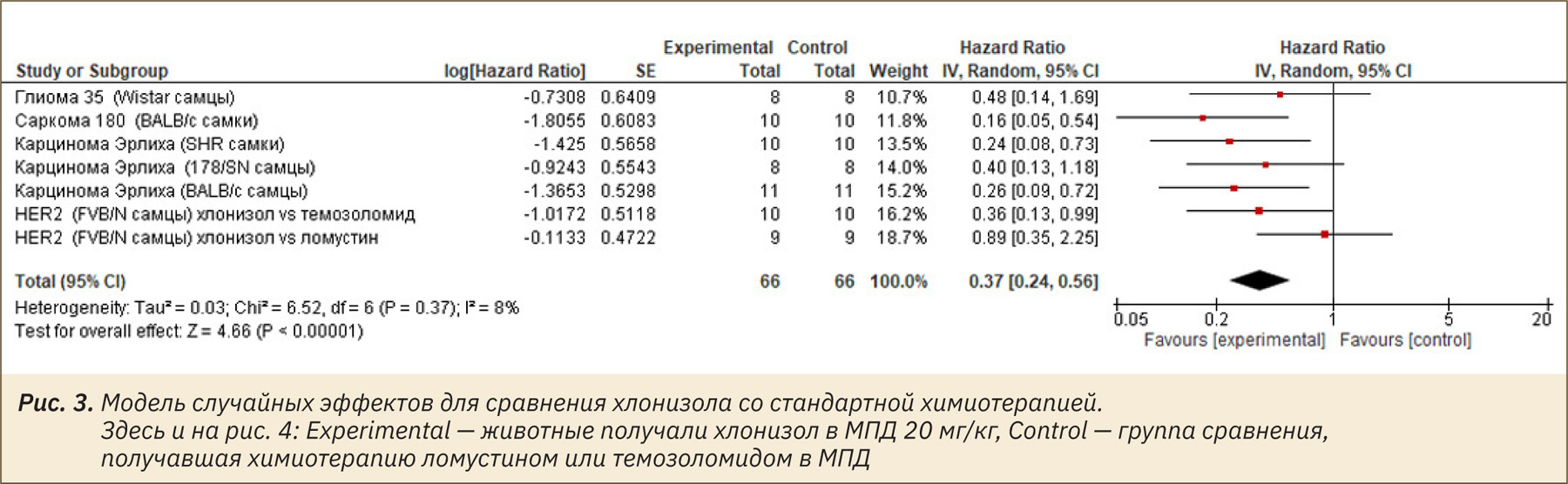
Анализ ОВ. Полученная точечная величина общего размера эффекта и его 95% ДИ показали, что пероральное или внутрибрюшинное введение хлонизола в максимально переносимой дозе (МПД) 20 мг/кг статистически значимо снижало риск смерти животных с интракраниальными опухолями на 63% (HR=0,37; 95% CI: 0,24–0,56; P<0,00001) по сравнению с контрольным лечением (рис. 3). Направленность эффекта в пользу хлонизола была устойчива между исследованиями, несмотря на использование разных животных и трансплантируемых штаммов, путей введения хлонизола и препаратов сравнения. Значимой гетерогенности между исследованиями не наблюдалось (Tau2=0,03; Chi2=6,52; df=6; P=0,33; I2=8%).
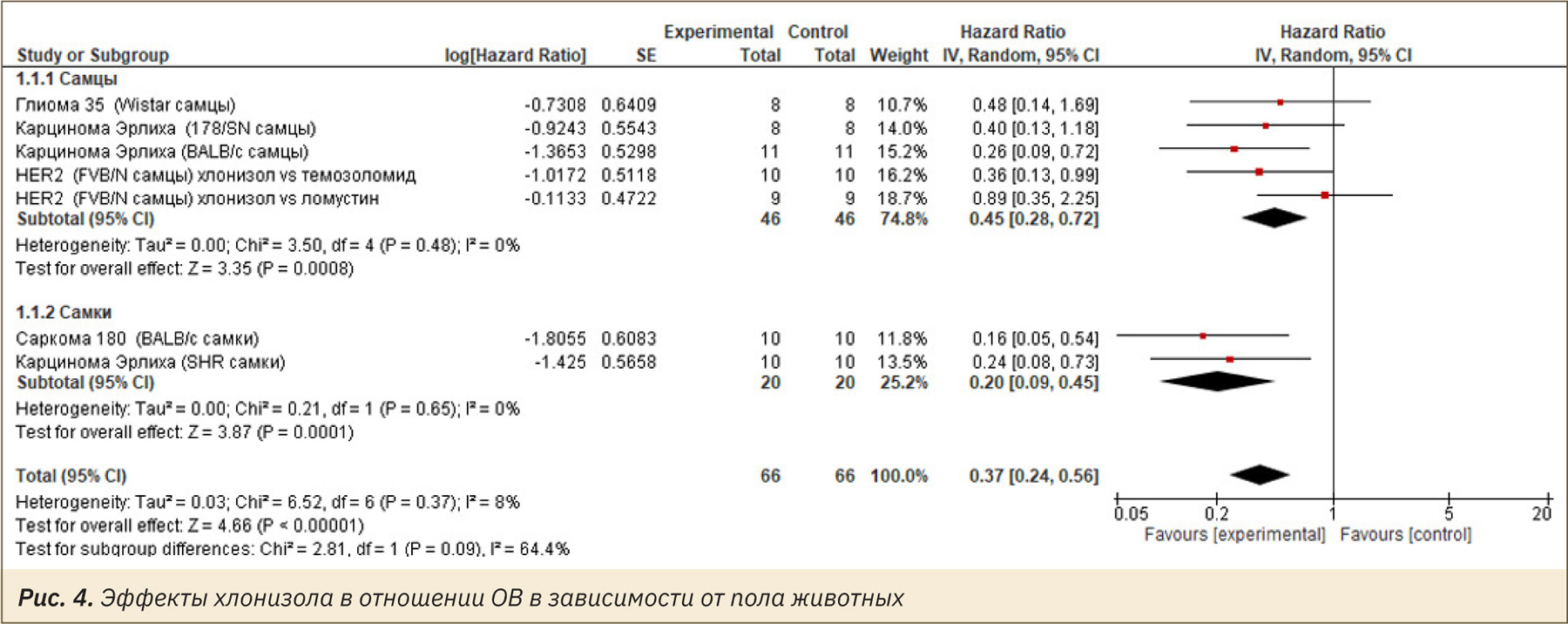
Для поиска возможного источника гетерогенности между исследованиями была предпринята попытка post-hoc-анализа в зависимости от пола животных. При подгрупповом анализе χ2‑тест выявил статистически значимую гетерогенность между самцами и самками (Chi2=2,81, df=1; P=0,09), индекс гетерогенности I2 составил 64% (рис. 4).
Как самостоятельный метод лечения системная химиотерапия при опухолевом поражении ГМ применяется нечасто из‑за ее низкой способности проникать через гематоэнцефалический барьер [11]. Из арсенала средств химиотерапии для лечения первичных и метастатических опухолей ГМ наиболее широко используются производное имидазотетразинов темозоломид и производное НАМ ломустин. Монотерапия этими препаратами обладает невысокой противоопухолевой активностью. Определенных успехов удалось добиться, комбинируя эти химиопрепараты с хирургическими и лучевыми методами лечения [12–14]. Хлонизол, как и ломустин, относится к производным НАМ. По данным Л.А. Островской и соавт. [15], для хлонизола соотношение площадей под кривыми концентрация—время в ГМ и крови (AUCГМ/AUCкровь) животных с карциномой легких Lewis составило 10,5 при внутривенном введении. Это указывает на высокую способность хлонизола проникать через гематоэнцефалический барьер.
Метаанализ обеспечивает решение проблемы обобщения данных ДКИ, предлагая надежную статистическую интеграцию и мощные инструменты для визуализации и сбора информации, которые легко интерпретировать. Чаще всего процедуре метаанализа предшествует поиск публикаций с заранее определенной стратегией поиска — систематический обзор. Тем не менее для ДКИ систематический обзор может потребоваться не всегда. Например, когда у исследователей есть доступ к множеству количественных данных исследований. Такая ситуация характерна для фармацевтических компаний [16]. Количественные результаты для представленного анализа были получены из внутренней базы данных отчетов по ДКИ научной лаборатории химиопрофилактики рака и онкофармакологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России. В качестве математической модели была выбрана модель со случайными эффектами, так как она в большей степени отражает реальную ситуацию, учитывая характер и разнообразие проведенных экспериментов на животных [8].
Включенные в анализ индивидуальные сравнительные ДКИ хлонизола продемонстрировали его преимущества у лабораторных грызунов в отношении широкого спектра опухолей, трансплантируемых интракраниально (см. таблицу). Тем не менее в ряде исследований не удалось достичь статистически значимых эффектов хлонизола по сравнению с активным контролем (см. таблицу). Вероятно, это связано с малым числом животных в группах (8–9 особей). В связи с этим обобщенная статистическая оценка однородных ДКИ выглядит вполне обоснованной. Проведенный метаанализ ДКИ показал, что по сравнению с контрольным лечением хлонизол, вводимый в МПД 20 мг/кг, статистически значимо снижал риск смерти животных с интракраниальными опухолями на 63% (HR=0,37; 95% CI: 0,24–0,56; P<0,00001) (см. рис. 3). Среди проанализированных ДКИ наблюдалось устойчивое направление эффекта в пользу хлонизола, менялась лишь величина размера этого эффекта (HR и границы его 95%-го доверительного интервала, 95% CI). Значимой гетерогенности между исследованиями не наблюдалось Tau2=0,03; Chi2=6,52; df=6; P=0,33; I2=8%.
Авторы также предприняли попытку поиска источников гетерогенности включенных исследований. Эту попытку не следует расценивать как слепое «прочесывание» данных (data dredging), а лишь как демонстрацию возможности подгруппового анализа результатов ДКИ на конкретном примере. Для поиска возможного источника гетерогенности между исследованиями был выполнен post-hoc-анализ в зависимости от пола животных. В проведенном подгрупповом анализе была обнаружена статистически значимая гетерогенность между исследованиями на самцах и самках (Chi2=2,81, df=1; P=0,09), индекс гетерогенности I2 составил 64% (см. рис. 4). Необходимо отметить, что мощность χ2‑теста может быть низкой из‑за малого количества исследований на самках. Следует также учитывать, что проведенное подгрупповое сравнение самцов и самок не было запланировано изначально, а его результаты следует интерпретировать крайне осторожно. Тем не менее эти сведения могут быть использованы для генерации гипотезы о том, что у самок хлонизол может обладать более выраженной противоопухолевой активностью.
Заключение
Впервые на примере оригинального отечественного цитостатика представлены результаты статистического синтеза данных отдельных ДКИ для получения обобщенной оценки эффективности этого соединения у животных на модели конкретной экспериментальной онкологической патологии. Проведенный анализ доступных ДКИ показал, что хлонизол, вводимый в МПД 20 мг/кг, обеспечивает значимые преимущества в ОВ лабораторных грызунов с трансплантированными интракраниально опухолями по сравнению с ломустином и темозоломидом. Полученные результаты могут служить обоснованием для дальнейшего изучения хлонизола в качестве средства химиотерапии первичных и метастатических опухолей центральной нервной системы.
Ограничения
Проведенное исследование имеет ряд ограничений, многие из которых связаны с дизайном и представленным объемом данных ДКИ, на которые авторы опирались при анализе.
Вклад авторов
Я.Г. Муразов — концепция и дизайн, сбор и статистический анализ данных, написание текста статьи.
А.Н. Стуков — сбор и систематизация материала, редактирование рукописи.
Ю.Г. Змитриченко — сбор и систематизация материала.
Г.В. Точильников — редактирование рукописи.
Список источников
- Bates A., Gonzalez-Viana E., Cruickshank G., Roques T. Primary and metastatic brain tumours in adults: summary of NICE guidance // BMJ. 2018. Vol. 362. P. k2924. https://doi.org/10.1136/bmj.k2924.
- Jones D.T.W., Banito A, Grünewald T.GP. et al. Molecular characteristics and therapeutic vulnerabilities across paediatric solid tumours // Nat. Rev. Cancer. 2019. Vol. 19. P. 420–438. https://doi.org/10.1038/s41568‑019‑0169‑x.
- Vargo M.M. Brain Tumors and Metastases // Phys Med Rehabil Clin N Am. 2017. Vol. 28. P. 115–141. https://doi.org/10.1016/j.pmr.2016.08.005.
- Ostrom Q.T, Wright C.H, Barnholtz-Sloan J.S. Brain metastases: epidemiology // Handb. Clin. Neurol. 2018. Vol. 149. P. 27–42. https://doi.org/10.1016/B978‑0‑12‑811161‑1.00002-5.
- Stukov A.N., Esikov K.A., Usmanova L.M. et al. Synthesis and Antitumor Activity of 2-[3-(2‑Chloroethyl)-3‑Nitrosoureido]-1,3‑Propanediol (Chlonisol) // Pharm. Chem. J. 2020. Vol. 54. P. 579–581. https://doi.org/10.1007/s11094‑020‑02242‑7.
- Ioannidis J.P.A., Schmid C.H., Lau J. META-ANALYSIS IN HEMATOLOGY AND ONCOLOGY // Hematol. Oncol. Clin. North Am. 2000. Vol. 14. P. 973–991. https://doi.org/10.1016/S0889-8588(05)70322-1.
- Vesterinen H.M., Sena E.S., Egan K.J. et al. Meta-analysis of data from animal studies: A practical guide // J. Neurosci. Methods. 2014. Vol. 221. P. 92–102. https://doi.org/10.1016/j.jneumeth.2013.09.010.
- Hooijmans C.R., IntHout J., Ritskes-Hoitinga M., Rovers M.M. Meta-Analyses of Animal Studies: An Introduction of a Valuable Instrument to Further Improve Healthcare // ILAR J. 2014. Vol. 55. P. 418–426. https://doi.org/10.1093/ilar/ilu042.
- Муразов Я.Г., Стуков А.Н., Змитриченко Ю.Г. и др. Оценка противоопухолевой активности 2-[3-(2‑хлорэтил)-3‑нитрозоуреидо]-1,3‑пропандиола (хлонизола) у мышей C57BL/6 с трансплантированной интракраниально меланомой B16 // Фармакокинетика и Фармакодинамика. 2021. Т. 1. С. 23–29. https://doi.org/10.37489/2587‑7836‑2021‑1‑23‑29 [Murazov I.G., Stukov A.N., Zmitrichenko I.G. et al. Evaluation of the antitumor activity of 2-[3-(2‑chloroethyl)-3‑nitrosoureido]-1,3‑propanediol (chlonisol) in C57BL/6 mice with intracranially transplanted B16 melanoma // Pharmacokinetics and Pharmacodynamics. 2021. Vol. 1. P. 23–29. (In Russ.)].
- Hooijmans C.R., Rovers M.M., de Vries R.B. et al. SYRCLE’s risk of bias tool for animal studies // BMC Med. Res. Methodol. 2014. Vol. 14. P. 43. https://doi.org/10.1186/1471‑2288‑14‑43.
- Jain K. K. A Critical Overview of Targeted Therapies for Glioblastoma // Front. Oncol. 2018. P. 8.
- Hotchkiss K. M., Sampson J. H. Temozolomide treatment outcomes and immunotherapy efficacy in brain tumor // J. Neurooncol. 2021. Vol. 151. P. 55–62. https://doi.org/10.1007/s11060‑020‑03598‑2.
- Zhu W., Zhou L., Qian J-Q. et al. Temozolomide for treatment of brain metastases: A review of 21 clinical trials // World J. Clin. Oncol. 2014. Vol. 5. P. 19–27. https://doi.org/10.5306/wjco.v5.i1.19.
- Weller M., Le Rhun E. How did lomustine become standard of care in recurrent glioblastoma? // Cancer Treat. Rev. 2020. Vol. 87. P. 102029. https://doi.org/10.1016/j.ctrv.2020.102029.
- Островская Л. А., Филов В. А., Ивин Б. А. и др. Хлонизол — Новый Эффективный Противоопухолевый Препарат Класса Нитрозоалкилмочевин // Российский Биотерапевтический Журнал. 2004. Т. 3 [Ostrovskaya L. A., Filov V. A., Ivin B. A. et al. Chlonizol — the new alkylnitrosourea drug with antitumor activity // Russian biotherapeutic journal. 2004. Vol. 3. P. 37–48 (In Russ.)].
- Munoz-Muriedas J. Large scale meta-analysis of preclinical toxicity data for target characterisation and hypotheses generation // PLOS ONE. 2021. Vol. 16. P. e0252533. https://doi.org/10.1371/journal.pone.0252533.




