Диет-индуцированные модели метаболических нарушений. Сообщение 4: экспериментальная неалкогольная жировая болезнь печени
Макарова М.Н., Макаров В.Г. Диет-индуцированные модели метаболических нарушений. Сообщение 4: экспериментальная неалкогольная жировая болезнь печени. Лабораторные животные для научных исследований. 2018; 4. https://doi.org/10.29296/2618723X-2018-04-04
Резюме
Резюме. Неалкогольная жировая болезнь печени относится к наиболее часто диагностируемым хроническим заболеваниям печени, в этиологии которых особую роль играет увеличение доли сахарозы, фруктозы и жира в структуре рациона питания населения. Неалкогольная жировая болезнь печени опасна как осложнениями со стороны печени (цирроз, рак печени и др.), так и влиянием на развитие сердечно-сосудистых заболеваний. Поэтому именно диет-индуцированные модели целесообразно использовать в экспериментах на животных с целью оценки эффективности методов и средств профилактики и лечения неалкогольной жировой болезни печени. Для моделирования неалкогольной жировой болезни печени наиболее часто используются грызуны (мыши, крысы, реже – морские свинки и хомяки), предпочтительнее самцы, у которых быстрее, чем у самок, развиваются нарушения в печени. Из крупных животных (например, мини-свиней) рекомендуется использовать линии с быстрым развитием неалкогольной жировой болезни печени, в частности, миниатюрных свиней Lee-Sung. Наиболее эффективными по скорости развития и интенсивности патологических изменений в печени являются модели с использованием метионин- и холин-дефицитного рациона, однако наиболее адекватными патогенезу развития неалкогольной жировой болезни печени человека признаны модели с высоким содержанием жира и углеводов типа западного и/или фаст-фудного рационов питания человека. Поэтому перспективным представляется использование рационов с высоким содержанием жира и углеводов на фоне дефицита метионина и холина. Для оценки развития неалкогольной жировой болезни печени и эффективности исследуемых лечебно-профилактических мероприятий у животных анализируют показатели состояния печени: АЛТ, АСТ, триглицериды и масса печени, гистология и гистохимия печеночной ткани и др.). Кроме того, широко применяют маркеры воспаления (ИЛ6, ФНОα, СРБ), исследование содержания альбумина, триглицеридов и холестерина сыворотки крови, глюкозы и инсулина натощак, инсулинорезистентности и др.
Введение
Рост распространенности неалкогольной жировой болезни печени (НАЖБП) тесно связан с увеличением заболеваемости ожирением и сахарным диабетом 2 типа [1]. Причем в индустриально развитых странах НАЖБП относится к наиболее часто диагностируемым хроническим заболеваниям печени [2, 3]. Особую роль при этом, как отмечают исследователи во всем мире, играет увеличение доли рафинированных углеводов (сахарозы и фруктозы) и жира в структуре рациона питания населения (питание западного типа и/или фаст-фуд) [4]. Следует отметить, что НАЖБП опасна не только своими осложнениями со стороны печени (цирроз, рак печени и др.), но и тем, что она способствует росту сердечно-сосудистой патологии [1]. Это обусловливает актуальность поиска средств лечения данной патологии, необходимость создания и использования адекватных экспериментальных моделей на животных и критериев их оценки.
Характеристика неалкогольной жировой болезни печени
НАЖБП – гетерогенная группа патологических изменений печени, характеризующихся воспалительной инфильтрацией на фоне жировой дистрофии гепатоцитов у лиц, не употребляющих алкоголь в гепатотоксических дозах [1, 5]. НАЖБП является одним из проявлений метаболического синдрома и тесно связана с такими нарушениями, как ожирение, инсулинорезистентность (ИР), гипергликемия, сахарный диабет (СД) 2-го типа, дислипидемия, изменение профиля адипокинов и др. [5, 6]. Распространенность НАЖБП во всем мире продолжает расти параллельно с ростом эпидемии ожирения и ИР. В настоящее время НАЖБП – наиболее частая причина хронических заболеваний печени [2, 7], прогрессирующих от простого стеатоза печени до неалкогольного стеатогепатита (НАСГ), а в более тяжелых случаях – до неалкогольного стеатофиброза (НАСФ) и цирроза, а также рака печени (гепатоцеллюлярной карциномы).
НАЖБП относят к группе болезней печени, обусловленных нарушениями питания и обмена веществ. При этом содержание жира в печени составляет более 5% от ее массы [2, 8]. В основе патогенеза НАЖБП лежит ИР, приводящая к ожирению. При этом увеличивается поступление в печень свободных жирных кислот (СЖК) и формируется стеатоз печени [5], который, при отсутствии воспаления и повреждения клеток печени, не переходит в следующие стадии поражения печени [1], имея доброкачественное течение. Если же под влиянием СЖК развивается оксидативный стресс, сопровождающийся активацией провоспалительных цитокинов (в первую очередь, фактора некроза опухоли – ФНОα) и повреждением гепатоцитов [1, 5], то развивается НАСГ, а при отсутствии лечения переходит в последующие стадии НАЖБП – НАСФ, цирроз и др. В этиологии НАЖБП большое значение имеет избыточное питание и недостаточная физическая активность, меньшее – прием некоторых препаратов (нестероидных противовоспалительных, гормональных и др.), дисбактериоз тонкого кишечника и пр. [1, 5].
Виды животных и рационы питания, используемые для индукции неалкогольной жировой болезни печени
Наиболее часто для моделирования НАЖБП используются грызуны, в особенности мыши [9–13] и крысы [13, 14], реже – морские свинки и хомяки [15, 16]. Это связано с выраженной генетической предрасположенностью мышей линии C57BL/6 и крыс линий Wistar и Sprague Dawley к НАЖБП. Причем самцы грызунов, в частности мышей, более чувствительны к нарушениям питания и у них легче и быстрее развивается НАЖБП (в точности, как и у мужчин, в сравнении с женщинами) [1]. Среди крупных животных исследователи отдают предпочтение мини-свиньям [4, 17], кролики используются реже [18].
Идеальная модель животного для НАЖБП должна отражать все аспекты сложного этиопатогенеза НАЖБП человека и типичную гистологическую картину ткани печени на различных этапах заболевания [14]. Однако разные модели способны воспроизводить только отдельные параметры и этапы развития НАЖБП человека. Как указывают J.T. Haas et al. [1], О. Kucera, Z. Cervinkova [14], высокожировая модель, широко используемая для индукции ожирения и сахарного диабета, редко применяется для моделирования НАЖБП в связи с тем, что на ней медленно развиваются такие важные характеристики, как воспаление клеток печени, фиброз и многие другие. Так, например, J.K. Lau et al. [6] приводят данные о том, что только высокожировой рацион вообще не вызывает в печени изменений, свойственных НАБЖП, у мышей линии C57BL/6. В то же время A. Nakamura, Y. Terauchi [8] наблюдали у мышей и НАБЖП, и даже опухоли печени при очень длительном (60 нед) введении высокожирового рациона питания.
Вместе с тем, если наиболее часто используемый для моделирования НАЖБП у грызунов рацион с дефицитом метионина и холина вызывает стеатоз, воспаление и фиброз клеток печени на фоне существенной потери веса, то высокожировой рацион с высоким содержанием сахарозы и холестерином способствует подобным изменениям, но уже на фоне ожирения [1, 6], что ближе к этиологии и патогенезу НАЖБП человека. Поэтому рекомендуется для индукции НАЖБП применять высокожировые рационы с сахарозой и холестерином и исключением из них метионина и холина [10]. Следует отметить, что при рационе с выраженным дефицитом метионина и холина уже на 2-й неделе развивается стеатоз печени, наблюдается рост аланин- и аспартаттрансаминаз, к которым на 3-й неделе присоединяется воспаление и некроз клеток с последующим развитием фиброза печени [1, 4, 13].
Для моделирования НАЖБП у мышей наиболее часто используют рационы питания с выраженным дефицитом метионина и холина, в том числе на фоне высокого содержания жиров и углеводов (в основном фруктозы), а также рационы питания типа западного и фаст-фуда [9–12]. Причем как показали исследователи из клиники Майо (Рочестер, Миннесота) [11, 12], наиболее выраженные изменения, характерные для НАЖБП, развиваются на фоне рациона питания с высоким содержанием и жира (40% от энергоценности), и углеводов (47%), в то время как только высокожировой рацион (60% энергоценности за счет жира и 25–29% – углеводов) не вызывал развития НАЖБП. В частности, если на фаст-фудном рационе (ФФР) изменения, характерные для воспаления и цирроза печени, к концу 25-й недели были довольно выраженными, то на высокожировом – они практически отсутствовали [11].
При моделировании НАЖБП на мышах следует также учитывать линии используемых животных. Так, например, N. Pejnovic et al. [18] показали, что наиболее часто применяемые линии мышей C57BL/6 и BALB/c по-разному реагируют на одинаковые гиперкалорийные рационы питания: мыши C57BL/6 больше склонны к развитию висцерального ожирения, гликемии, воспалению и фиброзу печени, в то время как у мышей BALB/c развивается преимущественно стеатоз печени. Длительное кормление метионин-дефицитным рационом приводило к более выраженному повреждению печени у мышей DBA/2J, чем у мышей линии C57BL/6, при этом у последних не развивался рак печени, в отличие от мышей линии DBA/2J [6].
Как указывают O. Kucera и Z. Cervinkova [14], на основании анализа большого числа исследований, для индукции НАЖБП у крыс, так же как и у мышей, используются различные пищевые модели: высокожировая, атерогенная, высокофруктозная и высокосахарозная, высокофруктозная и высокожировая, метионин и холин-дефицитная, диета кафетерия, холин-дефицитная. При этом наибольшее число патогенетических нарушений, свойственных НАЖБП, отмечено на атерогенных рационах питания, на рационах с дефицитом метионина и холина, рационах с высоким содержанием фруктозы и жира и некоторых других [14]. Менее выраженный эффект был на рационах с высоким содержанием только фруктозы и/или сахарозы, а также с дефицитом только холина. Из атерогенных рационов питания наиболее эффективными в развитии стеатогепатита были рационы с высоким содержание жира (230 г/кг рациона), сахарозы (430 г/кг рациона) и холестерина (1,9 г/кг рациона) [6]. Рацион питания, дефицитный по метионину и холину, наряду со стеатозом и фиброзом печени, повышает содержание триглицеридов в печени, а также активность трансаминаз и щелочной фосфатазы сыворотки крови у крыс, резко снижая при этом массу тела и печени [19].
Для индуцирования НАЖБП у мини-свиней используется стандартный рацион (53% от веса корма) + Лярд (10%) + сахароза (37%) [17], у миниатюрных свиней Lee-Sung – западный рацион (35,3% углеводы, 45,7% жиры и 18,3% белки, энергетическая плотность – 3,8 ккал/кг) [20], у кроликов – стандартный рацион с добавлением 10% Лярда и 2% холестерина [21] или только 1% холестерина [22]. Длительность наблюдения составляет около 2 лет для мини-свиней, 5 мес – у миниатюрных свиней Lee-Sung и около 12–13 нед для кроликов [17, 21, 22].
Показатели для оценки неалкогольной жировой болезни печени у разных видов животных
Для оценки развития неалкогольной жировой болезни печени в условиях эксперимента в первую очередь используются показатели состояния печени: аланин- (АЛТ) и аспартат-трансаминазы (АСТ) печени, триглицериды и масса печени, гистология и гистохимия печеночной ткани и др.) [9, 10]. Кроме того, определяют маркеры воспаления: интерлейкин-6 (ИЛ-6), фактор некроза опухолей-α (ФНО-α) в плазме крови и гомогенате ткани печени [9]; а также содержание альбумина, триглицеридов и фракций холестерина сыворотки крови, глюкозы натощак и инсулинорезистентность, гиалуроновую кислоту, гаптоглобин и др. [1]. Доказано существенное влияние на развитие НАЖБП холестерина липопротеидов низкой плотности, рост которых приводит к развитию воспаления, НАСГ и фиброза печени [16]. Как указывают S.J. Li et al. [20], одним из наиболее адекватных маркеров НАЖБП у свиней является ИЛ-6. В таблице приводятся показатели, характерные для различных животных, используемых в диет-индуцированных моделях НАЖБП.
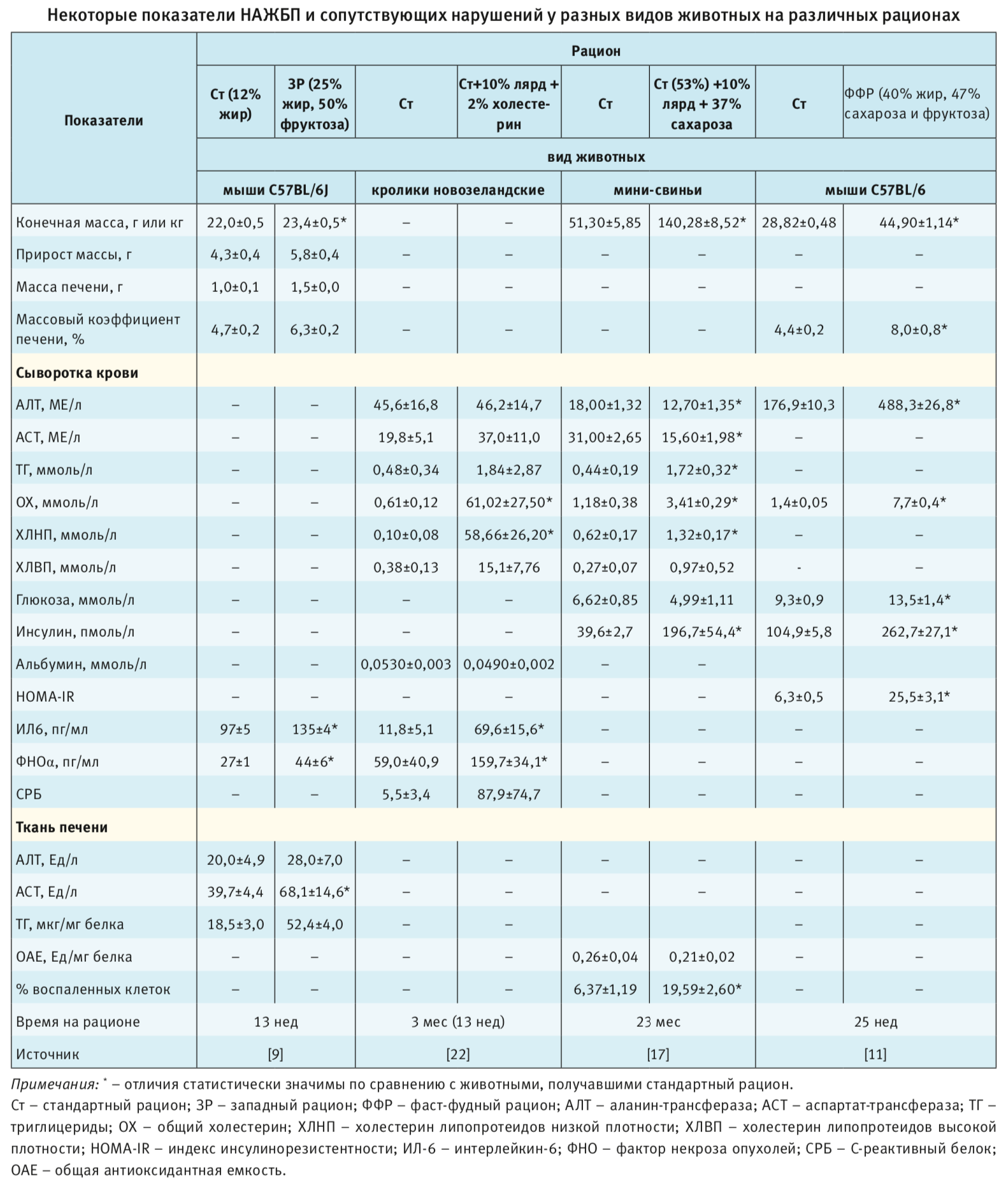
Следует отметить, что трансаминазы сыворотки крови, в частности у кроликов и мини-свиней, существенно
не изменяются при индукции НАЖБП, а АСТ у мини-свиней даже снижается после 2 лет эксперимента (см.
таблицу). Хотя при этом у кроликов в 16 раз повышается С-реактивный белок, а у мини-свиней
в 3 раза увеличивается число воспаленных клеток в ткани печени. Однако у мышей на ФФР отмечен
рост уровня АЛТ сыворотки крови почти в 3 раза, а у мышей на западном рационе – увеличение
содержания обеих трансаминаз в ткани печени. Важным представляется рост маркеров воспаления (ИЛ6
и ФНОα) в сыворотке крови мышей, получавших ФФР, а также у кроликов на рационе,
обогащенном свиным жиром и холестерином (см. таблицу). Практически на всех рационах у разных видов
животных отмечается рост содержания триглицеридов и общего холестерина,
а у мини-
свиней – на высокожировом рационе, обогащенном сахарозой, и у мышей на
ФФР достоверно растет концентрация инсулина сыворотки крови (см. таблицу).
Интересны также данные об изменении спектра жирных кислот в ткани печени на фоне рациона с повышенным содержанием жира и сахарозы у мини-свиней; наблюдалось существенное увеличение насыщенных жирных кислот (миристиновой, пальмитиновой, стеариновой и др.), а также олеиновой и арахидоновой, в то время как содержание линолевой кислоты было почти в 2 раза меньше, чем у животных на контрольном рационе [17]. Использование западного рациона у 4-месячных миниатюрных свиней Lee-Sung уже в течение 5 мес способствовало развитию у них НАСГ, близкого по характеристикам к НАСГ человека, с нарушением чувствительности к инсулину, толерантности к глюкозе и ростом СЖК, ИЛ6 и ФНОα; при этом инфильтрация клеток печени макрофагами у них возрастала почти в 3 раза (29,72±7,03 клеток/мм2) в сравнении с показателями у животных на контрольном рационе питания (10,47±2,48 клеток/мм2); отмечался также фиброз печени [20].
Заключение
Для моделирования НАЖБП современные исследователи наиболее часто используют грызунов, преимущественно мышей и крыс, в основном аутбредных линий, реже – морских свинок и хомяков. В моделях на грызунах предпочитают использовать самцов, у которых быстрее, чем у самок, развиваются нарушения в печени. Из крупных животных применяют мини-свиней Ossabaw, миниатюрных свиней Lee-Sung и др., а также кроликов. Мини-свиней Ossabaw и многих других линий используют ограниченно из-за необходимости длительных сроков исследования и дороговизны в обслуживании. Однако у некоторых мини-свиней, в частности миниатюрных свиней Lee-Sung, сроки развития НАЖБП близки к таковым у грызунов, т.е. их целесообразно использовать для моделирования болезни.
Наиболее эффективными по скорости развития и интенсивности патологических изменений в печени среди диет-индуцированных моделей НАЖБП являются модели с использованием метионин- и холин-дефицитного рациона, однако наиболее адекватными патогенезу развития НАЖБП человека признаны модели с высоким содержанием жира и углеводов типа западного и/или фаст-фудного рационов питания человека. Перспективно использование моделей, сочетающих в себе высокую скорость развития патологии печени с близостью патогенеза изменений к таковому у человека: рационы с высоким содержанием жира и углеводов на фоне дефицита метионина и холина.
Для оценки не только развития НАЖБП, но и эффективности исследуемых лечебно-профилактических мероприятий у животных следует в первую очередь использовать показатели состояния печени: АЛТ, АСТ, триглицериды и масса печени, гистология и гистохимия печеночной ткани и др. Кроме того, большинство исследователей широко применяют маркеры воспаления (ИЛ6, ФНОα, СРБ) сыворотки крови и гомогената печени, исследование содержания альбумина, триглицеридов и холестерина сыворотки крови, глюкозы и инсулина натощак, инсулинорезистентности и многие другие показатели, хорошо зарекомендовавшие себя для решения указанных задач.
Список источников
- Haas J.T., Francque S., Staels B. Pathophysiology and Mechanisms of Nonalcoholic Fatty Liver Disease. Annu. Rev. Physiol. 2016. 78:18.1–18.25. doi: 10.1146/annurev-physiol-021115-105331.
- Буторова Л.И. Неалкогольная жировая болезнь печени как проявление метаболического синдрома: эпидемиология, патогенез, особенности клинического проявления, принципы диагностики, современные возможности лечения. Пособие для врачей. М.; 2012: 58.
- Liang D., Chen H., Zhao L., Zhang W., Hu J., Liu Z., Zhong P., Wang W., Wang J., Liang G. Inhibition of EGFR attenuates fibrosis and stellate cell activation in diet-induced model of nonalcoholic fatty liver disease. Biochim. Biophys. Acta. 2018 Jan; 1864 (1): 133–42. DOI: 10.1016/j.bbadis.2017.10.016.
- Kanuri G., Bergheim I. In Vitro and in Vivo Models of Non-Alcoholic Fatty Liver Disease (NAFLD). Int. J. Mol. Sci. 2013, 14, 11963–80; DOI:10.3390/ijms140611963.
- Буеверов А.О. Неалкогольный стеатогепатит. Гастроэнтерология: национальное руководство. Под ред. В.Т. Ивашкина, Т.Л. Лапиной. М.: ГЭОТАР-Медиа, 2008: 626–31.
- Lau J.K., Zhang X., Yu J. Animal models of non-alcoholic fatty liver disease: current perspectives and recent advances. J. Pathol., 2017; 241 (1): 36–44. DOI: 10.1002/path.4829.
- Wree A, Broderick L, Canbay A, Hoffman H.M., Feldstein A.E. From NAFLD to NASH to cirrhosis – new insights into disease mechanisms. Nat. Rev. Gastroenterol. Hepatol., 2013; 10 (11): 627–36. DOI: 10.1038/nrgastro.2013.149.
- Nakamura A., Terauchi Y. Lessons from Mouse Models of High-Fat Diet-Induced NAFLD. Int. J. Mol. Sci. 2013, 14: 21240–57; DOI:10.3390/ijms141121240.
- Sellmann C., Baumann A., Brandt A., Jin C.J., Nier A., Bergheim I. Oral Supplementation of Glutamine Attenuates the Progression of Nonalcoholic Steatohepatitis in C57BL/6J Mice. J. Nutr. 2017 Nov; 147 (11): 2041–9. DOI: 10.3945/jn.117.253815.
- Kammoun H.L., Allen T.L., Henstridge D.C., Kraakman M.J., Peijs L., Rose-John S., Febbraio M.A. Over-expressing the soluble gp130-Fc does not ameliorate methionine and choline deficient diet-induced non alcoholic steatohepatitis in mice. PLoS One. 2017 Jun 20; 12 (6): e0179099. DOI: 10.1371/journal.pone.0179099.
- Charlton M., Krishnan A., Viker K. et al. Fast food diet mouse: novel small animal model of NASH with ballooning, progressive fibrosis, and high physiological fidelity to the human condition. Am. J. Physiol. Gastrointest. Liver Physiol. 2011 Nov; 301 (5): 825–34. DOI: 10.1152/ajpgi.00145.2011.
- Krishnan A., Abdullah T.S., Mounajjed T. et аl. Longitudinal Study of Whole Body, Tissue and Cellular Physiology in a Mouse Model of Fibrosing NASH with High Fidelity to the Human Condition. Am. J. Physiol. Gastrointest. Liver Physiol. 2017 Jun 1; 312 (6): 666–80. DOI: 10.1152/ajpgi.00213.2016.
- Van Herck M.A., Vonghia L., Francque S.M. Animal Models of Nonalcoholic Fatty Liver Disease—A Starter’s Guide. Nutrients. 2017 Sep 27; 9 (10). pii: E1072. DOI: 10.3390/nu9101072.
- Kucera O., Cervinkova Z. Experimental models of non-alcoholic fatty liver disease in rats. World J. Gastroenterol., 2014 Jul 14; 20 (26): 8364–76. DOI: 10.3748/wjg.v20.i26.8364.
- Cheah I.K., Tang R., Ye P. et al. Liver ergothioneine accumulation in a guinea pig model of nonalcoholic fatty liver disease. A possible mechanism of defence? Free Radic. Res., 2016; 50 (1): 14–25. DOI: 10.3109/10715762.2015.1099642.
- Lai Y.S., Yang T.C., Chang P.Y. et al. Electronegative LDL is linked to high-fat, high-cholesterol diet-induced nonalcoholic steatohepatitis in hamsters. J. Nutr. Biochem. 2016 Apr; 30: 44–52. DOI: 10.1016/j.jnutbio.2015.11.019.
- Yang, S.L., Xia J.H., Zhang Y.Y. et al. Hyperinsulinemia shifted energy supply from glucose to ketone bodies in early nonalcoholic steatohepatitis from high-fat high-sucrose diet induced Bama minipigs. Sci. Rep. 5, 13980 (2015). DOI: 10.1038/srep13980.
- Pejnovic N., Jeftic I., Jovicic N. et al. Galectin-3 and IL-33/ST2 axis roles and interplay in diet-induced steatohepatitis. World J. Gastroenterol., 2016; 22(44): 9706–17. DOI: 10.3748/wjg.v22.i44.9706.
- Panchal S.K., Brown L. Rodent Models for Metabolic Syndrome Research / J. Biomed. Biotechnol. Volume 2011, Article ID 351982, 14 pages. DOI:10.1155/2011/351982.
- Li S.J., Ding S.T., Mersmann H.J. et al. A nutritional nonalcoholic steatohepatitis minipig model. J. Nutr. Biochem. 2016 Feb; 28: 51–60. DOI: 10.1016/j.jnutbio.2015.09.029.
- Xie Y., Zhang H., Jin C. et al. Gd-OB-DTPA-enhanced T1ρ imaging vs diffusion metrics for assessment liver inflammation and early stage fibrosis of nonalcoholic steatohepatitis in rabbits. Magn. Reson. Imaging, 2018 May; 48: 34–41. DOI: 10.1016/j.mri.2017.12.017.
- Kim E.J., Kim B.H., Seo H.S., Lee Y.J., Kim H.H., Son H.H., Choi M.H. Cholesterol-induced non-alcoholic fatty liver disease and atherosclerosis aggravated by systemic inflammation. PLoS One. 2014 Jun 5; 9 (6): e97841. DOI: 10.1371/journal.pone.0097841.




