Моделирование травматических повреждений роговицы глаза
Ивкина А.С., Ивкин Д.Ю., Семивеличенко Е.Д. Плиско Г.А., Буренков П.В. Моделирование травматических повреждений роговицы глаза. Лабораторные животные для научных исследований. 2018; 2. https://doi.org/10.29296/2618723X-2018-02-04
Резюме
На базе Центра экспериментальной фармакологии СПХФУ на кроликах-самцах породы советская шиншилла как наиболее доступной и релевантной тест-системе проведено моделирование травматической эрозии (ТЭ) по методу С. Hanna, J.Е. O’Brien (1960) и кислотного ожога роговицы глаза с последующей гистологической оценкой патологического процесса. Для получения статистически достоверных результатов животных было достаточно. Описаны условия содержания животных и воспроизведение моделей, предложена балльная оценка выраженности травматического повреждения, в которой учитывались наличие или отсутствие патологических изменений, наличие и выраженность текущего экссудативного воспаления с последующей патологической васкуляризацией роговицы, наличие и распространенность фибропластических изменений роговицы как проявлений обратного развития патологического процесса и организации в его исходе. Состоятельность моделей подтверждена гистологически, выраженность повреждений преобладает при моделировании ТЭ; в дальнейшем интерес может представлять оценка состояния роговицы не только на 29-й день после моделирования патологии, но также на 8-й, 15-й, 22-й дни. Эксперимент позволяет исследовать развитие патологического процесса в динамике, что чрезвычайно актуально при исследовании глазных форм лекарственных препаратов с регенерирующим, антигипоксантным и антиоксидантным эффектами.
Введение
Экспериментальные модели повреждений роговицы глаза чрезвычайно актуальны для исследования глазных форм лекарственных препаратов с регенерирующим, антигипоксантным и антиоксидантным эффектами. Проведено моделирование травматической эрозии (ТЭ) и кислотного ожога (КО) роговицы глаза кролика с гистологическим исследованием на 29-й день.
Цель исследования – отработка травматических моделей офтальмопатологии и гистологическая оценка патологического процесса.
Материалы и методы
В качестве тест-системы были выбраны лабораторные кролики-самцы породы советская шиншилла (n=12). Число животных для исследования было достаточным для получения статистически достоверных результатов, но минимальным с точки зрения биоэтических принципов. Лабораторные кролики являются стандартной тест-системой в опытах по изучению специфической активности глазных капель [1]. Имеющиеся научные данные и утвержденные рекомендации не предоставляют приемлемых in vitro альтернатив к использованию лабораторных животных в качестве тест-системы в настоящем исследовании. Результаты эксперимента на полноценном живом организме наиболее правильно и полно отражают всю динамику взаимодействий различных типов клеток, тканей и органов в организме человека [2, 3].
Животные содержались в стандартных условиях в соответствии с санитарно-эпидемиологическими требованиями к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев) (утв. Постановлением Главного государственного санитарного врача РФ №51 от 29 августа 2014 г.), Методическими указаниями по содержанию и использованию лабораторных животных (Guide for the care and use of laboratory animals. National Academy press. – Washington, D.C., 1996) и Директивой 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях, а также Правилами, утвержденными Приказом Минздрава России от № 199н 01 апреля 2016 г. «Об утверждении правил надлежащей лабораторной практики».
Животные в период карантина и эксперимента содержались по 1 особи в металлических клетках для кроликов типа Europa BIOSCAPE с пластиковым поддоном (ZOONLAB, Германия) (размер клетки 73×73×52 см). Условия содержания соответствовали требованиям Директивы 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22 сентября 2010 г. по охране животных (площадь пола клетки ≥4200 см2, высота ≥45 см для кроликов массой от 3 до 5 кг). Клетки были оборудованы кормушками из нержавеющей стали, пластиковыми поилками и держателями этикеток. Подстил не использовался.
Животные содержались в контролируемых условиях окружающей среды при температуре 17–23°C и относительной влажности 30–70%. В комнатах содержания животных поддерживался 12-часовой цикл освещения и по крайней мере 10-кратная смена объема воздуха комнаты в час. Температура и влажность постоянно контролировались с помощью термогигрометров Testo 608-h1 (Китай).
Животные получали стандартный гранулированный корм «Полнорационный комбикорм для лабораторных кроликов и морских свинок» К-122, производства ООО «Лабораторкорм», Россия ad libitum в кормушку клетки. Животным давалась вода, соответствующая ГОСТ Р 51232-98 Вода питьевая, приготовленная методом фильтрации водопроводной воды через систему фильтров Аквафор. Питьевая вода давалась ad libitum в стандартных питьевых бутылочках с полной заменой воды 3 раза в неделю.
Период карантинирования животных составил 14 дней до начала эксперимента. Во время этого периода осуществлялся ежедневный ветеринарный осмотр и визуальный контроль потребления корма и воды. Животных с отклонениями в период карантина не зарегистрировано. Перед началом исследования все животные, прошедшие карантин, были включены в эксперимент и распределены на группы, которые формировали случайным образом, отклонение массы тела животных от среднего значения допускалось не более чем на 10%. В период карантина животные размещались в клетках, которые были идентифицированы карточкой, содержащей следующую информацию: пол и число животных, дата получения, возраст/масса тела при получении, назначение. После карантина каждому отобранному для исследования животному был присвоен индивидуальный идентификационный номер. Нумерация была сквозной – от 1-го до 12-го номера. Идентификационный номер был нанесен специальным нетоксичным маркером на внутреннюю поверхность уха животного. Каждая клетка была идентифицирована карточкой, содержащей следующую информацию: название исследования, номер исследуемой группы, а также индивидуальный номер животного.
Процедуры с животными были рассмотрены и утверждены биоэтической комиссией СПХФУ Минздрава России (Протокол № Rabbits-1/2-17 от 07.11.2017).
Внешний вид животных оценивали ежедневно во время ветеринарного осмотра в период карантина и проведения эксперимента. Клинический осмотр каждого животного на открытой площадке с обязательным офтальмологическим осмотром проводился при формировании групп, еженедельно в последующем на 8 и 15, 22 и 29-й дни.
Ежедневно проводили осмотр подопытных животных в клетках содержания, с целью выявления смерти или признаков отклонения в их состоянии здоровья.
Массу тела регистрировали при формировании групп, непосредственно перед первым введением, и еженедельно – в ходе исследования.
Моделировали патологию глаз – ТЭ и КО. При формировании ТЭ применяли метод С. Hanna, J.Е. O’Brien (1960) [1], согласно которому под местной анестезией (закапывание раствора 0,4% инокаина) на роговицу наносили метку 0,1% раствором флюоресцеина натрия. В пределах метки лезвием соскабливали эпителий роговицы. Дефект эпителия повторно окрашивали раствором флюоресцеина для того чтобы отчетливее визуализировались форма и размер ТЭ роговицы. КО в эксперименте формировали под местной анестезией (0,4% инокаином) аппликацией фильтровальной бумаги (в виде круга диаметром 8 мм), смоченной 3% раствором уксусной кислоты с экспозицией 5 с на роговицу [1].
Из 12 животных были сформированы 3 группы животных по 4 особи в каждой: 1-я – интактная с животными без индукции патологии; 2-я и 3-я группы состояли из животных, подвергшихся моделированию патологии (соответственно ТЭ и КО) без лечения.
На 29-й день эксперимента животные подвергались эвтаназии путем наркотизации углекислым газом в CO2-боксе с последующим извлечением глазных яблок, которые фиксировали в 10% нейтральном формалине.
Выполнялось гистологическое исследование структур передних отделов глазных яблок всех животных. После стандартной гистологической проводки и имбибиции парафином с помощью ротационного микротома были изготовлены срезы ткани толщиной 4 мкм, помещенные на предметные стекла, окрашенные гематоксилином и эозином и заключенные под покровные стекла. Гистологические препараты изучались в проходящем свете.
Результаты и обсуждение
Все животные переносили моделирование удовлетворительно: процедура не сопровождалась какими-либо негативными явлениями.
Внешний вид животных. По результатам проведенного клинического осмотра в период эксперимента изменений в поведении, общем состоянии и состоянии нервной системы у животных не выявлено. После индукции патологии (как КО, так и ТЭ) поведение животных не изменялось. У всех подопытных животных нос был умеренно влажный, патологические выделения отсутствовали. Уши – бледно-розовые, обычной температуры, нагноений, воспаления, загрязнений за весь период наблюдения ни у одного не отмечено. Зубы у всех сохранены. Дыхание в целом было нормальным у всех экспериментальных животных, признаков одышки не отмечалось.
Шерсть у всех животных – опрятная, блестящая, без очагов облысения. Тонус мускулатуры у всех животных был нормальным. Видимые слизистые оболочки бледно-розовой окраски, блестящие. Деформации или отека конечностей нет. Кожа без признаков раздражения или воспаления. Половые органы самцов правильно выражены.
Все животные нормального телосложения, удовлетворительного питания. У 100% кроликов всех групп двигательная активность была в норме. В целом поведение было стандартным. Кровотечений у животных не наблюдали.
Согласно офтальмологическому осмотру, на этапе формирования групп роговица глаз у всех кроликов находилась в состоянии нормы. На следующий день после моделирования патологии у групп кроликов с КО наблюдалось помутнение роговицы, отек и слизистое нагноение (рис. 1а), а животные с ТЭ характеризовались наличием слезотечения и светобоязни, а также зеленоватым оттенком роговицы глаза после взаимодействия белков раневой поверхности с флуоресцеином (см. рис. 1б, в).

Масса тела кроликов. Масса тела равномерно увеличивалась в течение всего периода наблюдения. В период наблюдения животные потребляли корм и воду в рамках физиологических потребностей.
Гистологическое исследование. Гистологической оценке подвергались глазные яблоки всех животных. У животных интактной группы значимой патологии не выявлено. Роговица – из 5 слоев, многослойный плоский эпителий – обычного строения, сосуды не определяются, патологической клеточной инфильтрации не выявлено (рис. 2а). Строение радужки, ресничного тела не нарушено (рис. 2б). Строение лимба обычное строения, с минимально выраженной лимфогистиоцитарной инфильтрацией (см. рис. 2в). Склера – сосудистая, строение сетчатой оболочки –в норме.
При моделировании обеих патологий наблюдали гистологические изменения (см. рис. 2).
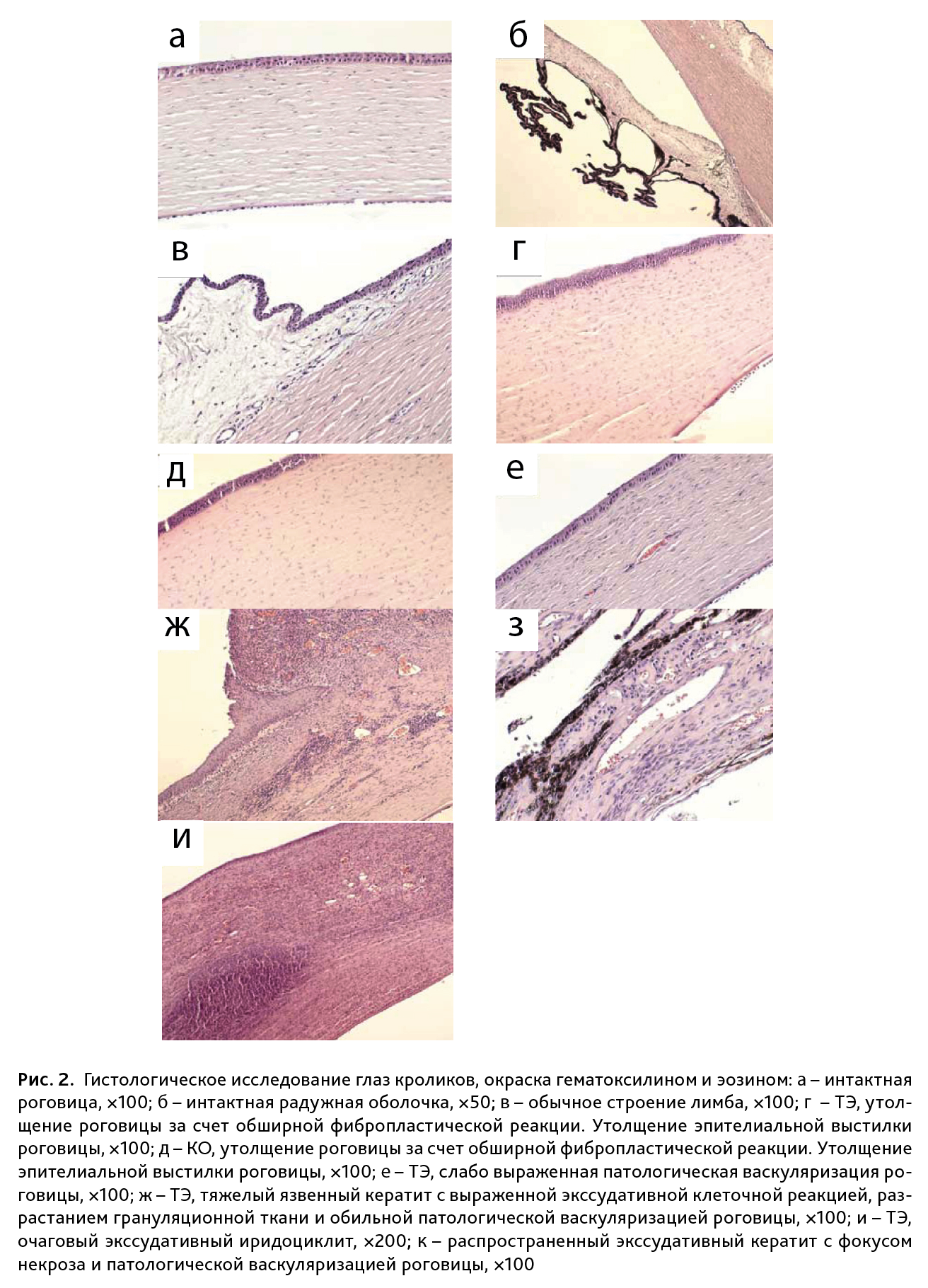
Для объективизации морфологических изменений роговицы при ТЭ и КО была использована полуколичественная шкала характера и степени выраженности патологического процесса. Учитывались наличие или отсутствие патологических изменений, наличие и выраженность текущего экссудативного воспаления (с последующей патологической васкуляризацией роговицы), наличие и распространенность фибропластических изменений роговицы (как проявления обратного развития патологического процесса и организации в его исходе): «нет патологии» – 0 баллов; фибропластическая реакция роговицы с формированием ограниченного или обширного рубца – 1 или 2 балла соответственно; кератит разной степени выраженности от слабо выраженного (3 балла), средней степени выраженности (4 балла), до тяжелого язвенного (5 баллов). Распределение патологических изменений, отраженных в баллах при различных моделях отражено в таблице.
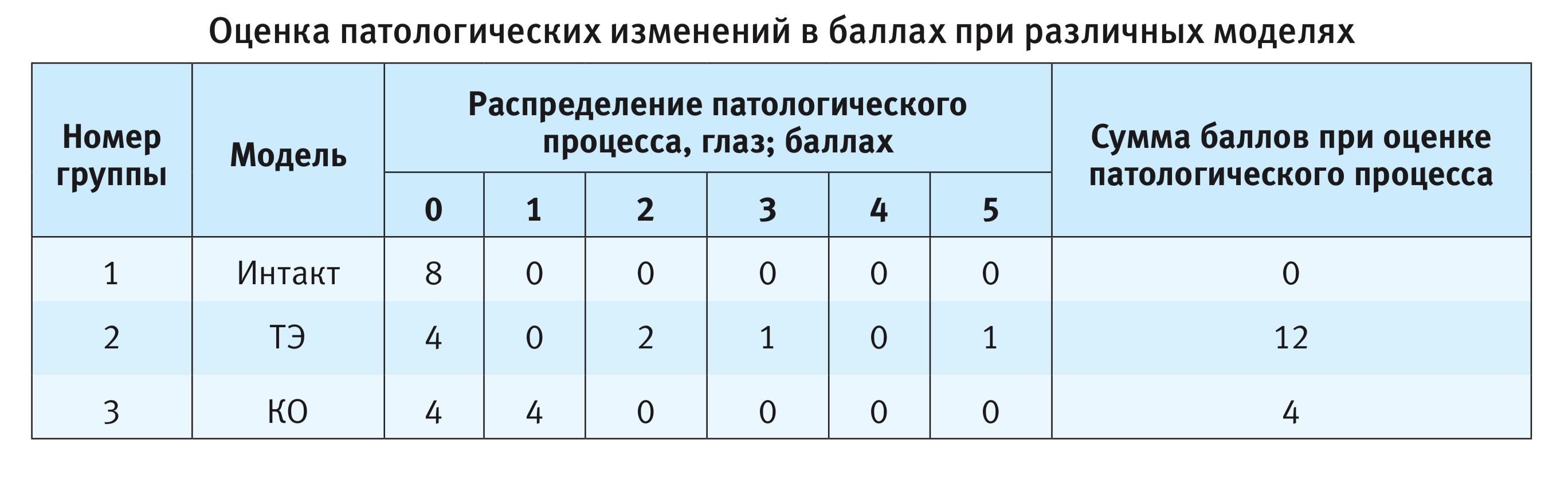
Согласно результатам исследования, состоятельность моделей подтверждена гистологически, выраженность повреждения преобладает при моделировании ТЭ. В дальнейшем целесообразно оценивать состояние роговицы не только на 29-й день после моделирования патологии, но также на 8-й, 15-й и 22-й дни. В таком случае появится возможность исследовать развитие патологического процесса в динамике.
Список источников
- Канюков В.Н., Стадников А.А., Трубина О.М., Яхина О.М. Экспериментальное моделирование травматических повреждений роговицы. – Вестник ОГУ, 2014, 12 (173): 156–9.
- Руководство по лабораторным животным и альтернативным моделям в биомедицинских технологиях. Под ред.: Н.Н. Каркищенко и С.В. Грачева. М., 2010.
- Руководство по проведению доклинических исследований лекарственных средств. Ч. I. М.: Гриф и К, 2012.




