Поддержание генетически модифицированных линий мышей: вклад в развитие биоколлекций в России
Петрова Е.С., Громова А.В., Анисименко М.С., Рубан Л.А., Егорова С.А., Петровская И.Ф., Амстиславская Т.Г., Липина Т.В. Поддержание генетически модифицированных линий мышей: вклад в развитие биоколлекций в России. Лабораторные животные для научных исследований. 2018; 2. https://doi.org/10.29296/2618723X-2018-02-01
Резюме
Потребность в биомедицинских исследованиях на мышах с генетическими нарушениями возрастает постоянно во всем мире. Неотъемлемой частью работы ученых является эффективное сотрудничество между научно-исследовательскими группами как внутри одной страны, так и на международном уровне. Процесс импорта генетически модифицированных мышей в Россию сопряжен с выполнением ряда условий, поскольку необходимо оформление таких документов, как сертификат здоровья, генетический паспорт, интеллектуальные права на передачу той или иной линии мышей, договор о научном сотрудничестве. Рассматривается процедура доставки генетических линий мышей из центра феногеномики (Toronto Centre for Phenogenomics, Канада, http://www.phenogenomics.ca/) в виварий НИИФФМ РАН (Россия). На примере питомника НИИФФМ, содержащего модифицированных мышей линий DISC1-Q31L, DISC1-L100P, PDE4B-M220T, Clstn2-KO и составляющих уникальную научную установку «Биологическая коллекция – генетические биомодели нейропсихических заболеваний», описана организация поддержания племенного ядра биоколлекции, включая регулярную проверку на патогены, возвратное скрещивание генетически модифицированных мышей с мышами дикого типа и их генотипирование. Представленные данные могут быть полезны для продуктивного расширения биоколлекций в России.
Введение
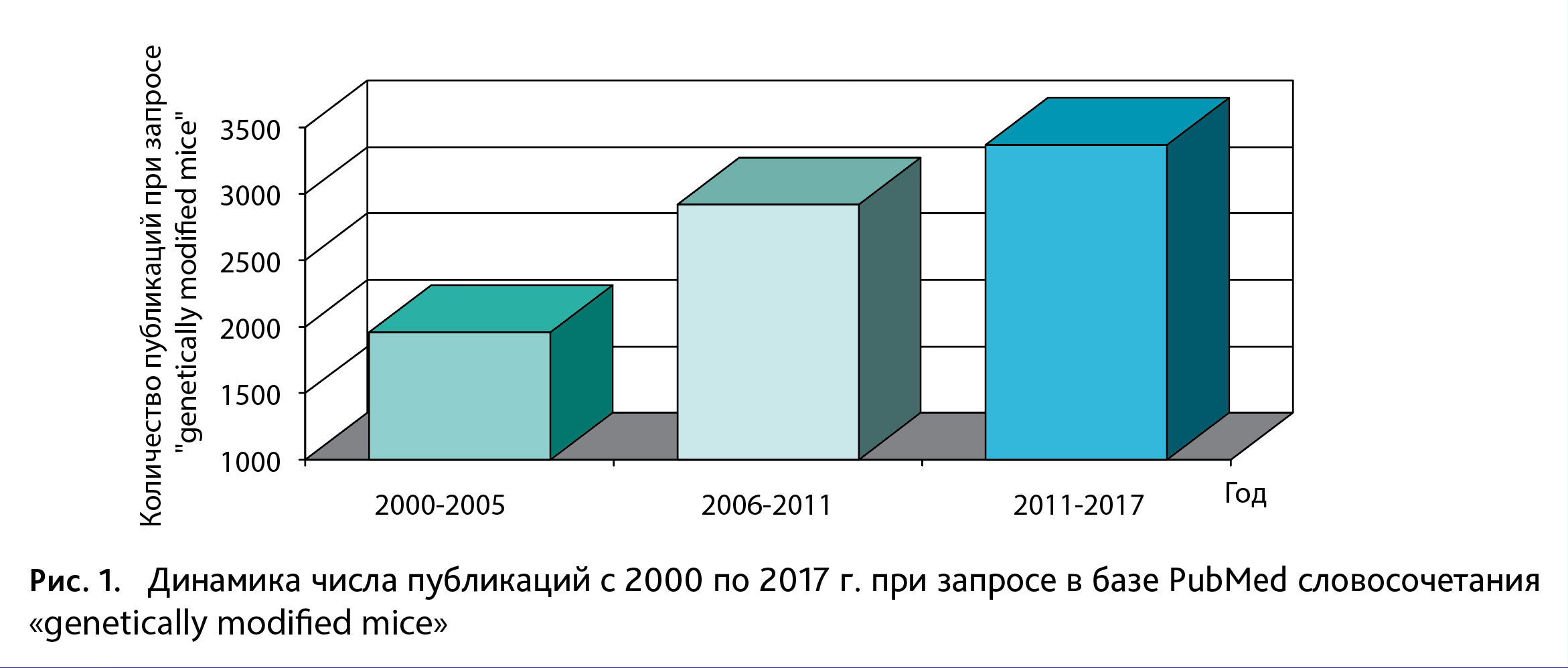
В настоящее время изучение фундаментальных и прикладных биомедицинских проблем невозможно без проведения исследований на лабораторных животных, где особая роль отведена генетически модифицированным организмам. Благодаря современным молекулярно-клеточным методам появилась возможность создания генетических линий животных. В результате этого у исследователей теперь есть уникальный инструмент для выяснения роли того или иного гена как во временном (возможность изучать эффекты гена при его активации/ингибировании в тот или иной период нейроразвития), так и в пространственном (возможность изучать эффекты гена при его активации/ингибировании в той или иной клеточной популяции) измерениях. В настоящий момент мышь является широко используемым организмом для изучения биологии и различных расстройств у человека по нескольким причинам. Во-первых, оба генома мыши и человека содержат 3,1 биллион пар оснований и ~5% геномов состоят из генов, которые идентичны в среднем на 85% [1]. Во-вторых, организм мыши подходит для проведения успешных генетических модификаций, в отличие, например, от крыс. Разработка CRISPR-Cas9 технологии, которая позволяет осуществлять высокоэффективное редактирование генома, используя сайт-направленные ДНК-эндонуклеазы, значительно ускорила создание новых генетических линий мышей [2]. Генетические модели, разработанные на мышах, широко используются в различных областях биологии – от нейронауки и этологических исследований до физиологии и онкологии [3]. Так, в Лаборатории Джексона (The Jackson Laboratory https://www.jax.org/) создано более 5000 генетически модифицированных линий мышей, из которых 1500 – модели генетических заболеваний человека [4]. Наконец, содержание и разведение мышей сравнительно дешево и достаточно доступно. На рис. 1 представлена динамика количества публикаций за последние 17 лет при запросе в базе PubMed словосочетания «genetically modified mice», отражающая растущий спрос на генетические линии мышей.
Разнообразие генотипов мышей привело к созданию в 2005 г. Международной организации Federation of International Mouse Resources – FIMRe (http://www.fimre.org), которая объединяет 17 национальных центров генетических ресурсов Северной Америки, Европы, Азии, Австралии и координирует их работу [5]. Генетически модифицированные линии мышей доступны из различных международных ресурсов, включая, центр региональных ресурсов мутантных мышей (IMMRRC, http://www.mmrrc.org), Европейский архив мутантных мышей (EMMA, http://www.emmanet.org), питомник Taconic Farms (http://www.taconic.com), Японский биоресурсный центр RIKEN (http://www.brc.riken.jp/rmpd/mouse_phenome_about.html), Лаборатория Джексон (http://www.jax.org).
В России не так много питомников, содержащих генетически модифицированные линии мышей. Например, к биоресурсным центрам (со статусом SPF; specific pathogen free – отсутствие патогенных микроорганизмов) относятся питомник лабораторных животных «Пущино», в котором содержатся 7 генетических линий; питомник на базе SPF-вивария ИЦиГ СО РАН (Новосибирск) включает коллекцию из 13 генетически модифицированных линий мышей; SPF-виварий ИФАВ РАН (Черноголовка) – 7 линий мутантных мышей.
Для изучения нейробиологических механизмов ментальных расстройств на базе НИИ физиологии и фундаментальной медицины (Новосибирск) в 2016 г. была создана биоресурсная коллекция генетических мышей «Биологическая коллекция – генетические биомодели нейропсихиатрических расстройств» (http://www.physiol.ru/structure/ckpunu/unu), включающая 4 генетические линии: DISC1-Q31L, моделирующая депрессивно-подобное состояние; DISC1-L100P, соответствующая модели шизофрении [6]: PDE4B-M220T, проявляющая эндофенотипы посттравматического стрессового расстройства [7]; Clstn2-KO, моделирующая расстройство аутистического спектра с проявлением гиперактивности [8, 9]. Для поддержания биоресурсной коллекции питомника необходимо выполнять ряд обязательных методических процедур, регламентирующих разведение животных, обновление племенных ядер, включая возвратное скрещивание с диким типом, плановый контроль соответствия генотипа и эндофенотипов каждой генетической линии.
Введение в мировую практику требований системы GLP (Good Laboratory Practice) для проведения доклинических испытаний лекарственных веществ привело к еще более жестким условиям к стандартизации содержания животных. Стандартность лабораторного животного определяется не только его генетическим статусом, технологией разведения и содержания, но и состоянием его здоровья. По состоянию здоровья лабораторные животные делятся на следующие категории: конвенциональные – содержащиеся в открытой системе (1-я категория); улучшенные конвенциональные – находящиеся в барьерной системе неполного типа. Исходными животными этой категории могут быть только животные более высокого класса качества (SPF); 2-я категория качества животных соответствует таковой, именуемой во многих странах MD (Minimal Diseases); 3-я и 4-я категории соответствуют категории SPF животных, содержащихся в строгой барьерной системе; 5-я категория включает гнотобиоты (безмикробных) или аксенных животных, содержащихся в изоляторах. Стандартность животных определяется мониторингом их статуса на патогены в соответствии с категорией. Контроль состояния животных осуществляется регулярно с минимальной частотой для животных 1-й и 2-й категорий –
1 раз в 6 мес, для 3-й и 4-й категории – 1 раз в 2–3 мес, для 5-й категории – 1 раз в 6 мес.
Цель настоящей публикации – обсуждение вопросов приобретения мутантных мышей из международных источников, поддержания чистоты генетической линии в локальных питомниках России, а также предоставления методических рекомендаций по содержанию и генотипированию генетически модифицированных линий мышей на примере биоколлекции на базе НИИФФМ.
Материал и методы
Лабораторные животные. Линия мышей DISC1-Q31L несет точечную мутацию (замена одного нуклеотида) во 2-м экзоне гена DISC1 (Disrupted-in-Schizophrenia-1), приводящую к замене глутамина на лейцин в положении 31-й аминокислоты в DISC1 протеине. Мыши линии DISC1-L100P с точечной мутацией во 2-м экзоне гена DISC1, приводящей к замене лейцина на пролин в положении 100-й аминокислоты в белке DISC1. Линия PDE4B-M220T несет мутацию в 7-м экзоне гена PDE4B (Phosphodiesterase 4B), приводящая к замене метионина на треонин в 220-м положении протеина PDE4B. Линия мышей Clstn2-KO с нокаутом гена кальсинтенин-2 (calsyntenin-2; Clstn2-KO). Мутантные линии мышей (DISC1-Q31L; DISC1-L100P; PDE4B-M220T) были созданы при сотрудничестве лаборатории профессора Дж. Родера с исследователями биоресурсного центра RIKEN [6], а Clstn2-KO линия была получена при взаимодействии с лабораторией профессора А.-М. Крэга [8].
Импорт генетических линий мышей в Россию. Организацию ввоза генетических линий мышей из Центра феногеномики (Торонто, Канада; http://www.phenogenomics.ca/) в виварий НИИФФМ (http://www.physiol.ru/; Новосибирск, Россия) осуществляло ООО «ЭМБИ» (https://academpark.com/residents/1648/; http://embiresearch.com). Были подготовлены следующие документы:
- контракт поставки лабораторных мышей между Центром феногеномики и ООО «ЭМБИ»;
- счет на оплату контракта;
- международный ветеринарный сертификат здоровья;
- генетический паспорт на каждую генетическую линию;
- разрешение на ввоз от Россельхознадзора через пункты пропуска, расположенные на внешней границе Таможенного союза, в которых осуществляется пограничный государственный ветеринарный контроль.
Общее число ввозимых самцов и самок четырех генетических линий мышей составило 45, т.е. более установленного Россельхознадзором (по правилам Россельхознадзора число животных не должно превышать 50). Доставка генетически модифицированных мышей производилась компанией «Мировой курьер» (https://www.worldcourier.com/) и заняла 5 дней, включая отправку из Торонто (24.06.2014) и получение ООО «ЭМБИ» в Новосибирске (28.06.2014).
Инбредное разведение гомозиготных генетических линий мышей. Разведение генетических линий осуществляют по принципу тесного инбридинга в 2 этапа: 1-й этап – работа с племенным ядром и 2-й – ступенчатое расширенное воспроизводство для использования в экспериментах (племенное стадо). Племенное ядро линии представляет собой группу животных, состоящую из размножающихся пар репродуктивного возраста (родных братьев и сестер) в соотношении 1 самец/
1 самка. В пределах племенного стада к 1 самцу подсаживают 2 самки. Обязательна регистрация инбредного возраста каждого гнезда, которая определяется количеством поколений, обозначается «F» и номером поколения. Все рожденные от 1-го поколения (F1) инбредного разведения потомки (помет) считаются 2-м поколением (F2), при скрещивании которого рождается 3-е поколение (F3) и т.д. Данные генетико-селекционные процедуры являются основополагающими для исключения возможности генетической контаминации (случайных скрещиваний) и потери гомозиготности линий.
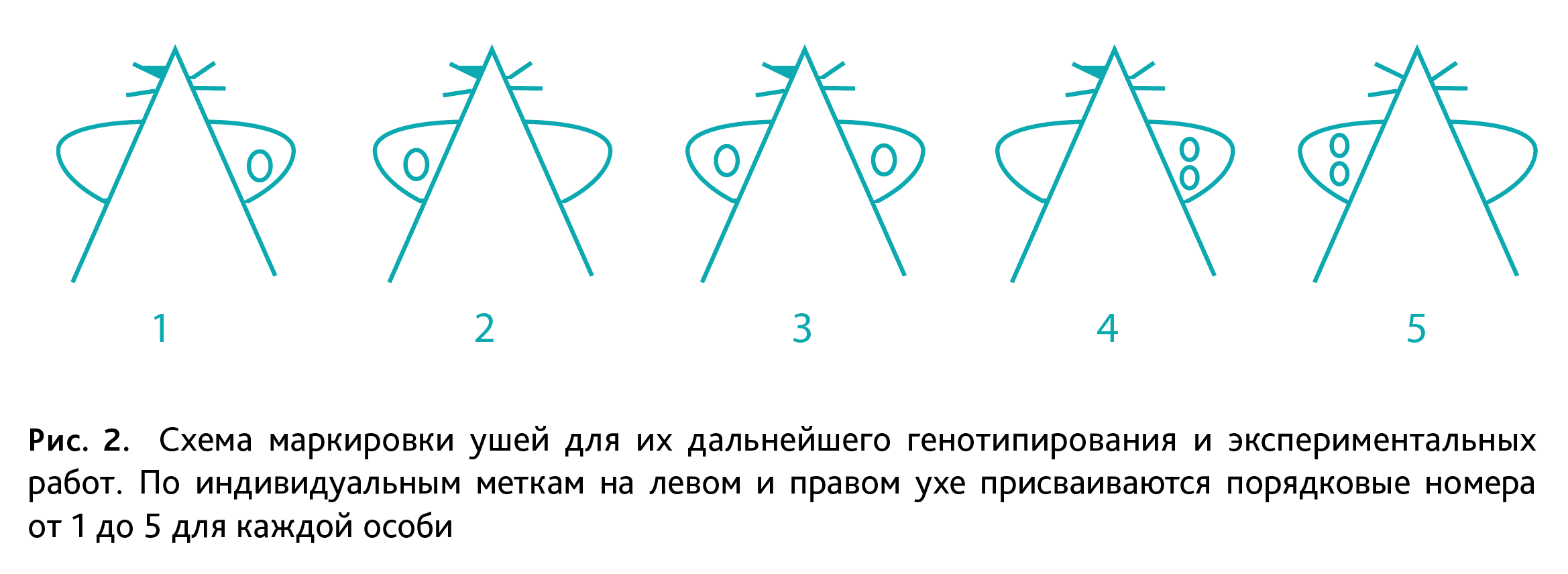
Обновление племенных ядер гомозиготных генетических линий мышей. Для поддержания каждой генетической линии формируют 8–12 родительских гнезд, которые при выбраковке подвергают обновлению за счет ссаживания особей из детей (пометов) генетических линий, достигших половозрелого возраста, находящихся в непосредственно родственных связях. Родительские племенные ядра по истечении репродуктивного возраста (7–8 мес) подвергаются выбраковке (эвтаназии с последующей утилизацией). При падеже/признаках нежизнеспособности самки или самца в родительской паре гнезда выбраковывается все гнездо. При разведении генетических линий мышей биоресурсной коллекции, соблюдая инбридинг, необходимо организовать возвратное скрещивание каждой мутантной/нокаутной линии с контрольной линией – мыши дикого типа C57Bl/6NCrl для получения гетерозиготных животных. Затем полученных гетерозиготных самцов и самок используют для создания гнезд с целью формирования потомства, состоящего из 25% мышей дикого типа, 50% – гетерозигот и 25% – гомозиготных особей в одном помете. Полученных животных маркируют (рис. 2) и генотипируют для дальнейшего формирования новых гнезд между гомозиготными особями. Данная процедура осуществляется с регулярностью 1 раз в 1–2 года.
Определение патогенов. Мониторинг здоровья генетических линий мышей выполняется в соответствии с рекомендациями FELASA (Федерация европейских научных ассоциаций по лабораторным животным) методом иммуноферментного анализа (ИФА) с детекцией вирусов специфичными антителами в сыворотке или плазме крови и методом полимеразной цепной реакции (ПЦР) для определения бактерий и вирусов в фекалиях и мазках из ротовой полости [10]. Для исследования патогенов у мышей отбирали биологический материал и направляли в лабораторию ООО «Белки-Биотехнологии» (https://www.bbt-lab.com).
Для определения вирусов методом ИФА необходимо отобрать плазму или сыворотку крови. Допустимо ее разведение фосфатно-солевым буфером не более чем в 10 раз. Объем неразведенной сыворотки 1 образца на 1 патоген должен составлять 5 мкл, т.е. для анализа вирусов, рекомендуемых FELASA, необходимо не менее 50 мкл сыворотки. Для определения бактерий верхних дыхательных путей методом ПЦР берется мазок из ротовой полости. Зонд не должен касаться рабочих поверхностей и рук. Анализ остальных бактерий из списка FELASA проводится в образцах фекалий животных методом ПЦР. Для исследования требуется 1 г фекалий от каждого исследуемого животного.
Контроль микробиологического статуса конвенциональных мышей в виварии НИИФФМ осуществляется следующими методами:
Тест-система. Метод состоит в исследовании животных высокой катего-
рии качества (SPF) с известным исходным состоянием после пребывания их в течение определенного срока (8 нед и более) в колонии конвенционального разведения.
Выборка животных из популяции колонии. Метод включает общее посмертное, микробиологическое и гистологическое обследование. Шансы обнаружить инфекцию зависят от числа проверенных животных по отношению к общему числу особей в колонии (%), а также от степени распространения инфекции среди животных. Мыши отбираются из каждой зоны обитания, где минимальная выборка составляет не менее 10 особей, 5 из которых – в возрасте 10–12 нед, 5 – старше 6 мес.
Плановая проверка животных на инфекции. Метод позволяет обнаружить патогены или повреждения, угрожающие здоровью колонии и качеству проводимых экспериментов.
Результаты мониторинга здоровья хранятся у руководителя, курирующего биоресурсную коллекцию генетических линий мышей на бумажном носителе, который должен быть заверен подписью и печатью лаборатории, где выполнялось исследование.
Генотипирование. 1. Выделение ДНК солевым методом. Лизирующий буфер готовится непосредственно перед выделением ДНК (Табл. 1, 2). Буфер В хранится при температуре 4°С. Кончик хвоста (около 0,5 см) поместить в пробирку на 1,5 мл. Добавить 1 мл лизирующего буфера. Инкубировать при температуре 50°С на шейкере 18–20 ч. Охладить пробирки до 4°С и добавить
300 мкл 6М NaCl, перемешивать 10 с на Vortex. Затем центрифугировать
15 мин при 12 000 g и 4°С. Супернатант слить в чистую пробирку на 1,5 мл и центрифугировать 10 мин при 11 000 g и 4°С. Этот раствор можно хранить при температуре 4°С (5–7 дней) до получения результатов генотипирования. Далее отобрать 200 мкл супернатанта в чистую пробирку на 1,5 мл и добавить 400 мкл 96% холодного этанола, охладить до -20°С. Должна наблюдаться белесая взвесь в верхней части раствора. После этого смесь перемешать до формирования плотного белого осадка и центрифугировать 10 мин при 7000 g и 4°С. Супернатант слить, осадок просушить (около 10 мин), оставив пробирки вверх дном на салфетке. Затем добавить 1 мл 70% этанола и центрифугировать 10 мин при 7000 g и 4°С. Слить супернатант, осадок просушить и добавить 50–100 мкл бидистиллированной воды. Расчет концентрации ДНК производили на приборе NanoDrop 2000 (Thermo Scientific, США) при максимуме поглощения 260 нм. Рабочее разведение раствора ДНК должно быть около
50 нг/мкл. Необходимо обратить внимание на чистоту полученных растворов. Соотношение 260/230 должно быть >2,2 (230 нм – максимум поглощения полисахаридов); соотношение 260/280 должно быть >1,8 (280 нм – максимум
поглощения белков).
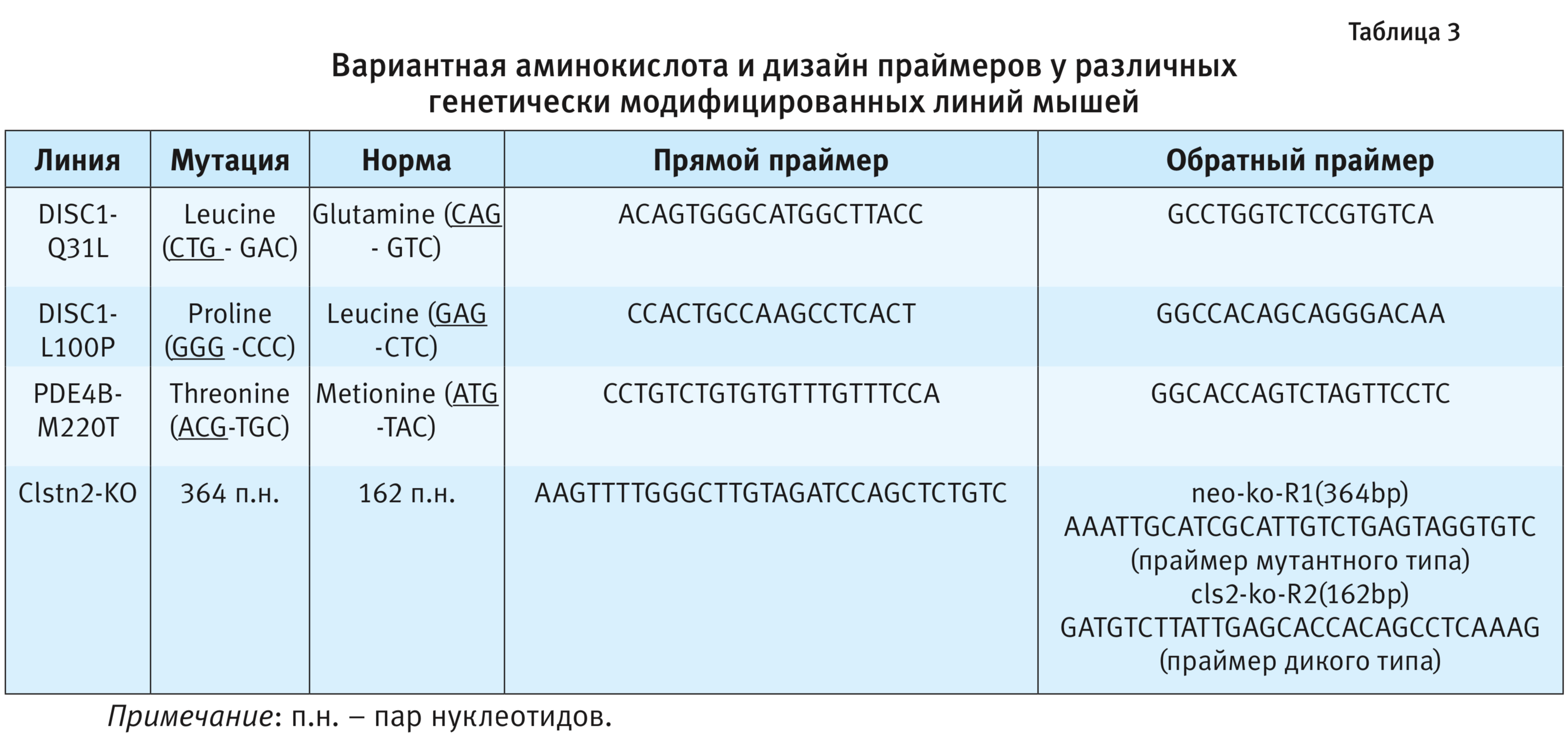
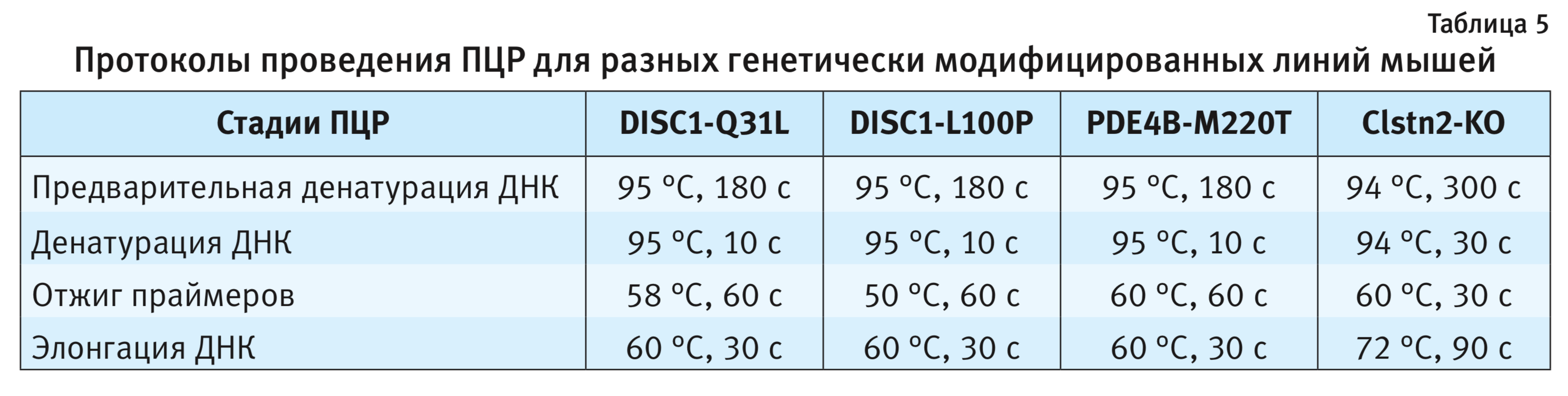
2. ПЦР. Праймеры и зонды. Синтез праймеров и зондов осуществляла компания ООО «Лаборатория-Медиген» (Новосибирск). Для разработки ПЦР-протокола необходимо первоначально провести конструирование пары праймеров (затравки для ДНК-полимеразы) (табл. 3). Праймеры подбирали с помощью программы Primer 3. Полученные параметры проверяли на специфичность, используя биоинформационную базу данных NCBI (National Center for Biotechnological Information, США) (https://www.ncbi.nlm.nih.gov/tools/primer-blast/).


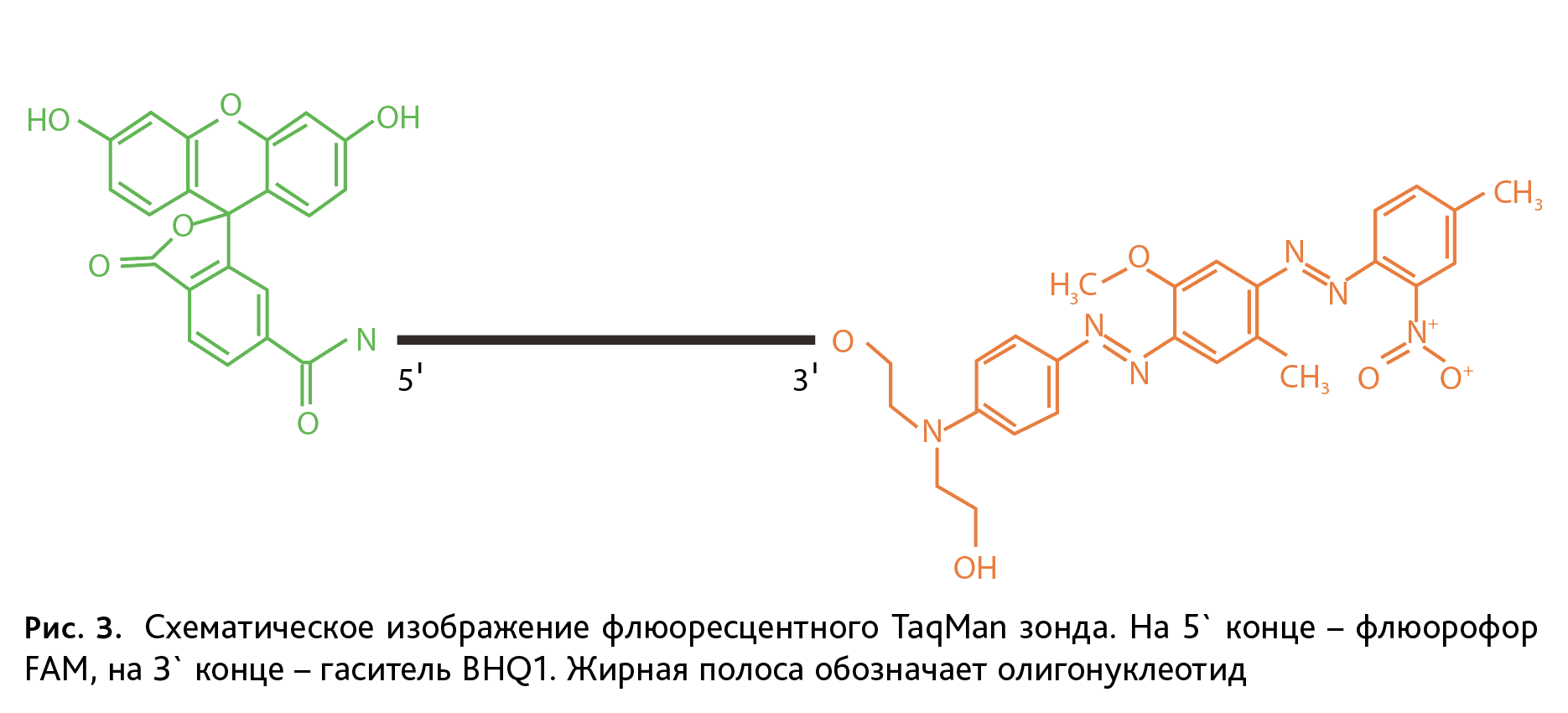
Праймер-зонды представляют собой комплиментарные к фрагменту ДНК с точечной мутацией олигонуклеотиды, меченные на 5` конце флюоресцентным красителем FAM (Fluorescein amidite) для дикого типа, R6G (Rhodamine 6G) – для мутантов, и гасителем флюоресценции BHQ1 (Black Hole Quencher-1) на 3` конце. Схематичное изображение флюоресцентного TaqMan зонда представлено на рис. 3. Для генотипирования мышей линий DISC1-Q31L, DISC1-L100P, PDE4B-M220T использовали следующие флюоресцентные зонды (подчеркнуты нуклеотиды, комплементарные соответствующему полиморфизму):
DISC1-Q31L: 5’ – FAM-CAGTAGCCCCTCAGAGG-BHQ1-3’
5’ – R6G-CAGTAGCCCCTCTGAGG-BHQ1-3’
DISC1-L100P: 5’ – FAM-CTCTTGAGAAAAGGCT-BHQ1-3’
5’ – R6G-CTCTTGGGAAAAGGCT-BHQ1-3’
PDE4B-M220T: 5’ – FAM-ATCAGAAACTAGCAATGGAG-BHQ1-3’
5’ – R6G-ATCAGAAACTAGCAACGGAG-BHQ1-3’
Для линии Clstn2-KO зонды не конструировали вследствие возможности генотипирования такой мутации менее затратным методом гель-электрофореза.
Раствор Master Mix, состоящий из компонентов (BIORON LifeScience, Германия) для проведения ПЦР аликвотировали по 0,5 мл для хранения при температуре -20°С (табл. 4). Смесь PCR mix готовят непосредственно перед выполнением ПЦР и не хранят. В расчете на 1 образец необходимо 23 мкл раствора PCR mix, содержащий Master Mix (5 мкл), 10 мкМ прямой праймер (1 мкл), 10 мкМ обратный праймер (1 мкл), 10 мкМ зонд для дикого типа (1 мкл), 10 мкМ зонд для мутантного типа (1 мкл) и ddH2O (14 мкл). Для мышей линии Clstn2-KO праймеры в концентрации 10 мкМ добавляют в количестве по 1 мкл, соответственно 15 мкл ddH2O. На 1 пробу необходимо 2 мкл раствора ДНК с концентрацией около 50 нг/мкл.
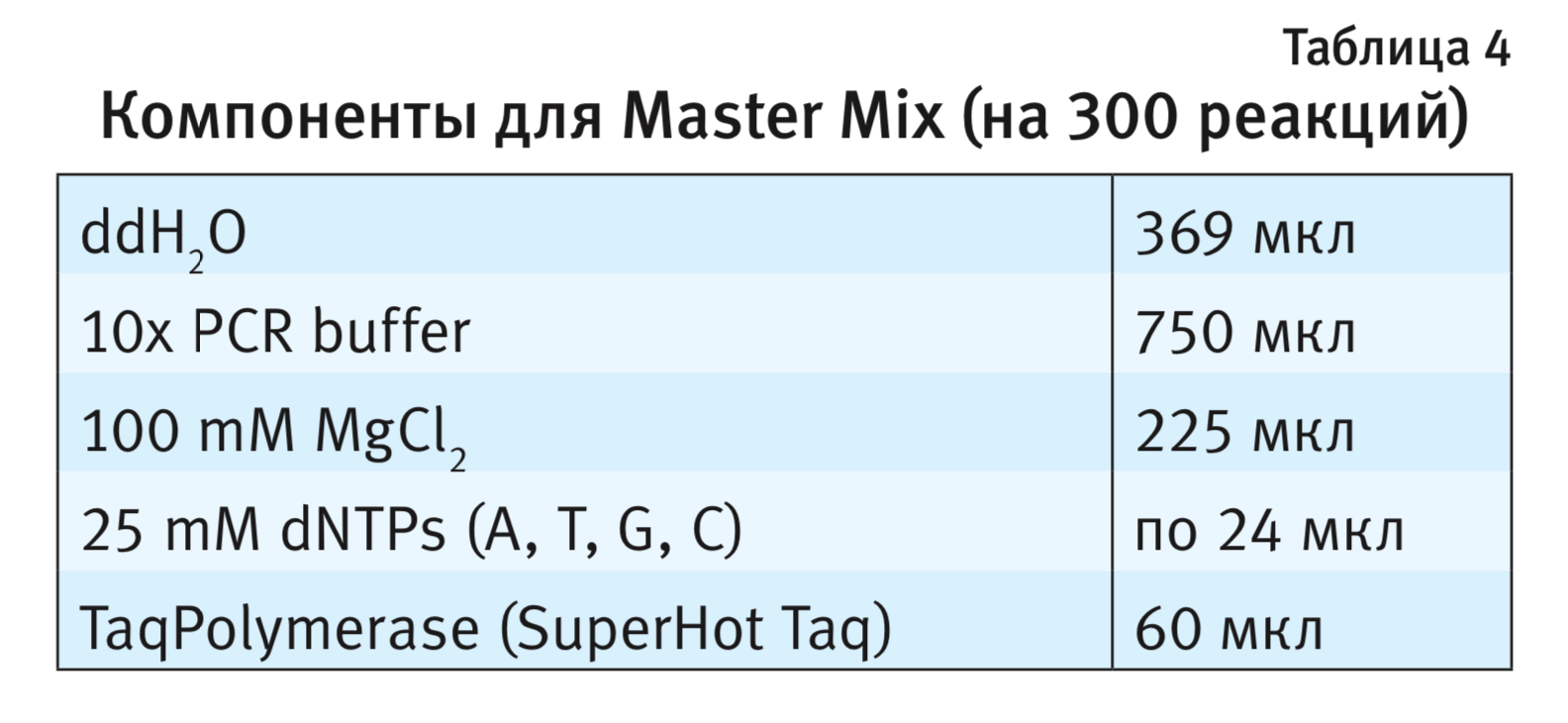
Параметры для ПЦР. Температурные оптимумы каждой стадии ПЦР для четырех генетических линий мышей представлены в табл. 5. Предварительную денатурацию молекулы ДНК проводили при температуре 95°С в течение 3 мин, далее повторяли 35 циклов. Уровень флуоресценции детектировали по окончании каждого цикла ПЦР.
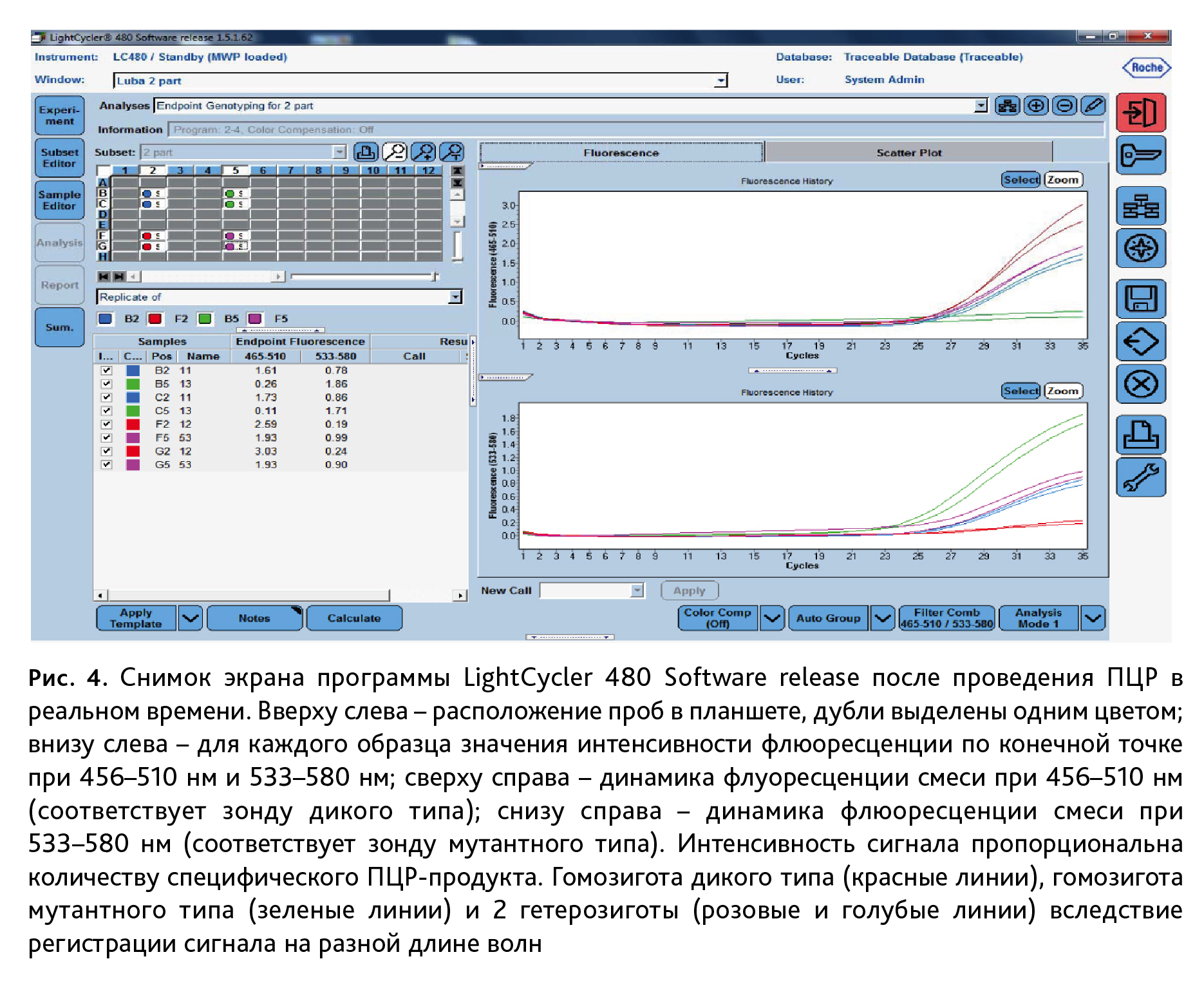
3. Анализ ПЦР-продуктов. Генотипирование мышей с точечными мутациями методом ПЦР в реальном времени выполняли на приборе LightCycler 480 (Roche LifeScience, Германия). Флюоресценцию зондов для дикого типа (FAM) регистрировали при длине волны 465–510 нм, для мутантного типа (R6G) – 533–580 нм (рис. 4).
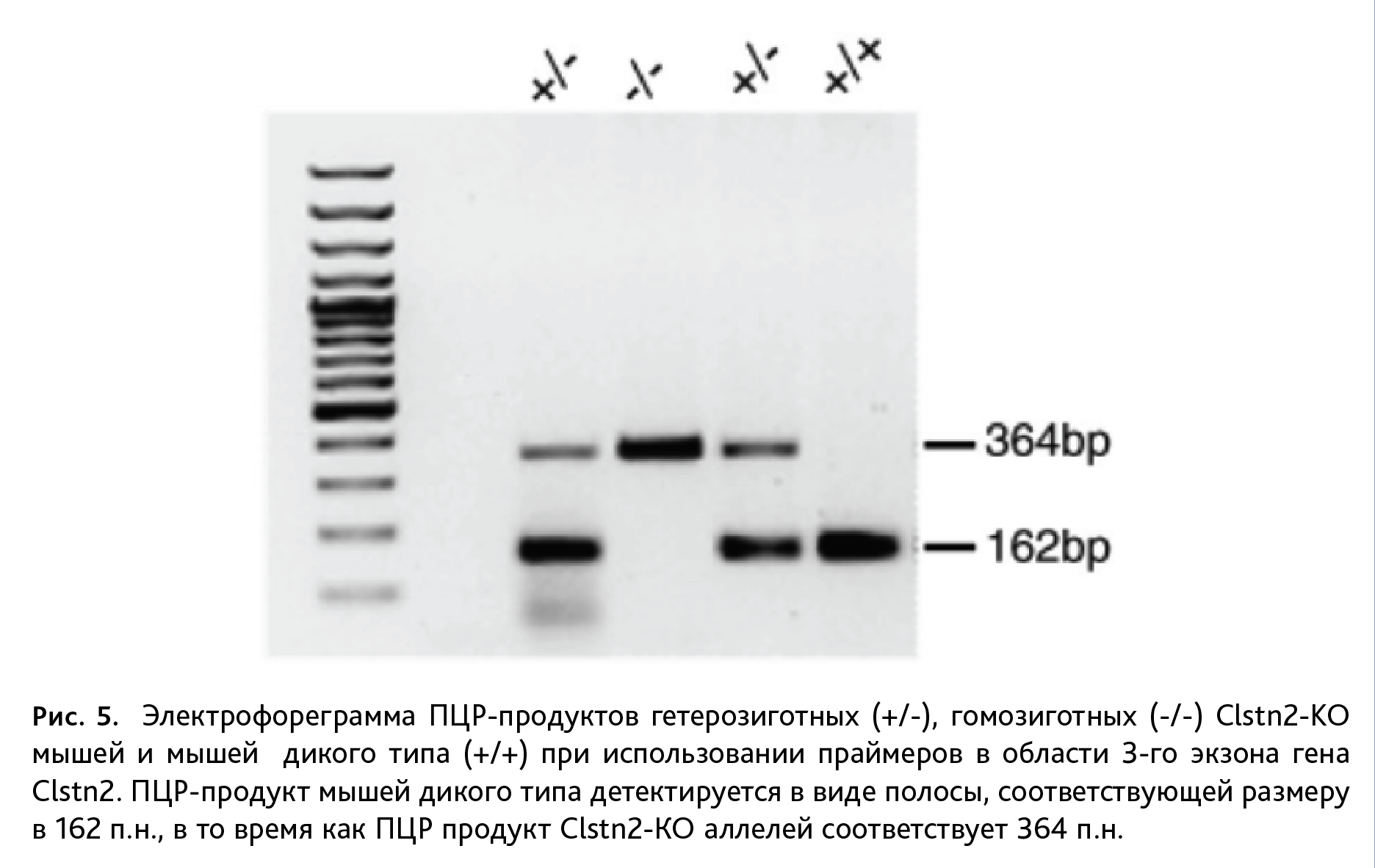
При генотипировании мышей линии Clstn2-KO после ПЦР осуществляли гель-электрофорез продуктов амплификации в камере для горизонтального фореза (Хеликон, Россия) при напряжении 150 В в течение 35 мин. Для электрофореза использовали 2% агарозный гель в 1х ТАЕ буфере. Образцы (5 мкл) смешивали с 1 мкл краски (0,025% раствор бромфенолового синего в 30% растворе глицерина) и вносили в агарозный гель. После электрофореза гель инкубировали в растворе бромистого этидия в течение 10 мин, промывали в воде и анализировали в гель-документирующей камере (GelDoc ХR+; BIO-RAD, США) в ультрафиолете. Размер амплифицированного продукта у мышей дикого типа составляет 162 пары нуклеотидов (п.н.), у Clstn2-KО мышей – 364 п.н. В качестве линейки молекулярных масс использовали маркер (100 bp DNA Ladder, BIORON LifeScience, Германия) (рис. 5).
Результаты и обсуждение
Для поддержания генетически модифицированных линий мышей в России важно разработать нормы и регламент по ввозу, содержанию, разведению, обновлению племенных ядер животных, а также обеспечить доступность процедуры генотипирования, протокол которого формируется при создании линии и должен быть в открытом доступе. На базе УНУ НИИФФМ, в которой содержатся мыши линий DISC1-Q31L, DISC1-L100P, PDE4B-M220T, Clstn2-KO, нами отработан эффективный, доступный и воспроизводимый протокол генотипирования.
Водный раствор ДНК с чистотой и концентрацией, достаточной для генотипирования, получен методом солевой экстракции нуклеиновых кислот в присутствии протеиназы К, без применения фенола и хлороформа. Данный метод доступный по стоимости, не требует особых условий и оборудования. После доведения раствора ДНК бидистиллированной водой до концентрации 50 нг/мкл для линий мышей с точечными мутациями проводили ПЦР в реальном времени. Этот метод основан на количественной детекции флюоресцентного сигнала, который увеличивается пропорционально накоплению в реакционной смеси целевого специфического фрагмента ДНК. Используемые нами зонды TaqMan представляют собой олигонуклеотиды с флюорофором – молекулой способной к флюоресценции, на 5` конце и гасителем – на 3` (рис. 3). В ходе ПЦР после гибридизации зонда с комплементарной последовательностью, ДНК-полимераза, обладающая 5`-экзонуклеазной активностью, разрушает зонд и приводит к разобщению флюорофора и гасителя, а значит – к возрастанию флюоресценции. Такая система позволяет достоверно регистрировать накопление фрагмента гена строго определенной
последовательности.
Генотипирование мышей линии Clstn2-KO проводили с использованием гель-электрофореза. У мышей данной линии нарушена экспрессия гена Clstn2, что ведет к отсутствию синаптического белка кальсинтенина-2. В результате возникают функциональный дефицит тормозных вставочных ГАМК интернейронов и последующий социальный дефицит, а также нарушения долговременной пространственной памяти и гиперактивности [8, 9]. Нокаутировние гена осуществляется за счет вставки в 3-й экзон гена Clstn2, локализованного на 9-й хромосоме, неомициновой кассеты. Амплифицированные фрагменты гена Clstn2 у мышей дикого типа распределяются в геле относительно линейки молекулярных масс между 100 и 200 п.н., что соответствует размеру продукта ПЦР в 162 п.н., для мышей линии Clstn2-KO длина ампликона равна 364 п.н. (рис. 5). У гетерозиготных животных присутствуют амплифицированные продукты длиной 162 п.н. и 364 п.н.
Заключение
Ключевая роль лабораторных мышей в решении задач фундаментальной биологии и смежных наук требует создания новых генетических линий животных с заданным по запросу исследователя генотипом. Исследователи всего мира имеют неограниченный доступ к ресурсам многочисленных генетических линий мышей, однако в России пока не создан специализированный центр с единой коллекцией таких мышей, который бы объединял как создание новых уникальных линий, так и централизованную организацию их импорта в виварии научно-исследовательских институтов страны. Приобретение генетически модифицированных мышей из зарубежных питомников с доступом к ~5000 линиям существенно повысит эффективность научных исследований в России.
Перспективная задача российского научного сообщества в области биологии и медицины – организация и отработка процедуры поддержания биоколлекций, начиная с импорта генетически модифицированных линий мышей, включая сертификат здоровья, генетический паспорт с протоколом генотипирования и создание условий содержания генетических линий в локальных питомниках России. Контроль наследования заявленной мутации необходимо проводить путем скрининговой процедуры генотипирования. Для эффективного поддержания чистоты генетических линий мышей следует учитывать такие критерии методик генотипирования, такие как доступность, надежность, воспроизводимость.
Благодарности
В данной работе были использованы генетические линии мышей, входящие в состав уникальной научной установки (УНУ) «Биологическая коллекция – генетические биомодели нейропсихических заболеваний» (№493387) НИИФФМ.
Список источников
- Mouse Genome Sequencing Consortium et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 2002; 420 (6915): 520–62.
- Burgio G. Redefining mouse transgenesis with CRISPR/Cas9 genome editing technology. Genome Biol. 2018; 19 (1): 27–30.
- Rosenthal N., Brown S. The mouse ascending: perspectives for human-disease models. Nat. Cell. Biol. 2007; 9 (9): 993–9.
- Bult C.J., Eppig J.T., Blake J.A. et al. Mouse genome database 2016. Nucleic Acids Res. 2016; 44 (D1): D840–7.
- Davisson M. FIMRe: Federation of International Mouse Resources: global networking of resource centers. Mamm. Genome. 2006; 17 (5): 363–4.
- Clapcote S.J., Lipina T.V., Millar K.J. et al. Behavioral phenotypes of Disc1 missense mutations in mice. Neuron. 2007; 54 (3): 387–402.
- Ryabova O.V., Pavlov K.S., Lipina T.V. The complex approach to study endophenotypes related to posttraumatic stress disorder in mice with point mutation in the phosphodiesterase 4B gene (PDE4B-M220T). XII International interdisciplinary congress «Neuroscience for Medicine and Psychology», Sudak, Crimea, Russia, June 1–1, 2016; 339.
- Lipina T.V., Prasad T., Yokomaku D. et al. Cognitive deficits in calsyntenin-2-deficient mice associated with reduced GABAergic transmission. Neuropsychopharmacology. 2016; 41 (3): 802–10.
- Ranneva S.V., Pavlov K.S., Gromova A.V. et al. Features of emotional and social behavioral phenotypes of calsyntenin2 knockout mice. Behav. Brain Res. 2017; 332: 343–54.
- FELASA working group on revision of guidelines for health monitoring of rodents and rabbits et al. FELASA recommendations for the health monitoring of mouse, rat, hamster, guinea pig and rabbit colonies in breeding and experimental units. Lab. Anim. 2014; 48 (3): 178–92.




