Методика вскрытия и извлечения органов лабораторных животных. Сообщение 7: собаки, кошки
Работа выполнена без спонсорской поддержки.
Лосева Е.А., Савватейкина А.И., Устенко Ж.Ю., Беляева Е.В., Гущин Я.А. Методика вскрытия и извлечения органов лабораторных животных. Сообщение 7: собаки, кошки. Лабораторные животные для научных исследований. 2023; 4. https://doi.org/10.57034/2618723X-2023-04-04
Резюме
Некропсия и последующее гистологическое исследование органов и тканей являются одними из основных методов изучения токсичности, без которых невозможна адекватная оценка результатов доклинических исследований. Ввиду этого появляется необходимость в разработке определенного порядка вскрытия, обеспечивающего повторяемость выполняемых манипуляций от этапа к этапу и от эксперимента к эксперименту, а также позволяющего извлекать органы в необходимом составе, сохраняя их целостность, пригодную для гистологического исследования, и оптимально использовать рабочее время. Цель данной работы — описать методику вскрытия и извлечения органов собак (на примере породы бигль) и кошек, применимую в доклинических исследованиях. Собаки используются для оценки фармакологической безопасности, фармакокинетики и эффективности тестируемых лекарственных препаратов. Также они служат моделью для изучения эпилепсии, остеоартрита и других патологий. Кошки играют важную роль в изучении некоторых инфекционных, офтальмологических заболеваний, необходимы для проведения ряда исследований по оценке фармакокинетических показателей тестируемого препарата. Оба вида животных подвержены спонтанным заболеваниям и используются в кардиологических исследованиях, в изучении метаболических заболеваний (в частности, диабета), в сравнительной онкологии. Животные задействованы в качестве моделей воспалительных заболеваний, в биомедицинских исследованиях (как источники выделения стволовых клеток). В статье поэтапно описана методика от процедуры подготовки к вскрытию, внешнего осмотра и до последовательного вскрытия полостей и частей тела для извлечения органов. Все способы извлечения органов, а также последовательность выполняемых действий, описанные в данной статье, обеспечивают воспроизводимость этапов некропсии, извлечение органов в необходимом составе с сохранением их целостности, пригодной для дальнейшего гистологического исследования, минимизацию их повреждений, оптимизацию рабочего процесса.
Введение
Кошки и собаки являются животными-компаньонами для человека и подвергаются аналогичному влиянию окружающей среды, что важно для изучения многофакторных заболеваний — астмы, диабета, онкологии и др. [1].
Собаки являются биологической моделью для оценки фармакологической безопасности, фармакокинетики и эффективности лекарственных средств, а также используются для моделирования некоторых патологий человека [1, 2]. Среди собак распространены такие спонтанные патологии, как эпилепсия, остеоартрит, что делает их хорошей трансляционной моделью для терапевтических разработок [1, 4, 5].
Из всех видов животных-компаньонов собаки, пожалуй, представляют наибольший интерес для регенеративной медицины: они являются моделью для восстановления костных дефектов, используются в исследовании регенеративных лекарственных средств, а также в таком перспективном направлении, как терапия стволовыми клетками [6, 7].
Кошки используются для изучения инфекционных заболеваний. Примерами могут служить вирусная лейкемия кошек, которая вызывает лимфосаркому, иммунодефицитная болезнь кошек, являющаяся естественной моделью синдрома приобретенного иммунодефицита человека, и др.
Велика роль кошек и в изучении офтальмологических заболеваний. Кошки с диагностированной доминантно наследственной тяжелой дистрофией сетчатки являются моделью для таких болезней, как амавроз Лебера и альбинизм. Данный вид животных используется при проведении ряда исследований по оценке фармакокинетических показателей тестируемых препаратов [3].
Оба вида животных подвержены спонтанным заболеваниям и используются в кардиологических исследованиях (у них, как и у человека, встречаются дилатационная кардиомиопатия, гипертрофическая кардиомиопатия и аритмогенная кардиомиопатия правого желудочка), в изучении метаболических заболеваний (в частности, диабета), в сравнительной онкологии, в качестве модели воспалительных заболеваний, в биомедицинских исследованиях (как источники выделения стволовых клеток) [1, 3, 7, 8].
Ввиду того что некропсия и последующее гистологическое исследование органов и тканей являются одними из основных методов изучения токсичности, без которых невозможна адекватная оценка результатов доклинических исследований, появляется необходимость в разработке определенного порядка, обеспечивающего повторяемость выполняемых манипуляций от этапа к этапу и от эксперимента к эксперименту. Это позволит извлекать органы в необходимом составе, сохраняя их целостность, пригодную для гистологического исследования, и оптимально использовать рабочее время.
Цель данной работы — описать методику вскрытия и извлечения органов собак (на примере породы бигль) и кошек, применимую в доклинических исследованиях.
Научные труды по патологической анатомии животных содержат описание методик и порядок вскрытия трупов, но при стандартном патолого-анатомическом исследовании нет необходимости извлекать большое количество органов [9, 10]. Особенностью вскрытий в доклинических исследованиях является то, что для дальнейшего гистопатологического исследования необходимо извлечь определенный перечень органов и тканей, согласно Рекомендации коллегии ЕЭК № 10 от 21 мая 2020 г.1, их количество достигает 42 и более. В пределах одного эксперимента может осуществляться несколько плановых эвтаназий, проведенных с временным периодом, с участием разных лаборантов-исследователей и врачей-патоморфологов. Поэтому крайне важно придерживаться одинаковой методики вскрытия и извлечения органов.
Материал и методы
Некропсия собак породы бигль проведена в секционной АО «НПО «ДОМ ФАРМАЦИИ», животные участвовали в текущих экспериментах, одобренных биоэтической комиссией. Плановая эвтаназия являлась конечной точкой эксперимента. Масса тела 5 самцов собак составляла от 11,9 до 15,8 кг, 5 самок — от 12,9 до 14,5 кг, возраст животных был 19–22 мес. Специально для отработки методики животных не эвтаназировали.
Содержание и эвтаназия собак осуществлялись в соответствии с Директивой 2010/63/EU2.
Собак эвтаназировали, используя передозировку анестетика совместно с миорелаксантом, седативным и анальгезирующим средствами — препаратами Пропофол (в дозе 8 мг/кг), Риделат С (4 мг/кг), Ксила (8 мг/кг) и Трамадол (10 мг/кг). После констатации факта смерти проводили удаление жизненно важных органов, а затем извлекали остальные органы и ткани [11, 12].
Некропсия кошек была осуществлена в секционной с использованием биоматериала, предоставленного клиниками Санкт-Петербурга: вскрытию подлежали 1 самец и 2 самки, умерших по естественным причинам, масса животных составляла 2,5–4 кг.
При анатомическом описании была использована учебная литература и Международная ветеринарная анатомическая номенклатура, переведенная на русский язык [13, 14].
Для некропсии использовались костные щипцы-кусачки, остротупоконечные и глазные ножницы, анатомические пинцеты разных размеров, мини-ножовки и рамочные пилы, скальпели со сменными одноразовыми брюшистыми лезвиями, гравер Dremel 4000, одноразовые перчатки, фартуки и нарукавники, одноразовые пеленки, бинты, пульверизатор с водой для смачивания шерсти (рис. 1). Фотофиксация осуществлялась с использованием фотокамеры Canon SX620 HS.

Результаты и обсуждение
Подготовка трупа к некропсии
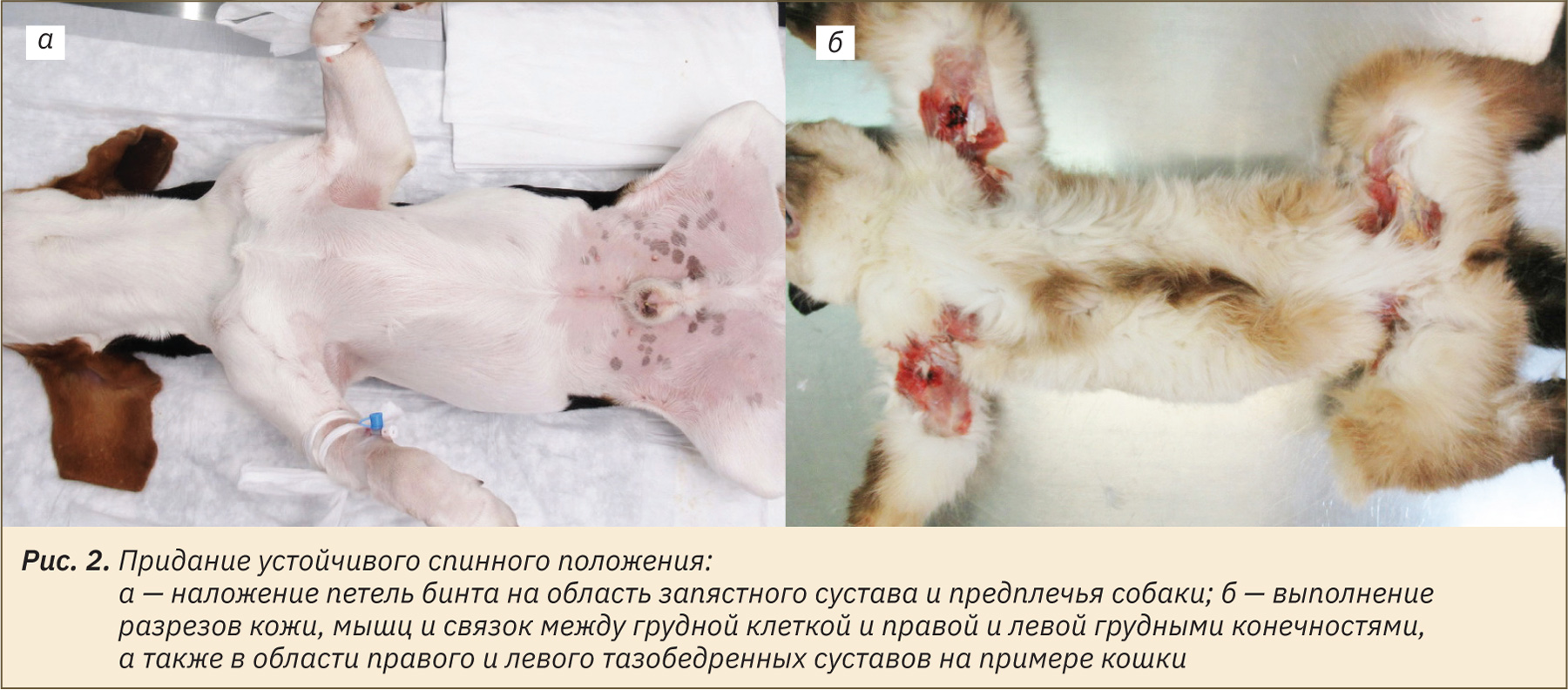
Приступая к процедуре некропсии, необходимо провести общий осмотр трупа животного на наличие внешних изменений кожного покрова, слизистых оболочек, любых повреждений. Далее труп животного помещают на спину. Для придания устойчивого положения делают петли из бинта в области запястного сустава или предплечья и фиксируют края бинтов на крючках стола либо связывают их друг с другом с обратной стороны стола (рис. 2, а). Предлагаем также и другой способ фиксации, благодаря которому устойчивое положение обеспечивается путем выполнения разрезов кожи, мышц и связок между грудной клеткой и правой и левой грудными конечностями, а также в области правого и левого тазобедренных суставов. Зафиксированные раскинутые конечности надежно сохраняют положение трупа (рис. 2, б). При необходимости обильно смочить шерстный покров водой.
Отбор молочной железы и кожи
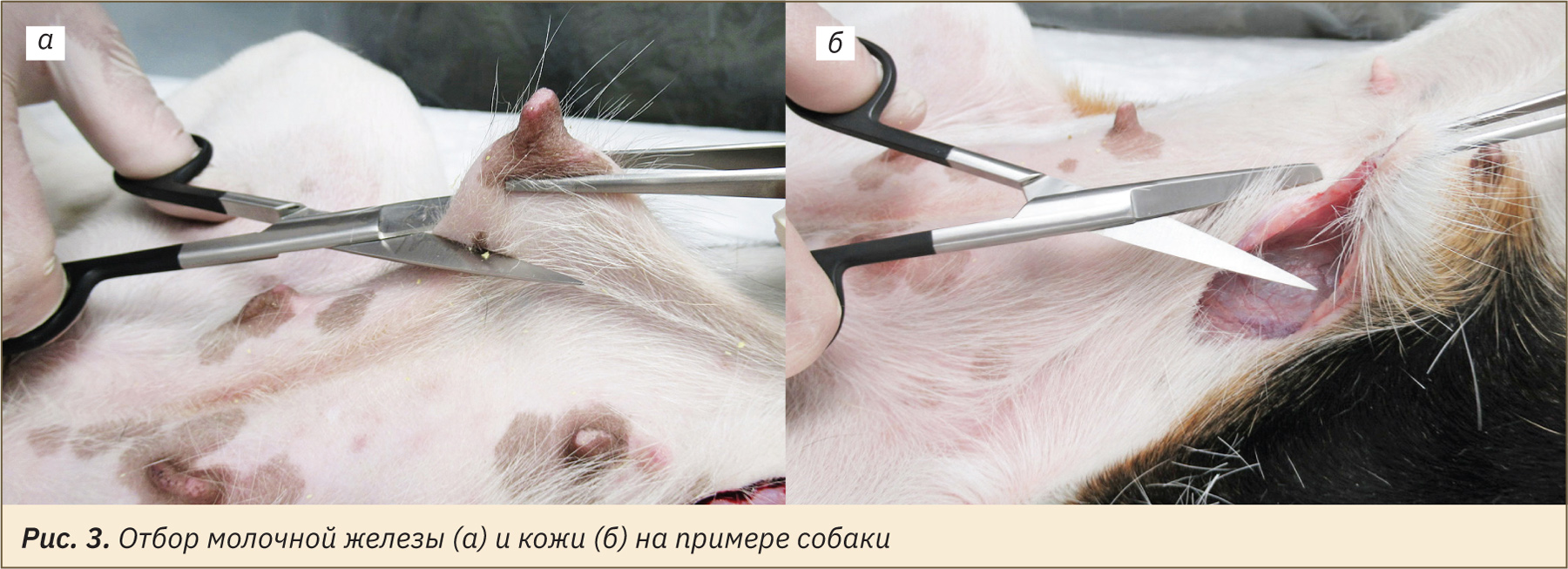
При отборе молочной железы необходимо произвести разрезы кожи по бокам от белой линии живота в области локализации молочных желез. Также можно ориентироваться на расположение соска: захватив сосок пинцетом, сделать надрез под молочной железой (рис. 3, а).
Отбор кожи производится с латеральной брюшной области, избегая тканей молочной железы и участков кожи с сильно развитым подкожным слоем. Для этого нужно захватить и приподнять лоскут кожи и выполнить надрез (рис. 3, б).
Вскрытие грудной и брюшной полостей
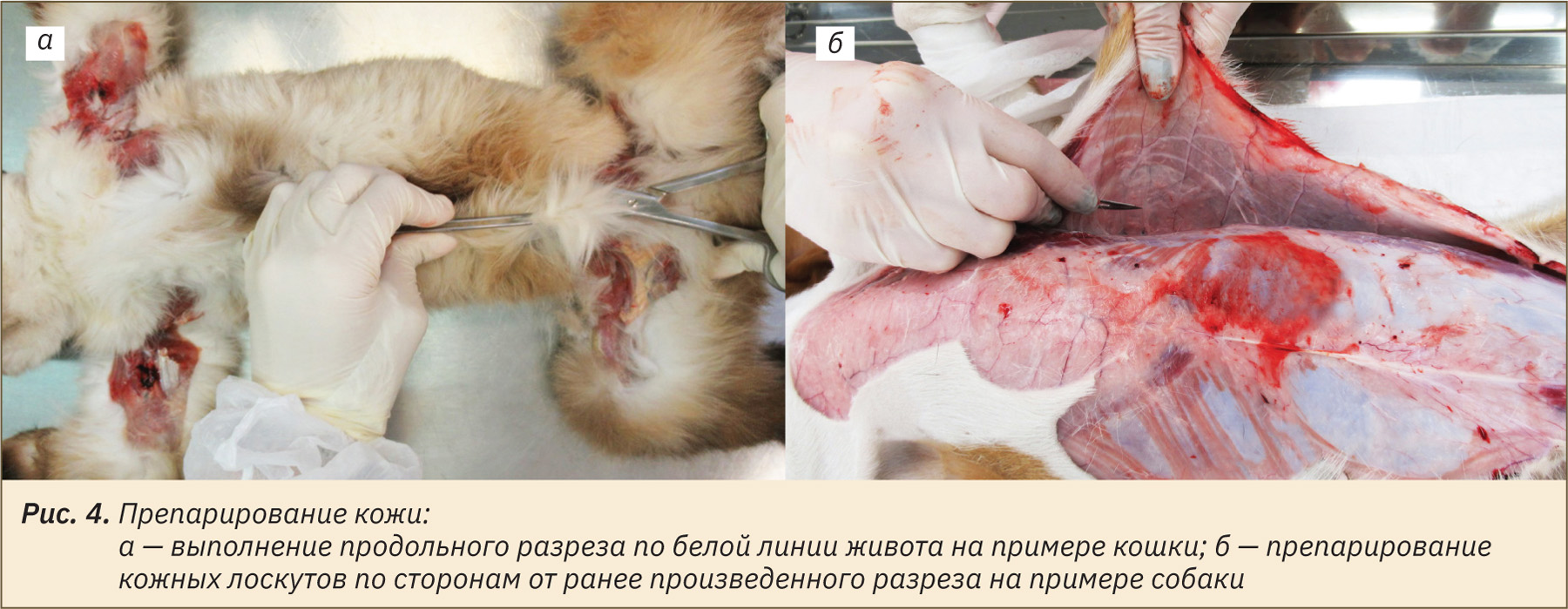
Для удобства некропсии сначала необходимо отпрепарировать кожу. Для этого нужно захватить и приподнять кожу с подлежащим подкожным слоем в каудальной части живота, как показано на рис. 4, а, надрезать ее и сделать продольный разрез по белой линии живота до нижней челюсти, не повредив брюшную стенку. Далее отпрепарировать кожу по сторонам от ранее произведенного продольного разреза (рис. 4, б).
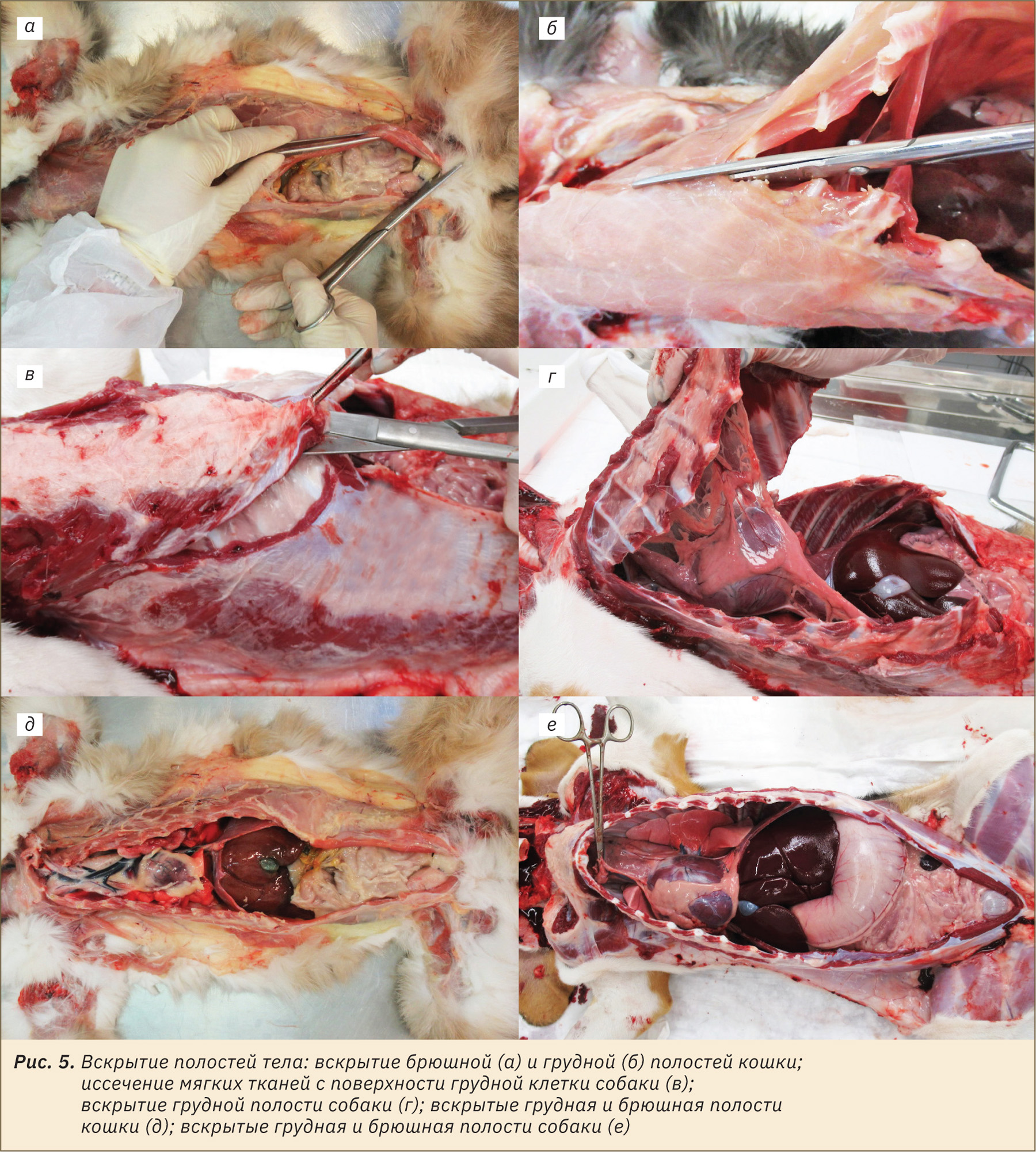
Для вскрытия брюшной полости сделать разрез мышечной стенки от паха вдоль белой линии живота, приподняв участок брюшной стенки (рис. 5, а). Данный разрез следует делать аккуратно, погружая тупоконечную часть ножниц в брюшную полость, чтобы не повредить внутренние органы. При необходимости исследования мочи провести ее отбор при помощи шприца из мочевого пузыря.
Для удобства вскрытия грудной полости иссечь мягкие ткани в области грудной клетки (особенно у собак), как показано на рис. 5, в. Грудную полость необходимо вскрыть двумя разрезами (слева и справа) по бокам от грудины косо краниально, перерезая ребра и мягкие ткани (рис. 5, б, г). В качестве инструментов можно использовать пилу, костные щипцы-кусачки, ножницы. Аккуратно отделяя плевру и перикард, удалить грудную кость.
Извлечение органов в области шеи и нижней челюсти
Топография нижнечелюстных лимфатических узлов и подчелюстных слюнных желез кошки и собаки и их извлечение изображены на рис. 6, а–г.
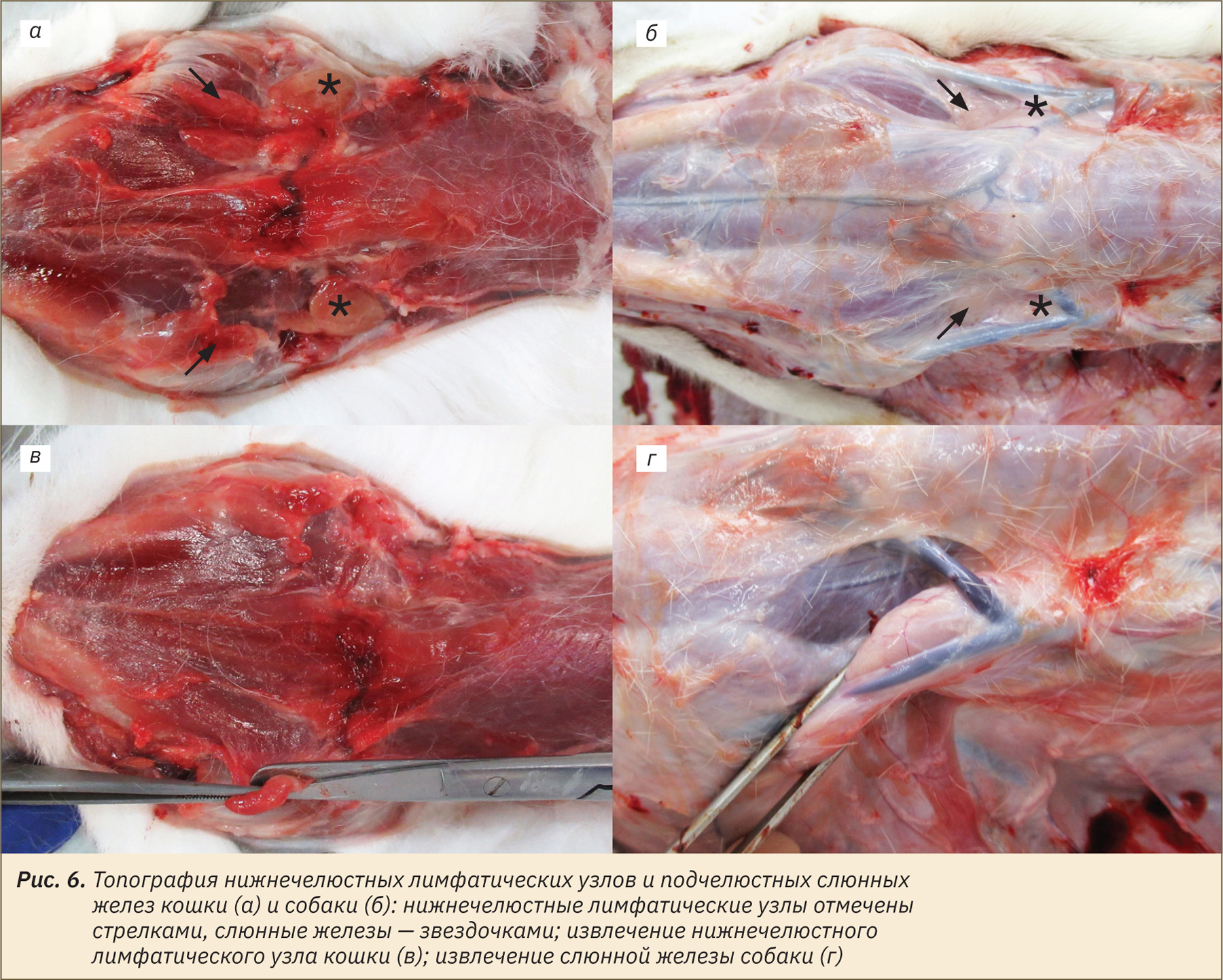
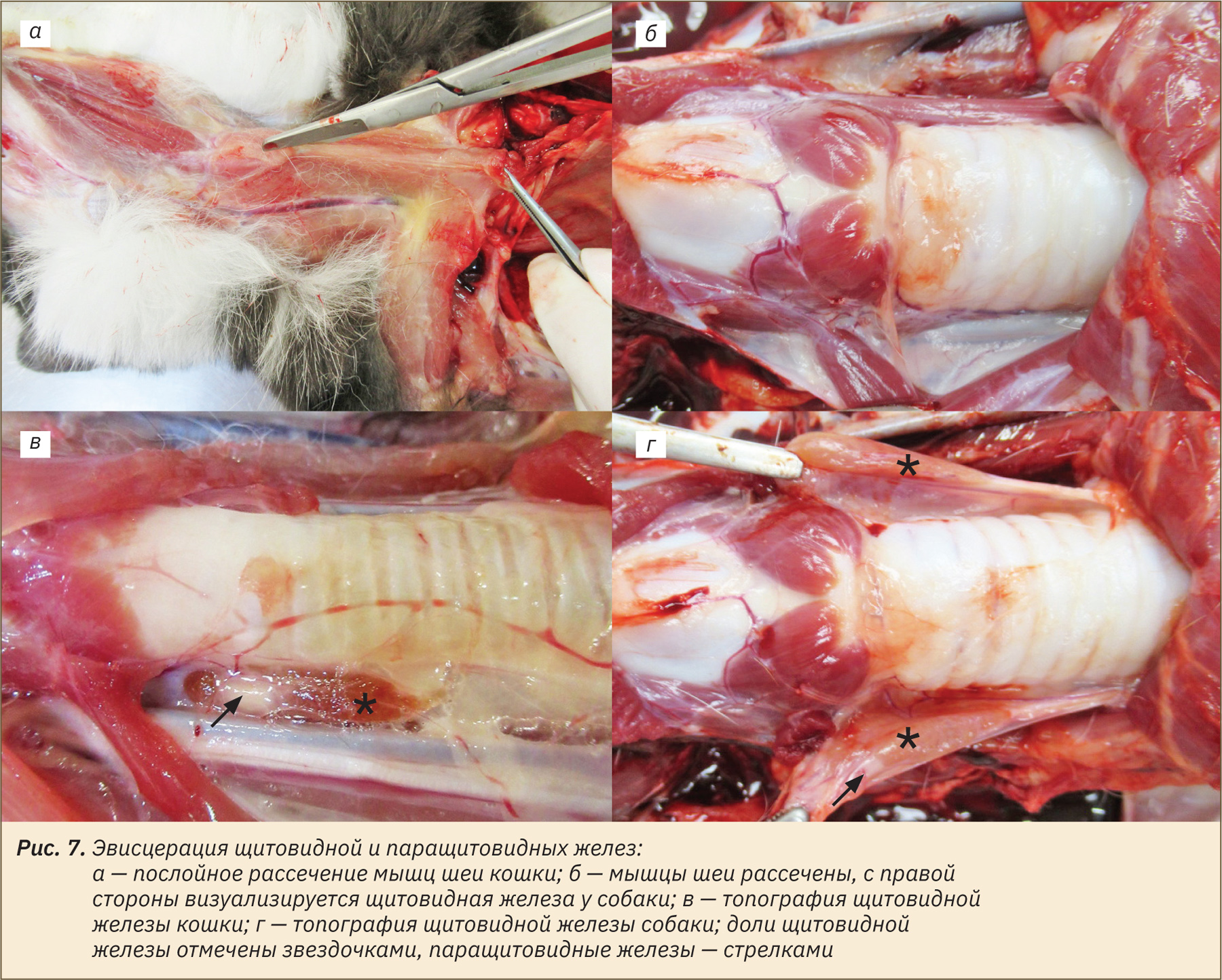
Далее совместно выделяют щитовидную и паращитовидные железы, для этого необходимо послойно рассечь мышцы шеи, лежащие над трахеей (рис. 7, а–г).
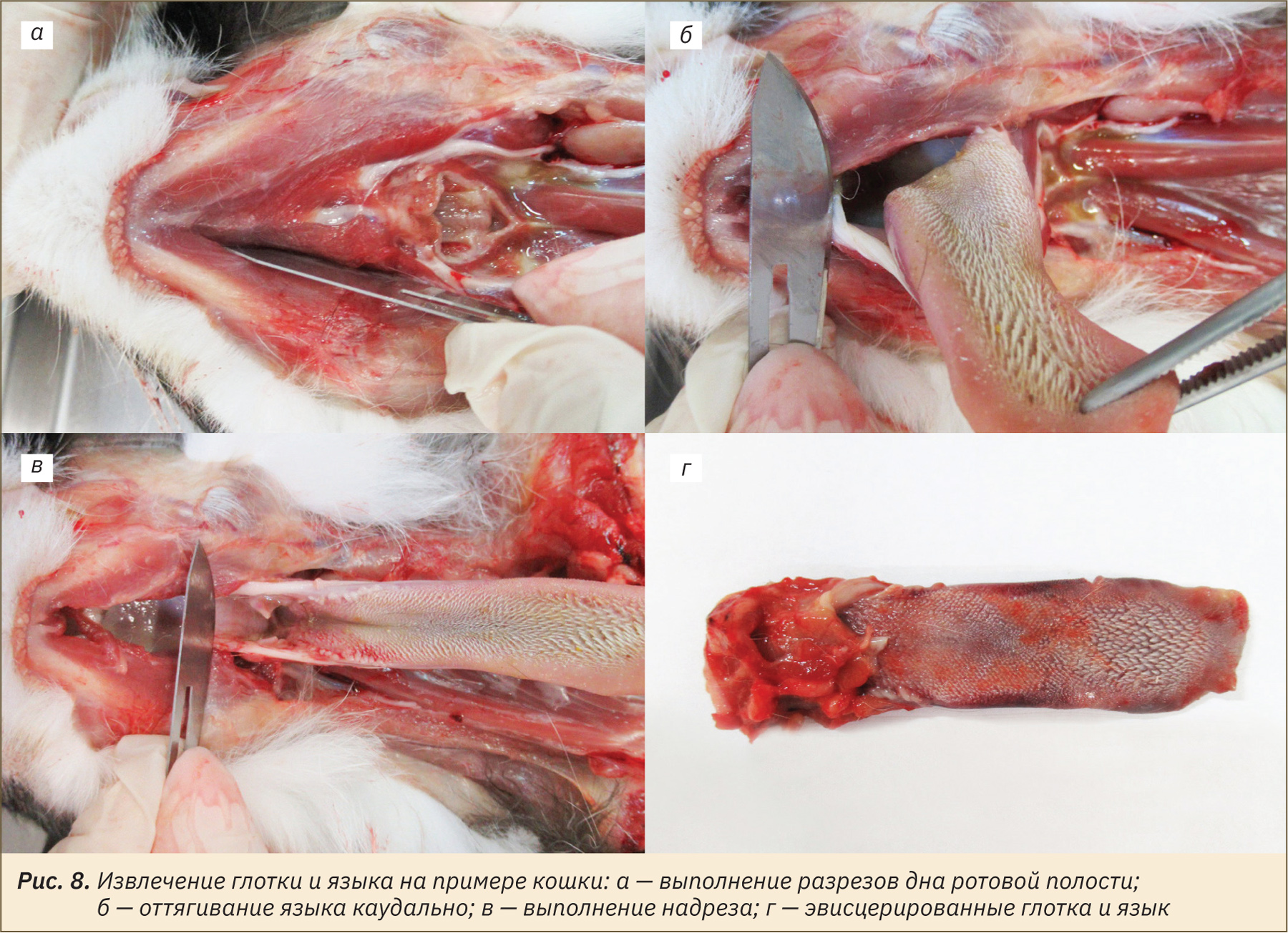
Для извлечения языка и глотки сделать разрезы дна ротовой полости скальпелем, как продемонстрировано на рис. 8, а. После этого захватить отпрепарированные мышцы и язык и оттянуть каудально (рис. 8, б). Далее сделать надрез в области твердого нёба у входа в глотку, сохранив целостность глотки (рис. 8, в). Извлечь язык с глоткой (рис. 8, г).
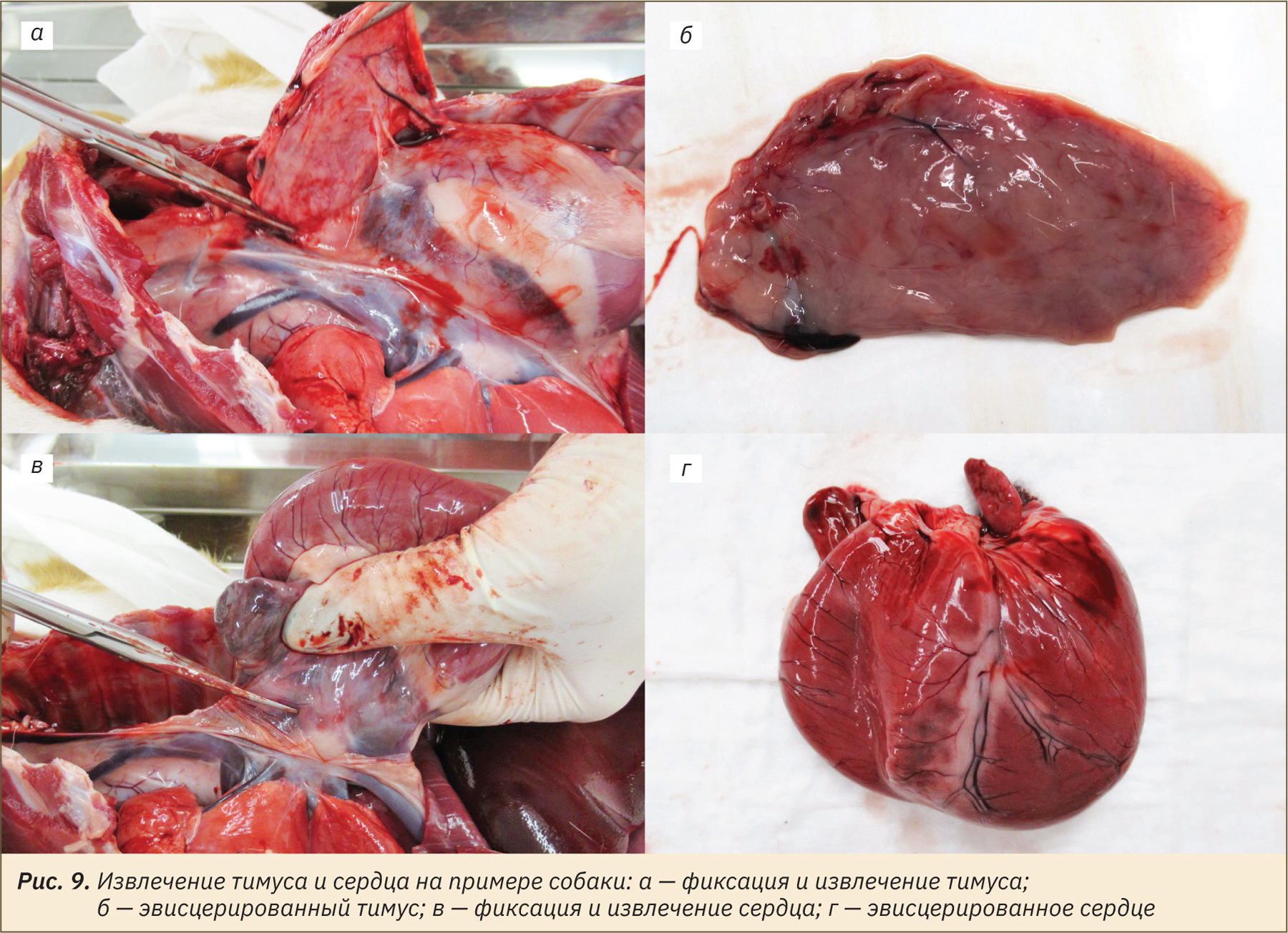
Извлечение органов грудной полости
Сначала извлечь грудную долю тимуса, расположенную в прекардиальном средостении (рис. 9, а, б). Далее извлечь сердце, вскрыв перикардиальную полость и перерезав удерживающие его сосуды (рис. 9, в, г).
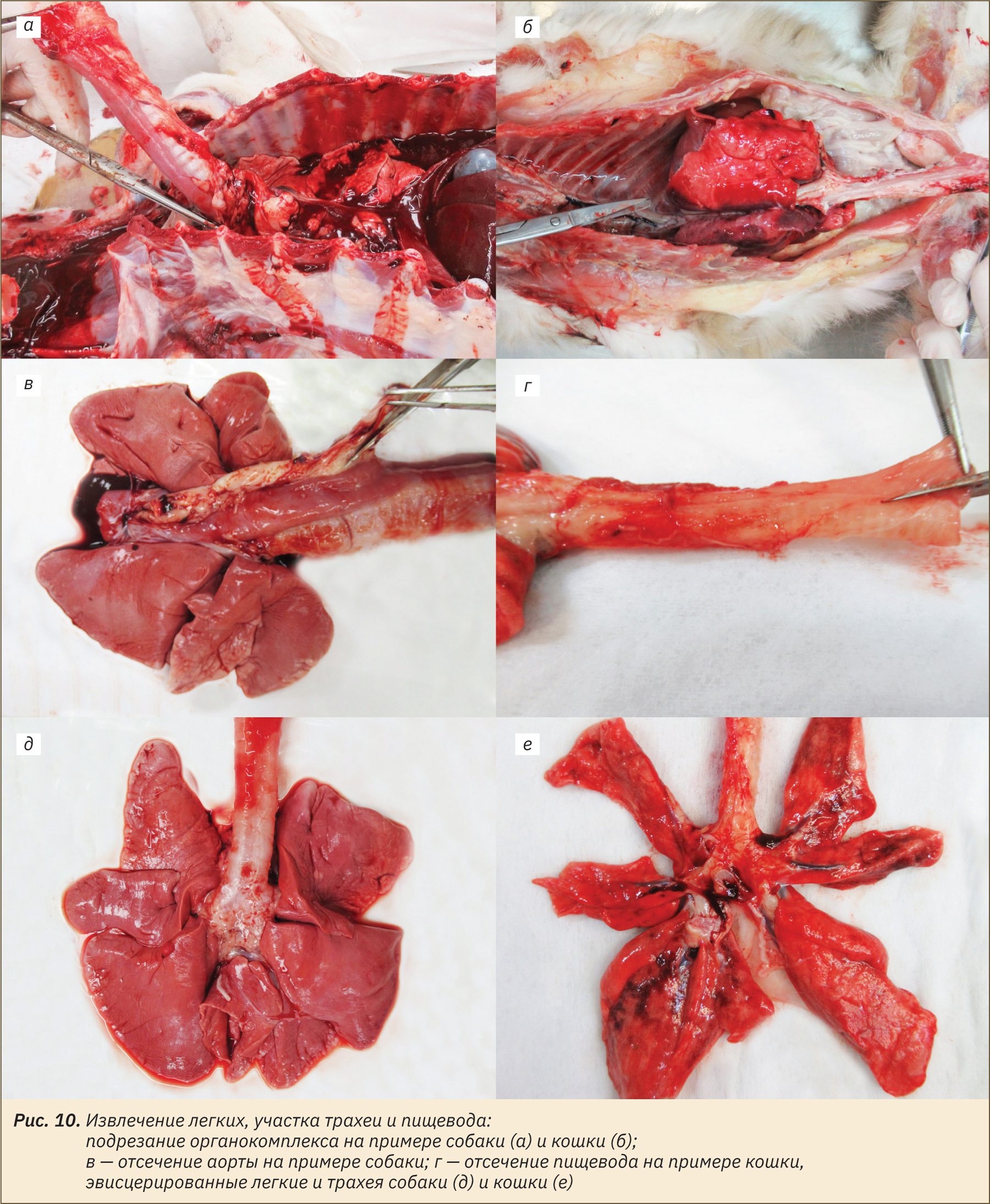
Для извлечения легких, участка трахеи и пищевода перерезать зафиксированные пинцетом трахею, пищевод в области шеи, оттянуть их каудально, при необходимости помогая надрезами по линии позвоночного столба (рис. 10, а, б). Далее перерезать аорту и пищевод в области диафрагмы и извлечь органокомплекс. Отделить пищевод и аорту от легких (рис. 10, в, г), освободить легкие от остатков перикарда и жировой ткани. Эвисцерированные легкие изображены на рис. 10, д, е.
Извлечение органов брюшной полости
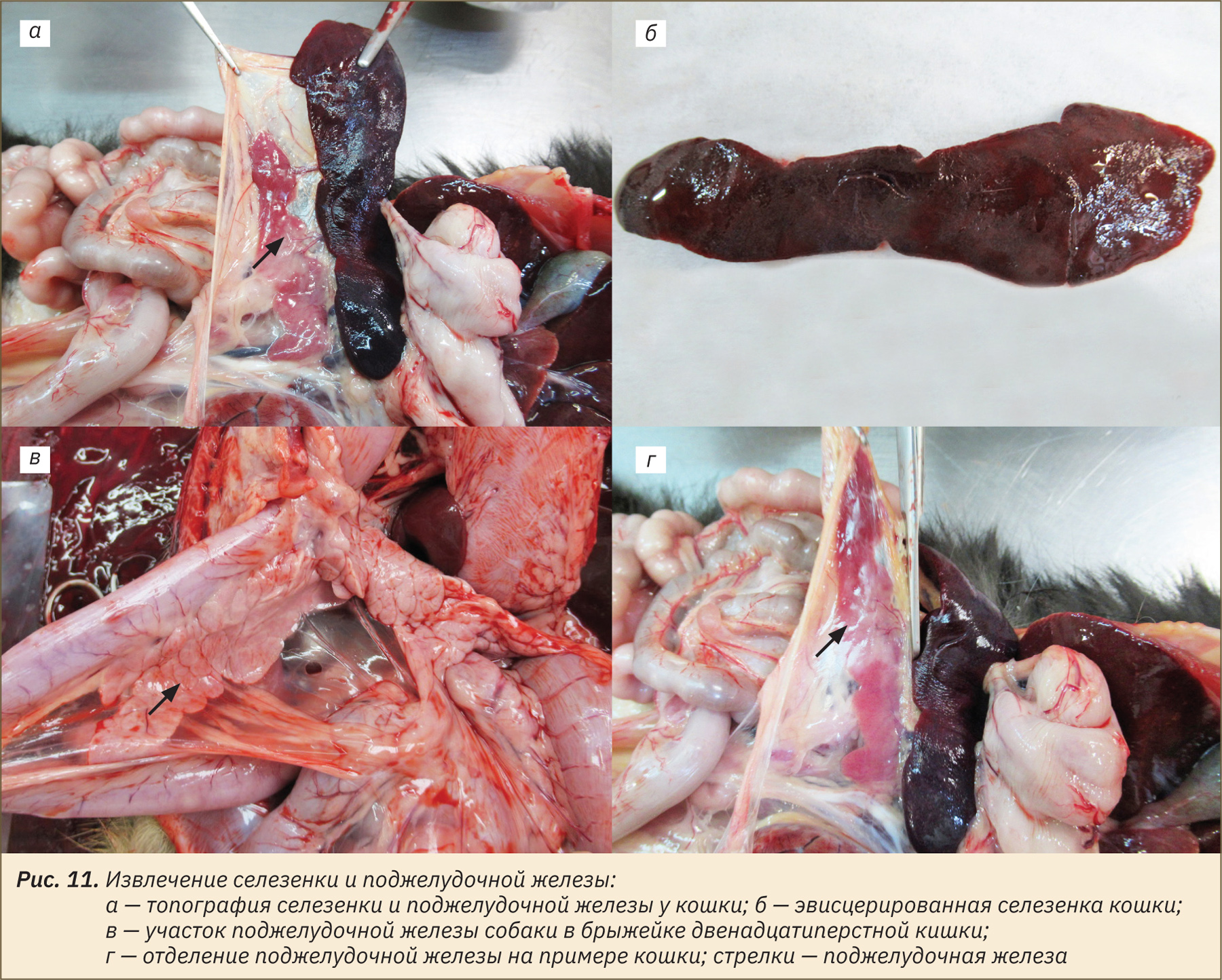
Сначала извлечь селезенку, расположенную в левой подреберной области живота, отделив от нее сосуды, связки и брыжейки (рис. 11, а, б). Далее извлечь участок поджелудочной железы, лежащей в брыжейке двенадцатиперстной кишки и большом сальнике (рис. 11, в, г).
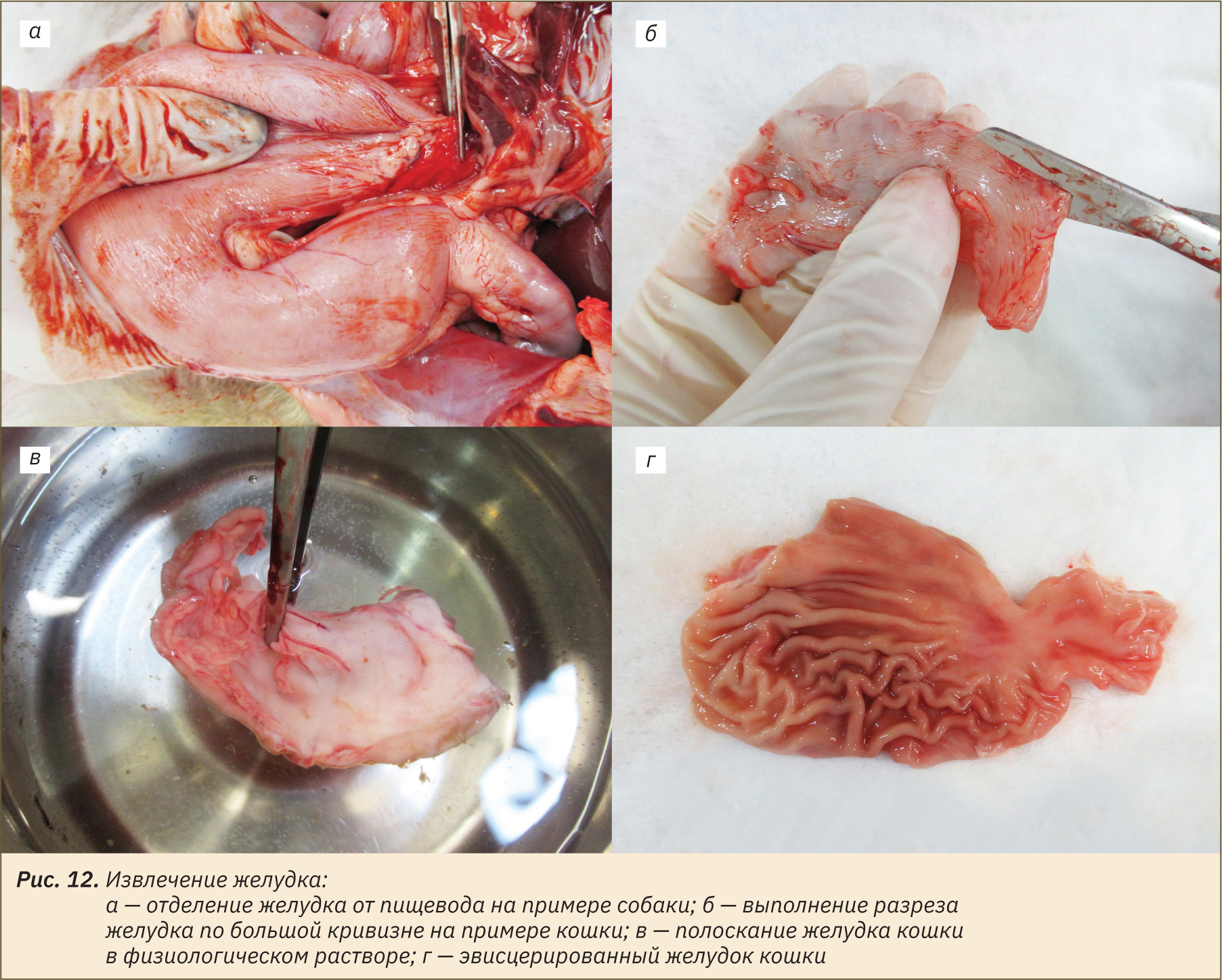
На следующем этапе эвисцерировать желудок, отделив его в краниальной части от пищевода, а в каудальной от двенадцатиперстной кишки (рис. 12, а). Сделать разрез желудка по большой кривизне и прополоскать его в физиологическом растворе, освободив от содержимого (рис. 12, б, в). Следует обратить внимание на то, что после вскрытия желудка нельзя прикасаться к его слизистой оболочке, для промывания захватить его пинцетом со стороны серозной оболочки. Вскрытый желудок изображен на рис. 12, г.
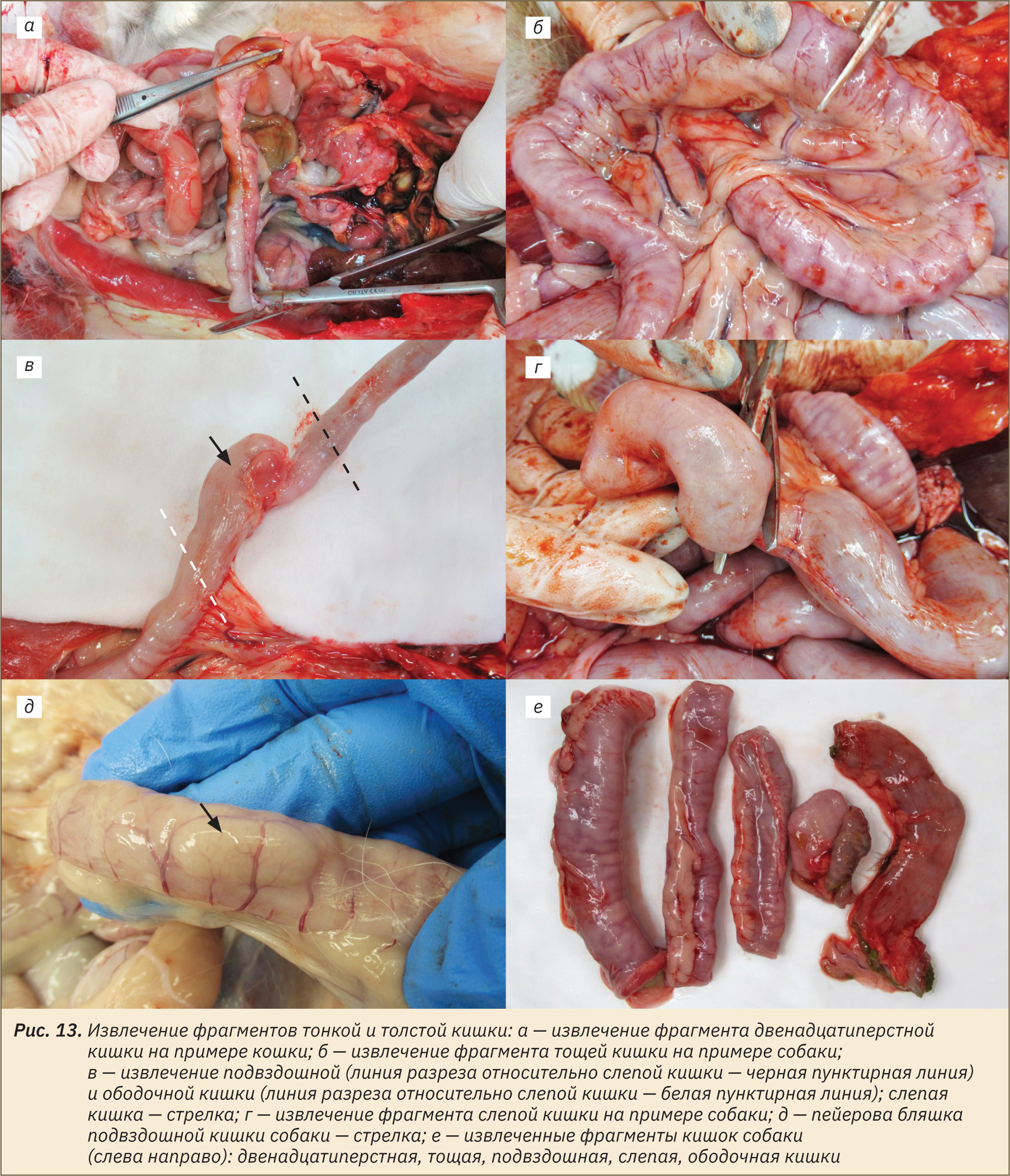
Далее извлечь фрагменты тонкой и толстой кишки длиной 4–5 см: двенадцатиперстную, отступив от желудка пару сантиметров, тощую — на любом участке, ориентируясь на брыжейку тощей кишки, подвздошную, отступив от слепой кишки краниально пару сантиметров, слепую — фрагмент в области верхушки, ободочную, отступив пару сантиметров каудально от слепой кишки (рис. 13, а–г). При необходимости отобрать участок подвздошной кишки с пейеровой бляшкой (рис. 13, д).
Для эвисцерации печени совместно с желчным пузырем перерезать связки, удерживающие орган (рис. 14, а, б). После взвешивания отобрать по кусочку размером около 3×3 см от каждой доли, а также долю, к которой прилежит желчный пузырь.
Далее извлечь надпочечники и отделить от окружающей жировой ткани (рис. 14, в). У собак левый надпочечник бобовидной формы, а правый удлиненно-сердцевидной формы, у кошки они удлиненно-овальной формы. После этого эвисцерировать почки, не нарушая целостность фиброзной капсулы, и отделить от них окружающую жировую ткань (рис. 14, г).
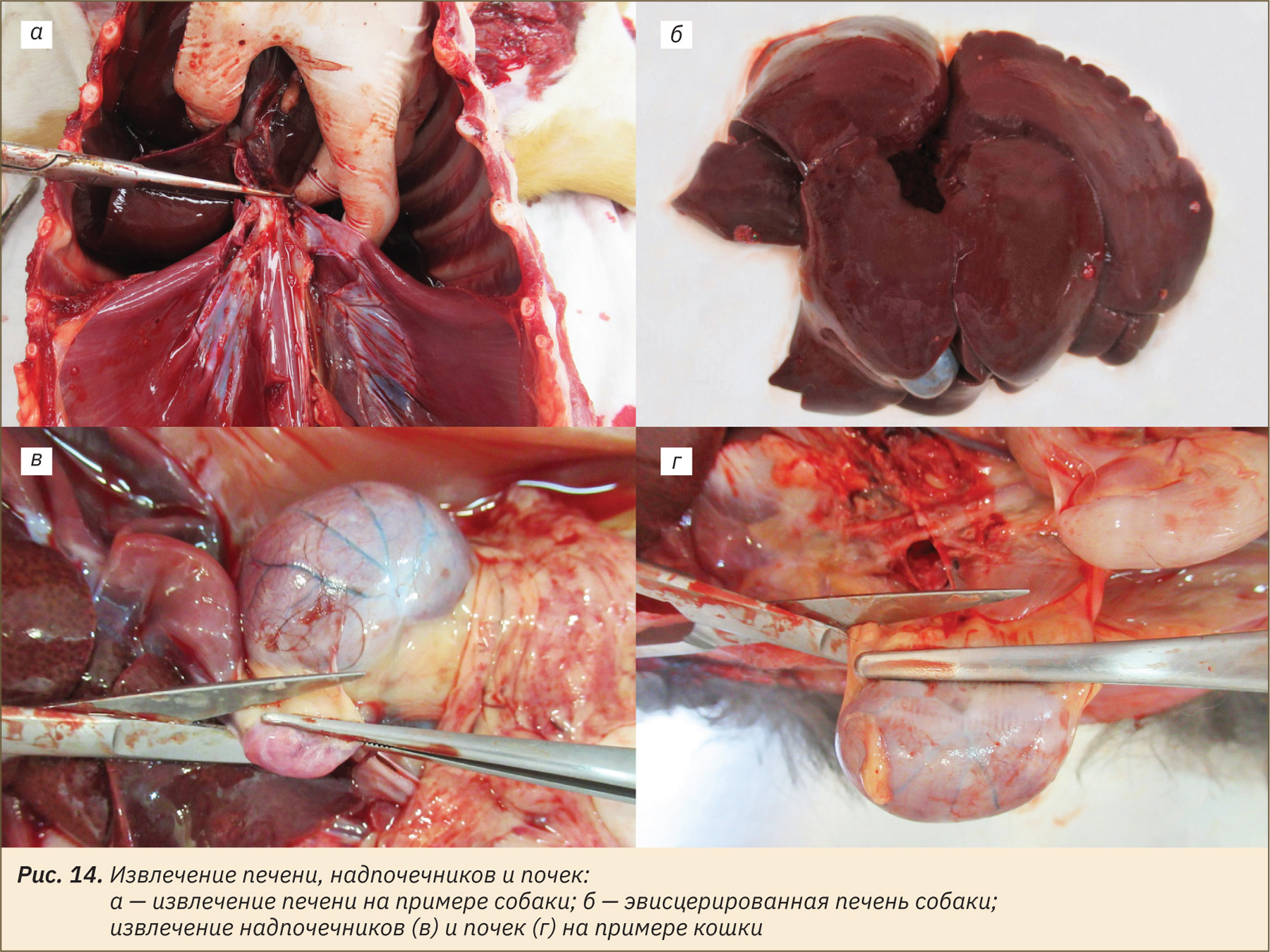
Извлечение мочевого пузыря и половых органов самцов и самок
У самок извлечь мочевой пузырь, перерезав шейку пузыря (рис. 15, а). У самцов удобнее извлекать мочевой пузырь совместно с предстательной железой, находящейся на его шейке, при необходимости убрать участок лонной кости с помощью костных щипцов-кусачек или пилы (рис. 15, б). Обратите внимание! Из добавочных половых желез у кобеля имеется только предстательная железа, у кота — предстательная железа и бульбоуретральные железы. Для эвисцерации семенников и придатков семенников разрезать мошонку, фасции и влагалищную оболочку, извлечь семенники и придатки семенников, перерезав семенной канатик (рис. 15, в, г). Отделить органы друг от друга (рис. 15, д).
У самок извлечь яичники, рога матки, матку и влагалище (рис. 15, е–з). Для удобства извлечения влагалища убрать участок лонной кости так же, как у самцов при эвисцерации мочевого пузыря совместно с предстательной железой (см. рис. 15, ж).
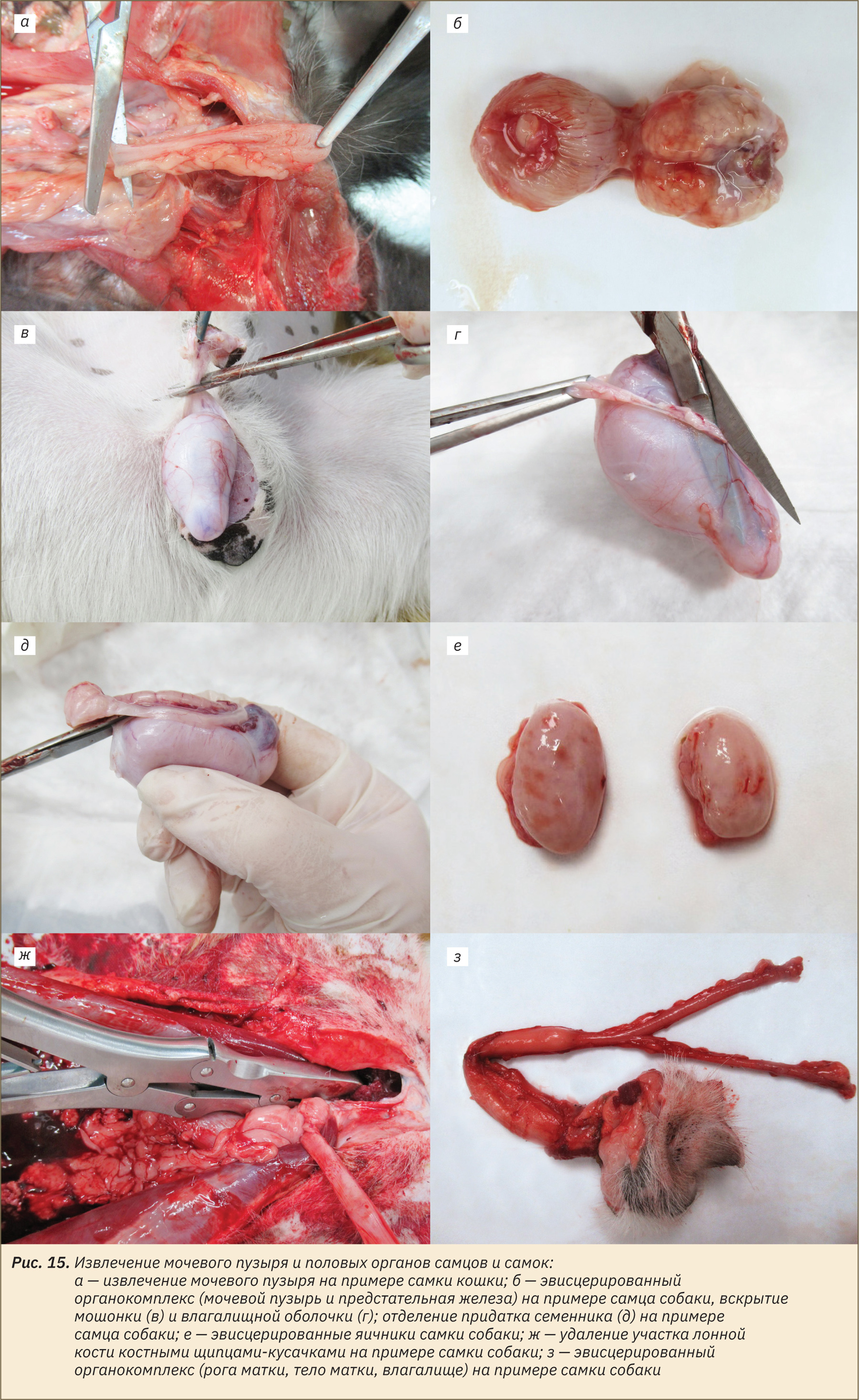
Извлечение скелетной мышцы и периферического нерва (на примере мышц бедра и седалищного нерва), бедренной кости
Для данной манипуляции необходимо сделать глубокий разрез кожи с латеральной поверхности бедра, отпрепарировать кожу и фасции, раздвинуть мышцы, обнажив нерв. Извлечь скелетную мышцу и нерв (рис. 16, а, б). Далее продолжить срезать прилегающие к бедренной кости мышцы, а также связки тазобедренного и бедроберцового сустава (рис. 16, в). Очистить кость от мягких тканей (рис. 16, г). У собак укоротить кость на середине ее длины, сохранив один из эпифизов. Таким образом, дальнейшему исследованию подлежит костная и хрящевая ткань, костный мозг, который выделяется из трубчатой кости при вырезке органов.
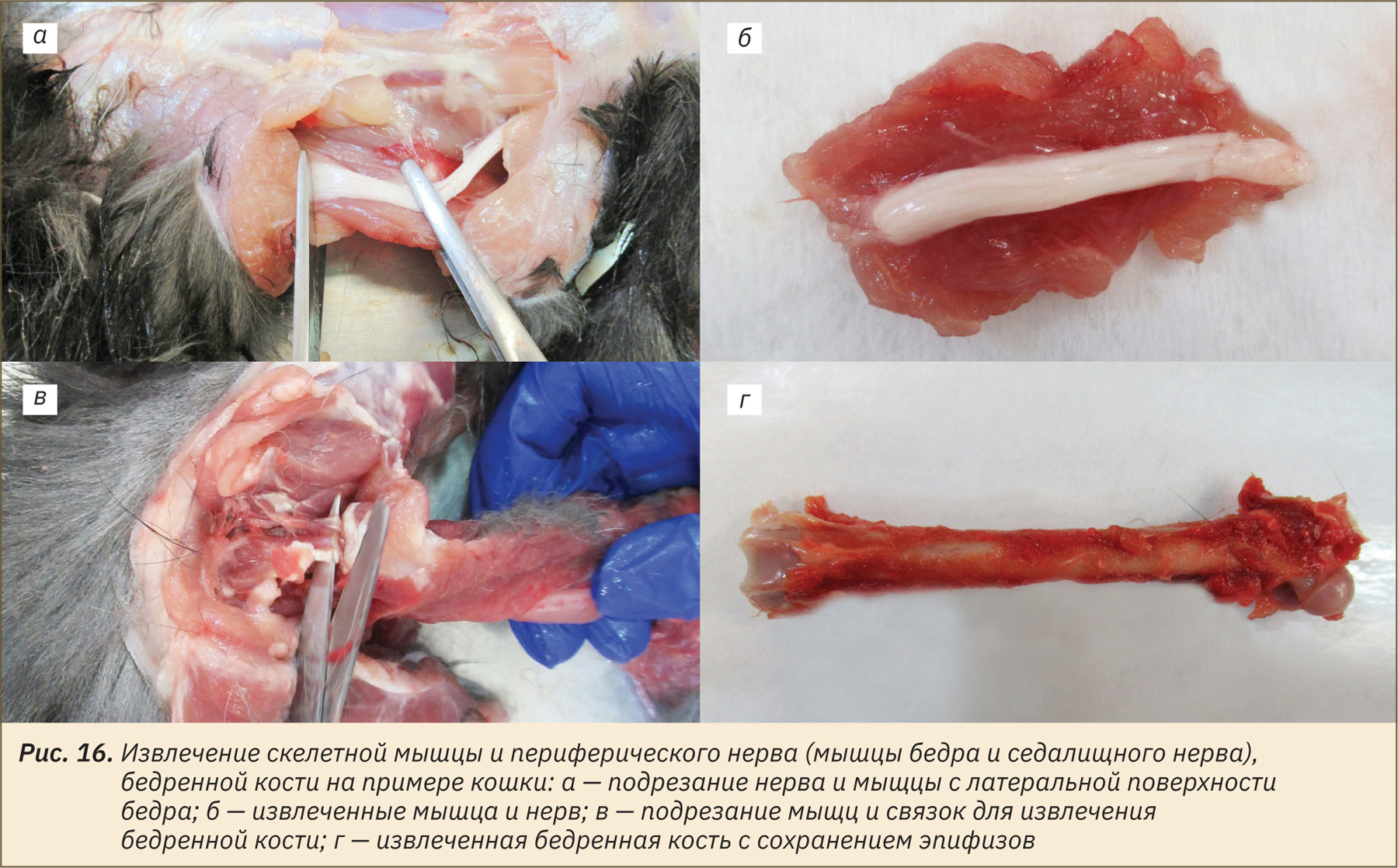
Извлечение слезной железы третьего века, глазных яблок и зрительных нервов
Визуализация слезной железы третьего века происходит благодаря оттягиванию третьего века наружу (рис. 17, а). Необходимо выполнить разрез по окружности железы и эвисцерировать ее (рис. 17, б).
Для извлечения глазных яблок сделать круговой надрез кожи вокруг орбит (рис. 17, в). Далее, удерживая подлежащие глазу ткани пинцетом, постепенно надрезать их, извлекая глазное яблоко и зрительный нерв (рис. 17, г). Удалить мягкие ткани по окружности глазных яблок (рис. 17, д). Эвисцерированный глаз со зрительным нервом изображены на рис. 17, е.
Отсечение костей лица для дальнейшего исследования носовых ходов и синусов
Отсечение костей лица с носовыми ходами и синусами произвести с помощью пилы после удаления мягких тканей с верхней челюсти и носовых костей. Далее произвести поперечный распил на уровне нижнего края орбит (рис. 18, а, б).
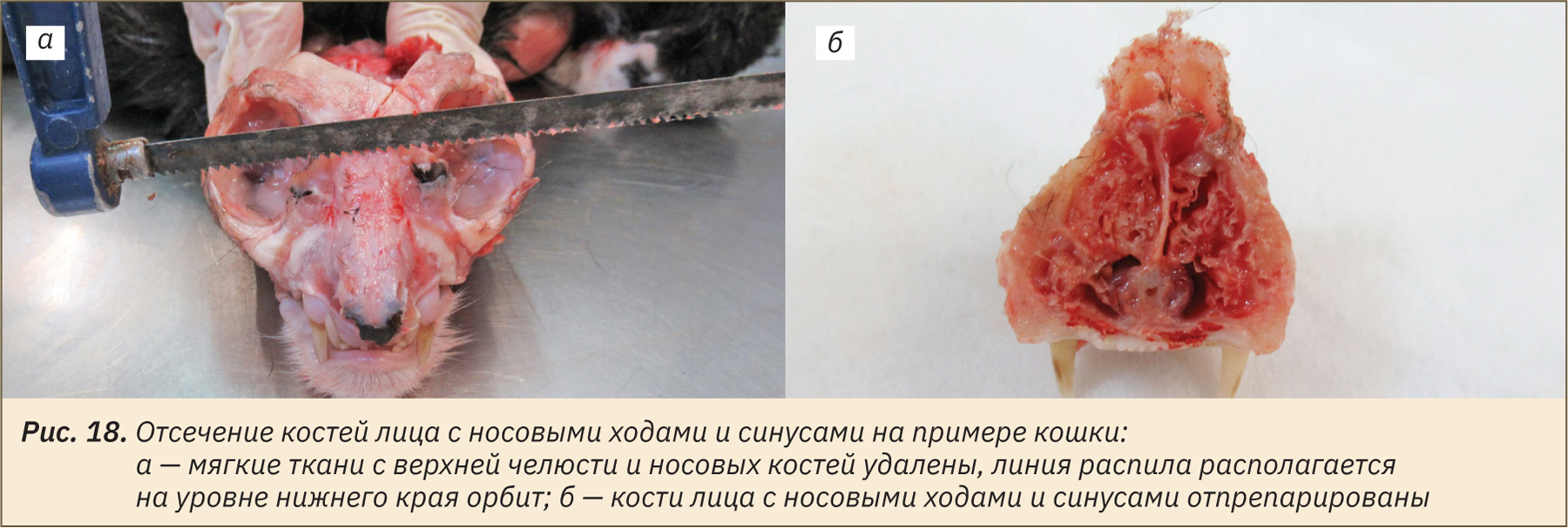
Извлечение головного мозга и гипофиза
Извлечение головного мозга осуществляется следующим образом. Сначала необходимо срезать кожу и подлежащие мягкие ткани от затылка до спинки носа (рис. 19, а). Сделать круговой распил по затылочным, лобным и височным костям черепа, соединив их на большом отверстии затылочной кости (рис. 19, б–г). Распилы удобно делать пилой или гравером с установленной насадкой-диском. После выполнения распилов удалить образованную «крышку» черепа, аккуратно отделить твердую мозговую оболочку и извлечь головной мозг в наклонном положении, перерезая черепные нервы (рис. 19, д, е).
Гипофиз визуализируется после извлечения головного мозга, он располагается в гипофизарной ямке клиновидной кости (рис. 19, ж). Подрезать диафрагму седла (у собак она довольно плотная) и аккуратно извлечь орган (рис. 19, з).
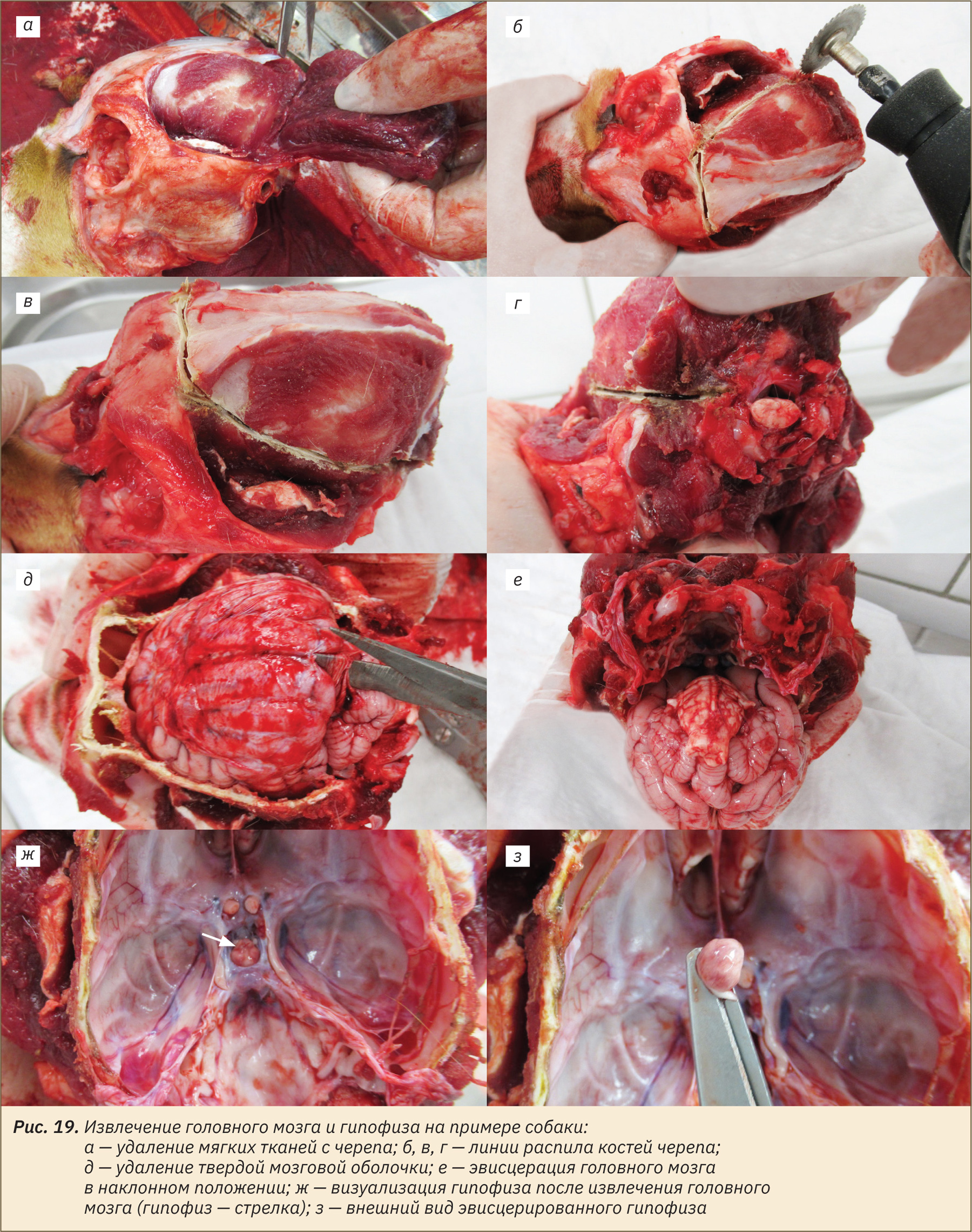
Извлечение спинного мозга
При необходимости, предусмотренной планом исследования, извлечь спинной мозг в определенном отделе позвоночника. Для извлечения спинного мозга со стороны вскрытой грудной полости разрезать кожу и межреберные мышцы до позвоночного столба (рис. 20, а), произвести перпендикулярный распил позвоночника до позвоночного канала, далее от места распила удалить тела последующих грудных позвонков на протяжении 3–5 см, направляя ножницы параллельно позвоночнику (рис. 20, б). Таким образом, станет виден спинной мозг. Далее надрезать участок спинного мозга с двух сторон и аккуратно его извлечь (рис. 20, в). Можно воспользоваться другим способом. Для извлечения спинного мозга необходимо рассечь вдоль позвоночника кожу, мышцы спины, максимально очистив позвоночный столб от мягких тканей, пересечь поперечные и остистые отростки позвонков, а затем произвести распилы костной ткани в области ножек дужек позвонков, открывая доступ к позвоночному каналу. Извлечь спинной мозг, перерезав его с двух сторон.
Заключение
Предложенная методика позволяет произвести полное и последовательное вскрытие лабораторных животных для детального исследования всех полостей, систем органов, органов, тканей и различных частей тела животного, тем самым обеспечить воспроизводимость этапов некропсии от эксперимента к эксперименту. Придерживаясь данной методики, можно извлечь все необходимые органы и ткани, предусмотренные планом исследования, сохранив их целостность, пригодную для дальнейшего исследования, минимизировать потенциальные повреждения и избежать загрязнения материала, исключив, таким образом, возможность возникновения некоторых артефактов при изготовлении гистологического среза, эффективно использовать рабочее время.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Е.A. Лосева — проведение некропсии, фотофиксация, сбор и систематизация материала, написание и редактирование текста статьи, подготовка фотоматериалов для статьи, ответственность за все аспекты работы.
А.И. Савватейкина — проведение некропсии, фотофиксация, сбор и систематизация материала, написание и редактирование отдельных разделов статьи, подготовка фотоматериалов для статьи.
Ж.Ю. Устенко — планирование исследования, написание и редактирование текста статьи, решение вопросов, связанных с достоверностью данных и целостностью всех частей статьи, критический пересмотр текста.
Е.В. Беляева — идея, концепция и дизайн исследования, написание и редактирование текста статьи, критический пересмотр текста.
Я.А. Гущин — написание и редактирование текста статьи, критический пересмотр текста и одобрение окончательного варианта рукописи для публикации.
- Рекомендация коллегии Евразийской экономической комиссии от 21 мая 2020 г. № 10 «О Руководстве по проведению доклинических исследований токсичности при повторном (многократном) введении действующих веществ лекарственных препаратов для медицинского применения». [Rekomendaciya kollegii Evrazijskoj e’konomicheskoj komissii ot 21 maya 2020 g. № 10 “O Rukovodstve po provedeniyu doklinicheskix issledovanij toksichnosti pri povtornom (mnogokratnom) vvedenii dejstvuyushhix veshhestv lekarstvenny’x preparatov dlya medicinskogo primeneniya”. (In Russ.)].
- Директива 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. [Direktiva 2010/63/EU Evropejskogo parlamenta i Soveta Evropejskogo soyuza ot 22 sentyabrya 2010 g. po oxrane zhivotny’x, ispol’zuemy’x v nauchny’x celyax. (In Russ.)].
Список источников
-
Starkey M.P., Scase T.J., Mellersh C.S., Murphy S. Dogs really are man’s best friend-canine genomics has applications in veterinary and human medicine! // Brief. Funct. Genomic Proteomic. 2005. Vol. 4. N. 2. P. 112–128. DOI: 10.1093/bfgp/4.2.112.
-
Pellegatti M. Dogs and monkeys in preclinical drug development: the challenge of reducing and replacing // Expert Opin. Drug Metab. Toxicol. 2013. Vol. 9. N. 9. P. 1171–1180. DOI: 10.1517/17425255.2013.804061.
-
Макарова М.Н. Кошки в лабораторных исследованиях. Обзор литературы // Лабораторные животные для научных исследований. 2021. № 1. С. 86–104. [Makarova M.N. Koshki v laboratorny’x issledovaniyax. Obzor literatury’ // Laboratorny’e zhivotny’e dlya nauchny’x issledovanij. 2021. N. 1. P. 86–104. (In Russ.)]. DOI: 10.29296/2618723X-2021-01-09.
-
Löscher W. Dogs as a Natural Animal Model of Epilepsy // Front. Vet. Sci. 2022. Vol. 9. N. 928009. DOI: 10.3389/fvets.2022.928009.
-
Tellegen A.R., Dessing A.J., Houben K. at al. Dog as a Model for Osteoarthritis: The FGF4 Retrogene Insertion May Matter // J. Orthop. Res. 2019. Vol. 37. N. 12. P. 2550–2560. DOI: 10.1002/jor.24432.
-
Gonçalves N.N., Ambrósio C.E., Piedrahita J.A. Stem cells and regenerative medicine in domestic and companion animals: a multispecies perspective // Reprod. Domest. Anim. 2014. Vol. 49. N. s4. P. 2–10. DOI: 10.1111/rda.12392.
-
Kol A., Arzi B., Athanasiou K.A., Farmer D.L. at al. Companion animals: Translational scientist’s new best friends // Sci. Transl. Med. 2015. Vol. 7. N. 308. P. 308ps21. DOI: 10.1126/scitranslmed.aaa9116.
-
Moshref M., Tangey B., Gilor C. at al. Concise Review: Canine Diabetes Mellitus as a Translational Model for Innovative Regenerative Medicine Approaches // Stem Cells Transl. Med. 2019. Vol. 8. N. 5. P. 450–455. DOI: 10.1002/sctm.18-0163.
-
Жаров А.В., Иванов И.В., Стекольников А.П. Вскрытие и патоморфологическая диагностика болезней животных. Учебники и учеб. пособия для высш. учеб. заведений / Под ред. А.В. Жарова. Москва: Колос, 2000. 400 с. [Zharov A.V., Ivanov I.V., Stekol’nikov A.P. Vskrytie i patomorfologicheskaya diagnostika boleznei zhivotnykh. Uchebniki i ucheb. posobiya dlya vyssh. ucheb. zavedenii / Pod red. A.V. Zharova. Moskva: Kolos, 2000. 400 p. (In Russ.)].
-
Кудряшов А.А., Балабанова В.И. Патологоанатомическая диагностика болезней собак и кошек. Учебное пособие / А.А. Кудряшов. Санкт-Петербург: НОУ ДО «Институт Ветеринарной Биологии». 2011. 220 с. [Kudryashov A.A., Balabanova V.I. Patologoanatomicheskaya diagnostika boleznei sobak i koshek. Uchebnoe posobie / A.A. Kudryashov. Sankt-Peterburg: NOU DO “Institut Veterinarnoi Biologii”. 2011. 220 p. (In Russ.)].
-
Беляева Е.В., Устенко Ж.Ю., Гущин Я.А. Методика вскрытия и извлечения органов лабораторных животных. Сообщение 6: карликовые свиньи // Лабораторные животные для научных исследований. 2019. № 4. С. 55–77. [Belyaeva E.V., Ustenko J.U., Guschin Ya.A. Metodika vskry’tiya i izvlecheniya organov laboratorny’x zhivotny’x. Soobshhenie 6: karlikovy’e svin’i // Laboratorny’e zhivotny’e dlya nauchny’x issledovanij. 2019. N. 4. P. 55–77. (In Russ.)]. DOI:10.29296/2618723X-2019-04-08.
-
Рекомендации по проведению некропсии лабораторных животных: монография / Под ред. В.Г. Макарова и М.Н. Макаровой. Санкт-Петербург: НПО «ДОМ ФАРМАЦИИ». 2023. 92 с. [Rekomendatsii po provedeniyu nekropsii laboratornykh zhivotnykh: monografiya / Pod red. V.G. Makarova i M.N. Makarovoi. Sankt-Peterburg: NPO “DOM FARMATSII”. 2023. 92 p. (In Russ.)].
-
Зеленевский Н.В. Анатомия животных: учебное пособие для вузов / Н.В. Зеленевский, К.Н. Зеленевский. 2-е, испр. Санкт-Петербург: Лань, 2022. 848 с. [Zelenevskii N.V. Anatomiya zhivotnykh: uchebnoe posobie dlya vuzov / N.V. Zelenevskii, K.N. Zelenevskii. 2-e, ispr. Sankt-Peterburg: Lan’, 2022. 848 p. (In Russ.)].
- Зеленевский Н.В. Международная ветеринарная анатомическая номенклатура на латинском и русском языках. Nomina Anatomica Veterinaria: справочник / Н.В. Зеленевский. Санкт-Петербург: Лань, 2022. 400 с. [Zelenevskii N.V. Mezhdunarodnaya veterinarnaya anatomicheskaya nomenklatura na latinskom i russkom yazykakh. Nomina Anatomica Veterinaria: spravochnik / N.V. Zelenevskii. Sankt-Peterburg: Lan’, 2022. 400 p. (In Russ.)].




