Некоторые видовые особенности анатомии гепатобилиарной системы и состава желчи у лабораторных животных
Работа выполнена без спонсорской поддержки.
Султанова К.Т., Мирошников М.В., Крышень К.Л. Некоторые видовые особенности анатомии гепатобилиарной системы и состава желчи у лабораторных животных. Лабораторные животные для научных исследований. 2023; 3. https://doi.org/10.57034/2618723X-2023-03-08
Резюме
Желчные кислоты являются важными сигнальными молекулами, принимающими участие в регуляции метаболизма липидов, глюкозы, поддержании метаболического и энергетического гомеостаза. В качестве модельных организмов в фармакодинамических исследованиях используют мышей, крыс, морских свинок и кроликов. Это связано с доступностью данных животных, экономической выгодой и анатомическими особенностями гепатобилиарной системы. Заметные различия в составе желчных кислот между лабораторными животными и людьми могут играть важную роль и способны снижать трансляционную ценность данных, полученных с использованием той или иной тест-системы. Выбор определенного вида животного для фармакодинамических исследований потенциальных терапевтических агентов должен быть обусловлен несколькими факторами, к числу которых можно отнести анатомо-физиологическое сходство гепатобилиарной системы и биохимические особенности желчи. Именно эти факторы являются основополагающими при изучении новых фармакологических агентов и интерпретации полученных данных.
Цель обзора — сравнение некоторых видовых анатомо-физиологических особенностей гепатобилиарной системы, а также освещение основных аспектов продукции желчи и метаболизма желчных кислот у наиболее часто используемых лабораторных животных (мыши, крысы, морские свинки и кролики) как между собой, так и с таковыми у человека. Мыши и крысы являются достаточно распространенными тест-системами, однако наличие мурихолевых кислот ограничивает их трансляционность. Кроме того, небольшой размер тела мышей может вызвать трудности в оперативных манипуляциях, связанных с процедурой отбора желчи. Использование крыс в отличие от мышей таких трудностей не вызывает, однако у них отсутствует желчный пузырь, что обусловливает анатомическое различие с гепатобилиарной системой человека. Кролик обладает оптимальным размером тела и анатомическим сходством билиарной системы с таковой у человека, однако количественное преобладание биливердина и дезоксихолевой кислоты — фактор, обусловливающий отличия от человека. У морской свинки также оптимальный размер тела и анатомическое сходство с гепатобилиарной системой человека, высокая скорость холереза и в целом схожий состав желчных кислот, для нее разработано достаточное количество экспериментальных модельных патологий. Описанные качества лабораторных животных, сопоставимость или отличия от таковых у человека указывают на необходимость обоснованного выбора релевантной тест-системы с учетом особенностей каждой из них.
Введение
Желчные кислоты — это органические кислоты, входящие в состав желчи, которые выполняют несколько функций в организме, включая стимулирование оттока, выведение желчи и содействие всасыванию жиров и жирорастворимых витаминов в кишечнике [1, 2]. Желчные кислоты образуются из холестерина, и, следовательно, синтез желчных кислот является основным путем расщепления и выведения холестерина из организма. Желчь поступает из печени через желчные протоки в тонкий кишечник. У человека в среднем вырабатывается 600 мл желчи в сутки [3]. Поддержание гомеостаза желчных кислот также необходимо для достижения их физиологических функций и предотвращения токсического действия. Желчные кислоты являются важными сигнальными молекулами, принимающими участие в регуляции метаболизма липидов в печени, глюкозы, поддержании метаболического и энергетического гомеостаза [4].
Существует необходимость сравнительного изучения метаболизма и состава желчи лабораторных животных и человека в выявлении наиболее важных показателей функции гепатобилиарной системы. Данные показатели могут быть использованы для диагностики заболеваний, связанных с нарушениями функции гепатобилиарной системы, позволят получить информацию о динамике заболевания и облегчить контроль эффективности лечения. Наиболее часто в качестве модельных организмов в фармакодинамических исследованиях используются мыши, крысы, морские свинки и кролики. Это связано с доступностью данных животных, экономической выгодой, простотой содержания и схожестью физиологических и биохимических показателей с таковыми у человека [5].
Цель обзора — сравнение некоторых видовых анатомо-физиологических особенностей гепатобилиарной системы, а также освещение основных аспектов продукции желчи и метаболизма желчных кислот у наиболее часто используемых лабораторных животных (мыши, крысы, морские свинки и кролики) как между собой, так и с таковыми у человека.
Видовые особенности гепатобилиарной системы лабораторных животных
Мыши являются одной из наиболее популярных тест-систем в доклинических исследованиях [6, 7]. Топография гепатобилиарной системы мыши схожа с таковой у человека, однако наблюдаются и различия. Печень состоит из пяти долей — левой и правой медиальных, левой и правой боковых и хвостатой доли. Желчный пузырь расположен между левой и правой медиальной долей, а внепеченочные желчные пути проходят по каудальной поверхности печени и открываются в двенадцатиперстную кишку [8]. Проток поджелудочной железы ответвляется от точки, намного дистальнее двенадцатиперстной кишки, поэтому для мышей характерно наличие длинного гепатопанкреатического протока. У мышей скорость холереза составляет в среднем 100 мл/кг в сут [9].
Желчные кислоты синтезируются из холестерина в перицентральных гепатоцитах, и это представляет собой основной путь катаболизма холестерина у мышей так же, как и у человека. Так, у человека около 0,5 г холестерина в день превращается в желчные кислоты (примерно 7 мг в день на 1 кг массы тела), и это составляет почти половину холестерина, выводимого из организма в день. У мышей количество холестерина, преобразованного в желчные кислоты (около 1,25 мг холестерина в день; примерно 50 мг в день на кг массы тела), количественно больше в расчете на массу тела, что отражает более высокую скорость биосинтеза холестерина. При этом у обоих видов катаболизм холестерина в желчные кислоты составляет одинаковую общую долю (около 45%) ежедневной элиминации холестерина [10].
Состав желчных кислот у мышей существенно отличается от такового у людей, у которых основными желчными кислотами являются холевая, хенодезоксихолевая, дезоксихолевая и литохолевая кислоты, а также их конъюгаты с глицином и таурином. Однако у мышей основные желчные кислоты — это холевая и производное хенодезоксихолевой кислоты мурихолевая, а также их конъюгаты с таурином. Конъюгаты желчных кислот с глицином практически отсутствуют [8].
CYP2C70 мышей метаболизирует хенодезоксихолевую кислоту до гидрофильных мурихолевых кислот. У людей кишечная микробиота способствует превращению первичных желчных кислот (холевой и хенодезоксихолевой) в дезоксихолевую и литохолевую кислоты соответственно. Хенодезоксихолевая кислота — цитотоксическая желчная кислота в отличие от мурихолевой, которая является цитопротекторной. К тому же доля вторичных желчных кислот в желчи у мышей заметно ниже (менее 3%) по сравнению с таковой у людей (примерно 20–30%). Заметное различие в составе желчных кислот между мышами и людьми затрудняет экстраполяцию результатов экспериментов [9].
Необходимо отметить, что у человека в отличие от грызунов конъюгация с таурином и глицином регулируется с помощью диеты [11]. Гомеостаз желчных кислот у мышей строго контролируется, чтобы предотвратить токсичность желчных кислот, не влияя на их физиологические функции. Желчные кислоты метаболизируются посредством амидирования [глицин (G) или таурин (T)], гидроксилирования (с помощью CYP450) или конъюгации [5, 12].
Известно, что сульфатирование является основным путем метаболизма желчных кислот у человека и второстепенным путем у многих других видов, а гидроксилирование в положении 6-α, 6-β и 7-β посредством различных изоформ CYP450 является основным путем детоксикации желчных кислот у грызунов, что приводит к образованию гидрофильных желчных кислот: мурихолевой и урсодезоксихолевой соответственно. Кроме того, G-амидирование преобладает у людей, тогда как Т-амидирование — у мышей. Также у рассматриваемых животных активность гидроксилирования желчных кислот выше по сравнению с таковой у человека, а активность глюкуронирования второстепенна и сопоставима у человека и мыши [5, 12].
В отличие от человека около половины пула желчных кислот у мышей состоит из 6-гидроксилированных мурихолевых кислот, однако их наличие у мышей обусловливает различия метаболического фенотипа по сравнению с людьми. Известно, что мурихолевые кислоты участвуют в обмене холестерина. Так, при отсутствии рассматриваемых кислот снижаются синтез и выведение холестерина из организма [8].
У крыс печень представлена пятью долями, как у мышей [8, 13]. Внепеченочные желчные пути проходят по каудальной части печени и открываются в двенадцатиперстную кишку, тогда как желчный пузырь полностью отсутствует, без рудиментов. У крыс пузырный проток не отходит от уровня точки бифуркации воротной вены, а дистальная часть желчных путей входит в доли печени. За исключением отсутствующего домена желчного пузыря, анатомия гепатобилиарной системы крыс сходна с таковой у мышей — желчные пути проходят вдоль портальной вены, артериальная система образована печеночной артерией, а проток поджелудочной железы ответвляется далеко от стенки двенадцатиперстной кишки, поэтому у крыс, как и у мышей, печеночно-поджелудочные протоки длинные. У таких животных как крысы, у которых отсутствует желчный пузырь, желчь выделяется непрерывно в разбавленной форме и в больших объемах. В отличие от особей с желчным пузырем, желчь крыс не концентрируется и не накапливается в периоды голодания. У крыс скорость холереза составляет в среднем 90 мл/кг в сут [9].
Холевая и хенодезоксихолевая кислоты являются основными желчными кислотами, синтезируемыми непосредственно в печени крысы. В желудочно-кишечном тракте и под влиянием кишечной микрофлоры желчные кислоты, выделяемые печенью, подвергаются молекулярным преобразованиям. В результате чего дезоксихолевая кислота превращается из холевой, а литохолевая кислота — из хенодезоксихолевой, как и у человека. У крыс, как и у мышей, вторичные желчные кислоты превращаются в первичные с помощью 7α-гидроксилазы. В желчи крысы также были найдены урсодезоксихолевая и различные мурихолевые кислоты. Желчные кислоты у крыс конъюгируют преимущественно с таурином. Конъюгаты желчных кислот с глицином, как и у мышей, практически отсутствуют. У крыс активность гидроксилирования желчных кислот выше по сравнению с таковой у человека [5, 12, 14–16].
Стоит отметить, что перевязка желчных протоков опосредует увеличение синтеза желчных кислот в 2 раза у грызунов (мышей и крыс), в то время как у человека холестаз ассоциирован с подавлением синтеза желчных кислот [17].
В целом метаболизм желчных кислот у мышей и крыс сопоставим между собой и в значительной степени отличается от такового у человека.
Морская свинка наряду с мышами и крысами широко используется в качестве модели in vivo в доклинических исследованиях, в частности, при изучении гепатобилиарной системы и влияния на нее новых тестируемых фармакологических агентов [18]. У рассматриваемого вида выделяют 6 долей печени — правая латеральная, правая медиальная, левая латеральная, левая медиальная, хвостатая и квадратная доли. Желчный пузырь прикреплен к правой медиальной доле связкой, присутствует связка, соединяющая желчный пузырь с четырехугольной долей [19]. Кроме того, для морских свинок характерно явное сужение шейной зоны желчного пузыря. Эта особенность и острый угол, образованный кистозным протоком с желчным пузырем, являются морфологическим субстратом застоя желчи и опосредуют склонность к образованию желчных камней, делая морских свинок релевантной моделью для исследования литолитиков. Общий печеночный проток отсутствует у морских свинок. Для общего желчного протока характерно уникальное ампулярное расширение, из которого небольшой проток впадает в первый сегмент двенадцатиперстной кишки. Открытие общего желчного протока в просвет двенадцатиперстной кишки находится в верхней части двенадцатиперстного сосочка, который располагается дистальнее привратника. У морских свинок скорость холереза составляет в среднем 230 мл/кг в сут [13].
Основными кислотами в желчи морской свинки являются хенодезоксихолевая, урсодезоксихолевая и 7-кетолитохолевая. Холевая (3α,7α,12α-тригидроксихолановая) кислота содержится в желчи взрослых, но не у неполовозрелых морских свинок. В то время как хенодезоксихолевая (3α,7α-дигидроксихолановая) и 7-кетолитохолевая (3α-гидрокси-7-кетохолановая) кислоты содержатся в желчи как у неполовозрелых, так и у зрелых морских свинок [20].
Печень кролика состоит из пяти долей — хвостатой, правой боковой, левой боковой, правой центральной и левой центральной. Печень фиксируется на месте в брюшной полости связками, соединенными с диафрагмой и дорсальной стенкой живота. У кролика отсутствует общий печеночный проток. Желчный пузырь представляет собой полый орган грушевидной формы, прилежащий к печени в углублении каудальной поверхности. Желчь выделяется в тонкую кишку через желчные протоки. У кроликов есть желчный пузырь, и общий желчный проток входит в двенадцатиперстную кишку отдельно от протока поджелудочной железы, тем самым его относительно легко канюлировать. Желчь вырабатывается непрерывно и хранится в желчном пузыре до ее выхода в тонкую кишку [21, 22]. Количество желчи, вырабатываемой этим животным в сутки, составляет около 120 мл/кг [13].
Состав желчных кислот у кроликов значительно различается по сравнению с другими млекопитающими. Например, более 80% желчных кислот кролика состоит из дезоксихолевой. В отличие от большинства других млекопитающих, где билирубин является единственным конечным продуктом распада белков, содержащих гем, выделяемый с желчью, у кроликов с желчью выделяется как биливердин (70%), так и билирубин (30%), что, вероятно, связано и с низкой активностью биливердинредуктазы. У кролика конъюгация, по-видимому, почти полностью специфична для глицина. Конъюгированные желчные кислоты секретируются в систему желчных каналов, транспортируются по желчным протокам и хранятся в желчном пузыре [23, 24]. Амидирование у кроликов происходит в основном с глицином, как и у человека [5, 12].
Концентрация желчных кислот в сыворотке крови до и после приема пищи — маркер функции гепатобилиарной системы у лабораторных животных. Однако цекотрофия кроликов делает практически невозможным их голодание, необходимое для препрандиальной пробы, поэтому измерение желчных кислот в доклинических исследованиях проводится редко [25].
В таблице 1 представлена обобщенная информация по анатомо-физиологическим особенностям рассмотренных животных в качестве тест-систем.
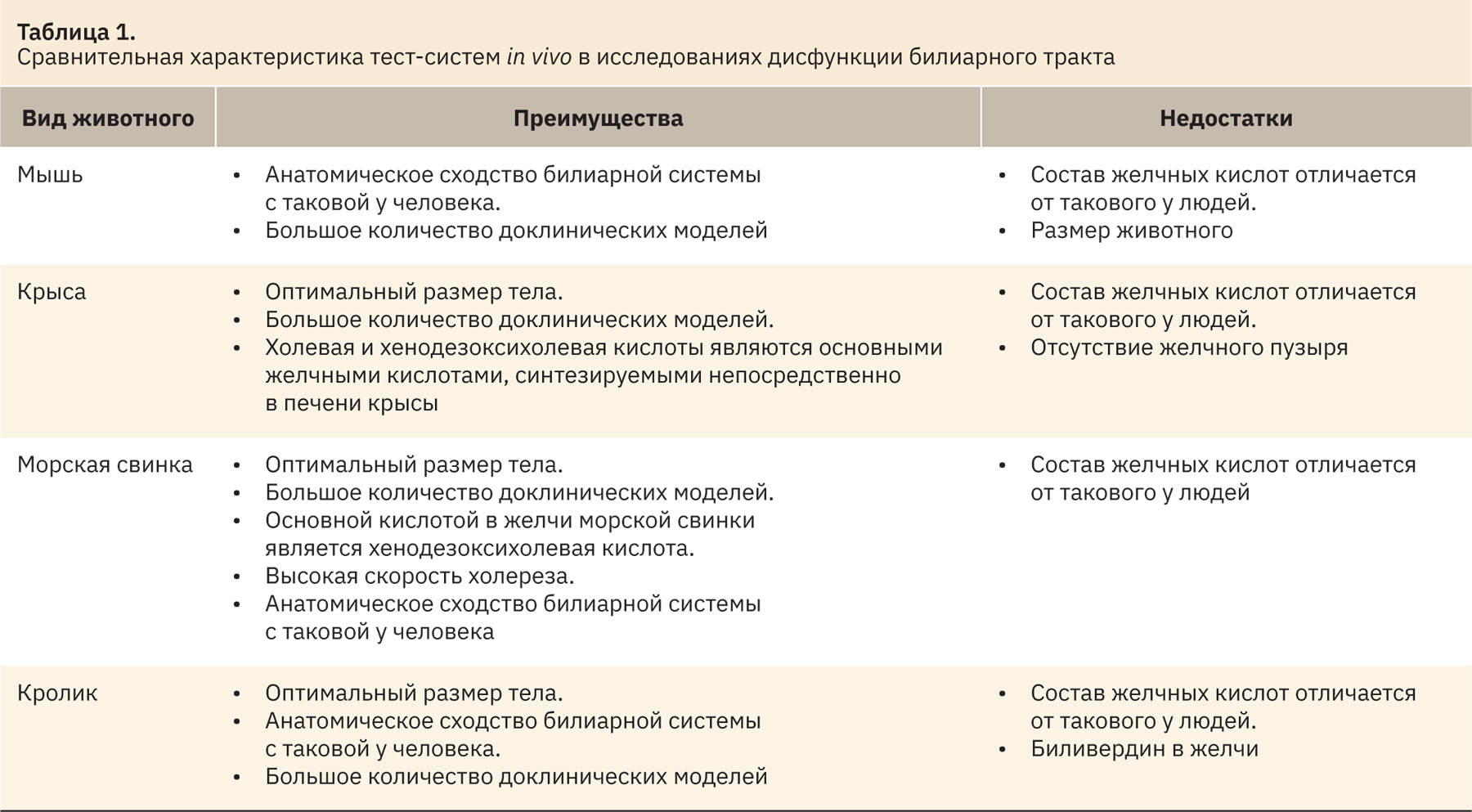
Мыши и крысы являются достаточно распространенными тест-системами, однако существенное различие в составе желчных кислот (наличие мурихолевых кислот) ограничивает их трансляционность. Хотя холевая и хенодезоксихолевая кислоты являются основными желчными кислотами у крыс, все же общий состав желчи в большей степени схож с таковым у мышей. Небольшой размер тела мышей может вызвать трудности при хирургических манипуляциях, связанных с процедурой отбора желчи. Использование крыс в отличие от мышей таких трудностей не вызывает, однако у них отсутствует желчный пузырь, что указывает на анатомическое различие с гепатобилиарным трактом человека. Кролик обладает оптимальным размером тела и анатомическим сходством билиарной системы с человеческой, но присутствие биливердина и значительного количества дезоксихолевой кислоты в желчи указывает на различия в составах желчных кислот в сравнении с человеком.
Заметные различия в составе и метаболизме желчных кислот между лабораторными животными и людьми ограничивают трансляционность. Кроме того, видовые различия в метаболизме желчных кислот опосредуют таковые в гепатотоксичности желчных кислот. Например, у кроликов и морских свинок, хенодезоксихолевая и литохолевая кислоты вызывают поражение печени в связи с отсутствием способности к сульфатированию желчных кислот. При этом мыши и крысы более устойчивы к токсическому воздействию желчных кислот.
Морская свинка обладает оптимальным размером тела, что удобно для проведения манипуляций, анатомическим сходством с гепатобилиарной системой человека, высокой скоростью холереза и в целом схожим составом желчных кислот, также для нее разработано достаточное количество экспериментальных модельных патологий, что делает ее релевантной тест-системой для изучения гепатобилиарных патологий и соответствующих терапевтических агентов.
Заключение
Использование лабораторных животных продолжает играть решающую роль в изучении патологий гепатобилиарного тракта, метаболизма желчных кислот, разработке лекарственных агентов. Стоит отметить, что выбор определенного вида животного должен быть обусловлен многими факторами, к числу которых можно отнести анатомо-физиологическое сходство тест-системы и человека, также необходимо учитывать особенности метаболизма и состава желчи.
Мыши, крысы, морские свинки и кролики — распространенные лабораторные животные, используемые для изучения веществ, способных влиять на продукцию желчи. Так, основные анатомо-морфологические аспекты строения гепатобилиарной системы рассматриваемых животных соответствуют таковым у человека. Однако присутствуют и различия, например, у крыс отсутствует желчный пузырь. Кроме того, есть различия в метаболизме и составе желчных кислот — выработка у грызунов мурихолевых кислот снижает их трансляционную ценность.
У мышей, крыс и морских свинок желчные кислоты являются чувствительным индикатором функции и целостности печени. Однако у кроликов, хотя и происходит изменение уровня желчных кислот при патологии гепатобилиарной системы, все же цекотрофия значительно ограничивает возможность проведения препрандиальной пробы.
Анатомические особенности гепатобилиарной системы морской свинки, высокая скорость холереза и в целом схожий состав желчных кислот делают ее релевантной тест-системой для фармакодинамических исследований.
Стоит отметить, что выявленные особенности лабораторных животных не исключают использование тех или иных животных, а указывают на необходимость обоснованного выбора релевантной тест-системы с учетом специфики каждой из них.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
К.Т. Султанова — анализ научной и методической литературы, написание и редактирование текста рукописи, обобщение результатов исследования.
М.В. Мирошников — анализ научной и методической литературы, научное редактирование текста рукописи.
К.Л. Крышень — идея разработки темы и обоснование актуальности работы, критический пересмотр содержания.
Список источников
-
Boyer J.L. Bile formation and secretion // Comprehensive physiology. 2013. Vol. 3. N. 3. P. 1035. DOI: 10.1002/cphy.c120027.
-
Hundt M., Basit H., John S. Physiology, bile secretion, 2017.
-
Zollner G., Trauner M. Mechanisms of cholestasis // Clinics in liver disease. 2008. Vol. 12. N. 1. P. 1–26. DOI: 10.1016/j.cld.2007.11.010.
-
Esteller A. Physiology of bile secretion // World journal of gastroenterology: WJG. 2008. Vol. 14. N. 37. P. 5641. DOI: 10.3748/wjg.14.5641.
-
Thakare R., Alamoudi J.A., Gautam N. et al. Species differences in bile acids I. Plasma and urine bile acid composition // Journal of applied toxicology. 2018. Vol. 38. N. 10. P. 1323–1335. DOI: 10.1002/jat.3644.
-
Kruepunga N., Hakvoort T.B., Hikspoors J.P. et al. Anatomy of rodent and human livers: What are the differences? // Biochimica et Biophysica Acta (BBA) — Molecular Basis of Disease. 2019. Vol. 1865. N. 5. P. 869–878. DOI: 10.1016/j.bbadis.2018.05.019.
-
Мирошников М.В., Макарова М.Н. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 4: мыши // Лабораторные животные для научных исследований. 2021. № 3. С. 64–70. [Miroshnikov M.V., Makarova M.N. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referensnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 4: myshi // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2021. N. 3. P. 64–70. (In Russ.)]. DOI: 10.29296/2618723X-2021-03-08.
-
Honda A., Miyazaki T., Iwamoto J. et al. Regulation of bile acid metabolism in mouse models with hydrophobic bile acid composition // Journal of lipid research. 2020. Vol. 61. N. 1. P. 54–69. DOI: 10.1194/jlr.RA119000395.
-
Higashiyama H., Uemura M., Igarashi H. et al. Anatomy and development of the extrahepatic biliary system in mouse and rat: a perspective on the evolutionary loss of the gallbladder // Journal of anatomy. 2018. Vol. 232. N. 1. P. 134–145. DOI: 10.1111/joa.12707.
-
Li J., Dawson P.A. Animal models to study bile acid metabolism // Biochimica et Biophysica Acta (BBA) — Molecular Basis of Disease. 2019. Vol. 1865. N. 5. P. 895–911. DOI: 10.1016/j.bbadis.2018.05.011.
-
Евсютина Ю.В., Ивашкин В.Т. Метаболизм желчных кислот, заболевания печени и микробиом // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2018. Т. 28. № 2. С. 4–10. [Evsyutina YU.V., Ivashkin V.T. Metabolizm zhelchnyh kislot, zabolevaniya pecheni i mikrobiom // Rossijskij zhurnal gastroenterologii, gepatologii, koloproktologii. 2018. Vol. 28. N. 2. P. 4–10. (In Russ.)]. DOI: 10.22416/1382-4376-2018-28-2-4-10.
-
Thakare R., Alamoudi J.A., Gautam N. et al. Species differences in bile acids II. Bile acid metabolism // Journal of applied toxicology. 2018. Vol. 38. N. 10. P. 1336–1352. DOI: 10.1002/jat.3645.
-
Kwon Y. Handbook of essential pharmacokinetics, pharmacodynamics and drug metabolism for industrial scientists. Springer Science & Business Media, 2001.
-
Wahlström A., Al-Dury S., Stahlman M. et al. CYP3A11 is not essential for the formation of murine bile acids // Biochemistry and biophysics reports. 2017. N. 10. P. 70–75. DOI: 10.1016/j.bbrep.2017.02.011.
-
Rudling M. Understanding mouse bile acid formation: Is it time to unwind why mice and rats make unique bile acids? // Journal of Lipid Research. 2016. Vol. 57. N. 12. P. 2097–2098. DOI: 10.1194/jlr.C072876.
-
Alnouti Y., Csanaky I.L., Klaassen C.D. Quantitative-profiling of bile acids and their conjugates in mouse liver, bile, plasma, and urine using LC-MS/MS // Journal of Chromatography B. 2008. Vol. 873. N. 2. P. 209–217. DOI: 10.1016/j.jchromb.2008.08.018.
-
Straniero S., Laskar A., Savva C. et al. Of mice and men: murine bile acids explain species differences in the regulation of bile acid and cholesterol metabolism [S] // Journal of lipid research. 2020. Vol. 61. N. 4. P. 480–491. DOI: 10.1194/jlr.RA119000307.
-
Мирошников М.В., Султанова К.Т., Макарова М.Н. и др. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 7: морские свинки // Лабораторные животные для научных исследований. 2022. № 3. С. 4–15. [Miroshnikov M.V., Sultanova K.T., Makarova M.N. i dr. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referensnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 7: morskie svinki // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2022. N. 3. P. 4–15. (In Russ.)]. DOI: 10.57034/2618723X-2022-03-01.
-
Rajathi S., Ramesh G., Kannan T.A. et al. Morphology of the gall bladder and extrahepatic ducts in the postnatal ages of guinea pig // Int. J. Curr. Microbiol. App. Sci. 2020. Vol. 9. N. 6. P. 1110–1116. DOI: 10.20546/ijcmas.2020.906.137.
-
Tint G.S., Xu G.R., Batta A.K. et al. Ursodeoxycholic acid, chenodeoxycholic acid, and 7-ketolithocholic acid are primary bile acids of the guinea pig // Journal of Lipid Research. 1990. Vol. 31. N. 7. P. 1301–1306.
-
Paramo M., Garcia-Barquin P., Santa Maria E. et al. Evaluation of the rabbit liver by direct portography and contrast-enhanced computed tomography: anatomical variations of the portal system and hepatic volume quantification // European radiology experimental. 2017. Vol. 1. N. 1. P. 1–7. DOI: 10.1186/s41747-017-0011-8.
-
Stan F.G. Comparative Study of the Liver Anatomy in the Rat, Rabbit, Guinea Pig and Chinchilla // Bulletin of the University of Agricultural Sciences & Veterinary Medicine Cluj-Napoca. Veterinary Medicine. 2018. Vol. 75. N. 1. DOI: 10.15835/buasvmcn-vm:002717.
-
Hagey L.R., Schteingart C.D., Rossi S.S. et al. An N-acyl glycyltaurine conjugate of deoxycholic acid in the biliary bile acids of the rabbit // Journal of lipid research. 1998. Vol. 39. N. 11. P. 2119–2124. DOI: 10.1016/S0022-2275(20)32466-4.
-
Subbiah M.T.R., Marai L., Dinh D.M. et al. Sterol and bile acid metabolism during development. 1. Studies on the gallbladder and intestinal bile acids of newborn and fetal rabbit // Steroids. 1977. Vol. 29. N. 1. P. 83–92. DOI: 10.1016/0039-128x(77)90111-8.
- Melillo A. Rabbit clinical pathology // Journal of exotic pet medicine. 2007. Vol. 16. N. 3. P. 135–145. DOI: 10.1053/j.jepm.2007.06.002.




