Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 10: монгольские песчанки
Работа выполнена без спонсорской поддержки.
Мирошников М.В., Султанова К.Т., Ковалева М.А. Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 10: монгольские песчанки. Лабораторные животные для научных исследований. 2023; 3. https://doi.org/10.57034/2618723X-2023-03-06
Резюме
Песчанки как вид лабораторных животных широко используются в качестве экспериментальных моделей в ряде областей биомедицинских исследований. Данный вид лабораторных животных относительно прост в обслуживании и обращении. Они являются альтернативной тест-системой среди грызунов, таких как мыши и крысы. Наиболее часто применяются в изучении церебральной ишемии или инсульта, нейропсихотропных исследованиях, процессов старения, развития онкологических заболеваний, а также изучении паразитарных, вирусных и бактериальных инфекций, исследовании механизмов и терапии эпилептических припадков и метаболических нарушений, таких как ожирение и сахарный диабет. Цель данной работы — создание базы референтных интервалов биохимических показателей нормальных здоровых половозрелых монгольских песчанок с дальнейшим использованием их в повседневной рутинной лабораторной практике в доклинических центрах. Данные, которые были использованы для формирования референтных интервалов, получены от интактных животных в АО «НПО «ДОМ ФАРМАЦИИ». Все манипуляции и эксперименты одобрены биоэтической комиссией. В исследовании задействовано 20 самцов и 20 самок (небеременные и нерожавшие, без учета фазы эстрального цикла) монгольских песчанок. Возраст животных соответствовал диапазону 6–8 нед, масса тела самцов и самок была в пределах 60 г. В сыворотке крови животных определяли уровни следующих показателей: креатинин, мочевина, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, холестерин, триглицериды, общий белок, альбумин, глюкоза, общий билирубин, рассчитывали количество глобулинов, а также соотношение альбумин/глобулины. Полученные диапазоны у самцов и самок не имели статистической разницы между собой. Данные интервалы были проанализированы на предмет сравнения с другими референтными интервалами песчанок, указанными в научной литературе, а также с диапазонами аналогичных показателей, характерными для человека. Нормы биохимических показателей сыворотки крови песчанок являются важным инструментом, необходимым для мониторинга здоровья животных в ходе биомедицинских исследований, наблюдения за динамикой моделирования патологических состояний на животных и изучения безопасности новых фармакологических агентов. Важным аспектом в доклинических исследованиях является создание любых интервалов нормы у лабораторных животных в каждом научном центре отдельно. Это связано с большим количеством преаналитических, аналитических и постаналитических особенностей, а также с минимизацией риска неверной интерпретации полученных данных в ходе биомедицинского исследования.
Введение
Песчанка монгольская — вид грызунов рода малых песчанок. Миролюбивые и устойчивые к недостатку воды грызуны. Зарегистрировано более 100 видов песчаноподобных грызунов, но монгольская песчанка (Meriones unguiculatus) является видом, наиболее часто используемым в биомедицинских исследованиях. Рассматриваемые животные используются в научных целях с 1880-х годов, начиная с изучения туберкулеза; они также сыграли значительную роль в исследованиях шистосомоза в 1950–1960-х годах. Песчанки обладают уникальными характеристиками, которые позволяют использовать их в биомедицинских опытах, таких как исследования дерматитов, процессов старения, тревожно-депрессивных расстройств, а также ряда других патологий [1].
Так, у песчанок отсутствует виллизиев круг — артериальный круг головного мозга, расположенный в основании головного мозга и обеспечивающий компенсацию недостаточности кровоснабжения за счет перетока из других сосудистых бассейнов, что позволяет использовать их в изучении церебральной ишемии или инсульта [2, 3].
Песчанки подходят для научных работ, связанных с паразитарными, бактериальными и вирусными агентами. Так, рассматриваемые животные используются для изучения эхинококкоза, гименолепидоза, свиного и бычьего цепня, гемонхоза, токсокароза, стронгилоидоза. Песчанки применяются для изучения всех аспектов жизненного цикла трематод (шистосомоз) и потенциальных методов лечения. Рассматриваемые животные являются хорошими тест-системами для изучения криптоспоридиоза и лямблиоза [4], хеликобактериоза, поскольку у песчанок развиваются тяжелый гастрит и язва желудка. Монгольская песчанка — оптимальная тест-система in vivo для моделирования листериоза, лептоспироза и боррелиоза [5–7].
Среди вирусных заболеваний, исследуемых на песчанках, можно отметить вирусы гепатита Е [9] и энцефалита [9, 10]. Новорожденные песчанки также могут быть экспериментально инфицированы реовирусом [4].
Рассматриваемые животные считаются перспективной моделью для изучения механизмов и лечения эпилепсии. У животных наблюдаются спонтанные, повторяющиеся генерализованные припадки, начинающиеся примерно в 6-недельном возрасте, часто регистрируются судороги в ответ на внешние раздражители, к примеру, на струю сжатого воздуха, причем возникшие судороги могут иметь разную интенсивность и частоту. Примечательно, что у песчанок в первые недели моделирования патологии судороги могут и не возникнуть, но к 5–6-й неделе процент животных с припадками значительно возрастает. Эпилептические припадки характеризуются клонико-тоническими компонентами. Характер поведенческих припадков соответствует изменениям в записи электроэнцефалограммы. В целом имеющиеся данные литературы [11, 12] указывают, что модель песчанок интересна и может быть полезна для изучения механизмов, лежащих в основе «спонтанных» припадков.
Песчанка — это первая доклиническая модель, используемая для изучения гемохроматоза. При экспериментальном железоиндуцированном моделировании у песчанок гистопатологические поражения сердца и печени схожи с таковыми у человека [4].
Рассматриваемый вид лабораторных животных применяется для изучения обменных процессов, в частности липидов. У песчанок спонтанно возникают и моделируются такие состояния, как ожирение [13], гиперинсулинемия и сахарный диабет [14]. Песчанка была выбрана для создания моделей неалкогольной жировой болезни печени, ожирения и нарушения обмена веществ в печени посредством диеты с высоким содержанием жиров и холестерина [15]. Потребление диеты, богатой простыми жирами и углеводами, приводит к увеличению общей массы тела животного, массы печени и жировой ткани, уровня глюкозы, триглицеридов и концентрации TNF-α в жировой ткани. У песчанок также наблюдается значительное увеличение общего содержания холестерина и триглицеридов в печени, что способствует более высокой интенсивности стеатоза печени. В моделях неалкогольной жировой болезни печени был обнаружен ряд общих черт с заболеванием у человека: избыточное накопление свободных жирных кислот, нарушение липидного обмена в крови, изменения формы и размера клеток печени, а также морфологии печени. Прогрессирование цирроза печени в связи с неалкогольной жировой болезнью у песчанок четко делится на стадии, что позволяет изучать прогрессирование заболевания. Результаты указывают на сильную положительную корреляцию между метаболизмом липидов и циррозом, который соответствует клиническому течению заболевания у человека. Таким образом, модель цирроза неалкогольной жировой болезни печени у песчанок может быть использована для изучения прогрессирования неалкогольной жировой болезни печени, особенно стадии цирроза [16–18].
Песчанки рассматриваются как потенциальные модели для изучения диабета и его осложнений. Введение стрептозотоцина песчанкам вызывает нарушения обмена веществ — значительно повышается уровень глюкозы, холестерина и триглицеридов в плазме/сыворотке, а также снижается содержание инсулина и гликогена. Регистрируется низкая концентрация липопротеинов высокой плотности, при этом содержание липопротеинов низкой плотности высокое. У песчанок наблюдаются повышенная активность антиоксидантных ферментов и уровень малонового диальдегида в тканях поджелудочной железы, определяется дегенеративное повреждение со снижением процентной площади β-клеток поджелудочной железы [19].
Монгольские песчанки используются в исследованиях по изучению фармакологической активности и безопасности лекарственных средств. В отечественной литературе представлено ограниченное количество данных в отношении нормальных значений биохимических показателей.
Таким образом, цель данной работы — создание базы референтных интервалов биохимических показателей у нормальных здоровых половозрелых монгольских песчанок для дальнейшего использования в испытательном центре при проведении доклинических исследований и мероприятий по мониторингу здоровья данного вида.
Материал и методы
Все манипуляции проведены на базе АО «НПО «ДОМ ФАРМАЦИИ». Данные, используемые в эксперименте, получены от интактных животных в период с мая по июнь 2022 г. Исследование одобрено биоэтической комиссией. Всего в эксперимент было отобрано 40 животных — 20 самцов и 20 небеременных и нерожавших самок, без учета фазы эстрального цикла. Возраст монгольских песчанок находился в диапазоне 6–8 нед, масса — 50–70 г. Животных содержали в стандартных условиях вивария — температура воздуха 22–26 °С, относительная влажность 40–75%, 12-часовой световой день. Питание монгольских песчанок проводили в соответствии с Директивой 2010/63/EU1. Исследование выполнено с соблюдением принципов надлежащей лабораторной практики. Все биохимические показатели определяли в идентичных общепринятых лабораторных условиях во избежание преаналитических и аналитических ошибок. Забор крови у животных производили путем пункции перикарда. Песчанок подвергали эвтаназии, применяя диоксид углерода (СО2). Кровь собирали натощак в вакуумные пластиковые пробирки объемом 1 мл с активатором свертывания и гелем (ООО «КОРВЕЙ», Россия). Кровь центрифугировали 15 мин при 3000 оборотах в минуту (об/мин) на центрифуге ОПн-3.04 ДАСТАН (ОАО ТНК «Дастан», Киргизия), затем полученную сыворотку переносили в чистые стерильные кюветы, в которых непосредственно происходило измерение интересующих биохимических показателй на автоматическом биохимическом анализаторе Rendom Access A-25 (BioSystems, Испания). Используя соответствующие наборы (BioSystems, Испания), регистрировали такие показатели, как креатинин, мочевина, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, холестерин, триглицериды, общий белок, альбумин и глюкоза. Рассчитывали количество глобулинов, а также соотношение альбумин/глобулины. Концентрацию общего билирубина определяли с помощью набора реактивов (АО «Вектор-Бест-Балтика», Россия). Постаналитические расчеты были проведены с использованием таких программ, как GraphPad Prism 9.0 (США) и Microsoft Excel 2010 (Microsoft, США). Статистические выбросы оценивали с помощью метода Тьюки, вид распределения определяли, применяя критерий Шапиро–Уилка, парные сравнения между животными разного пола — U-критерий Манна–Уитни и t-критерий Стьюдента.
Результаты и обсуждение
На первом этапе постаналитической работы были исключены так называемые жесткие и мягкие выбросы данных по методу, описанному ранее [20].
Данные о доле статистических выбросов по каждому показателю и выходящих за пределы референтных интервалов представлены в табл. 1.
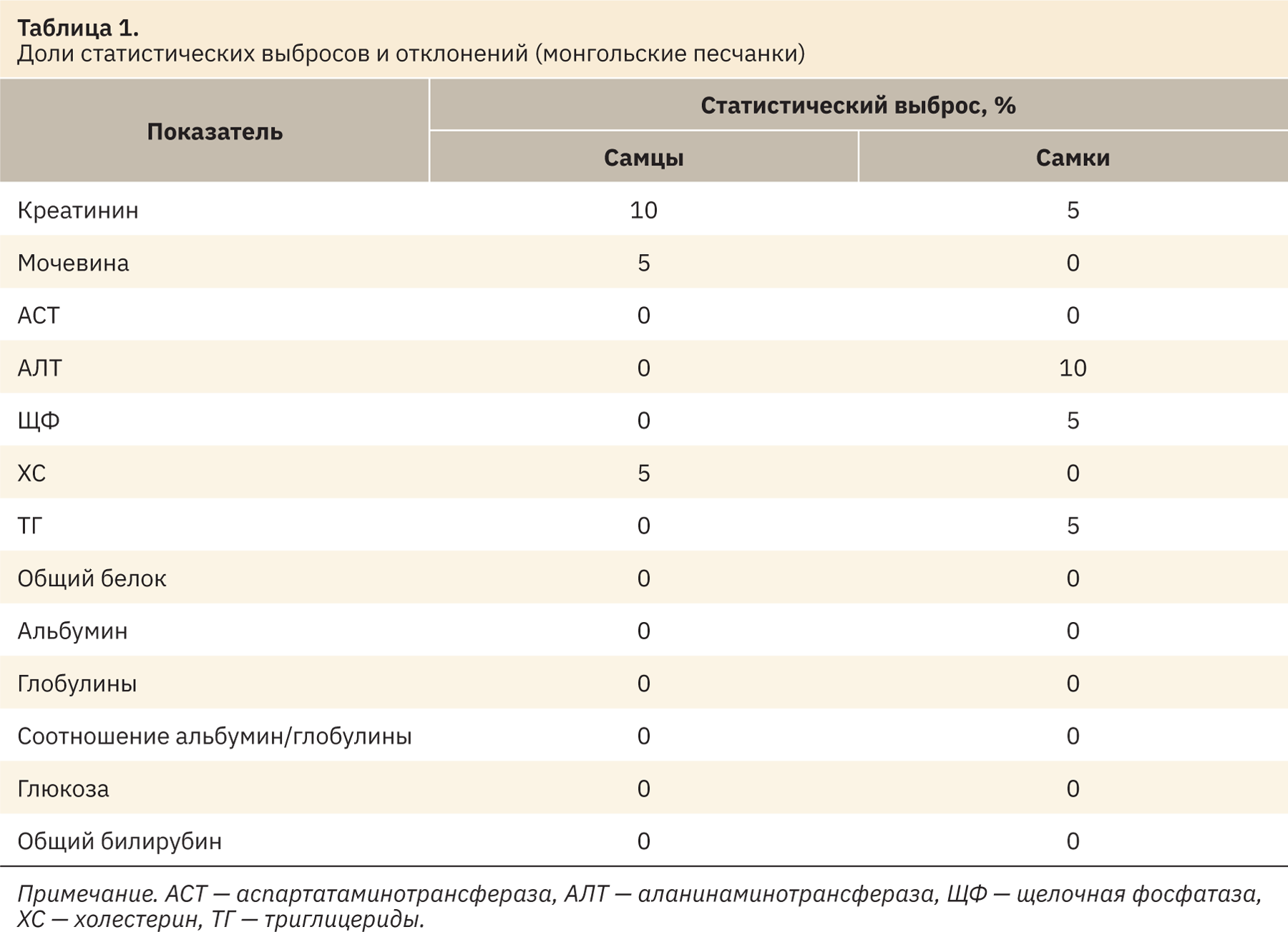
Наибольшие статистические выбросы и отклонения среди биохимических показателей крови у самцов зарегистрированы в отношении креатинина — 10%, мочевины и холестерина — 5% (см. табл. 1). У самок наибольшие статистические отклонения зарегистрированы в отношении аланинаминотрансферазы — 10%, а также креатинина и триглицеридов — 5%. По всем остальным регистрируемым биохимическим показателям отклонений не выявлено.
В табл. 2 представлены результаты референтных интервалов биохимических показателей крови монгольских песчанок.
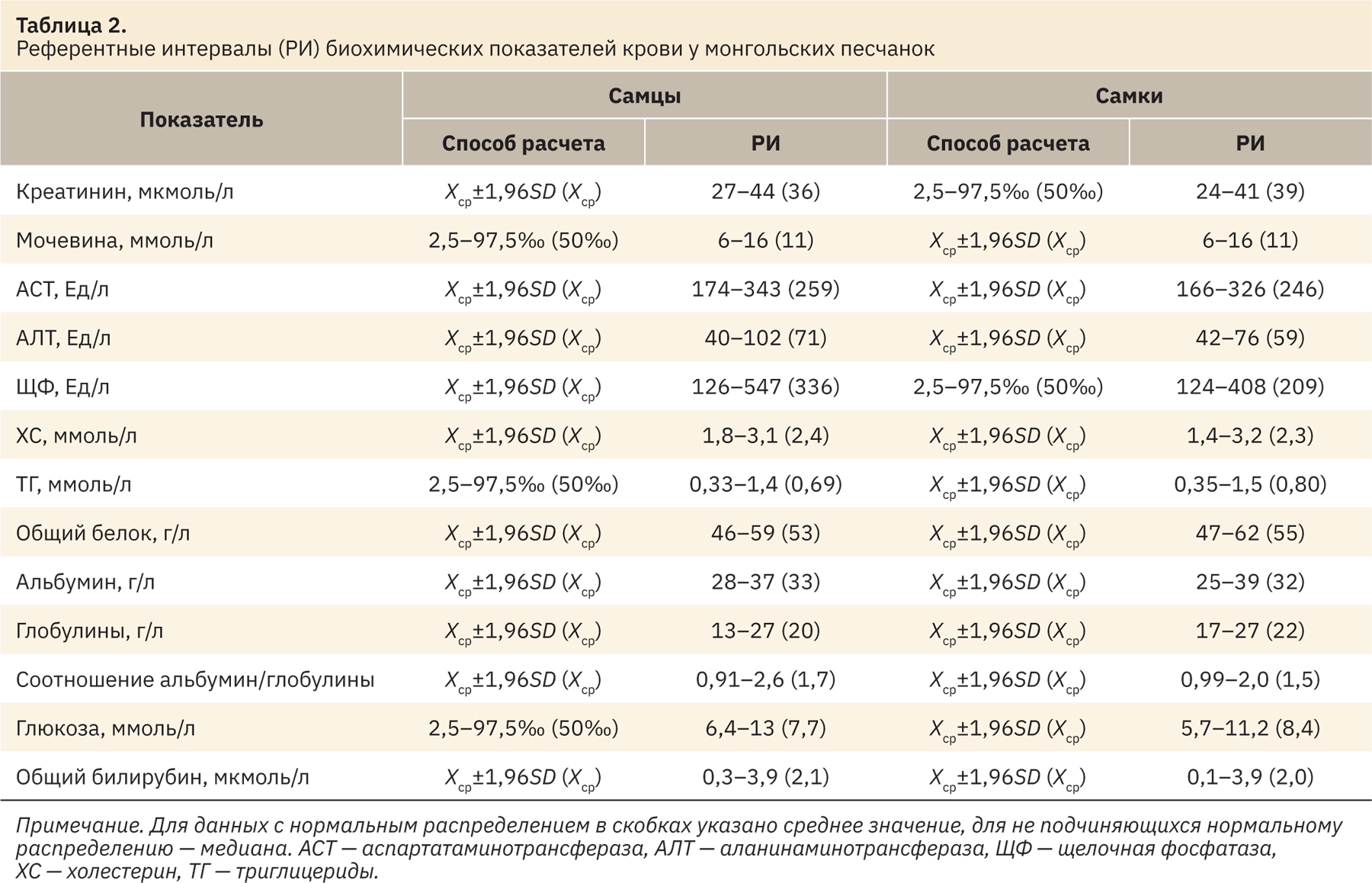
Полученные диапазоны значений у самцов и самок монгольских песчанок сопоставимы между собой по всем рассматриваемым показателям, статистической разницы не выявлено (см. табл. 2).
При сравнении полученных интервалов с референтными значениями, указанными в источниках литературы (табл. 3), показано, что в целом диапазоны рассматриваемых показателей как у самцов, так и самок схожи, но присутствуют и различия.
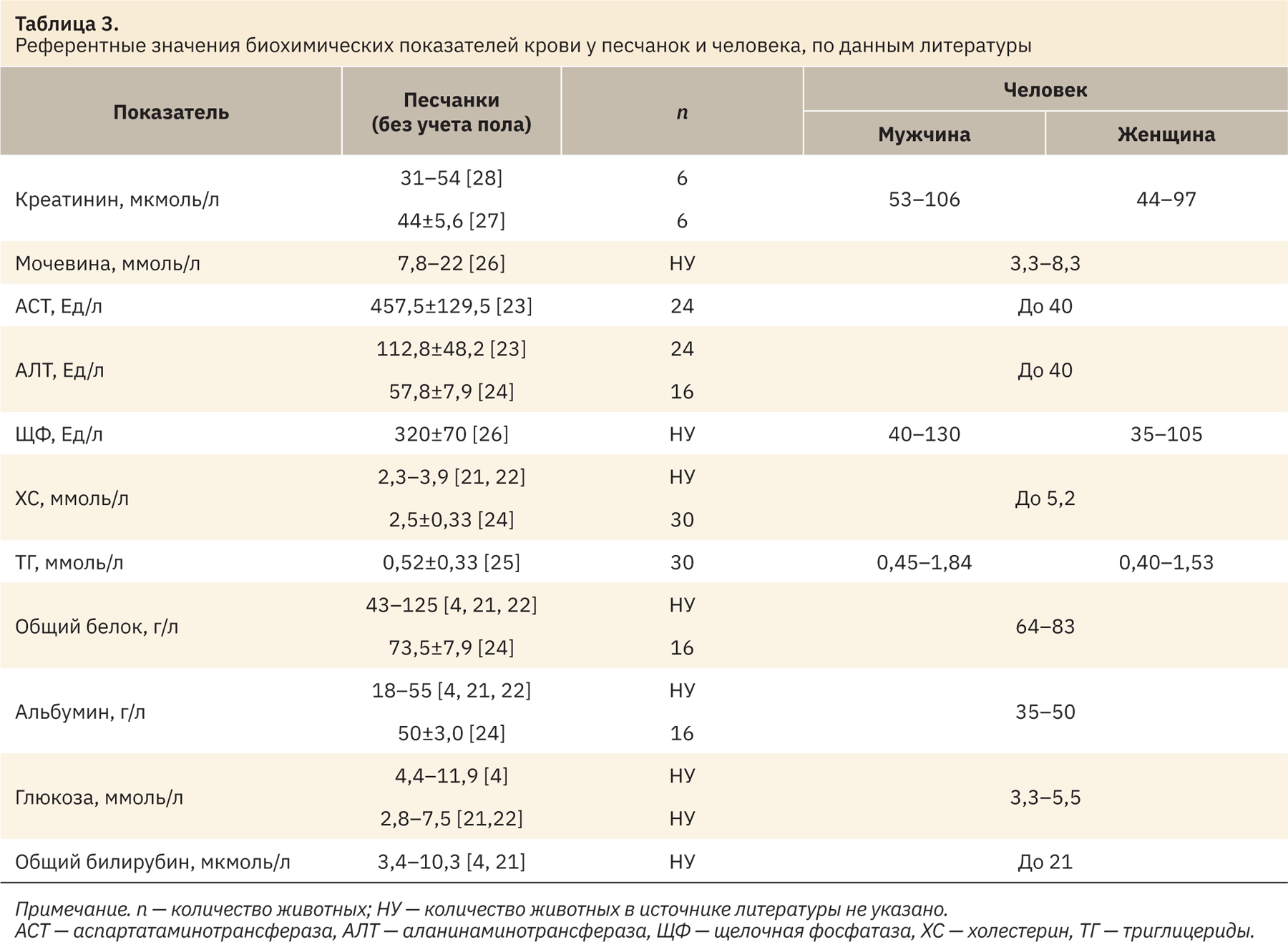
Так, диапазоны нормальных значений мочевины, общего белка и альбумина оказались уже, чем представленные в публикациях, а щелочной фосфатазы, холестерина, триглицеридов, наоборот, шире. Референтные интервалы аспартатаминотрансферазы и общего билирубина имели более низкий диапазон значений, чем рассмотренные значения в источниках литературы. Данные различия могут быть связаны с преаналитическими и аналитическими особенностями проведения анализа, породы животных и условий их содержания. Именно поэтому лучшим решением для всех доклинических центров является установление своих собственных референтных интервалов у лабораторных животных. В этом случае риск неверной интерпретации полученных данных в ходе доклинического эксперимента сводится к минимуму. Рассчитанные значения уровня креатинина, аланинаминотрансферазы и глюкозы у монгольских песчанок соответствуют аналогичным данным литературы.
Сопоставляя полученные референтные интервалы биохимических показателей крови у песчанок с таковыми человека (см. табл. 3), можно сделать вывод, что интервал значений креатинина у здоровых монгольских песчанок лежит в более низком диапазоне в сравнении с нормами, характерными для человека, при этом нормальные показатели мочевины и глюкозы рассматриваемого вида животных, наоборот, — в более высоком диапазоне. Референтный интервал аспартатаминотрансферазы монгольских песчанок значительно шире, чем аналогичный диапазон у человека. Нижние границы нормы аланинаминотрансферазы и щелочной фосфатазы у песчанок соответствуют верхним границам нормы человека, интервалы данных показателей у рассматриваемых животных лежат в более высоких диапазонах значений относительно значений, характерных для человека. Верхняя граница нормального диапазона общего белка и альбумина соответствует нижней границе аналогичных показателей человека. Диапазоны нормы холестерина и общего билирубина у здоровых песчанок меньше таковых человека. Референтные интервалы уровня триглицеридов у песчанок и человека схожи между собой.
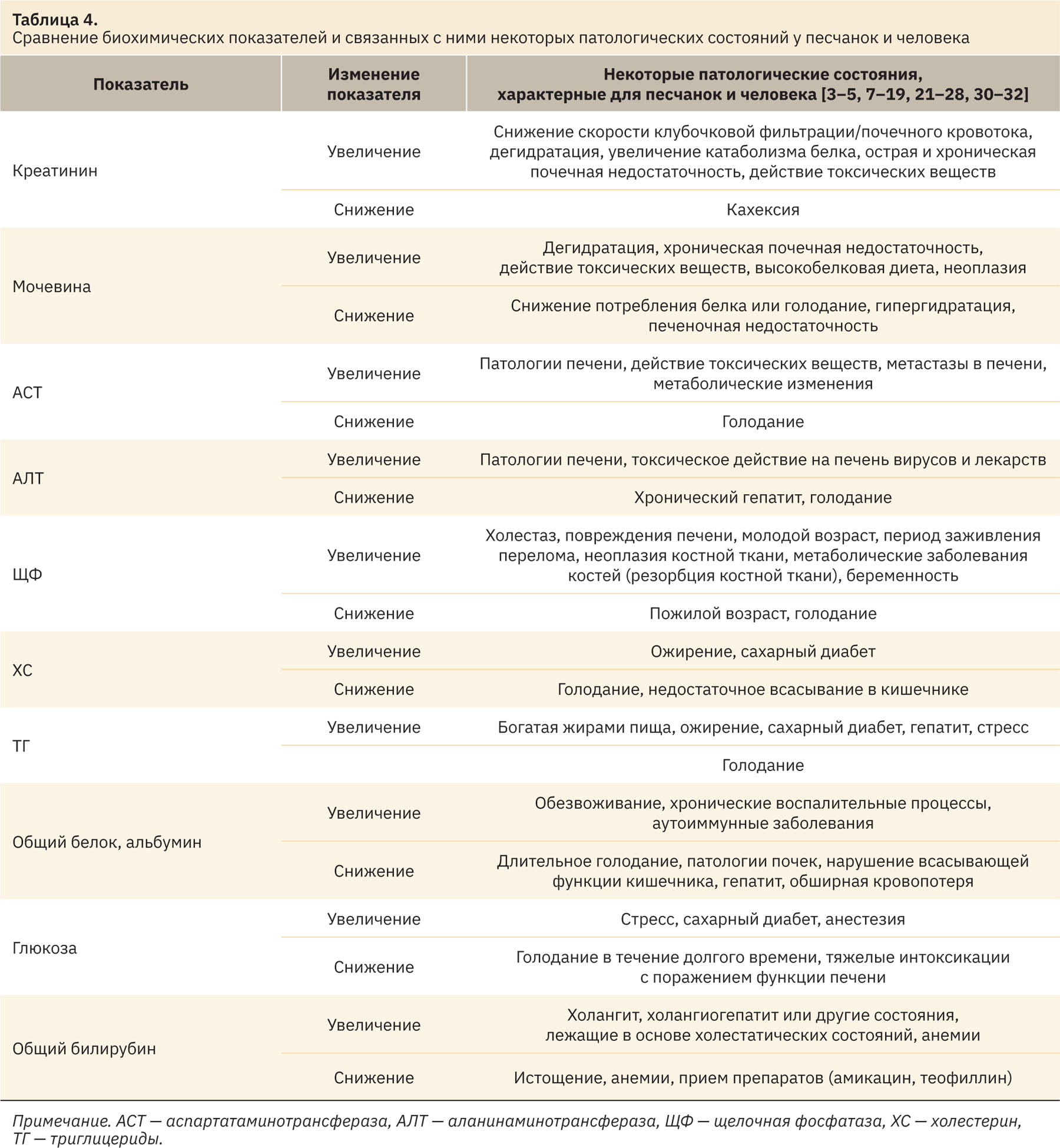
Референтные интервалы биохимических показателей крови являются важной составляющей в доклинических исследованиях и позволяют наблюдать в динамике за изменениями, происходящими с лабораторными животными в ходе биомедицинского эксперимента [29]. Данные нормы могут указать на поражение определенных органов или систем организма, тем самым исследователь может получить важную информацию о безопасности изучаемого вещества или судить об оценке моделируемого патологического состояния на лабораторном животном.
Оценка функции печени у песчанок, как и людей, определяется посредством таких ферментов, как аланинаминотрансфераза, щелочная фосфатаза и общий билирубин. Наиболее часто в исследованиях анализируют изменения значений аланинаминотрансферазы. Щелочную фосфатазу целесообразно использовать в характеристике повреждения печени только у взрослых животных, так как у растущих особей она будет всегда выше нормы. Повышение уровня фермента щелочной фосфатазы чаще всего наблюдается при холестазе или вирусном гепатите. Как и у других видов млекопитающих, повышенный уровень общего билирубина указывает на холангит, холангиогепатит или другие состояния, лежащие в основе холестатических состояний. Уровень билирубина в крови повышается также при усиленном распаде гемоглобина. Помимо упомянутых показателей, желчные кислоты также могут служить полезным маркером хронического гепатита у песчанок [30]. Фермент аспартатаминотрансфераза выделяется из поврежденных клеток печени и мышц. В сочетании с повышением уровня других печеночных ферментов, таких как аланинаминотрансфераза, увеличенный уровень аспартатаминотрансферазы указывает на повреждение печени. Значения лактатдегидрогеназы и креатинкиназы повышаются у песчанок при сердечных патологиях. Креатинин, мочевина, общий белок и альбумин используются для оценки функции почек [31]. Также уровень данных показателей может указывать на изменения в возрастном тканевом катаболизме, желудочно-кишечное кровотечение или повышенное содержание белка в пище. Снижение уровня общего белка и альбумина может служить показателем нефропатии с потерей белка у грызунов. Изменения значений мочевины начинаются только после того, как функция почек нарушена на 70%: уменьшение указывает на тяжелое заболевание печени, при котором аммиак не перерабатывается в мочевину. Креатинин является более чувствительным показателем скорости клубочковой фильтрации и функции почек. Песчанки с хронической нефропатией могут демонстрировать клиническую полиурию, полидипсию и потерю массы в результате снижения аппетита. Гипопротеинемия и гипоальбуминемия могут быть результатом потери белка, вызванной кровотечением, наличием паразитов или голоданием. Как правило, гипоальбуминемия возникает в результате снижения потребления белка, его всасывания или дисфункции поджелудочной железы (нарушение переваривания или мальабсорбция), а также снижения синтеза в печени, повышенной потери белка, вызванной желудочно-кишечным заболеванием или заболеванием почек. Гиперальбуминемия и сопутствующая гиперглобулинемия обычно указывают на обезвоживание. Низкий уровень общего белка свидетельствует об отеках и асците. Гиперглобулинемия говорит о хронической стимуляции иммунной системы. У песчанок значения альбумина и соотношение альбумин/глобулины снижаются в связи с возрастом или беременностью [31, 32]. Показатели уровня глюкозы в крови песчанок очень чувствительны к обращению с животными и технике отбора биообразцов. Стресс повышает уровень глюкозы в крови. Регулярное контактирование, или хэндлинг, уменьшает этот эффект. Голодание снижает уровень глюкозы в крови. Циркадные эффекты влияют на уровень сахара в крови грызунов. Как было сказано ранее, многие грызуны склонны к диабету. Песчанки подвержены ожирению, у них могут развиться пониженная толерантность к глюкозе и сахарный диабет [21, 31]. Сыворотка крови песчанок часто липемична, особенно у старых животных, семена подсолнечника в рационе могут также способствовать этому. Кроме того, сыворотка крови песчанок становится липемичной при стандартном рационе с содержанием жира более 4%. Повышенный уровень холестерина вызывает ожирение печени у грызунов. Метаболизм холестерина у песчанок аналогичен таковому человека, поэтому этот вид используется для изучения влияния пищевого холестерина и жиров на организм. У песчанок, в рационе которых пища с высоким содержанием холестерина, часто образуются камни в желчном пузыре [21, 32].
В табл. 4 представлены рассматриваемые биохимические показатели в контексте их изменения при различных патологических состояниях.
Далее были рассчитаны коэффициенты вариации биохимических показателей крови песчанок. Сравнительные данные приведены в табл. 5.
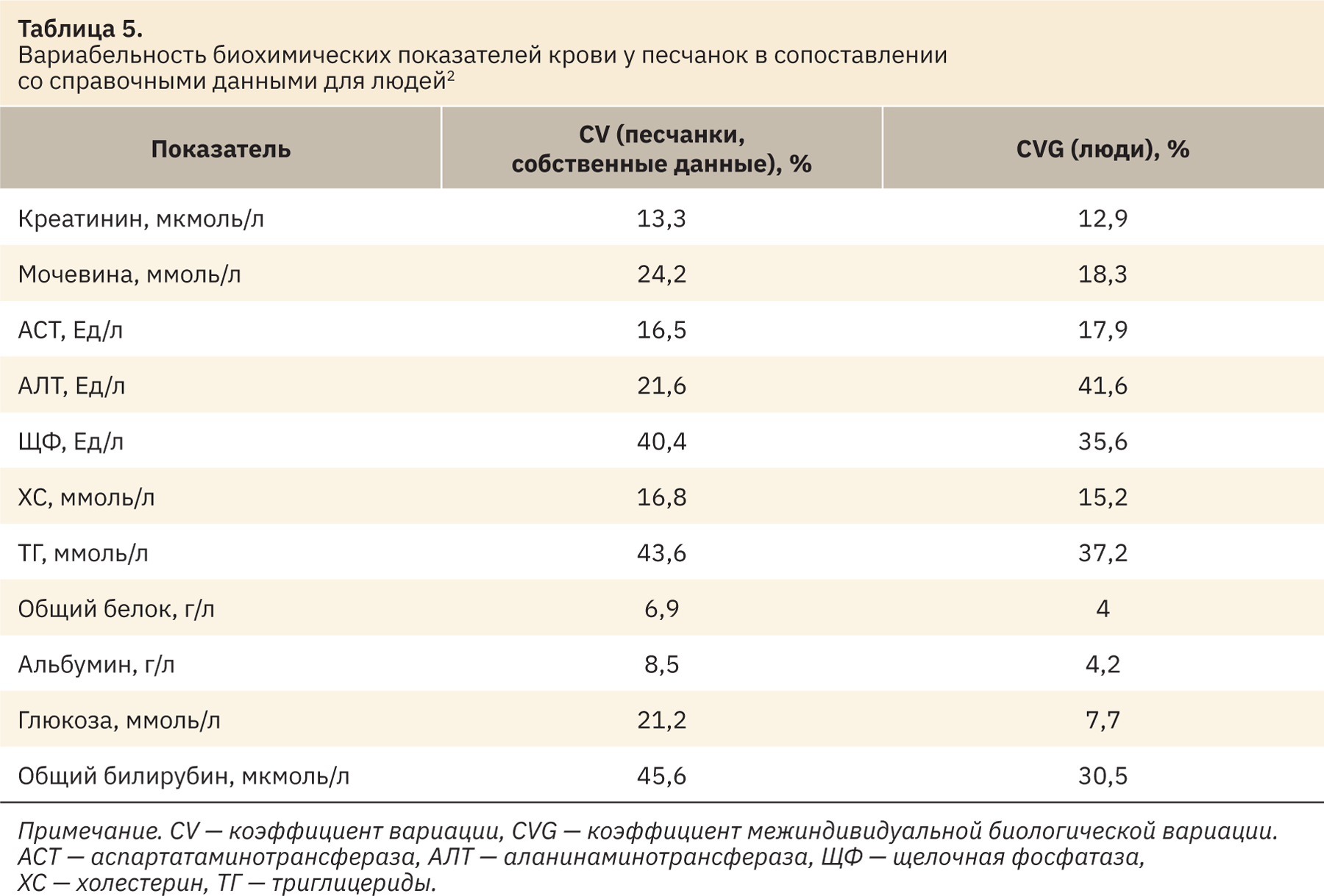
Схожая вариабельность c человеком отмечена по таким показателям, как креатинин, аспартатаминотрансфераза, щелочная фосфатаза, холестерин, триглицериды и общий белок. Вариабельность таких биохимических показателей крови песчанок, как мочевина, альбумин, глюкоза и общий билирубин, оказались выше, чем у человека. Вариабельность значений аланинаминотрансферазы песчанок оказалась ниже, чем у человека. Данная информация может быть полезной при интерпретации полученных результатов в доклинических исследованиях и экстраполяции данных между двумя видами.
Заключение
Надлежащее проведение доклинических исследований по оценке фармакологической активности и безопасности лекарственных средств является ключевым этапом при принятии решения о стратегии дальнейшей разработки препарата и планировании его клинических исследований. Показатели, определяющиеся в ходе биометрических исследований, позволяют установить органы-мишени токсического действия препарата, оценить динамику и обратимость эффектов, создать суждение о фармакодинамике, а также чрезвычайно важны при проведении мероприятий по мониторингу здоровья. При интерпретации данных важно учитывать не только контрольные показатели, а также сопоставлять результаты с референтными интервалами. Таким образом, представленные данные вариабельности биохимических показателей крови у песчанок будут способствовать повышению качества интерпретации результатов доклинических исследований и позволят точнее определить соотношение польза/риск.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
М.В. Мирошников — идея разработки темы и обоснование актуальности работы, написание, редактирование и доработка текста рукописи, ответственность за все аспекты работы, связанные с достоверностью данных.
К.Т. Султанова — написание и редактирование текста рукописи, обобщение результатов исследования, работа с табличным материалом.
М.А. Ковалева — анализ научной и методической литературы, научное редактирование текста рукописи.
- EU Directive 2010/63/EU Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes.
- ГОСТ Р 53022.2–2008 Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 2. Оценка аналитической надежности методов исследования (точность, чувствительность, специфичность) Москва, 2008. [GOST R 53022.2–2008 Tekhnologii laboratornye klinicheskie. Trebovaniya k kachestvu klinicheskih laboratornyh issledovanij. CHast’ 2. Ocenka analiticheskoj nadezhnosti metodov issledovaniya (tochnost’, chuvstvitel’nost’, specifichnost’) Moskva, 2008. (In Russ.)].
Список источников
-
Рыбакова А.В., Макарова М.Н. Использование песчанок для биомедицинских исследований // Международный вестник ветеринарии. 2017. № 2. С. 117–124. [Rybakova A.V., Makarova M.N. Ispol’zovanie peschanok dlya biomedicinskih issledovanij // Mezhdunarodnyj vestnik veterinarii. 2017. N. 2. P. 117–124. (In Russ.)].
-
Вавилова В.А., Гущин Я.А. Моделирование глобальной церебральной ишемии у монгольских песчанок // Лабораторные животные для научных исследований. 2019. № 2. С. 1–17. [Vavilova V.A., Gushchin YA.A. Modelirovanie global’noj cerebral’noj ishemii u mongol’skih peschanok // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2019. N. 2. P. 1–17. (In Russ.)]. DOI: 10.29296/2618723X-2019-02-03.
-
Hickman D.L., Johnson J., Vemulapalli T.H. et al. Commonly used animal models // Principles of animal research for graduate and undergraduate students. 2017. P. 117. DOI: 10.1016/B978-0-12-802151-4.00007-4.
-
Batchelder M., Keller L.S., Sauer M.B. et al. Gerbils // The laboratory rabbit, guinea pig, hamster, and other rodents. Academic Press, 2012. P. 1131–1155. DOI: 10.1016/B978-0-12-380920-9.00052-3.
-
Bleich E.M., Martin M., Bleich A. et al. The Mongolian gerbil as a model for inflammatory bowel disease // International journal of experimental pathology. 2010. Vol. 91. N. 3. P. 281–287. DOI: 10.1111/j.1365-2613.2009.00701.x.
-
Гущин Я.А., Крышень А.А. Апробация модели инфекционного, ассоциированного Helicobacter pylori, воспаления желудочно-кишечного тракта у лабораторных песчанок // Лабораторные животные для научных исследований. 2020. № 3. С. 57–67. [Gushchin YA.A., Kryshen’ A.A. Aprobaciya modeli infekcionnogo, associirovannogo Helicobacter pylori, vospaleniya zheludochno-kishechnogo trakta u laboratornyh peschanok // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2020. N. 3. P. 57–67. (In Russ.)]. DOI: 10.29296/2618723X-2020-03-08.
-
Mestecky J., Kelsall B.L., Strober W. et al. Mucosal immunology. Academic Press, 2015.
-
Zhang W., Ami Y., Suzaki Y. et al. Mongolia gerbils are broadly susceptible to hepatitis E virus // Viruses. 2022. Vol. 14. N. 6. P. 1125. DOI: 10.3390/v14061125.
-
Hayles L.B. Susceptibility of the Mongolian gerbil (Meriones unguiculatus) to Western equine encephalitis // Canadian Journal of Microbiology. 1972. Vol. 18. N. 6. P. 941–944. DOI: 10.1139/m72-145.
-
Ikegami T., Makino S. The pathogenesis of Rift Valley fever // Viruses. 2011. Vol. 3. N. 5. P. 493–519. DOI: 10.3390/v3050493.
-
Bertorelli R., Adami M., Ongini E. The Mongolian gerbil in experimental epilepsy // The Italian Journal of Neurological Sciences. 1995. Vol. 16. P. 101–106. DOI: 10.1007/BF02229081.
-
Buckmaster P.S. Inherited epilepsy in Mongolian gerbils // Models of seizures and epilepsy. 2006. P. 273–294.
-
Song M., Ahn J.H., Kim H. et al. Chronic high-fat diet-induced obesity in gerbils increases pro-inflammatory cytokines and mTOR activation, and elicits neuronal death in the striatum following brief transient ischemia // Neurochemistry International. 2018. Vol. 121. P. 75–85. DOI: 10.1016/j.neuint.2018.09.009.
-
Shafrir E., Ziv E., Kalman R. Nutritionally induced diabetes in desert rodents as models of type 2 diabetes: Acomys cahirinus (spiny mice) and Psammomys obesus (desert gerbil) // ILAR journal. 2006. Vol. 47. N. 3. P. 212–224. DOI: 10.1093/ilar.47.3.212.
-
Hong W., Zhang T., Yan J. et al. Bioinformatics analysis of an animal model of diet-induced nonalcoholic fatty liver disease with rapid progression // Experimental Biology and Medicine. 2022. Vol. 247. N. 3. P. 263–275. DOI: 10.1177/1535370221105509.
-
Li W., Guan Z., Brisset J.C. et al. A nonalcoholic fatty liver disease cirrhosis model in gerbil: the dynamic relationship between hepatic lipid metabolism and cirrhosis // International journal of clinical and experimental pathology. 2018. Vol. 11. N. 1. P. 146.
-
Mallek A., Movassat J., Ameddah S. et al. Experimental diabetes induced by streptozotocin in the desert gerbil, Gerbillus gerbillus, and the effects of short-term 20-hydroxyecdysone administration // Biomedicine & pharmacotherapy. 2018. Vol. 102. P. 354–361. DOI: 10.1016/j.biopha.2018.03.070.
-
Ventura L.L.A., Fortes N.C., Santiago H.C. et al. Gerbils (Meriones unguiculatus) as a new experimental model of obesity induced by diet // PeerJ Preprints. 2016. P. e2535v1. DOI: 10.7287/peerj.preprints.2535v1.
-
Mallek A., Movassat J., Ameddah S. et al. Experimental diabetes induced by streptozotocin in the desert gerbil, Gerbillus gerbillus, and the effects of short-term 20-hydroxyecdysone administration // Biomedicine & pharmacotherapy. 2018. Vol. 102. P. 354–361. DOI: 10.1016/j.biopha.2018.03.070.
-
Мирошников М.В., Султанова К.Т., Ковалева М.А. и др. Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 6: яванские макаки // Лабораторные животные для научных исследований. 2022. № 2. С. 14–25. [Miroshnikov M.V., Sultanova K.T., Kovaleva M.A. et al. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referentnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 6: yavanskie makaki // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2022. N. 2. P. 14–25. (In Russ.)]. DOI: 10.29296/2618723X-2022-02-02.
-
Washington I.M., van Hoosier G. Clinical biochemistry and hematology // The laboratory rabbit, guinea pig, hamster, and other rodents. Academic Press, 2012. Р. 57–116.
-
Heatley J.J., Harris M.C. Hamsters and gerbils // Manual of exotic pet practice. WB Saunders, 2009. P. 406–432.
-
Otto-Duessel M., Aguilar M., Moats R. et al. Antioxidant-mediated effects in a gerbil model of iron overload // Acta haematologica. 2007. Vol. 118. N. 4. P. 193–199. DOI: 10.1159/000109879.
-
Atmaca N., Cinar M., Güner B. et al. Evaluation of oxidative stress, hematological and biochemical parameters during Toxoplasma gondii infection in gerbils // Ankara Üniversitesi Veteriner Fakültesi Dergisi. 2015. Vol. 62. N. 3. P. 165–170. DOI: 10.1501/Vetfak_0000002675.
-
Li X., Lu J., Wang Y. et al. Establishment and characterization of a newly established diabetic gerbil line // PLoS one. 2016. Vol. 11. N. 7. P. e0159420. DOI: 10.1371/journal.pone.0159420.
-
Shimizu M., Iida K., Yoshida H. et al. Electrophoretic study of lactate dehydrogenase and alkaline phosphatase isoenzymes of the Mongolian gerbil (Meriones unguiculatus) // Journal of veterinary medical science. 1996. Vol. 58. N. 5. P. 401–406. DOI: 10.1292/jvms.58.401.
-
Soomro M.H., Shi R., She R. et al. Molecular and structural changes related to hepatitis E virus antigen and its expression in testis inducing apoptosis in Mongolian gerbil model // Journal of viral hepatitis. 2017. Vol. 24. N. 8. P. 696–707. DOI: 10.1111/jvh.12690.
-
Wasan K.M., Najafi S., Wong J. et al. Assessing plasma lipid levels, body weight, and hepatic and renal toxicity following chronic oral administration of a water soluble phytostanol compound, FM-VP4, to gerbils // J. Pharm. Sci. 2001. Vol. 4. N. 3. P. 228–234.
-
Васютина М.Л., Галагудза М.М., Гущин Я.А. и др. Референтные интервалы. Показатели нормы у лабораторных животных // Консультант GLP-Planet 2022. Мнение фармацевтической отрасли. Санкт-Петербург: Акционерное общество «Научно-производственное объединение «ДОМ ФАРМАЦИИ». 2022. С. 72–95. [Vasyutina M.L., Galagudza M.M., Gushchin Ya.A. et al. Referentnye intervaly. Pokazateli normy u laboratornyh zhivotnyh // Konsul’tant GLP-Planet 2022. Mnenie farmacevticheskoj otrasli. Sankt-Peterburg: Akcionernoe obshchestvo “Nauchno-proizvodstvennoe ob’edinenie “DOM FARMACII”. 2022. P. 72–95. (In Russ.)]. DOI: 10.57034/978-5-6048955-0-4-s4.
-
McKeon G.P., Nagamine C.M., Felt S.A. Hamsters and Gerbils // Exotic Animal Laboratory Diagnosis. 2020. P. 113–128.
-
Fisher P.G. Exotic mammal renal disease: causes and clinical presentation // Veterinary Clinics: Exotic Animal Practice. 2006. Vol. 9. N. 1. P. 33–67. DOI: 10.1016/j.cvex.2005.10.004.
- McClure D.E. Clinical pathology and sample collection in the laboratory rodent // Veterinary Clinics of North America: Exotic Animal Practice. 1999. Vol. 2. N. 3. P. 565–590. DOI: 10.1016/S1094-9194(17)30111-1.




