Определение сроков декальцинации образцов грудины, коленного сустава и препарата носовых ходов мышей, песчанок и хомячков
Устенко Ж.Ю., Лосева Е.А., Савватейкина А.И. Определение сроков декальцинации образцов грудины, коленного сустава и препарата носовых ходов мышей, песчанок и хомячков. Лабораторные животные для научных исследований. 2023; 2. https://doi.org/10.57034/2618723X-2023-02-06
Резюме
При проведении гистологии костной ткани необходима предварительная процедура декальцинации. Декальцинация — это вымывание солей кальция из органического матрикса кости. Наиболее часто в качестве декальцинирующего раствора используют растворы различных кислот. Для декальцинации можно отбирать целую кость или выпиленный предварительно фрагмент. В доклинических исследованиях часто требуется исследование коленного сустава, носовых ходов на всем протяжении. При исследовании костного мозга также чаще отбирают грудную кость. Выпиливание маленького фрагмента в доклинических исследованиях часто приводит к повреждению образца из-за маленького размера объектов. Поэтому для исследования в основном отбирают верхнюю челюсть и грудину целиком, препарат коленного сустава с включением берцовых и бедренной костей. В данной статье оценивали сроки декальцинации упомянутых образцов, отобранных у мыши, песчанки и хомячка при использовании в качестве декальцинирующего раствора смеси муравьиной и соляной кислот. Декальцинирующий раствор заменяли через день. Степень декальцинации и готовность образцов к гистологической проводке оценивали гравиметрическим методом. Установлено, что тенденции в изменении массы образцов и продолжительности декальцинации одинаковы для всех перечисленных животных. Ни в одном случае в течение 10 дней не удалось достичь абсолютной декальцинации. Однако степень декальцинации целых образцов кости оказалась достаточной для получения качественного гистологического среза. Все отобранные типы образцов достигли достаточной степени декальцинации на 4-й день. При такой продолжительности декальцинации можно оценивать морфологию респираторного и обонятельного эпителия носовых ходов, хряща сустава и клеток костного мозга. Если необходимо также исследовать анатомо-топографические связи и важна наилучшая их сохранность, срок декальцинации препаратов коленного сустава и носовых ходов допускается продлить до 7 дней. Декальцинация более 7 дней приводила к необратимым изменениям морфологии клеток. Клетки были плохо детализированы, ядра клеток хуже окрашивались гематоксилином, границы клеток были нечеткими.
Введение
Гистологическое исследование костной ткани невозможно без предварительной декальцинации образца. Декальцинация подразумевает вымывание при помощи специальных растворов солей кальция из органического матрикса предварительно зафиксированной кости. Фиксируют костные образцы наиболее часто, как и другие ткани, в 10% забуференном формалине [1]. При выборе декальцинирующего раствора следует учитывать цели исследования, планируемую в дальнейшем окраску и возможности конкретной лаборатории [2]. Наиболее часто в качестве декальцинирующего раствора используют растворы различных кислот [2]. Декальцинации можно подвергать исследуемую кость как целиком, так и предварительно выпиленный ее образец.
В доклинических испытаниях при исследовании образцов кости, в частности, костей тазовой конечности с включением коленного сустава, костей черепа и грудины, часто требуется сохранение анатомо-топографических связей [3]. Маленькие размеры животных часто не позволяют изъять интересующую область с сохранением целостности всех структур и их анатомо-топографических связей, поэтому декальцинации подвергают целиком череп, коленный сустав с бедренной и берцовыми костями, грудину. Дальнейшую вырезку проводят на декальцинированном материале [2].
Такой подход позволяет провести вырезку точно и аккуратно, сохранив интересующие анатомо-топографические связи. Однако он имеет и ряд недостатков: большие размеры образца ведут к более длительному проникновению декальцинирующего раствора и, как следствие, более длительной декальцинации; другие ткани интересующего органа (например, эпителий носовых ходов при исследовании препарата черепа или клетки костного мозга при исследовании грудины) чувствительны к слишком длительной декальцинации и могут быть значительно повреждены, что снижает качество последующего гистологического исследования.
Таким образом, важно выявить оптимальное время декальцинации образцов, которое, с одной стороны, позволит удалить достаточное количество солей из костной ткани для получения тонкого среза, а с другой — сохранит остальные ткани целыми и пригодными для гистологического анализа.
В предыдущей работе [4], сравнив доступные методы оценки конечной точки декальцинации, мы выявили, что гравиметрический метод является оптимальным по соотношению временных и финансовых затрат на его применение к полученному результату.
Цель данной работы — определить при помощи гравиметрического метода оптимальный срок декальцинации образцов носовых ходов, коленного сустава и грудины трех видов животных (мышь, песчанка и хомячок), а также описать гистологические артефакты при недостаточной или избыточной декальцинации.
Материал и методы
Исследование проводили в «НПО «ДОМ ФАРМАЦИИ», в качестве биологических тест-систем использовали самок мышей линии ICR-CD1 (n=9), самок и самцов песчанок (n=9), самок и самцов хомячков (n=8). Для исследования отбирали животных контрольных групп, подлежащих плановой эвтаназии в ходе текущих экспериментов. Специально для данного исследования животных не использовали. Эвтаназию проводили, применяя СО2‑камеру в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.10 по охране животных, используемых в научных целях1.
Отбор образцов и процедура декальцинации
Для исследования отбирали следующие образцы: грудная кость, препарат коленного сустава, препарат верхней челюсти с сохраненными носовыми ходами. От грудной кости отделяли ребра, мягкие ткани и мечевидный хрящ. Препарат коленного сустава получали, перерезая проксимально бедренную кость посередине длины и дистально большую и малую берцовые кости на уровне середины длины. Мягкие ткани также удаляли. Верхнюю челюсть с носовыми ходами очищали от кожи и мышц, удаляли глазные яблоки, отделяли нижнюю челюсть и перерезали череп поперечно на уровне глазниц.
Отобранные образцы фиксировали в 10% нейтральном забуференном формалине (Лабико, РФ) в соотношении 1:20. Время фиксации составило 72 ч. Декальцинацию проводили в электролитном декальцинирующем растворе (Лабико, РФ), представляющем смесь муравьиной и соляной кислот. Смену декальцинирующего раствора проводили через день. В каждой из групп образцы от 2 животных изъяли из эксперимента на 4‑й день декальцинации. На 7‑й день в группе мышей и песчанок изъяли образцы от 4 животных, а в группе хомячков — от 3. Для оставшихся образцов декальцинацию прекратили на 10‑й день.
Определение конечной точки декальцинации
Полученные образцы оценивали гравиметрическим методом. Образцы взвешивали после отбора и окончания срока фиксации в течение 9 дней декальцинации ежедневно. Процедуру проводили на аналитических весах 2‑го класса точности Adventurer RV 214 (AR 2140) (OHAUS, Китай), для чего образцы извлекали пинцетом из декальцинирующего раствора и промокали салфеткой для удаления излишков жидкости.
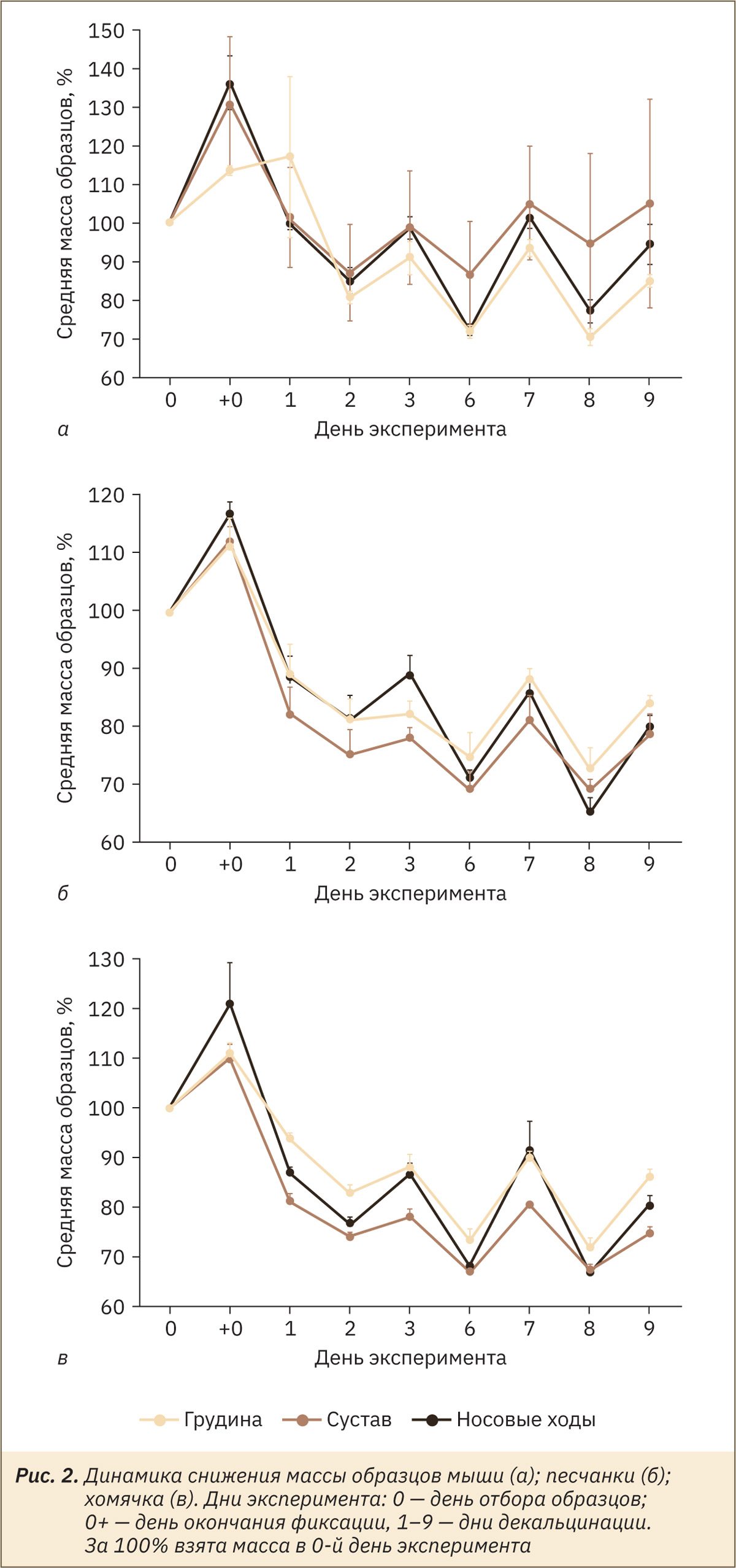
Для демонстрации данные массы образцов в каждый из дней эксперимента переводили в процентные значения. За 100% была взята масса образца в нулевой день эксперимента. Для полученных данных, выраженных в процентах, считали среднее и стандартную ошибку среднего в каждый из дней эксперимента. Полученные значения отмечали на графике.
Гистологическое исследование
Вырезку материала осуществляли микротомными лезвиями MX35 Premier+ (Thermo Scientific, США) следующим образом: препарат сустава разрезали на 2 половины в медианной плоскости и помещали одну половину в кассету; препарат носовых ходов последовательно разрезали в поперечной плоскости с ходом 4 мм и укладывали в кассеты 3 образца. Грудину помещали в кассету целиком (рис. 1).

В дальнейшем кассеты с образцами подвергали стандартной гистологической проводке: промывка, обезвоживание в батарее восходящих спиртов, пропитывание и заливка в парафин. Полученные парафиновые блоки охлаждали и нарезали на ротационном микротоме Accu-Cut® SRM™ 200 (Sakura, Нидерланды) на срезы толщиной 2–4 мкм. Срезы наносили на предметное стекло, сушили и красили гематоксилином и эозином.
Результаты и их обсуждение
Оценка контрольной точки
Масса всех образцов в каждой группе увеличивалась после фиксации. С 1‑го дня декальцинации отмечали уменьшение массы образцов.
Для всех исследуемых групп животных все отобранные образцы демонстрировали одинаковые тенденции в изменении массы. Плавное снижение массы образцов наблюдали в течение первых 2 суток декальцинации, далее она колебалась в пределах 52–153% от исходной. Результаты гравиметрического анализа представлены на рис. 2. Данные представлены в виде средних значений массы и стандартной ошибки среднего.
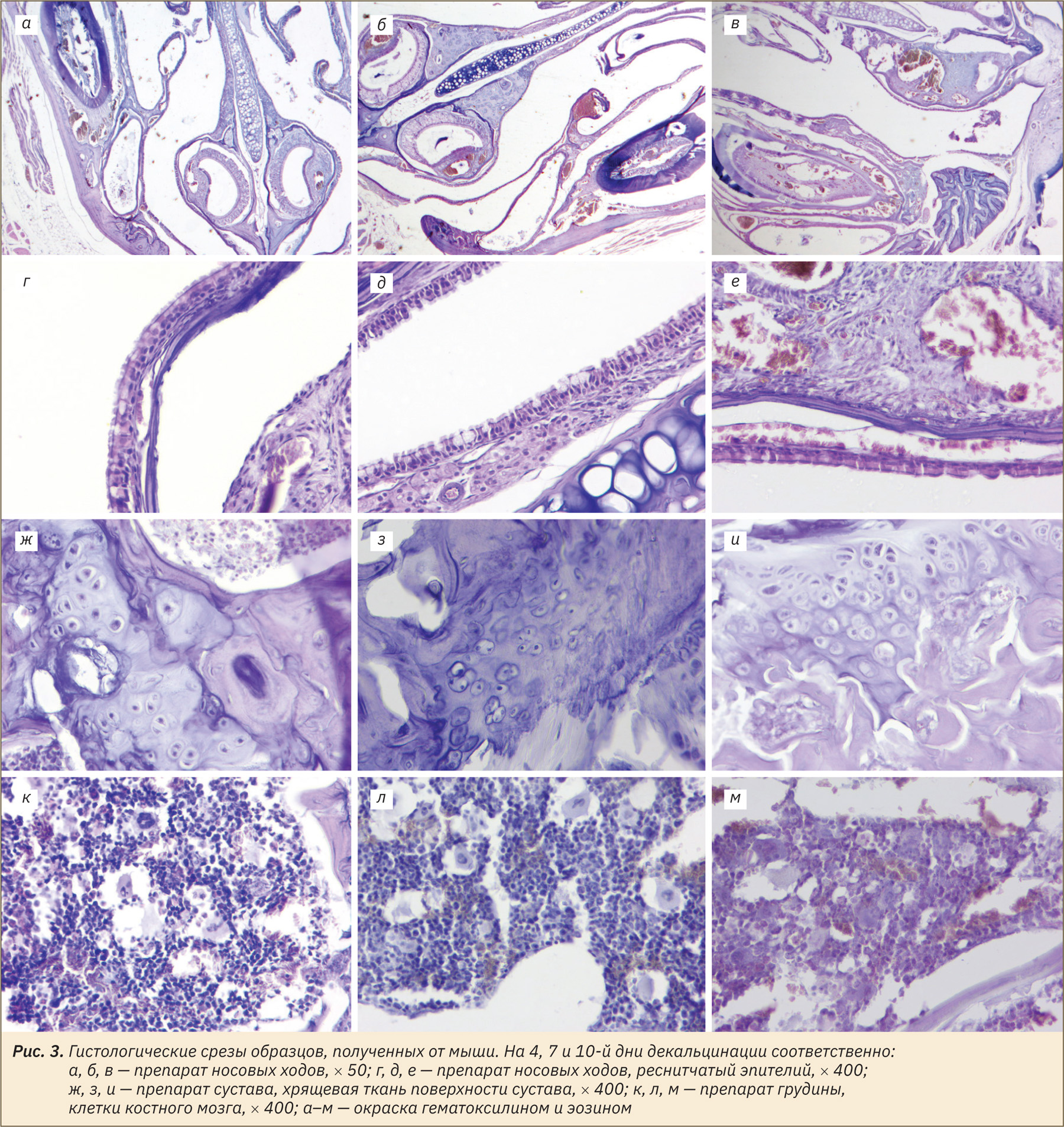
Результаты гистологического исследования костей с разным сроком декальцинации
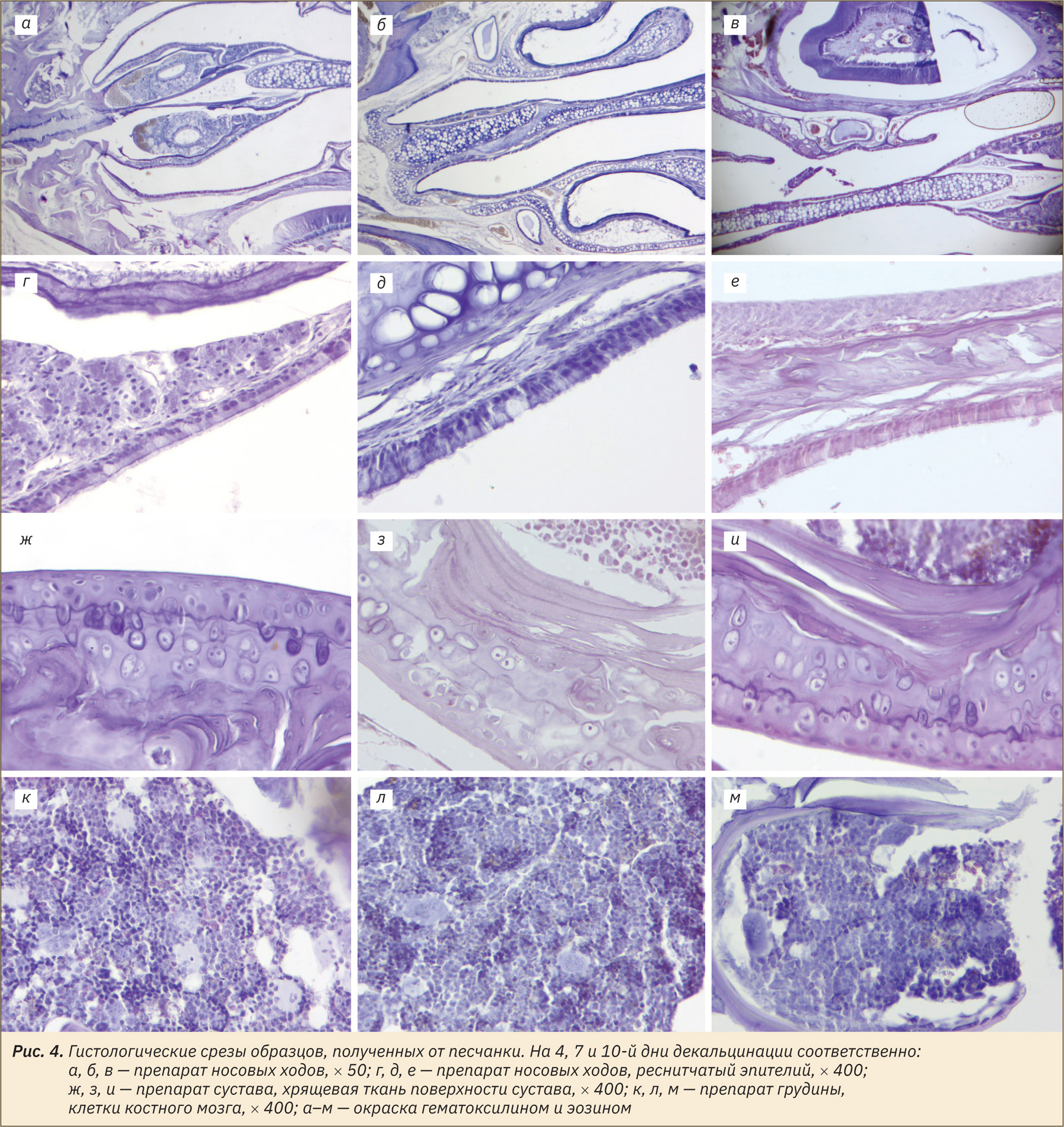
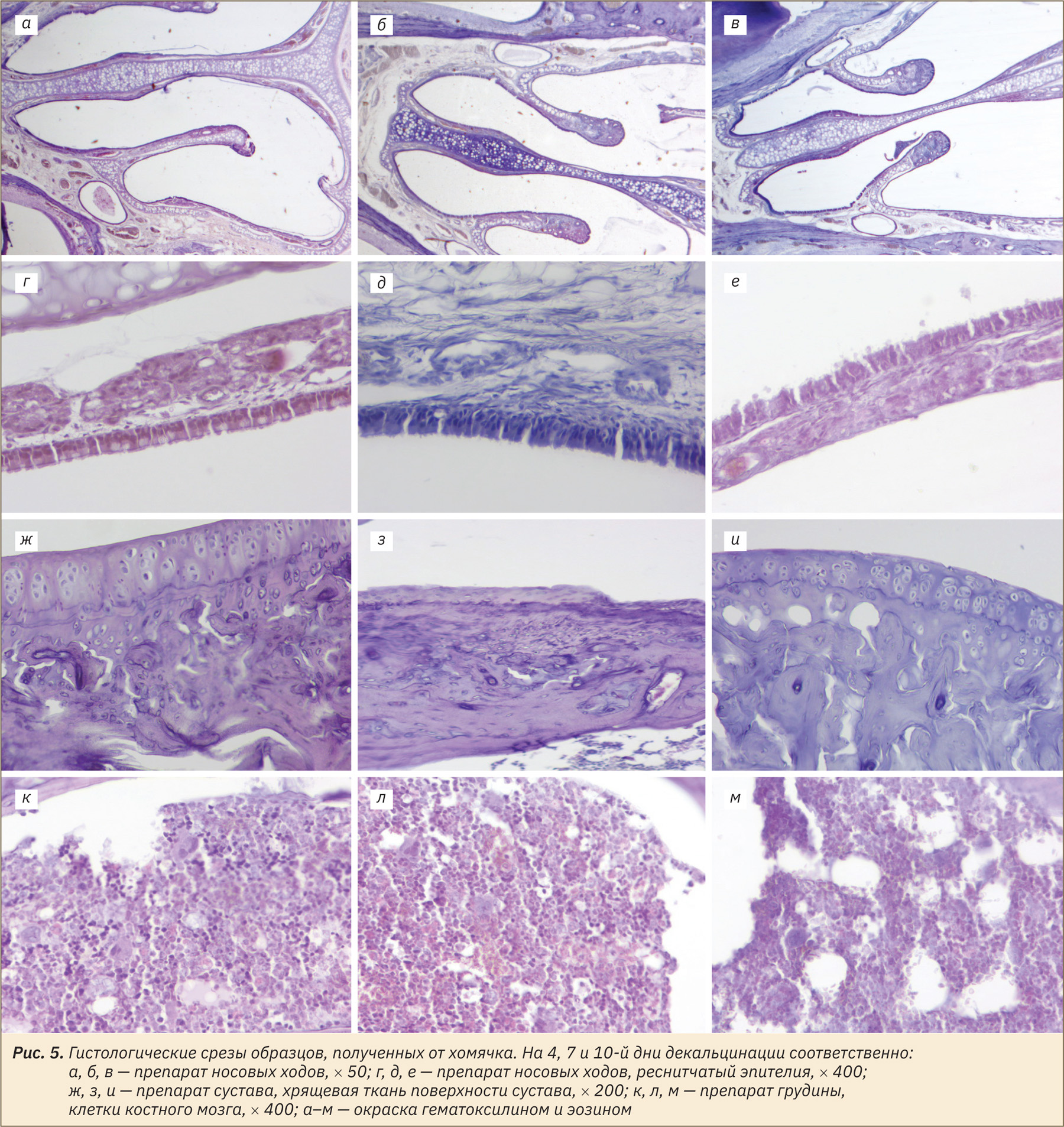
Во всех образцах, выведенных из эксперимента на 4‑й день, отмечали артефакты микротомии: окраску «полосами», разрывы. Однако целостность морфологии в преимущественном большинстве образцов была удовлетворительно сохранена. Сохранность взаимной ориентации тканей была достаточной для оценки анатомо-топографических отношений. Часть костных трабекул в образцах все еще содержала минерализованные очаги. Отмечали отличную сохранность эпителия носовых ходов и клеток костного мозга. Качество детализации клеток костного мозга в данных образцах и толщина получаемого среза позволяли провести обзорную оценку структур костного мозга.
Образцы, выведенные из эксперимента на 7‑й день, имели меньше артефактов микротомии. Морфология срезов преимущественно хорошо сохранена. Бо́льшая часть образцов также еще содержала минерализованные очаги. Эпителий носовых ходов в данных образцах хорошо детализирован. Клетки костного мозга грудины хуже восприняли красители, особенно гематоксилин, и были менее детализированы.
В образцах, выведенных из эксперимента на 10‑й день, отметили отличную степень декальцинации и хорошую сохранность морфологии, небольшое количества очагов минерализации костных трабекул, ярко выраженную деминерализацию тканей зубов. Однако клетки эпителия носовых ходов и костного мозга, а также хондроциты и остеоциты имели плохую детализацию, ядра плохо воспринимали гематоксилин, границы клеток преимущественно не просматривались.
Несмотря на различия в размерах, массе и анатомической конфигурации образцов костей, отобранных от трех видов животных, не отмечено существенных различий во влиянии длительности декальцинации на качество полученного препарата.
Репрезентативные фото, отражающие морфологию клеток в зависимости от длительности декальцинации, представлены на рис. 3–5.
Заключение
В результате данного исследования можно подтвердить вывод предыдущего исследования об удобстве и точности гравиметрического метода для оценки сроков декальцинации образцов костной ткани, а также рекомендовать данный метод для стандартизации методики декальцинации типовых образцов в лаборатории. Следует отметить, что стандартизацию рекомендуется проводить в рамках конкретной лаборатории при первичной отработке методики, так как на длительность процесса декальцинации могут повлиять выбранный декальцинирующий раствор, частота его смены, методика отбора образцов, температурные условия в лаборатории.
На основании результатов, полученных в данном исследовании, можно заключить, что при использовании декальцинирующего раствора из смеси соляной и муравьиной кислот образцы грудины, препараты суставов и носовых ходов, отобранные от мышей, песчанок и хомячков, достигают достаточной для рутинного токсикологического исследования степени декальцинации на 4‑й день. Толщина среза на данном сроке достаточна для рутинной световой микроскопии, при этом окраска равномерная, детализация структур клеток и их границ четкая.
Для препаратов носовых ходов и коленного сустава допустимой является декальцинация до 7 дней, так как образцы продемонстрировали достаточную для адекватной оценки сохранность клеток эпителия носовых ходов, хондроцитов и остеоцитов. Увеличение срока декальцинации от минимального может быть необходимо в случае, если основной интерес исследования представляют непосредственно костная или хрящевая ткани и их анатомо-топографические отношения. Образцы грудины при необходимости исследования костного мозга не следует подвергать длительной декальцинации, так как морфология клеток необратимо ухудшается.
В рамках данного исследования очаги минерализации отмечались на всех сроках декальцинации. Аналогичное наблюдение отмечено в предыдущем исследовании на образцах крыс. Для получения максимально сохранных с точки зрения анатомо-топографических связей и морфологии клеток образцов можно рекомендовать вырезку интересующих участков на 2‑й день декальцинации и продолжение декальцинации только для вырезанных кусочков.
На основании полученных в исследовании данных можем рекомендовать следующий протокол декальцинации образцов костной ткани мышей, песчанок и хомячков:
1) 1–3‑й день: отбор материала и фиксация;
2) 4‑й день (1‑й день декальцинации): замена фиксатора на декальцинирующий раствор;
3) 5‑й день (2‑й день декальцинации): вырезка интересующего участка (если необходимо);
4) 6‑й день (3‑й день декальцинации): замена декальцинирующего раствора на свежий;
5) 7‑й день (4‑й день декальцинации): по результатам оценки степени декальцинации:
- 5.1) промывка образца и начало дальнейшей гистологической проводки или помещение в 10% забуференный формалин для хранения в случае если степень декальцинации достаточная;
- 5.2) если декальцинация неудовлетворительная, повторить пункты 4, 5 до достижения достаточной степени декальцинации образца.
Рекомендуется проводить корректировку сроков декальцинации гравиметрическим методом при смене типа декальцинирующего раствора, его поставщика, а также при обработке нового типа образцов.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Вклад авторов
Ж.Ю. Устенко — идея, концепция и дизайн исследования, сбор и систематизация материала, написание и редактирование текста статьи, подготовка фотоматериалов для статьи.
Е.A. Лосева — сбор и систематизация материала, написание и редактирование текста статьи.
А.И. Савватейкина — сбор и систематизация материала, написание и редактирование текста статьи.
- Директива 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях / пер. с англ. яз. М.С. Красильщиковой, И.В. Белозерцевой. Санкт-Петербург, 2012. 50 с.
Список источников
-
Пешков М.В. Декальцинация в гистологической лабораторной технике // Архив патологии. 2012. № 6. С. 43–45. [Peshkov M.V. Dekal’cinaciya v gistologicheskoj laboratornoj tekhnike // Arhiv patologii. 2012. N. 6. P. 43–45. (In Russ.)].
-
Skinner R.A. Decalcification of Bone Tissue: in Handbook of Histology Methods for Bone and Cartilage / edited by Yuehuei H. An and Kylie L. Martin. Humana Press: Totowa, New Jersey, 2003. 588 p.
-
Morgan K.T. Approaches to the identification and recording of nasal lesions in toxicology studies // Toxicology Pathology. 1991. Vol. 19. N. 4. P. 337–351.
- Устенко Ж.Ю., Викулина Д.А., Гущин Я.А. Определение сроков декальцинации образцов грудины, коленного сустава и препарата носовых ходов крыс //Лабораторные животные для научных исследований. 2021. № 3. С. 17–26. [Ustenko Zh.Yu., Vikulina D.A., Gushchin Ya.A. Opredelenie srokov dekal’tsinatsii obraztsov grudiny, kolennogo sustava i preparata nosovykh khodov krys // Laboratornye zhivotnye dlya nauchnykh issledovanii. 2021. N. 3. P. 17–26. (In Russ.)]. DOI: 10.29296/2618723X-2021‑03‑03.




