Новые биосинтетические имплантаты для хирургического лечения туберкулеза легких
Работа выполнена без спонсорской поддержки.
Токаев Т.К., Синицын М.В., Бикбаев А.С., Григорьев Т.Е., Загоскин Ю.Д., Штыхно А.О. Новые биосинтетические имплантаты для хирургического лечения туберкулеза легких. Лабораторные животные для научных исследований. 2023; 2. https://doi.org/10.57034/2618723X-2023-02-04
Резюме
Проводилось экспериментальное испытание биосовместимых биодеградируемых высокопористых плевральных имплантатов для хирургического лечения деструктивного туберкулеза легких. Лабораторным животным имплантировали высокопористый биорезорбируемый материал на основе полилактида и поликапролактона. Изучали морфологическую картину имплантатов и местных тканей после интраплевральной имплантации через 7, 21, 54, 66 и 78 нед, животных выводили из эксперимента путем передозировки средств для наркоза. В качестве экспериментальных животных использовали половозрелых самок кроликов породы шиншилла, возраст к началу исследования 1–1,5 года, масса тела 3500–4300 г. При изучении морфологической картины имплантатов в течение длительного эксперимента наблюдали хорошую биосовместимость, что проявлялось отсутствием некроза в имплантатах и окружающих тканях. В имплантатах с течением времени формируется капсула, начиная с 7-й недели, протекают процессы васкуляризации, которые происходят в начале в поверхностных отделах с развития мелких сосудов капиллярного типа, в последующем наблюдается врастание сосудов в толщу имплантатов и формирование, помимо капилляров, тонкостенных сосудов синусоидного типа, а также и более крупных сосудов (артерий и вен). В прилежащих мягких тканях (легкое, плевра, мягкие ткани грудной стенки) в 1-м и 2-м имплантационном периодах реактивные изменения минимальные, проявляются в виде очагового фиброза мышечных волокон, очаговой мононуклеарной инфильтрации в фиброзной ткани в 1-м имплантационном периоде (7 нед), а также в виде слабовыраженной клеточной инфильтрации в отдельных полях зрения в прилежащих мягких тканях во 2-м периоде. При дальнейшем исследовании в 3, 4 и 5-м трансплантационных периодах перифокальных изменений не отмечено. Изучены морфологические изменения в имплантате и прилежащих тканях грудной стенки. Доказано, что высокопористый плевральный имплантат на основе полилактида и поликапролактона имеет хорошую биосовместимость и биобезопасность, является перспективным материалом для общей торакальной хирургии и хирургического лечения деструктивного распространенного туберкулеза легких.
Введение
В хирургии туберкулеза легких до сих пор не решена проблема коррекции объема плевральной полости или заполнения остаточных полостей больших объемов, возникающих в результате хирургических вмешательств, таких как комбинированные резекции легкого или экстраплевральный пневмолиз. Хирургические методы коррекции объема плевральной полости (различные виды торако-, торакомио-, диафрагмо-, оментопластика), применяемые до настоящего времени, травматичны, зачастую сопровождаются деформацией грудной клетки и выраженным послеоперационным болевым синдромом, что существенно снижает качество жизни пациента [1–4].
Используемые имплантируемые материалы природного происхождения (коллаген, коллагеновые губки, структурированный коллаген, фибриноген, желатин, гиалуроновая кислота и др.) характеризуются быстрыми сроками резорбции, недостаточными для проявления коллапсохирургического эффекта [5–10]. Биостабильные материалы синтетического происхождения (пенополиуретан, стеклопластик, полиметилметакрилат, полистирол, силикон и др.) вызывают различные осложнения воспалительного характера как в ранние, так и в отдаленные сроки наблюдения.
В настоящее время лучшими из существующих имплантируемых изделий для экстраплевральной имплантации являются грудные силиконовые имплантаты, хотя они и имеют определенные недостатки, характерные для биостабильных материалов, и не предназначены для плевральной имплантации [11–15].
Несмотря на удовлетворительные непосредственные результаты имплантации биостабильных имплантатов в интра- или экстраплевральную полость, большинство осложнений наблюдается в отдаленные сроки — через 10 лет и более [16–18].
Оптимальным вариантом решения этой проблемы является разработка так называемой биологической пломбы, то есть использование таких пломбировочных материалов, через которые могла бы в процессе биорезорбции прорастать собственная рыхлая соединительная ткань и за счет этого обеспечивать временный или длительный обратимый или необратимый коллапсохирургический эффект. Однако до настоящего времени не разработано таких объемных пломбировочных изделий, которые бы имели все необходимые физико-механические и биологические свойства.
Перспектива разработки необходимых материалов связана с применением технологий тканевой инженерии и регенеративной медицины.
Цель исследования — экспериментальное испытание биосовместимых биодеградируемых высокопористых плевральных имплантатов для хирургического лечения деструктивного туберкулеза легких.
Материал и методы
В качестве имплантата применяли губчатые материалы на основе смеси полилактида (PLA марки «Nature Works» №4032D, США, со средневесовой молекулярной массой 200 кДа и индексом полидисперсности 2) и поликапролактона (PCL марки «SigmaAldrich» №440744, США, со среднечисловой молекулярной массой 80 кДа и индексом полидисперсности 2). В качестве экспериментальных животных использовали 5 половозрелых самок кроликов породы шиншилла, возраст к началу исследования 1–1,5 года, масса тела 3500–4300 г. Животных получали из питомника ООО «Кролинфо» (Россия), экспериментальную часть исследования проводили непосредственно в питомнике. В период адаптации и эксперимента кролики содержались по 1 особи в металлических клетках с пластиковым поддоном (pазмер клетки 73×73×52 см, площадь пола клетки 4200 см2 и более, высота 45 см и более для кроликов массой от 3 до 5 кг). Условия содержания животных соответствовали требованиям Директивы 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных1. Клетки были оборудованы кормушками из нержавеющей стали, пластиковыми поилками и держателями этикеток. Подстил не использовался. Животные содержались в контролируемых условиях окружающей среды при температуре 17–23 °C и относительной влажности 30–70%. В помещениях содержания животных поддерживался 12‑часовой цикл освещения. Исследование на лабораторных животных проводили в строгом соответствии с принципами надлежащей лабораторной практики2, а также стандарта ГОСТа Р ИСО 10993‑2‑20093.
Для исследования имплантатов и местных реакций тканей in vivo, в максимально приближенных к клиническим условиям применения, использовали метод интраплевральной имплантации. Имплантируемые образцы представляли собой пористые материалы в виде диска размером 18×10 мм, который вводили интраплеврально животным. Плевральную имплантацию выполняли методом фиксации диска к внутренней поверхности грудной клетки, а именно к париетальной плевре, нерассасывающейся нитью — граница раздела имплантат/париетальная плевра. Сроки эксплантации — оценку состояния имплантата и местных реакций тканей осуществляли за 5 имплантационных периодов: 7, 21, 54, 66 и 78 нед; животных выводили из эксперимента путем передозировки эфирного наркоза. На каждую точку эксплантации использовали по одному животному. Фрагменты ткани (имплантат с прилежащей частью легкого и грудной стенки) фиксировали в 10% забуференном формалине, проводку осуществляли в спиртах восходящей концентрации. Готовили парафиновые блоки, изготавливали срезы толщиной 2 мкм. Окраску проводили гематоксилином Майера и эозином, по Ван-Гизону, а также использовали дополнительную окраску по Браше.
Гистологические микропрепараты изучали под микроскопом AXIO Imager A1 (ZEISS, Германия) с микрофотосъемкой на цифровую камеру CanonPowerShot A640. Сканированные изображения препаратов получали на цифровом сканере «NikonSuperCoolscan 8000 ED» (масштабная линия на сканах 1 мм). Кроме того, морфологическую картину имплантатов, ложа и окружающих тканей оценивали согласно ГОСТу ISO 10993‑6‑20114.
Помимо рутинного микроскопического исследования, проведены гистохимические исследования — окраску по Ван-Гизону использовали для выявления фиброзных структур в имплантатах (в том числе формирование и состояние фиброзной капсулы имплантатов), прилежащих тканях, то есть оценивали процессы организации. Коллагеновые волокна окрашивались в красный цвет, мышечная ткань, элементы кожи (за исключением, фиброзированных участков дермы) — в зеленовато-желтый цвет.
Результаты
Результаты имплантации оценивали по морфологической картине в имплантатах и в местных тканях в различные сроки после интраплевральной имплантации.
Морфологическая картина в имплантатах
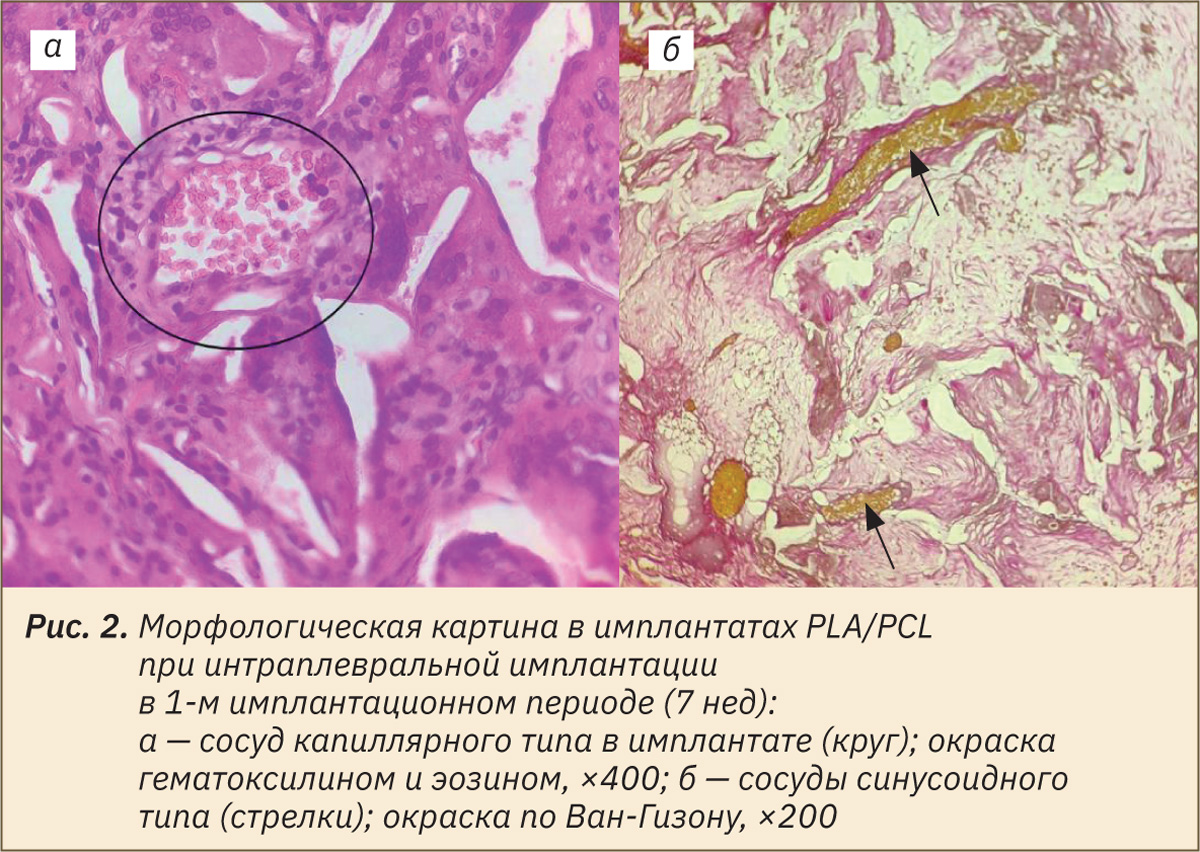
В 1‑м имплантационном периоде к 7‑й неделе вокруг имплантатов сформирована тонкая фиброзная капсула, что подтверждено окраской по Ван-Гизону. Имплантаты полностью замещены гигантскими многоядерными клетками инородных тел. В гигантских многоядерных клетках типа инородных тел имеются признаки фагоцитоза материала имплантата в виде бесформенных полупрозрачных, бесцветных или очень слабо базофильных (местами с легким сероватым оттенком) масс (рис. 1).

Субкапсулярно сформированы сосуды капиллярного типа (рис. 2, а), в то время как к 2‑му имплантационному периоду сформированы более крупные сосуды синусоидного типа (рис. 2, б).
В толще имплантата выявлена слабовыраженная мелкоочаговая лимфоидная инфильтрация (рис. 3).

Во 2‑м имплантационном периоде (21 нед) гигантские клетки инородных тел расположены в толще имплантата несколько более плотно по сравнению с 1‑м имплантационным периодом. Это обусловлено некоторым уменьшением количества материала имплантата между гигантскими многоядерными клетками типа инородных тел. При этом фагоцитоз материала имплантатов сохраняется, в цитоплазме гигантских клеток инородных тел определяются частицы материала имплантата. Мелкоочаговая мононуклеарная инфильтрация лимфоидного характера, выраженная больше, чем в 1‑м имплантационном периоде, это проявляется большим количеством инфильтратов. На рис. 4 представлены скопления плазматических клеток в толще имплантата (рис. 4, а, б). Помимо капилляров, отмечаются сосуды синусоидного типа.

К 3‑му имплантационному периоду (54 нед) гигантские клетки инородных тел в имплантате расположены более плотно по сравнению с 1‑м и 2‑м имплантационными периодами (7 и 21 нед). Количество материала имплантата уменьшено по сравнению с 1‑м и 2‑м имплантационными периодами (7 и 21 нед соответственно) (рис. 5).

В 4‑м имплантационном периоде (66 нед) гигантские клетки инородных тел расположены несколько более плотно, чем в 3‑м, между гигантскими клетками инородных тел практически отсутствует материал имплантата (рис. 6). Между гигантскими клетками инородных тел располагаются одноядерные макрофаги.

В 5‑м имплантационном периоде (78 нед) плотность расположения гигантских клеток инородных тел более выражена, чем в 3‑м и 4‑м имплантационном периодах. Между гигантскими клетками инородных тел располагаются одноядерные макрофаги (рис. 7, а). Фиброз слабо выражен, мелкоочаговый или проявляется в виде тонких рыхлых отдельно расположенных коллагеновых волокон, что подтверждено окраской на соединительную ткань (рис. 7, б, в). В толще имплантатов сосуды капиллярного, синусоидного типа и единичные более крупные сосуды, артерии и вены.

Таким образом, морфологическая картина в имплантатах при интраплевральной имплантации показывает, что в течение эксперимента в имплантатах формируется капсула, происходит уменьшение количества материала имплантатов, особенно между гигантскими клетками инородных тел. Фагоцитоз материала имплантата гигантскими клетками инородных тел сохраняется, но с течением эксперимента также становится менее выраженным.
Васкуляризация имплантатов начинается с субкапсулярных поверхностных отделов с развитием мелких сосудов капиллярного типа, последующим врастанием сосудов в толщу имплантатов, формированием, помимо капилляров, более крупных тонкостенных сосудов синусоидного типа, а также и более крупных сосудов (артерий и вен).
Выраженность лимфоидной инфильтрации имплантатов незначительно колеблется при различных сроках имплантации, наблюдается небольшая плазмоцитарная реакция, интенсивность которой изменяется при различных сроках имплантации без четкой зависимости от срока имплантации.
Явления фиброза постепенно нарастают с увеличением срока имплантации и уже к 7-й неделе отмечается субтотальный фиброз образцов.
Морфологическая оценка местных реакций тканей в различные сроки после имплантации
1‑й имплантационный период — 7 нед
В прилежащем к имплантату участке париетальной плевры очаговая мононуклеарная инфильтрация с преобладанием клеток с эксцентрически расположенным ядром, которые более соответствуют плазматическим клеткам. Мышечная и жировая ткань без изменений (рис. 8, а).
В прилежащих мягких тканях очаговый фиброз, очаговая мононуклеарная инфильтрация в фиброзной ткани (макрофагально-плазмоцитарная). Слабовыраженный диффузный фиброз жировой клетчатки. Участок плевры с умеренно выраженной диффузной мононуклеарной инфильтрацией и преобладанием плазматических клеток (рис. 8, б).

2‑й имплантационный период — 21 нед
Прилежащий к имплантату микроучасток фиброзной ткани с умеренно выраженной инфильтрацией, в инфильтрате мелкое скопление клеток с эксцентрически расположенным ядром (плазматические клетки). Фрагмент легкого с венозным полнокровием, небольшими дистелектазами, мелкоочаговой слабовыраженной лимфоидной инфильтрацией, признаков фиброзирования не найдено, что подтверждено окраской по Ван-Гизону. Сосуды и бронхи обычного строения, в стенке бронха очаговая фолликулоподобная инфильтрация. Плевра тонкая, интактная (рис. 9, а).
Прилежащие к имплантату мягкие ткани (поперечнополосатая мышечная ткань, жировая ткань) без изменений, легкое обычного строения (рис. 9, б), фрагмент костной ткани тоже, в межбалочном пространстве — красный костный мозг.

3‑й имплантационный период — 54 нед
Прилежащие к имплантату мягкие ткани — поперечнополосатая мышечная ткань (рис. 10, а), жировая клетчатка с нервными волокнами и фиброзная ткань без изменений. Фрагмент легкого с небольшими дистелектазами (рис. 10, б). Мелкоочаговая скудная лимфоидная инфильтрация, при окраске по Браше в инфильтратах и межальвеолярных перегородках единичные плазматические клетки. Сосуды и бронхи обычного строения. Слабовыраженное венозное полнокровие. Плевра тонкая интактная, фиброз не выявлен, что подтверждено соответствующими гистологическими окрасками.

4‑й имплантационный период — 66 нед
Фрагмент мягких тканей (поперечнополосатая мышечная, жировая клетчатка, фиброзная ткань) обычного строения. В одном фрагменте мышечной ткани небольшой очаговый отек. Фрагменты легкого с дистелектазами, преобладают ателектазы. Сосуды и бронхи обычного строения. Скудная мелкоочаговая лимфоидная инфильтрация. Умеренно выраженное венозное полнокровие. Париетальная плевра интактная (рис. 11, а). Висцеральная плевра тонкая интактная, без фиброза, в том числе в месте прилежания имплантата (окраска по Ван-Гизону) (рис. 11, б). В участке легкого, прилежащего к имплантату, очаговые умеренно выраженные реактивные изменения — в просвете альвеол макрофаги, десквамированный альвеолярный эпителий.

5‑й имплантационный период — 78 нед
Прилежащие мягкие ткани (поперечнополосатая мышечная ткань, жировая с нервными волокнами, фиброзная ткань) обычного строения, мелкий участок фиброза (окраска по Ван-Гизону), в одном из сосудов признаки слабовыраженного продуктивного васкулита (очаговая мононуклеарная инфильтрация, при окраске по Браше плазматических клеток не найдено) (рис. 12, б). Легкое обычного строения, очень мелкие дистелектазы (рис. 12, а). Мелкоочаговая скудная лимфоидная инфильтрация, фолликулоподобные структуры в стенке мелких бронхов. Периваскулярно слабовыраженный отек. Плевра тонкая интактная.

При морфологическом исследовании реакции местных тканей на интраплевральную имплантацию реактивные изменения местных тканей минимальные.
В 1‑м имплантационном периоде (7 нед) в прилежащих к имплантатам мягких тканях очаговый фиброз мышечных волокон, очаговая мононуклеарная инфильтрация в фиброзной ткани (макрофагально-плазмоцитарная). В прилежащей плевре мелкоочаговая плазматическая реакция.
Во 2‑м имплантационном периоде в прилежащих мягких тканях слабовыраженная клеточная инфильтрация в отдельных полях зрения.
В 3, 4 и 5‑м имплантационных периодах прилежащее к имплантатам легкое, плевра, мягкие ткани (поперечнополосатая мышечная ткань, жировая ткань) без патологических изменений.
Заключение
Экспериментальное исследование, проведенное на кроликах, показало высокую биосовместимость и биобезопасность высокопористого плеврального имплантата на основе полилактида и поликапролактона. Морфологическая картина в имплантатах при интраплевральной имплантации показывает, что в течение эксперимента в имплантатах протекают процессы фиброзирования, происходит уменьшение количества материала имплантатов особенно между гигантскими клетками инородных тел. Фагоцитоз материала имплантата гигантскими клетками инородных тел сохраняется, но с течением эксперимента также становится менее выраженным. Явления фиброза постепенно нарастают с увеличением срока имплантации, и уже к 7‑й неделе отмечается субтотальный фиброз образцов. Васкуляризация имплантатов начинается с субкапсулярных поверхностных отделов и развития мелких сосудов капиллярного типа, с последующим врастанием сосудов в толщу имплантатов, формированием, помимо капилляров, тонкостенных сосудов синусоидного типа, а также и более крупных сосудов — артерий и вен. В прилежащих мягких тканях минимальные реактивные изменения наблюдаются в 1‑м и 2‑м имплантационном периодах. При дальнейшем исследовании перифокальных изменений не отмечено.
На основании полученных данных высокопористый плевральный имплантат на основе полилактида и поликапролактона является перспективным материалом для хирургического лечения туберкулеза легких.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Все авторы принимали активное участие в обсуждении результатов и написании текста статьи.
-
Директива 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях / пер. с англ. Под ред. М.С. Красильщиковой, И.В. Белозерцевой. Санкт-Петербург, 2012. 48 с. [Direktiva 2010/63/EU Yevropeyskogo Parlamenta i Soveta Yevropeyskogo Soyuza po okhrane zhivotnykh, ispol’zuyemykh v nauchnykh tselyakh / transl. from English. Ed. M.S. Krasilshchikova, I.V. Belozertseva. St. Petersburg, 2012. 48 p. (In Russ.)].
-
ГОСТ 33044–2014 «Межгосударственный стандарт принципы надлежащей лабораторной практики». [Principles of good laboratory practice. (In Russ.)].
-
ГОСТ Р ИСО 10993‑2‑2009 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 2. Требования к условиям содержания животных». [Medical devices. Biological evaluation of medical devices. Part 2. Animal welfare requirements. (In Russ.)].
- ГОСТ ISO 10993‑6‑2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации». [Medical devices. Biological evaluation of medical devices. Part 6. Tests for local effects after implantation (In Russ.)].
Список источников
-
Богуш Л.К. Хирургическое лечение туберкулеза легких. Москва: Медицина, 1979. 296 c. [Bogush L.K. Khirurgicheskoe lechenie tuberkuleza legkikh. Moskva: Meditsina, 1979. 296 p. (In Russ.)].
-
Ямпольская В.Д. Экстраплевральный пневмоторакс и олеоторакс при туберкулезе легких. Москва: Медгиз, 1963. 240 c. [Yampol’skaya V.D. Ekstraplevral’nyi pnevmotoraks i oleotoraks pri tuberkuleze legkikh. Moskva: Medgiz, 1963. 240 p. (In Russ.)].
-
Николаев И.С., Жаднов В.З., Терентьева В.М. Хирургическое лечение больных с распространенным деструктивным туберкулезом легких // Проблемы туберкулеза. 1987. № 6. С. 45–47. [Nikolaev IS, Zhadnov VZ, Terent’eva VM. Khirurgicheskoe lechenie bol’nykh s rasprostranennym destruktivnym tuberkulezom legkikh // Problemy tuberkuleza. 1987. N. 6. P. 45–47. (In Russ.)].
-
Стойко Н.Г. Хирургическое лечение легочного туберкулеза. Москва: Медгиз, 1949. 271 c. [Stoiko N.G. Khirurgicheskoe lechenie legochnogo tuberkuleza. Moskva: Medgiz, 1949. 271 p. (In Russ.)].
-
Малов А.А. Экстраплевральный пневмолиз с пломбировкой в лечении распространённого деструктивного туберкулёза лёгких: дис. … канд. мед. наук. 14.01.17. Москва, 2011. 215 с. [Malov A.A. Ekstraplevral’nyi pnevmoliz s plombirovkoi v lechenii rasprostranennogo destruktivnogo tuberkuleza legkikh: dis. … kand. med. nauk. 14.01.17. Moskva, 2011. 215 p. (In Russ.)].
-
Кекин Е.С. Экстраплевральная пломбировка гемиторакса сухим фибриногеном после резекции легкого у больных туберкулезом // Проблемы туберкулеза. 1983. Т. 1. С. 52–55. [Kekin E.S. Ekstraplevral’naya plombirovka gemitoraksa sukhim fibrinogenom posle rezektsii legkogo u bol’nykh tuberkulezom // Problemy tuberkuleza. 1983. Vol. 1. P. 52–55. (In Russ.)].
-
Зыков Г.А, Свинцов А.Е., Мохирев А.И. и др. Способ коррекции плевральной полости при частичной резекции легкого. Патент RU 2533969 С1. [Zykov G.A, Svintsov A.E., Mokhirev A.I. i dr. Sposob korrektsii plevral’noi polosti pri chastichnoi rezektsii legkogo. Patent RU 2533969 S1. (In Russ.)].
-
Чудных С.М., Иванов А.В., Малов А.А. Видеоассистированный экстраплевральный пневмолиз в лечении больных деструктивными формами туберкулеза // Московский хирургический журнал. 2009. № 1 (5). С. 19–25. [Chudnykh S.M., Ivanov A.V., Malov A.A. Videoassistirovannyy ekstraplevral’nyy pnevmoliz v lechenii bol’nykh destruktivnymi formami tuberkuleza // Moskovskiy khirurgicheskiy zhurnal. 2009. N. 1 (5). P. 19–25. (In Russ.)].
-
Иванов А.В., Петерсон С.Б., Чудных С.М. и др. Способ хирургиченского лечения деструктивных форм туберкулеза дегких. Патент RUS 2280413. [Ivanov A.V., Peterson S.B., Chudnykh S.M. i dr. Sposob khirurgichenskogo lecheniya destruktivnykh form tuberkuleza degkikh. Patent RUS 2280413. (In Russ.)].
-
Гиллер Д.Б., Иванов А.В., Гиллер Б.М. и др. Способ операции экстраплеврального пнвемолиза при туберкулезе легких. Патент RUS 2290878. [Giller D.B., Ivanov A.V., Giller B.M. i dr. Sposob operatsii ekstraplevral’nogo pnvemoliza pri tuberkuleze legkikh. Patent RUS 2290878. (In Russ.)].
-
Агкацев Т.В., Синицын М.В. Способ операции экстраплеврального пневмолиза. Патент RU 2448658C1. [Agkatsev T.V., Sinitsyn M.V. Sposob operatsii ekstraplevral’nogo pnevmoliza. Patent RU 2448658C1. (In Russ.)].
-
Bertin F., Labrousse L., Gazaille V. et al. New modality of collapse therapy for pulmonary tuberculosis sequels: tissue expander // Ann. Thorac. Surg. 2007. Vol. 84. N. 3. P. 1023–1025. DOI: 10.1016/j.athoracsur.2007.04.013.
-
Синицин М.В., Агкацев Т.В., Решетников М.Н. и др. Экстраплевральный пневмолиз с пломбировкой в лечении больных деструктивным туберкулезом легких // Хирург. 2018. № 1–2. С. 54–63. [Sinitsin M.V., Agkatsev T.V., Reshetnikov M.N. i dr. Ekstraplevral’nyi pnevmoliz s plombirovkoi v lechenii bol’nykh destruktivnym tuberkulezom legkikh // Khirurg. 2018. N. 1–2. P. 54–63. (In Russ.)].
-
Красникова Е.В., Багиров М.А., Ловачева О.В. и др. Эффективность экстраплевральной пломбировки силиконовым имплантом у больных деструктивным туберкулезом легких и ее влияние на функциональное состояние легких и газовый состав крови // Туберкулёз и болезни лёгких. 2019. Т. 97. № 3. С. 16–25. [Krasnikova E.V., Bagirov M.A., Lovacheva O.V. i dr. Effektivnost’ ekstraplevral’noi plombirovki silikonovym implantom u bol’nykh destruktivnym tuberkulezom legkikh i ee vliyanie na funktsional’noe sostoyanie legkikh i gazovyi sostav krovi // Tuberkulez i bolezni legkikh. 2019. Vol. 97. N. 3. P. 16–25. (In Russ.)]. DOI: 10.21292/2075‑1230‑2019‑97‑3‑16‑25.
-
Севастьянов В.И., Григорьев А.М., Басок Ю.Б. и др. Биосовместимые и матриксные свойства полилактидных губок // Вестник трансплантологии и искусственных органов. 2018. Т. 20. № 2. С. 82–90. [Sevast’yanov V.I., Grigor’ev A.M., Basok Yu.B. i dr. Biosovmestimye i matriksnye svoistva polilaktidnykh gubok // Vestnik transplantologii i iskusstvennykh organov. 2018. Vol. 20. N. 2. P. 82–90. (In Russ.)]. DOI: 10.15825/1995‑1191‑2018‑2‑82‑90.
-
Calado T., Alvoeiro M., Cabral D. et al. Surgical treatment of complications 55 years after extraperiosteal lucite ball plombage for pulmonary tuberculosis // Rev. Port. Cir Cardiotorac. Vasc. 2017. Vol. 24. N. 3–4. P. 139.
-
Teschner M. Surgery of late complications of previous active treatment of lung tuberculosis with extrapleural plombage // Pneumologie. 1998. Vol. 52. N. 2. P. 115.
- Xie D., Huang D., Jiang G. et al. Thoracic wall abscess as a late complication of extrapleural plombage // Ann. Thorac. Surg. 2013. Vol. 96. N. 4. P. 107. DOI: 10.1016/j.athoracsur.2013.07.032.




