Определение базального уровня активности фермента дипептидилпептидазы-4 у различных видов лабораторных животных
Работа выполнена без спонсорской поддержки.
Барыбина Т.Н., Фаустова Н.М. Определение базального уровня активности фермента дипептидилпептидазы-4 у различных видов лабораторных животных. Лабораторные животные для научных исследований. 2023; 1. https://doi.org/10.57034/2618723X-2023-01-05
Резюме
Поиск и разработка новых лекарственных средств, способных поддерживать функцию поджелудочной железы, не теряют своей актуальности.
Одним из ключевых этапов при создании лекарственного препарата-ингибитора дипептидилпептидазы 4-го типа (ДПП-4) является оценка его эффективности на биологических моделях на этапе доклинических исследований. Определение активности фермента также представляет интерес как биомаркер формирования патологии сахарного диабета 2-го или смешанного типа у лабораторных животных.
Цель исследования — разработка и валидация методики определения активности фермента ДПП-4 (КФ 3.4.14.5) в биоматериале животных, оценка его базального уровня у крыс, мышей, дегу, песчанок, кроликов и карликовых свиней, а также сравнительная оценка активности фермента в сыворотке крови карликовых свиней в возрасте 2, 7, 9 мес, 1 года, 2 лет и старше 3 лет.
Активность ДПП-4 оценивали спектрофотометрическим методом с использованием специфичного хромогенного субстрата глицил-L-пролин-п-нитроанилида. В основе метода лежит ферментативное расщепление субстрата ферментом c образованием окрашенного продукта реакции п-нитроанилина, детектируемого при длине волны 405 нм.
В статье приведены валидационные характеристики методики. Линейность определения п-нитроанилина в плазме/сыворотке крови составила 0,025–0,30 мкмоль/мл; линейность определения активности ДПП-4 в плазме/сыворотке крови — 2,0–16,2 МЕ/л; относительная погрешность при оценке точности — 2,7 (14,9%), для нижнего предела количественного определения (НПКО) — 2,0 МЕ/л (19,7%). Прецизионность составила 5,5 (12,3%), для НПКО — 15,8%.
Полученные данные по активности ДПП-4 в сыворотке/плазме крови у песчанок (11,5–20,6 МЕ/л), крыс (8,7–12,3 МЕ/л), дегу (18,3–46,3 МЕ/л), кроликов (16,3–33,3 МЕ/л) близки к значениям, характерным для человека (15,9–42,0 МЕ/л). Активность ДПП-4 в плазме крови мышей несколько ниже, чем у человека, — 5,8–8,3 МЕ/л.
В настоящее время возрастает интерес к применению моделей метаболических нарушений на карликовых свиньях в связи со схожестью данной тест-системы с человеческим организмом. У половозрелых карликовых свиней (9 мес—2 года) активность ДПП-4 в сыворотке крови свиней составила 5,4–12,9 МЕ/л. Установлено, что для карликовых свиней характерны возрастные изменения активности ДПП-4 как и для человека: снижение активности увеличивается с возрастом с 7,1–18,8 МЕ/л (2 мес) до 3,8–7,8 МЕ/л (3–6 лет).
Приведенные в статье данные могут стать теоретической основой при выборе тест-системы для доклинических исследований.
Введение
В последние годы широкое развитие получило лечение сахарного диабета 2‑го типа с использованием ингибиторов дипептидилпептидазы-4 (ДПП-4) с целью стимуляции секреции инсулина гастроинтестинальными гормонами. Препараты этой группы за счет подавления активности ДПП-4 повышают концентрацию инкретинов, которые секретируются в кишечнике в течение суток в ответ на прием пищи [1]. Инкретины способствуют увеличению синтеза инсулина, что нормализует уровень сахара в крови. При низком уровне сахара крови действие инкретинов на выработку инсулина и глюкагона отсутствует [2, 3]. Препараты, ингибирующие ДПП-4, имеют ряд преимуществ перед другими антидиабетическими средствами, в частности, протекция уязвимых β-клеток поджелудочной железы [4, 5]. Поэтому поиск и разработка новых лекарственных средств, способных поддерживать функцию поджелудочной железы, не теряют своей актуальности.
Одним из ключевых шагов по созданию лекарственного препарата — ингибитора ДПП-4 является оценка его эффективности на биологических моделях на этапе доклинических исследований.
Помимо оценки действия антидиабетических препаратов, показатели активности фермента ДПП-4 могут представлять интерес на этапе формирования патологии сахарного диабета 2‑го или смешанного типа у лабораторных животных. Так, для некоторых видов животных оценка гликозилированного гемоглобина не является показательной в связи с метаболическими особенностями вида. Например, карликовые свиньи обладают большей толерантностью к глюкозе, чем человек. Это обусловлено малой проницаемостью эритроцитов для глюкозы. Исходя из этого, следует подбирать иные показатели для оценки развития нарушений углеводного обмена в исследованиях [6].
Цель настоящего исследования — разработка и валидация методики определения активности фермента в биоматериале животных и экспериментальная оценка базального уровня активности фермента ДПП-4 для лабораторных животных (крыс, мышей, дегу, песчанок, кроликов и карликовых свиней), а также сравнительная оценка активности фермента ДПП-4 в сыворотке крови карликовых свиней разного возраста.
Данные показатели могут быть положены в основу экспериментов, где активность ДПП-4 выступает в роли маркера различных патологий или для оценки эффективности лекарственных препаратов.
Материал и методы
Для проведения исследования отбирали кровь здоровых особей песчанок, дегу, кроликов, крыс, мышей и карликовых свиней, полученных в виварии АО «НПО «ДОМ ФАРМАЦИИ». Отбор проб произведен без наркотизации животных. Сведения о животных представлены в табл. 1.
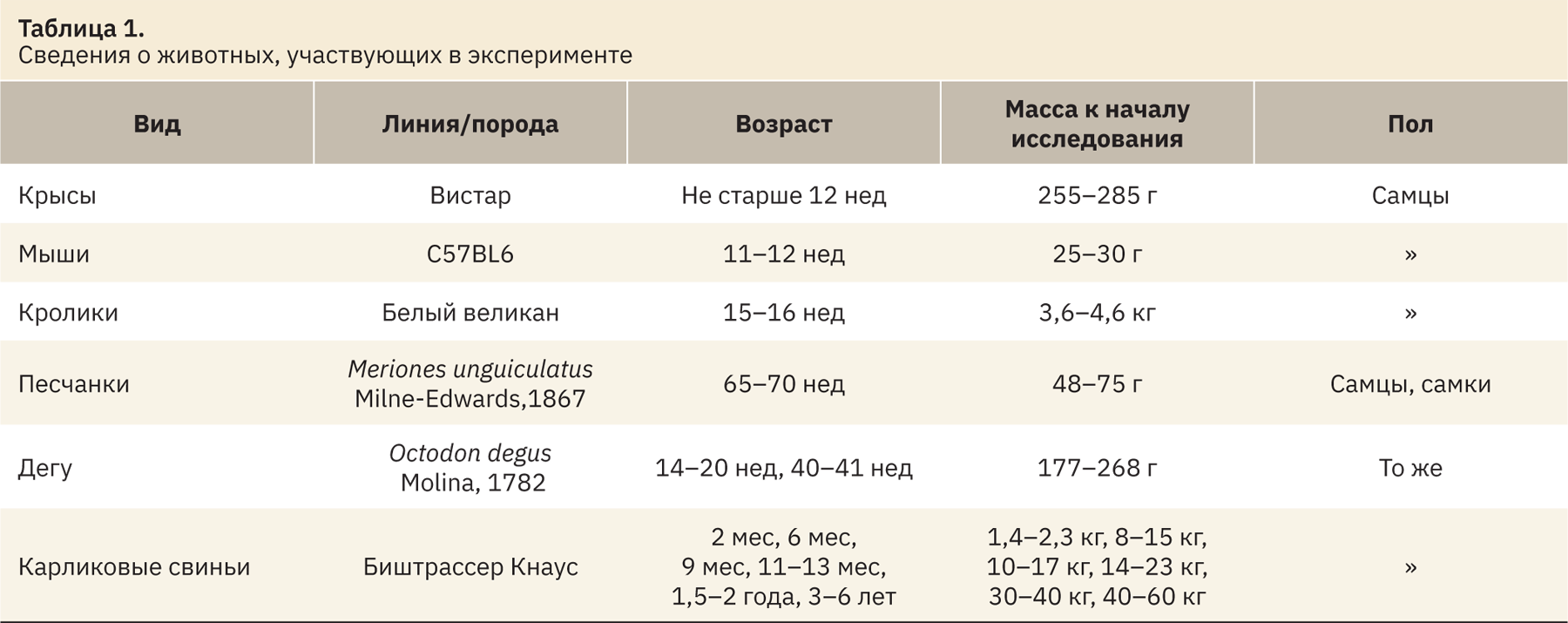
Животные содержались в условиях вивария в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях1, получали стандартный рацион питания и поения, удовлетворяющий потребности вида. При клиническом осмотре было подтверждено отсутствие отклонений в состоянии здоровья животных.
В ходе исследования использовали следующее оборудование и материалы: анализатор микропланшетный CLARIOstar (BMG Labtech, Германия), система получения воды очищенной Simplicity® (Millipore, США), центрифуга лабораторная Z 216МК(Hermle Labortechnik GmbH, Германия), весы лабораторные AR 2140 (Ohaus, Китай), рН-метр HANNA HI 8314 (портативный рН/мВ/°С-метр) (HANNA Instruments), планшеты 96‑луночные полистироловые (Aptaca S.P.A, Италия).
Реактивы
Глицил-L-пролин-п-нитроанилид (99% и более, № G-0513, Sigma-Aldrich), трис-(гидроксиметил)-аминометан (99% и более), хлористоводородная кислота (х.ч.), диметилсульфоксид (ДМСО) (№ 1.4.7, ООО «Биолот», Россия), гепарин натрия 5000 МЕ/мл (РУП «Белмедпрепараты»).
В качестве положительного контроля использован ситаглиптин — специфический ингибитор фермента ДПП-4. В исследовании использован ситаглиптина фосфат (вторичный фармацевтический стандарт).
Для приготовления калибровочных растворов стандартного образца использован p-нитроанилин (Sigma-Aldrich, № 185310, Китай).
Подготовка биопроб
Отбор проб крови у лабораторных животных производили с учетом видовых особенностей: у крыс и мышей из хвостовой вены, песчанок и дегу из полости сердца, у кроликов из краевой вены уха, у карликовых свиней из яремной вены.
Необходимый для исследования объем крови отбирали в вакуумные пробирки без антикоагулянта для получения сыворотки крови. Для получения плазмы крови использовали пробирки с гепарином натрия. Далее пробы центрифугировали в течение 15 мин при 3000 об/мин. Отделившуюся в процессе центрифугирования сыворотку/плазму переносили во вторичные пробирки.
Допустимо использование для анализа плазмы/сыворотки со слабой степенью гемолиза. На основании оценки стабильности аналита в плазме или сыворотке крови делали выводы о пригодности биообразцов для анализа в течение 3 сут после отбора при температуре 2–8 °С. При температуре ниже –18 °С допустимо хранение в течение 3 мес. Для проб допустим только один цикл замораживания. Данные о стабильности фермента ДПП-4 в плазме крови сделаны на основании проведенного теста на стабильность и представлены в табл. 2.
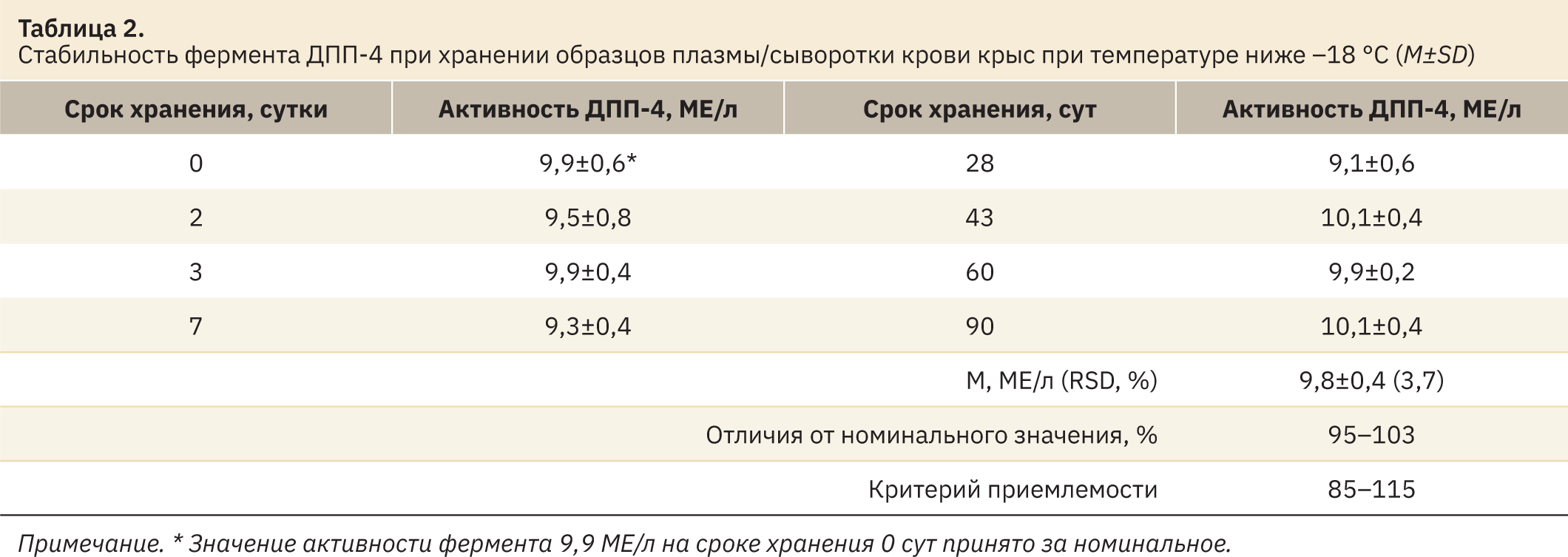
Средние значения скорости ферментативной реакции и активности фермента в плазме/сыворотке крови в течение всего срока хранения находились в пределах ±4% от номинальной активности, что свидетельствует о стабильности фермента в этом биоматериале в течение 90 дней.
Приготовление рабочих растворов
Рабочий буферный раствор — 0,1M тpиc-HCl буферный раствор (рН 8,0±0,2)
Точную навеску трис-(гидроксиметил)-аминометана массой 1,211 г растворяли в 60–70 мл воды очищенной. Доводили рН до 8,0 хлористоводородной кислотой. Раствор доводили до объема 100 мл водой очищенной.
1 мМ раствор субстрата глицил-L-пролин-п-нитроанилида (Gly-L-Pro-p-Nitroanilide)
Для приготовления сток-раствора с концентрацией 10 мМ точную навеску субстрата массой 13,2 мг растворяли в 2 мл ДМСО, затем вносили 2 мл рабочего буферного раствора. Для приготовления рабочего раствора субстрата концентрацией 1 мМ смешивали сток-раствор субстрата с рабочим буферным раствором в соотношении 1:9.
Раствор ситаглиптина (положительный контроль)
Точную навеску вторичного фармацевтического стандарта ситаглиптин фосфата массой 64,3 мг, растворяли в 25 мл воды очищенной, 1 мл полученного раствора разбавляли рабочим буферным раствором в соотношении 1:49.
В качестве отрицательного контроля использовали рабочий буферный раствор.
Методика
Согласно данным литературы, наиболее популярные методы для определения фермента ДПП-4 — спектрофотометрический (субстрат — глицил-пролин-п-нитроанилид) и флуориметрический (субстрат — глицил-пролин-4‑метил-кумарил-7‑амид) [7, 8].
Для исследования был выбран спектрофометрический метод. В данном методе субстратом реакции является глицил-пролин-п-нитроанилид, из которого под действием фермента ДПП-4 образуется глицил-пролин и п-нитроанилин2 (рис. 1) [7].
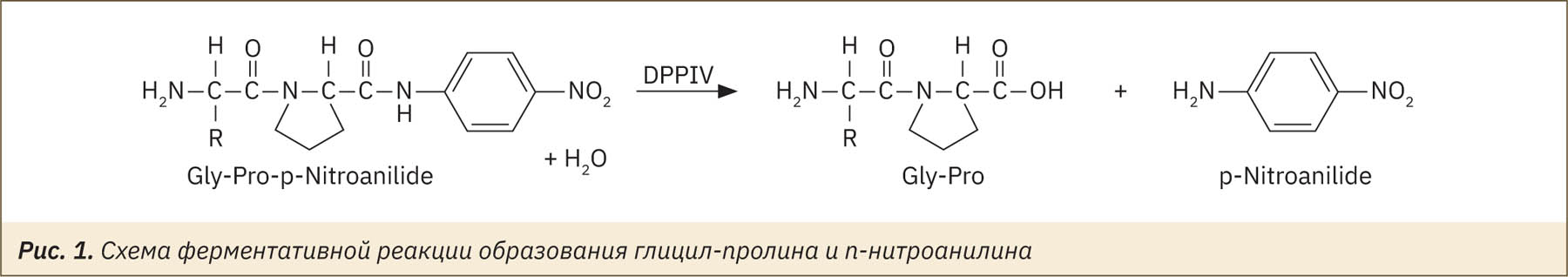
В лунки 96‑луночного полистиролового планшета вносили по 20 мкл исследуемого биоматериала лабораторных животных не менее чем в трех повторностях. Затем во все лунки вносили по 40 мкл 0,1М трис-HCl-буферного раствора (рН 8,0±0,2), за исключением лунок с положительным контролем.
В качестве положительного контроля использовали смесь, содержащую 20 мкл плазмы/сыворотки крови, 20 мкл 0,1М трис-HCl- буферного раствора и 20 мкл раствора специфического ингибитора ситаглиптина (1 мкМ).
Затем во все лунки вносили по 40 мкл 1 мМ раствора субстрата. Полученную смесь инкубировали в микропланшетном анализаторе в течение 25 мин при температуре 37 °С, измеряя при этом оптическую плотность в кинетическом режиме с интервалом 5 мин при длине волны 405 нм.
Для построения зависимости оптической плотности от концентрации п-нитроанилина готовили калибровочные растворы с концентрациями 25–30 мкМ (для калибровочных растворов использована модельная смесь, содержащая 20 мкл плазмы/сыворотки крови лабораторных животных, 20 мкл калибровочного раствора и 60 мкл рабочего буферного раствора).
Скорость ферментативной реакции вычисляли как изменение оптической плотности по отношению к времени ферментативной реакции:
U=(Dt – D0)/t, (1)
где U — скорость ферментативной реакции, о.е/мин; Dt — оптическая плотность реакционной смести в конце инкубации, о.е.; D0 — оптическая плотность реакционной смести до начала инкубации, о.е.; t — время реакции, мин.
Полученные значения скорости для параллельных реакций усредняли. На основании значения скорости реакции вычисляли активность фермента ДПП-4 в мкмоль/мин/л (в МЕ/л) по формуле:
АДПП-4=(U×0,1)/(a×V), (2)
где АДПП-4 — активность фермента ДПП-4, МЕ/л; U — скорость ферментативной реакции, о.е/мин; 0,1 — объем реакционной смеси, мл; V — объем аликвоты плазмы/сыворотки крови, мл; a — коэффициент, полученный при построении калибровочной зависимости для п-нитроанилина, о.е.×л/мкмоль (а=0,002).
При получении активности фермента больше верхнего предела количественного определения (ВПКО) сыворотку крови разбавляли рабочим буферным раствором. Полученное значение активности умножали на коэффициент разбавления пробы.
Обработка результатов
Данные, полученные по результатам исследования, подвергались проверке на соответствие закону нормального распределения. Проверка гипотезы о нормальном распределении осуществлялась с использованием критерия Шапиро–Уилка.
Для всех данных применена описательная статистика: рассчитаны средние арифметические значения (M), соответствующие стандартные отклонения (SD).
Выводы о наличии различий между выборками самцов и самок песчанок, дегу и карликовых свиней, а также между карликовыми свиньями разных возрастных групп делали на основании расчета t-критерия Стьюдента.
Статистический анализ выполняли с помощью программного обеспечения GraphPad Prism, Version 9.1.1.225 (Сан-Диего, США).
Результаты и обсуждение
ДПП-4 входит в состав суперсемейства пролилолигопептидаз, избирательно расщепляющих связь Х-Про и Х-Ала в дипептидах (где Х — любая аминокислота, кроме пролина), и отличается от других пролилолигопептидаз наличием двух глутаминовых остатков в каталитическом центре для обеспечения их биологической активности [9].
При разработке методики определения активности фермента в биоматериале животных оценивали:
1) аналитический диапазон определения продукта ферментативной реакции (п-нитроанилина) в плазме крови и валидационные характеристики определения концентрации п-нитроанилина;
2) аналитический диапазон определения активности фермента и валидационные характеристики методики определения активности фермента в биоматериале животных.
Валидацию методики определения п-нитроанилина в плазме крови проводили в соответствии с нормативными документами по следующим параметрам: специфичность, линейность, аналитическая область методики, точность, прецизионность, пределы количественного определения.

В табл. 3 представлены валидационные параметры определения активности фермента ДПП-4 в плазме крови животных.
Относительные погрешности при оценке точности и значения прецизионности в общем случае должны быть не более 15%, для НПКО — не более 20%. Полученные результаты относительной погрешности при оценке точности 1,9–9,8% (для НПКО — 19,8%) и значения прецизионности 5,5–12,3% (для НПКО — 15,8%) соответствуют этим требованиям (см. табл. 3).
Таким образом, в результате данного этапа валидирована методика определения активности фермента ДПП-4 в плазме крови крыс. Выбранные условия проведения реакции указаны в разделе «Материал и методы».
В ходе валидационных испытаний изучено влияние доступа животных к пище (на примере крыс) на активность фермента ДПП-4 в плазме. Статистически достоверных отличий в активности фермента ДПП-4 в плазме крови животных после 12‑часового голодания (10,7±1,4 МЕ/л, n=9) и имеющих доступ к пище ad libitum (10,1±1,4 МЕ/л, n=10) не выявлено.
В дальнейшем разработанную и валидированную методику применяли для оценки активности фермента ДПП-4 в плазме и сыворотке крови различных лабораторных животных.
Для проведения эксперимента использовали популярные тест-системы, которые чаще всего применяются при моделировании различных метаболических нарушений, в частности, сахарного диабета 2‑го типа [10]. Референтные значения базального уровня фермента ДПП-4 у различных видов лабораторных животных представлены в табл. 4.
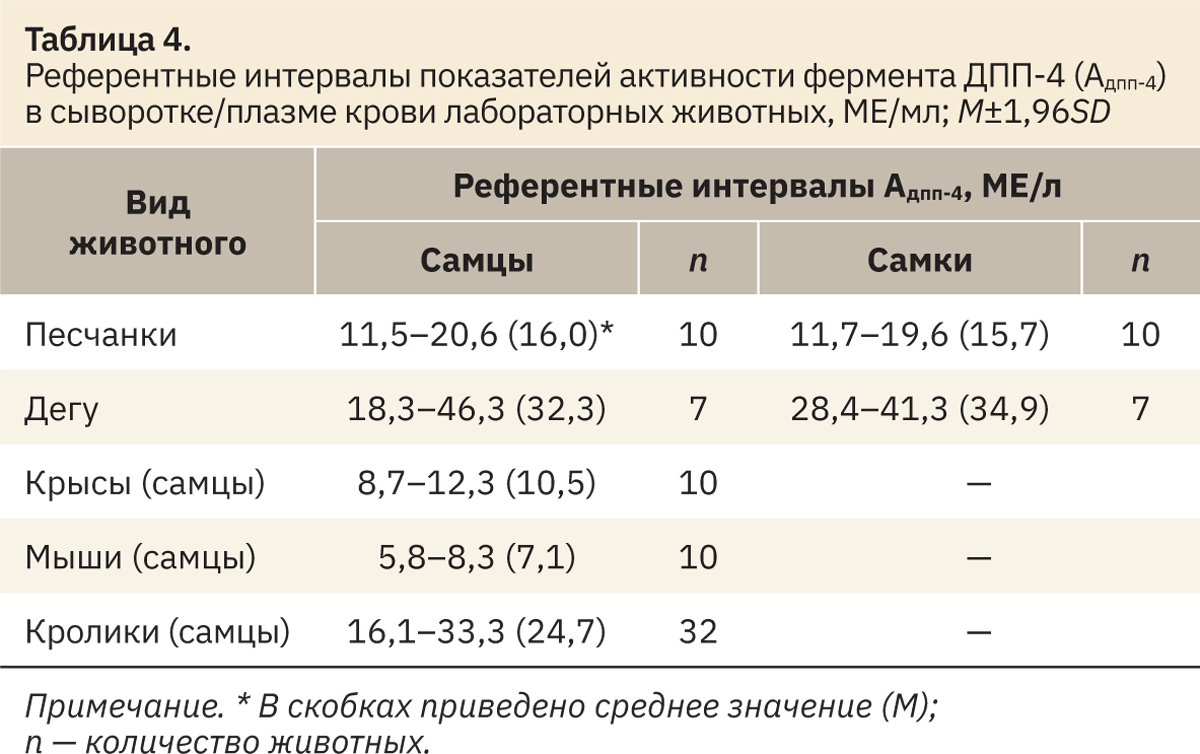
В результате определения активности ДПП-4 в биоматериале песчанок проведена сравнительная оценка показателей между выборками самцов и самок. Полученные статистические данные позволяют сделать вывод об отсутствии значимых различий базального уровня фермента у самцов и самок данного вида лабораторных животных.
Весьма высокий уровень активности фермента установлен для дегу (средний для самцов — 32,3, для самок — 34,9 МЕ/л).
В различных источниках литературы уровень (в МЕ/л) активности ДПП-4 в крови половозрелых интактных крыс-самцов варьирует от 2,4 (±0,12) до 13,3 (±1,47) [11, 12]. Подобный разброс может быть обусловлен различиями в методике определения активности фермента, возрастными особенностями выборки, условиями содержания, иммунным статусом животных, методом забора крови (прижизненно или посмертно). В нашем исследовании у крыс-самцов уровень (в МЕ/л) активности ДПП-4 составил 8,7–12,3 (10,5).
Наименьший уровень (в МЕ/л) активности ДПП-4 установлен для мышей самцов — 5,8–8,3 (7,1), а у кроликов он был сопоставим с показателями у дегу — 16,1–33,3 (24,7).
В целом результаты активности ДПП-4, полученные на грызунах, сопоставимы и наиболее близки к значениям, характерным для человека (мужчины — 17,7–52,6 МЕ/л, женщины — 17,0–50,8 МЕ/л) [13, 14], что позволяет рекомендовать эти виды при оценке метаболических нарушений углеводного обмена.
В настоящее время возрастает интерес к применению моделей метаболических нарушений на карликовых свиньях [15]. Этому способствует ряд причин, в частности, схожесть данной тест-системы с человеческим организмом по ряду биохимических показателей и молекулярной структуре пептидаз [16].
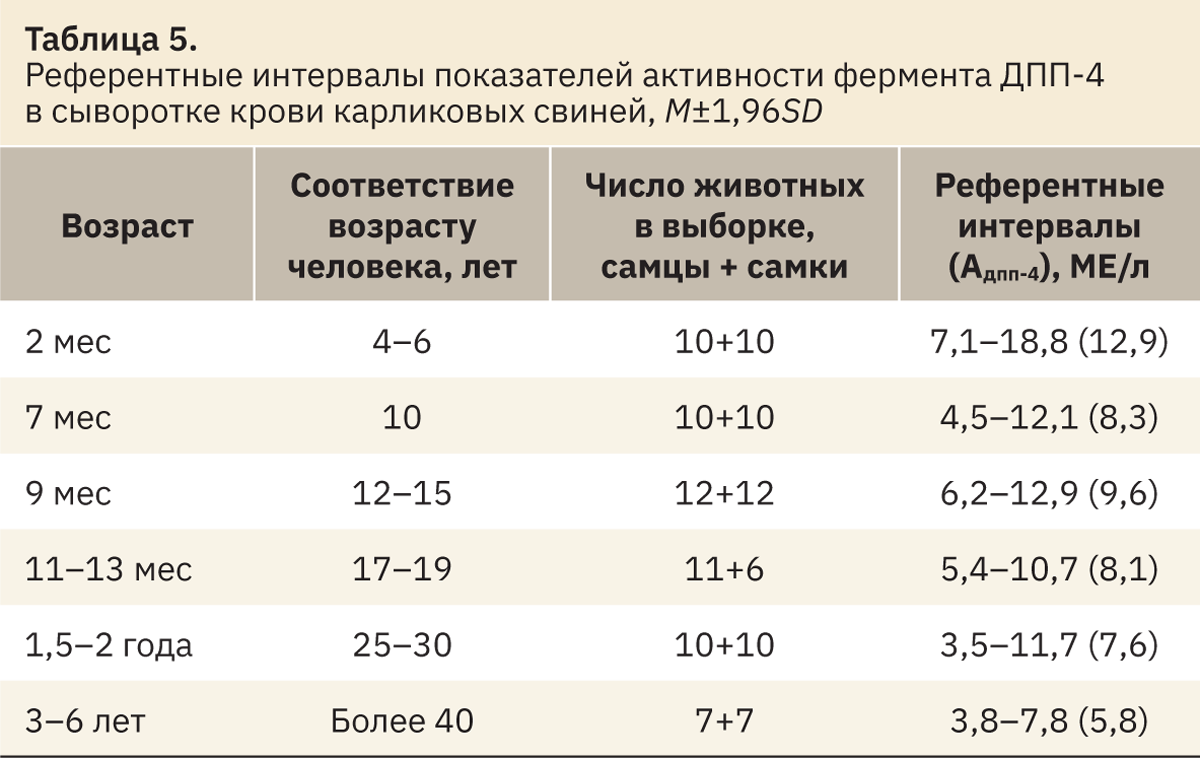
С возрастом у человека наблюдается снижение активности фермента [4, 13]. Подобная тенденция к снижению уровня ДПП-4 отмечена и у карликовых свиней после периода закрытия эпифизарных зон роста [16, 17]. Данные табл. 5 демонстрируют не только возрастные колебания ДПП-4, но и отражают разницу естественного уровня активности между половозрелыми и неполовозрелыми особями.
При сравнительном анализе базальной активности ДПП-4 между самцами и самками карликовых свиней одной возрастной группы статистически значимых различий не обнаружено ни в одной из выборок (уровень значимости p>0,05), поэтому референтные интервалы рассчитывали без учета пола.
Полученные значения активности позволяют сделать вывод, что уровень активности ДПП-4 у карликовых свиней несколько ниже, чем у человека.
В источниках литературы приводится базальный уровень активности ДПП-4 в крови половозрелых здоровых свиней датской линии LY/YL, равный 15,7±2,5 МЕ/л, что более чем в 1,6 раза превышает данные, полученные для карликовых свиней породы Биштрассер Кнаус [18]. При планировании экспериментов с животными следует учитывать возможные различия уровня биохимических показателей между особями одного вида, но разных пород.
Заключение
Представленные данные отражают разницу базального уровня активности ДПП-4 у различных видов животных. Для карликовых свиней определены показатели активности фермента среди особей разных возрастных категорий. Показано, что наиболее близкими по активности этого фермента к человеку являются дегу и кролики, что позволяет рекомендовать эти виды при оценке метаболических нарушений углеводного обмена, а для карликовых свиней характерны изменения активности фермента в онтогенезе, что также делает их привлекательными для изучения активности фермента в различных экспериментальных моделях.
Результаты данного исследования могут стать теоретической основой при выборе тест-системы для доклинических исследований.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Вклад авторов
Т.Н. Барыбина — анализ образцов, анализ научной и методической литературы, сбор, обработка и систематизация экспериментальных данных, подготовка и доработка рукописи.
Н.М. Фаустова — идея исследования, разработка и валидация методики, анализ образцов и ответственность за все аспекты работы, связанные с достоверностью данных.
Список источников
-
Шестакова М.В., Викулова О.К. Современные возможности фармакотерапии сахарного диабета 2 типа при помощи аналогов глюкагоноподобного пептида-1 (ГПП-1) // Сахарный диабет. 2007. Т. 10. № 1. С. 9–15. [Shestakova M.V., Vikulova O.K. Sovremennye vozmozhnosti farmakoterapii sakharnogo diabeta 2 tipa pri pomoshchi analogov glyukagonopodobnogo peptida-1 (GPP-1) // Sakharnyi diabet. 2007. Vol. 10. N. 1. P. 9–15. (In Russ.)]. DOI: 10.14341/2072-0351-5908.
-
Скворцов В.В., Тумаренко А.В. Современные аспекты фармакотерапии сахарного диабета 2 типа — фокус на ингибиторы ДПП-4 // Качественная Клиническая Практика. 2012. № 1. С. 76–82. [Skvortsov V.V., Tumarenko A.V. Sovremennye aspekty farmakoterapii sakharnogo diabeta 2 tipa — fokus na ingibitory DPP-4 // Kachestvennaya Klinicheskaya Praktika. 2012. N. 1. P. 76–82. (In Russ.)].
-
Виллхауэр Э. Вилдаглиптин: первый инновационный ингибитор ДПП-4 // Сахарный диабет. 2010. Т. 13. № 3. С. 118–120. [Villkhauehr EH. Vildagliptin: pervyi innovatsionnyi ingibitor DPP-4 // Sakharnyi diabet. 2010. Vol. 13. N. 3. P. 118–120. (In Russ.)]. DOI: 10.14341/2072-0351-54993.
-
Панькив В.И. Инкретины: новая веха в лечении сахарного диабета 2-го типа. Возможности ситаглиптина в достижении компенсации сахарного диабета 2-го типа // Международный эндокринологический журнал. 2011. Т. 6. № 38. С. 72–82. [Pan’kiv V.I. Inkretiny: novaya vekha v lechenii sakharnogo diabeta 2-go tipa. Vozmozhnosti sitagliptina v dostizhenii kompensatsii sakharnogo diabeta 2-go tipa // Mezhdunarodnyi ehndokrinologicheskii zhurnal. 2011. Vol. 6. N. 38. P. 72–82. (In Russ.)].
-
Дедов И.И., Яшков Ю.И., Ершова Е.В. Инкретины и их влияние на течение сахарного диабета 2 типа у пациентов с морбидным ожирением после бариатрических операций // Ожирение и метаболизм. 2012. Т. 9. № 2. С. 3–10. [Dedov I.I., Yashkov U.I., Ershova E.V. Inkretiny i ikh vliyanie na techenie sakharnogo diabeta 2 tipa u patsientov s morbidnym ozhireniem posle bariatricheskikh operatsii // Ozhirenie i metabolizm. 2012. Vol. 9. N. 2. P. 3–10. (In Russ.)]. DOI: 10.14341/omet201223-10.
-
Higgins P.J., Garlick R.L., Bunn H.F. Glycosylated Hemoglobin In Human And Animal Red Cells. Role Of Glucose Permeability // Diabetes. 1982. Vol. 31. P. 744–748.
-
Таран А.С., Чепляева Н.И. Методы оценки дипептидилпептидаза-4 ингибирующей активности in vitro // Волгоградский научно-медицинский журнал. 2014. Т. 1. С. 26–29. [Taran A.S., Cheplyaeva N.I. Metody otsenki ipeptidilpeptidaza-4 ingibiruyushchei aktivnosti in vitro // Volgogradskii nauchno-meditsinskii zhurnal. 2014. Vol. 1. P. 26–29. (In Russ.)].
-
Косман В.М., Фаустова Н.М., Уракова (Ампилогова) И.Н., Карлина М.Н., Макаров В.Г. Ингибирование фермента дипептидилпептидазы-4 после перорального введения кроликам экстракта гонад морских ежей (Strongylocentrotus droebahiensis) как возможный биомаркер фармакокинетики // Разработка и регистрация лекарственных средств. 2020. Т. 9. № 3. С. 158–165. [Kosman V.M., Faustova N.M., Urakova (Ampilogova) I.N., Karlina M.N., Makarov V.G. Ingibirovanie fermenta dipeptidilpeptidazy-4 posle peroral’nogo vvedeniya krolikam ehkstrakta gonad morskikh ezhei (Strongylocentrotus droebahiensis) kak vozmozhnyi biomarker farmakokinetiki // Razrabotka i registratsiya lekarstvennykh sredstv. 2020. Vol. 9. N. 3. P. 158–165. (In Russ.)]. DOI: 10.33380/2305-2066-2020-9-3-158-165.
-
Gupta R, Walunj S.S., Tokala R.K. Emerging drug candidates of dipeptidyl peptidase IV (DPP IV) inhibitor class for the treatment of type 2 diabetes // Curr. Drug Targets. 2009. Vol. 10. P. 71–87.
-
Макарова М.Н., Макаров В.Г. Диет-индуцированные модели метаболических нарушений. Сообщение 2: экспериментальное ожирение // Лабораторные животные для научных исследований. 2018. № 2. С. 38–47. [Makarova M.N., Makarov V.G. Diet-indutsirovannye modeli metabolicheskikh narushenii. Soobshchenie 2: ehksperimental'noe ozhirenie // Laboratornye zhivotnye dlya nauchnykh issledovanii. 2018. N. 2. P. 38–47. (In Russ.)]. DOI: 10.29926/2618723X-2018-02-05.
-
Спасов А.А., Чепляева Н.И., Ленская К.В., Снигур Г.Л. Влияние лимиглидола на ДПП-4 и морфологические особенности островкового аппарата поджелудочной железы при остеопорозотоциновом сахарном диабете // Экспериментальная и клиническая фармакология. 2015. Т. 78. № 5. С. 8–12. [Spasov A.A., Cheplyaeva N.I., Lenskaya K.V., Snigur G.L. Vliyanie limiglidola na DPP-4 i morfologicheskie osobennosti ostrovkovogo apparata podzheludochnoi zhelezy pri osteoporozototsinovom sakharnom diabete // Ehksperimental’naya i klinicheskaya farmakologiya. 2015. Vo. 78. N. 5. P. 8–12. (In Russ.)]. DOI: 10.30906/0869-2092-2015-78-5-8-12.
-
Иванова Е.А., Золотов Н.Н., Позднев В.Ф., Воронина Т.А. Активность дипептидилпептидазы IV при экссудативном воспалении у грызунов // Патогенез. 2018. Т. 16. № 1. С. 51–57. [Ivanova E.A., Zolotov N.N., Pozdnev V.F., Voronina T.A. Aktivnost’ dipeptidilpeptidazy IV pri ehkssudativnom vospalenii u gryzunov // Patogenez. 2018. Vol. 16. N. 1. P. 51–57. (In Russ.)]. DOI: 10.25557/2310-0435.2018.01.51-57.
-
Lambeir A.M., Durinx C., Scharpé S., Meester I.D. Dipeptidyl-Peptidase IV from Bench to Bedside: An Update on Structural Properties, Functions, and Clinical Aspects of the Enzyme DPP IV // Critical Reviews in Clinical Laboratory Sciences. 2003. Vol. 40. N. 3. P. 209–294. DOI: 10.1080/713609354.
-
Tohyama S., Kobayashi E. Age-Appropriateness of Porcine Models Used for Cell Transplantation // Cell Transplant. 2019. Vol. 28. N. 2. P. 224–228. DOI: 10.1177/0963689718817477.
-
Koopmans S.J., Schurmann T. Considerations on pig models for appetite, metabolic syndrome and obese type 2 diabetes: From food intake to metabolic disease // Eur. J. Pharmacol. 2015. Vol. 759. P. 231–239. DOI: 10.1016/j.ejphar.2015.03.044.
-
Engel M., Hoffmann T., Wagner L. et al. The crystal structure of dipeptidyl peptidase IV (CD26) reveals its functional regulation and enzymatic mechanism // PNAS. 2003. Vol. 100. N. 9. P. 5063–5068. DOI: 10.1073/pnas.0230620100.
-
Михеева И.Г., Соколов О.Ю., Яковлева А.А. и др. Клиническое значение активности дипептидилпептидазы-4 в сыворотке крови новорожденных детей с церебральной ишемией // Педиатрия. 2015. Т. 94. № 1. С. 19–23. [Mikheeva I.G., Sokolov O.YU., Yakovleva A.A. et al. Klinicheskoe znachenie aktivnosti dipeptidilpeptidazy-4 v syvorotke krovi novorozhdennykh detei s tserebral’noi ishemiei // Pediatriya. 2015. Vol. 94. N. 1. P. 19–23. (In Russ.)].
- Deacon C.F., Hughes T.E., Holst J.J. Dipeptidyl peptidase IV inhibition potentiates the insulinotropic effect of glucagon-like peptide 1 in the anesthetized pig // Diabetes. 1998. Vol. 47. P. 764–769. DOI: 10.2337/diabetes.47.5.764.




