Получение образцов мочи у лабораторных животных (обзор)
Трофимец Е.И., Кательникова А.Е., Крышень К.Л. Получение образцов мочи у лабораторных животных (обзор). Лабораторные животные для научных исследований. 2021; 1. https://doi.org/10.29296/2618723X-2021-01-04
Резюме
Получение и лабораторный анализ образцов мочи у экспериментальных животных зачастую являются неотъемлемой частью проведения доклинических исследований лекарственных средств, необходимой для оценки состояния почек и мочевыводящих путей. Основными требованиями к забору образцов мочи у экспериментальных животных являются сбор чистых образцов мочи без загрязнения фекалиями, кормом или иными примесями, простота и удобство, эффективность и быстрота сбора. Способ сбора мочи в основном зависит от целей исследования (необходим одномоментный образец или собранный за определенный период времени), от размера тела лабораторного животного и объема получаемого образца. В настоящее время существует достаточно большое количество методов сбора образцов мочи, но каждый из них требует технических навыков и отработки выполнения в лабораторных условиях с целью получения чистых биологических образцов в достаточном для анализа объеме. В лабораторной практике при выборе метода забора биологических образцов необходимо отдавать преимущество простым в выполнении, удобным и по возможности минимально травматичным для животных методам. Особое внимание стоит уделить развитию стресса и дискомфорта у животных при том или ином методе сбора образцов мочи, так как у животных, испытывающих стресс, невозможно получить достоверные результаты исследований. Статья представляет собой обзор данных литературы по забору образцов мочи у разных видов лабораторных животных. Поиск статей, опубликованных на английском языке, осуществляли по базам данных Google Scholar и PubMed, на русском языке – по базе данных научной электронной библиотеки eLIBRARY.RU. Выполнен сравнительный анализ преимуществ и недостатков различных методов получения образцов мочи у разных видов животных, при этом описаны не только методы, особое внимание уделено благополучию животных и предотвращению развития стресса при использовании того или иного метода.
Введение
Получение и лабораторный анализ образцов мочи у экспериментальных животных зачастую являются неотъемлемой частью проведения доклинических исследований лекарственных средств, необходимой для оценки состояния почек и мочевыводящих путей.
Основными требованиями к получению образцов мочи у экспериментальных животных являются: получение чистых образцов мочи без загрязнения фекалиями, кормом или иными примесями, простота и удобство, эффективность и быстрота сбора. Образцы мочи необходимы для проведения либо качественного, либо количественного (в том числе расчета скорости клубочковой фильтрации (СКФ)) анализа. Анализ мочи является одним из наиболее информативных и часто выполняемых лабораторных тестов. Моча, собранная в ветеринарных целях, полезна для определения общего состояния здоровья и физиологического состояния животного, а также для постановки соответствующего диагноза. Небольшого количества мочи будет достаточно для проведения общего клинического анализа. Количественный анализ для углубленной оценки патологии требует сбора временных проб мочи (СКФ) и полезен для определения диуреза, оценки функции почек или проведения фармакокинетических исследований.
Способ сбора мочи в основном зависит от целей исследования (необходим одномоментный образец или собранный за определенный период времени), размера тела лабораторного животного и объема получаемого образца.
Статья представляет собой обзор данных литературы по получению образцов мочи у разных видов лабораторных животных.
Получение образцов мочи у грызунов
Мыши и крысы являются двумя основными видами лабораторных животных, которых широко используют в качестве тест-систем для оценки острой и хронической токсичности. Они обладают такими ключевыми преимуществами, как наличие определенной генетической линии, низкая стоимость, относительно короткая продолжительность жизни с высоким репродуктивным уровнем и использование минимального пространства для содержания.
При получении образцов мочи от грызунов для анализа необходимо учитывать тот факт, что в течение ночи грызуны более активны, в связи с чем увеличивается потребление ими пищи и воды. Увеличение потребления воды напрямую сказывается на концентрации некоторых веществ в моче. В течение дня, когда животные менее активны, концентрация этих веществ быстро снижается [1]. Учитывая данный факт, важно собирать образцы мочи у грызунов последовательно в одно и то же время.
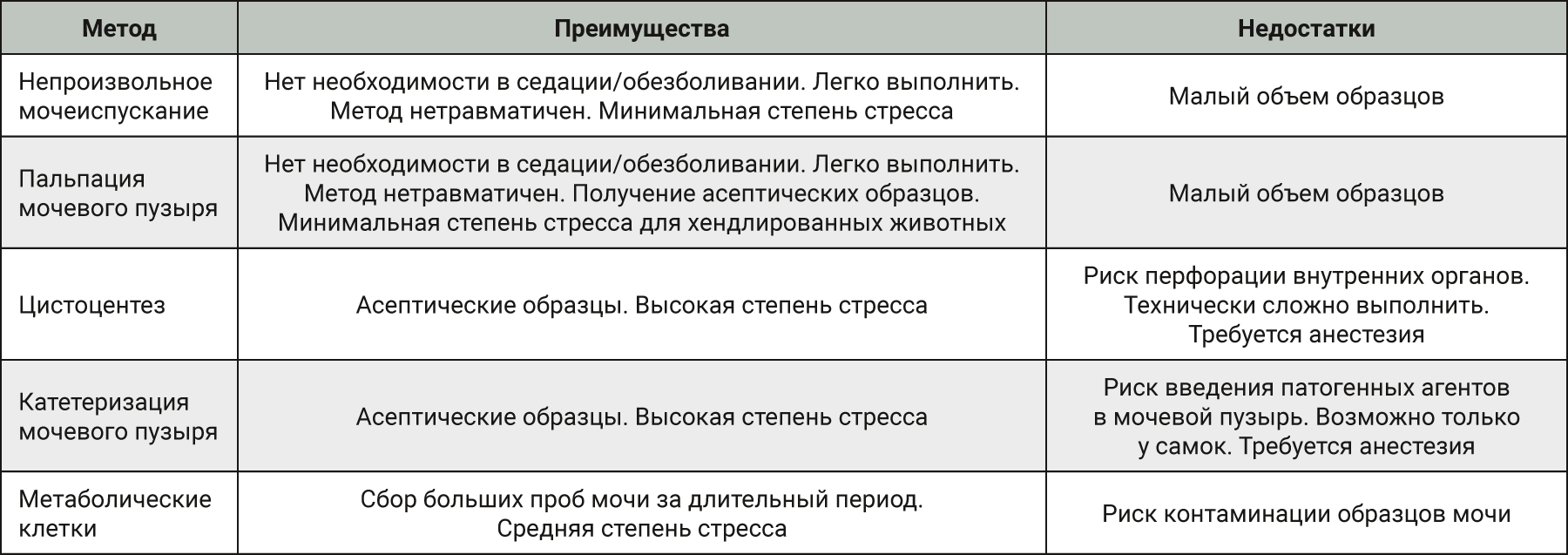
Для получения образцов мочи у грызунов могут быть выбраны различные методы в соответствии с целью эксперимента: непроизвольное мочеиспускание, пальпация мочевого пузыря, цистоцентез, катетеризация мочевого пузыря и использование метаболических клеток.
Часто непроизвольное мочеиспускание происходит во время работы с лабораторными животными. Животных следует помещать на поверхность вне клетки, как это было предложено B.T. Kurien и R.H. Scofield [2]. Авторы представили метод получения образцов мочи у мышей для качественного анализа посредством помещения животных на поверхность, покрытую прозрачной пленкой. Для одновременного забора образцов мочи у нескольких животных была создана простая х-образная конструкция из картона (рис. 1). Исследователи отметили, что после помещения животного на прозрачную пленку в течение 12 с удавалось получить образец мочи без какого-либо физического воздействия на него. Объемы полученных образцов колебались в пределах от 10–250 мкл.

Также непроизвольное мочеиспускание можно получить во время фиксации животного. Одной рукой исследователь фиксирует животное, другой – собирает образец мочи.
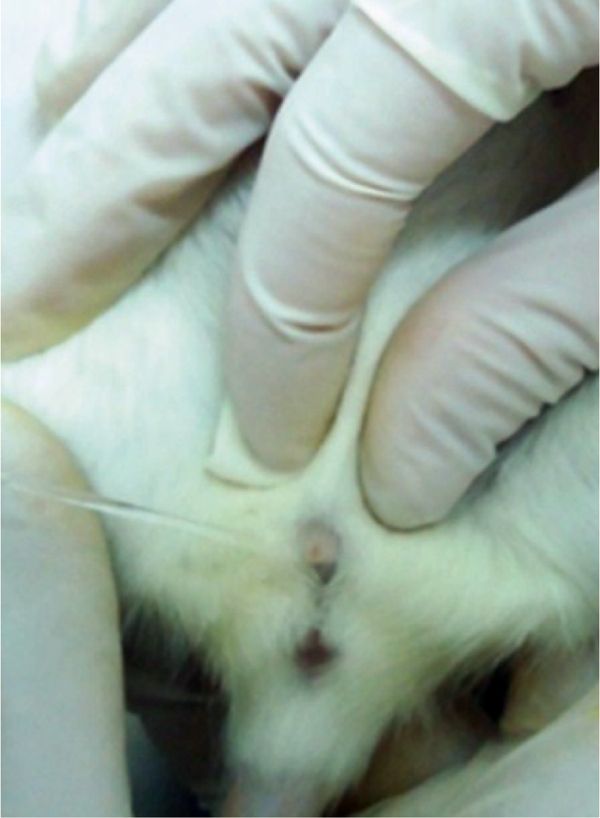
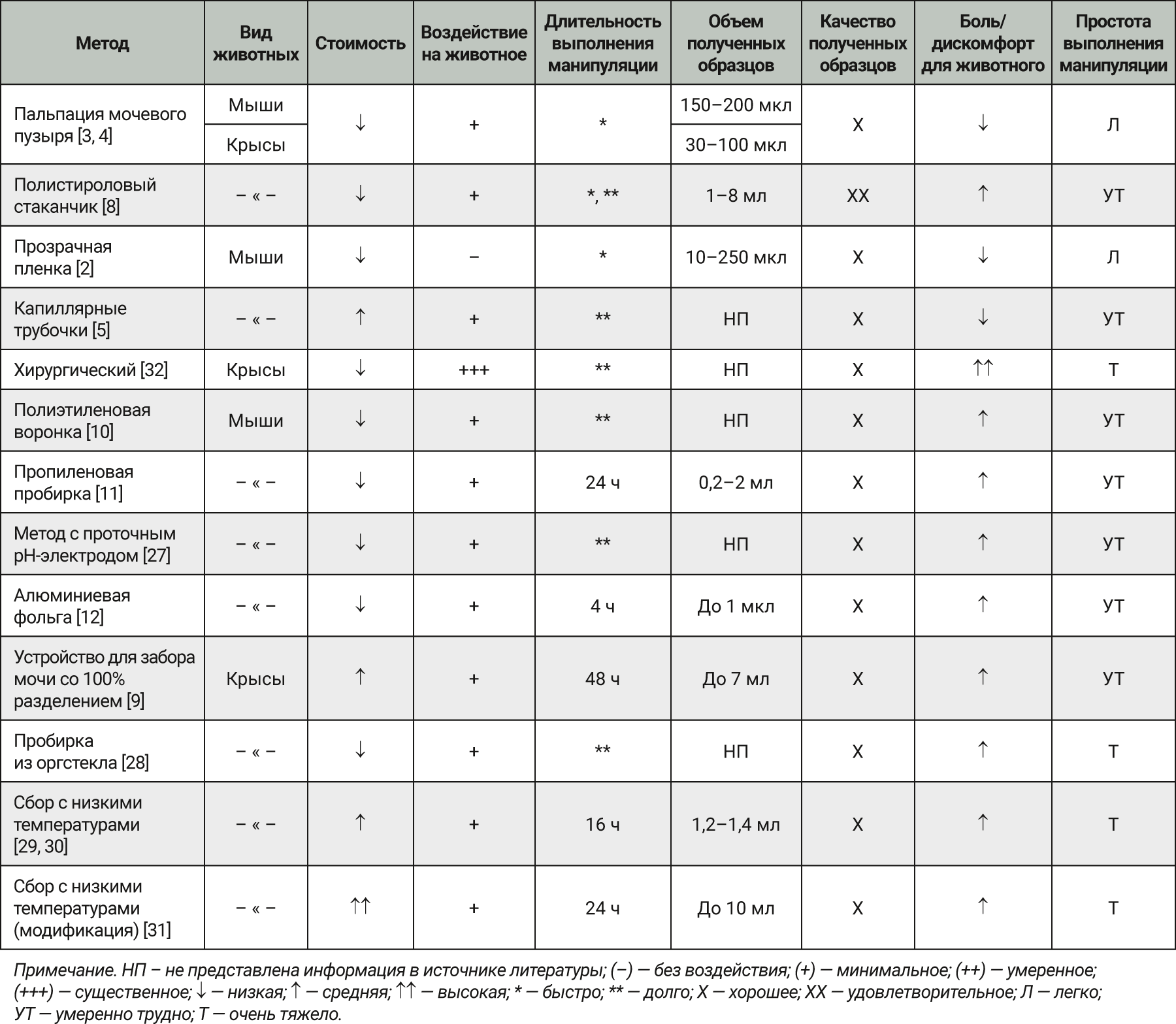
R.H. Watts и J. Weiss [3, 4] описали очень простой метод сбора образцов мочи у грызунов с помощью пальпации. Принцип метода заключался в побуждении акта мочеиспускания путем изменения уретрального давления. Одной рукой необходимо фиксировать животное, другой – мягко проводить пальпацию брюшной стенки в области мочевого пузыря (рис. 2), тем самым побуждая животное к мочеиспусканию. Этот метод позволяет собрать небольшие образцы мочи: 150–200 мкл от крысы и 30–100 мкл от мыши. Если стоит задача получить асептические образцы, то первые капли выделяющейся мочи необходимо пропустить.
В своей работе S. Hayashi и T. Sakaguchi [5] показали, что капиллярные трубочки могут быть полезны для сбора образцов мочи у самцов крыс. Одной рукой фиксировали животное, другой – обхватывали тело крысы так, чтобы большой палец располагался в области мочевого пузыря. В дальнейшем проводили надавливание в данной области, провоцируя акт мочеиспускания. При появлении образца мочи его немедленно собирали при помощи капиллярной трубочки, которую удерживали между указательным и средним пальцами. Данный метод был признан подходящим для рутинного сбора образцов мочи у крыс и мышей. Однако при использовании этого метода не удалось точно определить объем полученных образцов.
По данным J.Weiss и I. Washington, Van G. Hoosier [4, 6] , цистоцентез является очень трудоемкой и сложной манипуляцией у грызунов. Чтобы качественно выполнить цистоцентез, животное должно быть полностью обездвижено, чего в большинстве случаев можно достичь только посредством применения общей анестезии. Цистоцентез должен проводиться только в присутствии ультразвукового контроля, чтобы избежать перфорации органов брюшной полости и загрязнения образца (например, кровью или кишечным содержимым). При отсутствии ультразвукового контроля этот метод рекомендуется применять у только что эвтаназированных животных. Цистоцентез несет в себе значительный риск перфорации органа и дает возможность получить только небольшие объемы образцов мочи.
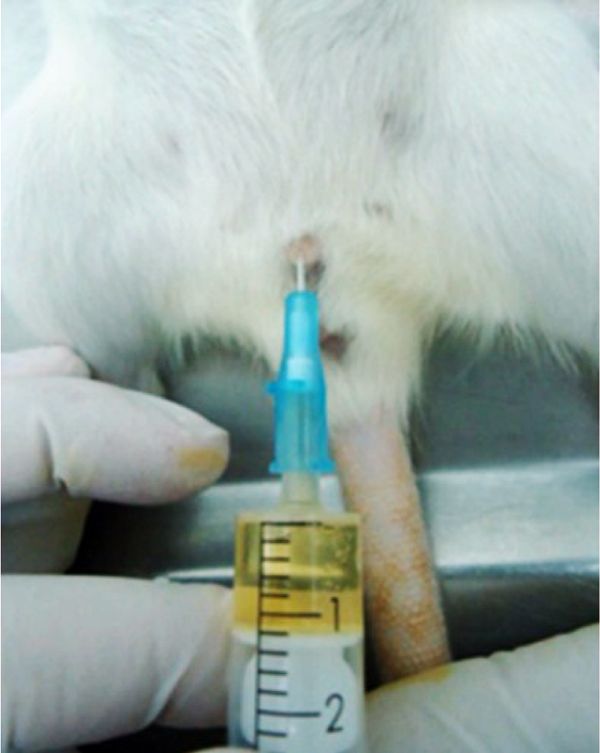
Еще один метод получения образцов мочи – катетеризация мочевого пузыря [7]. Для выполнения данной манипуляции животное так же, как и при цистоцентезе, должно быть полностью обездвижено и/или успокоено. Также стоит отметить, что катетеризация мочевого пузыря может быть выполнена только у самок грызунов в связи с анатомическими особенностями самцов (искривление полового члена самца препятствует введению и продвижению катетера по мочеиспускательному каналу в мочевой пузырь). Диаметр катетера должен быть 18 или 24 G для крыс и мышей соответственно. Перед введением катетера надлобковую область следует слегка помассировать, чтобы стимулировать форсированное мочеиспускание. Первые выступающие капли мочи помогут визуализировать уретру. Катетер должен быть стерильным, чтобы свести к минимуму риск попадания патогенных микроорганизмов в организм животного. Для удобства продвижения по мочеиспускательному каналу и снижения риска травматизации катетер необходимо смазать, например, вазелиновым маслом. Сама техника постановки катетера мало чем отличается от катетеризации мочевого пузыря у крупных видов животных: катетер аккуратно продвигают по мочеиспускательному каналу до тех пор, пока в нем не появятся капли мочи, что в свою очередь свидетельствует о правильном его расположении (рис. 3). Катетеризация мочевого пузыря у грызунов чревато определенными рисками для животных, может развиться цистит и произойти разрывы уретры или мочевого пузыря.
Для проведения некоторых лабораторных тестов недостаточно малого количества образца мочи, а использование метаболических клеток становится утомительным и затратным при большом количестве животных в эксперименте.
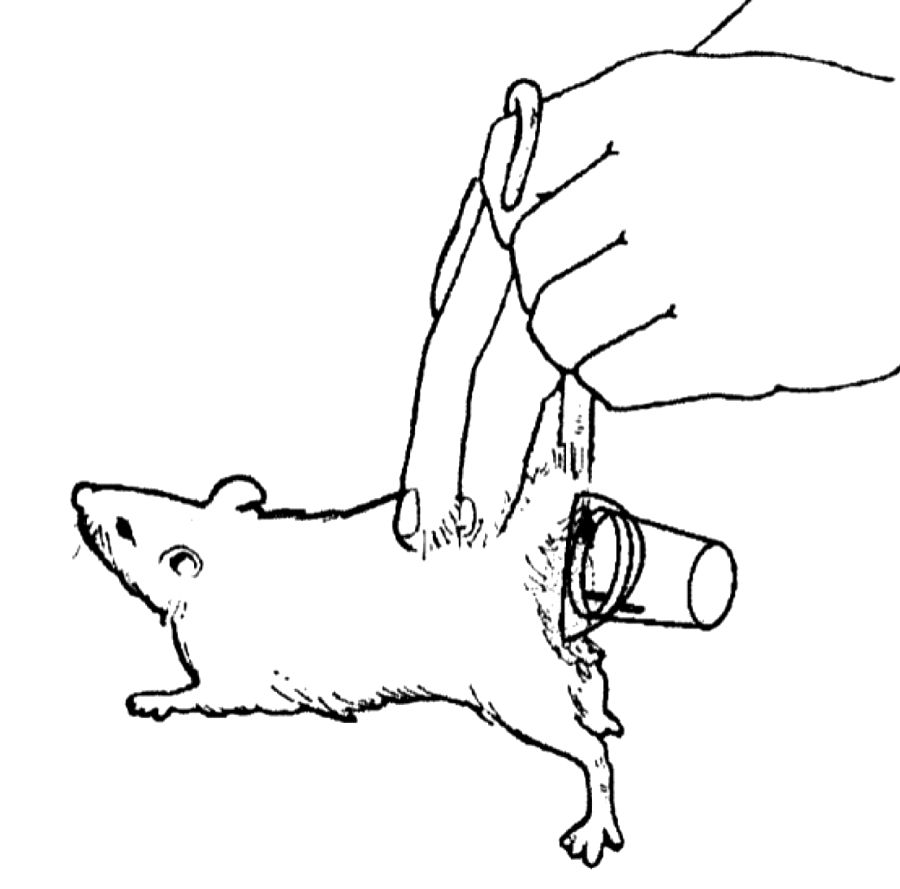
F.K. Khosho [8] разработал простой, надежный и эффективный метод получения достаточного объема образцов мочи у крыс с помощью пластикового стаканчика. Пластиковый стаканчик объемом 5 мл фиксировали по бокам промежности животного с помощью ленты (рис. 4), что позволяло легко снимать емкость для сбора образцов мочи. После прикрепления емкости крысу одной рукой приподнимали за хвост, пальцами другой руки активно стимулировали животное в области спины. Было установлено, что у 80% животных удавалось получить образцы мочи в объеме 0,1–0,8 мл в течение нескольких секунд, в то время как у оставшихся 20% манипуляция занимала более длительное время (от 5 до 10 мин). Для получения чистых, свободных от загрязнений образцов необходимо предварительное мытье и выбривание шерсти в области промежности животного. Автор отметил, что если самостоятельно фиксировать рукой стакан для сбора образцов мочи у промежности крысы, то скорость выполнения процедуры значительно сокращается, но в дальнейшем такая техника не прижилась в виду потери количества образца мочи и загрязнения фекалиями.
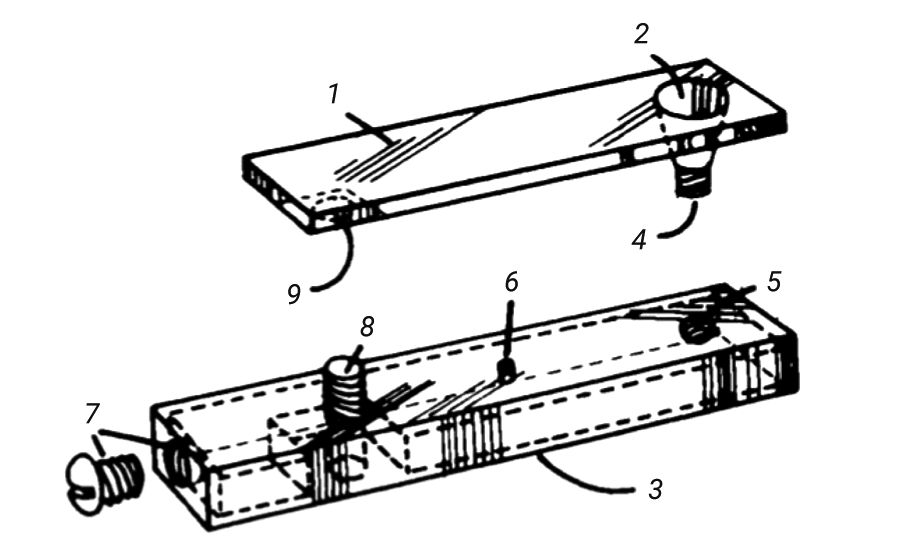
В 1984 г. исследователи A.J. Jackson и J.C. Sutherland [9] изобрели приспособление для сбора образцов мочи (рис. 5), которое обеспечило 100% разделение кала от мочи и позволило собрать образцы мочи объемом до 7 мл.
Данное устройство крепили к коже в области промежности у крысы так, чтобы уретра оказалась в воронке (рис. 6). Для лучшей фиксации приспособления предварительно выбривали шерсть без использования мыла и других поверхностно-активных веществ, которые могли бы помешать прикреплению. Область прикрепления обезжиривали спиртом и монтажную пластину крепили к коже с помощью быстросохнущего клея, избегая контакта с уретрой. Время склеивания составило от 1 до 5 мин. Авторы отметили, что склеивание лучше всего происходило при относительной влажности воздуха 58–68%. При крепком удержании монтажной пластины на коже животного в дальнейшем устанавливали вторую часть приспособления – мочеприемник. В течение суток устройство оставалось на месте, однако за счет естественных процессов эпителизации клеток кожи в некоторых местах уже не так надежно крепилась. Эту проблему было легко исправить путем нанесения дополнительно клея на отклеенные участки. По окончании исследования клей легко удаляли с помощью ацетона или жидкости для снятия лака.
Данный метод получения образцов мочи сравним с таковым при сборе мочи с помощью метаболических клеток, однако животные при установке данного приспособления находятся в естественных условиях обитания. Основываясь на результатах исследования, можно предположить, что прибор хорошо переносится лабораторными грызунами и, по-видимому, не влияет на их потребление пищи и воды. Данный метод подходит как для самцов, так и для самок крыс. Авторы отметили образование абсцессов в области прикрепления у некоторых животных, поскольку патологические изменения были выявлены как в опытных, так и в контрольной группе без прикрепления приспособления, сделан вывод, что развитию абсцессов способствовало не прикрепление устройства, а бритье. Также при гистологическом исследовании выявили слабую инфильтрацию тканей в области фиксации эозинофильными лейкоцитами, что указывало на наличие слабого местно-раздражающего действия клея на кожу, что допустимо. Из-за малого объема мочеприемника следует периодически опорожнять его. Данное устройство может быть полезно при сборе мочи в токсикологических, фармакокинетических или метаболических исследованиях без удаления животных из их обычной среды обитания.
В рутинной практике у грызунов для получения большого объема образцов мочи и сбора за продолжительный временной промежуток используют метаболические клетки.
В источниках литературы описаны различные приспособления, предшествующие современным метаболическим клеткам и позволяющие собрать суточные образцы мочи. Так, I.H. Perline [10] предложил сбор образцов мочи у мышей с помощью недорогой системы (рис. 7), представляющей собой полиэтиленовую воронку диаметром 22,5 см. В воронке располагали вогнутое нейлоновое сито, сверху приподнятых краев нейлонового сита – сито из нержавеющей стали. После размещения мыши на воронке сверху ставили пластиковую крышку с вентиляцией и поилкой. Под системой помещали емкость для сбора образцов мочи.
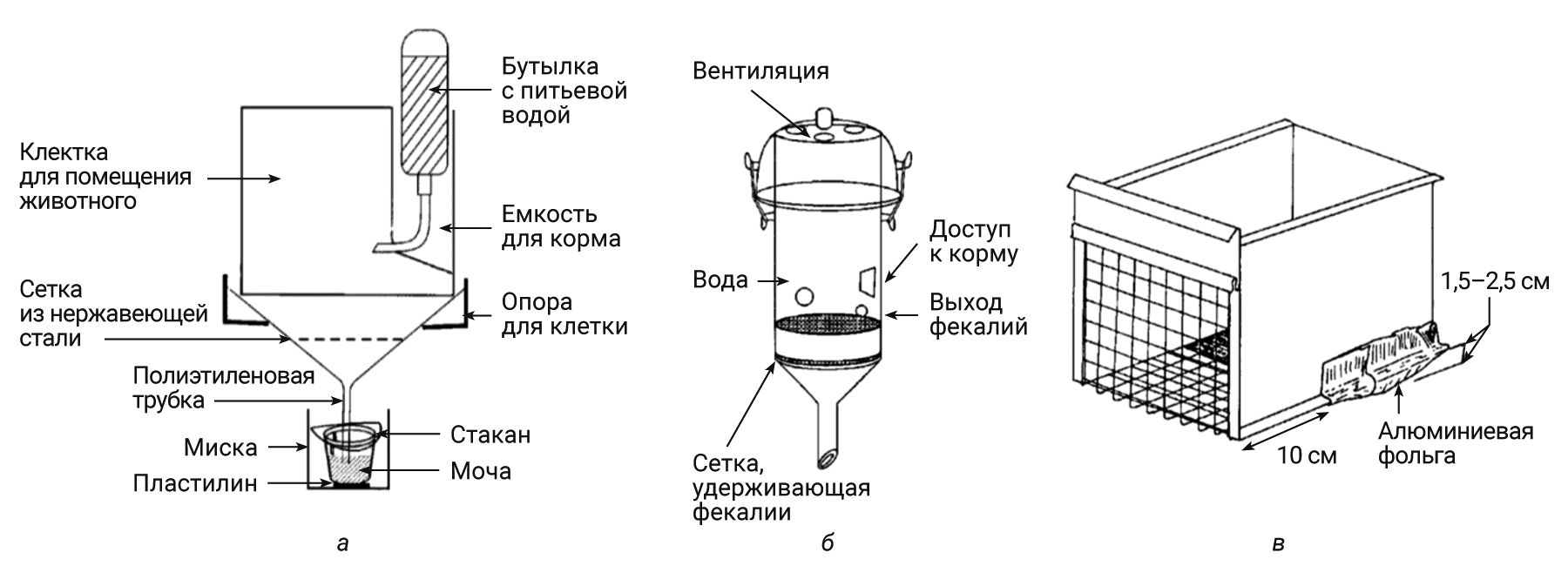
C.R. Smith и соавт. [11] сконструировали недорогой одноразовый аппарат для индивидуального сбора мочи у мышей с использованием одноразовой конической полипропиленовой пробирки объемом 250 мл для центрифугирования и проволоки (см. рис. 7). При данном методе разбавление образцов мочи из-за протекающей поилки и/или загрязнения от продуктов питания были исключены за счет использования внешних отделений для питьевой воды и корма. Конический конец пробирки отрезали так, чтобы создать отверстие диаметром 1 см. Через прорези в боковых стенках в пробирке располагали горизонтально сетку из нескольких проволок, где животное размещалось на время сбора образцов мочи. Еще одна проволочная сетка, установленная в нижней части пробирки, задерживала фекалии, но позволяла образцам мочи стекать вниз. Под системой устанавливали емкость для сбора образцов мочи. За 24 ч у мыши массой 25 г получали объем мочи от 0,5 до 2 мл.
В 1979 г. M. Merkenschlager и W. Wilk [12] разработали метод сбора образцов мочи у мышей с использованием алюминиевой фольги. Животных помещали в подвесные клетки с решетчатым дном. К дну клетки, в 10 см от ее передней части прикрепляли алюминиевую фольгу так, чтобы образовался скос с углублением на 1,5–2,5 см ниже дна (в соответствии с рис. 7). Складки фольги образовывали небольшие пространства для накопления образцов мочи, сохраняя их отдельно от фекалий. Данный метод нашел практическое применение при сборе образцов мочи в течение 4 ч. Объем образцов составил примерно 1 мл. Однако исследователи установили, что метод не подходит для сбора суточных образцов мочи главным образом из-за того, что мыши при наличии доступа к фольге пытаются ее грызть. Также за столь длительный период некоторое количество образца мочи испарялось, накапливалось большое количество фекалий, это приводило к трудностям получения незагрязненных образцов.
M. Fenske [13] предложил способ сбора суточных образцов мочи у таких мелких лабораторных животных, как монгольские песчанки, крысы, морские свинки и древесные землеройки. Животных содержали в клетках, идентичных по размеру клеткам содержания. Под клетки, оборудованные сетчатыми полами из нержавеющей стали, исследователь помещал алюминиевые листы и спустя 24 ч собирал с них образцы мочи. Несмотря на то, что моча в углублениях алюминиевых листов высыхала, ее было легко получить единичным промыванием алюминиевых листов (удавалось получить до 84–100% объема образца).
На сегодняшний день существует большое количество коммерческих фирм, выпускающих метаболические клетки для лабораторных животных (например, Harvard Apparatus, СШA; Braintree Scientific, СШA; Techniplast, СШA).
Метаболические клетки разработаны таким образом, чтобы обеспечить идеальное разделение фекалий и мочи, что достигается благодаря использованию специальной конструкции воронки и разделительного конуса. На рис. 8 представлена типичная метаболическая клетка для грызунов.
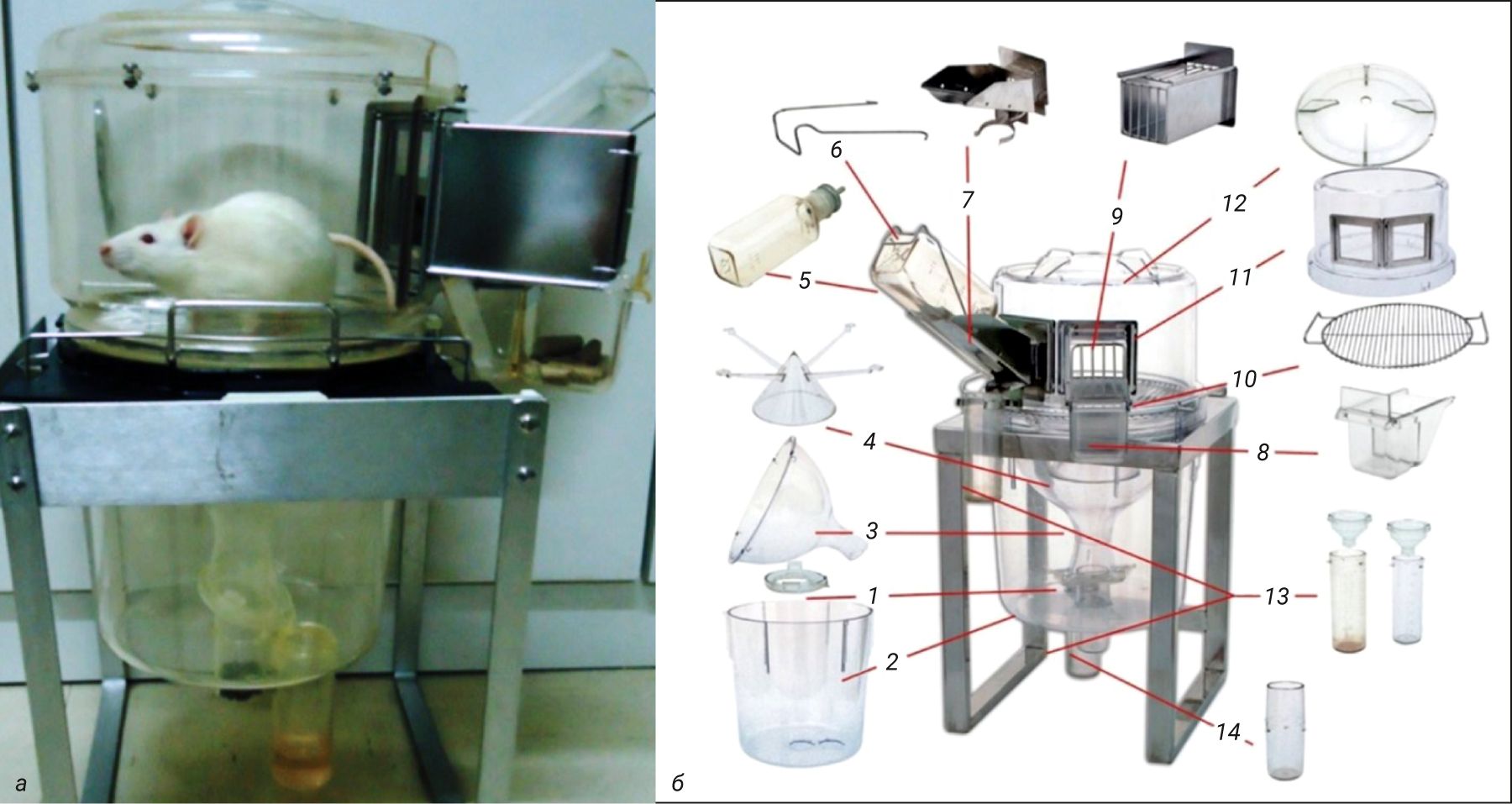
Система спроектирована так, чтобы свести к минимуму стресс для животных: конструкция кормушки, выполненная в виде выдвижного ящика, позволяет легко заполнять ее, а все детали под полом клетки можно отсоединять, не мешая животным, включая трубки для сбора мочи и фекалий. Отдельно вынесена поилка. Как правило, на поилках нанесена градуировка, что позволяет исследователю оценивать точный объем выпитой питьевой воды. Все компоненты клетки автоклавируются.
Однако мы не обнаружили публикаций, в которых бы оценивался уровень стресса у животных, находящихся в метаболических клетках. При этом необходимо учитывать, что метаболические клетки имеют площадь пола в разы меньше, чем рекомендовано для содержания лабораторных животных [12]. Поверхность метаболической клетки, на которой располагается животное, представляет собой проволочную сетку, что также создает для животного неудобство нахождения в ней и даже может привести к травматизации конечностей, развитию пролежней и пододерматитов [14, 15].
Важность благополучия животных при получении достоверных экспериментальных данных была подчеркнута в нескольких научных исследованиях [16–22] и сформулирована в Директиве Европейского экономического союза [23] и American Association for Laboratory Animal Science [24]. От животных, испытывающих стресс, невозможно получить достоверные результаты исследований. По последним данным установлено, что те условия, в которых содержатся животные, принципиально влияют на качество результатов исследования [25, 26].
Коммерчески доступные метаболические клетки имеют большие площади для сбора, что приводит к потерям объема полученных образцов мочи. R.W.West и соавт. [27] спроектировали стеклянную клетку с минимальной площадью поверхности для мышей с целью 24-часового сбора мочи в комбинации с проточным рН-электродом и низкотемпературной ванной для контроля рН мочи и охлаждения образцов. Аппарат представлял собой цилиндрическую стеклянную клетку с воронкообразным дном, снабженным двумя сетками из нержавеющей стали для поддержки животного и предотвращения оседания фекалий на поверхности для сбора образцов мочи. Сетки были разделены кольцом из нержавеющей стали. В стеклянных стенках клетки было проделано три отверстия. Одно отверстие обеспечивало доступ к пище. Второе отверстие снабжалось трубкой для подачи воды, а третье, расположенное у верхнего экрана, использовалось для удаления фекалий, прилипших к верхней сетке. Эксперимент, проведенный с использованием этого устройства, показал, что удалось собрать 74,2% объема образца мочи, в то время как 25,8% образцов было обнаружено прилипшими к поверхности клетки.
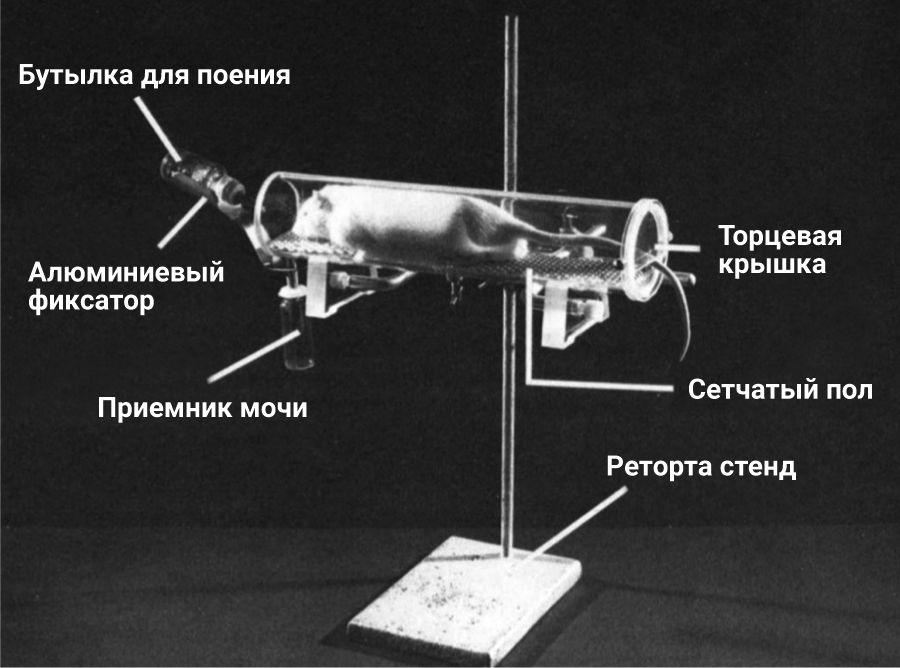
S. Toon и M. Rowland [28] изготовили устройство из оргстекла для отбора биологических образцов (мочи, кала, крови) во время проведения фармакокинетических и метаболических исследований (рис. 9). Основная часть устройства представлена прозрачной трубкой из оргстекла. Для крыс использовались трубки длинной 35 см с внутренним и внешним диаметром 6,3 и 7,6 см соответственно, а также с шириной прорези 0,4 см в верхней части для размещения канюли, которые позволяли проводить отбор проб и вводить лекарственные препараты. Пол трубки – алюминиевая алмазная сетка, расположенная в 1 см от дна трубки. Пол съемный для облегчения очистки крепился с помощью трех планок из нержавеющей стали. На одном конце трубки помещался сборник для мочи. Само устройство крепилось на кронштейне на высоте 20 см от поверхности. Авторами было установлено, что данная высота является наиболее подходящей для предотвращения побега. При легком наклоне трубки к дренажу образцы мочи быстро вытекали через дренаж в подготовленный сосуд. Несмотря на то, что животные не проявляли признаков дискомфорта из-за расположения стока под носом, все же лучше располагать сток в хвостовом конце трубки. Исследователи применяли аппарат для исследований, которые длились не больше 8 ч. Установлено, что расположение конструкции на расстоянии 20 см от поверхности является достаточным для того, чтобы животное не попыталось сбежать, а при возможном падении не смогло причинить себе вред. Животные очень быстро привыкали к нахождению в данном приспособлении, а благодаря прозрачным стенкам за ними было легко наблюдать, оценивая степень и уровень их дистресса. Данное приспособление подходило для фармакокинетических исследований, в которых было необходимо получить разные виды биологического материала (моча, кровь, фекалии). Несмотря на то что авторы создали данное устройство для крыс массой тела 350 г, размеры трубки могут быть изменены для других видов лабораторных животных, например мышей или морских свинок.
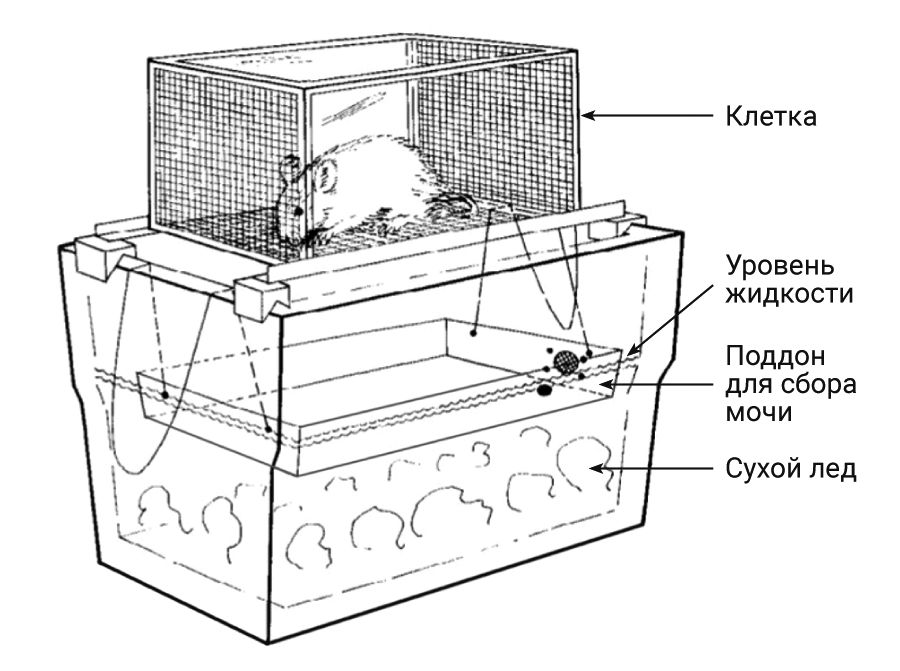
Для количественного определения нестабильных сое-динений, присутствующих в моче, важно предотвратить окислительные, ферментативные процессы и бакте-риальную деградацию, что можно добиться содержанием полученных образцов при низких температурах. W.D. Denckla [29, 30] разработал метод сбора свежеполученных образцов мочи у крыс методом свободного падения через сетчатый пол на поддон, охлажденный до -55°C или на сухой лед. Поддон для сбора мочи имел тефлоновое покрытие и чаще всего представлял собой противень для выпечки необходимого размера, чтобы поместить внутри холодильника. Клетка крысы располагалась на 3,75 см выше края холодильника. Установлено, что около 4 кг сухого льда хватает на 16 ч. Моча образовывала сферические гранулы, которые не прилипали к фекалиям. Фекальные гранулы можно было легко удалить пинцетом до появления новых образцов мочи (рис. 10).
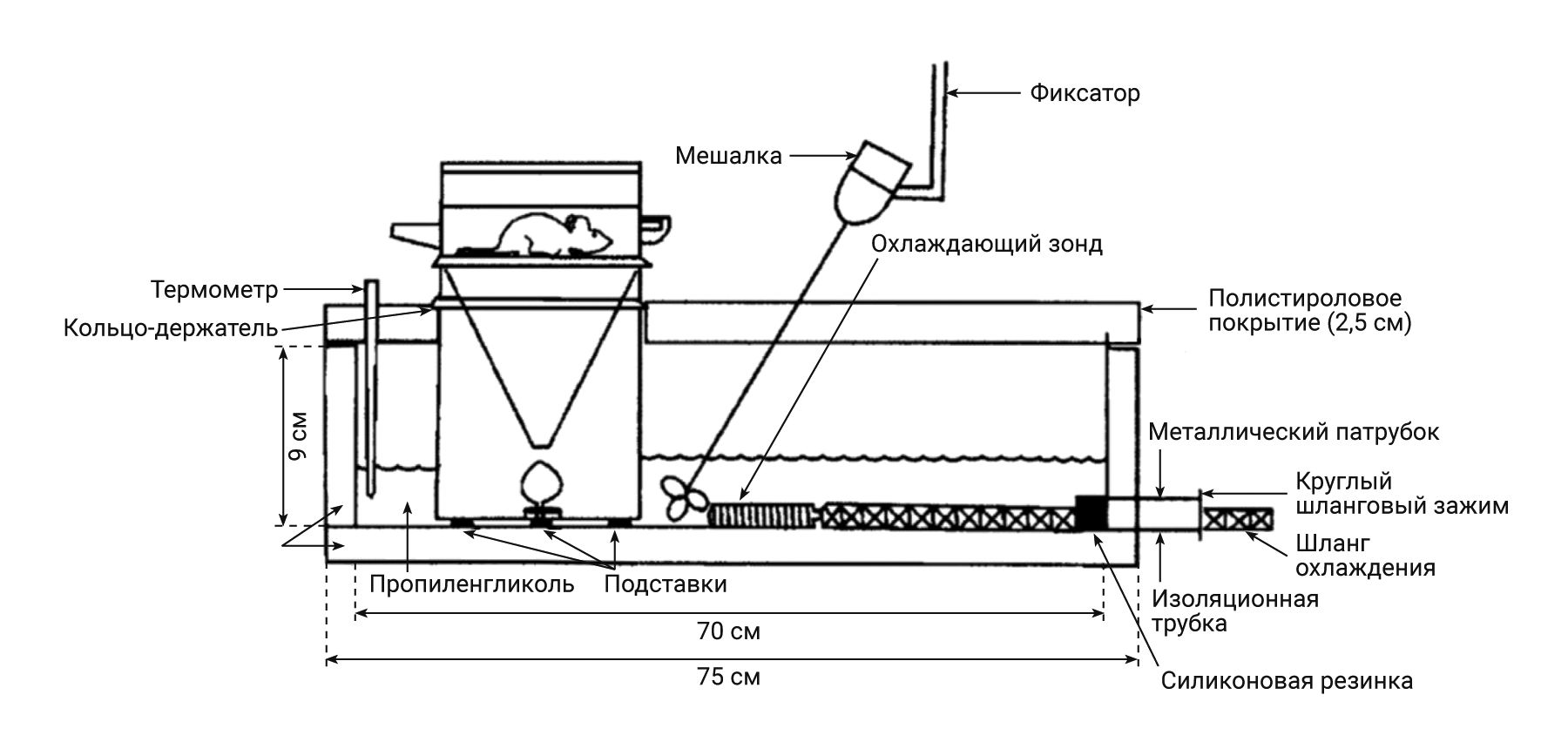
В 1978 г. C.W. Lartigue и соавт. [31] разработали более сложную систему получения мочи при низкотем-пературном режиме -19°С (рис. 11). Система состояла из металлического поддона, в котором находился про-пиленгликоль, охлаждаемый с помощью специального зонда и циркулирующий посредством медленно вра-щающегося миксера. Поддон состоял из нержавеющей стали, к нему был присоединен термометр для контроля температуры. Кроме этого, под воронкой располагалась пластиковая «лампа», служившая для отклонения фекалий в сторону. Под данной «лампой» была установлена емкость для сбора мочи. Если фекалии при падении отклонялись в сторону при ударе о «лампу», то моча стекала по ее стенкам в емкость. С помощью данного метода авторам удалось получить до 50 мл мочи у крыс за период сбора и обеспечить хорошее отделение фекалий и мочи.
W.A. White [32] предложил методику получения образцов мочи у анестезированных самцов крыс путем проведения операции по установке в просвет полового члена самца крысы постоянного катетера. Техника операции напоминала технику проведения цистотомии. Образцы мочи, собранные с помощью данного метода, были свободны от посторонних загрязнений и сопоставимы по качеству с образцами мочи, полученными естественным способом. Однако выполнение данной операции очень трудоемкое, дорогостоящее и приводит к развитию крайней степени дискомфорта у животных.
В табл. 1, 2 представлена сводная информация преимуществ и недостатков того или иного метода получения образцов мочи у грызунов.
Получение образцов мочи у кроликов
Кролик является широкораспространенным лабораторным животным для медико-биологических исследований и используется как биологическая тест-система для изучения различных заболеваний человека и животных как генетических, так и приобретенных. Данный вид лабораторных животных широко используется при урологических исследованиях, в том числе и при моделировании различных патологий мочевыделительной системы [33–46].
Еще в 1971 г. J.S. Garvey и B.L.Aalseth в своем исследовании [47] показали, что образцы мочи могут быть легко получены у новорожденных кроликов (до 10-дневного возраста) методом поглаживания брюшной стенки в области мочевого пузыря. Поглаживание следует продолжать до тех пор, пока не произойдет выделение мочи, что в свою очередь может быть достигнуто только при расслаблении мышц.
Однако после 10-дневного возраста у кроликов изменяется тонус мочевого пузыря и для получения образцов мочи данным методом требуется больше сил и времени. Если у новорожденных кроликов образцы мочи можно получить при слабо наполненном органе, то для забора образцов мочи у кроликов старшего возраста успех выполнения процедуры напрямую зависит от степени наполнения мочевого пузыря. Также стоит отметить, что животное должно быть максимально расслаблено для опорожнения мочевого пузыря, следовательно, рекомендовано проводить все действия с животным максимально аккуратно. Исследователь должен помнить, что слишком сильное давление на брюшную стенку или грубая фиксация животного могут привести к развитию дискомфорта, травматизации или даже удушью. Следует учитывать тот факт, что на каждого животного необходимо потратить определенное время для стимуляции опорожнения мочевого пузыря (от нескольких секунд до нескольких минут). С помощью данного метода авторам удалось собрать до 5 мл мочи [47].
В настоящее время в ветеринарной практике для получения образцов мочи у домашних кроликов наиболее широко применяют именно данный метод в виду минимального физического воздействия на организм животного. Однако такой метод подходит только в тех случаях, когда не требуется проведения дальнейшего бактериологического исследования образцов мочи. Очень важно при использовании методики фиксировать животное так, как представлено на рис. 12. Образцы мочи могут быть собраны с помощью помощника непосредственно в подготовленную тару либо на чистую (без использования едких дезинфицирующих средств) поверхность [48].
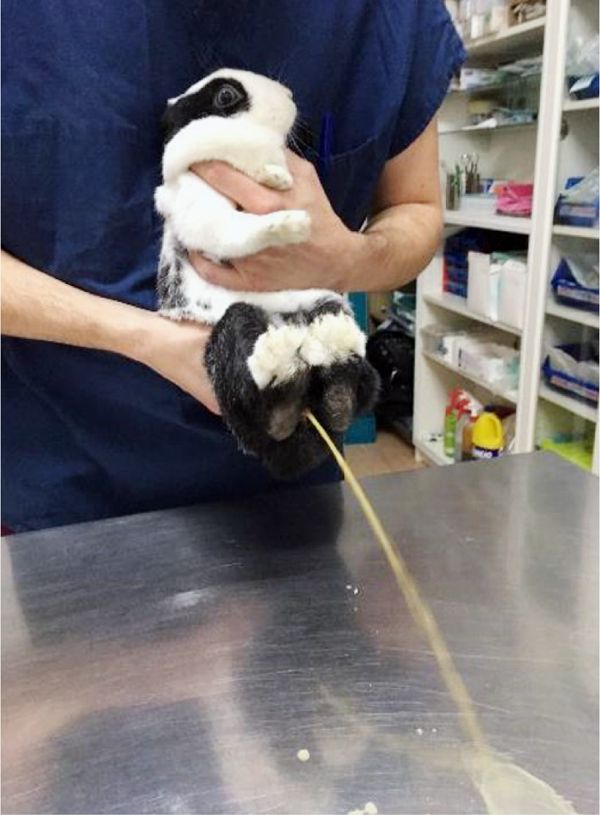
Цистоцентез позволяет получить асептические образцы мочи без потенциального загрязнения посторонними примесями. Следует соблюдать осторожность при выполнении цистоцентеза, так как микротравмы стенки мочевого пузыря в результате прокола иглы могут стимулировать местную минерализацию, возможен прокол слепой кишки, увеличенной в объеме матки или даже развитие абсцесса [48]. Таким образом, в качестве профилактики осложнений рекомендовано проводить цистоцентез под ультразвуковым сопровождением. Применение ультразвукового сопровождения в качестве вспомогательного средства позволяет свести риски травматизации тканей к минимуму, проследить правильное расположение иглы при выполнении процедуры, а также оценить в принципе возможность проведения процедуры в зависимости от наполнения мочевого пузыря. Для начала методом ультразвукового исследования (УЗИ) визуализируют мочевой пузырь, оценивают степень его наполнения. При переполненном органе манипуляцию не рекомендуют проводить в виду риска разрыва мочевого пузыря. Прокол брюшной стенки проводят под маркером ультразвукового датчика стерильной иглой с соблюдением правил асептики и антисептики. На мониторе УЗИ-аппарата визуализируют иглу в виде гиперэхогенной линии, испускающей эхоакустическую тень при движении датчика. Под контролем УЗИ иглу продолжают медленно продвигать вглубь до прокола стенки мочевого пузыря. При нахождении иглы в полости мочевого пузыря во время отведения поршня в шприц будет набираться моча. Это самый «чистый» способ получения проб мочи, так как она берется непосредственно из мочевого пузыря и не содержит бактерий, характерных для уретры. Данную процедуру можно выполнить как под легкой кратковременной анестезией (например, применение ингаляционного анестетика «Изофлуран») в случае невозможности фиксации животного в неподвижном положении, так и без нее при наличии достаточных навыков персонала. Важно отметить, что при практически пустом мочевом пузыре получить образцы мочи крайне трудно.
В своем исследовании K.G. Benson и J. Paul-Murphy [49] описали получение образцов мочи у кроликов с помощью коммерческих метаболических клеток (суточные образцы мочи). В прошлом лабораторных кроликов содержали в клетках небольшого размера, что, как было показано, приводило к развитию стресса и дискомфорта у животных. Клетки должны быть такого размера, чтобы обеспечить животному максимальную свободу движений. По данным K. Boers и соавт. [50], при помещении кролика в метаболическую клетку необходимо обеспечить обогащение окружающей среды таким образом, чтобы животное не испытывало дискомфорт и/или стресс. Под понятием «обогащение окружающей среды» авторы полагали оснащение клеток/вольеров содержания соломенным подстилом, размещение в них деревянных палок и веток деревьев для предоставления животным потребности грызть, картонных коробок и пластиковых ящиков в качестве «безопасных» мест для укрытия, заменяющих норы. Во избежание развития стресса у кроликов необходимо предусмотреть, чтобы животное визуально не было изолировано от других кроликов (так как кролики предпочитают жить группами). Основание клеток не должно иметь железной сетки или проволочного настила, так как это часто приводит к развитию у животных язвенного пододерматита. Таким образом, для успешного сбора мочи у кроликов животные должны находиться в условиях максимально свободных от стресса. Однако такой подход не позволяет собирать незагрязненные образцы мочи.
Еще одним из возможных методов получения образцов мочи у кроликов является катетеризация мочевого пузыря [51–54]. Данную процедуру необходимо проводить под анестезией в виду болезненности и возможной травматизации при сопротивлении животного.
Стандартная техника катетеризации мочевого пузыря у кроликов
Животное фиксируют на спине в положении лежа. Для катетеризации применяют резиновые уретральные катетеры размером от №8 до 18 в зависимости от величины кролика. Для придания катетеру жесткости можно вставить в него медную проволоку (в качестве мандрена). Введение катетера проводят следующим образом: направляющий конец катетера сгибают на 90° и вводят постепенно в уретру. Катетер необходимо держать строго по средней линии. Легким нажатием направляющий конец катетера доводят до изгиба мочевого канала. Катетер вводят на длину 10–14 см, затем удаляют мандрен и из катетера должна начать вытекать моча. Если моча не выделяется, то катетер продвигают глубже или оттягивают на 1,5 см, а также аккуратно надавливают на область мочевого пузыря (немного выше лобковой кости). Катетер следует вводить спокойно, легкими движениями. Перед введением катетер обязательно стерилизуют и слегка смазывают вазелином [54, 55].
Несмотря на то что техника катетеризации мочевого пузыря у кроликов описана во многих источниках литературы, ее выполнение по стандартной технике не может быть рутинным ввиду возникающих в процессе процедуры сложностей.
Лишь в одном исследовании [56] авторы изучали проблемы катетеризации кроликов. В основном трудности возникали при попытках катетеризации мочевого пузыря у самцов кроликов. При неудачной катетеризации животных подвергали эвтаназии и детально изучали расположение уретрального катетера. По результатам проведенного исследования авторы установили, что основной проблемой катетеризации самцов кроликов служит неверное размещение уретрального катетера вследствие введения его ошибочно не в полость мочевого пузыря, а в просвет пузырьковидной железы. Это происходит из-за анатомических особенностей самцов кроликов, у которых в мочеиспускательный канал также открываются эякуляторные протоки (рис. 13).
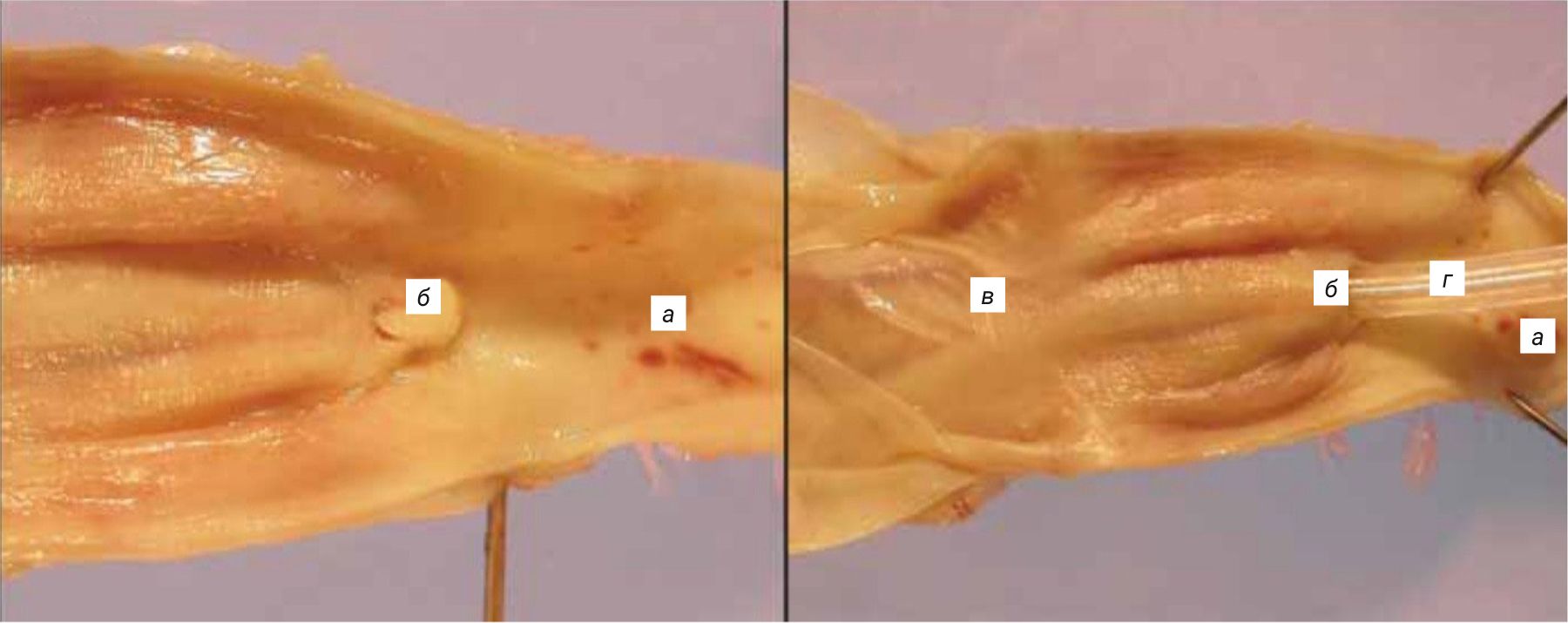
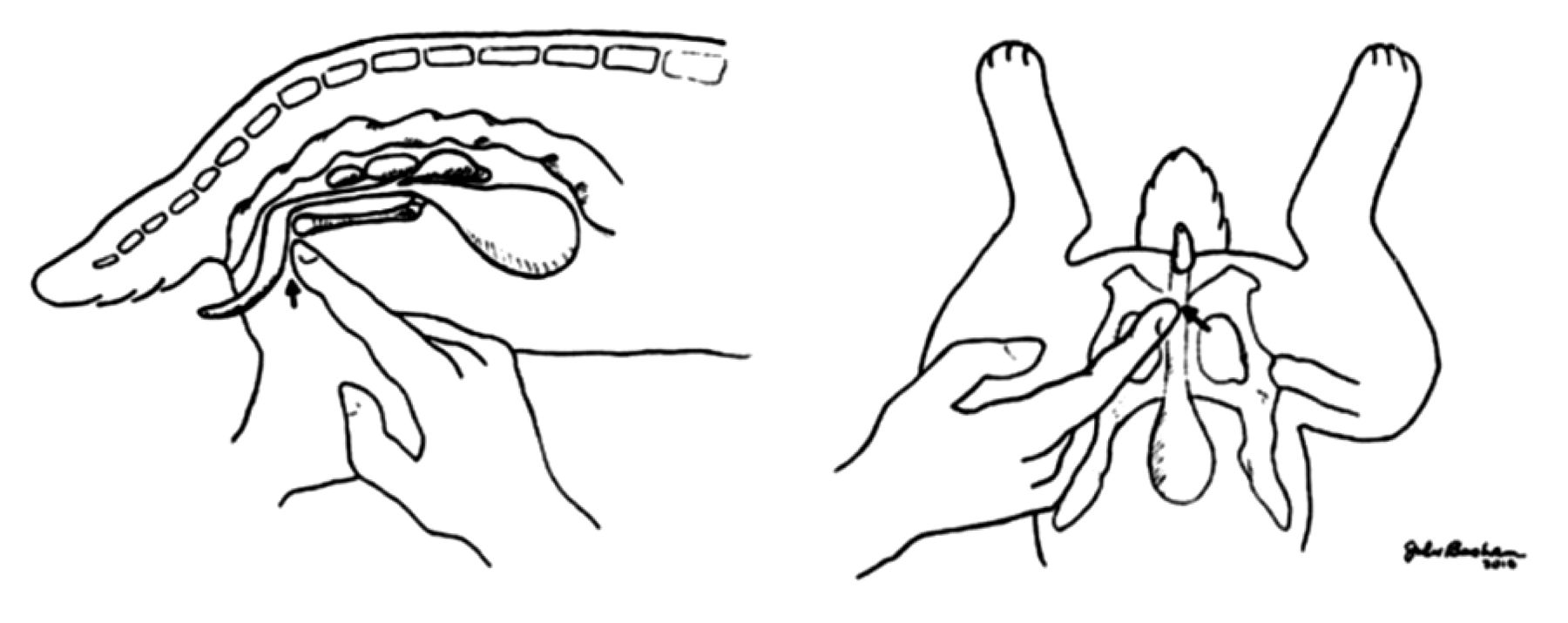
При анализе полученных результатов авторы предложили модифицированную технику катетеризации мочевого пузыря у самцов кроликов с применением пальцевого надавливания в области лобкового сращения для корректного введения уретрального катетера в полость мочевого пузыря. Животных предварительно анестезировали с помощью изофлурана. При данной технике самца кролика укладывали на спину брюшной стенкой кверху. Предварительно смазав уретральный катетер вазелином, аккуратно с помощью одной руки вводили его в мочеиспускательный канал. Кончик указательного пальца другой руки располагали каудально на лобковом сращении и слегка надавливали, параллельно продвигая другой рукой уретральный катетер (рис. 14). При достижении полости мочевого пузыря из уретрального катетера начинала выходить моча. Благодаря использованию данной техники удалось предотвратить вход уретрального катетера в просвет пузырьковидной железы, что обеспечило успешное проведение катетеризации мочевого пузыря и получение образцов мочи.
Получение образцов мочи у хорьков
J.K. Morrisey и J.C. Ramer [57] отметили, что предпочтительным методом забора образцов мочи у хорьков является цистоцентез, однако необходимо соблюдать нескольких важных условий для качественного выполнения манипуляции – мочевой пузырь должен быть пальпируемым а животное необходимо полностью обездвиживать. Техника проведения аналогична таковой для других видов животных. По данным авторов, у хорьков катетеризация мочевого пузыря неоправданно трудоемкая и зачастую неэффективная процедура. Также образцы мочи можно получить у хорьков при естественном мочеиспускании и легком массаже брюшной стенки в области мочевого пузыря [58].
Получение образцов мочи у карликовых свиней
В настоящее время свинья считается одной из лучших биологических моделей в связи с ее анатомо-физиологическим сходством с человеком [59]. Использование в эксперименте домашних свиней ограничено рядом неудобств, обусловленных их размерами. В доклинических исследованиях активно используются карликовые свиньи, они удобны для содержания в лабораторных условиях и проведения различных манипуляций. Показано, что карликовые свиньи чувствительны к широкому спектру лекарственных средств и химических веществ.
В источниках литературы описано совсем небольшое количество методов получения образцов мочи у свиней.
В настоящее время все чаще карликовых свиней заводят в качестве домашних питомцев, и, как свидетельствуют публикации, владельцам в большинстве случаев удается приучить их справлять нужду или в специально отведенных местах, или на улице. Таким образом, в ветеринарной практике при необходимости получить образец мочи владельцы просто выводят своего питомца на улицу и во время естественного акта мочеиспускания собирают выделяющуюся мочу в подготовленный контейнер [60].
По данным литературы, для получения образцов мочи у самок карликовых свиней подходящим методом является катетеризация мочевого пузыря. Применяют гибкие резиновые уретральные катетеры Фолея. Для свиней массой тела от 10 до 70 кг подходят уретральные катетеры диаметром 1,67–4,7 мм. Самок карликовых свиней проще катетеризировать в лежачем положении на животе при использовании уретральных катетеров со стилетом. Отверстие уретры расположено каудально в конце края лобковой кости, таким образом, катетер продвигают по средней линии для входа в уретру. Иногда при постановке катетер упирается в дивертикул, вызванный временным закупориванием, что возможно устранить путем мягкого вращения катетера. Катетеризация мочевого пузыря у самцов карликовых свиней – очень трудоемкая процедура из-за наличия препуциального дивертикула, штопорообразной верхушки полового члена и наличия сигмовидного изгиба [61]. Удавалось провести катетеризацию мочевого пузыря у самца карликовой свиньи, поместив палец в прямую кишку свиньи и осторожно надавливая на катетер через стенку прямой кишки вентрально и краниально.
Возможным методом получения образцов мочи у самцов карликовых свиней является цистоцентез, проведение которого следует осуществлять под ультразвуковым контролем [61].
Получение образцов мочи у кошек и собак
Кошки и собаки также применяются в доклинических исследованиях в качестве тест-систем, хотя по сравнению с другими лабораторными животными значительно реже.
Как и у других видов животных, для получения асептического образца мочи рекомендовано отдавать предпочтение цистоцентезу [62, 63]. Техника выполнения не отличается от таковой у других видов животных. В связи с возможным развитием осложнений после или во время данной манипуляции цистоцентез рекомендовано применять только тогда, когда необходимо собрать образцы мочи для бактериологического анализа, процедуру необходимо проводить только с сопровождением УЗИ. У собак и кошек цистоцентез можно выполнить как в положении животного лежа на боку, так и на спине. Чаще всего при хороших навыках персонала животные не нуждаются в анестезии.
Еще одним методом, описанным в литературе, является получение образцов мочи у кошек и собак при помещении животных в специальные метаболические клетки [63]. Данные метод применяли в тех случаях, когда было необходимо получить образцы мочи за продолжительный период у большого количества животных. Несмотря на преимущество в минимальном физическом воздействии на животное, не удавалось получить чистые образцы мочи. Также содержание животных на сетчатом полу приводило к развитию дискомфорта и стресса у животных. Основываясь на особенностях поведения кошек, F.J. Pastoor и соавт. [64] предложили использовать метаболические клетки со сплошным полом, которые дополнительно были оснащены контейнерами, разделяющими мочу от фекалий, при этом авторы учли важную потребность кошек в зарывании фекалий.
В ветеринарной практике часто для получения разовой порции мочи применяют метод пальпации мочевого пузыря. Однако данный метод требует необходимого опыта в проведении и в некоторых случаях может занять длительное время. Также эту процедуру невозможно выполнить при пустом мочевом пузыре у животного.
У кошек и собак образцы мочи могут быть получены при естественном мочеиспускании. В таком случае у кошек образцы мочи собирают из предварительно вымытого лотка без наполнителя. Если животное не привыкло к отсутствию наполнителя, то существует специальный наполнитель для сбора образцов мочи, который не впитывает мочу. Владельцы собак чаще всего собирают образцы мочи во время выгула в подготовленный контейнер.
Также у кошек и собак активно применяется катетеризация мочевого пузыря. В целом техника проведения не отличается от таковой у остальных видов лабораторных животных. Манипуляцию предпочтительно проводить под анестезией в виду болезненности и возможного риска травматизации [63].
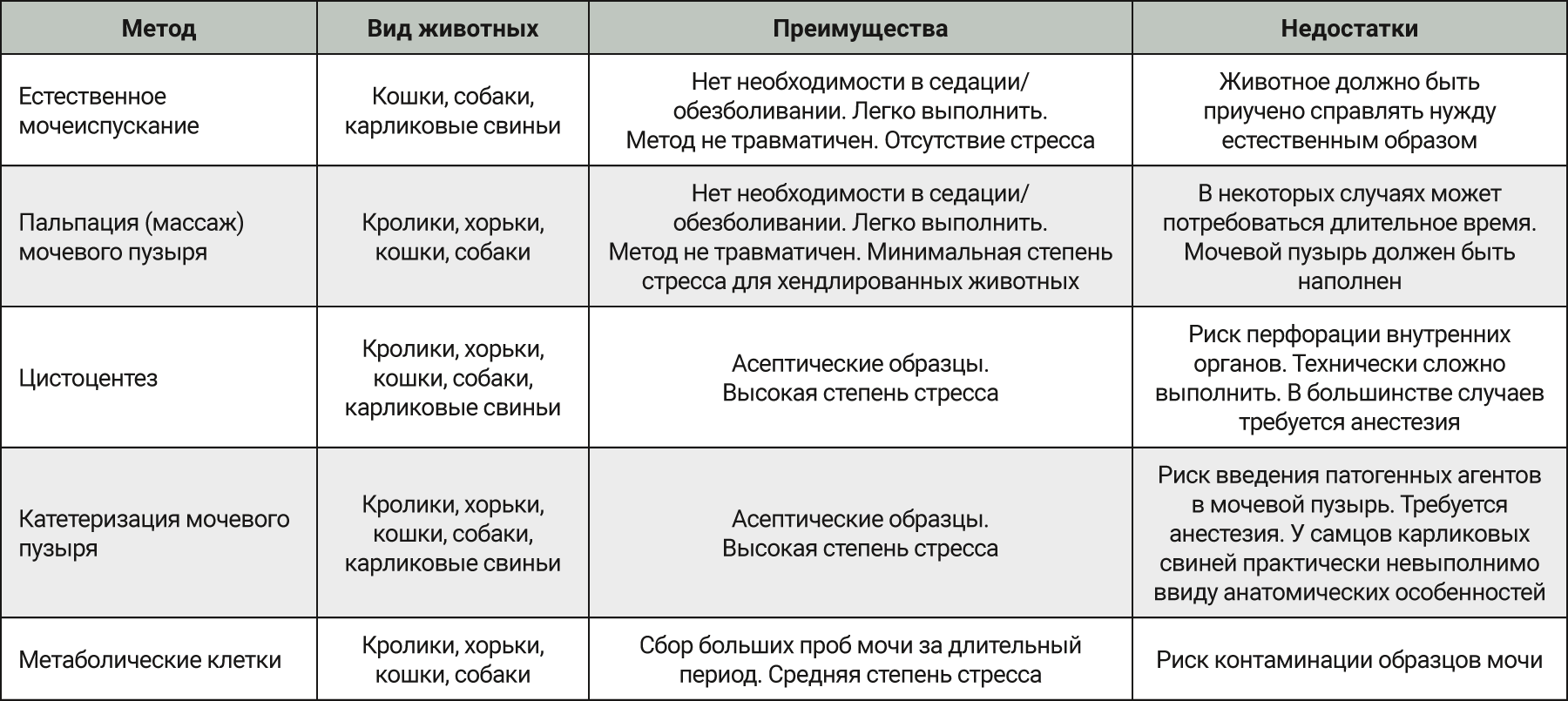
В табл. 3 представлены преимущества и недостатки различных методов получения образцов мочи у крупных видов лабораторных животных.
Заключение
Таким образом, в данном обзоре были рассмотрены различные методы получения образцов мочи у лабораторных животных. Методов получения образцов мочи большое количество, но каждый из них требует технических навыков и отработки выполнения в лабораторных условиях с целью получения чистых биологических образцов в достаточных для анализа объемах. В лабораторной практике при выборе метода получения биологических образцов необходимо отдавать преимущество простым в выполнении, удобным и по возможности минимально травматичным для животных методам. Особое внимание стоит уделить развитию стресса и дискомфорта у животных при том или ином методе забора образцов мочи, так как у животных, испытывающих стресс, невозможно получить достоверные результаты исследований.
Вклад авторов
Е.И. Трофимец – сбор данных литературных источников, сбор и анализ данных, написание и редактирование текста статьи
А.Е. Кательникова – научное консультирование
К.Л. Крышень – научное консультирование, редактирование текста статьи, научное консультирование и утверждение окончательного варианта статьи для публикации
Список источников
- Cohen S.M., T. Ohnishi, N.M. Clark, J. He & L.L. Arnold. Investigations of rodent urinary bladder carcinogens: collection, processing, and evaluation of urine and bladders // Toxicol. Pathol. – 2007. – Vol. 35(3). – P. 337-347. DOI: 10.1080/01926230701197115.
- Kurien B.T., Scofield R.H. Mouse urine collection using clear plastic wrap // Laboratory animals. – 1999. – Vol. 33. – №. 1. – P. 83-86. DOI: 10.1258/002367799780578525.
- Watts R.H. A simple capillary tube method for the determination of the specific gravity of 25 and 50 micro l quantities of urine // Journal of clinical pathology. – 1971. – Vol. 24. – №. 7. – P. 667. DOI:10.1136/jcp.24.7.667.
- Weiss J., G. Tayler, F. Zimmermann & K. Nebendahl. Collection of body fluids in the laboratory rat // Academic Press. – USA. – 2000. – P. 494-498. DOI:10.1016/B978-012426400-7.50064-9.
- Hayashi S., Sakaguchi T. Capillary tube urinalysis for small animals // Laboratory animal science. – 1975. – Vol. 25. – №. 6. – P. 781-782.
- Washington I.M., Van Hoosier G. Clinical biochemistry and hematology. The laboratory rabbit, guinea pig, hamster, and other rodents. – Academic Press. – 2012. – P. 57-116. DOI: 10.1016/B978-0-12-380920-9.00003-1.
- Talhada D. Recommendations for urine and urinary bladder collection in chemical carcinogenesis assays with rodents // Scand J Lab Anim Sci. – 2015. – Vol. 41. – P. 1-8. DOI: https://doi.org/10.23675/sjlas.v41i0.331
- Khosho F.K., Kaufmann R.C., Amankwah K.S. A simple and efficient method for obtaining urine samples from rats // Laboratory animal science. – 1985. – Vol. 35. – №. 5. – P. 513-514. PMID: 4057948.
- Jackson A.J., Sutherland J.C. Novel device for quantitatively collecting small volumes of urine from laboratory rats // Journal of Pharmaceutical Sciences. – 1984. – Vol. 73. – P. 816–818. DOI:10.1002/JPS.2600730627.
- Perline I.H. An inexpensive mouse urine collection system // Physiology & behavior. – 1971. – Vol. 6. – №. 5. – P. 597. DOI:10.1016/0031-9384(71)90211-3.
- Smith C.R., Felton J.S., Taylor R.T. Description of a disposable individual-mouse urine collection apparatus // Laboratory animal science. – 1981. – Vol. 31. – №. 1. – P. 80-82. PMID: 7253557.
- Merkenschlager M., Wilk W. Recommendation for the keeping of laboratory animals in accordance with animal protection principles // Recommendations for the Possible Limitation and Substitution of Experiments with Animals. – 1979.
- Fenske M. Application of a new, simple method for quantitative collection of 24-hour urines in small laboratory animals: determination of basal excretion of proteins, creatinine, urea, electrolytes, and of free steroids // Zeitschrift fur Versuchstierkunde. – 1989. – Vol. 32. – №. 2. – P. 65-70. PMID: 2756797.
- Ewbank R. Laboratory dogs and cats: report of the working group // Standards in Laboratory Animal Management. – 1984. – P. 105-106.
- Lawlor M.M. Comfortable quarters for rats in research institutions // Comfortable quarters for laboratory animals. – 2002. – P. 26-32.
- Anderson C.O., Denenberg V.H., Zarrow M.X. Effects of handling and social isolation upon the rabbit's behaviour // Behaviour. – 1972. – P. 165-175. DOI:10.1163/156853973X00526.
- Hughes B.O., Black A.J. The influence of handling on egg production, egg shell quality and avoidance behaviour of hens // British Poultry Science. – 1976. – Vol. 17. – №. 2. – P. 135-144. DOI:10.1080/00071667608416258.
- Miller C. Behavioral responsiveness of young chimpanzees (Pan troglodytes) to a novel environment // Folia primatologica. – 1986. – Vol. 47. – №. 2-3. – P. 128-142. DOI:10.1159/000156270.
- Jezierski T.A., Konecka A.M. Handling and rearing results in young rabbits // Applied Animal Behaviour Science. – 1996. – Vol. 46. – №. 3-4. – P. 243-250. DOI:10.1016/0168-1591(95)00653-2.
- Lensink B.J. Reducing veal calves' reactivity to people by providing additional human contact // Journal of Animal Science. – 2000. – Vol. 78. – №. 5. – P. 1213-1218. DOI:10.2527/2000.7851213X.
- Rochlitz I. Recommendations for the housing and care of domestic cats in laboratories //Laboratory Animals. – 2000. – Vol. 34. – №. 1. – P. 1-9. DOI:10.1258/002367700780577939.
- Russell W.M.S. The ill-effects of uncomfortable quarters // Comfortable Quarters for Laboratory Animals. – 2002. – P. 1-5.
- European Economic Community (1986) Council directive 86/609 on the Approximation of Laws, Regulations, and Administrative Provisions Regarding the Protection of Animals Used for Experimental and Other Scientific Purposes, Annex II Guidelines for Accomodation and Care of Animals. Official Journal of the European Communities L358, 7–28.
- American Association for Laboratory Animal Science (2001) Cost of Sharing: Recognizing Human Emotions in the Care of Laboratory Animals. Memphis, TN: American Association for Laboratory Animal Science.
- Würbel H. Ideal homes? Housing effects on rodent brain and behaviour // Trends in neurosciences. – 2001. – Vol. 24. – №. 4. – P. 207-211. DOI:10.1016/S0166-2236(00)01718-5
- Sherwin C.M. Comfortable quarters for mice in research institutions // Comfortable quarters for laboratory animals. – 2002. – Vol. 9. – P. 6-17.
- West R.W., Stanley J.W., Newport G.D. Single-mouse urine collection and pH monitoring system // Laboratory animal science. – 1978. – Vol. 28. – №. 3. – P. 343-345.
- Toon S., Rowland M. A simple restraining device for chronic pharmacokinetic and metabolic studies in rats // Journal of Pharmacological Methods. – 1981. – Vol. 5. – P. 321–323. DOI:10.1016/0160-5402(81)90044-9.
- Denckla W.D. Low temperature urine collector for unstable compounds // Journal of Laboratory and Clinical Medicine. – 1966. – Vol. 68. – P. 173–176. DOI:10.5555/URI:PII:0022214366900709.
- Denckla W.D. Inexpensive low-temperature urine collector // Journal of Applied Physiology. – 1969. – Vol. 26. – P. 393–394. DOI:10.1152/JAPPL.1969.26.3.393.
- Lartigue C.W., Driscoll T.B., Johnson P.C. Low-temperature urine collection apparatus for laboratory rodents // Laboratory Animal Science. – 1978. – Vol. 28. – P. 594–597.
- White W.A. A technique for urine collection from anesthetized male rats // Laboratory Animal Science. – 1971. – Vol. 21. – P. 401–402.
- Barlas M. The effects of piroxicam to the muscosal barrier of the bladder after overdistension – an experimental study in rabbits // International Urology and Nephrology. – 2004. – Vol. 34. – P. 321–324. DOI:10.1023/A:1024449702272.
- Csanaky I, Gregus Z. Species variations in the biliary and urinary excretion of arsenate, arsenite, and their metabolites // Comp Biochem Physiol C Toxicol Pharmacol. – 2002. – Vol. 131. – P. 355–365. DOI:10.1016/S1532-0456(02)00018-2.
- Hachem R., Reitzel R., Borne A., Jiang Y., Tinkey P., Uthamanthil R., Chandra J., Ghannoum M., Raad I. Novel antiseptic urinary catheters for prevention of urinary tract infections: correlation of in vivo and in vitro test results // Antimicrob Agents Chemother. – 2009. – Vol. 53. – P. 5145–5149. DOI:10.1128/AAC.00718-09.
- Khoury A.E., Olson M.E., Lam K., Nickel J.C., Costerton J.W. Evaluation of the retrograde contamination guard in a bacteriologically challenged rabbit model // British journal of urology. – 1989. – Vol. 63. – P. 384–388. DOI:10.1111/J.1464-410X.1989.TB05223.X.
- Morck D.W, Lam K., McKay S.G., Olson M.E., Prosser B., Ellis B.D., Cleeland R., Costerton J.W. 1994. Comparative evaluation of fleroxacin, ampicillin, trimethoprimsulfamethoxazole, and gentamicin as treatments of catheter-associated urinary tract infection in a rabbit model // International journal of antimicrobial agents. –1994. – Vol. 4. – P. 21–27. DOI:10.1016/0924-8579(94)90018-3.
- Morck D.W., Olson M.E., McKay S.G., Lam K., Prosser B., Cleeland R., Costerton J.W. Therapeutic efficacy of fleroxacin for eliminating catheter-associated urinary tract infection in a rabbit model // Am J Med. – 1993. – P. 23–30.
- Morck D.W., Olson M.E., Read R.R., Buret A.G., Ceri H. The rabbit model of catheter-associated urinary tract infection // In: Zak O, Sande MA, editors. Handbook of animal models of infection. Boston (MA): Academic Press – 1999. – P. 453–462. DOI:10.1016/B978-012775390-4/50192-5.
- Nickel J.C., Grant S.K., Costerton J.W. Catheter-associated bacteriuria. An experimental study // Urology. – 1985. – P. 369–375.
- Nickel J.C., Grant S.K., Lam K., Olson M.E., Costerton J.W. Bacteriologically stressed animal model of new closed catheter drainage system with microbicidal outlet tube // Urology. – 1991. –P. 280– 289. DOI:10.1016/S0090-4295(91)80363-C.
- Nickel J.C., Olson M.E., Costerton J.W. In vivo coefficient of kinetic friction: study of urinary catheter biocompatibility // Urology. – 1987. P. 501–503. DOI:10.1016/0090-4295(87)90037-9.
- Papavramidis T.S., Lazou T.P., Cheva A., Gamvros O.J. Chronically increased intraabdominal pressure: validating a model // Obesity Surgery. – 2010. – P. 900–905. DOI:10.1007/s11695-010-0156-5.
- Pugach J.L., DiTizio V., Mittelman M.W., Bruce A.W., DiCosmo F., Khoury A.E. Antibiotic hydrogel-coated Foley catheters for prevention of urinary tract infection in a rabbit model // The Journal of urology. – 1999. – P. 883–887. DOI:10.1097/00005392-199909010-00084.
- Richards C.L., Hoffman K.C., Bernhard J.M., Winslow S.D., Norman J.C., Whalen R.L. Development and characterization of an infection-inhibiting urinary catheter // ASAIO Journal. – 2003. – P. 449–453. DOI:10.1097/01. MAT.0000073965.14266.1 A.
- Schroder A., Kogan B.A., Lieb J., Levin R.M. Increased blood flow after catheterization and drainage in the chronically obstructed rabbit urinary bladder // Urology. – 2001. – P. 295–300. DOI:10.1016/S0090-4295(01)01142-6.
- Garvey J.S., Aalseth B.L. Urine collection from newborn rabbits // Laboratory Animal Science. – 1971. – P. 739.
- Gallego M. Laboratory reference intervals for systolic blood pressure, rectal temperature, haematology, biochemistry and venous blood gas and electrolytes in healthy pet rabbits // Open veterinary journal. – 2017. – Vol. 7. – №. 3. – P. 203-207. DOI:10.4314/ovj.v7i3.1.
- Benson K.G., Paul-Murphy J. Clinical pathology of the domestic rabbit. Acquisition and interpretation of samples // The Veterinary Clinics of North America. Exotic Animal Practice. – 1999. – Vol. 2. – P. 539–551. DOI:10.1016/S1094-9194(17)30109-3.
- Boers K., Gray G., Love J., Mahmutovic Z., McCormick S., Turcotte N., Zhang Y. Comfortable quarters for rabbits in research institutions. In: Comfortable Quarters for Laboratory Animals, 9th edn (Reinhardt V, Reinhardt A, eds). Washington DC: Animal Welfare Institute. – 2002.
- Melillo A. Rabbit clinical pathology // Journal of Exotic Pet Medicine. – 2007. – Vol. 16. – №. 3. – P. 135-145. DOI:10.1053/j.jepm.2007.06.002.
- Sun Y. Decreased urethral mucosal damage and delayed bacterial colonization during short-term urethral catheterization using a novel trefoil urethral catheter profile in rabbits // The Journal of urology. – 2011. – Vol. 186. – №. 4. – P. 1497-1501. DOI:10.1016/j.juro.2011.05.043.
- Lieb J. The effect of urine volume and nitric oxide on basal bladder blood flow: response to catheterization and drainage // Neurourology and Urodynamics: Official Journal of the International Continence Society. – 2001. – Vol. 20. – №. 1. – P. 115-124. DOI:10.1002/1520-6777(2001)20:1<115::AID-NAU13>3.0.CO;2-3.
- Елизарова О.Н., Жидкова Л.В., Кочеткова Т.А. Пособие по токсикологии для лаборантов // М.: Медицина. – 1974. [Elizarova O.N., ZHidkova L.V., Kochetkova T.A. Posobie po toksikologii dlya laborantov // M.: Medicina. – 1974.].
- Мелешков С.Ф. Функциональная оценка мочевого пузыря у кроликов // Омский научный вестник. – 2014. – №. 1 (128). – С. 112-115. [Meleshkov S.F. Funkcional'naya ocenka mochevogo puzyrya u krolikov // Omskij nauchnyj vestnik. – 2014. – №. 1 (128). – P. 112-115].
- Uthamanthil R.K. Urinary catheterization of male rabbits: A new technique and a review of urogenital anatomy // Journal of the American Association for Laboratory Animal Science. – 2013. – Vol. 52. – №. 2. – P. 180-185. PMID: 23562102.
- Morrisey J.K., Ramer J.C. Ferrets. Clinical pathology and sample collection // The Veterinary Clinics of North America. Exotic Animal Practice. – 1999. – P. 553–564. DOI:10.1016/S1094-9194(17)30110-X.
- Eshar D., Wyre N.R., Brown D.C. Urine specific gravity values in clinically healthy young pet ferrets (Mustela furo) // Journal of Small Animal Practice. – 2012. – Vol. 53. – №. 2. – P. 115-119. DOI:10.1111/j.1748-5827.2011.01173.x.
- Тихонов В.Н. Мини-свиньи – надежда человечества // Химия и Жизнь. – 2011. – №9. – С.32-36. [Tihonov V.N. Mini-svin'i – nadezhda chelovechestva // Himiya i ZHizn'. – 2011. – № 9. – P.32-36].
- Van Metre D.C., Angelos S.M. Miniature pigs // Veterinary Clinics of North America: Exotic Animal Practice. – 1999. – Vol. 2. – №. 3. – P. 519-537. DOI:10.1016/s1094-9194(17)30108-1.
- Swindle M.M., Smith A.C. Swine in the Laboratory: surgery, anesthesia, imaging, and experimental techniques – 2007. – P. 40-42. DOI:10.1201/9781420009156.
- Давидюк Е.В. Цистоцентезный способ сбора мочи для анализа у собак и кошек // Проблемы современной науки и образования. – 2015. – №. 10. – С. 148-149. [Davidyuk E.V. Cistocenteznyj sposob sbora mochi dlya analiza u sobak i koshek // Problemy sovremennoj nauki i obrazovaniya. – 2015. – №. 10. – P. 148-149].
- Kurien B.T., Everds N.E., Scofield R.H. Experimental animal urine collection: a review // Laboratory animals. – 2004. – Vol. 38. – №. 4. – P. 333-361. DOI:10.1258/0023677041958945.
- Pastoor F.J., van’t Klooster A.T., Beynen A.C. An alternative method for the quantitative collection of faeces and urine of cats as validated by the determination of mineral balance // Zeitschrift fur Versuchstierkunde. – 1990. – P. 259–263. PMID: 2082623.




