Апробация модели развития дегенеративных изменений межпозвонковых дисков у кроликов
Куксгауз И.А., Гущин Я.А., Мазукина Е.В., Кашкин В.А., Макаров В.Г. Апробация модели развития дегенеративных изменений межпозвонковых дисков у кроликов. Лабораторные животные для научных исследований. 2021; 1. https://doi.org/10.29296/2618723X-2021-01-03
Резюме
Цель данной работы – апробация модели формирования дегенеративных изменений в межпозвонковых дисках (МПД) у кроликов как возможной модели дегенеративной болезни диска у человека и разработка простого и воспроизводимого протокола. На сегодняшний день существует много моделей, начиная от in vitro и заканчивая in silico, которые могут быть информативны для исследования конкретных компонентов дегенерации МПД. Однако учитывая сложное строение МПД и отсутствие идеальной модели патологии, в экспериментах in vivo существует возможность более точного воспроизведения патогенеза заболевания. Моделирование патологии осуществляли при помощи пункции иглой диаметром 18G (1,27 мм) МПД на уровне поясничного отдела сегмента L5–L6. Успешность формирования патологии оценивали при помощи морфометрической, рентгенологической и гистологической оценки повреждений МПД на различных временных отрезках после индукции патологии. Проявление патологических изменений сопровождалось снижением высоты диска, подтвержденным морфометрией и рентгенологическим анализом. При гистологическом исследовании отмечено нарушение организации коллагеновых волокон, часть которых была разорвана или наблюдалось их разволокнение с отложением фибрина между ними. Также выявлено фиброзирование студенистого ядра, в некоторых случаях – его разрушение с формированием фиброзных «перегородок» и уплотнением межклеточного матрикса. Определена сопутствующая патология, которая характеризовалась кровоизлияниями как в окружающие ткани, так и непосредственно в ткани диска, а также формированием грыж, которые образовывались в различных направлениях. Таким образом, в условиях эксперимента был сформирован протокол моделирования и оценки выраженности процесса дегенерации МПД после пункции иглой. Дегенеративные изменения начинались уже через 6 нед после индукции патологии, имели максимальное развитие к 8-й неделе и отмечались вплоть до 22-й недели. Через 14 нед после индукции патологии выявлено наличие дегенеративный изменений в соседних неповрежденных дисках, что указывает на системный характер повреждения.
Введение
Дегенерация поясничного диска представляет собой сложный процесс, проявляющийся изменениями в клеточном, матричном, концевом отделах и нервно-сосудистых компонентах межпозвонкового диска (МПД). В связи с актуальностью проблемы дегенеративных изменений позвоночника в поясничном отделе человека разработано множество моделей на животных в целях дальнейшего понимания и лечения этого состояния [1–11].
Разработка соответствующих моделей заболеваний МПД на животных необходима и для понимания патофизиологии, а также использования и тестирования потенциальных лекарственных кандидатов и методов лечения. Тестирование в условиях in vitro и in silico может быть информативно для исследования конкретных компонентов дегенерации МПД. Однако, учитывая сложность, присущую МПД, в экспериментах in vivo удается более точно воспроизводить патогенез патологии.
Моделирование дегенерации МПД в настоящее время осуществляется на различных видах лабораторных животных, таких как нокаутные мыши по Col2α1 [1], крысы [10], кролики [12], собаки [13], овцы [11, 14], козы [15], свиньи [16] и приматы [2]. Каждый из перечисленных видов имеет свои преимущества в качестве объекта для моделирования дегенеративных изменений. Например, хвост мыши и крысы представляет собой легкодоступную модель дегенерации МПД в результате механического повреждения, асимметричного сжатия или введения протеолитических ферментов [17, 18]. Однако экстраполяция данных, полученных на хвостовом отделе позвоночного столба грызунов, на МПД поясничного отдела позвоночника человека ставится под сомнение некоторыми исследователями в связи с разными механическими нагрузками на диски, а также анатомическими различиями – из хвостовых позвонков только первые 2 или 3 имеют невральную дужку и хорошо развитые поперечные и остистые отростки [19]. Для воспроизведения давления вышележащего отдела позвоночника у грызунов используют бипедальную модель, когда проводится ампутация хвоста и передних лап, в результате чего животное вынуждено находиться большую часть времени в вертикальном положении [20, 21]. Однако с позиции биоэтики данный подход не является гуманным. Основное преимущество моделей дегенерации МПД на более крупных видах животных – больший размер МПД по сравнению с грызунами. Например, овцы и козы одни из немногих видов животных, которые также быстро теряют нотохордальные клетки из пульпозного ядра после рождения, как и человек [22]. В источниках литературы [6, 12, 23–27] наиболее часто встречаются модели дегенерации МПД на кроликах, основными преимуществами которых являются более высокая степень гомологии с МПД человека, наличие фасеточных суставов, паравертебральных мышц и связок по сравнению с хвостом грызунов, больший размер животного и МПД, а также рентабельность модели по сравнению с более крупными животными [22].
Дегенеративные изменения в позвоночнике делят на спонтанные и экспериментально индуцированные. Наиболее изучены в отношении спонтанной дегенерации МПД песчаные крысы [28], хондродистрофоидные собаки (имеющие породную предрасположенность) [29] и приматы [7]. Спонтанные модели дисковой болезни могут быть особенно полезны для создания моделей дегенерации диска, однако длительное и временами непредсказуемое течение спонтанной дегенерации часто ограничивает их использование в исследованиях потенциальных методов лечения [22].
Экспериментально индуцированные модели делят на воспроизведенные путем нарушения биомеханики или структурных компонентов позвоночного столба. Нарушение биомеханики получают, создавая нестабильность или компрессию (например, при помощи аппарата Илизарова [3]), а структурные – разрушая МПД, воздействуя на них или химически нарушая их трофику (введение протеолитических ферментов, индукторов апоптоза) [19].
Одним из самых распространенных методов формирования дегенеративных изменений МПД является повреждение структурных компонентов МПД (фиброзного кольца) острыми предметами [8, 12]. На сегодняшний день разработаны методики пункции диска иглой как с введением раствора (2,5 мкл 0,1М раствора фосфатного буфера в течение 30 с) [9], так и без него [12]. Диаметр иглы варьирует от 23G (0,65 мм) – 46% деформации по отношению к размеру до 16G (1,68 мм) – 100% деформации по отношению к размеру диска. При этом использование игл диаметром 16G и 18G обеспечивает наиболее предсказуемое, медленное и прогрессирующее сужение диска [12, 23, 27]. Развитие патологии, как правило, отмечается со 2-й недели после индукции и регистрируется до 28 нед. При этом пик дегенеративных изменений наблюдается спустя 8 нед после индукции патологии [8, 12]. В большинстве протоколов для обеспечения доступа к позвонкам используют лапаротомию [25], экстраперитонеальный доступ [30] или забрюшинный доступ [12], что сопровождается повышенной травматизацией. Описаны также модели дегенерации, вызванные чрескожным проколом МПД [27].
Таким образом, в связи с большим разнообразием методических подходов в каждой лаборатории возникает необходимость разработки собственных удобных и воспроизводимых протоколов. Принимая во внимание вышеизложенное, мы предположили, что наиболее оптимальной моделью формирования дегенеративных изменений МПД при проведении доклинических исследований в нашей лаборатории является прокол фиброзного кольца МПД кролика на уровне поясничного отдела иглой диаметром 18G [12]. Для снижения травматизации оперативный доступ осуществляли через рассеченную кожу в области поясничного отдела животного без последующего рассечения мышечного слоя.
Цель данной работы – апробация модели формирования дегенеративных изменений МПД у кроликов в условиях нашей лаборатории при помощи пункции иглой диаметром 18G на уровне поясничного отдела (L5–L6) с последующей морфометрической и гистологической оценкой повреждений на различных временных отрезках после прокола.
Материал и методы
Животные и условия их содержания
В экспериментах использовали самцов кроликов породы Новозеландские массой тела 2000–3500 г (n=30) (питомник КФХ «Нера», Россия). Животных содержали в индивидуальных клетках с решетчатым полом без подстила, с зоной для отдыха (сплошной пол), снабженных автоматической ниппельной системой поения, в стандартных условиях окружающей среды (фоторежим 12 ч свет/12 ч темнота, температура воздуха 18±3°С, влажность 50±20%) при свободном доступе к стандартному корму. Данная научно-исследовательская работа рассмотрена на биоэтической комиссии АО НПО «Дом Фармации», одобрена для проведения (№ БЭК 5.83/18-1), выполнена в соответствии с рекомендациями Директивы 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных. Все данные собраны и проанализированы двумя независимыми наблюдателями, которые не знали о групповой принадлежности животных. Это исследование соответствовало принципам «трех R» (reduction, refinement and replacement). Все усилия были направлены на минимизацию страданий животных и сокращение количества используемых животных.
Методика моделирования патологии
Анестезия
Для моделирования экспериментальной патологии использовали общую анестезию смесью препаратов Золетил 100 (Virbac Sante Animale, Франция) (2,6 мг/кг) и Ксилазин (Interchemie werken De Adelaar B.V, Нидерланды) (2,6 мг/кг) при их внутривенном введении.
Моделирование патологии
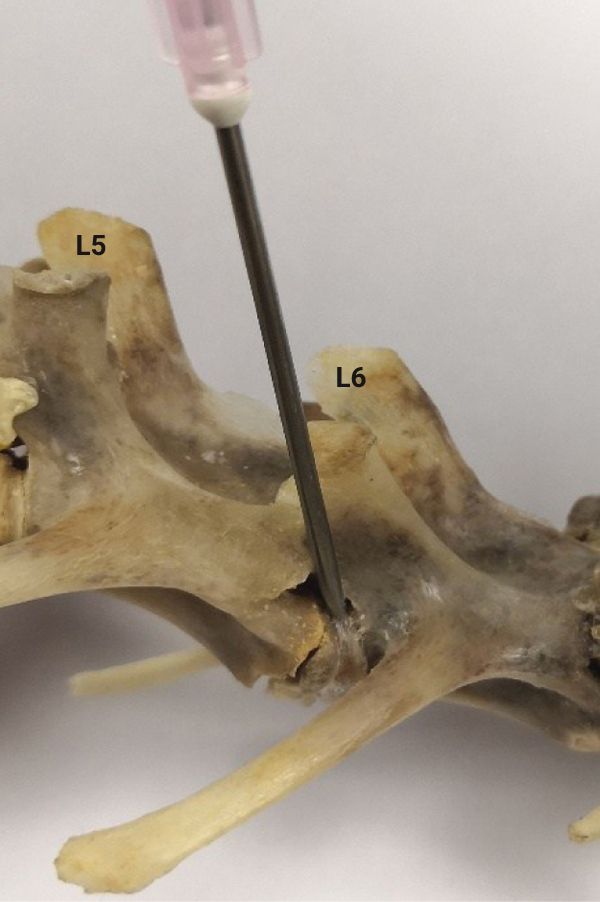
После введения животного в состояние хирургического наркоза в области поясничного отдела выбривали шерсть, операционную поверхность обрабатывали 5% спиртовым раствором йода. Кролика помещали в положение лежа на правом боку, после чего осуществляли продольный дорсальный разрез кожи (латеральнее позвоночного столба примерно на 1 см) для обеспечения доступа к сегментам L4–L7. Мышечный слой не рассекали. Методом пальпации идентифицировали остистые отростки поясничных позвонков L5 и L6. Иглу диаметром 18G (1,27 мм) вводили через мышечный слой, ориентируясь на краниальный суставной отросток, до фиброзного кольца (схема введения представлена на рис. 1). Затем осуществляли прокол фиброзного кольца на глубину примерно 5 мм. Далее иглу удаляли, кожу ушивали узловыми швами с использованием шовного материала (шелк Resorba 3-0, Германия), операционную рану обрабатывали антисептиком (Алюминиум Спрей, Pernix Pharma Kft, Венгрия). В группе ложнооперированных животных (n=3) осуществляли аналогичные манипуляции, за исключением прокола МПД.
Эвтаназию животных проводили через 1, 2, 4, 6, 8, 10, 12, 14, 22 нед после индукции патологии (n=3) путем внутривенной передозировки анестетика для общей анестезии (Золетил 100 и Ксилазин). После эвтаназии осуществляли забор материала для последующего анализа.
Морфометрическое исследование
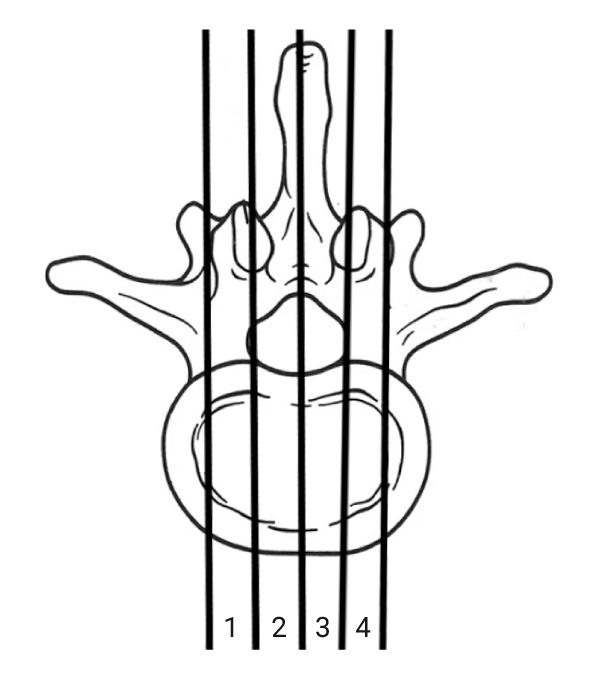
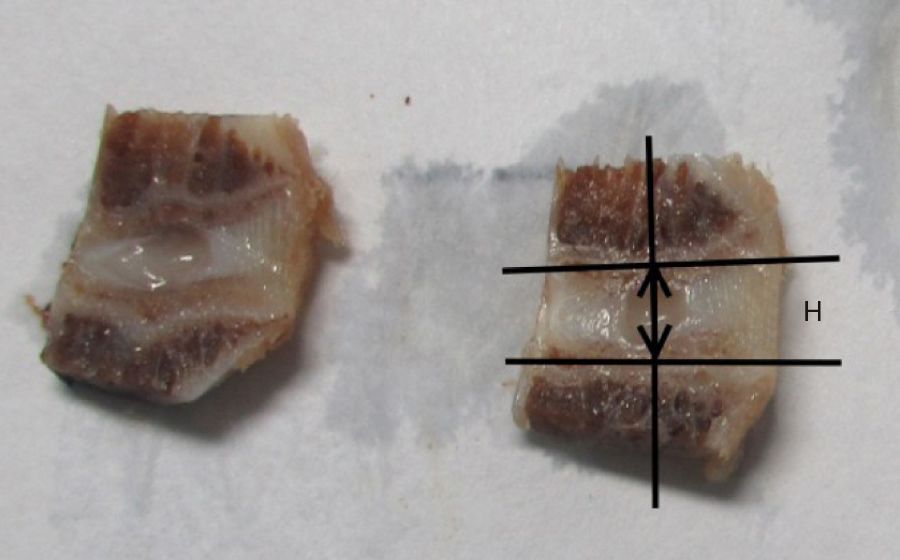
У всех животных были взяты образцы МПД L5–L6 с индуцированной патологией и два соседних диска на уровне L4–L5 и L6–L7 с прилежащими телами соседних позвонков. Для последующего исследования материал фиксировали в 10% растворе нейтрального формалина в течение 24 ч, после чего проводили декальцинацию материала в электролитном растворе на основе муравьиной и соляной кислот. Позвонки после декальцинации разрезали скальпелем в сагиттальной плоскости на 4 фрагмента (рис. 2), данные срезы фотографировали и измеряли высоту МПД (рис. 3) в программе «Видеотест-размер 5.0» (Россия).
Гистологическое исследование
Полученные срезы по общепринятой методике заливали в парафин, изготавливали гистологические срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином (ГЭ) и по методу Ван Гизона. Анализ гистологических препаратов осуществляли при помощи светооптического микроскопа Accu-Scope 3000 SERIES (США) при увеличении 40 и 100. Микрофотографирование проводили при помощи цифровой фотокамеры TOUPCAM UCMOS05100KPA (Китай) и программного обеспечения ToupView 3.7.7892 (Китай).
Рентгенологическое исследование
Рентгенологическое исследование выполнено прижизненно через 8 нед после индукции патологии на уровне поясничного отдела позвоночника с помощью рентгенологической установки (Orange – 1040HF; EcoRay Co., Ltd, Сеул, Южная Корея) с параметрами экспозиции 1,25 mAс и анодного напряжения 41 кB.
По результатам рентгенологического исследования проведен расчет расстояния между соседними позвонками поясничного отдела путем импорта изображений в программу ImageJ вер.1,52i (NIH, Bethesda, MD).
Статистический анализ данных
Обработку полученных данных проводили с помощью пакета статистических программ Statistica 10.0. (StatSoft, США). Парное сравнение выполняли с использованием t-теста в случае нормально распределенных данных и теста Манна–Уитни, если распределение данных не соответствовало критериям нормального распределения. Выпадающее значение выявлялось при помощи теста Граббса [31, 32]. Различия считали достоверными при р<0,05.
Результаты
Результаты морфологического анализа
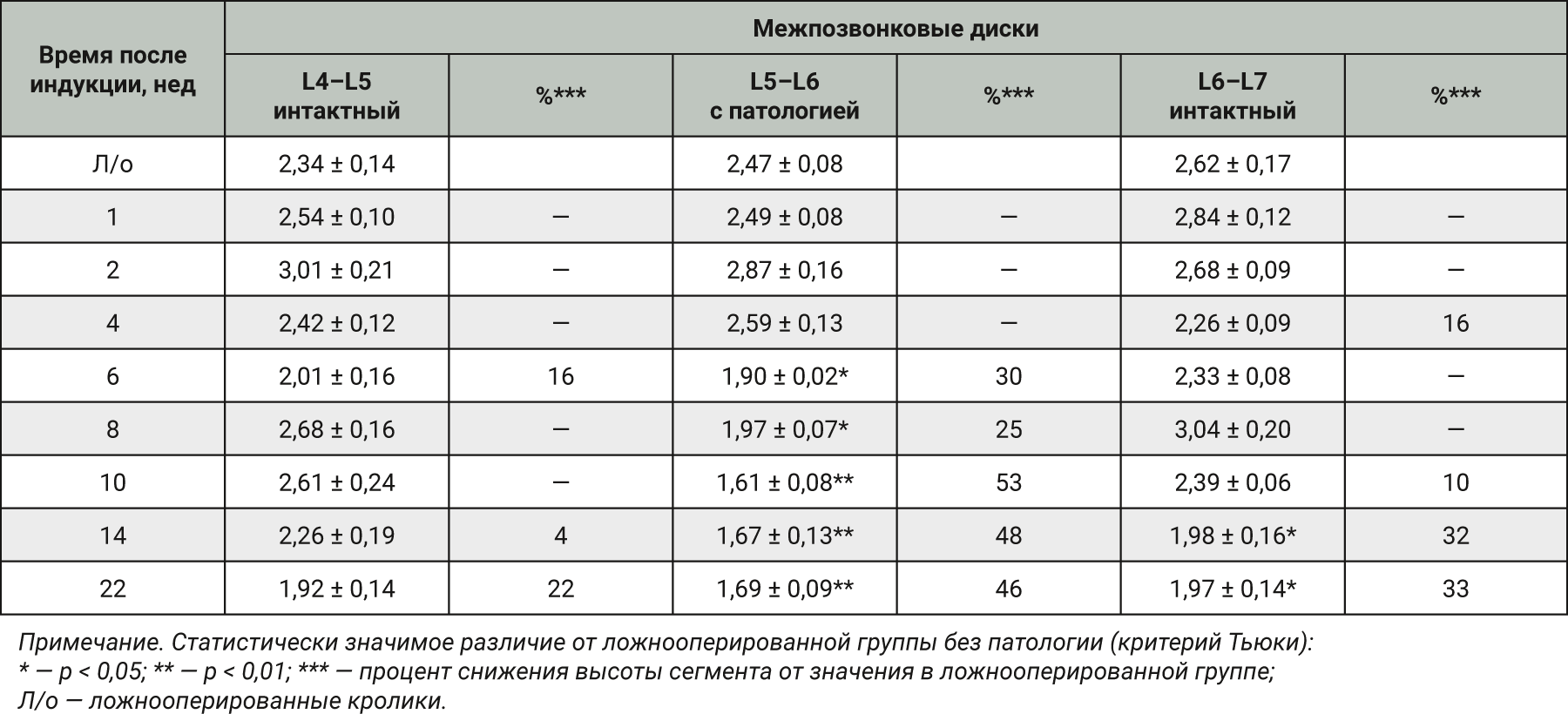
Дисперсионный анализ данных (ANOVA) выявил статистически значимое изменение высоты сегмента L5–L6 (p<0,001). Последующие межгрупповые сравнения подтвердили уменьшение высоты сегмента L5–L6 у экспериментальных животных по сравнению с высотой данного сегмента у ложнооперированных животных начиная с 6-й недели после индукции патологии (p<0,05, критерий Тьюки, табл. 1).
Результаты гистологического исследования
Индукция патологии (прокол иглой фиброзного кольца) осуществлялась на МПД (уровень L5–L6). Соседние диски уровня L4–L5 и L6–L7 оставались интактными. При гистологическом анализе установлено, что все интактные МПД и диски у кроликов ложнооперированной группы без индукции патологии имели правильное строение и состояли из пульпозного (студенистого) ядра, фиброзного кольца и замыкательной пластинки. Ядро было представлено в виде округлых клеток и окружающего их студенистого матрикса. Вокруг ядра располагалось фиброзное кольцо, состоящее из плотной соединительной ткани и коллагеновых волокон (рис. 4 и 5).
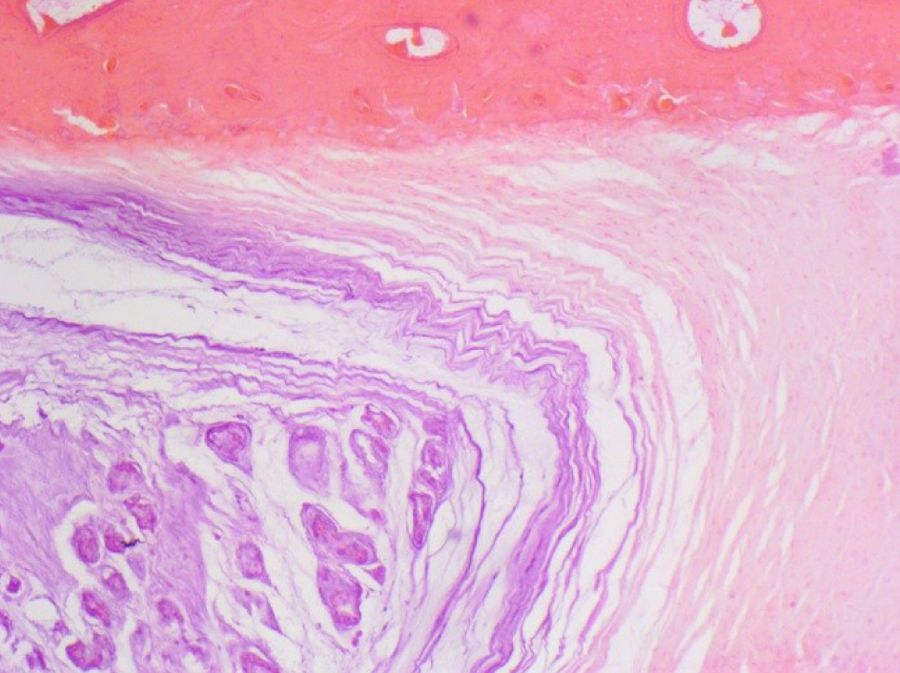
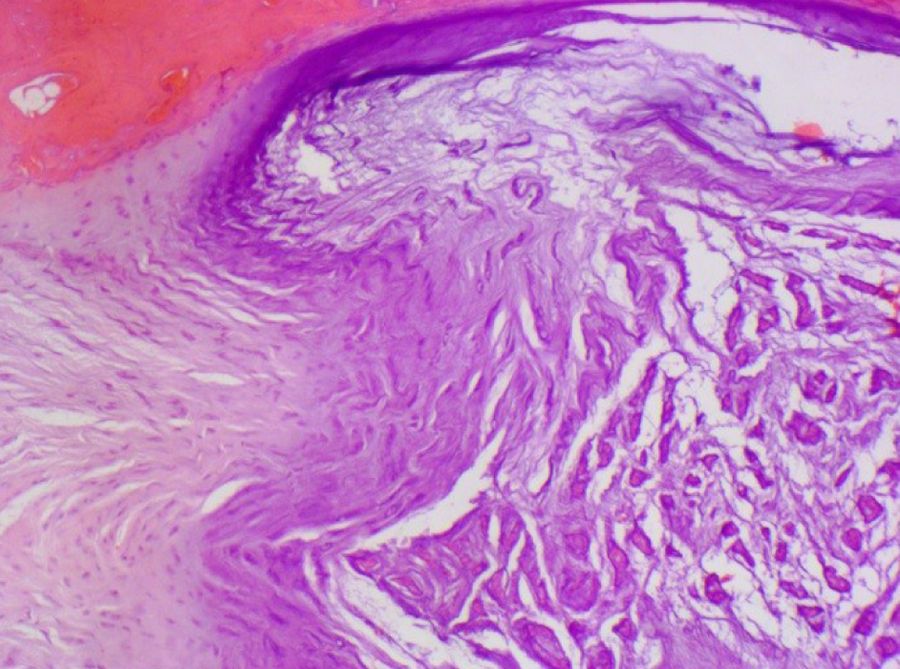
При анализе гистологических образцов дисков после пункции выявлены проявления дистрофии МПД различной степени выраженности. Легкое нарушение строения фиброзного кольца характеризовалось нарушением организации коллагеновых волокон, часть из них была разорвана, при этом граница между ядром и кольцом сохранена на большем протяжении (рис. 6). При умеренной степени поражения наблюдали участки с нарушением целостности границы (рис. 7) и явной дезорганизацией соединительнотканных волокон кольца, их фрагментацией и выраженной извитостью (рис. 8 и 9).
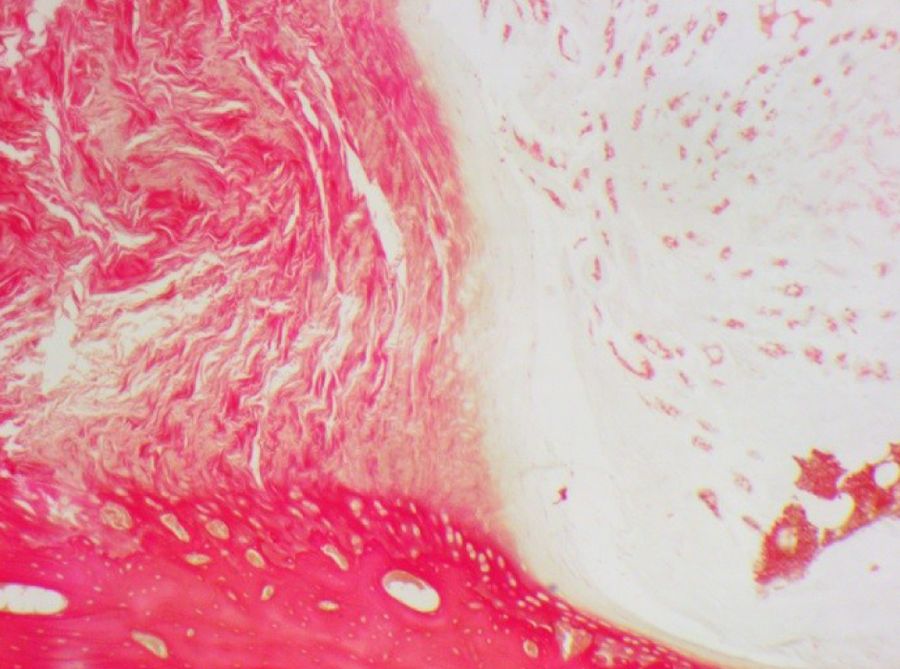
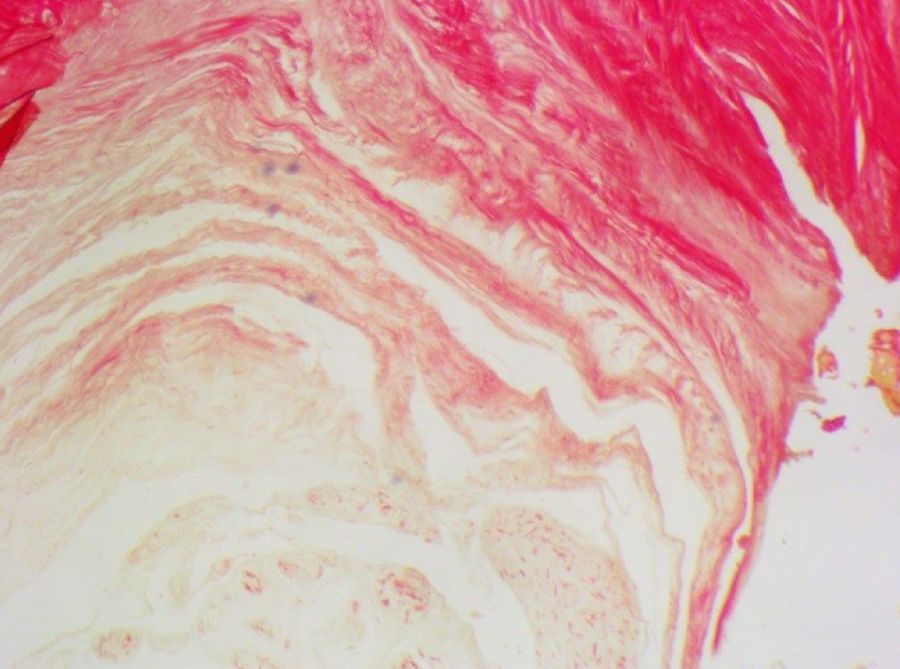
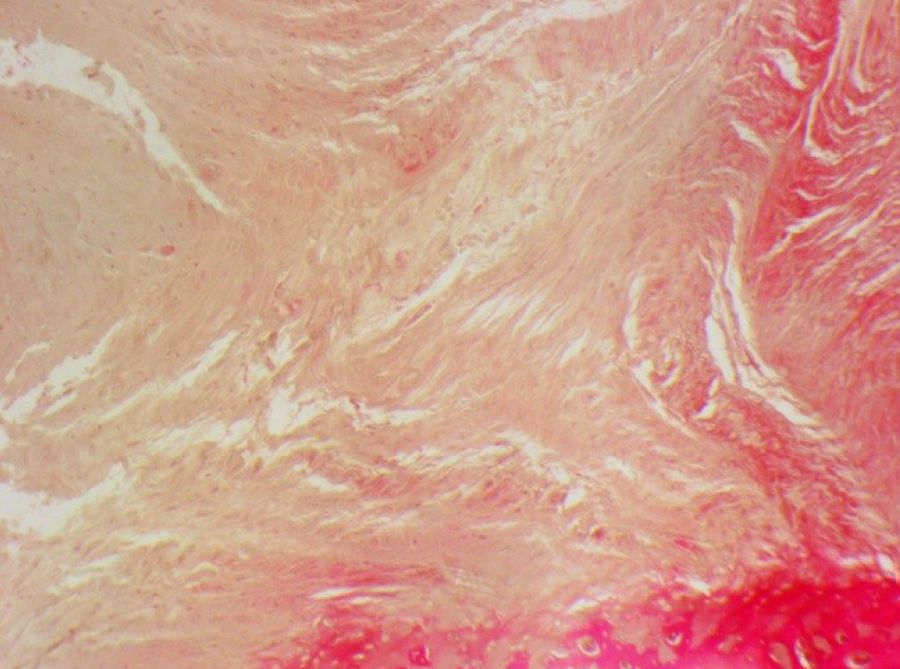
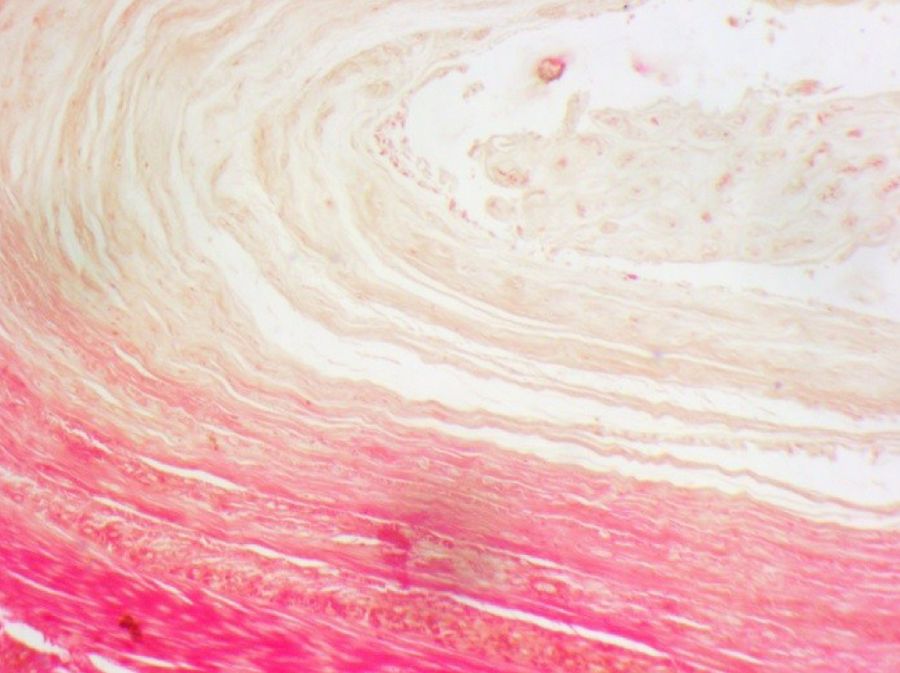
В более тяжелых случаях отмечали фиброз кольца с умеренной или выраженной дезорганизацией коллагеновых волокон, их разволокнением и отложением фибрина между ними. В патологический процесс вовлекалось студенистое ядро, в котором наблюдались процессы фиброзирования (рис. 10). В дальнейшем можно было обнаружить разрушение ядра с формированием фиброзных «перегородок», разделяющих его на части (рис. 11).


Кроме наблюдаемых патологических изменений в фиброзном кольце, выявлены сопутствующие патологии: кровоизлияния как в окружающие ткани, так и непосредственно в ткани диска, а также формирование грыж, которые образовывались как в боковых направлениях (рис. 12), так и в вертикальном – грыжа Шморля (см. рис. 12). Стоит отметить, что, начиная с 6-й недели, патологические изменения наблюдались и в соседнем (L6–L7) с пунктированным сегментом (рис. 13).


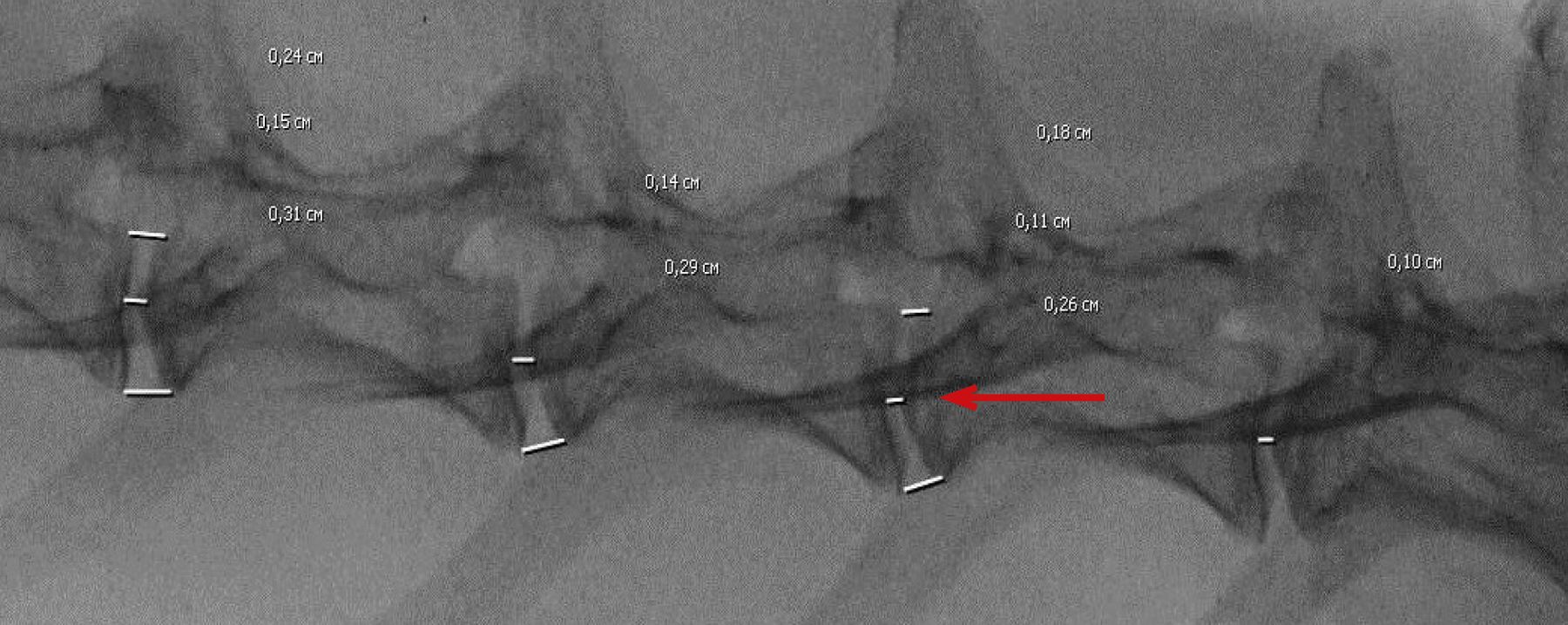
На рис. 14 представлена прижизненная рентгенограмма позвоночника кролика через 8 нед после индукции патологии. Расстояние между телами поясничных позвонков L5 и L6 уменьшено (0,11 см) по сравнению с интактными сегментами, что говорит об утончении МПД L5–L6 и подтверждает развитие патологии.
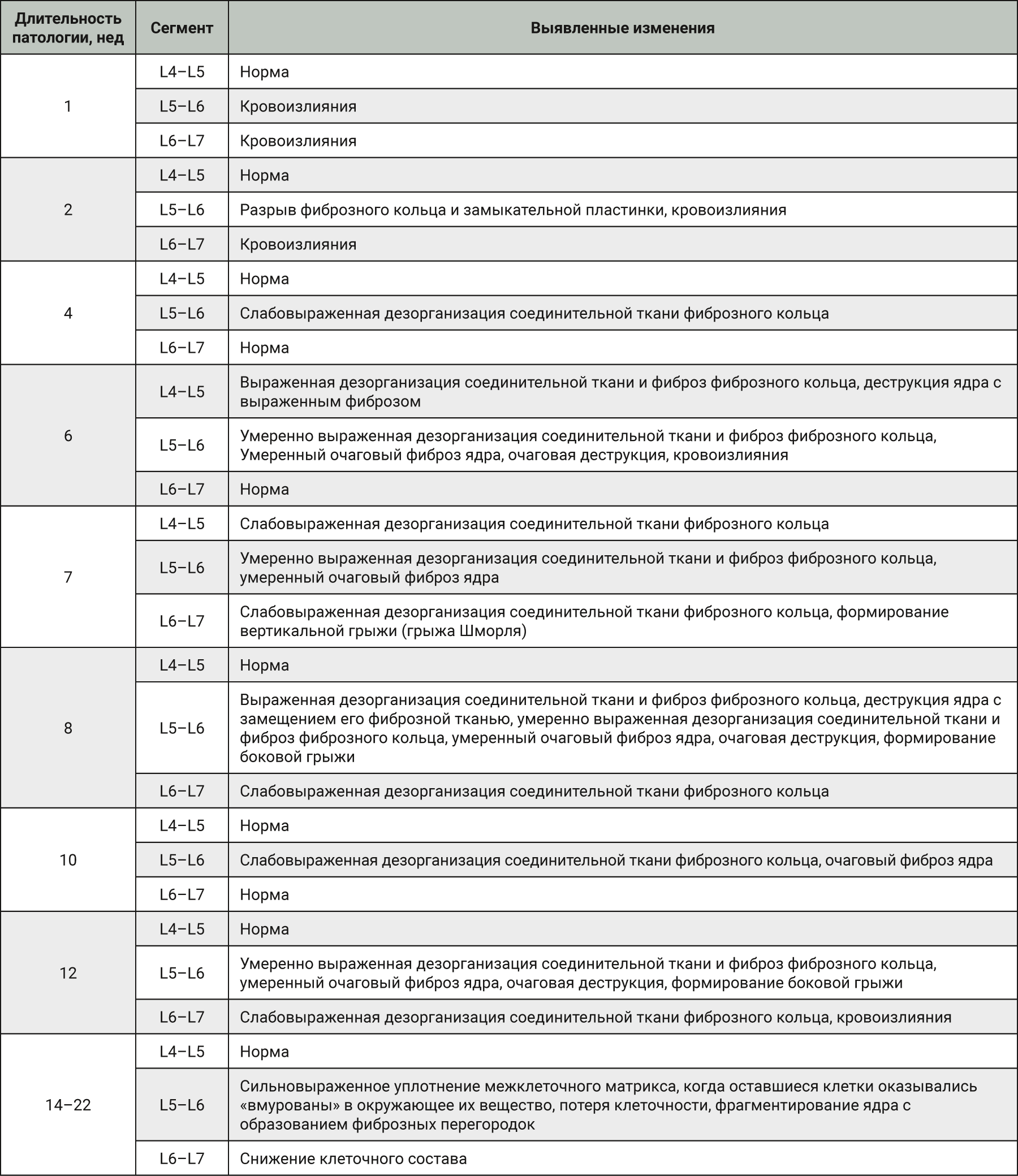
В табл. 2 представлена обобщающая информация по патологическим изменениям, которые наблюдались в ходе исследования. Через 1 и 2 нед после индукции патологии в МПД отмечали наличие кровоизлияний и разрывы фиброзного кольца. Подобные изменения на столь ранних сроках после моделирования указывают на последствия самой манипуляции и не являются отражением дегенеративных изменений.
Обсуждение результатов
Моделирование дегенеративных изменений выполняли при помощи прокола МПД на уровне позвонков L5–L6 иглой размером 18G (1,27 мм) на глубину около 5 мм от границы фиброзного кольца.
Дегенеративные нарушения, индуцированные проколом диска, оценивали при помощи морфометрического и гистологического анализа после плановой некропсии на различных временных отрезках после моделирования патологии. При морфометрическом исследовании измеряли высоту диска с индуцированной патологией и высоту соседних дисков без патологии на уровне L4–L5 и L6–L7 для оценки системного характера повреждений. Для проведения гистологического анализа срезы дисков окрашивали ГЭ и по методу Ван Гизона. Критериями оценки являлись состояние фиброзного кольца, границы между фиброзным кольцом и пульпозным ядром, клеточность и матрикс пульпозного ядра.
При морфометрическом анализе пораженного диска выявлено снижение его высоты по сравнению с МПД у ложнооперированных животных. Следует заметить, что, начиная с 14-й недели после индукции патологии, статистически значимое снижение высоты наблюдали и в соседних дисках (уровень L4–L5 и L6–L7), которые не прокалывали иглой. Данное наблюдение указывает на развитие генерализованного патологического процесса с вовлечением соседних интактных дисков, что свидетельствует об усугублении тяжести заболевания.
При анализе гистологических образцов дисков после пункции выявлены проявления дистрофии МПД различной степени выраженности. Легкое повреждение фиброзного кольца заключалось в нарушении организации коллагеновых волокон, часть из которых была разорвана. В более тяжелых случаях наблюдался фиброз кольца с умеренной или выраженной дезорганизацией коллагеновых волокон, их разволокнением и отложением фибрина между ними. В данном случае в патологический процесс вовлекалось студенистое ядро, в котором выявлялись процессы фиброзирования. В дальнейшем можно было обнаружить разрушение ядра и выраженное уплотнение межклеточного матрикса, потерю клеточности и фрагментирование ядра с образованием фиброзных «перегородок». В самом тяжелом проявлении патологии ткань МПД подвергалась значительному замещению фиброзной тканью с почти полным разрушением пульпозного ядра. Кроме того, наблюдалась и сопутствующая патология, характеризующаяся формированием грыж, которые образовывались как в боковых направлениях, так и в вертикальном (грыжа Шморля).
Через 22 нед после индукции патологии в МПД регистрировались сопоставимые признаки дегенерации, которые отмечались через 14 нед. При гистологическом анализе срезов дисков дегенеративно-дистрофические изменения характеризовались изменением строения фиброзного кольца, которое сопровождалось нарушением организации коллагеновых волокон, повреждением границы пульпозного ядра с явной дезорганизацией соединительнотканных волокон кольца, а также наличием признаков фиброза с выраженным нарушением границ между структурами диска.
Таким образом, гистологическое исследование подтвердило формирование и прогрессирование дегенеративно-дистрофических изменений в МПД на уровне L5–L6 после прокола иглой диаметром 18G (1,27 мм). Дегенеративные изменения отмечались уже через 6 нед после индукции патологии, а максимальное развитие получали к 8-й неделе.
Для более полной оценки успешности моделирования патологии, помимо рентгеноскопии и гистологических исследований, используют магнитно-резонансную томографию [12, 24–26], биохимические исследования [33], методы ПЦР-диагностики и Вестерн-блотт-анализ [30]. Однако далеко не каждая лаборатория располагает такими возможностями. Как было показано в данной статье, рентгеноскопия и гистологические исследования дают достаточно полную картину развития дегенеративных изменений МПД.
На основании результатов, полученных в нашей лаборатории, для моделирования дегенеративных изменений в МПД на уровне сегмента L5–L6 можно рекомендовать использовать иглу 18G (1,27 мм). Примененный способ введения иглы через мышечный слой, по нашему мнению, является наиболее приемлемым в связи со снижением повреждения мягких тканей, связанного с рассечением мышц для получения доступа к МПД, и коротким послеоперационным восстановительным периодом. Тестирование лекарственных кандидатов (хондропротекторов) на данной модели следует начинать с 8-й недели после индукции патологии. Для оценки динамики изменений высоты МПД после прокола рекомендуется проводить рентгенологическое исследование до индукции патологии, через 6–8 нед после и далее в зависимости от предполагаемой длительности применения тестируемого кандидата в клинической практике.
Таким образом, в условиях лаборатории был апробирован малотравматичный способ формирования дегенерации межпозвонковых дисков с последующей патоморфологической оценкой развития патологии.
Вклад авторов
Куксгауз И.А. – участие в выполнении эксперимента, написание текста, анализ данных литературы;
Гущин Я.А. – выполнение патоморфологического исследования;
Мазукина Е.В. – участие в выполнении эксперимента;
Кашкин В.А. – идея, анализ данных литературы, редактирование текста, анализ и интерпретация результатов работы;
Макаров В.Г. – редактирование текста, утверждение окончательного варианта статьи для публикации.
Список источников
- Sahlman J., Inkinen R., Hirvonen T., Lammi M. J., Lammi P. E., Nieminen J., Lapveteläinen T., Prockop D. J., Arita M., Li S. W., Hyttinen M. M., Helminen H. J., Puustjärvi K. Premature vertebral endplate ossification and mild disc degeneration in mice after inactivation of one allele belonging to the Col2a1 gene for Type II collagen // Spine (Phila Pa 1976). ‒ 2001. ‒ V. 26, No 23. ‒ P. 2558-65.
- Platenberg R. C., Hubbard G. B., Ehler W. J., Hixson C. J. Spontaneous disc degeneration in the baboon model: magnetic resonance imaging and histopathologic correlation // J Med Primatol. ‒ 2001. ‒ V. 30, No 5. ‒ P. 268-72.
- Iatridis J. C., Mente P. L., Stokes I. A., Aronsson D. D., Alini M. Compression-induced changes in intervertebral disc properties in a rat tail model // Spine (Phila Pa 1976). ‒ 1999. ‒ V. 24, No 10. ‒ P. 996-1002.
- Ching C.T., Chow D. H., Yao F.Y., Holmes A.D. The effect of cyclic compression on the mechanical properties of the inter-vertebral disc: an in vivo study in a rat tail model // Clin Biomech (Bristol, Avon). ‒ 2003. ‒ V. 18, No 3. ‒ P. 182-9.
- Rousseau M. A., Ulrich J. A., Bass E. C., Rodriguez A. G., Liu J. J., Lotz J. C. Stab incision for inducing intervertebral disc degeneration in the rat // Spine (Phila Pa 1976). ‒ 2007. ‒ V. 32, No 1. ‒ P. 17-24.
- Phillips F.M., Reuben J., Wetzel F.T. Intervertebral disc degeneration adjacent to a lumbar fusion. An experimental rabbit model // J Bone Joint Surg Br. ‒ 2002. ‒ V. 84, No 2. ‒ P. 289-94.
- Nuckley D. J., Kramer P. A., Del Rosario A., Fabro N., Baran S., Ching R. P. Intervertebral disc degeneration in a naturally occurring primate model: radiographic and biomechanical evidence // J Orthop Res. ‒ 2008. ‒ V. 26, No 9. ‒ P. 1283-8.
- Aoki Y., Akeda K., An H., Muehleman C., Takahashi K., Moriya H., Masuda K. Nerve fiber ingrowth into scar tissue formed following nucleus pulposus extrusion in the rabbit anular-puncture disc degeneration model: effects of depth of puncture // Spine (Phila Pa 1976). ‒ 2006. ‒ V. 31, No 21. ‒ P. E774-80.
- Yerramalli C. S., Chou A. I., Miller G. J., Nicoll S. B., Chin K. R., Elliott D. M. The effect of nucleus pulposus crosslinking and glycosaminoglycan degradation on disc mechanical function // Biomech Model Mechanobiol. ‒ 2007. ‒ V. 6, No 1-2. ‒ P. 13-20.
- Jeong J. H., Lee J. H., Jin E. S., Min J. K., Jeon S. R., Choi K. H. Regeneration of intervertebral discs in a rat disc degeneration model by implanted adipose-tissue-derived stromal cells // Acta Neurochir (Wien). ‒ 2010. ‒ V. 152, No 10. ‒ P. 1771-7
- Oehme D., Ghosh P., Shimmon S., Wu J., McDonald C., Troupis J. M., Goldschlager T., Rosenfeld J. V., Jenkin G. Mesenchymal progenitor cells combined with pentosan polysulfate mediating disc regeneration at the time of microdiscectomy: a preliminary study in an ovine model // J Neurosurg Spine. ‒ 2014. ‒ V. 20, No 6. ‒ P. 657-69.
- Masuda K., Aota Y., Muehleman C., Imai Y., Okuma M., Thonar E. J., Andersson G. B., An H. S. A novel rabbit model of mild, reproducible disc degeneration by an anulus needle puncture: correlation between the degree of disc injury and radiological and histological appearances of disc degeneration // Spine (Phila Pa 1976). ‒ 2005. ‒ V. 30, No 1. ‒ P. 5-14.
- Bergknut N., Rutges J. P., Kranenburg H. J., Smolders L. A., Hagman R., Smidt H. J., Lagerstedt A. S., Penning L. C., Voorhout G., Hazewinkel H. A., Grinwis G. C., Creemers L. B., Meij B. P., Dhert W. J. The dog as an animal model for intervertebral disc degeneration? // Spine (Phila Pa 1976). ‒ 2012. ‒ V. 37, No 5. ‒ P. 351-8.
- Vadalà G., Russo F., Pattappa G., Peroglio M., Stadelmann V. A., Roughley P., Grad S., Alini M., Denaro V. A Nucleotomy Model with Intact Annulus Fibrosus to Test Intervertebral Disc Regeneration Strategies // Tissue Eng Part C Methods. ‒ 2015. ‒ V. 21, No 11. ‒ P. 1117-24.
- Y. Zhang, S. Drapeau, H. S. An, D. Markova, B. A. Lenart, D. G. Anderson. Histological features of the degenerating intervertebral disc in a goat disc-injury model // Spine (Phila Pa 1976). ‒ 2011. ‒ V. 36, No 19. ‒ P. 1519–1527.
- Acosta F. L., Jr., Metz L., Adkisson H. D., Liu J., Carruthers-Liebenberg E., Milliman C., Maloney M., Lotz J. C. Porcine intervertebral disc repair using allogeneic juvenile articular chondrocytes or mesenchymal stem cells // Tissue Eng Part A. ‒ 2011. ‒ V. 17, No 23-24. ‒ P. 3045-55.
- J. P. Norcross, G. E. Lester, P. Weinhold, L. E. Dahners. An in vivo model of degenerative disc disease // Journal of Orthopaedic Research. ‒ 2003. ‒ V. 21, No 1. ‒ P. 183-188.
- C.Court, O. K.Colliou, J.R.Chin, E. Liebenberg, D. S. Bradford, J.C. Lotz. The effect of static in vivo bending on themurine intervertebral disc // Spine Journal. ‒ 2001. ‒ V. 1, No 4. ‒ P. 239–245.
- С. В. Малышкина, Н. В. Дедух, А. А. Левшин, С. Б. Костерин. Моделирование дегенерации межпозвонкового диска в эксперименте на животных (обзор литературы) // Ортопедия, травматология и протезирование. ‒ 2015. ‒ T. 1. ‒ C. 114-124.
- Cassidy J. D., Yong-Hing K., Kirkaldy-Willis W. H., Wilkinson A. A. A study of the effects of bipedism and upright posture on the lumbosacral spine and paravertebral muscles of the Wistar rat // Spine (Phila Pa 1976). ‒ 1988. ‒ V. 13, No 3. ‒ P. 301-8.
- Higuchi M., Abe K., Kaneda K. Changes in the nucleus pulposus of the intervertebral disc in bipedal mice. A light and electron microscopic study // Clin Orthop Relat Res. ‒ 1983. No 175. ‒ P. 251-7.
- Daly C., Ghosh P., Jenkin G., Oehme D., Goldschlager T. A Review of Animal Models of Intervertebral Disc Degeneration: Pathophysiology, Regeneration, and Translation to the Clinic // Biomed Res Int. ‒ 2016. ‒ V. 2016. ‒ P. 5952165.
- Ashinsky B. G., Gullbrand S. E., Bonnevie E. D., Mandalapu S. A., Wang C., Elliott D. M., Han L., Mauck R. L., Smith H. E. Multiscale and multimodal structure-function analysis of intervertebral disc degeneration in a rabbit model // Osteoarthritis Cartilage. ‒ 2019. ‒ V. 27, No 12. ‒ P. 1860-1869.
- Xin L., Zhang C., Zhong F., Fan S., Wang W., Wang Z. Minimal invasive annulotomy for induction of disc degeneration and implantation of poly (lactic-co-glycolic acid) (PLGA) plugs for annular repair in a rabbit model // Eur J Med Res. ‒ 2016. ‒ V. 21. ‒ P. 7.
- Шехтер А.Б., Басков В.А., Захаркина О.Л., Гуллер А.Е., Борщенко И.А., Колышев И.Ю., Капанадзе Г.Д., Басков А.В., Соболь Э.Н. Моделирование дегенеративных изменений межпозвонковых дисков (остеохондроза) у кроликов: макроскопическое и гистологическое изучение // БИОМЕДИЦИНА. ‒ 2009. ‒ T. 1, № 2. ‒ C. 41-69.
- Kong M. H., Do D. H., Miyazaki M., Wei F., Yoon S. H., Wang J. C. Rabbit Model for in vivo Study of Intervertebral Disc Degeneration and Regeneration // J Korean Neurosurg Soc. ‒ 2008. ‒ V. 44, No 5. ‒ P. 327-33.
- Kwon Y. J. Resveratrol has anabolic effects on disc degeneration in a rabbit model // J Korean Med Sci. ‒ 2013. ‒ V. 28, No 6. ‒ P. 939-45.
- Silberberg R. Histologic and morphometric observations on vertebral bone of aging sand rats // Spine (Phila Pa 1976). ‒ 1988. ‒ V. 13, No 2. ‒ P. 202-8.
- Bergknut N., Auriemma E., Wijsman S., Voorhout G., Hagman R., Lagerstedt A. S., Hazewinkel H. A., Meij B. P. Evaluation of intervertebral disk degeneration in chondrodystrophic and nonchondrodystrophic dogs by use of Pfirrmann grading of images obtained with low-field magnetic resonance imaging // Am J Vet Res. ‒ 2011. ‒ V. 72, No 7. ‒ P. 893-8.
- Ren S., Liu Y., Ma J., Liu Y., Diao Z., Yang D., Zhang X., Xi Y., Hu Y. Treatment of rabbit intervertebral disc degeneration with co-transfection by adeno-associated virus-mediated SOX9 and osteogenic protein-1 double genes in vivo // Int J Mol Med. ‒ 2013. ‒ V. 32, No 5. ‒ P. 1063-8.
- Grubbs F. E. Procedures for Detecting Outlying Observations in Samples // Technometrics. ‒ 1969. ‒ V. 11, No 1. ‒ P. 1-21.
- Ord K. Outliers in statistical data // International Journal of Forecasting. ‒ 1996. ‒ V. 12, No 1. ‒ P. 175-176.
- Mwale F., Masuda K., Grant M. P., Epure L. M., Kato K., Miyazaki S., Cheng K., Yamada J., Bae W. C., Muehleman C., Roughley P. J., Antoniou J. Short Link N promotes disc repair in a rabbit model of disc degeneration // Arthritis Research & Therapy. ‒ 2018. ‒ V. 20, No 1. ‒ P. 201.




