Аллергия на лабораторных грызунов: недооцененная проблема
Васютина М.Л., Бреднева О.Г. , Иванов С.А. , Салминьш Д.А. , Галагудза М.М. Аллергия на лабораторных грызунов: недооцененная проблема. Лабораторные животные для научных исследований. 2019; 4. https://doi.org/10.29296/2618723X-2019-04-01
Резюме
В настоящем обзоре раскрыта проблема аллергизации научного и обслуживающего персонала при работе с лабораторными грызунами, дается краткая характеристика основных аллергенов лабораторных грызунов, рассмотрены механизмы и клинические проявления аллергии на лабораторных животных. Обозначены способы предотвращения профессиональной аллергии и основные пути минимизации отягчающих факторов: контроль производственной среды, административные мероприятия, применение принципов надлежащей работы с животными, использование средств индивидуальной защиты, своевременное выявление и диагностика заболевания. Сделан акцент на необходимости более глубокого изучения и детальной оценки данного вопроса, в том числе на законодательном уровне.
Распространенность аллергии на лабораторных животных и динамика
Аллергия на лабораторных животных (АЛЖ) представляет собой важную разновидность профессионально обусловленной аллергии. В США с аллергенами лабораторных грызунов ежегодно контактируют 90 тыс. человек, занятых в научных исследованиях и их обеспечении [1]. В Великобритании АЛЖ находится на 5-м месте по встречаемости среди всех видов профессионально обусловленной аллергии [2]. При этом в отечественной литературе вопросы, связанные с АЛЖ, практически не освещены.
Согласно некоторым данным [3], 15% лиц, контактирующих с аллергенами лабораторных животных, имеют специфические IgE, а у 10% развивается клинически манифестная форма аллергии. При сочетании методов анкетирования и выявления аллерген-специфических IgE показано, что у 17% из 100 работников вивариев отмечены как симптомы аллергии, так и признаки сенсибилизации, у 25% имелись клинические симптомы, но отсутствовали специфические антитела, у 1% имелись аллерген-специфические антитела при отсутствии симптомов, а 57% не выявлено ни симптомов аллергии, ни специфических IgE [4]. Риск зависит от аллергенной нагрузки, хотя зависимость может иметь не прямо пропорциональный характер, так как известны случаи уменьшения выраженности сенсибилизации и клинических проявлений даже при воздействии высоких доз аллергенов [5].
По данным некоторых исследований, ведущим фактором, определяющим интенсивность иммунного ответа на аллергены грызунов, является вариабельность аллергенной нагрузки во времени [6]. Есть немодифицируемые факторы риска, связанные с организмом человека, в частности, наличие атопии в анамнезе и HLA-DR7 генотип.
Характеристика аллергенов животного происхождения
Наиболее важные аллергены лабораторных животных относятся к семейству липокалинов. Их основные представители: Musm 1 (мыши), Ratn 1 (крысы), Cavp 1 (морские свинки), Phos 21 (хомяки), Oryc 1 (кролики). Все эти аллергены, как правило, выделение с мочой, за исключением Ratn 1, который выделяется преимущественно со слюной. В то же время у мышей и морских свинок со слюной аллергены фактически не выделяются [7].
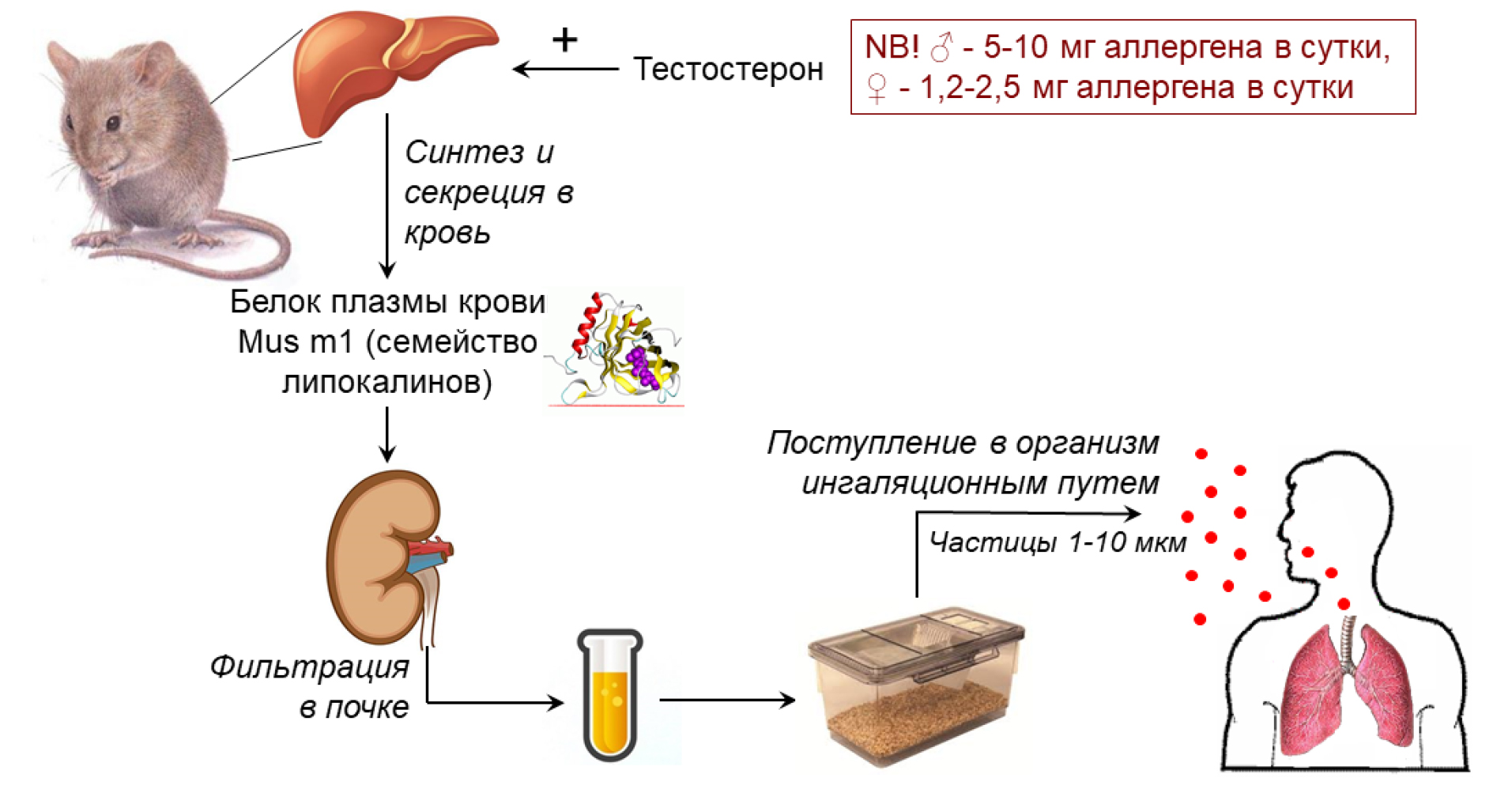
Мышиный Musm 1 и крысиный Ratn 1 имеют 64% гомологию аминокислотной последовательности [8]. Именно такая высокая степень гомологии играет ключевую роль в развитии перекрестной реактивности к аллергенам грызунов другого вида даже при отсутствии предшествующего контакта с ними [9]. У мышей липокалины в норме синтезируются гепатоцитами и секретируются в кровь (рис. 1). Наиболее высок риск у работников, контактирующих с самцами мышей, поскольку интенсивность синтеза липокалинов в печени животных усиливается тестостероном. Взрослые самцы мышей выделяют 5–10 мг аллергенного белка с мочой в день, тогда как самки – в 4 раза меньше. Определенное количество липокалинов содержится также в слущенном эпидермисе и в слюне грызунов. Часть белка подвергается фильтрации в почках и попадает в мочу, после чего сорбируется на подстилочном материале [9].
Аллергены лабораторных грызунов попадают в организм человека ингаляционным путем, связываясь с пылевыми частицами диаметром от 1 до 10 мкм [10]. Значительную и малоизученную проблему представляет собой перенос аллергенов животного происхождения работниками из производственных помещений в домашнюю среду. Так, например, у работающих с лабораторными животными, были обнаружены значительно более высокие уровни аллергенов в материале домашних подушек и матрасов, чем у людей других профессий [11].
Механизмы развития аллергии на лабораторных животных
Большинство клинических форм АЛЖ относятся к аллергическим реакциям анафилактического типа. Реакции анафилактического типа представляют собой гиперчувствительность немедленного типа, при которой клинические проявления развиваются, в среднем, спустя десятки минут после вторичного контакта с аллергеном. В отечественной литературе принято выделять 3 стадии патогенеза аллергии.
В ходе 1-й стадии, называемой иммунологической (или стадией сенсибилизации), происходит первичное поступление аллергена в организм человека ингаляционным путем, его распознавание антиген-презентирующими клетками и представление наивным Т-клеткам в составе белков главного комплекса гистосовместимости II класса (ГКГС II). В результате активации Т-клеточного рецептора и в присутствии интерлейкина-4 происходит дифференцировка наивных Т-клеток в Т-хелперы 2 типа. Последние посредством секреции интерлейкинов-4 и -13, а также взаимодействия связанного с Т-клеточным рецептором антигенного эпитопа с ГКГС II на поверхности В-лимфоцитов стимулируют превращение последних в плазмоциты, синтезирующие значительные количества иммуноглобулинов E (IgE), специфически распознающих данный антиген (аллерген) [12]. E.J. Krop и соавт. [13] показали положительную корреляцию между уровнем интерлейкина-4 и титром аллерген-специфических IgE у лиц с сенсибилизацией к аллергенам крысы. IgE обладают способностью к «заякориванию» в мембране тучных клеток и базофилов крови за счет взаимодействия Fc-фрагмента с FcεRI рецепторами. Еще один класс антител, который отвечает за формирование сенсибилизации к аллергенам лабораторных грызунов, это IgG4 [14].
Патохимическая (2-я) стадия запускается при повторном попадании в организм аллергена и его связывании с Fab-фрагментами, фиксированных на тучных клетках IgE. Возникающие при этом конформационные изменения Fc-фрагмента активируют FcεRI рецепторы, что запускает 3 типа реакций в тучных клетках:
- происходит активация сократительного аппарата, приводящая к высвобождению содержимого гранул тучных клеток, содержащих медиаторы аллергии;
- возникает активация фосфолипазы А2, обеспечивающей образование арахидоновой кислоты из мембранных фосфолипидов с последующим превращением арахидоновой кислоты в простагландины и лейкотриены;
- стимулируется экспрессия генов, кодирующих провоспалительные цитокины.
Таким образом, происходит генерация широкого спектра химических медиаторов анафилактических реакций, включающих биогенные амины, производные арахидоновой кислоты, факторы хемотаксиса, протеолитические ферменты, цитокины и хемокины. Наступает 3-я стадия – патофизиологическая или стадия клинических проявлений; – связанная с реализацией действия основных медиаторов анафилактических реакций на соответствующие рецепторы. Важнейшие эффекты действия медиаторов: вазодилатация, повышение проницаемости микрососудов, бронхоспазм, гиперсекреция желез, появление зуда, боли, жжения.
Клинические формы аллергии на лабораторных животных
Аллергические реакции анафилактического типа проявляются в виде таких заболеваний, как аллергический ринит, аллергические конъюнктивит и атопическая бронхиальная астма. Аллергический ринит проявляется в виде периодически возникающих приступов чихания, сопровождающихся резким усилением секреции и обильными выделениями из носа. При аллергическом конъюнктивите после контакта с животными развивается покраснение конъюнктивы, сопровождающееся зудом, болью и жжением, а также усиленным слезотечением. Атопическая бронхиальная астма сопровождается развитием приступов экспираторной одышки, приводящих в тяжелых случаях к альвеолярной гиповентиляции, артериальной гипоксемии и газовому ацидозу. При продолжении контакта с аллергенами грызунов у сенсибилизированных лиц выявляется прогрессирующее нарушение функции внешнего дыхания. Так, объем форсированного выдоха за 1-ю секунду и форсированная жизненная емкость легких снижаются со скоростью 83 и 148 мл/год соответственно [15].
Наиболее грозным клиническим проявлением АЛЖ является анафилактический шок, который связан с генерализованной дегрануляцией тучных клеток и значительным повышением концентрации медиаторов аллергии в крови, что приводит к выраженным гемодинамическим и респираторным расстройствам [16, 17]. Из 198 организаций в США, располагающих вивариями для содержания грызунов, в 15 в период с 2001 по 2016 гг. был отмечен хотя бы один случай анафилактического шока [15]. Вероятность развития анафилактического шока выше после укусов персонала лабораторными грызунами. Хотя наличие атопической астмы или других проявлений аллергии на животных – фактор риска развития анафилактического шока, но в некоторых случаях его развитие после укуса животным являлось первым проявлением АЛЖ.
Способы профилактики аллергии на лабораторных животных
G.M. Stave [18] выделяет 4 подхода к предотвращению АЛЖ:
- контроль производственной среды;
- административные мероприятия;
- надлежащие принципы работы с животными;
- применение средств индивидуальной защиты.
Контроль производственной среды включает различные проектные, инженерно-технические и технологические решения, направленные на снижение содержания аллергенов в воздухе рабочей зоны. Существуют нормативы по допустимому содержанию аллергенов животного происхождения в воздухе рабочей зоны. В странах Евросоюза этот уровень составляет <5 нг/м3 [19]. Так как аллергены связаны с взвешенными в воздухе механическими частицами, существует зависимость аллергенной нагрузки от количества взвешенных частиц. Последнее, в свою очередь, зависит от множества факторов, включая кратность воздухообмена, количество содержащихся животных и оборудования в помещении, тщательность его уборки, наличие/отсутствие труднодоступных мест для уборки (например, радиаторы отопления, шкафы без ножек, напольные отбойники, наклеенные таблички), эффективность и качество ежедневной/еженедельной уборки помещений содержания животных и др.
Существенное снижение аллергенной нагрузки на персонал достигается при использовании местных вытяжек над зонами содержания и использования животных. Особенно важно применение местных вытяжек при подготовке животного к операции, когда производится бритье операционного поля с удалением шерсти, и при очистке клеток от загрязненного подстила. В последнем случае рекомендуется применять специальные станции сбора использованного подстила, в которых с помощью потока очищенного воздуха создается надежный барьер между оператором и аллергенами. Аналогичный принцип лежит в основе действия станций замены клеток, которые размещаются в комнатах содержания животных. Они представляют собой боксы с вертикальным ламинарным потоком, а также защитным барьерным потоком воздуха. Станции сконструированы для защиты животных, операторов и окружающей среды от потенциального риска загрязнения при выполнении процедур замены клетки, а также для других манипуляций, проводимых в рабочей зоне, за счет физической изоляции, удержания и контролируемого удаления из рабочей зоны патогенных биологических агентов и микроорганизмов, а также частиц пыли и аллергенов. Принцип работы станции заключается в том, что воздушный поток из внешней среды перемещается вокруг оператора в переднюю решетку бокса, исключая выход частиц и аллергенов за пределы рабочей зоны, что обеспечивает защиту персонала. Поток воздуха в таких станциях достигает примерно 0,5 м/с и называется «барьерным». Кроме того, обеспечивается и нисходящий ламинарный поток воздуха скоростью> 0,35 м/с; при этом HEPA-фильтр обеспечивает эффективность фильтрации воздуха до 99,995% (в зависимости от модели станции) для размера частиц до 0,06 мкм. Для сравнения, минимальный размер аллергенов составляет не более 0,1 мкм (при минимальном диаметре пылевой частицы 1 мкм), что минимизирует вероятность перекрестного загрязнения вдоль рабочей поверхности бокса.
Защите персонала от аллергенов способствует применение клеток с фильтрами в конвенциональных колониях, а также лабораторных и аутопсийных столов с перфорацией и нижней вытяжкой.
Одним из основных технологических достижений в области содержания лабораторных грызунов в последние 50 лет стали индивидуально вентилируемые клетки (ИВК). ИВК были впервые разработаны в Джексоновской лаборатории (США) и стали серийно производиться с начала 1980-х годов. Преимущества ИВК по сравнению с открытыми клетками включают:
- более высокую плотность посадки животных;
- лучшую степень стандартизации влажности и содержания СО2 и NH3 в клетках;
- меньший уровень затрат энергии;
- снижение смертности новорожденных грызунов.
Важнейшее дополнительное преимущество ИВК заключается в уменьшении содержания аллергенов в воздухе рабочей зоны. Показано, что уровень аэроаллергенов в воздухе помещений содержания животных в 7–250 раз ниже в зонах использования ИВК по сравнению с зонами открытого содержания [20, 21]. К сожалению, в литературе нет данных о встречаемости АЛЖ у работников организаций, использующих ИВК, в сравнении с другими системами содержания, хотя эти данные очень востребованы. Само по себе наличие ИВК не гарантирует снижения аллергенной нагрузки на персонал, если не соблюдаются надлежащие практики их эксплуатации и обслуживания. Например, процедура замены загрязненных фильтров, находящихся в вытяжной системе ИВК, может сопровождаться резким увеличением содержания аллергенов в воздухе [22]. При использовании открытых клеток для содержания грызунов также применяются технические решения, направленные на уменьшение поступления аэроаллергенов в воздух производственных помещений, например, ряды стеллажей с клетками отделяются от основного помещения вертикально ориентированными поликарбонатными ламелями [23].
Поскольку одна из наиболее аллергизирующих процедур – очистка клеток от загрязненного подстила, целесообразно в крупных питомниках применять роботические системы для очистки и мойки клеток. Учитывая эффект накопления аллергенов, содержащихся в моче грызунов, в подстиле, большое значение имеет исходное качество подстилочного материала, в частности гигроскопичность, и применение технологии обеспыливания в производстве. Таким образом, подстилочному материалу для содержания лабораторных грызунов уделяется большое внимание, чему посвящены соответствующие исследования [24]. Следует отметить, что само по себе наличие большого количества пыли в подстилочном материале является фактором риска для развития аллергических реакций, как у персонала, так и у животных.
Для мониторинга уровня аллергенов в производственной среде предложены недорогие надежные методы, в частности метод латерального проточного иммуноанализа образцов, полученных при протирании рабочих поверхностей [25]. Необходим также периодический контроль взвешенных частиц в воздухе рабочей зоны, в том числе в помещениях содержания животных и помещениях стерилизационных блоков.
Административные мероприятия. Эффективных в плане профилактики АЛЖ административным решением является минимизация количества лабораторных животных, используемых в эксперименте. Данный вопрос находится в компетенции комиссии по биоэтике, которая должна проверять обоснование количества животных, представленное руководителем исследования, на этапе рассмотрения и утверждения протокола-заявки на выполнение исследования. Существенное значение имеет организация администрацией испытательного центра обучения и тренинга персонала, в рамках которых отдельные темы должны быть посвящены вопросам профилактики АЛЖ, надлежащего применения средств индивидуальной защиты, важности соблюдения гигиенических процедур. К административным мерам контроля традиционно относят запретительные регламентирующие действия, а именно ограничение доступа в комнаты содержания животных, ограничение перемещения животных за пределы зон их содержания. Следует больше внимания уделять правилам обращения с одноразовой и многоразовой технологической одеждой, которая использовалась при работе с лабораторными животными. Поскольку на своей поверхности она содержит значительное количество аллергенов, в ней строго запрещается перемещаться за пределами вивария, а после ее снятия необходимо ее изолировать до момента стирки или утилизации, например, путем помещения в герметизированные пластиковые пакеты.
Принципы надлежащей работы с животными включают такие практики, как уменьшение плотности размещения животных, в частности за счет уменьшения скученности в манипуляционных, операционных и других зонах; смачивание шерсти либо использование вакуумного отсоса с HEPA-фильтрацией при бритье операционного поля; дизайн экспериментов, минимизирующий процедуры хэндлинга животных. Простые и надежные подходы также включают мытье рук и качественную влажную уборку помещений, где использовались животные.
Средства индивидуальной защиты. Обеспечение персонала, работающего с лабораторными животными, надлежащими средствами индивидуальной защиты (СИЗ), является требованием Руководства по содержанию и использованию животных [NRC, 2011]. Стандартный набор технологической одежды должен включать рабочую одежду (обязательно с длинным рукавом), перчатки, шапочку и бахилы. Отдельного обсуждения заслуживают СИЗ дыхательной системы. Необходимо отметить, что стандартная хирургическая маска не обеспечивает плотного прилегания и изоляции дыхательной системы от частиц, содержащих аллергены. Кроме того, хирургические маски характеризуются очень вариабельной эффективностью фильтрации воздуха. Так, например, исследование фильтрующей эффективности 42 типов хирургических масок показало ее вариабельность в пределах от 13 до 98% [26]. Тем не менее, использование хирургической маски при первом контакте с животными, существенно снижает вероятность сенсибилизации [27]. Для эффективной защиты от аллергенов животного происхождения необходимо использовать респираторы, полностью закрывающие рот и нос (рис. 2, а). Р2 респиратор значительно уменьшает количество вдыхаемых аллергенов на 90% [28]. Шлема-респиратор с встроенной активной системой фильтрации рекомендован для работников, уже сенсибилизированных к аллергенам ЛЖ и имеющим различную выраженность аллергии (см. рис. 2, б) [29].

Перед использованием респираторов персонал должен пройти специальное обучение технике надевания респиратора. Кроме того, при первой выдаче работнику респиратора, а также ежегодно после этого следует проводить так называемый качественный тест прилегания респиратора. Для этой цели используется набор (fittest), состоящий из колпака с воротником, двух распылителей, раствора для теста на чувствительность и раствора для теста на прилегание (см. рис. 2, в). Смысл процедуры заключается в распылении тестового агента, обладающего горьким или сладким вкусом, под колпак при надетом респираторе. Во время проведения оценки чувствительности испытуемый дышит через приоткрытый рот со слегка вытянутым языком. Если испытуемый не чувствует вкуса после определенного числа ингаляций, значит имеет место достаточное прилегание респиратора к лицу. Качественный тест прилегания отвечает требованиям Управления производственной безопасности и охраны здоровья (OSHA, США) и подходит для тестирования прилегания всех типов респираторов. Процесс гармонизации российских стандартов по средствам индивидуальной защиты органов дыхания с западными стандартами длится уже более 10 лет, но до сих пор не разработаны нормативные документы, которые позволяли бы определить, какие СИЗ способны обеспечить надежную защиту при известных условиях работы и как организовать их правильное применение. Имеющиеся рекомендации в основном несовершенны и не являются обязательными для выполнения. Несмотря на очевидные данные о необходимости использования респираторов для защиты от аллергенов, существует значительная вариабельность применения их в разных организациях [30].
Медицинские осмотры и опросы, диагностика
Среди мероприятий, направленных на предотвращение АЛЖ, особое место занимает медицинское наблюдение за лицами, относящимися к группе риска. При приеме на работу рекомендуется проведение анкетирования, беседы со специалистом и выполнение спирометрии [31]. Если на данном этапе становится очевидно, что соискатель имеет повышенный риск развития АЛЖ, целесообразно провести оценку уровня аллерген-специфических IgE в сыворотке крови. В процессе работы медицинское наблюдение должно включать регулярное заполнение анкеты, содержащей вопросы относительно симптомов со стороны дыхательной системы, глаз, носоглотки, кожных покровов. В первые годы работы сотрудника анкетирование должно проводиться чаще. В случае выявления на основе анкет новых симптомов, подозрительных на АЛЖ, либо ухудшения течения существующих заболеваний, требуется незамедлительная консультация специалиста и обследование. Лица, перенесшие анафилактический шок в результате контакта с лабораторными животными, должны переводиться на другие виды работ, исключающие возможность укуса животными.
Диагностика АЛЖ осуществляется с помощью кожных аллергических проб или метода белковых аллергочипов ImmunoCAP, а также радиоаллергосорбентного теста (РАСТ) с целью выявления специфических IgE в сыворотке крови. В некоторых исследованиях предпринимаются попытки комплексного подхода к оценке выраженности АЛЖ, включающего анкетирование, выполнение кожных аллергических проб, спирометрию, анализ оксида азота в выдыхаемом воздухе и определение уровня перекиси водорода в конденсате выдыхаемого воздуха, а также микрочиповый анализ IgE в сыворотке [31]. Повторная оценка уровня оксида азота в выдыхаемом воздухе может быть полезным биомаркером интенсивности аллергического воспаления дыхательных путей, сопровождающегося эозинофильной инфильтрацией [7, 32].
Заключение
Изучение проблемы аллергии на лабораторных грызунов очень важно для охраны труда научных работников и вспомогательного персонала, обеспечивающего содержание животных. Необходимы также дальнейшие исследования, включающие оценку взаимосвязи между степенью экспозиции и исходом, определение минимального порога экспозиции для возникновения клинических проявлений аллергии, разработку методов ранней диагностики и скрининга, выявление индивидуальной предрасположенности с возможностью персонализированного подхода к профилактике.
Список источников
- Newill CA, Evans R, Khoury MJ. Preemployment screening for allergy to laboratory animals: epidemiologic evaluation of its potential usefulness. J. Occup. Med. 1986; 28:1158–64.
- Meredith S.K., McDonald J.C. Work-related respiratory disease in the United Kingdom, 1989–1992: report on the SWORD project. Occup Med (Lond). 1994; 44 (4): 183–9
- Jeal H.L., Jones M.G., Cullinan P.C. Epidemiology of laboratory animal allergy. In: Sigsgaard T, Heederik D, editors. Occupational Asthma (Progress in Inflammation Research). Basel: Birkhäuser Verlag AG; 2010.
- D'Ovidio M.C., Wirz A., Zennaro D., Massari S., Melis P., Peri V.M., Rafaiani C., Riviello M.C., Mari A. Biological occupational allergy: Protein microarray for the study of laboratory animal allergy (LAA). AIMS Public Health. 2018; 5 (4): 352–65
- Jeal H., Draper A., Harris J., et al. Modified Th2 responses at high-dose exposures to allergen: using an occupational model. Am J Respir Crit Care Med 2006; 174: 21–25.
- Peng R.D., Paigen B., Eggleston P.A., et al. Both the variability and level of mouse allergen exposure influence the phenotype of the immune response in workers at a mouse facility. J Allergy Clin Immunol 2011; 128: 390–6.
- Jones M. Laboratory Animal Allergy in the Modern Era. Curr Allergy Asthma Rep. 2015 Dec; 15 (12): 73.
- Virtanen T., Kinnunen T., Rytkönen-Nissinen M. Mammalian lipocalin allergens-insights into their enigmatic allergenicity. Clin Exp Allergy. 2012; 42 (4): 494–504.
- Jeal H., Harris J., Draper A., Taylor A.N., Cullinan P., Jones M. Dual sensitization to rat and mouse urinary allergens reflects cross-reactive molecules rather than atopy. Allergy. 2009; 64 (6): 855–61.
- Ohman J.L. Jr, Hagberg K., MacDonald M.R., et al. Distribution of airborne mouse allergen in a major mouse breeding facility. J Allergy Clin Immunol 1994; 94: 810–7.
- Krop E.J., Doekes G., Stone M.J., Aalberse R.C., van der Zee J.S. Spreading of occupational allergens: laboratory animal allergens on hair-covering caps and in mattress dust of laboratory animal workers. Occup Environ Med. 2007; 64 (4): 267–72.
- Ramadani F., Bowen H., Upton N., Hobson P.S., Chan Y.C., Chen J.B., Chang T.W., McDonnell J.M., Sutton B.J., Fear D.J., Gould H.J. Ontogeny of human IgE-expressing B cells and plasma cells. Allergy. 2017 Jan; 72 (1): 66–76.
- Krop E.J.M., van de Pol M.A., Lutter R., Heederik D.J.J., Aalberse R.C., van der Zee J.S.. Dynamics in cytokine responses during the development of occupational sensitization to rats. Allergy 2010; 65: 1227–33.
- Portengen L., de Meer G., Doekes G., Heederik D. Immunoglobulin G4 antibodies to rat urinary allergens, sensitization and symptomatic allergy in laboratory animal workers. Clin Exp Allergy. 2004; 34 (8): 1243–50.
- Portengen L., Hollander A., Doekes G., de Meer G., Heederik D. Lung function decline in laboratory animal workers: the role of sensitisation and exposure. Occup Environ Med. 2003; 60 (11): 870–5.
- Stave G.M., Lee E.H., Darcey D.J. Laboratory animal bite anaphylaxis: a national survey: part 1: case series and review of the literature. J Occup Environ Med. 2017; 59 (8): 728–38.
- Stave G.M., Lee E.H., Darcey D.J.. Laboratory animal bite anaphylaxis: a national survey: part 2: treatment protocols. J Occup Environ Med. 2017; 59 (8): 739–41.
- Stave G.M. Occupational Animal Allergy. Curr. Allergy Asthma Rep. 2018; 18 (2): 11.
- Gordon S., Preece R.. Prevention of laboratory animal allergy. Occup Med (Lond). 2003; 53 (6): 371–7.
- Gordon S., Fisher S.W., Raymond R.H. Elimination of mouse allergens in the working environment: assessment of individually ventilated cage systems and ventilated cabinets in the containment of mouse allergens. J Allergy Clin. Immunol. 2001; 108 (2): 288–94.
- Renstrom A., Bjoring G., Hoglund A.U. Evaluation of individually ventilated cage systems for laboratory rodents: occupational health aspects. Lab Anim. 2001; 35 (1): 42–50.
- Thulin H., Bjorkdahl M., Karlsson A.S., Renstrom A. Reduction of exposure to laboratory animal allergens in a research laboratory. Ann Occup Hyg. 2002; 46 (1): 61–8.
- Krohn T.C., Itter G., Fosse R., Hansen A.K.. Controlling allergens in animal rooms by using curtains. J Am Assoc Lab Anim Sci. 2006 May; 45 (3): 51–3.
- Kaliste E., Linnainmaa M., MeklinT., Torvinen E., NevalainenA. The bedding of laboratory animals as a source of airborne contaminants. Laboratory Animals Ltd. Laboratory Animals (2004) 38, 25–37
- Koets M., Renström A., Zahradnik E., Bogdanovic J., Wouters I.M., van Amerongen A. Rapid one-step assays for on-site monitoring of mouse and rat urinary allergens. J Environ Monit. 2011; 13 (12): 3475–80.
- Heinsohn P.A., Jacobs R.R., Concoby B.A, eds. 1995. Biosafety Reference Manual. 2nd ed. Fairfax VA: American Industrial Hygiene Association.
- Jones M., Schofield S., Jeal H., Cullinan P. Respiratory protective equipment reduces occurrence of sensitization to laboratory animals. Occup Med (Lond). 7
- Renström A., Karlsson A.S., Tovey E. Nasal air sampling used for the assessment of occupational allergen exposure and the efficacy of respiratory protection. Clin Exp Allergy. 2002; 32: 1769–75.
- Slovak A.J., Orr R.G., Teasdale E.L. Efficacy of the helmet respirator in occupational asthma due to laboratory animal allergy (LAA). Am Ind Hyg Assoc J. 1985; 46: 411–5.
- Stave G.M., Darcey D.J.. Prevention of laboratory animal allergy in the United States: a national survey. J Occup Environ Med. 2012; 54: 558–63.
- Nicholson P.J., Mayho G.V., Roomes D., Swann A.B., Blackburn B.S. Health surveillance of workers exposed to laboratory animal allergens. Occup Med (Lond). 2010; 60 (8): 591–7.
- Tafuro F., Selis L., Goldoni M., Stendardo M., Mozzoni P., Ridolo E., Boschetto P., Corradi M. Biomarkers of respiratory allergy in laboratory animal care workers: an observational study. Int Arch Occup Environ Health. 2018; 91 (6): 735–44.
- Hewitt R.S., Smith A.D., Cowan J.O., Schofield J.C., Herbison G.P., Taylor D.R. Serial exhaled nitric oxide measurements in the assessment of laboratory animal allergy. J Asthma. 2008; 45 (2): 101–7.




