Влияние этомерзола фумарата на антиоксидантную систему и перекисное окисление липидов эритроцитов крыс при отравлении ацетатом ртути
Работа выполнена без спонсорской поддержки.
Щепеткова К.М., Кашуро В.А., Шустов Е.Б., Батоцыренова Е.Г., Красникова Е.Н. Влияние этомерзола фумарата на антиоксидантную систему и перекисное окисление липидов эритроцитов крыс при отравлении ацетатом ртути. Лабораторные животные для научных исследований. 2022; 4. https://doi.org/10.57034/2618723X-2022-04-04
Резюме
Ртуть относится к числу наиболее опасных тяжелых металлов и представляет серьезную угрозу для здоровья человека. Даже в низких концентрациях ртуть способна повреждать функции многих органов и тканей. Связываясь с SH-группами ферментов, ртуть оказывает ингибирующее действие на их активность, что приводит к избыточному накоплению активных форм кислорода и развитию оксидативного стресса. Окислительно-восстановительный баланс в живом организме поддерживается многоуровневой антиоксидантной системой. Эритроциты защищены от действия активных метаболитов кислорода при помощи различных биологических механизмов, включая воздействие низкомолекулярных антиоксидантов и ферментов. Снижение антиоксидантной способности эритроцитов может повлиять на системную антиоксидантную защиту всего организма. Выяснение механизмов формирования поражений при субхроническом воздействии ртути и ее соединений и фармакологическая коррекция таких нарушений остаются важной проблемой современной медицины.
Цель настоящего исследования — изучение влияния фумаровой соли этомерзола на процессы перекисного окисления липидов, параметры антиоксидантной системы эритроцитов крыс при субхроническом низкодозовом воздействии водного раствора ацетата ртути. Субхроническое отравление моделировали путем ежедневного однократного введения водного раствора ацетата ртути в дозе 4 мг/кг крысам линии Вистар, включенным в контрольную и опытную группы. Через 30 дней введения ацетата ртути животных опытной группы делили на 2 подгруппы. В одной подгруппе проводили фармакологическую коррекцию, используя внутрижелудочное введение водного раствора фумаровой соли этомерзола в дозе 12,5 мг/кг в течение 14 дней. Другая подгруппа в те же сроки получала дистиллированную воду. Результаты исследования показали, что введение препарата привело к снижению концентрации диеновых конъюгатов и малонового диальдегида в гемолизате эритроцитов опытной группы крыс. Введение этомерзола фумарата животным опытной группы способствовало снижению активности супероксиддисмутазы, глутатионпероксидазы и глюкозо-6‑фосфатдегидрогеназы, а также увеличению активности глутатионтрансферазы.
Установлено, что фумаровая соль этомерзола оказывает антиоксидантное действие после субхронического отравления ацетатом ртути.
Введение
Высокая биологическая активность ртути и ее способность к биоаккумуляции представляет опасность для живых организмов даже в небольших количествах. Токсичность ртути обусловлена ее высокой аффинностью к тиолсодержащим белкам различной молекулярной массы. Связываясь с SH-группами ферментов, ртуть оказывает ингибирующее действие на их активность [1], что приводит к избыточному накоплению активных форм кислорода и развитию оксидативного стресса [2]. Окислительно-восстановительный баланс в живом организме поддерживается многоуровневой антиоксидантной системой (АОС). Эритроциты обладают мощной антиоксидантной защитой, которая состоит из ферментативных и неферментативных путей. Снижение антиоксидантной способности эритроцитов может повлиять на системную антиоксидантную защиту всего организма. С другой стороны, показано, что изменение показателей АОС в эритроцитах коррелирует с таковыми в тканях внутренних органов и может использоваться для лабораторной диагностики их поражения [3]. В связи с этим эритроциты являются универсальной моделью для изучения состояния АОС при токсических воздействиях и их фармакологической коррекции [4, 5].
В настоящее время подходы для фармакологической коррекции АОС основаны на использовании препаратов, способствующих утилизации активных форм кислорода, а также оказывающих антигипоксантное действие для поддержания энергией процессов обезвреживания продуктов перекисного окисления липидов (ПОЛ) [4, 6]. Одним из таких представителей является фумаровая соль этоксиэтилтиобензимидазола (этомерзола фумарат). В экспериментальных исследованиях установлено повышение физической работоспособности мышей-самцов как при гемической гипоксии, так и гипертермии [7]. Данные об антиоксидантных свойствах фумарата этомерзола при токсических нагрузках отсутствуют.
Цель настоящей работы — изучение влияния фумаровой соли этомерзола на показатели антиоксидантной системы и перекисного окисления липидов эритроцитов крыс при субхроническом низкодозовом воздействии ацетата ртути.
Материал и методы
Исследование выполнено на 30 половозрелых самцах крыс Вистар в возрасте 2 мес, массой 160–200 г, полученных из питомника «Рапполово» (Россия). Животных содержали на базе «Испытательного центра доклинических исследований» ФГБУ НКЦТ им. С.Н. Голикова ФМБА России в соответствии с международными требованиями [8]. Лабораторные животные находились в условиях карантина в течение 14 дней. В помещениях вивария поддерживалась температура воздуха 20–25 °С и относительная влажность 50–65% при световом режиме: 12 ч — день; 12 ч — ночь. Перед началом исследования животные были распределены на 3 группы с помощью метода рандомизации [9]. Животные 1‑й группы (контрольная) получали ежедневно внутрижелудочно 1 мл дистиллированной воды в течение всего срока исследования; 2‑й группе 30 дней вводили внутрижелудочно ацетат ртути (ч.д.а., 0,08% водный раствор) в дозе 4 мг/кг, а затем в течение 14 дней — дистиллированную воду в объеме 1 мл; 3‑я группа получала ацетат ртути в течение 30 дней в той же дозе, а затем 14 дней препарат фармакологической коррекции. Субхроническое отравление обусловлено длительным поступлением малых, субтоксичных доз отравляющего агента. Согласно паспорту токсичности ацетата ртути, полулетальная доза при внутрижелудочном пути введения для лабораторных крыс составляет 40,9 мг/кг, поэтому низкотоксичная доза для введения животным контрольной и опытной групп — 4 мг/кг. Таким образом, внутрижелудочное введение 0,08% водного раствора ацетата ртути (ч.д.а., Ленреактив, Россия) животным 2‑й (контрольной) и 3‑й (опытной) групп в дозе 0,1 ЛД50 (среднелетальная доза) в течение 30 дней позволило смоделировать субхроническое отравление. За весь период введения токсиканта каждое животное контрольной и опытной групп получило суммарно 120 мг/кг ацетата ртути, что соответствует 18 мг/кг ртути. Для фармакологической коррекции субхронического отравления ацетатом ртути была использована фумаровая соль этоксиэтилтиобензимидазола (этомерзола фумарат, ч.д.а.), синтезированная на кафедре органической химии Санкт-Петербургского государственного химико-фармацевтического университета. Животным 3‑й группы терапию проводили, используя 0,25% водный раствор этомерзола фумарата внутрижелудочно однократно в дозе 12,5 мг/кг в течение 14 дней.
В течение всего эксперимента животных содержали в клетках по 10 особей при свободном доступе к корму и питьевой воде. Протокол исследования был одобрен локальным этическим комитетом ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России (№ 03/03 от 20.10.21).
На 44‑е сутки лабораторных животных подвергали наиболее распространенному и гуманному методу умерщвления — эвтаназии в СО2‑камере с последующей декапитацией. Процедура была выполнена согласно международным требованиям [10] и стандартным операционным процедурам, принятым в «Испытательном центре доклинических исследований» ФГБУ НКЦТ им. С.Н. Голикова ФМБА России [11], под контролем ветеринарного врача испытательного центра. Забор крови для биохимических исследований проводили в пластиковые гепаринизированные пробирки (Vacuette, Австрия). Для получения гемолизата эритроцитов кровь отстаивали 30 мин при температуре 4 °С, а затем центрифугировали при 3000 об/мин в течение 10 мин. После отделения плазмы эритроцитарную взвесь 3‑кратно отмывали холодным физиологическим раствором из расчета 1:2, а затем центрифугировали при 3000 об/мин в течение 10 мин. Гемолиз эритроцитов осуществляли, добавляя эритроцитарную взвесь в 5 мМ трис-HCl-буфер с pH 7,6 в соотношении 1:9.
В полученном гемолизате эритроцитов определяли показатели АОС и ПОЛ. Концентрацию восстановленного глутатиона (ВГ), малонового диальдегида (МДА), диеновых конъюгатов (ДК), активность глутатион-S-трансферазы (ГТ) определяли на спектрофотометре UV-2400 фирмы Shimadzu. Концентрацию гемоглобина, активность ферментов глюкозо-6‑фосфатдегидрогеназы (Г-6‑ФДГ), супероксиддисмутазы (СОД), глутатионпероксидазы (ГП) определяли на биохимическом анализаторе «А-25» (BioSystems S.A., Испания). Для определения активности ферментов АОС (СОД, ГП, Г-6‑ФДГ) использовали наборы фирмы Randox (Великобритания). Концентрацию исследуемых субстратов и активность ферментов в гемолизате пересчитывали на 1 г гемоглобина, уровень которого определяли с помощью набора фирмы BioSystems S.A. (Испания).
Статистическую обработку результатов проводили с использованием программного обеспечения Statistica 6.0. Вычисляли среднее значение и ошибку среднего (М±m), оценку достоверности различий средних данных провели с использованием U-критерия Манна–Уитни при уровне значимости 0,05.
Результаты и обсуждение
Проведенное исследование позволило установить, что субхроническое низкодозовое воздействие ацетата ртути привело к значительным изменениям АОС эритроцитов. Так, в группе отравленных после введения ацетата ртути отмечалось повышение активности СОД на 42,8% (p<0,05), активности ГП на 12,7% (p<0,05) и снижение активности ГТ на 27,7% (p<0,05) по сравнению с контрольной группой (табл. 1).
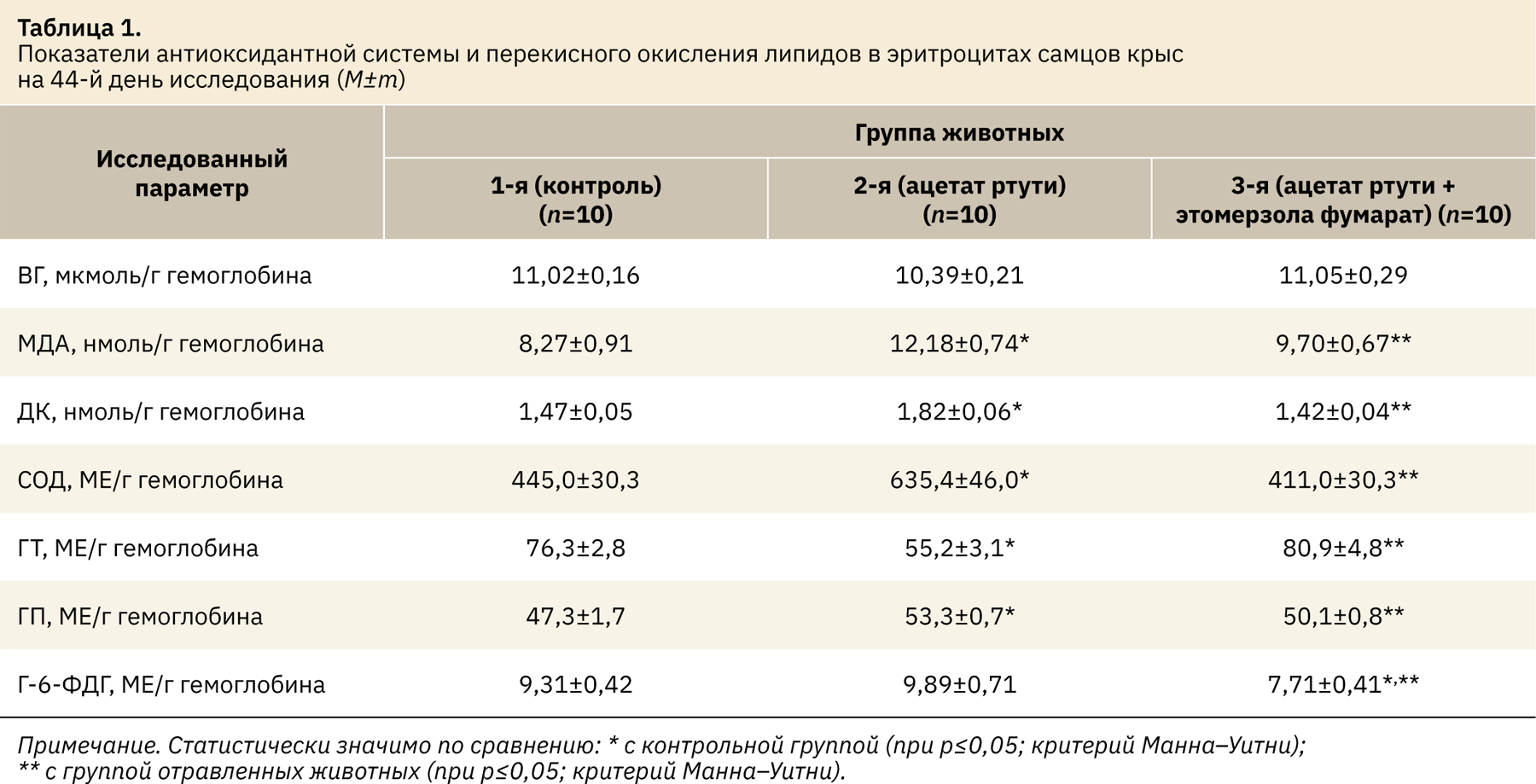
Накопление ртути в эритроцитах привело к усиленному образованию продуктов ПОЛ. Так, концентрация ДК в группе отравленных животных достоверно возрастала на 23,8%, а концентрация МДА — на 47,3% по сравнению с контрольной группой. Образование продуктов ПОЛ свидетельствует о развитии оксидативного стресса, что может привести к изменению биологических функций мембраны, включая снижение текучести и повышение проницаемости мембраны, инактивацию связанных с мембраной ферментов и потерю незаменимых жирных кислот [11]. Концентрация восстановленного глутатиона и активность других ферментов, принимающих активное участие в обезвреживании активных форм кислорода и продуктов ПОЛ, изменялись незначительно. Полученные данные демонстрируют нарушение антиоксидантного равновесия в эритроцитах после введения ацетата ртути в дозе 4 мг/кг.
Курсовое применение препарата фумаровой соли этоксиэтилтиобензимидазола позволило устранить выявленный дисбаланс ферментативного звена АОС и снизить активность процессов ПОЛ. Его использование привело к снижению содержания продуктов ПОЛ в гемолизате эритроцитов. По сравнению с опытной группой без фармакологической коррекции концентрация ДК достоверно снижалась на 22%, а МДА — на 20,4%. Исследуемый препарат способствовал нормализации активности СОД. Активность данного фермента по сравнению с группой без фармакологической коррекции снижалась на 35,3% (р<0,05). На фоне введения этомерзола фумарата также отмечалась более быстрая нормализация активности ГП и ГТ. У животных данной группы активность ГП достоверно снизилась на 6% по сравнению с группой без фармакологической коррекции. Активность ГТ достоверно увеличивалась на 46,6% по сравнению с группой без фармакологической коррекции. Активность Г-6‑ФДГ, напротив, достоверно снижалась по сравнению с группой без коррекции на 22%, а с контрольной группой на 17,2%. Все показатели в данной экспериментальной группе, за исключением Г-6‑ФДГ, статистически достоверно не отличались от данных контрольной группы.
Заключение
Применение этомерзола фумарата в течение 14 дней на фоне субхронического отравления ацетатом ртути приводило к снижению уровня продуктов перекисного окисления липидов диеновых конъюгатов и малонового диальдегида, что свидетельствует о способности препарата подавлять избыточное образование продуктов окислительной деградации липидов.
Введение этомерзола фумарата также устраняло нарушение баланса ферментативного звена антиоксидантной системы эритроцитов, что подтверждается отсутствием статистически значимых различий активности ферментов антиоксидантной защиты эритроцитов крыс 3‑й группы от тех же показателей контрольной группы. Полученные результаты свидетельствуют об антиоксидантном действии препарата на фоне субхронического отравления ацетатом ртути.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
К.М. Щепеткова — сбор материала, обработка материала, статистическая обработка данных, сбор и анализ источников литературы, написание текста, редактирование текста.
В.А. Кашуро — руководство исследованием, концепция и дизайн исследования, редактирование текста, утверждение рукописи для публикации.
Е.Б. Шустов — редактирование текста, утверждение рукописи для публикации.
Е.Г. Батоцыренова — руководство исследованием, концепция и дизайн исследования, редактирование текста, утверждение рукописи для публикации.
Е.Н. Красникова — редактирование текста.
Все авторы одобрили версию для публикации.
Список источников
-
Русецкая Н.Ю., Бородулин В.Б. Биологическая активность селеноорганических соединений при интоксикации солями тяжелых металлов // Биомедицинская химия. 2015. № 64(4). С. 449–461. [Rusetskaya N.Yu., Borodulin V.B. Biologicheskaya aktivnost’ selenoorganicheskikh soedinenii pri intoksikatsii solyami tyazhelykh metallov // Biomeditsinskaya khimiya. 2015. N. 64(4). P. 449–461. (In Russ.)].
-
Щепеткова К.М., Батоцыренова Е.Г., Литвиненко Л.А., Раменская Н.П., Кашуро В.А. Антиоксидантная система и перекисное окисление липидов в эритроцитах крыс при низкодозовом воздействии ацетатом ртути // Педиатр. 2022. Т. 13. № 2. С. 25–34. [Shchepetkova K.M., Batotsyrenova E.G., Litvinenko L.A., Ramenskaya N.P., Kashuro V.A. Antioksidantnaya sistema i perekisnoe okislenie lipidov v eritrotsitakh krys pri nizkodozovom vozdeistvii atsetatom rtuti // Pediatr. 2022. Vol. 13. N. 2. P. 25–34. (In Russ.)].
-
Кашуро В.А., Глушков С.И., Карпищенко А.И., Новикова Т.М., Глушкова Т.И., Минаева Л.В., Сибирев С.А. Состояние системы глутатиона в тканях паренхиматозных органов лабораторных животных при повторном введении циклофосфана // Нефрология. 2006. Т. 10. № 4. С. 82–86. [Kashuro V.A., Glushkov S.I., Karpishchenko A.I., Novikova T.M., Glushkova T.I., Minaeva L.V., Sibirev S.A. Sostoyanie sistemy glutationa v tkanyakh parenkhimatoznykh organov laboratornykh zhivotnykh pri povtornom vvedenii tsiklofosfana // Nefrologiya. 2006. Vol. 10. N. 4. P. 82–86. (In Russ.)].
-
Головко А.И., Батоцыренова Е.Г., Комов Ю.В., Хальчицкий С. Е., Кашуро В.А. Обзор лекарственных препаратов для коррекции нарушений ЦНС, развившихся в результате действия нейротоксикантов // Medline.ru. Российский биомедицинский журнал. 2022. Т. 23. № 1. С. 385–419. [Golovko A.I., Batotsyrenova E.G., Komov Yu.V., Khalchitsky S.E., Kashuro V.A. Obzor lekarstvennykh preparatov dlya korrektsii narushenii CNS, razvivshihsya v rezultate deistviya neirotoksikantov // Medline.ru. Rossiiskyi biomeditsinskii zhurnal. 2022. Vol. 23. N. 1. P. 385–419. (In Russ.)].
-
Кашуро В.А. Патогенетическое и диагностическое значение системы глутатиона в оценке цитотоксического действия противоопухолевых препаратов: автореферат диссертации на соискание ученой степени доктора медицинских наук / Военно-медицинская академия им. С.М. Кирова. Санкт-Петербург. 2009. [Kashuro V.A. Patogeneticheskoe i diagnosticheskoe znachenie sistemy glutationa v otsenke tsitotoksicheskogo deistviya protivoopukholevykh preparatov: avtoreferat dissertatsii na soiskanie uchenoi stepeni doktora meditsinskikh nauk / Voenno-meditsinskaya akademiya im. S.M. Kirova. Sankt-Peterburg. 2009. (In Russ.)].
-
Кострова Т.А., Батоцыренова Е.Г., Золотоверхая Е.А., Кубарская Л.Г., Кашуро В.А., Краснов К.А. Влияние виолуровой кислоты на антиоксидантную систему в отдаленный период после отравления тиопенталом натрия // Medline.ru. Российский биомедицинский журнал. 2021. Т. 22. С. 551–561. [Kostrova T.A., Batotsyrenova E.G., Zolotoverkhaya E.A., Kubarskaya L.G., Kashuro V.A., Krasnov K.A. Vliyanie violurovoi kisloty na antioksidantnuyu sistemu v otdalennyi period posle otravleniya tiopentalom natriya // Medline.ru. Rossiiskii biomeditsinskii zhurnal. 2021. Vol. 22. P. 551–561. (In Russ.)].
-
Болотова В.Ц., Болотина Ю.Д., Шустов Е.Б. Влияние этилтиобензимидазола фумарата на физическую работоспособность мышей в условиях одновременного гипоксического и гипертермического воздействия // Биомедицина. 2021. Т. 17. № S3. С. 139–143. [Bolotova V.Ts., Bolotina Yu.D., Shustov E.B. Vliyanie etiltiobenzimidazola fumarata na fizicheskuyu rabotosposobnost’ myshei v usloviyakh odnovremennogo gipoksicheskogo i gipertermicheskogo vozdeistviya // Biomeditsina. 2021. Vol. 17. № S3. P. 139–143. (In Russ.)].
-
Директива 2010/63/EU Европейского парламента и совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях. Гл. I, ст. 6. [Direktiva 2010/63/EU Evropeiskogo parlamenta i soveta Evropeiskogo soyuza ot 22.09.2010 po okhrane zhivotnykh, ispol’zuemykh v nauchnykh tselyakh. Gl. I, st. 6. (In Russ)].
-
Altman D.G. How to randomize // British medical journal. 1999. Vol. 319 (7211). Р. 703–704.
-
Рыбакова А.В., Макарова М.Н. Методы эвтаназии лабораторных животных в соответствии с европейской директивой 2010/63 // Международный вестник ветеринарии. 2015. № 2. С. 96–107. [Rybakova A.V., Makarova M.N. Metody ehvtanazii laboratornykh zhivotnykh v sootvetstvii s evropeiskoi direktivoi 2010/63 // Mezhdunarodnyi vestnik veterinarii. 2015. N. 2. P. 96–107. (In Russ)].
-
Зайцева М.А., Бонитенко Е.Ю., Иванов М.Б., Скобелев Д.О., Чечеватова О.Ю., Пикалова Л.В. Система обеспечения качества при проведении мультицентровых доклинических исследований // Фундаментальные исследования. 2014. Т. 7–5. С. 955–959. [Zajceva M.A., Bonitenko E.Ju., Ivanov M.B., Skobelev D.O., Chechevatova O.Ju., Pikalova L.V. Sistema obespechenija kachestva pri provedenii mul’ticentrovyh doklinicheskih issledovanij // Fundamental’nye issledovanija. 2014. Vol. 7–5. P. 955–959. (In Russ.)].
- Adedara I.A., Ebokaiwe A.P., Farombi E.O. Tissues distribution of heavy metals and erythrocytes antioxidant status in rats exposed to Nigerian bonny light crude oil // Toxicology and Industrial Health. 2011. Vol. 29 N. 2. Р. 162–168.




