Качественные реакции для определения патологических показателей в моче лабораторных животных как альтернатива тест-полоскам
Работа выполнена без спонсорской поддержки.
Кузнецова А.И., Фаустова Н.М., Аргинтаева А.Е. Качественные реакции для определения патологических показателей в моче лабораторных животных как альтернатива тест-полоскам. Лабораторные животные для научных исследований. 2022; 3. https://doi.org/10.57034/2618723X-2022-03-08
Резюме
Анализ мочи является необходимой частью доклинических исследований лекарственных препаратов и проводится для определения клинического состояния здоровья животных, оценки результатов экспериментальных манипуляций, а также влияния лекарственных препаратов на мочевыделительную систему. Для данного вида исследований часто используют тест-полоски для анализа мочи человека (метод «сухой химии»). Этот полуколичественный метод является простым и быстрым, но может давать искаженные результаты при использовании в ветеринарии, так как моча разных видов животных имеет существенные отличия от мочи человека по качественному и количественному содержанию различных компонентов. Необходимость получения достоверных данных при анализе мочи животных привела к разработке альтернативных методов исследования патологических компонентов мочи в случаях, когда анализ с помощью тест-полосок невозможен или некорректен.
Цель данной работы — подбор и адаптация методик определения патологических компонентов мочи лабораторных животных в микропланшетном формате.
Сравнили различные методы определения патологических показателей в моче и выбрали оптимальные методики для анализа мочи животных. Все подобранные альтернативные методики адаптированы для 96-луночного планшета, что позволяет существенно сократить объем биоматериала и время анализа. Данные методики при необходимости позволяют перейти от качественной оценки к количественному анализу на основании результатов измерения оптической плотности исследуемых растворов и построения калибровочного графика.
Для качественной и количественной/полуколичественной оценки патологических показателей мочи выбраны следующие методы: 1) белок — реакция с пирогаллоловым красным; 2) кровь/эритроциты — амидопириновая проба (реакция со спиртовым раствором пирамидона, уксусной кислоты и 3% перекиси водорода); 3) желчные пигменты (билирубин, уробилиноген) — реакция с диазониевой солью сульфаниловой кислоты по методу Маллой–Эвелина; 4) кетоновые тела — реакция с нитропруссидом натрия; 5) глюкоза — глюкозооксидазный метод.
Для проведения анализа минимально необходимое количество мочи от животного составляет 70 мкл.
В работе представлены результаты анализа образцов мочи клинически здоровых половозрелых лабораторных животных, наиболее часто использующихся для проведения исследований в нашей организации (крысы, кролики, хорьки и карликовые свиньи), по следующим показателям: белок, кетоновые тела, глюкоза, желчные пигменты, кровь (гемоглобин).
Введение
Анализ мочи является одним из основных диагностических скрининговых тестов при проведении доклинических исследований безопасности и эффективности лекарственных средств, которому предшествуют только биохимический и общий анализы крови [1, 2]. Это важный метод диагностики заболеваний мочевыводящих путей, оценки физиологического состояния животного, баланса жидкости в организме и результатов экспериментальных манипуляций при проведении научных исследований [3, 4]. Моча является одной из самых доступных биожидкостей [5]. В клинической практике для анализа мочи применяются тест-полоски (метод «сухой химии»), результаты с которых считываются визуально (в сравнении с цветовой шкалой) либо с помощью анализатора мочи. Однако использование для анализа мочи животных реагентных тест-полосок, предназначенных для человека, приводит к появлению ложноположительных и/или ложноотрицательных результатов вследствие значительных различий в составе мочи человека и животных. Некоторые особенности определения различных показателей с помощью тест-полосок представлены в табл. 1.

Состав мочи у разных видов животных значительно варьирует. Моча кроликов и хомяков содержит большое количество солей, кроме того, значение pH мочи этих видов животных выше, чем у человека, pH 7,5–8,8. У некоторых видов грызунов и кроликов наблюдается явление физиологической протеинурии. Например, у кроликов концентрация белка в моче может достигать 16 мг/мл [12], в то время как с помощью тест-полосок определяется концентрация белка только до 10 мг/мл.
В связи с существенными межвидовыми различиями и вышеперечисленными особенностями возникла необходимость разработки альтернативных качественных и/или полуколичественных методов анализа мочи лабораторных животных для оценки физико-химических свойств мочи по основным показателям: белок, глюкоза, кетоновые тела, желчные пигменты (билирубин, уробилиноген), кровь (эритроциты).
Качественная реакция должна быть селективной и чувствительной, а диагностически значимые изменения показателей мочи должны вызывать визуально заметные изменения окраски для оценки результатов. При этом для проведения качественных реакций желательно использовать небольшой объем мочи, что связано с трудностями получения данного вида биоматериала в достаточном объеме у мелких лабораторных животных.
Цель данной работы — подобрать и адаптировать для 96‑луночного планшета методики качественных и/или количественных методов определения патологических показателей мочи лабораторных животных.
Материал и методы
В исследовании использовали биоматериал, полученный от интактных животных в период с мая по июль 2020 г. в АО НПО «ДОМ ФАРМАЦИИ».
Пробы мочи были взяты у самцов и самок аутбредных крыс (8–10 нед, БЭК 1.10/20), кроликов (советская шиншилла, 12–14 нед, в ходе проведения мониторинга здоровья животных), хорьков (16–20 мес, БЭК 2.15/20) и карликовых свиней (4–5 мес, в ходе проведения мониторинга здоровья животных). Животные содержались в стандартных условиях вивария. Используемые рационы кормления и режим поения представлены в табл. 2.

В настоящее время существует достаточно большое количество методов сбора образцов мочи у животных. Основным требованием к получению образцов мочи у экспериментальных животных являются: получение чистых образцов без загрязнения фекалиями, кормом или иными примесями. При этом необходимо отдавать предпочтение простым в выполнении и по возможности минимально травматичным для животных методам [13]. У таких животных, как кролики, хорьки, карликовые свиньи, сбор однократной порции мочи осуществляли посредством массажа брюшной стенки, у крыс — с помощью метаболических клеток в течение 4 ч.
Все манипуляции с животными выполняли с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986) [1], в соответствии с правилами надлежащей лабораторной практики и Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях.
Исследуемые образцы мочи анализировали не позднее, чем после 3 ч поступления в лабораторию либо хранили в холодильной камере при температуре 2–8 °С не более суток.
Для спектрофотометрических измерений анализируемые растворы должны быть прозрачными, поэтому мочу крыс, хорьков и кроликов предварительно центрифугировали (центрифуга лабораторная клиническая Опн-3.04 «Дастан», Киргизия) при 1500 об/мин (300 g) в течение 10 мин, для анализа отбирали надосадочную жидкость. Мочу кроликов, имеющую в норме значения pH в щелочной области 7,5–8,8, для проведения реакций подкисляли 10% уксусной кислотой до нейтрального значения рН 7,0.
Стандартные образцы (СО): стандарт общего белка (Protein Standart, REF 5-11640 г/л, «PZ Cormay S.A.», Польша), глюкоза (х.ч., «Вектон», Россия); мультикалибратор биохимический (№ 18011, «Biosystem», Испания).
В качестве СО крови (эритроциты/гемоглобин) использовали пулированную эритроцитарную массу крови интактных карликовых свиней с содержанием гемоглобина 40 г/л. Концентрацию гемоглобина определяли на гематологическом анализаторе Mythic 18 Vet (Orphée, Швейцария).
Контрольные образцы: контрольный материал Ликвичек (Liquichek) «Общий анализ мочи», двухуровневый (1‑й уровень — норма, 2‑й уровень — патология), для полосок (№ 435, Bio-Rad Laboratories, США).
Для проведения исследования использовали следующие реагенты: кислота сульфосалициловая 2/В 98,00% чда (КНР, перефасовано ООО «НеваРеактив»), биуретовый реактив (Total Protein, Ref № 2-236, «PZ Cormay S.A.», Польша), реактив Бредфорда (Bradford Reagent, Ref № B6916, «Sigma-Aldrich», США), реагент для определения белка в моче пирогаллоловый красный [Proteine (urine), Ref № 11559, BioSystem, Испания], глюкоза (х.ч., «Вектон», Россия), набор реагентов для определения глюкозы «Глюкозооксидаза/пероксидаза» (Ref № 12503 BioSystem, Испания), 4‑диметиламиноантипирин (97%, № 115740059, Китай), уксусная кислота (ледяная, х.ч., АО «Вектон», Россия), перекись водорода (№ 800002, «Ленреактив», Россия), набор реагентов для определения концентраций общего и прямого билирубина методом Маллой–Эвелина «Liquick Cor-BIL TOTAL» (№ 2-344) и «Liquick Cor-BIL Direct» (№ 2-348) («PZ Cormay S.A.», Польша), натрий едкий (чда, «Башкирская содовая компания», Россия); тест-полоски LabStrip U11Plus (77 Elektronika Kft, Венгрия).
Определение белка в моче лабораторных животных
Для определения наличия белка в образцах мочи лабораторных животных (крыс, кроликов, хорьков) было апробировано несколько реакций, представленных в табл. 3.

Инкубацию проводили в термостатированном шейкере ST-3L («Elmi», Латвия).
Методика определения белка по реакции с сульфосалициловой кислотой
Этот классический метод определения белка в моче человека основан на коагуляции белка 15% раствором ССК с помутнением раствора за счет образования осадка [11, 14].
Качественную реакцию с ССК проводили с разведениями стандарта общего белка и с модельными смесями белка в моче при концентрации белка от 0,625 до 0,0098 мг/мл. Наличие белого осадка/помутнения раствора визуально оценивали на черном фоне.
Методика определения белка с биуретовым реактивом
Метод основан на взаимодействии ионов двухвалентной меди с пептидными связями молекулы белка в щелочной среде с образованием окрашенного комплекса [15].
Для анализа использовали калибровочные растворы стандарта общего белка с концентрациями от 0,078 до 20 мг/мл, мочу животных (крысы, кролики), модельные смеси (растворы стандарта общего белка в моче животных) и биуретовый реактив (Total Protein, № 2-236, Cormay, Польша). Визуально оценивали окраску на белом фоне. Для количественного определения уровня белка в моче на микропланшетном анализаторе «Clario Star» измеряли оптическую плотность при длине волны 546 нм.
Методика определения белка с реактивом Бредфорда
Метод основан на связывании белка с красителем кислотный синий 90 (Кумасси бриллиантовый синий R-250, реактив Бредфорда), при этом наблюдается переход окраски от голубого к синему через коричневый цвет. Краситель наиболее активно связывается с остатками аргинина и лизина белка, что может приводить к погрешности при количественном определении различных видов белков [15].
Для анализа использовали калибровочные растворы СО общего белка с концентрациями от 0,0098 до 0,625 мг/мл, мочу животных (крысы, кролики, хорьки), модельные смеси и реактив Бредфорда (Sigma-Аldrich, № B6915, США). Визуально оценивали наличие окрашивания в лунках планшета на белом фоне. При наличии белка наблюдалось изменение окраски от бледно-голубого цвета реактива до темно-синего через коричневый цвет. Для количественного определения уровня белка измеряли оптическую плотность при длине волны 595 нм.
Методика определения белка с пирогаллоловым красным
В основе метода лежит взаимодействие красителя пирогаллолового красного и молибдата натрия в сукцинатном буфере с белками мочи с образованием окрашенных соединений (вишневое окрашивание). Образующийся комплекс имеет максимум поглощения при 600 нм, что также позволяет проводить количественное определение белка в моче в широком диапазоне концентраций [16].
Для анализа использовали калибровочные растворы СО общего белка с концентрациями от 0,078 до 5 мг/мл, мочу лабораторных животных, модельные смеси и реактив для определения белка в моче «Пирогаллоловый красный» [Proteine (urine), № REF 11559, BioSystem, Испания].
Визуально оценивали наличие окрашивания в лунках планшета на белом фоне. При наличии белка в моче оранжевое окрашивание реактива переходит в фиолетовое (вишнево-бордовое). Окраска устойчива в течение 40 мин.
Далее проводили количественное определение уровня белка в моче на микропланшетном анализаторе «Clario Star» при длине волны 600 нм (основной фильтр) и 670 нм (референсное значение длины волны).
Определение кетоновых тел в моче лабораторных животных
К кетоновым телам, присутствующим в моче и свидетельствующим о патологических процессах в организме, относятся ацетоуксусная кислота, β-оксимасляная кислота и ацетон.
Методика определения кетоновых тел в моче по реакции Легаля (с нитропруссидом натрия)
Метод основан на способности ацетона и ацетоацетата в щелочной среде образовывать с нитропруссидом натрия комплексы оранжево-красного цвета, превращающиеся при подкислении раствора в соединения вишнево-красного цвета. Если ацетон отсутствует, то при подкислении окрашивание становится бледно-желтым. Проба более чувствительна к ацетоуксусной кислоте, чем к ацетону [11, 14].
В качестве стандартного образца использовали контрольный материал Ликвичек (Liquichek) в виде серии последовательных разведений в 2 раза контрольного образца мочи 2‑го уровня (патология) в 1‑м уровне (норма).
В лунки планшета последовательно вносили 25 мкл мочи, 10 мкл 1% раствора нитропруссида натрия, 20 мкл 2М раствора гидроксида натрия, перемешивали и добавляли 50 мл уксусной кислоты концентрированной. После внесения в пробу раствора нитропруссида натрия и гидроксида натрия реакционная смесь приобретала желто-оранжевую окраску, после добавления уксусной кислоты при наличии кетонов происходило вишнево-красное окрашивание, при отсутствии кетоновых тел раствор становился бледно-желтым.
Определение крови (гемоглобина) в моче лабораторных животных. Амидопириновая (пирамидоновая) проба
Химическое обнаружение крови сводится к нахождению пигмента гемоглобина, который обладает «пероксидазной» активностью и способен окислять пирамидон в присутствии перекиси водорода [14, 17].
В лунку планшета последовательно вносили 25 мкл спиртового раствора пирамидона, 25 мкл уксусной кислоты и 25 мкл 3% перекиси водорода, перемешивали, добавляли 25 мкл исследуемых образцов мочи.
В присутствии крови появляется сине-фиолетовое окрашивание (положительная проба) [14]. Интенсивность и время появления окраски зависят от количества крови. Отрицательный ответ регистрируют через 2–3 мин [17]. В отсутствие крови цвет пробы не изменяется (от бледно-желтого до светло-желто-коричневого в зависимости от вида животных и цвета исходной мочи).
Пулированный гемолизат эритроцитов интактных животных использовали в качестве СО гемоглобина. Для получения гемолизата к 100 мкл эритроцитарной массы добавляли 900 мкл воды очищенной, интенсивно перемешивали до получения однородной массы, выдерживали 5 мин при температуре 2–8 °С. Мембраны эритроцитов отделяли посредством центрифугирования при 3000 об/мин в течение 10 мин. Концентрацию гемоглобина в образце гемолизата определяли с помощью гематологического анализатора Mythic 18. Концентрация гемоглобина составила 40 г/л (40 мг/мл). Далее готовили калибровочные растворы с помощью серии последовательных разведений в 2 раза в воде очищенной и модельные смеси с образцами мочи лабораторных животных для определения чувствительности метода.
Определение уровня глюкозы в моче лабораторных животных
Для качественной оценки наличия в моче глюкозы были использованы два известных метода (табл. 4):
1) качественная реакция глюкозы с гидроксидом меди (II);
2) глюкозооксидазный метод с использованием набора реагентов «Глюкозооксидаза/пероксидаза».

Глюкоза, являясь многоатомным спиртом, способна вступать в реакцию с гидроксидом меди (II) в щелочной среде, образуя устойчивое растворимое комплексное соединение синего цвета [18]. Принцип глюкозооксидазного метода заключается в том, что под действием ферментов глюкозооксидазы и пероксидазы глюкоза вступает в реакцию с 4‑аминоантипирином и фенолом, образуя цветной комплекс, который может быть измерен спектрофотометрически [19].
Для проведения анализа готовили калибровочные растворы СО с содержанием глюкозы 0,001–20 мг/мл (0,003–112 ммоль/л) в воде и модельные смеси СО глюкозы с мочой клинически здоровых лабораторных животных (крыс, кроликов, мини-пигов, хорьков) с концентрацией глюкозы в пробе 0,978–20 мг/мл (0,44–28 ммоль/л). С использованием контрольных образцов мочи Ликвичек 1‑го и 2‑го уровней готовили серию растворов с концентрацией глюкозы от 0,28 до 18 ммоль/л. Реакции проводили в 96‑луночном планшете.
Окрашивание проб в лунках планшета оценивали визуально на белом фоне.
При наличии глюкозы в моче животных выполняли количественный анализ: на микропланшетном анализаторе «Clario Star» измеряли оптическую плотность при длине волны 505 нм (основной фильтр) и 670 нм (референсное значение длины волны).
Приготовление калибровочных растворов СО глюкозы
Для подготовки калибровочных растворов готовили сток-раствор СО глюкозы с концентрацией 10 мг/мл (1%) (табл. 5). В мерную колбу объемом 5 мл помещали навеску глюкозы массой 50 мг (точная навеска), вносили воду очищенную, перемешивали до полного растворения.

Определение желчных пигментов в моче лабораторных животных по методу Маллой–Эвелина
Билирубин при взаимодействии с диазотированной сульфаниловой кислотой образует азобилирубиновый комплекс пурпурного цвета [20]. Для определения чувствительности и калибровочного диапазона методики готовили на основе контрольного образца Ликвичек 2‑го уровня (патология) и мочи животных (хорьков) модельные смеси, содержащие прямой билирубин в диапазоне концентраций 13,9–112,8 мкмоль/л.
Определение общего билирубина с помощью набора реагентов «Liquick Cor-BIL Total Malloy-Evelyn», № 2-344: в лунку планшета помещали 100 мкл реагента 1, инкубировали 3 мин при температуре 37 °C, вносили 10 мкл контрольного образца/анализируемых проб мочи/модельных смесей, инкубировали 1 мин при 650 об/мин и температуре 37 °С, затем добавляли 25 мкл реагента 2 и инкубировали 5 мин в тех же условиях. При содержании билирубина более 14 мкмоль/л пробы окрашивались в оранжевый цвет разных оттенков: от оранжево-желтой до оранжево-розовой.
Определение прямого билирубина с помощью набора реагентов «Liquick Cor-BIL Direct Malloy-Evelyn», № 2-348: в лунки планшета вносили по 80 мкл реагента 1, инкубировали 3 мин при температуре 37 °C, затем — 10 мкл контрольного образца/анализируемых проб мочи/модельных смесей, инкубировали 4 мин при 37 °С и 650 об/мин, далее добавляли 10 мкл реагента 2, инкубировали 2 мин при 37 °С и 650 об/мин. В присутствии прямого билирубина или его производных в количестве более 14 мкмоль/л развивается пурпурная (фиолетово-розовая) окраска.
Результаты и обсуждение
Результаты определения белка в моче лабораторных животных
С помощью тест-полосок в моче человека можно определить от 0,15 до 5,0 мг/мл белка. Соответствующие различным уровням концентрации белка в моче приведены в табл. 6.

По некоторым данным литературы [21, 22], в норме в моче кроликов может содержаться 1–6 г белка на 1 л, в других работах [12] указано, что физиологическая норма содержания белка в моче для самцов до 14 г/л, для самок до 16 г/л. Для крыс нормальная концентрация белка составляет до 0,3 г/л. У самцов крыс уровень белка в норме несколько выше, чем у самок [23]. У хорьков концентрация белка не должна превышать 1 г/л.
Качественная реакция на наличие белка с сульфосалициловой кислотой
Эта реакция является классической для определения белка в моче человека, но результаты определения в моче лабораторных животных варьируют в зависимости от вида животного. За границу отсечения норма/патология взята концентрация белка в пробе 0,3 мг/мл.
В калибровочных растворах СО общего белка в воде помутнение раствора наблюдалось при количестве белка от 0,625 до 0,010 мг/мл включительно. В моче крыс реакция является положительной вплоть до концентрации белка 0,098 мг/мл, в моче хорьков — до 0,08 мг/мл, что значительно ниже границы отсечения норма/патология (0,3 мг/мл).
В образцах мочи кроликов положительную реакцию наблюдали для проб с концентрацией белка более 0,6 мг/мл, что может быть связано со щелочным pH мочи данного вида животных.
При проведении реакции с ССК сделать заключение об уровне белка в пробах мочи лабораторных животных трудно, в том числе из‑за собственной окраски или мутности мочи (табл. 7). При высоких концентрациях белка в моче выпадает белый осадок в виде сгустка. Кроме того, метод не подходит для животных, у которых наличие белка в моче является нормой (например, кроликов).

Таким образом, реакцию с ССК нельзя отнести к универсальному методу для всех видов животных: чувствительность для мочи крыс на порядок выше таковой у других животных, и, наоборот, в моче кроликов с помощью данной реакции в некоторых случаях невозможно оценить концентрацию белка. Метод не подходит для спектрофотометрического анализа из‑за выпадения осадка.
Качественная реакция на наличие белка с биуретовым реактивом
Сине-фиолетовое окрашивание пробы в разведении СО общего белка в воде наблюдается при концентрации белка 1,25–20 мг/мл.
В образцах мочи крыс окрашивание слабо заметно, определить цвет в образцах мочи кроликов и хорьков трудно из‑за собственной окраски мочи, имеющей желтый или желто-оранжевый цвет (табл. 8).
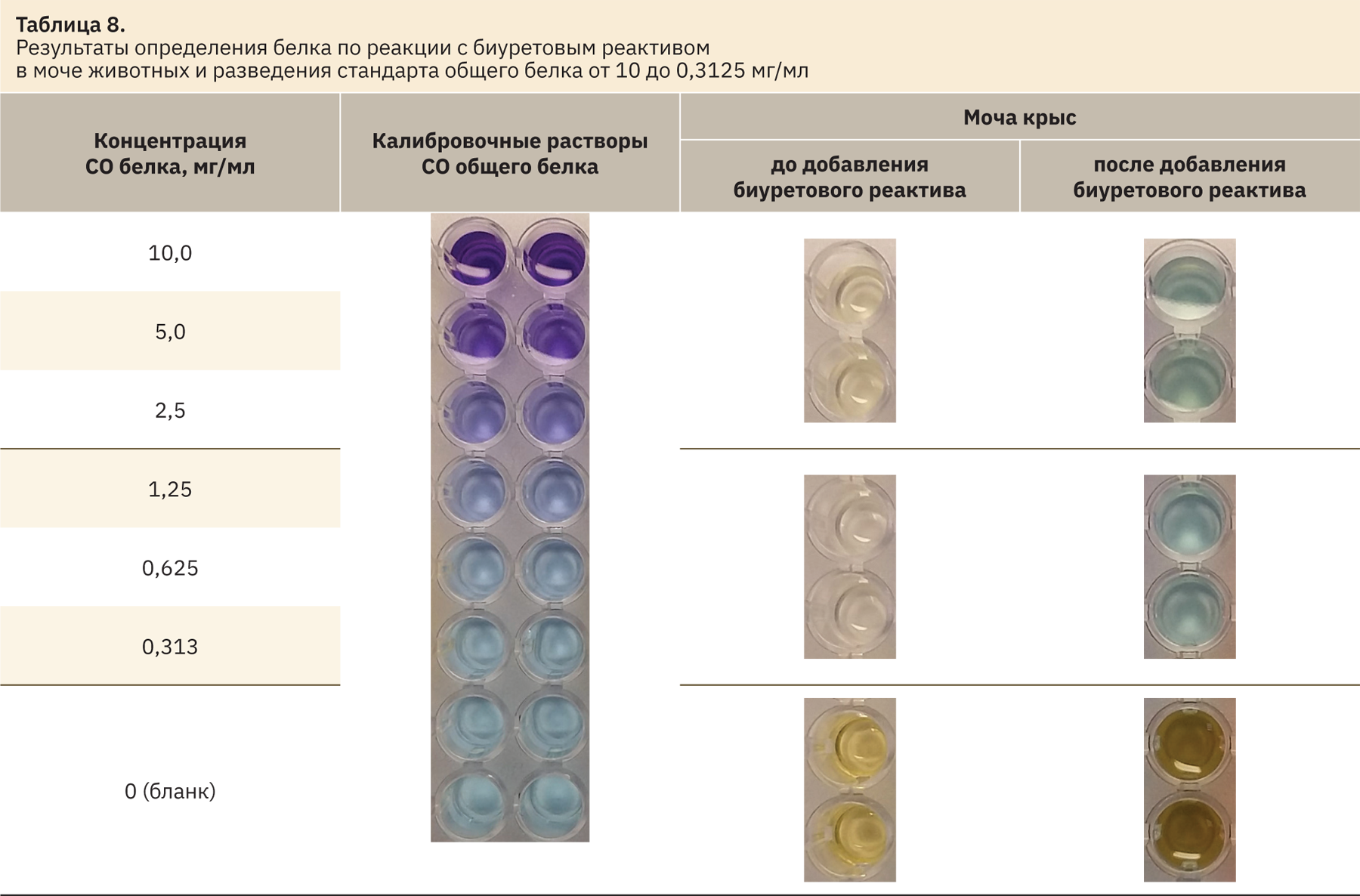
Для проведения реакции требуется достаточно большой объем биоматериала (не менее 50 мкл), который не всегда удается получить при рутинном анализе мочи у мелких лабораторных животных (мышей, песчанок, крыс, дегу и др.).
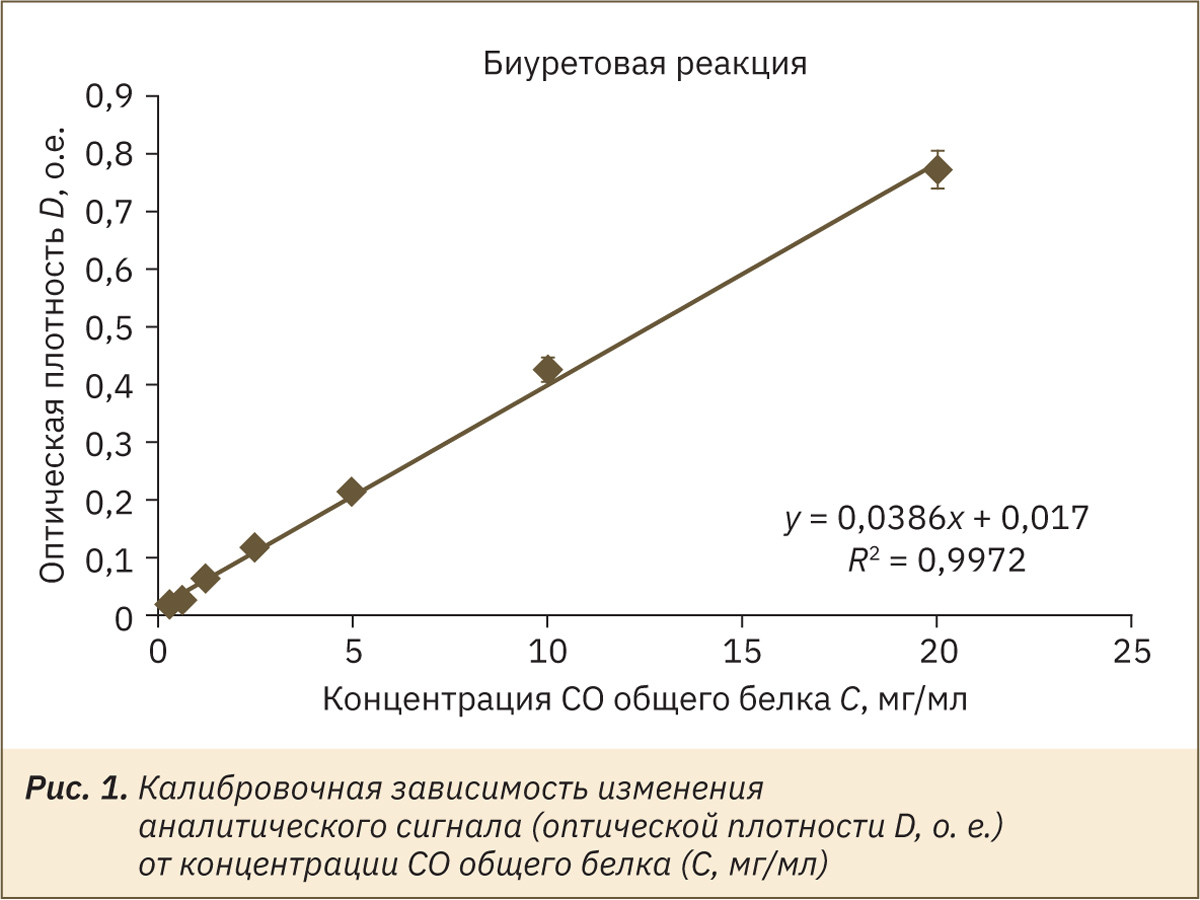
На рис. 1 представлен калибровочный график для определения концентрации белка биуретовым методом. При визуальной оценке результата реакции в водных калибровочных растворах аналитическая область методики составляет 1,25–20 мг/мл, при использовании измерения оптической плотности на приборе — 0,31–20 мг/мл.
Метод не подходит для качественного анализа белка в моче лабораторных животных из‑за необходимости проведения реакции с достаточно большим объемом биоматериала (не менее 50 мкл), сложности оценки окраски в пробах мочи хорьков и кроликов и непригодности метода для анализа мутных растворов, содержащих соли аммония или осадок [15].
Качественная реакция на наличие белка с реактивом Бредфорда
Изменение окраски происходит от коричневого цвета до темно-синего, что сильно затрудняет визуальную оценку в моче яркого цвета (например, у кроликов, хорьков) (табл. 9).
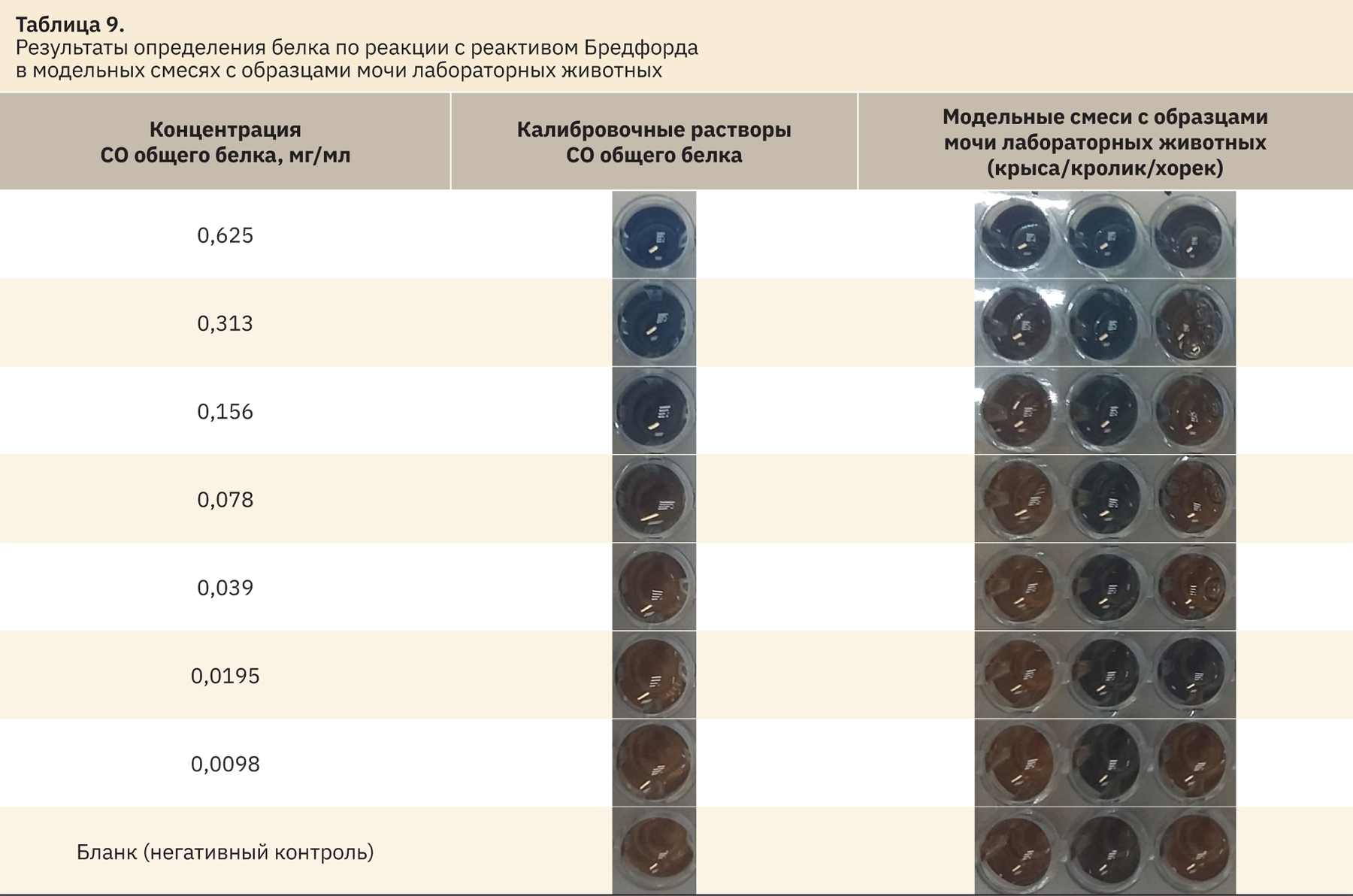
В моче кроликов реакция положительна вплоть до концентрации белка 0,005 мг/мл, у крыс — до 0,016 мг/мл, у хорьков — до 0,039 мг/мл.
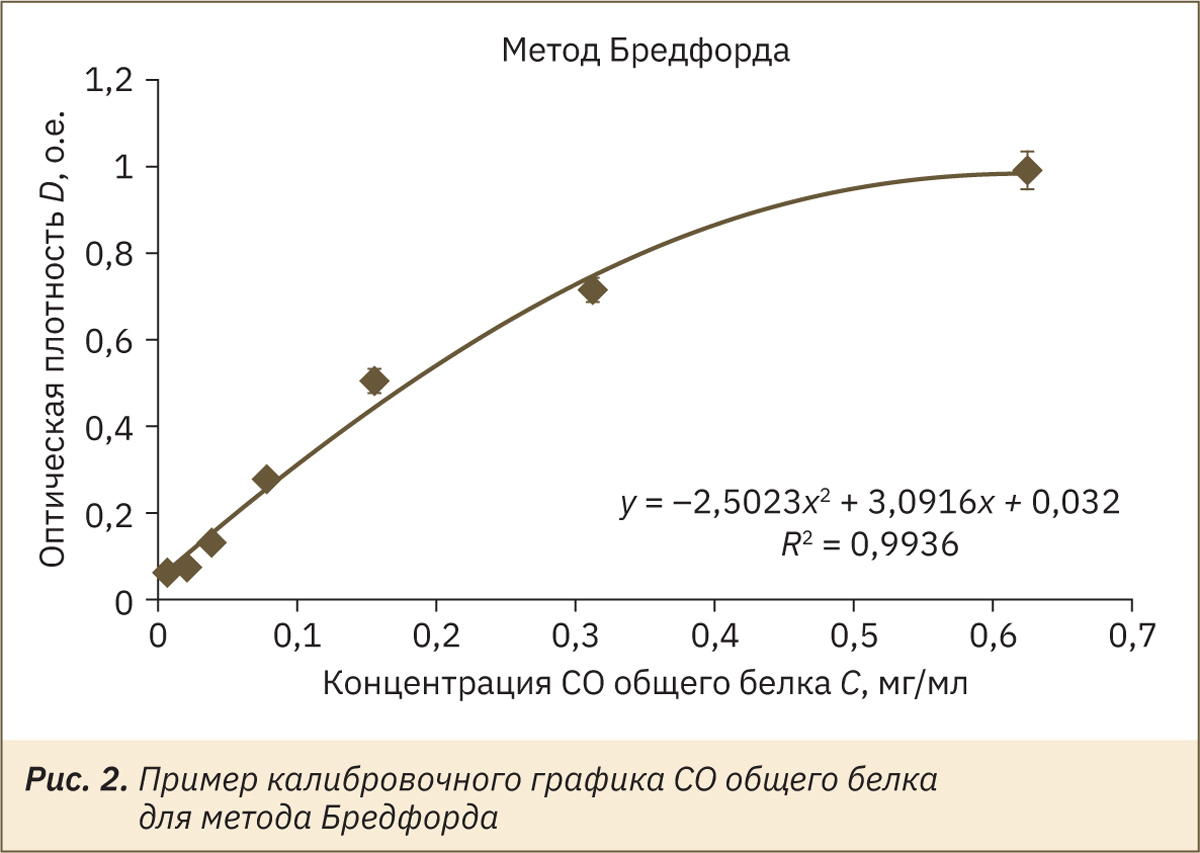
На рис. 2 представлен пример калибровочной зависимости для определения концентрации белка по методу Бредфорда. Аналитический диапазон методики 0,02–1,2 мг/мл. Зависимость оптической плотности от концентрации белка в данном методе не является линейной. Из-за затруднений в визуальной оценке цвета проб сложно принять решение о необходимости количественного определения содержания белка в моче, вследствие чего данная методика также признана не подходящей для визуального скрининга наличия белка в моче лабораторных животных.
Качественная реакция на наличие белка с пирогаллоловым красным
Наиболее чувствительной и позволяющей использовать минимальное количество биоматериала (5 мкл) является реакция белка с красителем пирогаллоловым красным.
При визуальной оценке наблюдали следующие изменения окраски в зависимости от концентрации белка в пробе: оранжевый (цвет реактива) → красно-вишнево-фиолетовый, при этом, чем выше содержание белка, тем интенсивнее окраска фиолетового цвета.
Изменение окраски в разведениях стандартного белка наблюдается до концентрации белка в пробе 0,16 мг/мл включительно. Собственный цвет мочи всех видов животных не влияет на окраску реакционной смеси (табл. 10). Окраска устойчива в течение 40 мин.

Методика линейна в диапазоне концентраций белка от 0,017 до 2,5 мг/мл (рис. 3а), но при включении в аналитический диапазон методики концентрации более 2,5 мг/мл зависимость становится нелинейной и обработка данных выполняется, например, с помощью 4‑параметрической математической модели (рис. 3б). У большого количества животных таких видов, как кролики и хорьки, концентрация белка в моче выше 2,5 мг/мл, в этом случае рекомендуем использовать для количественного анализа и построения калибровочной зависимости также растворы с содержанием белка 2,5 и 5 мг/мл.
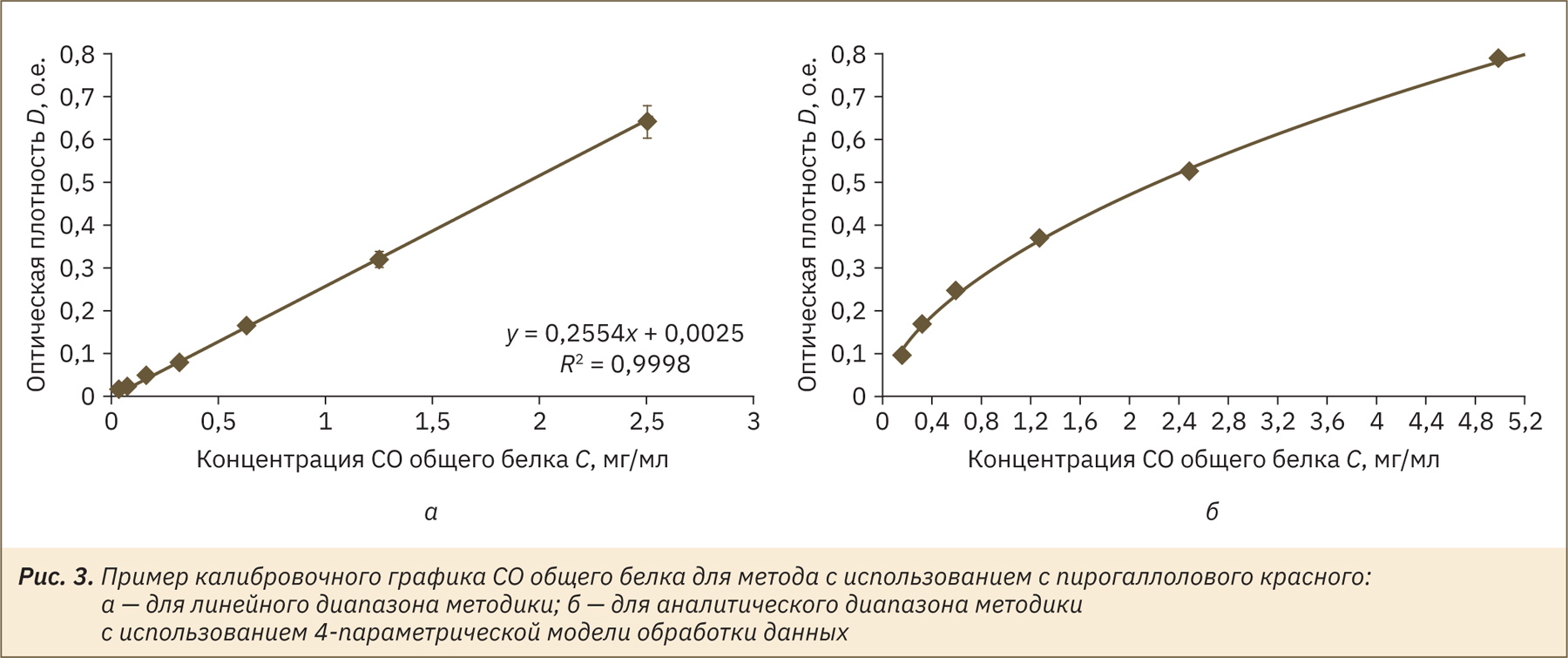
Таким образом, реакция с пирогаллоловым красным на белок является достаточно чувствительной, результат не зависит от состава исследуемого образца мочи, благодаря небольшому объему пробы собственный цвет мочи не влияет на окрашивание раствора, при необходимости количественного определения можно измерить оптическую плотность. Метод простой и не требует приготовления реактивов. Окрашивание отчетливо определяется визуально при постановке реакции в планшете и стабильно не менее 40 мин. На наш взгляд, метод является наиболее подходящим для определения белка в малых объемах мочи.
Определение кетонов в моче лабораторных животных
В табл. 11 указаны уровни кетонов, которые определяются с помощью тест-полосок в моче человека.

По результатам поиска сведений, указанных в источниках литературы, были выделены две реакции, которые могут быть применены в лабораторном анализе мочи животных: проба Либена и проба Легаля.
Проба Либена на ацетон (йодоформная проба)
Для проведения анализа к 50 мкл мочи прибавляли 10 мкл 10% раствора натрия гидроксида и 20–30 мкл раствора Люголя.
Было проведено пробное исследование в пробирках. Результаты анализа оказались неудовлетворительными: в пробах мочи с положительной реакцией на кетоновые тела по тест-полоскам раствор Люголя осел на дно, желтого осадка не наблюдалось, запах мочи не изменился. Воспроизведение методики в 96‑луночном планшете также не дало положительного результата — визуальной оценки результата реакции (вид сверху) недостаточно, а в горизонтальной проекции его можно оценить только в крайних лунках. Кроме того, определить, из какой лунки исходит запах йодоформа, также не представляется возможным, вследствие чего эта проба не подходит для анализа мочи лабораторных животных.
Проба Легаля (с нитропруссидом натрия)
Для определения чувствительности методики и оценки уровня содержания кетоновых тел в моче готовили серию разведений ацетона и ацетилацетона в моче лабораторных животных (ацетилацетон нерастворим в воде, но растворим в моче). Предел обнаружения ацетилацетона в реакции с нитропруссидом (около 0,0063 мг/мл) значительно ниже, чем тот, который можно определить с помощью тест-полосок (0,05 мг/мл). Сведений о наличии ацетилацетона в моче человека и животных не найдено, вследствие этого был сделан вывод о том, что ацетилацетон не подходит в качестве СО кетонового тела. Предел обнаружения ацетона по реакции с нитропруссидом натрия составил 6,8 мг/мл, что существенно выше порога отсечения норма/патология. Также использование в качестве калибровочных растворов СО ацетона имеет ряд сложностей, так как при температуре воздуха в лаборатории выше 22 °С ацетон очень быстро испаряется из приготовленных растворов, что приводит к искажению результатов.
Поэтому для приготовления калибровочных растворов использовали контрольный материал Ликвичек, уровень 2 (патология), кетоновые тела которого дают в реакции с нитропруссидом натрия устойчивое окрашивание, не зависящее от температуры окружающей среды. Для определения аналитического диапазона методики готовили калибровочные растворы с содержанием кетонов 5–150 мг/дл. Раствор контрольной мочи 1‑го уровня (норма) использовали в качестве бланка (отрицательного контроля). Содержание других компонентов в контрольном образце Ликвичек уровень 2 не мешает проведению реакции Легаля.
Предел обнаружения кетоновых тел составил 19–20 мг/дл, что сопоставимо с границей отсечения норма/патология (уровень 1+ в соответствии с градацией тест-полосок).
У крыс (n=20) был проведен сравнительный анализ мочи с определением уровня кетонов с помощью тест-полосок и качественной реакции с нитропруссидом натрия. Качественная реакция с нитропруссидом натрия для проб мочи, в которых при использовании тест-полосок не было обнаружено кетоновых тел, или их уровень не превышал физиологическую норму (5 мг/дл, уровень +/–), была визуально отрицательной. В пробах, где уровень кетоновых тел соответствовал патологическому уровню (15 мг/дл, уровень 1+), появлялось слабое окрашивание (+/–). Положительная реакция с нитропруссидом натрия была обнаружена только для пробы с концентрацией кетонов выше 15 мг/дл.
Стабильность окраски проб с мочой кроликов не превышает 5 мин после добавления реактивов, поэтому визуальную оценку рекомендуется проводить сразу после добавления реагентов и перемешивания. Спустя указанное время, независимо от содержания кетонов, растворы приобретают зеленую окраску.
Первоначально объем анализируемых образцов мочи составлял 50 мкл, но в ходе испытаний объем пробы был снижен до 25 мкл в целях уменьшения расхода биоматериала при рутинном анализе.
Для определения влияния концентрации уксусной кислоты на ход реакции использовали следующие растворы с ее содержанием 20%, 30%, 50% и концентрированную уксусную кислоту. Насыщенность цвета проб одинаковая, однако реакционная смесь мутная во всех случаях, кроме пробы с концентрированной уксусной кислотой. Вследствие этого в дальнейшем использовали только концентрированную уксусную кислоту для получения прозрачной окрашенной реакционной смеси.
Проба визуально оценивается как положительная при концентрации кетонов выше 15 мг/дл. За границу отсечения норма/патология принято значение 20 мг/дл. Таким образом, реакция с нитропруссидом натрия была выбрана для микропланшетного анализа при определении высокого уровня содержания кетонов в моче.
Определение крови (гемоглобина) в моче лабораторных животных
Амидопириновая (пирамидоновая) проба
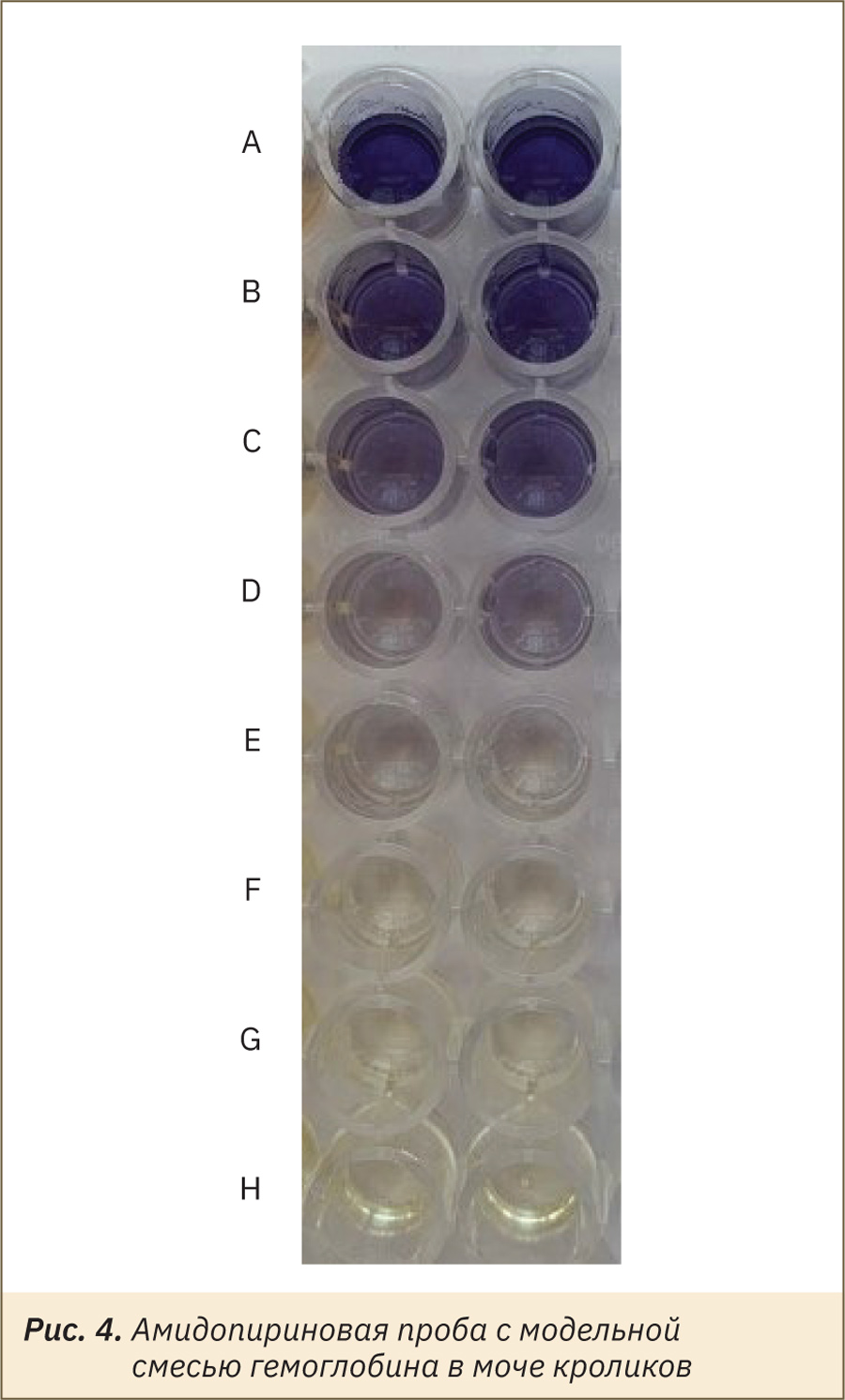
В модельных смесях гемоглобина с мочой крыс и кроликов и в контрольном образце мочи 2‑го уровня наблюдалось сине-фиолетовое окрашивание. Окраска образцов мочи интактных крыс и кроликов, не содержащих эритроциты и следы гемоглобина, не изменялась (цвет раствора бледно-желтый) (рис. 4).
Чувствительность данной методики (нижняя граница видимого результата) в моче составила 0,039 г/л. Окраска стабильна 2–3 мин. Через 10 мин окрашивание полностью исчезает. Сравнение результатов с клинической практикой пока затруднительно, так как концентрация крови на тест-полосках указывается в других единицах — клетки/мкл (число клеток в 1 мкл).
В норме с помощью данной методики не должно проявляться окрашивание. При наличии окрашивания необходимо провести микроскопическое исследование мочи в обязательном порядке.
Данная методика определения наличия крови (гемоглобина) в образцах мочи лабораторных животных пригодна для дальнейшего использования и качественной оценки.
Определение глюкозы в моче лабораторных животных
Оценка содержания глюкозы в моче по реакции с гидроксидом меди в щелочной среде
При постановке реакции в микропланшетном варианте с растворами СО глюкозы в диапазоне концентраций от 20 до 0,313 мг/мл растворения осадка гидроксида меди (II) и изменения цвета раствора не происходило.
Изменение окраски в пробах СО глюкозы в воде c концентрацией 10 мг/мл происходит только после внесения дополнительных реагентов (табл. 12).

При постановке реакции с модельными смесями СО глюкозы с мочой клинически здоровых лабораторных животных (крыс, кроликов, хорьков, карликовых свиней) с концентрацией глюкозы в пробе 5 мг/мл (28 ммоль/л) изменение цвета раствора не происходит, осадок Cu(OH)2 не растворяется.
Также было выявлено, что содержание в пробе аскорбиновой кислоты приводит к выпадению оранжево-бурого осадка (табл. 13).

Далее вместо растворов глюкозы в качестве стандартного образца использовали контроль мочи Ликвичек 2‑го уровня (патологический) с содержанием глюкозы 18 ммоль/л. При этом цвет реакционной смеси изменялся на фиолетовый (вместо ожидаемого синего), что было обусловлено взаимодействием гидроксида меди с белком, входящим в состав контроля (см. табл. 13).
Реакция взаимодействия глюкозы с гидроксидом меди в щелочной среде малочувствительна [синее окрашивание наблюдается для растворов с концентрацией глюкозы более 10 мг/мл (более 56 мМ)], требует использования сравнительно большого объема пробы мочи и реагентов, неспецифична (определению глюкозы мешает наличие в пробах аскорбиновой кислоты и белка). Таким образом, реакция не подходит для анализа мочи лабораторных животных на содержание глюкозы.
Оценка содержания глюкозы в моче с помощью глюкозооксидазного метода
Согласно данным литературы [24], глюкозооксидазный метод является одним из самых специфичных и чувствительных для определения глюкозы.
Для определения чувствительности методики при исследовании мочи различных видов животных были проанализированы калибровочные растворы глюкозы в воде в широком диапазоне концентраций от 0,003 до 112 ммоль/л (0,001 до 20 мг/мл). Визуальная оценка позволяет однозначно определить наличие глюкозы в растворе при концентрации выше 1,75 ммоль/л. Для дальнейшего анализа были приготовлены модельные смеси с мочой животных с содержанием глюкозы 0,88–112 ммоль/л (табл. 14).
Появление розового окрашивания отмечено также в калибровочных растворах и модельных смесях, для которых уровень глюкозы ниже уровня, принятого за норму (1,75 мМ) (+/–) (табл. 15, 16).
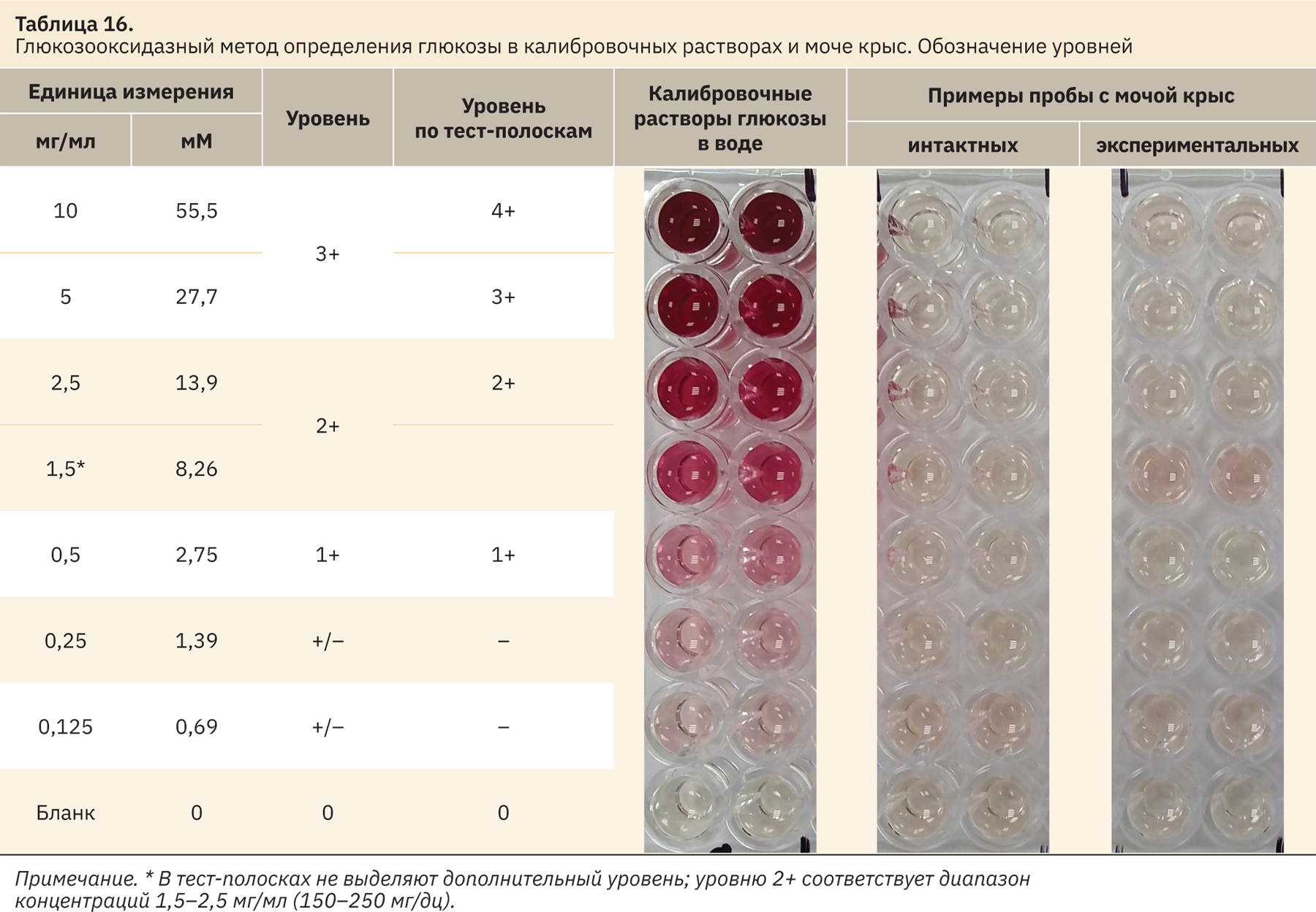
Необходимо отметить, что для всех видов животных, моча которых была использована для получения модельных смесей, чувствительность методики при визуальной оценке составила 0,31 мг/мл (1,75 мМ).
В дальнейшем для оценки уровня глюкозы и построения калибровочной зависимости использовали растворы СО следующих концентраций: 0,125, 0,25, 0,5, 1,5, 2,5, 5 и 10 мг/мл (см. табл. 15 и 16), что позволяло соотнести показания тест-полосок и результаты качественной реакции. Калибровочный раствор с концентрацией 0,5 мг/мл (2,8 мМ) — граница отсечения нормы/патологии (уровень 1+). Калибровочные растворы с концентрациями 0,125 и 0,25 мг/мл являются дополнительными при необходимости проведения количественного анализа при обнаружении в моче лабораторных животных патологических количеств глюкозы (0,5 мг/мл или более) по калибровочному графику после измерения оптической плотности.
Таким образом, глюкозооксидазный метод достаточно чувствителен и подходит для микропланшетного анализа. Малый объем пробы (5 мкл) позволяет нивелировать влияние собственной окраски мочи. При необходимости количественного определения можно измерить оптическую плотность на микропланшетном анализаторе. Метод простой и не требует приготовления реактивов. Окрашивание отчетливо определяется визуально при постановке реакции в планшете. Данный метод является наиболее подходящим для определения уровня глюкозы в малых объемах мочи.
Определение желчных пигментов в моче лабораторных животных
Основными реакциями на желчные пигменты являются пробы Гмелина и Розина (табл. 17).

Проба Гмелина — метод качественного определения билирубина в биологической жидкости (обычно в моче), основанный на появлении характерных цветных колец на границе жидкостей при наслаивании концентрированной азотной кислоты на небольшое количество исследуемого материала. Реакция основана на окислении азотной кислотой билирубина в биливердин зеленого цвета. Если в моче содержатся желчные пигменты, то на границе двух жидкостей образуются кольца зеленого, синего, фиолетового, красного и желтого цвета.
Для проведения унифицированной пробы Розина в пробирку наливают 4–5 мл мочи (в адаптированном варианте для планшета 40–50 мкл) и осторожно по стенкам пробирки наслаивают 1% спиртовой раствор йода. При наличии билирубина на границе между жидкостями появляется зеленое кольцо [14, 25].
Однако адаптация данных методик для 96‑луночного полистиролового планшета с использованием концентрированных кислот невозможна. При анализе образцов мочи с низкой плотностью, что часто встречается у крыс при получении мочи с водной нагрузкой, происходит смешивание слоев, и отсутствует граница между ними. При проведении реакции в 96‑луночном планшете оценить наличие кольца на границе двух слоев в лунках планшета проблематично, как и наслоить раствор йода. Для проведения этих реакций требуется значительный объем мочи — не менее 1 мл.
На наш взгляд, метод Маллой–Эвелина, применяемый в клинической диагностике для определения концентрации общего и прямого билирубина в сыворотке/плазме крови, является наиболее подходящей альтернативой вышеуказанным методам для анализа мочи [20]. В клинической практике существуют наборы реагентов для определения общего и прямого билирубина.
Оценка содержания желчных пигментов с помощью реагентов для определения общего билирубина по методу Маллой–Эвелина
Интактная моча крыс, кроликов и контрольный образец мочи Ликвичек 1‑го уровня после внесения реагентов цвет не меняют — билирубин отсутствует. В контрольных образцах мочи 2‑го уровня и в модельных смесях на его основе появляется окраска от ярко-оранжевого до светло-оранжевого цвета. Для проведения реакции Маллой–Эвелина использовали также образцы мочи хорьков с повышенным уровнем билирубина. Концентрацию билирубина предварительно оценивали с помощью тест-полосок LabStrip U11Plus (77 Elektronika Kft, Венгрия). При проведении реакции возникли трудности с визуальной оценкой полученных результатов: поскольку моча хорьков интенсивно окрашена, интерпретировать результаты не представлялось возможным — собственная окраска мочи и результат окрашивания трудно различимы.
На основании данных литературы [26], известно, что непрямой билирубин в моче не обнаруживается. Поэтому в дальнейшем приняли решение определять желчные пигменты в моче только с помощью набора реагентов для определения прямого билирубина.
Оценка содержания желчных пигментов с помощью реагентов для определения прямого билирубина по методу Маллой–Эвелина
Апробацию методики проводили с использованием контрольных образцов Ликвичек и мочи хорьков с концентрацией общего билирубина от 6,3 до 51,3 мкмоль/л. Концентрация билирубина в моче хорьков и в контрольных образцах Ликвичек была предварительно измерена с помощью автоматического биохимического анализатора A-25 (Biosystems, Испания). Полуколичественную оценку уровня билирубина в образцах мочи осуществляли, используя тест-полоски.
После внесения реагентов контрольные образцы Ликвичек 2‑го уровня приобрели ярко-розовую окраску. Образцы мочи хорьков, содержащие билирубин, имели светло-розовую окраску. Образцы мочи без билирубина и контрольные образцы мочи 1‑го уровня цвет не изменили.
Таким образом, метод Маллой–Эвелина (с диазониевой солью сульфаниловой кислоты) для определения прямого билирубина пригоден для исследования уровня желчных пигментов в моче лабораторных животных. Положительную реакцию можно визуально увидеть при концентрации билирубина более 17 мкмоль/л.
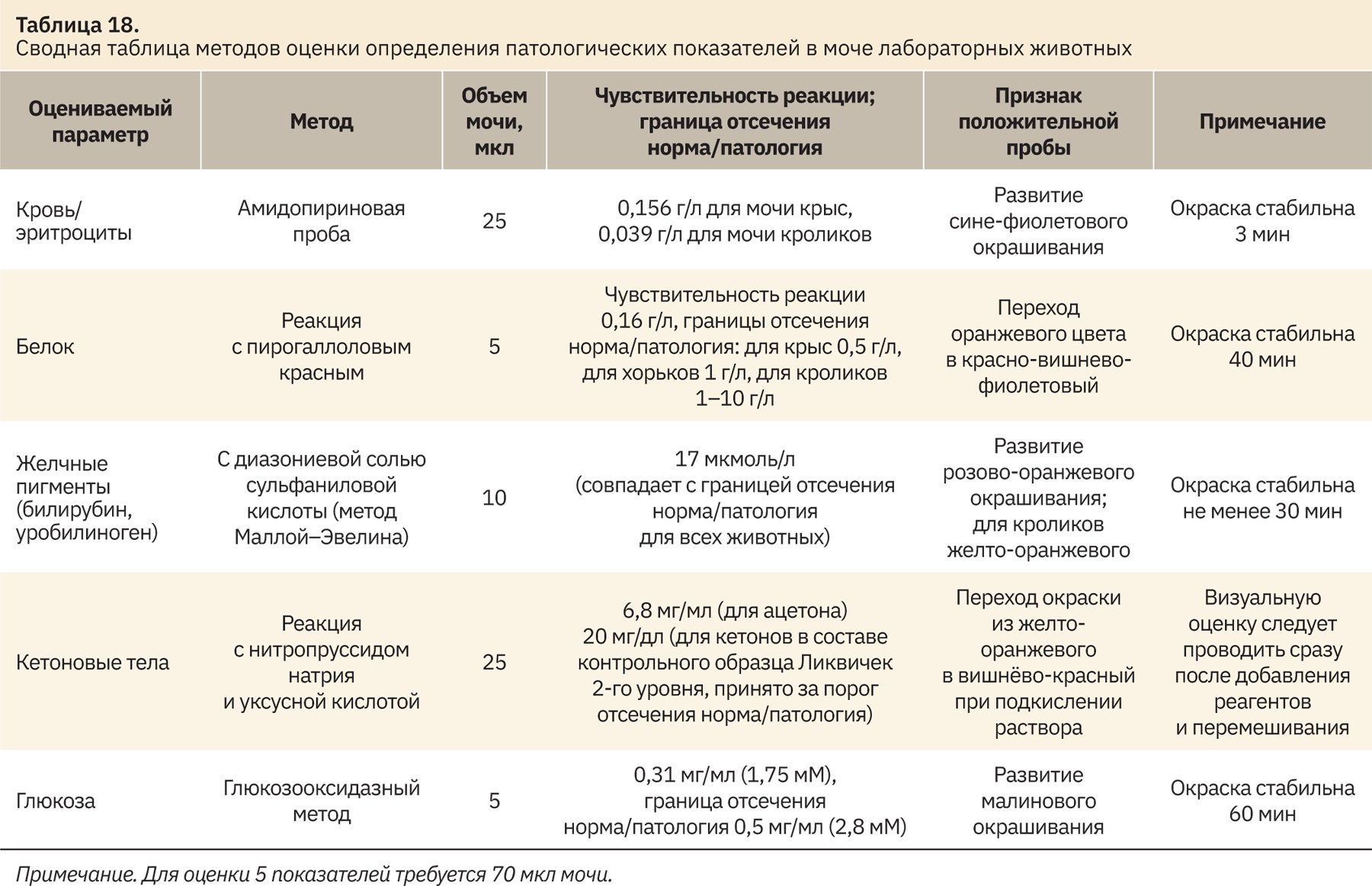
В табл. 18 приведены обобщающие сведения о методиках оценки патологических показателей в моче лабораторных животных, которые были выбраны для дальнейшей работы с данным биоматериалом в ходе токсикологических исследований.
Заключение
Проведен сравнительный анализ методов определения патологических показателей мочи и выделены оптимальные методики анализа мочи лабораторных животных по показателям: кровь/эритроциты, белок, желчные пигменты (билирубин, уробилиноген), кетоновые тела, глюкоза.
Выбранные методики анализа мочи лабораторных животных позволяют использовать минимальные объемы мочи, легко выполнимы, имеют невысокую стоимость. Все подобранные альтернативные методики адаптированы для 96‑луночного планшета, что позволяет при необходимости для части методик выполнить количественный анализ исследуемого компонента посредством измерения оптической плотности на микропланшетном анализаторе и построения калибровочного графика.
При выявлении патологических компонентов мочи, не проводя дополнительных манипуляций, можно провести количественную оценку целевых аналитов.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
А.И. Кузнецова — анализ научной и методической литературы, выполнение практической части исследования, написание и редактирование текста статьи, работа с табличным материалом.
Н.М. Фаустова — анализ научной и методической литературы, редактирование и доработка текста статьи, ответственность за все аспекты работы, связанные с достоверностью данных.
А.Е. Аргинтаева — анализ научной и методической литературы, выполнение практической части исследования.
Список источников
- Coppens A., Speeckaert M., Delanghe J. The pre-analytical challenges of routine urinalysis // Acta Clin. Belg. 2010. Vol. 65. N. 3. P. 182–189. doi: 10.1179/acb.2010.038.
-
Delanghe J., Speeckaert M. Preanalytical requirements of urinalysis // Biochem. Med. 2014. Vol. 24. N. 1. P. 89–104. doi: 10.11613/BM.2014.011.
-
Kurien B.T., Everds N. E., Scofield R.H. Experimental animal urine collection: A review // Lab. Anim. 2004. Vol. 38. N. 4. P. 333–361. doi: 10.1258/0023677041958945.
-
Carolyn A.S., Nicole M.W. 1st ed. United Kingdom: Wiley-Blackwell, 2012. Practical Veterinary Urinalysis. 68 p.
-
Sharma A., Nigam R., Kumar A. et al. Mass spectrometry-based identification of urinary antimicrobial peptides in dairy cows // Protein Pept. Lett. 2020. Vol. 27. N. 3. P. 225–235. doi: 10.2174/0929866526666191025105038.
-
Беркоу Р.Р., Флетчер Э. Руководство по медицине. Диагностика и терапия. Т. 2. М.: Мир, 1997. 87 c. [Berkou R.R., Fletcher E. Rukovodstvo po meditsine. Diagnostika i terapiya. Vol. 2. M.: Mir, 1997. 87 p. (In Russ.)].
-
Перепанова Т.С. Диагностическая значимость анализа мочи и тест-полосок // Эффективная фармакотерапия. 2018. № 18. C. 24–29. [Perepanova T.S. Diagnosticheskaya znachimost’ analiza mochi i test-polosok // Effektivnaya farmakoterapiya. 2018. N. 18. P. 24–29 (In Russ.)].
-
Tietz Textbook of Clinical Chemistry and Molecular Diagnostics, 4th ed. Burtis C.A., Ashwood E.R., Bruns D.E., WB Saunders Co, 2005.
-
Agúndez M.G., Porquet N. C. Evaluation of urine dipstick for proteinuria assessment in pet rabbits // Vet Rec. 2021. Vol. 11. P. e306. doi: 10.1002/vetr.306.
-
Исследование мочи методом сухой химии. Электронный ресурс. URL: https://stormoff.ru/mediacenter/articles/article_267/ (дата обращения: 04.2022) [Issledovanie mochi metodom sukhoi khimii. Elektronnyi resurs. URL: https://stormoff.ru/mediacenter/articles/article_267/ (data obrashcheniya: 04.2022) (In Russ.)].
-
Биохимия почек и мочи. Учебное пособие для самостоятельной работы студентов. URL: https://studfile.net/preview/4120873/ (дата обращения: 04.2022) [Biokhimiya pochek i mochi. Uchebnoe posobie dlya samostoyatel’noi raboty studentov. URL: https://studfile.net/preview/4120873/ (data obrashcheniya: 04.2022) (In Russ.)].
-
Özkan С., Kaya A., Akgül Y. et al. Normal Values of Hematological and Some Biochemical Parameters in Serum and Urine of New Zealand White Rabbits // World Rabbit Science. 2012. Vol. 20. Р. 253–259.
-
Трофимец Е.И., Кательникова А.Е., Крышень К.Л. Получение образцов мочи у лабораторных животных (обзор) // Лабораторные животные для научных исследований. 2021. № 1. С. 30–47. [Trofimets E.I., Katel’nikova A.E., Kryshen’ K.L. Poluchenie obraztsov mochi u laboratornykh zhivotnykh (obzor) // Laboratornye zhivotnye dlya nauchnykh issledovanii. 2021. № 1. P. 30–47. (In Russ.)]. doi: 10.29296/2618723X-2021‑01‑04.
-
Медицинские лабораторные технологии и диагностика: Справочник. Медицинские лабораторные техологии / Под редакцией профессора А.И. Карпищенко. Санкт-Петербург: Интермедика, 2002. 408 с. [Meditsinskie laboratornye tekhnologii i diagnostika: Spravochnik. Meditsinskie laboratornye tekhologii / Pod redaktsiei professora A.I. Karpishchenko. Sankt-Peterburg: Intermedika, 2002. 408 p.].
-
ОФС. 1.2.3.0012.15. Определение белка Государственная Фармакопея Российской Федерации. ХIV изд. М.: МЗ РФ. 2018. Т. 1–4. 7019 с. [OFS. 1.2.3.0012.15. Opredelenie belka Gosudarstvennaya Farmakopeya Rossiiskoi Federatsii. KhIV izd. M.: MZ RF. 2018. T. 1–4. 7019 p.].
-
Ларичева Е.С., Андреев Ю.Н., Ребякова Е.Н., и др. Способен ли метод определения белка в моче с пирогаллоловым красным претендовать на роль основного? // Лабораторная диагностика. 2009. № 1. С. 24–31. [Laricheva E.S., Andreev Yu.N., Rebyakova E.N., i dr. Sposoben li metod opredeleniya belka v moche s pirogallolovym krasnym pretendovat’ na rol’ osnovnogo? // Laboratornaya diagnostika. 2009. № 1. P. 24–31. (In Russ.)].
-
Практикум к лабораторным занятиям по биологической химии /под редакцией профессора В.И. Шарапова. Учебное пособие для студентов 1–2 курсов лечебного, педиатрического, стоматологического факультетов. Новосибирск, 2011. [Praktikum k laboratornym zanyatiyam po biologicheskoi khimii /pod redaktsiei professora V.I. Sharapova. Uchebnoe posobie dlya studentov 1–2 kursov lechebnogo, pediatricheskogo, stomatologicheskogo fakul’tetov. Novosibirsk, 2011. (In Russ.)].
-
Сарычева Т.А. Качественные реакции. Электронный ресурс. URL: https://portal.tpu.ru/SHARED/s/
SARICHEVA/learning/Tab/%D0%9A%D0%B0%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%B5%D0%BD%D0%BD%D1%8B%D0%B5%20%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8_2017.pdf (дата обращения: 03.2022). [Sarycheva T.A. Kachestvennye reakcii. Elektronnyi resurs. URL: https://portal.tpu.ru/SHARED/s/SARICHEVA/learning/Tab/
%D0%9A%D0%B0%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%B5%D0%BD%D0%BD%D1%8B%D0%B5%20%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8_2017.pdf (data obrashcheniya: 03.2022) (In Russ.)].
-
Набор реагентов для определения концентрации глюкозы «Глюкоза. Глюкозооксидаза/пероксидаза». Инструкция. BioSystems S.A. [Nabor reagentov dlya opredeleniya koncentracii glyukozy «Glyukoza. Glyukozooksidaza/peroksidaza». Instrukciya. BioSystems S.A. (In Russ.)].
-
Медицинские лабораторные технологии. Справочник / Под редакцией профессора А.И. Карпищенко. Санкт-Петербург: Интермедика, 2002. 600 с. [Meditsinskie laboratornye tekhnologii. Spravochnik / Pod redaktsiei professora A.I. Karpishchenko. Sankt-Peterburg: Intermedika, 2002. 600 p. (In Russ.)].
-
Анатомо-физиологические особенности кроликов. Лабораторные животные. Электронный ресурс. URL: https://handcent.ru/laboratornye-zhivotnye/373‑anatomo-fiziologicheskie-osobennosti-krolikov-chast-5.html (дата обращения: 04.2022). [Anatomo-fiziologicheskie osobennosti krolikov. Laboratornye zhivotnye. Elektronnyi resurs. URL: https://handcent.ru/laboratornye-zhivotnye/373‑anatomo-fiziologicheskie-osobennosti-krolikov-chast-5.html (data obrashcheniya: 04.2022) (In Russ.)].
-
Suckow M.A., Stevens К.А., Wilson R.P. The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents. 2012. 1268 p. doi: 10.1016/C2009‑0‑30495‑X.
-
Стадник Н.А., Адоньева С.М., Тарасова П.В. Влияние протеиновой смеси и гейнера на мочевыделительную систему крыс // Международный научно-исследовательский журнал. 2017. № 04 (58). C. 187–195. [Stadnik N.A., Adon’eva S.M., Tarasova P.V. Vliyanie proteinovoi smesi i geinera na mochevydelitel’nuyu sistemu krys // Mezhdunarodnyi nauchno-issledovatel’skii zhurnal. 2017. N. 04 (58). P. 187–195 (In Russ.)]. doi: 10.23670/IRJ.2017.58.164.
-
Walker H.K., Hall W.D., Hurst J.W., Clinical Methods: The History, Physical, and Laboratory Examinations. 3rd ed. Boston: Butterworths, 1990.
-
Запруднова Е.А. Практикум по биохимии. Владимир: Изд-во Владим. гос. ун-та, 2011. 56 с. [Zaprudnova E.A. Praktikum po biokhimii. Vladimir: Izd-vo Vladim. gos. un-ta, 2011. 56 p. (In Russ.)].
- Мурадеева Г.В., Серова С.С., Шандрагулина С.В. Основы лабораторной диагностики. Учебно-методическое пособие. Архангельск: ГОУ СПО «АМК», 2008. 208 с. [Muradeeva G.V., Serova S.S., Shandragulina S.V. Osnovy laboratornoi diagnostiki. Uchebno-metodicheskoe posobie. Arkhangel’sk: GOU SPO «AMK», 2008. 208 p. (In Russ.)].




